LAPORAN PRAKTIKUM KIMIA FISIK II KESETIMBANGAN UAP-CAIR PADA SISTEM BINER
Oleh
Nama : Luki Aprilliya S NIM : 121810301026 Kelompok : 6
Asisten : Rizqon
LABORATORIUM KIMIA FISIKA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
BAB 1. PENDAHULUAN
I.1Latar Belakang
Larutan adalah fase yang homogen yang mengandung lebih dari satu komponen. Apabila sistem hanya terdiri dari dua zat maka disebut larutan biner, seperti alkohol dalam air. Menurut sifatnya dikenal larutan ideal dan non ideal. Jika larutan diuapkan sebagian, maka mol fraksi dari masing-masing penyusun larutan tidak sama karena ”volatilitas”, (mudahnya menguap) dari masing-masing penyusunnya berbeda. Uap relatif mengandung lebih banyak zat yang lebih volatil dari pada cairannya. Hal ini dapat dilihat dari diagram kesetimbangan uap dan cairan pada tekanan tetap dan suhu tetap.
Suatu campuran biner akan membentuk suatu kesetimbangan, yaitu kesetimbangan uap-cair. Kesetimbangan uap cair dapat ditentukan ketika ada variabel yang tetap (konstan) pada suatu waktu tertentu. Saat kesetimbangan ini terjadi, kecepatan antara molekul-molekul campuran yang membentuk fase uap sama dengan kecepatan molekul-molekulnya membentuk cairan kembali. Contoh nyata penggunaan data termodinamika kesetimbangan uap-cair yaitu dalam berbagai metoda perancangan kolom distilasi packed column dan try column. Salah satu contoh aplikasi dari percobaan kesetimbangan uap cair ini adalah pembuatan tabung gas LPG. Proses pembuatan tabung gas LPG ini menggunakan prinsip distilasi, yaitu tekanan uap dalam tabung bila semakin besar akan mengubah gas di dalam tabung menjadi cair. Berdasarkan fakta diatas, maka percobaan kesetimbangan uap-cair pada sistem binair ini dilakukan.
I.2Tujuan percobaan
BAB 2. TINJAUAN PUSTAKA
2.1 MSDS (Material Safety Data Sheet)
2.1.1 Etanol
Etanol berwujud cair dan tidak berwarna dengan aroma seperti alcohol. Berat molekul etanol ± 46,08 g mol-1 dan dapat mendidih pada suhu 78o C serta meleleh pada suhu -117o C.
Etanol cenderung mudah larut dalam air, baik air dingin maupun air panas. Etanol berbahaya bila terjadi kontak langsung dengan mata dan kulit. Penanganan yang dapat dilakukan bila terjadi kontak langsung dengan etanol yaitu bila terjadi kontak langsung dengan mata, mata segera dibasuh dengan air selama ± 15 menit dengan mata terbuka. Penanganan bila terjadi kontak langsung dengan kulit harus segara menyiran bagian kulit yang kena cairan dengan air yang banyak dan segera menutupi bagian kulit, serta melepaskan pakaian dan sepatu yang terkontaminasi. Penanganan bila terhirup yaitu segera pindah ke tempat dengan udara yang lebih segar, bila tidak bernapas maka diberi napas buatan atau bantuan oksigen. Penanganan bila tertelan yaitu jangan memberikan apapun melalui mulut kepada orang yang tidak sadar dan segera hubungi dokter (Anonim, 2015).
2.1.2 Aquades
Aquades disebut juga Aqua Purificata (air murni) H2O dengan. Air murni adalah air
yang dimurnikan dari destilasi. Satu molekul air memiliki dua hidrogen atom kovalen terikat untuk satu oksigen. Aquades merupakan cairan yang jernih, tidak berwarna dan tidak berbau. Aquades juga memiliki berat molekul sebesar 18,0 g/mol dan pH antara 5-7. Rumus kimia dari aquades yaitu H2O. Aquades ini memiliki allotrop berupa es dan uap. Senyawa ini tidak
berwarna, tidak berbau dan tidak meiliki rasa. Aquades merupakan elektrolit lemah. Air dihasilkan dari pengoksidasian hidrogen dan banyak digunakan sebagai bahan pelarut bagi kebanyakan senyawa dan sumber listrik (Sarjoni, 2003).
2.2 Kesetimbangan Uap-Cair pada Sistem Biner
Larutan ada yang jenuh, tidak jenuh, dan lewat jenuh. Larutan disebut jenuh pada temperatur tertentu, bila larutan tidak dapat melarutkan lagi lebih banyak zat terlarut. Bila jumlah zat terlarut kurang dari ini, disebut larutan tidak jenuh dan bila lebih disebut lewat jenuh. Kemungkinan larutan banyak sekali, ada sembilan kemungkinan yaitu:
a. Larutan gas dalam gas b. Larutan cairan dalam gas c. Larutan zat padat dalam gas d. Larutan gas dalam zat padat e. Larutan cairan dalam zat padat f. Larutan zat padat dalam zat padat g. Larutan gas dalam cairan
h. Larutan cairan dalam cairan i. Larutan zat padat dalam cairan.
Percobaan yang akan dilakukan menggunakan larutan gas dalam cairan. Kelarutan gas dalam cairan tergantung jenis gas, jenis pelarut, tekanan dan temperatur (Sukardjo, 1989).
Larutan yang banyak dipakai sebagai model adalah larutan ideal. Larutan ini sedemikian rupa sehingga interaksi antara partikel, lain jenis sama dengan yang sejenis. Interaksi itu berupa daya tolak atau daya tarik sesamanya. Dengan kata lain, dalam larutan partikel satu komponen tidak mempengaruhi partikel lain didekatnya. Energi yang dikandung komponen larutan sebelum dan sesudah tercampur sama sehingga ΔH pencampuran nol. Artinya, dalam pencampuran tidak ada kalor yang diserap atau dilepaskan (Syukri, 1999).
Suatu komponen (pelarut) mendekati murni jika komponen itu berperilaku sesuai dengan Hukum Roult dan mempunyai tekanan uap yang sebanding dengan fraksi mol. Beberapa larutan menyimpang jauh dari Hukum Roult. Walaupun demikian, dalam hukum itu semakin dipatuhi jika komponennya berlebih (sebagai pelarut) sehingga mendekati kemurnian. Bisa dikatakan, bahwa hukum ini menerangkan pendekatan yang baik untuk pelarut selama larutan ini encer (Atkins, 1999).
lingkungan pelarut murni. Zat terlarut dalam larutan tak ideal encer mengikuti Hukum Henry, bukan Hukum Roult (Petrucci, 1992).
Pengertian dari larutan ideal diadakan untuk perbandingan dengan larutan-larutan yang biasa didapat yaitu larutan non ideal, disini akan ditinjau larutan ideal cairan dalam cairan jadi merupakan suatu larutan zat cair biner. Larutan ideal adalah larutan yang gaya tarik antara molekul – molekulnya sama, artinya gaya tarik antar molekul pelarut dan zat terlarut, sama dengan gaya tarik molekul pelarutnya atau molekul zat terlarutnya (Sukardjo, 1989).
Larutan dapat dikatakan menjadi larutan ideal apabila larutan tersebut mempunyai ciri-ciri :
a. Homogen pada seluruh sistem mulai dari fraksi mol sampai 1.
b. Tidak ada entalpi pencampuran pada waktu komponen dicampur membentuk larutan (ΔH Pencampuran = 0).
c. Tidak ada beda volume pencampuran artinya volume larutan = jumlah volume komponen yang dicampur (ΔH Pencampuran = 0).
d. Memenuhi Hukum Roult.
Sifat komponen larutan ideal suatu zat akan mempengaruhi sifat komponen yang lain, sehingga sifat larutan yang dihasilkan terletak diantara sifat kedua komponennya, contoh sistim benzena – toulena. Sedangkan larutan non ideal adalah larutan yang tidak memiliki sifat di atas. Larutan ini dibagi dua golongan yaitu :
a. Larutan non ideal deviasi positip yang mempunyai volume ekspansi, di mana akan menghasilkan titik didih maksimum pada sistim campuran itu. Contoh: Sistem Aseton – Karbondisulfida
b. Larutan non ideal deviasi negatif yang mempunyai volume kontraksi, di mana akan menghasilkan titik didih minimum pada sistim campuran itu. Contoh: sistem benzena -etanol dan sistim aseton – chloroform.
(Tim Kimia Fisik, 2015).
Larutan dikatakan ideal jika larutan tersebut mengikuti hukum Roult pada seluruh kisaran komposisi sistem. Hukum Roult dalam bentuknya yang lebih umum didefinisikan sebagai fugasitas dari tiap komponen dalam larutan yang sama dengan keadaan serta fraksi molnya dalam larutan tersebut, yakni :
f1 = X1 . f1*
Sedangkan hubungan antara tekanan parsial dan komposisinya dalam larutan merupakan pendekatan dalam hal larutan yang mempunyai komponen tekanan parsial kecil.
Dimana :
P1 = tekanan uap larutan Po = tekanan uap larutan murni
X1 = mol fraksi larutan
Potensial kimia dari tiap komponen dalam larutan didefinisikan sebagai : μ1 = μ1o + R T ln X1
(Dogra, 1990).
Dua fasa dikatakan berada dalam kesetimbangan jika temperatur, tekanan, dan potensial kimia dari masing-masing komponen yang terlibat di kedua fasa bernilai sama. Ketika berada dalam keadaan kesetimbangan, fraksi mol suatu komponen dari suatu campuran memiliki nilai yang tertentu. Komponen yang lebih mudah menguap akan memilki nilai fraksi mol yang lebih besar pada fasa uap dan sebaliknya. Sifat ini kemudian dimanfaatkan dalam proses pemisahan dengan metode distilasi. Kemurnian suatu komponen yang mudah menguap akan lebih baik pada fasa uap, fasa uap ini kemudian diambil untuk mendapatkan campuran dengan kadar kemurnian yang lebih baik. Jika dikehendaki komposisi uap yang dalam kesetimbangan dengan campuran air, tidak cukup bila hanya mengetahui sifat-sifat campuran cair pada komposisi seperti itu saja; harus mengetahui sampai sejauh mana sifat-sifat itu (khususnya energi Gibbs) bergantung pada komposisi. Pengaruh temperatur yang pokok pada kesetimbangan uap-cair terdapat dalam tekanan uap komponen murni atau lebih tepatnya dalam fugasitas zat cair komponen murni. Sementara koefisien aktivitas bergantung pada temperatur sebagaimana halnya komposisi, ketergantungan itu biasanya kecil bila dibandingkan dengan ketergantungan tekanan uap zat cair murni pada temperatur. Dalam suatu campuran, kenaikan temperatur 10oC meningkatkan tekanan uap zat cair sebesar 1,5 - 2
kali. Oleh karena itu, kecuali pada perubahan temperatur yang besar sering lebih mudah bila pengaruh temperatur terhadap energi Gibbs diabaikan saja ketika menghitung kesetimbangan uap-cair (Reid, 1990).
Bisa dikatakan bahwa hukum Roult ini menerangkan pendekatan yang baik untuk pelarut selama larutan itu encer. Kimia memberi notasi kuantitatif yang berhubungan dengan zat murni dengan superskrip, sehingga potensial kimia campuran A adalah μA, karena tekanan uap cairan murni pada kesetimbangan kedua potensial kimiawi sama besar, sehingga keduanya dapat dieliminasi (Atkins, 1999).
Secara umum hanya sedikit larutan yang memenuhi hukum Raoult. Larutan yang tidak memenuhi hukum Raoult disebut larutan non ideal. Pada larutan ideal dari zat pelarut A dan zat pelarut B, tarikan A-B sama dengan tarikan A-A dan B-B, sedangkan kalor pelarutan, ΔH(l)
= 0. Jika tarikan antara A-B lebih besar dari tarikan A-A dan B-B, maka proses pelarutan adalah eksoterm dan ΔH(l) < 0. Misalnya pada campuran antara aseton (C3H6O) dan kloroform
(CHCl3) terjadi ikatan hidrogen antara aseton dan kloroform sehingga tekanan uap larutan
BAB 3. METODOLOGI PERCOBAAN
3.1 Alat dan Bahan 3.1.1 Alat
- Set alat destilasi - Pipet
- Pipet volume - Pipet Morh - Gelas Beaker - Piknometer 3.1.2 Bahan
- Etanol - Akuades
3.2 Cara Kerja
- ditentukan berat jenis masing-masing zat dengan menggunakan piknometer. - dibuat pasangan kedua yaitu etanol : aquades dengan konsentrasi 20%, 40%,
60%, 80%, dan 100%.
- didestilasi setiap campuran, dicatat titik didih masing-masing.
- diambil distilat dengan pipet dan ditentukan konsentrasi serta residunya. - dilakukan untuk setiap pencampuran lainnya.
- dibuat grafik standar n(konsentrasi) - X pada campuran yang belum didestilasi. - didapat diagram T –X dari turunannya.
Etanol dan Aquades
BAB 4. HASIL DAN PEMBAHASAN
20 0,9578 -4,2611 8,431 85 0,087
40 0,9293 -2,70 7,186 83 0,198
60 0,9249 -0,0997 7,286 80 0,355
80 0,8346 4,0893 5,934 79 0,571
100 0,7576 - 8,015 - 1,00
4.2 Pembahasan
Praktikum kali ini dilakukan percobaan tentang kesetimbangan uap-cair pada sistem biner. Larutan biner adalah larutan yangg mengandung dua atau lebih zat yg dapat melarut dengan sempurna. Larutan biner memiliki sifat yang sama dengan larutan ideal yaitu homogen pada seluruh sistem mulai dari mol fraksi 0-1, tidak ada entalpi pencampuran pada waktu komponen-komponen di campur membentuk larutan (ΔH pencampuran = 0), tidak ada volume pencampuran artinya volume larutan = jumlah volume komponen yang dicampurkan (ΔVpencampuran = 0) dan memenuhi hukum Roult P1= X1P°. Percobaan kali ini digunakan
campuran etanol dengan aquades sebagai sampelnya.
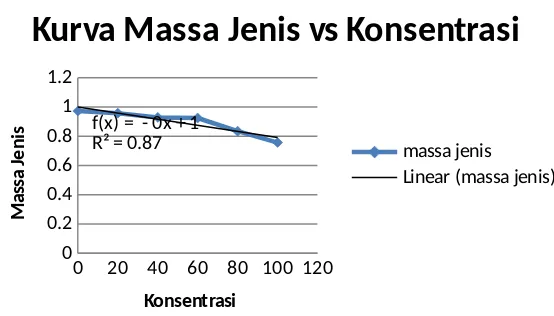
digunakan untuk menentukan massa jenis larutan dengan berbagai konsentrasi tersebut. Hasil perhitungan dari percobaan ini didapatkan massa jenis campuran dari konsentrasi 0 sampai 100% diperoleh massa jenis sebesar 0,9735; 0,9578; 0,9293; 0,9249; 0,8346; dan 0,7576 g/mL. Hasil ini menunjukkan bahwa hubungan antara massa jenis dengan konsentrasi berbanding terbalik, dimana semakin besar konsentrasinya maka massa jenis suatu larutan akan semakin menurun. Adapun grafik antara massa jenis dengan konsentrasi adalah:
0 20 40 60 80 100 120
Kurva Massa Jenis vs Konsentrasi
massa jenis
Gambar 1. Kurva antara massa jenis dengan konsentrasi
Langkah selanjutnya yaitu pengujian komposisi alkohol dalam campuran sebelum dilakukan proses destilasi. Perlakuan ini bertujuan untuk mengetahui berapa besar komposisi alkohol yang ada dalam campuran. Perlakuan ini dilakukan dengan menggunakan alat yaitu sensor alkohol. Prinsip kerja sensor alkohol ini adalah sensor menghisap zat alkohol yang sifatnya volatil (mudah menguap) dan zat lain yang menguap sehingga uap tersebut akan mengakibatkan hambatan sensor turun serta membuat tegangan beban naik, makin besar konsentrasi gas nilai V ini akan naik. Cara mengoperasikannya yaitu dengan mengaktifkan aplikasi pada PC yang telah terhubung pada suatu rangkain alat yang memiliki ujung sensor seperti speaker kecil, setelah aplikasi tersebut siap dioperasikan maka speaker kecil tersebut diletakkan pada mulut botol. Peletakkannya harus pas agar tidak ada alkohol yang menguap dan nilai yang dihasilkan sesuai. Setelah itu, diklik tombol run dan tunggu beberapa saat sampai nilai yang dihasilkan menyimpan secara otomatis.
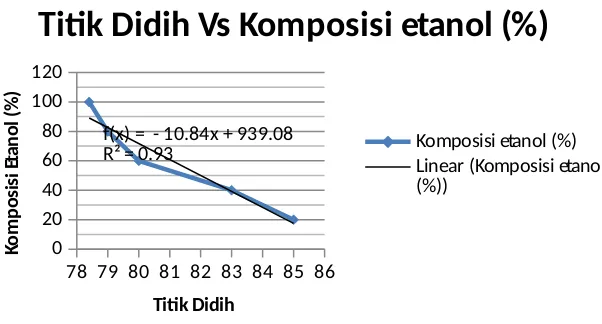
distilasi masing-masing konsentrasi antara lain 85, 83, 80, 79, dan 76oC. Hal ini sudah sesuai
dengan literatur yang ada, dimana titik didih akan menurun seiring bertambahnya konsentrasi. Alkohol bersifat mudah menguap karena alkohol merupakan senyawa volatil, sehingga semakin besar konsentrasinya maka akan semakin besar pula kecepatan menguapnya. Hal ini menyebabkan alkohol pada konsentrasi lebih tinggi akan mendidih pada suhu yang lebih rendah. Hasil detilasi yang berupa destilat kemudian diuji komposisi alkoholnya menggunakan sensor alkohol. Hasil pengukuran, didapatkan persentase volume rata-rata pada variasi konsentrasi ini antara lain berturut-turut 8,431; 7,186; 7,286; 5,934 dan 8,015. Hasil ini kemudian digunakan untuk menghitung fraksi mol atau komposisi alkohol yang terdapat dalam destilat tersebut. Hasil perhitungan fraksi mol yang diperoleh yaitu 0,087; 0198; 0,355; 0,571 dan 1. Hasil ini kemudian diplotkan dalam suatu kurva antara suhu pada saat alkohol mendidih dan komposisi. Berikut ini adalah kurva antara suhu dengan komposisi:
78 79 80 81 82 83 84 85 86
Titik Didih Vs Komposisi etanol (%)
Komposisi etanol (%)
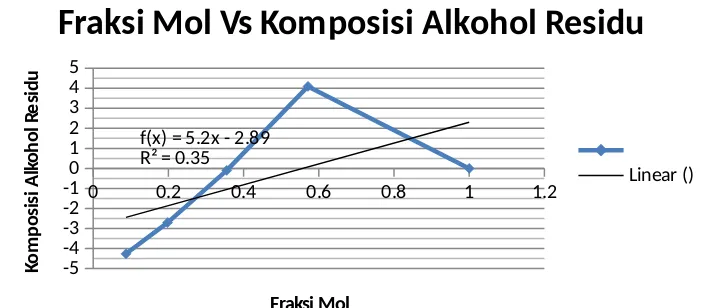
Kurva antara Fraksi Mol dengan Destilat juga dapat diplotkan dari data yang diperoleh. Berikut ini adalah kurva antara Fraksi Mol dengan Destilat alkohol :
0 0.2 0.4 0.6 0.8 1 1.2
Fraksi Mol Vs Alkohol Destilat
Linear ()
Gambar 3. Kurva antara Fraksi mol dengan alkohol destilat
Perlakuan selanjutnya yaitu menguji komposisi alkohol pada residu. Hasil uji didapatkan persentase volume alkohol residu berturut-turut yaitu -4,2611; -2,70; -0,0997; 4,0893 dan 0. Hasil ini kemudian diplotkan dalam kurva antara fraksi mol dengan komposisi pada residu. Kurva antara fraksi mol dengan komposisi residu sebagai berikut:
0 0.2 0.4 0.6 0.8 1 1.2
Fraksi Mol Vs Komposisi Alkohol Residu
Linear ()
Gambar 4. Kurva antara fraksi mol dengan komposisi pada residu
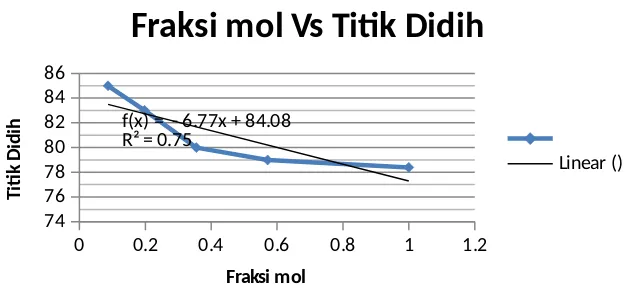
komposisi yang sama dengan cairan, sehingga akan terjadi penguapan tanpa terjadi perubahan komposisi. Destilasi tidak akan dapat memisahkan kedua cairan yang dicampurkan jika komposisi azeotrop sudah dicapai, hal ini karena komposisi kondensat sama dengan komposisi cairan. Titik azeotrop adalah titik tercapainya komposisi azeotrop tercapai. Trend grafik yang didapat dari detilat dan residu berdasarkan hasil uji pada alat sensor didapatkan hasil yang kurang sesuai. Dimana dari konsentrasi rendah ke tinggi untuk destilat didapat nilai yang muncul pada alat tidak beraturan. Sehingga memungkinkan kesalahan terjadi pada hasil yang didapat karena kurang telitinya alat dan juga praktikan dalam melakukan percobaan. Kadar residu untuk alkohol yang didapat sudah sesuai, meskipun untuk konsentrasi 100% tidak di ukur dan didapat hasil yang baik. Hasil yang diperoleh juga dapat dilihat dari plot antara fraksi mol dengan titik didih alkohol tiap konsentrasi 20-100%. Berikut kurva antara fraksi mol dengan titik didih :
0 0.2 0.4 0.6 0.8 1 1.2
74 76 78 80 82 84 86
f(x) = - 6.77x + 84.08 R² = 0.75
Fraksi mol Vs Titik Didih
Linear ()
Fraksi mol
Ti
tik
D
id
BAB 5. PENUTUP
5.1 Kesimpulan
Adapun kesimpulan yang dapat diambil dari percobaan kali ini yaitu :
- Sifat-sifat larutan biner sama dengan sifat-sifat larutan ideal, yaitu homogen mulai dari fraksi mol 0-1, ΔH pencampuran = 0, ΔV pencampuran = 0, dan memenuhi hukum Raoult - Hubungan antara komposisi dengan suhu yakni berbanding terbalik, semakin besar
komposisi alkohol maka semakin kecil suhu untuk mendidihkannya.
5.2 Saran
DAFTAR PUSTAKA
Anonim. 2015. Etanol. (http://www.sciencelab.com/msds.ethanol.html) [diakses pada tanggal 5 Oktober 2015].
Atkins, P.W.1999. Kimia Fisik Jilid II Edisi IV. Jakarta: Erlangga.
Bird, Tony. 1993. Kimia untuk Universitas. Jakarta : PT Gramedia Pustaka Utama. Dogra, SK. 1990. Kimia Fisik dan Soal – Soal. Jakarta : Universitas Indonesia. Hiskia, Achmad. 1996. Kimia Larutan. Bandung: PT Cipta Aditya Bakti.
Petrucci. 1992. Kimia Dasar: Prinsip-Prinsip dan Terapan Modern. Jakarta : Erlangga. Reid. 1990. Sifat-Sifat Gas dan Zat Cair. Jakarta : Gramedia.
Sarjoni, 2003. Kamus Kimia. Jakarta : PT Rineka Cipta. Sukardjo. 1989. Termodinamika Kimia. Jakarta : Erlangga. Syukri. 1999. Kimia Dasar Jilid 1. Bandung: ITB.
LAMPIRAN
1. Pengukuran masa jenis
Ρ = ((m. piknometer+cairan)−(m. piknometerkosong)) volumealko h ol
0 32,443 42,178 9,735 10 0,9735
20 32,443 42,021 9,578 10 0,9578
40 32,443 41,736 9,293 10 0,9293
60 32,443 41,692 9,249 10 0,9249
80 32,443 40,798 8,346 10 0,8346
a. Etanol (alkohol) 20%
X . alkohol=
V . alkohol x ρ. alkohol Mr
V .alkohol x ρ .alkohol
Mr +
V .alkohol x ρ .alkohol
X . alkohol=
V . alkohol x ρ. alkohol Mr
V .alkohol x ρ .alkohol
Mr +
V .alkohol x ρ .alkohol
Komposisi etanol
Komposisi alkohol
Komposisi alkohol
Fraksi Mol alkohol
(%) Residu Destilat
20 -4,2611 8,431 0,087
40 -2,7 7,186 0,198
60 -0,0997 7,286 0,355
80 4,0893 5,934 0,571