DETEKSI DAN IDENTIFIKASI ODONTOGLOSSUM
RINGSPOT VIRUS (ORSV) PADA TANAMAN ANGGREK
LENY ISNAWATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2009
ABSTRAK
LENY ISNAWATI. Deteksi dan Identifikasi Odontoglossum Ringspot Virus (ORSV) Pada Tanaman Anggrek. Dibimbing oleh GEDE SUASTIKA.
Odontoglossum Ringspot Virus (ORSV) merupakan salah satu penyebab penyakit penting pada tanaman anggrek. Pada umumnya ORSV yang menginfeksi tanaman anggrek menunjukkan adanya gejala mosaik serta bercak nekrotik yang memiliki ciri khas yaitu bercak yang berbentuk lingkaran seperti cincin (ringspot) pada permukaan daun dan pecahnya warna bunga. Penyebaran dan penularan virus tersebut terjadi secara mekanis melalui kontaminasi peralatan selama proses pemisahan tanaman dan pemanenan bunga anggrek. Penelitian ini bertujuan untuk mendapatkan informasi mengenai keberadaan ORSV, melakukan deteksi dan identifikasi, mengetahui gejala pada tanaman anggrek serta kisaran inang dari virus tersebut dengan cara penularan secara mekanis pada berbagai jenis tanaman indikator. Survey kejadian penyakit yang disebabkan ORSV di sentra pertanaman anggrek di Gunung Sindur dengan kejadian penyakit 6.67%-26.67% merupakan indikasi bahwa ORSV sudah masuk ke Indonesia. Hasil uji ELISA dengan antiserum ORSV dan deteksi molekuler dengan primer spesifik ORSV diketahui bahwa ORSV sudah ditemukan menyerang tanaman anggrek di Indonesia. Tanaman anggrek yang terinfeksi ORSV menunjukkan gejala berupa mosaik pada daun disertai bercak klorotik yang berwarna hitam yang selanjutnya akan berubah menjadi bercak nekrotik atau bercak berbentuk cincin (ringspot). ORSV dapat ditularkan secara mekanis. Pada pengujian kisaran inang dengan menggunakan beberapa tanaman indikator menunjukkan bahwa ORSV dapat menginfeksi G. globosa, N. tabacum, N. benthamiana, D. stramonium, Physalis sp, C. amaranticolor, dan C. quinoa. Dari hasil pengamatan partikel virus, ORSV yang diisolasi dari tanaman anggrek mempunyai partikel berbentuk batang kaku berukuran sekitar 300 nm x 18 nm, tidak diselubungi enveloped, yang merupakan ciri dari kelompok Tobamovirus.
Judul : DETEKSI DAN IDENTIFIKASI ODONTOGLOSSUM RINGSPOT VIRUS (ORSV) PADA TANAMAN ANGGREK
Nama : Leny Isnawati NRP : A34051288
Menyetujui, Dosen Pembimbing
Dr. Ir. Gede Suastika, Msc. NIP 19620607 198703 1 003
Mengetahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, MSc. NIP 19640204 199002 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 06 Desember 1986 dari pasangan Bapak Rudy Wijaya dan Ibu Enok Kuraesin. Penulis merupakan anak pertama dari dua bersaudara.
Penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMAN I Cileungsi, Bogor pada tahun 2005. Pada tahun yang sama, penulis masuk ke Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB), tingkat pertama di Tempat Persiapan Bersama (TPB), tingkat kedua di Departemen Proteksi Tanaman, Faperta, IPB.
Selama kuliah penulis aktif dalam berbagai kegiatan organisasi. Organisasi yang pernah diikuti oleh penulis antara lain, anggota Entomologi Club, anggota Organic Farming, Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) pada divisi Kewirausahaan tahun 2007-2008.
Penulis pernah menjadi asisten praktikum pada beberapa mata kuliah Ilmu Hama Tumbuhan Dasar (2007 dan 2009), dan Hama Penyakit Tanaman Setahun (2008). Penulis juga berhasil mengikuti PKMP (anggota tim) tentang Virus pada Tanaman Krisan pada tahun 2008, PKMP (ketua tim) tentang Indeksi Infeksi Virus pada Tanaman Anggrek dan PKMP (anggota tim) tentang Eksplorasi Bakteri Pendegradasi Tinja Manusia pada tahun 2009, anggota tim pameran pada PIMNAS (Pekan Ilmiah Nasional) XXII di Universitas Brawijaya, Malang pada tahun 2009.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala nikmat, rahmat, dan hidayah-NYA sehingga penulis dapat menyelesaikan skripsi dengan judul “Deteksi dan Identifikasi Odontoglossum Ringsspot Virus (ORSV) Pada Tanaman Anggrek”. Skripsi ini dapat terselesaikan dengan baik karena bantuan dan dukungan dari berbagai pihak. Untuk itu dengan penuh rasa cinta dan kasih sayang penulis ingin mengucapkan terimakasih kepada Kedua Orang Tua tercinta Bapak Rudy Wijaya dan Ibu Enok Kuraesin yang selalu mengharapkan agar penulis menjadi yang terbaik, selalu memberikan doa, nasihat, dan semangat yang tiada hentinya. Semoga persembahan dapat menjadi sebuah kebanggaan yang dapat dipersembahkan kepada kedua orang tua saya.
Terimakasih sebesar-besarnya penulis sampaikan kepada Dr. Ir. Gede Suastika, MSc. yang selalu membimbing dan mengarahkan penulis dalam proses penelitian yang telah penulis jalankan serta Dr. Ir. Idham Sakti Harahap, MSi selaku dosen penguji atas beberapa saran untuk perbaikan skripsi ini. Terima kasih penulis sampaikan kepada Ir. Irwan Lakani, Msc yang dengan sabar membimbing dan mengarahkan penulis selama proses penelitian. Terima kasih juga untuk seluruh teman – teman DPT 42, 43, 44 dan para sahabatku Aryo, Ozi, Meo, Triva, huda, Eko, sahabat Panineungan, atas segala masukan dan dorongan semangat yang diberikan. Terima kasih penulis ucapkan kepada Bapak Edi Supardi, Mba Tuti, Bu Ifa, Mba Deva, Bundo, dan rekan lab Viro lainnya atas dorongan semangat dan bantuannya selama penelitian ini.
Semoga skripsi ini menjadi langkah awal bagi penulis agar lebih mendalami dan memahami ilmu yang sudah didapatkan. Penulis menyadari bahwa tulisan ini merupakan salah satu rangkaian tugas akhir sekaligus sebagai awal proses pembelajaran ke arah yang lebih baik sehingga penulis berharap adanya masukan yang positif dari berbagai pihak.
Bogor, Juni 2009
DAFTAR ISI
Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR ... i PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan ... 5 Manfaat Penelitian ... 5 TINJAUAN PUSTAKA ... 3 Tanaman Anggrek ... 3Klasifikasi dan Penyebaran ... 3
Budidaya anggrek ... 7
Gejala Infeksi Virus Pada Tanaman Anggrek ... 8
Karakter Molekular ORSV ... 9
Uji Penularan Virus ke Tanaman Indikator ... 9
Deteksi dan Identifikasi Virus ... 10
Deteksi Virus ... 8
Serologi ... 11
Molekuler ... 11
BAHAN DAN METODE ... 13
Tempat dan Waktu Penelitian ... 13
Sumber Inokulum dan Pengamatan Kejadian Penyakit di Lapang ... 13
Isolasi Virus ... 13
Deteksi dengan Double antibody sandwich(DAS)-ELISA ... 14
Deteksi dengan Reverse Transcriptase (RT)-PCR ... 15
Ekstraksi RNA total ... 15
Pembuatan cDNA ... 16
Amplifikasi DNA dengan PCR ... 16
Deteksi Mikroskop Elektron ... 16
Kajian Kisaran Inang Virus ORSV ... 17
HASIL DAN PEMBAHASAN ... 18
Gejala Infeksi Virus Pada Tanaman Anggrek ... 19
Isolasi Virus ... 21
Deteksi Serologi ORSV ... 22
Deteksi Molekuler ORSV ... 22
Morfologi Partikel Virus ... 23
Kajian Kisaran Inang Virus ORSV ... 23
KESIMPULAN DAN SARAN ... 27
DAFTAR TABEL
Halaman Tabel 1 Volume dan nilai ekspor tanaman hias Indonesia
periode 2003-2008 ………... 3 Tabel 2 Volume dan nilai impor tanaman hias Indonesia
periode 2003-2008 ………... 3 Tabel 3 Luas panen, produksi dan produkstivitas
anggrek Indonesia periode 2003-2008 ……….. 4 Tabel 4 Data kejadian penyakit virus ORSV di tiga lokasi pengamatan
di Gunung Sindur ... 18 Tabel 5 Hasil deteksi serologi ORSV dengan metode DAS-ELISA… 22 Tabel 6 Hasil uji kisaran inang ORSV melalui penularan
DAFTAR GAMBAR
Halaman Gambar 1 Gejala pada tanaman anggrek Dendrobium sp. yang positif
terinfeksi ORSV (berdasar uji ELISA), A : gejala pada permukaan atas daun,
B : gejala pada permukaan bawah daun ... 20 Gambar 2 Gejala infeksi ORSV pada N. benthamiana,
A : gejala ringspot pada daun N. benthamiana,
B :perbesaran gambar ringspot pada daun……… 21 Gambar 3 Gambar 3 Hasil amplifikasi genom ORSV
pada bagian gen protein mantel dengan RT-PCR.
(1) DNA ORSV hasil deteksi, (2) Marker 1000 bp……… 23 Gambar 4 Gambar 4 gejala yang tampak pada tanaman indikator yang
diinokulasi ORSV pada uji kisaran inang. (A) N. tabacum, (B) N. benthamiana, (C) D. stramonium, (D) Physalis sp, (E) C. quinoa (F) C. amaranticolor (G) G. globosa (H) cabai IPB 13……….. 26
PENDAHULUAN
Latar Belakang
Tanaman hias memiliki arti penting sepanjang sejarah peradaban manusia. Sejak dulu tanaman hias banyak digunakan untuk mengungkapkan perasaan sekaligus sebagai bahan untuk menambah keasrian lingkungan. Berbagai suku bangsa di Asia, Afrika dan Amerika Latin masih melestarikan kebiasaan penggunaan tanaman hias untuk menyemarakkan upacara adat, keagamaan, dan perayaan hari besar nasional. Pada masa kini, ketika kehidupan masyarakat mulai mapan, penggunaan tanaman hias menjadi populer.
Dalam industri tanaman hias, Indonesia mempunyai potensi besar untuk mengembangkan bisnis ini. Berdasarkan kekayaan alamnya, Indonesia menempati urutan ke-3 setelah Brazil dan Colombia. Akan tetapi penanganan tanaman hias di Indonesia diakui memang jauh tertinggal dengan negara-negara lain. Jika dilihat dari perkembangan usaha tanaman hias di kawasan Asia Tenggara, Indonesia masih berada di bawah negara Thailand dan Malaysia yang merupakan negara maju dalam industri tanaman hias. Salah satu jenis tanaman hias penting di dunia adalah anggrek. Menurut para ahli botani, di dunia terdapat lebih dari 30 ribu spesies anggrek. Di Indonesia, plasma nutfah anggrek diperkirakan lebih dari 5.000 jenis (Rukmana 2000), sekitar 80% genera dan spesies anggrek berada di kawasan Asean (Amiarsi et al.1996).
Anggrek merupakan tanaman yang sangat banyak jenisnya terutama keindahan bunganya. Bentuk, ukuran, variasi warna dan corak bunga anggrek memiliki keindahan yang sangat mempesona. Warnanya beraneka ragam dari putih, kuning, jingga, merah nyala, merah tua, pink dan kombinasi warna lainnya. Susunan bunganya pun sangat bagus. Daya tahan kesegaran bunganya pun luar biasa. Kesegaran anggrek potong mampu bertahan tiga minggu, walau tanpa diberi bahan pengawet. Itulah sebabnya bunga anggrek sering dijuluki ratu bunga
(Yos Sutioso 2002).
Di lingkungan petani anggrek, dikenal adanya anggrek sebagai tanaman koleksi dan anggrek sebagai bunga potong. Kedua jenis tersebut mempunyai sifat dan karakteristik berbeda. Kesalahan memilih jenis terlihat ketika hasil produksi
akan dimanfaatkan. Anggrek yang bukan untuk bunga potong akan cepat layu ketika dirangkai sebagai bunga hias. Anggrek sebagai bunga potong memiliki kriteria yang khas. Jenis itu memiliki nilai ekonomis, mudah dibudidayakan dan anggrek potong memiliki ketahanan yang sangat baik kalau perlakuan panen dan pasca panennya dikerjakan dengan baik. Anggrek sebagai bunga potong merupakan produk yang mudah rusak kalau penanganannya kurang hati-hati. Ini karena kualitas bunga potong sangat ditentukan oleh penampilannya yang dituntut
harus prima.
Anggrek termasuk tanaman dari keluarga Orchidaceae. Tanaman berbunga indah ini tersebar luas di pelosok dunia termasuk Indonesia. Kontribusi anggrek Indonesia dalam khasanah anggrek dunia cukup besar. Dari 20.000 spesies anggrek yang tersebar di seluruh dunia 6.000 diantaranya merupakan hasil persilangan atau hibrida. Diperkirakan setiap tahun dihasilkan 1.000 hibrida baru (Edi Sandara 2002).
Di antara keluarga tanaman berbunga lainnya, sosok bunga anggrek termasuk paling beragam. Beberapa jenis mirip kalajengking (Arachis), kupu-kupu (Phalaenopsis), dan kantung (Paphiopedilum). Jumlah kuntumnya juga bervariasi dari satu hingga ratusan kuntum. Bunga-bunga tersebut juga ditemukan dalam berbagai ukuran demikian juga keragaman warnanya hampir semua jenis warna melekat pada bunga yang dijadikan simbol cinta dan kecantikan ini. Bunga merupakan unsur terpenting dari tanaman anggrek. Struktur dasar bunganya sudah baku, terdiri dari tiga kelompok (sepal) dan tiga tajuk bunga (petal). Salah satu petal berubah menjadi bibir bunga atau labellum. Bagian inilah yang menjadi ciri khas bunga anggrek sehingga berbeda dengan famili tanaman berbunga lainnya. Jadi tak salah jika segala keistimewaan dan keindahan melekat bunga ini.
Pada perkembangannya dalam industri perdagangan tanaman hias. Indonesia memiliki potensi untuk dapat bersaing dengan negara lain. Ekspor anggrek Indonesia terdiri atas tiga macam bentuk yaitu benih, tanaman dan bunga potong. Pada tahun 2003, ekspor anggrek Indonesia mencapai 399.996 kg atau senilai 1.054.894 dollar dan pada tahun 2005 meningkat menjadi 525.468 kg atau senilai dengan 1.430.296 dollar. Namun ekspor anggrek pada tahun berikutnya menurun terus. Pada tahun 2008, ekspor anggrek hanya 166.930 kg atau senilai
740.751 dollar. Sedangkan untuk impor anggrek, pada tahun 2008 mencapai 34.651 kg atau senilai 78.265 dollar seperti terlihat pada tabel 1 dan 2.
Tabel 1 Volume dan nilai ekspor tanaman hias Indonesia periode 2003-2008
Tahun Volume ekspor¹ Total3 Nilai ekspor² Total4 Anggrek Tanaman
hias lainnya Anggrek
Tanaman hias lainnya 2003 399.996 281.932 681.928 1.054.894 332.444 1.387.338 2004 426.113 13.639.041 14.065.154 1.325.954 11.588.485 12.914.439 2005 525.468 17.733.797 18.259.265 1.430.296 13.597.114 15.027.410 2006 362.705 14.684.644 15.047.349 1.232.199 15.099.472 16.331.671 2007 202.804 15.672.879 15.875.683 1.166.671 11.407.260 12.573.931 2008 166.930 3.176.632 3.343.562 740.751 8.489.970 9.230.721
Sumber: Pusdatin dan BPS (diolah)
Keterangan: 1) satuan dalam Kilogram
2) satuan dalam US $
3) total volume ekspor
4) total nilai ekspor
Tabel 2 Volume dan nilai impor tanaman hias Indonesia periode 2003-2008
Sumber: Pusdatin dan BPS (diolah)
Keterangan: 1) satuan dalam Kilogram
2) satuan dalam US $
3) total volume impor
4) total nilai impor
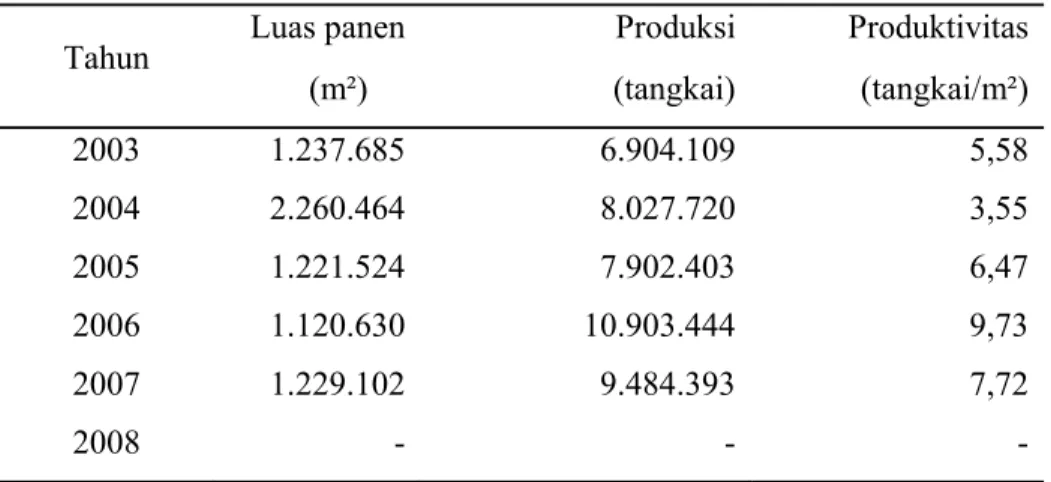
Perkembangan luas panen dan produksi komoditas anggrek mengalami pasang surut. Pada tahun 2003, luas panen mencapai 1.237.685 m2 dengan produksi sebesar 6.904.109 tangkai dan meningkat pada tahun 2004 menjadi 8.027.720 tangkai. Namun, pada tahun 2005 luas panen menurun sehingga jumlah produksi hanya sebesar 7.902.403 tangkai meskipun pada tahun 2006 produksi
Tahun Volume impor¹ Total3 Nilai impor² Total4 Anggrek Tanaman
hias lainnya Anggrek
Tanaman hias lainnya 2003 99.647 24.352 123.999 221.466 154.829 376.295 2004 138.781 667.866 806.647 350.047 835.658 1.185.705 2005 122.171 887.220 1.009.391 537.750 1.311.248 1.848.998 2006 70.848 1.006.105 1.076.953 334.784 1.228.680 1.563.464 2007 72.689 9.419.596 9.492.285 480.204 4.649.906 5.130.110 2008 34.651 7.866.714 7.901.365 78.265 4.037.106 4.115.371
sempat naik hingga 10.903.444 tangkai dengan nilai produktivitas sebesar 9.73 tangkai/m2. Pada tahun 2007 kembali turun menjadi 9.484.393 tangkai dengan produktivitas sebesar 7.72 tangkai/m2 seperti terlihat pada tabel 3.
Tabel 3 Luas Panen, produksi dan produktivitas anggrek Indonesia periode 2003-2008
Tahun Luas panen Produksi Produktivitas (m²) (tangkai) (tangkai/m²) 2003 1.237.685 6.904.109 5,58 2004 2.260.464 8.027.720 3,55 2005 1.221.524 7.902.403 6,47 2006 1.120.630 10.903.444 9,73 2007 1.229.102 9.484.393 7,72 2008 - - -
Sumber: Pusdatin dan BPS (diolah)
Dalam industri tanaman hias khususnya anggrek, tidak terlepas dari berbagai faktor yang dapat menghambat atau menjadi kendala diantaranya keterbatasan ilmu dan teknologi, kurangnya modal, terbatasnya sumberdaya manusia yang berkualitas, kurangnya benih atau bibit yang berkualitas, serta serangan hama dan penyakit dalam budidaya anggrek yang dapat mengakibatkan penurunan mutu dan jumlah produksi tanaman, bahkan dapat menyebabkan kematian tanaman. Beberapa penyakit penting yang menyerang anggrek diantaranya adalah disebabkan oleh virus tanaman. Tanaman anggrek dilaporkan dapat terserang oleh kurang lebih 50 jenis virus (Chang et al 2005; Zettler et al 1990; Navalienskiene et al 2005). Salah satu virus penting yang dapat menyerang anggrek dengan penyebaran yang luas di dunia adalah Odontoglossum ringspot virus (ORSV) (Zettler et al 1990; wisler 1989; Sherpa et al 2004).
Pada umumnya ORSV yang menginfeksi tanaman anggrek menunjukkan adanya gejala mosaik serta bercak nekrotik yang memiliki ciri khas yaitu bercak yang berbentuk lingkaran seperti cincin (ringspot) pada permukaan daun dan pecahnya warna bunga. Penyebaran dan penularan virus tersebut terjadi secara mekanis melalui kontaminasi peralatan selama proses pemisahan tanaman dan
pemanenan bunga anggrek (Zettler et al 1990). Untuk mendeteksi penyakit yang disebabkan oleh virus dapat dilakukan dengan berbagai cara antara lain pengamatan gejala, uji penularan dengan vektor atau tanaman indikator, uji serologi dan teknik deteksi molekuler. Deteksi molekuler diantaranya dengan cara hibridisasi asam nukleat dan teknik Polymerase chain reaction (PCR). serta pengamatan partikel virus dengan menggunakan mikroskop elektron.
Di Indonesia, informasi mengenai penyakit anggrek akibat virus ORSV sangat sedikit sekali karena belum ada laporan resmi mengenai keberadaan virus tersebut. Namun, berdasarkan hasil pengamatan di lapang, indikasi gejala yang tampak pada tanaman anggrek yang teramati mengarah pada gejala yang disebabkan oleh virus ORSV. Jika penyebarannya tidak segera dikendalikan, dikhawatirkan ORSV ini dapat mengancam berbagai macam anggrek di Indonesia. Kegiatan ekspor impor dalam perdagangan tanaman anggrek menjadi salah satu pintu masuknya virus tersebut. Berdasarkan uraian tersebut perlu dilakukan penelitian lebih lanjut tentang deteksi dan identifikasi ORSV pada tanaman anggrek yang ada di Indonesia.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan informasi mengenai keberadaan ORSV, melakukan deteksi dan identifikasi, mengetahui gejala pada tanaman anggrek serta kisaran inang dari virus tersebut dengan cara penularan secara mekanis pada berbagai jenis tanaman indikator.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberi tambahan informasi mengenai ORSV pada tanaman anggrek sehingga dapat digunakan sebagai dasar penentuan strategi pengendalian yang lebih terarah di lapang.
TINJAUAN PUSTAKA
Tanaman Anggrek Klasifikasi dan penyebaran
Dalam klasifikasi Benson (1976), anggrek tergolong ke dalam divisi: Spermatophyta, kelas: Angiospermae, sub-kelas: Monocotyledonae, ordo: Orchidales, famili: Orchidaceae. Anggrek dari famili Orchidaceae merupakan famili tanaman terbesar yang banyak tersebar dan beraneka ragam di dunia. Anggota dari suku ini dapat ditemukan di seluruh dunia kecuali padang pasir yang kering dan daerah yang selalu tertutup salju. Jenis anggrek yang terdapat di dunia berkisar antara 17.000-35.000. Kontribusi anggrek Indonesia dalam khasanah anggrek dunia cukup besar. Dari 20.000 spesies anggrek yang tersebar di seluruh dunia, 6.000 diantaranya berada di hutan Indonesia (Widiastoety et al., 1998; Sandara 2002).
Tanaman anggrek ada yang berbatang monopodial, yaitu batang hanya mempunyai sumbu utama sehingga batang dapat tumbuh lurus ke atas, seperti Vanda, Arachnis, Renanthera, dan Rynchostylis, dan ada juga yang berbatang simpodial, yaitu batang yang pertumbuhan ujung-ujungnya terbatas, seperti Cattleya, Dendrobium, dan Oncidium.
Bunga anggrek tersusun dari tangkai bunga, daun kelopak sebanyak tiga helai, daun mahkota sebanyak tiga helai dan salah satunya menjadi bibir bunga, tangkai sari yang berbentuk tugu, butir-butir sari yang menggumpal menjadi polinum, putik bakal buah yang mirip dengan tangkai bunga dan bakal biji yang terletak di dalam bakal buah. Proses penyerbukan secara alami terjadi dengan bantuan serangga.
Anggrek merupakan tanaman hias yang mempunyai nilai estetika tinggi. Bentuk dan warna bunga serta karakteristik lainnya yang unik menjadi daya tarik tersendiri dari spesies tanaman hias ini sehingga banyak diminati oleh konsumen, baik di dalam maupun luar negeri. Anggrek yang disukai adalah dalam bentuk bunga potong dan tanaman pot.
Budidaya anggrek
Secara alami anggrek (Famili Orchidaceae) hidup epifit pada pohon dan ranting-ranting tanaman lain, namun dalam pertumbuhannya anggrek dapat ditumbuhkan dalam pot yang diisi media tertentu. Ada beberapa faktor yang mempengaruhi pertumbuhan tanaman, seperti faktor lingkungan, antara lain sinar matahari, kelembaban dan temperatur serta pemeliharaan seperti : pemupukan, penyiraman serta pengendalian OPT.
Keperluan cahaya matahari untuk tiap anggrek berbeda-beda. Ada jenis anggrek yang membutuhkan cahaya matahari 100% seperti Arachnis, Renanthera, Vanda. Ada juga yang hanya membutuhkan 60-70% saja seperti Oncidium. Dendrobium dan Aranda dari jenis hybrid membutuhkan cahaya matahari 10-15% (Prasojo 1986). Suhu udara yang tinggi menyebabkan pembuatan material sel sangat pesat, tetapi pertumbuhan tanaman lambat karena disimilasi juga besar sehingga yang diuraikan sebesar yang dibuat.
Pada umumnya anggrek-anggrek yang dibudidayakan memerlukan temperatur 28 + 2° C dengan temperatur minimum 15° C. Anggrek tanah pada umumnya lebih tahan panas daripada anggrek pot. Tetapi temperatur yang tinggi dapat menyebabkan dehidrasi yang dapat menghambat pertumbuhan tanaman. Kelembaban nisbi (RH) yang diperlukan untuk anggrek berkisar antara 60–85%. Fungsi kelembaban yang tinggi bagi tanaman antara lain untuk menghindari penguapan yang terlalu tinggi. Pada malam hari kelembaban dijaga agar tidak terlalu tinggi, karena dapat mengakibatkan busuk akar pada tunas-tunas muda. Oleh karena itu diusahakan agar media dalam pot jangan terlampau basah. Sedangkan kelembaban yang sangat rendah pada siang hari dapat diatasi dengan cara pemberian semprotan kabut (mist) di sekitar tempat pertanaman dengan
bantuan sprayer.
Jenis unsur hara yang dibutuhkan anggrek sama dengan yang dibutuhkan oleh tanaman pada umumnya. Selain unsur makro (C,H,O,N,S,P,Ca,Mg) juga butuh unsur mikro (Prasojo 1986). Pemberian pupuk dapat dilakukan dengan cara menabur, disiram, atau disemprot. Sedangkan pupuk kandang diberikan dengan cara mencampurkan pupuk kandang dengan medium. Untuk mengurangi terbawanya patogen, maka sebaiknya digunakan pupuk kandang yang sudah
matang. Perkembangbiakkan anggrek dapat dilakukan dengan biji. Media yang biasa digunakan untuk menumbuhkan biji dalam botol adalah agar yang telah dicampur dengan berbagai unsur hara. Setelah biji tumbuh menjadi bibit yang sudah cukup besar, bibit dipindahkan ke dalam pot. Media yang biasa digunakan antara lain pakis cacah, kulit pinus, arang kayu, atau sabut kelapa (Soeryowinoto 1984). Media dari bahan organik misalnya pakis, mempunyai daya sebagai buffer, misalnya dalam pengaturan derajat asam sehingga akan lebih aman bagi pemeliharan anggrek.
Gejala Infeksi Virus Pada Tanaman Anggrek
Gejala penyakit virus di lapangan merupakan data pertama yang diperlukan untuk identifikasi virus. Tipe gejala infeksi virus pada tanaman inang yang khas (tanaman inang diferensial) dapat menjadi petunjuk awal untuk identifikasi virus. Anggrek dilaporkan dapat terinfeksi oleh lebih dari 50 jenis virus penyebab penyakit. Gejala yang dihasilkan bermacam-macam, tergantung pada virus patogen, spesies atau hibrida anggrek yang diinfeksi, dan kondisi lingkungan. Odontoglossum ringspot virus (ORSV) atau disebut juga sebagai Tobbaco mosaic virus_orchid strain (TMV-O) merupakan salah satu virus penting yang menyerang anggrek di Amerika Serikat (Corbett 1967) dan sudah menyebar ke negara-negara lain seperti Jerman (Smith 1972), Singapura (Sanderson dan Yong 1972), Malaysia (Poh dan Hua 1970) dan Indonesia (Rusmilah Suseno 1979). Jensen (1951) mengemukakan bahwa strain TMV yang pertama kali diisolasi dari anggrek Odontoglossum yang menyebabkan gejala bercak bercincin pada daun yaitu virus bercak bercincin Odontoglossum.
ORSV dapat menyerang berbagai macam anggrek diantaranya Aranda spp., Dendrobium spp.,Odontoglossum spp., Phalaenopsis spp. dan Grammatophyllum sp.( Rusmilah Suseno 1979). Biasanya pada daun timbul lingkaran, garis-garis, bercak hijau kekuningan atau coklat. Pada umumnya virus ini tidak menimbulkan gejala pada bunga anggrek. ORSV dapat menimbulkan gejala lesio lokal pada Chenopodium amaranticolor, Gompherena globosa, dan Nicotiana glutinosa (Suseno 1985).
Pada beberapa jenis anggrek seperti Cattleya sp., gejala infeksi virus ini bervariasi, yaitu berupa garis-garis klorotik, bercak klorotik sampai nekrotik atau
bercak berbentuk cincin. Pada Oncidium sp. bercak nekrotik berwarna hitam tampak nyata pada permukaan bawah daun. Di lapang persentase tanaman anggrek Oncidium sp. terinfeksi virus ini dapat mencapai 100%. Gejala pada bunga, misalnya anggrek Cattleya sp. berupa mosaik pada sepal dan petal. Bagian tepi dari bunga ini biasanya bergelombang.
Karakter Molekuler ORSV
Partikel ORSV berbentuk batang kaku memanjang, tidak diselubungi enveloped, terdiri atas molekul ssRNA berukuran 6 kb. Ukuran partikel virus ini 300nm x 18 nm, sama seperti Tobacco mosaic virus. ORSV telah diketahui dapat menulari 31 genus anggrek lainnya. Uji proteksi silang dengan strain yang lemah menunjukkan pengurangan suseptibilitas tanaman terhadap strain virulen lainnya dari virus yang sama (Zaitlin 1976). ORSV mudah ditularkan melalui cairan perasan yang menempel pada alat pemotong tanaman sakit atau tetesan air siraman, tetapi tidak ditularkan melalui biji ( Smith 1972).
Uji Penularan Virus ke Tanaman Indikator
Tanaman indikator adalah tanaman yang dikenal sebagai tanaman yang suseptibel terhadap virus yang spesifik. Ketika tanaman indikator diinokulasikan oleh virus, akan menunjukkan gejala. Uji penularan pada tanaman indikator merupakan salah satu cara untuk mengetahui inang alternatif bagi virus, untuk perbanyakkan virus dan untuk mendeteksi adanya virus tanaman. Keberhasilan pengujian ini tergantung pada konsentrasi virus dalam sap, sumber inokulum, metode penyiapan inokulum, ketahanan virus dalam sap, dan tanaman inang.
Tanaman indikator yang umumnya digunakan untuk pengujian virus diantaranya dari famili Solanaceae yaitu tanaman Nicotiana tabacum cv. White Burley, Nicotiana tabacum cv. Xanthi, Nicotiana tabacum cv. Samsun NN, Nicotiana clevelandii, Nicotiana glutinosa L., Nicotiana rustica, Lycopersicon esculentum L., Beta vulgaris L., Datura stramonium, famili Chenopodiaceae yaitu tanaman Chenopodium quinoa, Chenopodium amaranticolor Coste & Reyn, famili Leguminosae yaitu tanaman Phaseolus vulgaris L., Vicia faba L., Pisum sativum L., Vigna unguiculata L., famili Cruciferaceae yaitu tanaman Brassica
perviridis cv. Tendergreen Mustard, Brassica pekinensis Rupr., famili Cucurbitaceae yaitu tanaman Cucumis sativus L., Cucumis melo L., Cucumis pepo L., famili Amaranthaceae yaitu tanaman Gomphrena globosa L., Tetragonia expansa Murr. (Matthhews 1991; Hidayat et al. 2005).
Lawson dan Ali (1975) menyatakan bahwa ORSV mempunyai beberapa tanaman inang yang dapat digunakan sebagai tanaman indikator yaitu C.occidentalis, G.globosa, C.amaranticolor, N.glutinosa, N.tabacum, dan Beta vulgaris. Tanaman tersebut dapat digunakan dalam uji hayati karena menunjukkan gejala lesio lokal dan periode inkubasi yang relatif singkat.
Deteksi dan Identifikasi Virus
Identifikasi virus sebagai penyebab penyakit merupakan faktor kunci yang menentukan keberhasilan pengendalian di lapangan. Identifikasi berdasarkan gejala sering tidak cukup untuk menentukan virus penyebab penyakit. Gejala dapat disebabkan oleh infeksi campuran dari beberapa virus atau virus yang berbeda dapat menimbulkan gejala yang sama. Pengamatan gejala yang diikuti oleh pengamatan mikroskop elektron dilakukan untuk mengetahui bentuk virion yang menginfeksi tanaman. Saat ini, deteksi dan identifikasi virus dapat dilakukan menggunakan teknik biologi molekul yang didasarkan atas runutan nukleotida genom virus yang khas. Sifat virus yang menjadi dasar identifikasi virus adalah gejala penyakit, kisaran tanaman inang, dan kekhasan vektor. Selain itu, mikroskop elektron juga dapat digunakan untuk mengetahui genus dan famili virus berdasarkan bentuk dan ukuran virion. Beberapa hal yang perlu diketahui agar identifikasi virus dapat dengan mudah dilakukan adalah sebagai berikut : (1) setiap virus mempunyai kisaran inang yang berbeda, sehingga hubungan khas antara virus dan tanaman inang dapat dijadikan sebagai salah satu cara identifikasi virus. (2) beberapa virus mungkin dapat menginfeksi satu jenis tanaman inang, tetapi salah satu virus menginfeksi secara sistemik dan yang lain hanya infeksi lokal. (3) setiap virus mempunyai vektor yang berbeda, sehingga hubungan ini dapat dijadikan sebagai salah satu cara untuk mengetahui virus tertentu.
Serologi
Enzyme Linked Immunosorbent Assay (ELISA) telah banyak mengalami modifikasi sejak pertama kali teknik ini diperkenalkan untuk mendeteksi virus dalam konsentrasi yang rendah (Bos 1990). Dalam ELISA terjadi proses reaksi antara antigen dan antiserum yang membentuk komplek antigen-antiserum (Ag-As) pada lubang plat mikrotiter yang terbuat dari polystyrene. Zat-zat yang dapat mengindikasikan terbentuknya antibodi di dalam serum disebut antigen. Antigen umumnya adalah protein. Serum yang mengandung antibodi disebut antiserum. Interaksi antara antigen dan antiserum bersifat spesifik, artinya antiserum hanya mengenali satu jenis epitop pada antigen. Epitop merupakan bagian dari antigen yang dapat dikenali oleh antibodi atau bagian dari antigen yang dapat berinteraksi dengan antibodi (Crowther 1996). Secara umum, prosedur ELISA yang banyak digunakan dalam virologi tumbuhan adalah Direct-ELISA dan Indirect-ELISA. Perbedaannya adalah pada Direct-ELISA, enzim konjugat terdapat pada molekul immunoglobulin pertama yang langsung bereaksi dengan antigen. Pada Indirect -ELISA, enzim konjugat terdapat pada molekul immunoglobulin kedua yang beraksi dengan antiserum (Crowther 1996; Dijkstra & De Jegger 1998).
Molekuler
Polymerase Chain Reaction (PCR) merupakan cara yang sangat peka untuk melakukan deteksi dan identifikasi patogen tanaman. Teknik ini memberikan beberapa kelebihan bila dibandingkan cara konvensional, antara lain tidak diperlukan pembiakan patogen pada media dan hal ini sangat menguntungkan untuk patogen yang belum dapat dibiakkan secara in vitro seperti virus. Teknik ini memiliki kepekaan yang tinggi dan dapat dilakukan dengan tepat, serta dapat digunakan untuk berbagai tujuan lainnya (Henson & French 1993).
PCR merupakan metode molekuler untuk penggandaan DNA secara in vitro menggunakan enzim dan sepasang primer yang bersifat spesifik terhadap DNA target. Dengan metode ini, segmen tertentu pada DNA dapat digandakan hingga jutaan kali lipat dalam waktu relatif singkat sehingga memudahkan berbagai teknik lain yang menggunakan DNA. Empat komponen utama dalam proses PCR adalah (1) DNA cetakan yaitu fragmen DNA yang akan
dilipatgandakan, (2) oligonukleotida primer yaitu suatu sekuen oligonukleotida pendek yang digunakan untuk mengawali sintesis rantai DNA, (3) deoksiribonukleotida trifosfat (dNTP), terdiri atas dATP, dCTP, dGTP, dTTP, dan (4) enzim DNA polimerase yaitu enzim yang melakukan katalisis reaksi sintesis rantai DNA. Komponen lain yang juga penting adalah senyawa bufer (Yuwono 2006; Dijkstra & De Jegger 1998).
Amplifikasi DNA dimulai dengan denaturasi DNA template pada suhu 95oC selama 1-2 menit sehingga DNA yang untai ganda (double stranded) akan terpisah menjadi untai tunggal. Tahap kedua adalah penempelan (annealing) primer pada DNA cetakan pada suhu 56oC selama 1 menit. Primer akan membentuk ikatan hidrogen dengan cetakan pada daerah sekuen yang komplementer dengan sekuen primer. Tahap ketiga adalah sintesis DNA pada suhu 72oC selama 1-2 menit. Pada suhu ini akan terbentuk DNA baru berdasarkan informasi yang ada pada DNA cetakan dengan bantuan enzim DNA polimerase. Ketiga tahapan tersebut diulangi 25-34 siklus. Setelah PCR suhu menjadi 4oC (Yuwono 2006; Dijkstra & De Jegger 1998).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai Februari 2009 sampai Juni 2009.
Metode
Sumber Inokulum dan Pengamatan Kejadian Penyakit di Lapang
Untuk mengetahui status penyakit di lapang, dilakukan survei di beberapa tempat untuk mengamati kejadian penyakit yang dihitung dengan menggunakan rumus :
KP =
Keterangan :
KP = Kejadian Penyakit
n = Jumlah tanaman yang menunjukan gejala N = Jumlah tanaman yang diamati
Inokulum awal diambil dari sentra produksi tanaman anggrek di Gunung Sindur yaitu tanaman anggrek yang menunjukkan gejala mosaik, klorotik dan nekrotik yang kemudian diinokulasikan beberapa kali pada tanaman Chenopodium amaranticolor, Nicotiana benthamiana, N. benthamiana dan terakhir pada N. benthamiana lagi untuk mendapatkan virus tunggal ORSV.
Isolasi Virus
Sampel tanaman yang diduga terinfeksi ORSV diisolasi dengan menggunakan tanaman N. benthamiana. Bagian tanaman anggrek yang positif terinfeksi ORSV digerus dengan mortar dan pistil steril. Larutan bufer fosfat 0,05 M pH 7.0, ditambahkan dengan perbandingan 0,1 gram per 0,5 ml larutan bufer fosfat (1:5 b/v). Kemudian cairan sap diinokulasikan ke bagian jaringan daun
n
tanaman N. benthamiana. Setiap tanaman diinokulasi pada 3 helai daun termuda yang telah membuka penuh. Sebelum diinokulasi, permukaan jaringan daun dilukai dengan menggunakan karborundum 600 mesh, kemudian sap dioleskan dengan menggunakan cotton bud yang dilakukan searah tulang daun tanpa digosok berlawanan arah. Setelah itu dilakukan pembilasan sisa- sisa karborundum yang masih melekat pada daun tanaman uji dengan aquades.
Deteksi dengan Double Antibody Sandwich (DAS)-ELISA
Deteksi ORSV hasil penularan secara mekanis pada tanaman indikator dilakukan dengan metode DAS-ELISA menurut Crowther 1995. Plat mikrotiter di beri coating dengan antiserum ORSV sebanyak 100 μl (perbandingan antiserum dan coating buffer 1:500) lalu diinkubasi pada suhu 4º semalam (overnight). Setelah itu plat dicuci dengan PBST (phosphate buffer saline tween-20) [8 g NaCl, 0,2 g KH2PO4, 1,15 g Na2HPO4, 0,2 g KCl, 0,2 g NaN3, 0,5 ml Tween 20, pH 7,4] sebanyak 5 kali. 0,2 g daun tanaman indikator yang bergejala digerus dalam GEB (general extract buffer) [1,3 g Na2SO3, 20 g PVP-40, 0,2 g NaN3, 2 g Powdered egg albumin, 20 g Tween-20, pH 7,4]. Sap tanaman diambil sebanyak 100 μl kemudian dimasukan kedalam sumuran plat mikrotiter. Plat mikrotiter diinkubasi selama 2 jam pada suhu 37º. Selanjutnya plat mikrotiter dicuci 5 kali dengan PBST. Kemudian enzim konjugat yang dilarutkan dan ECI buffer (Bovine serum albumin 2 g, PVP-40 20 g, NaN3 0,2 g) sebanyak 100 μl dimasukan kedalam sumuran (perbandingan konjugat dan ECI buffer 1:500) dan diinkubasi pada suhu 37º selama 2 jam, kemudian dibilas 5 kali dengan PBST. PNP (P-nitrophenyl-phosphate) yang telah dilarutkan dalam PNP buffer (0,1 g MgCl2, 0,2 g NaN3, 97 ml dietanolamin), dimasukkan sebanyak 100 μl kedalam sumuran plat mikrotiter dan diinkubasikan selama 30-60 menit pada suhu ruang. Perubahan warna diamati pada masing-masing sumuran.
Reaksi positif ditandai dengan adanya perubahan warna pada cairan yang berada didalam sumuran plat mikrotiter yaitu warna kuning setelah waktu inkubasi. Reaksi segera dihentikan dengan penambahan 3M NaOH, selanjutnya dianalisis secara kuantitatif menggunakan ELISA reader pada panjang gelombang
405 nm. Pengujian dinyatakan bernilai positif jika nilai absorban sampel 1,5 kali dari nilai kontrol negatif.
Deteksi dengan Reverse Trancriptase (RT)--PCR
Ekstraksi RNA total. RNA total diperoleh dari 0,1 g daun sampel yang bergejala diekstraksi menggunakan RNEasy Plant Mini Kit (Qiagent Inc., Chatsworth, CA., USA) sesuai dengan instruksi first strand complementary DNA (cDNA) dalam mesin PCR. Daun N. benthamiana sumber virus ORSV ditimbang sebanyak 0.1 gram kemudian digerus dengan menggunakan mortar dan pistil dengan bantuan nitrogen cair. Hasil gerusan dimasukkan ke dalam tabung mikro 2 ml dan ditambahkan 450 µl buffer ekstraksi (buffer RLT) yang mengandung 1% merkaptoethanol kemudian divortex, setelah itu sampel diinkubasi pada suhu 56ºC selama 10 menit. Sampel dipipet dan dimasukkan ke dalam QIAShredder spin colomn ungu lalu ditempatkan pada tabung 2ml, disentrifugasi pada kecepatan 13000 rpm selama 2 menit. Supernatan diambil dengan menggunakan pipet tanpa menyentuh pellet dalam tabung koleksi, lalu pindahkan ke dalam tabung mikro 2ml, setelah itu ditambahkan sebanyak 0,5 volume ethanol 96% (± 225 µl) campur dengan menaik turunkan pipet. Sampel dimasukkan (± 650 µl termasuk endapan yang terbentuk) ke dalam RNeasy mini colomn pink, tempatkan pada tabung koleksi 2 ml lalu ditutup dengan baik dan disentrifugasi pada kecepatan 10000 rpm selama 15 menit. Cairan yang terdapat pada tabung koleksi dibuang, kemudian ditambahkan 700 µl buffer RW1 ke dalam RNeasy colomn dan ditutup, disentrifugasi pada kecepatan 10000 rpm selama 15 menit untuk mencuci colomn. RNeasy colomn dipindahkan ke dalam tabung koleksi 2 ml baru, buffer RPE dipipet sebanyak 500 µl lalu dimasukan ke dalam RNeasy colomn kemudian ditutup rapat, disentrifugasi pada kecepatan 10000 rpm selama 15 menit. Kemudian cairan yang ada pada tabung koleksi dibuang. Tabung koleksi digunakan kembali, ditambahkan sebanyak 500 µl buffer RPE lalu disentrifugasi pada kecepatan 10000 rpm selama 2 menit. Untuk meyakinkan bahwa colomn telah kering, colomn dipindahkan pada tabung koleksi baru kemudian disentrifugasi kembali pada kecepatan 10000 rpm selama 1 menit. Kemudian
ditambahkan 40 µl RNAse freewater ke dalam tabung RNEasy colomn, didiamkan selama 10 menit lalu disentrifugasi pada kecepatan 10000 rpm selama 1 menit.
Pembuatan cDNA. RNA hasil ekstraksi selanjutnya ditranskripsi balik menjadi DNA komplementer dengan menggunakan teknik PCR. Reaksi RT-PCR dengan total volume 18 μl terdiri atas 2 μl sampel RNA, 2 μl NE buffer RT 10x, 0,7 μl M-MuLV RT, 4μl 10 mM dNTP, 1,5μl 10 μM oligo-dT, 0,7 µl DTT (dithiothreitol), 0,7μl Rnase inhibitor, dan 6,4 μl H2O. Amplifikasi dilakukan dalam sebuah Automated Thermal Cycler (GeneAmp 9700; Perkin-Elmer Corp., Norwalk, CT) diprogram untuk satu siklus pada 25ºC selama 5 menit, 42ºC selama 60 menit, dan 70ºC selama 15 menit.
Amplifikasi DNA dengan PCR. Amplifikasi DNA virus dilakukan dengan metode PCR dengan menggunakan pasangan primer ORSV CP U 5’-GCTCTAGAATGGGTCGTTTGCGTTTTGTAG-3’ (forward primer) dan ORSV CP D 5’–TCCCCCGGGTCAATACGGATCAGATTGTGC– 3’ (reverse primer). Reaksi PCR dengan total volum 25 μl, terdiri atas 9,5 μl dH2O, 1 μl 10mM primer ORSV CP U, 1 μl ORSV CP D, 12,5 μl PCR mix, dan 1 μl sampel DNA. Amplifikasi dilakukan dalam sebuah Automated Thermal Cycler (GeneAmp 2400; Perkin-Elmer Corp., Norwalk, CT) diprogram untuk 35 siklus amplifikasi sebagai berikut: pemisahan utas DNA pada suhu 95 oC selama 30 detik, penempelan primer pada DNA 51 oC selama 45 detik dan sintesis DNA pada suhu 72 oC selama 1 menit. Khusus untuk siklus terakhir ditambah tahapan sintesis selama 10 menit, kemudian siklus berakhir pada suhu 4 oC. Elektroforesis dilakukan pada gel agarosa 1,2 % yang dijalankan pada 75 V selama 45 menit. Amplikon divisualisasi dengan 2 μg/ml etidium bromide dalam buffer elektroforesis (40 mM Tris, 20 mM sodium asetat, dan 1 mM EDTA, pH 7.0), kemudian diamati pada UV transiluminator dan difoto untuk dokumentasi.
Deteksi dengan Elektron Mikroskop.
Bentuk dan ukuran partikel virus diamati dengan menggunakan mikroskop elektron transmisi model JEOL 1010 pada 80 kV. Preparat disiapkan dengan mencampur 5 μl sampel dengan 5 μl phosphotungstic acid 2%, selanjutnya grid
berukuran 400 mesh yang telah dilapisi membrane kolodion dan dikarbonisasi ditempelkan pada preparat tersebut selama 1-2 menit. Diharapkan partikel virus yang ada pada preparat sampel akan menempel pada grid. Pengamatan partikel virus dilakukan dengan pembesaran 40.000 kali.
Kajian Kisaran Inang Virus ORSV
Uji penularan virus dilakukan terhadap delapan jenis tanaman yang dijadikan sebagai tanaman indikator, diantaranya Gomphrena globosa, Nicotiana tabacum, Nicotiana benthamiana, Datura mild, Physalis sp, Chenopodium amaranticolor, Chenopodium quinoa,dan cabe IPB 13.
Satu gram daun N.benthamiana yang positif terinfeksi ORSV yang menunjukkan gejala mosaik, dilumatkan dalam 0,5 ml larutan penyangga fosfat 0,05 M pH 7.0 (1:5 b/v) dengan menggunakan mortar dan pistil steril. Permukaan daun tanaman indikator yang akan diinokulasi dilukai dengan serbuk karborondum 600 mesh untuk memudahkan virus masuk ke dalam sel. Sap dioleskan ke permukaan daun tanaman indikator yang dilakukan searah tulang daun dengan menggunakan cotton bud, kemudian dicuci dengan aquades untuk menghilangkan karborondum yang tersisa. Inokulasi dilakukan pada masing – masing tanaman indikator dengan 5 ulangan. Pengamatan dilakukan setiap hari meliputi gejala yang timbul serta masa inkubasi dan persentase kejadian penyakit.
HASIL DAN PEMBAHASAN
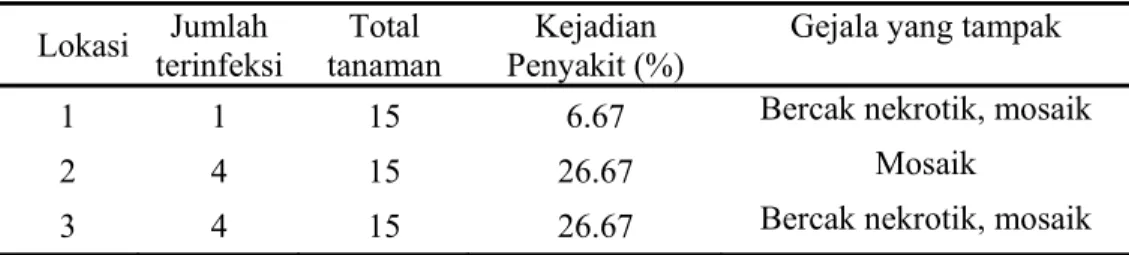
Sumber Inokulum dan Pengamatan Kejadian Penyakit di Lapang Tanaman anggrek yang diduga terinfeksi ORSV diambil dari salah satu sentra pertanaman anggrek yaitu di Gunung Sindur, Jawa Barat, dengan luas lahan minimal sekitar 300-500 m2. Dari tempat tersebut dipilih tiga lokasi pertanaman anggrek secara acak. Dari setiap lokasi diambil 15 tanaman anggrek secara acak sebagai sampel dengan memilih tanaman yang menunjukkan berbagai macam gejala diantaranya mosaik, bercak klorotik, bercak nekrotik dan daun bergelombang atau keriting. Kemudian ke 15 sampel tersebut dilakukan uji serologi dengan metode ELISA untuk mendeteksi keberadaan ORSV. Berdasarkan pada hasil pengamatan pada tanaman anggrek di ketiga lokasi tersebut diperoleh data mengenai jumlah tanaman anggrek yang menunjukkan gejala penyakit akibat virus patogen. Dari 15 tanaman anggrek yang diuji secara serologi dengan metode ELISA untuk deteksi ORSV, ternyata tidak semua sampel tersebut terinfeksi oleh ORSV. Pada lokasi 1, hanya ada satu sampel positif terinfeksi ORSV dengan nilai kejadian penyakit sebesar 6,67%, sedangkan pada lokasi 2 dan 3 memiliki nilai kejadian penyakit yang sama yaitu 26,67%. Data tersebut menunjukkan bahwa ORSV sudah berada di Indonesia walaupun persentase kejadian penyakit yang diperoleh tidak begitu besar. Hal ini dapat dijadikan sebagai indikasi keberadaan ORSV. Sehingga diperlukan tindakan pencegahan agar penyebaran ORSV dapat dikendalikan.
Tabel 4 Data kejadian penyakit virus ORSV di tiga lokasi pengamatan di Gunung Sindur
Lokasi terinfeksi Jumlah tanaman Total Penyakit (%) Kejadian Gejala yang tampak 1 1 15 6.67 Bercak nekrotik, mosaik
2 4 15 26.67 Mosaik
Gejala Infeksi ORSV pada Tanaman Anggrek
Gejala penyakit yang tampak pada tanaman merupakan akibat adanya gangguan fisiologi tanaman. Infeksi virus yang terjadi dalam sel akan mempengaruhi sintesis protein dan asam nukleat pada tanaman. Infeksi virus juga akan mempengaruhi jumlah dan bentuk sel serta organel seperti mitokondria dan kloroplas. Gangguan fisiologi tanaman mengakibatkan tanaman menunjukkan gejala di seluruh bagian tanaman. Infeksi virus pada tanaman inang tidak hanya menimbulkan satu tipe gejala penyakit saja, tetapi dapat menimbulkan lebih dari satu tipe gejala.
Gejala penyakit virus di lapangan merupakan data pertama yang diperlukan untuk identifikasi virus. Tipe gejala infeksi virus pada tanaman inang yang khas (tanaman inang diferensial) dapat menjadi petunjuk awal untuk identifikasi virus. Virus yang menular secara mekanis di lapangan hanya terjadi untuk virus yang stabil dan mempunyai konsentrasi yang tinggi dalam tanaman inang, seperti TMV (Mat Akin 2006).
Jensen (1951) mengemukakan bahwa strain TMV yang pertama kali diisolasi dari anggrek Odontoglossum yang menyebabkan gejala bercak bercincin pada daun yaitu ORSV. Virus ini juga menyebabkan gejala belang (mottle) berbentuk berlian, mosaik dan warna bunga pecah pada Cymbidium sp. serta gejala warna bunga pecah pada Cattleya sp.
ORSV dapat menyerang berbagai macam anggrek diantaranya Aranda spp., Dendrobium spp., Odontoglossum spp., Phalaenopsis spp. dan Grammatophyllum sp. ( Rusmilah Suseno 1976). Biasanya pada daun timbul lingkaran, garis-garis, bercak hijau kekuningan atau coklat. Pada umumnya virus ini tidak menimbulkan gejala pada bunga anggrek. ORSV dapat menimbulkan gejala lesio lokal pada C. amaranticolor, G. globosa, dan N. glutinosa. Pada beberapa jenis anggrek seperti Cattleya sp., gejala infeksi virus ini bervariasi, yaitu berupa garis-garis klorotik, bercak klorotik sampai nekrotik atau bercak berbentuk cincin.
Pada Oncidium sp. bercak nekrotik berwarna hitam tampak nyata pada permukaan bawah daun. Di lapang persentase tanaman anggrek Oncidium sp. terinfeksi virus ini dapat mencapai 100%. Gejala pada bunga, misalnya anggrek
Cattleya sp. berupa mosaik pada sepal dan petal. Bagian tepi dari bunga ini biasanya bergelombang.
Berdasarkan hasil pengamatan, pada tanaman anggrek Dendrobium sp. yang terinfeksi oleh ORSV menunjukkan adanya gejala berupa mosaik pada permukaan daun, selain itu juga terdapat bercak klorotik yang berwarna hitam yang selanjutnya akan berubah menjadi bercak nekrotik yang menyebar di seluruh permukaan daun (Gambar 1).
Gambar 1 gejala pada tanaman anggrek Dendrobium sp. yang positif terinfeksi ORSV (berdasar uji
ELISA), A : gejala pada permukaan atas daun, B : gejala pada permukaan bawah daun A
Isolasi Virus
Isolasi virus ORSV berhasil diisolasi dari sampel tanaman anggrek Dendrobium sp. yang terinfeksi positif berdasarkan hasil uji serologi dengan DAS-ELISA dengan menggunakan tanaman N. benthamiana dengan cara inokulasi mekanis. ORSV menyebabkan gejala mosaik dan adanya bercak melingkar (ringspot) pada tanaman N. benthamiana, gejala muncul enam hari setelah inokulasi. Gejala awal yang muncul adalah bentuk daun yang agak bergelombang atau abnormal, lalu muncul bercak lesio lokal di permukaan daun. Kemudian bercak menyebar membentuk bercak melingkar (ringspot) yang merata di seluruh permukaan daun. (Gambar 2).
Gambar 2 Gejala infeksi ORSV pada N. benthamiana, A : gejala ringspot pada daun
N. benthamiana, B :perbesaran gambar ringspot pada daun
Deteksi Serologi ORSV
Hasil deteksi serologi dengan metode DAS-ELISA terhadap sampel sap tanaman sakit menunjukkan bahwa semua tanaman indikator yang diuji pada pengujian kisaran inang menunjukkan hasil positif, kecuali cabai IPB 13. Hal ini dibuktikan dengan NAE tanaman uji bernilai 1,5 kali NAE kontrol negatif. Sedangkan NAE cabai IPB 13 kurang dari 1,5 kali NAE kontrol negatif (Tabel 2).
Tabel 5 Hasil deteksi serologi ORSV dengan metode DAS-ELISA
Sampel NAE* Keterangan
Buffer 0.195 Kontrol negatif 0.186 Kontrol positif 1.182 N. tabacum 0.298 + N. benthamiana 0.283 + D. stramonium 0.290 + Physalis sp 0.281 + C. quinoa 0.301 + C. amaranticolor 0.316 + G. globosa 0.296 + cabai IPB 13 0.244 ‐
*= nilai absorban ELISA, uji positif jika NAE tanaman uji 1,5 kali NAE kontrol negatif (tanaman sehat)
Deteksi Molekuler ORSV
Pita DNA yang berukuran 500 bp tampak pada hasil separasi DNA pada 1,2 % agarose gel TAE setelah proses amplifikasi dengan PCR menggunakan pasangan primer CP U dan CP D (Gambar 3). Pita DNA ORSV pada gel agarose tampak jelas, hal ini menunjukkan konsentrasi virus dalam tanaman cukup tinggi. Hasil PCR ini memperkuat bukti bahwa metode tersebut dapat digunakan untuk mendeteksi ORSV yang menyebabkan tanaman anggrek bergejala mosaik, klorosis, nekrosis atau bercak bercincin (ringspot).
Gambar 3 Hasil amplifikasi genom ORSV pada bagian gen protein mantel dengan RT-PCR. (1) DNA ORSV hasil deteksi, (2) Marker 1000 bp
Morfologi Partikel Virus
Pengamatan partikel virus dengan mikroskop elektron berhasil dilakukan. Partikel ORSV berbentuk batang kaku memanjang, tidak diselubungi enveloped. Ukuran partikel virus ini 300nm x 18 nm, sama seperti Tobacco mosaic virus (gambar partikel virus tidak ditampilkan).
Kajian Kisaran Inang Virus ORSV
Untuk mengetahui kisaran inang dari ORSV, dilakukan uji kisaran inang dengan cara penularan secara mekanis pada beberapa tanaman indikator seperti G. globosa, N. tabacum, N. benthamiana, D. stramonium, Physalis sp, C.amaranticolor, C. quinoa, dancabai IPB 13.
Hasil uji kisaran inang menunjukkan adanya variasi gejala, masa inkubasi dan kejadian penyakit. Munculnya gejala pada tanaman yang diinokulasi menunjukkan bahwa tanaman rentan terhadap serangan ORSV, sedangkan tanaman uji yang tidak menunjukkan gejala mungkin tanaman tersebut tahan
terhadap serangan ORSV atau terinfeksi tetapi tidak menunjukkan gejala. Boss (1970) mengemukakan bahwa perbanyakan virus pada tanaman yang rentan
tidak selalu menghasilkan gejala yang dapat dilihat atau disebut juga “gejala laten
± 500 bp
1000 bp
500 bp
atau tersembunyi”. Gejala laten ini dapat disebabkan oleh faktor lingkungan atau tanaman itu sendiri. Keadaan lingkungan tempat tumbuh, pada saat maupun inokulasi juga mempengaruhi perkembangan virus atau respon tanaman terhadap infeksi. Kassanis (dalam Bawden 1964) mengemukakan bahwa dengan menyimpan tanaman indikator pada suhu 37°C selama beberapa waktu sebelum inokulasi juga dapat meningkatkan jumlah lesio lokal yang terbentuk. Perlakuan suhu 37°C setelah inokulasi akan menurunkan jumlah lesio lokal yang terbentuk oleh beberapa virus tertentu. Faktor lain yang mungkin dapat menyebabkan tidak timbulnya gejala infeksi virus pada tanaman uji ialah tanaman uji tersebut mungkin bukan merupakan inang virus ORSV. Kemungkinan lain adalah jumlah virus yang dalam inokulum yang kurang mencukupi, jenis tanaman yang mengandung zat penghambat sehingga menghilangkan kestabilan virus dalam sap tanaman sakit.
Dari Tabel 2 dapat diketahui bahwa masa inkubasi yang diuji pada masing-masing tanaman inangnya berkisar 3-6 hari. Empat spesies tanaman dari famili Solanaceae yaitu N.tabacum, N.benthamiana, D.stramonium, dan Physalis sp. menampakkan gejala setelah diinokulasi dengan ORSV melalui penularan secara mekanis yang semuanya baru menunjukkan gejala enam hari setelah inokulasi.
N. tabacum menunjukkan gejala berupa bercak klorotik yang kemudian meluas dan berubah menjadi bercak nekrotik dan akhirnya membentuk seperti lingkaran (ringspot). Physalis sp menunjukkan gejala berupa bercak klorotik yang berwarna hijau kekuningan di pinggiran atau tepian permukaan daun, dan warna daun pun agak memucat menjadi agak kekuningan. Pada D. stramonium, gejala ditandai dengan adanya bercak klorotik yang lama-kelamaan bercak tersebut akan meluas dan mengering membentuk bercak nekrotik. Pada N.benthamiana, gejala berupa pemucatan warna daun atau adanya mosaik dan terdapat bercak nekrotik yang meluas.
C. quinoa merupakan tanaman yang paling cepat menunjukkan gejala lesio lokal nekrotik berwarna coklat pada permukaan daun yang diinokulasi dengan masa inkubasi tiga hari dengan persentase kejadian penyakit juga cukup tinggi mencapai 80%. Hal ini menunjukkan bahwa C. quinoa merupakan tanaman yang
paling rentan terhadap infeksi ORSV yang diuji diantara tanaman lain yang menunjukkan gejala. Sedangkan C. amaranticolor baru menunjukkan gejala lima
hari setelah inokulasi dengan persentase kejadian penyakit sebesar 100%. G. globosa baru menunjukkan gejala enam hari setelah inokulasi. Gejala ditandai
dengan adanya bercak klorotik di seluruh permukaan daun yang kemudian akan menjadi bercak nekrotik. Sedangkan pada cabai IPB 13, tidak ditemui adanya gejala akibat inokulasi virus.
Tabel 6 Hasil uji kisaran inang ORSV melalui penularan secara mekanis.
*= TR/TK x 100%
TR= jumlah tanaman terinfeksi, TK= jumlah tanaman yang diinokulasi, Kl= klorotik, Nk = nekrotik, Mo = mosaik, Tg = tidak bergejala
Jenis Tanaman Masa Inkubasi Kejadian Penyakit Gejala
(hari) (TR/TK) (%)* N. tabacum 6 2/5 40 Kl, Nk N. benthamiana 6 5/5 100 Mo, Nk D. stramonium 6 5/5 100 Kl, Nk Physalis sp 6 4/5 80 Kl C. quinoa 3 4/5 80 Nk C. amaranticolor 6 5/5 100 Kl G. globosa 6 5/5 100 Kl, Nk cabai IPB 13 0 0/5 0 Tg
KESIMPULAN DAN SARAN
Kesimpulan
Hasil uji ELISA dengan antiserum ORSV dan deteksi molekuler dengan primer spesifik ORSV diketahui bahwa ORSV sudah ditemukan menyerang tanaman anggrek di Indonesia. Tanaman anggrek yang terinfeksi ORSV menunjukkan gejala berupa mosaik pada daun disertai bercak klorotik yang berwarna hitam yang selanjutnya akan berubah menjadi bercak nekrotik atau bercak berbentuk cincin (ringspot). ORSV dapat ditularkan secara mekanis. Pada pengujian kisaran inang dengan menggunakan beberapa tanaman indikator menunjukkan bahwa ORSV dapat menginfeksi G. globosa, N. tabacum, N. benthamiana, D. stramonium, Physalis sp, C. amaranticolor, dan C. quinoa. Dari hasil pengamatan partikel virus, ORSV yang diisolasi dari tanaman anggrek mempunyai partikel berbentuk batang kaku berukuran sekitar 300 nm x 18 nm, tidak diselubungi enveloped, yang merupakan ciri dari kelompok Tobamovirus.
Saran
Perlu dilakukan penelitian lanjutan tentang pengujian respon beberapa varietas tanaman anggrek terhadap infeksi ORSV, karakteristik molekuler secara lebih lengkap, dan evaluasi berbagai upaya pengendalian untuk penyakit ini.
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York: Academi Press.
Akin, H.M. 2006. Virologi Tumbuhan. Yogyakarta : Kanisius.
Amiarsi, D., Syaifullah, dan Yulianingsih. 1996. Komposisiterbaik untuk larutan perendaman bunga anggrek potong Dendrobium Sovia Deep Pink. J. Hortikultura 9(1):45-50.
Bawden, F. C. 1964. Plant Viruses and Virus Diseases. Ronald Press. New York. 361p.
Bos, L. 1990. Pengantar Virologi Tumbuhan. Yogyakarta : Gadjah Mada Press.
Chang C, Chen CY, Hsu YH, Wu JT, Hu CC, Chang WC and Lin NS. 2005. Transgenic Resistance to Cymbidium Mosaic Virus in Dendrobium Expressing the Viral Capsid Protein Gene ; Transgenic Res. 14:41-46
Corbett, K. N. 1967. Some distinguish characteristhic of the orchid strain of tobacco mosaic virus. In Lawson, R. H. and Sahfqat Ali. The Handbook on Orchid Pest and Disease. American Orchid Soc. No. 4: 62-100.
Crowther JR. 1996. Method in Molecular Biology: ELISA Theory and Practice. Vol 42. Otowa: Humana Press.
[Dirjen PPHP] Direktorat Jenderal Pengolahan dan Pemasaran Hasil Pertanian. 2005. Road Map Pasca Panen dan Pemasaran Anggrek 2005-2010. Jakarta: Departemen Pertanian.
Dijkstra J, De Jagger. 1998. Practical Plant Virology: Protocol and Exercise. Boston: Springer.
Henson JM, French R. 1993. The Polymerase Chain Reaction and Plant Disease Diagnoses. Annu Rev. Phytopathol
Hidayat SH, Mutaqin KH, Nurkayati E, Suastika G. 2005. Penuntun Praktikum Virologi Tumbuhan Dasar. Bogor. Laboratorium Virologi Tumbuhan Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Institut Pertanian Bogor.
Hu JS. 1993. Tomato Spotted Wilt Detection of Cymbidium Mosaic Virus, Odontoglossum Ringspot Virus, Virus, and Potyviruses Infecting Orchids in Hawaii. Plant Dis. 77:464-468.
Jensen, D. D. & A.H. Gold. 1951. A Virus Ringspot of Odontoglossum Orchid, Symptoms, Transmission and Electron Microscopy. In Lawson & Sahfqat Ali. The Handbook on Orchid Pests and Disease. American Orchid Soc. No. 4: 62-100.
Lawson, R. H. and Shafqat Ali. 1975. Orchid Viruses and Their Detection by Bioassay, Serology and Electron Microscopy. The Handbook on Orchid Pests and Diseases. American Orchid Soc. No. $ : 62-100.
Lawson, R, H. 1995. Viruses and their control. Pages 74-104. In: Orchid Pests and Diseases, American Orchid Society, West Palm Beach, Florida
Matthhews REF. 1991. Plant Virology. Ed ke-3. London: Academic Press.
Navalinskiene M, Raugalas J, Samuitiene M. 2005. Viral disease of flower plants. Identification of Viruses affecting orchids (Cymbidium Sw.). Biology. 2 : 29-34
Poh, T. W. & H. T. Hua. 1970. Disease and Pests of Orchid. Ministry of Agriculture and Land Malaysia. 19p.
Rukmana, R. 2000. Budidaya anggrek bulan. Penerbit Kanisius. Yogyakarta. hal. 9-10.
Sandara Edi. 2002. Membuat Anggrek Rajin Berbunga. Agro Media Pustaka. hal. 1-2.
Sanderson & T. A. Yong. 1972. Disease and Pests of Orchid in Singapore. Agriculture Handbook No.1:15p.
Sherpa AR, Hallan V and Zaidi AA. 2004. Cloning and sequencing of coat protein gene of an Indian Odontoglossum ringspot isolate; Acta Virol. 48 : 267-269
Sutiyoso, Yos. 2002. Anggrek Potong Dendrobium. Jakarta : Penebar Swadaya.
Silalahi RH. 1992. Deteksi Virus Pada Tanaman Anggrek (Grammatophyllum sp) dengan Uji Hayati dan Mikroskop Elektron. [skripsi]. Bogor: Fakultas Pertanian, Institut pertanian Bogor.
Smith, K. M. 1957. A Textbook of Plant Virus Diseases 3rd edition. Brown Company. Boston. 652p.
Suseno, H. Rusmilah. 1976. Virus Mosaik Cymbidium pada Cattleya spp. di Indonesia. Kongres Nasional PFI ke VI, Gambung, Bandung, 20-21 Desember.
Widiastoety, D. 1998. Komoditas Anggrek No.3 : Pembibitan dan Budidaya Anggrek, Balai Penelitian dan Pengembangan Hortikultura-Badan Penelitian dan Pengembangan Pertanian, Jakarta.
Wisler GC. 1989. How to Control Orchid Viruses. The Complete Guidebook. Gainnesville : Maupin House Publ.
Yuwono T. 2006. Teori dan Aplikasi Polymerase Chain Reaction. Yogyakarta: Andi Offset.
Zaitilin, M. 1976. Letter to the Editor. Viral cross protection : more understanding is need. Phytopathol. 66 : 382-383.
Zettler FW, Ko NJ, Wisler GC, Elliot Mark S and Wong SM. 1990. Viruses of orchids and their control ; Plant Dis. 74 : 621-626
26
G am bar 4 g ejala y ang tam p ak p ada tanam an indikator y ang diino kulasi ORSV p ada uji kisaran inang . (A) N. tabac um , (B) N. bentham iana, (C ) D. stram o nium , (D) P hy salis sp , (E) C. q uino a (F ) C. am arantic o lo r (G ) G . g lo bo sa (H) c abai IPB 13
A
C D
E F
G H