EVALUASI SUPLEMENTASI EKSTRAK LERAK (Sapindus rarak)
TERHADAP POPULASI PROTOZOA, BAKTERI DAN
KARAKTERISTIK FERMENTASI RUMEN
SAPI PERANAKAN ONGOLE
SECARA IN VITRO
SKRIPSI
ARISMA KURNIAWATI
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2009
2 RINGKASAN
ARISMA KURNIAWATI D24051615. 2009. Evaluasi Suplementasi Ekstrak Lerak
(Sapindus rarak) terhadap Populasi Protozoa, Bakteri dan Karakteristik Fermentasi Rumen Sapi Peranakan Ongole secara In Vitro. Skripsi Departemen
Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Pembimbing Utama : Sri Suharti, S.Pt., M.Si.
Pembimbing Anggota : Ir. Sudarsono Jayadi, MSc.Agr
Sapindus rarak (lerak) merupakan tanaman yang mempunyai kandungan
saponin tinggi. Saponin merupakan senyawa sekunder tanaman yang dapat digunakan sebagai agen defaunasi pada sistem rumen ternak ruminansia untuk menekan pertumbuhan populasi protozoa. Pengurangan populasi protozoa diharapkan dapat meningkatkan populasi bakteri, karena pada kondisi normal protozoa sering memangsa bakteri rumen. Kandungan saponin buah lerak yang diekstrak dengan metanol akan meningkat hingga 81,5%. Ekstrak lerak mempunyai rasa yag pahit, sehingga manajemen pemberian harus disiasati agar lebih palatabel. Salah satu cara pemberian agar efisien yaitu dalam bentuk pakan blok. Penelitian ini bertujuan untuk mengevaluasi pengaruh suplemen ekstrak lerak (Sapindus rarak) ke dalam ransum yang mengandung pakan blok terhadap populasi protozoa, bakteri dan karakteristik fermentasi rumen sapi peranakan ongole secara in vitro.
Penelitian dilaksanakan dari bulan Juni sampai September 2008, di Laboratorium Biokimia, Fisiologi dan Mikrobiologi, Fakultas Peternakan, Institut Pertanian Bogor. Rancangan yang digunakan yaitu Rancangan Acak Kelompok (RAK), dengan tiga perlakuan dan empat ulangan. Perlakuan yang diberikan antara lain P1 (Ransum Kontrol / K), P2 (K + ekstrak lerak 0,09%) dan P3 (K + ekstrak lerak 0,18%). Ransum kontrol terdiri dari 48% hijauan, 50% konsentrat dan 2% pakan blok. Data dianalisis dengan menggunakan analysis of variance (ANOVA) dan untuk melihat perbedaan antar perlakuan diuji dengan uji jarak Duncan. Peubah yang diamati dalam penelitian ini adalah kecernaan bahan kering dan bahan organik (KCBK dan KCBO), konsentrasi VFA total, proporsi molar VFA, konsentrasi NH3, produksi gas total, populasi protozoa dan bakteri.
Hasil analisa ragam menunjukkan bahwa suplementasi ekstrak lerak tidak signifikan mempengaruhi nilai KCBK dan KCBO dan tidak signifikan meningkatkan konsentrasi VFA total, namun berdasarkan gambaran proporsi molar terjadi kenaikan propionat. Suplementasi ekstrak lerak tidak signifikan menurunkan konsentrasi NH3 dan populasi protozoa, namun suplementasi ekstrak lerak dapat meningkatkan populasi bakteri total. Produksi gas total cenderung meningkat pada inkubasi 0-48 jam, namun suplementasi ekstrak lerak tidak signifikan mempengaruhi nilai produksi gas total.
Dari penelitian ini dapat disimpulkan bahwa suplementasi ekstrak lerak dengan taraf 0,09% dan 0,18% dalam ransum dapat memodifikasi karakteristik fermentasi rumen, populasi protozoa dan bakteri. Suplementasi ekstrak lerak dapat meningkatkan proporsi propionat yang merupakan sumber energi utama bagi sapi pedaging.
Kata-kata kunci : Sapindus rarak, fermentasi rumen, kecernaan, saponin, sapi PO
3 ABSTRACT
In vitro Study of Suplementation of Sapindus rarak Extract on Protozoa and
Bacteria Population and Ongole Crossbreed Rumen Fermentation Characteristic
A. Kurniawati, S. Suharti and S. Jayadi
This experiment was conducted to evaluate the effect of suplementation using Sapindus
rarak extract on protozoal and bacteria population, fermentation characteristic and in vitro digestibility. The experimental design was Randomize Complete Block Design
with 5 treatments and 3 replications. The treatments were: P1 (control diet consist on 48% forage, 50% concentrat and 2% feed block), P2 (P1 + 0.09% Sapindus rarak extract), P3 (P1+0.18% Sapindus rarak extract). Variables observed were protozoal and bacteria population, dry matter and organic matter digestibilities, total Volatile Fatty Acid (VFA) concentration and VFA molar proportion, ammonia (NH3) concentration, and total gas production. Data were analyzed using Analysis of Variance and significant differences among treatment were examined using Duncan Multiple Range Test. The result showed that suplementation using Sapindus rarak extract did not significant decreased amonia (NH3)concentration and protozoa of population, but suplementation of Sapindus rarak extract increased bacteria population. Total gas production tend to increased during 0-48 h incubation. Dry matter and organic matter digestibilities and total VFA concentration was not affected by Sapindus rarak exstract suplementation. Molar proportion of VFA was shifted from asetat to propionat production and reduce the ration of acetat : propionat.
Keywords: Sapindus rarak, ruminal fermentation, digestibility, saponin, ongole
4
EVALUASI SUPLEMENTASI EKSTRAK LERAK (Sapindus
rarak) TERHADAP POPULASI PROTOZOA, BAKTERI DAN
KARAKTERISTIK FERMENTASI RUMEN
SAPI PERANAKAN ONGOLE
SECARA IN VITRO
SKRIPSI
ARISMA KURNIAWATI
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR 2009
5
EVALUASI SUPLEMENTASI EKSTRAK LERAK (Sapindus
rarak) TERHADAP POPULASI PROTOZOA, BAKTERI DAN
KARAKTERISTIK FERMENTASI RUMEN
SAPI PERANAKAN ONGOLE
SECARA IN VITRO
Oleh
ARISMA KURNIAWATI D24051615
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 1 September 2009
Pembimbing Utama Pembimbing Anggota
Sri Suharti, S.Pt, MSi Ir. Sudarsono Jayadi, MSc.Agr NIP. 19741012 200501 2 002 NIP. 19660226 199003 1 001
Dekan Ketua Departemen
Fakultas Peternakan Ilmu Nutrisi dan Teknologi Pakan
Institut Pertanian Bogor Fakultas Peternakan
Institut Pertanian Bogor
Dr.Ir.Luki Abdullah, MSc.Agr Dr. Ir. Idat Galih Permana, MSc NIP. 19670107 199103 1 003 NIP. 19670506 199103 1 001
6 RIWAYAT HIDUP
Penulis dilahirkan di Nganjuk pada tanggal 26 Maret 1987 dari pasangan Bapak Paiman dan Ibu Endang Purnamawati.
Penulis mengawali pendidikan dasarnya di Sekolah Dasar Negeri Ngrawan II pada tahun 1993 dan diselesaikan pada tahun 1999. Pendidikan lanjutan pertama dimulai oleh penulis pada tahun 1999 dan diselesaikan pada tahun 2002 di Sekolah Lanjutan Tingkat Pertama Negeri (SLTPN) I Nganjuk. Penulis kemudian melanjutkan ke Sekolah Menengah Umum Negeri (SMUN) I Nganjuk pada tahun 2002 dan lulus pada tahun 2005.
Penulis diterima sebagai mahasiswa Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor pada tahun 2005 melalui program USMI (Undangan Seleksi Masuk IPB). Selama mengikuti pendidikan, penulis aktif di Himpunan Mahasiswa Nutrisi dan Makanan Ternak (HIMASITER) Fakultas Peternakan, Institut Pertanian Bogor. Penulis juga aktif berpartisipasi dalam berbagai kegiatan kepanitiaan, antara lain kepanitiaan Baktisosial Mahasiswa Peternakan (Bloka-D) dan Seminar Pakan Nasional 2008.
7 KATA PENGANTAR
Alhamdulillahirabbil’aalamiin. Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia dan rahmatnya-Nya sehingga penelitian dan penulisan skripsi ini dapat diselesaikan. Skripsi ini berjudul Evaluasi Suplementasi
Ekstrak Lerak (Sapindus rarak) terhadap Populasi Protozoa, Bakteri dan Karakteristik Fermentasi Rumen Sapi Peranakan Ongole secara In Vitro.
Skripsi ini ditulis berdasarkan hasil penelitian yang penulis lakukan mulai bulan Juni sampai bulan September 2008 bertempat di Laboratorium Biokimia, Fisiologi dan Mikrobiologi Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Saponin merupakan suatu senyawa hasil metabolit sekunder tanaman yang dapat digunakan sebagai agen defaunasi protozoa. Lerak (Sapindus rarak) merupakan salah satu tanaman yang mempunyai kandungan saponin tinggi, yaitu mencapai 21%. Buah lerak yang diekstrak dengan metanol mempunyai kandungan saponin yang tinggi yaitu mencapai 81,5%. Penelitian ini bertujuan untuk mengevaluasi suplementasi ekstrak lerak ke dalam ransum terhadap populasi protozoa dan karakteristik rumen sapi PO secara in vitro.
Penulis memahami bahwa dalam penulisan skripsi ini masih banyak terdapat kekurangan. Oleh karena itu, besar harapan penulis adanya sumbangan pemikiran dari berbagai kalangan untuk perbaikan skripsi ini. Penulis pun mengucapkan terima kasih kepada seluruh pihak yang telah ikut berperan sehingga penulisan skripsi ini dapat terselesaikan. Semoga skripsi ini bermanfaat bagi pembaca.
Bogor, September 2009
8 DAFTAR ISI Halaman RINGKASAN ... i ABSTRACT ... iii LEMBAR PERNYATAAN ... iv LEMBAR PENGESAHAN ... v RIWAYAT HIDUP ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
TINJAUAN PUSTAKA ... 3
Lerak (Sapindus rarak) ... 3
Saponin ... 4
Pengaruh Saponin terhadap Sistem Rumen ... 6
Sistem Pencernaan Ternak Ruminansia ... 7
Mikroba Rumen ... 7
Kecernaan Bahan Kering dan Bahan Organik ... 10
Produksi Gas ... 10
Volatile Fatty Acid (VFA) ... 11
Amonia (NH3) ... 13
METODE ... 15
Lokasi dan Waktu ... 15
Materi ... 15
Rancangan Percobaan ... 15
Prosedur ... 16
HASIL DAN PEMBAHASAN ... 23
Kondisi Umum Penelitian ... 23
Populasi Protozoa ... 24
Populasi Bakteri ... 25
Kecernaan Bahan Kering (KCBK) ... 27
Kecernaan Bahan Organik (KCBO) ... 28
Produksi Gas Total ... 28
Konsentrasi NH3 (Amonia) ... 30
9
KESIMPULAN DAN SARAN ... 34
Kesimpulan ... 34
Saran... 34
UCAPAN TERIMAKASIH ... 35
DAFTAR PUSTAKA ... 36
10 DAFTAR TABEL
Nomor Halaman 1. Komposisi Nutrien Ransum dan Bahan Penyusun Ransum sebagai
Substrat Fermentasi. ... 23
2. Pengaruh Perlakuan terhadap Populasi Protozoa dan Bakteri Total.. 25 3. Pengaruh Perlakuan terhadap Kecernaan Bahan Kering dan Bahan
Organik ... 27 4. Produksi Gas Total selama Inkubasi 0-48 Jam ... 29 5. Rataan Konsentrasi NH3, VFA Total dan Proporsi Molar VFA ... 32
11 DAFTAR GAMBAR
Nomor Halaman
1. Buah dan Pohon Lerak ...
3
2. Struktur Kimia Kelas Utama dari Saponin (Wallace, 2002) 5
3. Proses Metabolisme Karbohidrat dalam Rumen Ternak
Ruminansia (McDonald et al., 2002) ...
12
4. Proses Metabolisme Protein dalam Rumen Ternak
Ruminansia (McDonald et al., 2002) ... ...
14
5. Grafik Pengaruh Ekstrak Lerak pada Produksi Gas... 29
12 DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Analisa Ragam KCBK ... 39
2. Hasil Analisa Ragam KCBO ... 39
3. Hasil Analisa Ragam Konsentrasi NH3 ... 39
4. Hasil Analisa Ragam Konsentrasi VFA ... 39
5. Hasil Analisa Ragam Populasi Protozoa ... 39
6. Hasil Analisa Ragam Produksi Gas selama Inkubasi 2 Jam. ... 39
7. Hasil Analisa Ragam Produksi Gas selama Inkubasi 4 Jam ... 40
8. Hasil Analisa Ragam Produksi Gas selama Inkubasi 8 Jam ... 40
9. Hasil Analisa Ragam Produksi Gas selama Inkubasi 12 Jam ... 40
10.Hasil Analisa Ragam Produksi Gas selama Inkubasi 24 Jam ... 40
13 PENDAHULUAN
Latar Belakang
Tingkat produktivitas sapi potong di Indonesia terutama yang dipelihara oleh peternak rakyat masih tergolong rendah. Hal tersebut disebabkan oleh beberapa faktor diantaranya kandungan nutrien ransum, tingkat kecernaan yang rendah dan manajemen pemeliharan yang belum optimal. Sapi pedaging membutuhkan konsentrat lebih banyak dari pada hijauan untuk prekusor pembentukan otot daging, namun pada umumnya karena alasan ekonomi peternak rakyat tidak mampu memberi pakan konsentrat yang cukup. Pemberian pakan dengan hijauan tinggi akan mengurangi tingkat kecernaan dalam sistem rumen.
Tingkat kecernaan pakan merupakan salah satu faktor yang mempengaruhi tingkat produktivitas ternak, dimana pada ternak ruminansia tingkat kecernaan pakan dipengaruhi oleh populasi mikroba yang ada didalam rumen. Sutardi (1979) menyatakan bahwa adanya bakteri dan protozoa yang hidup dalam rumen menyebabkan ruminansia dapat mencerna ransum yang mengandung serat kasar tinggi. Pernyataan ini didukung oleh Arora (1989) yang menyatakan bahwa protozoa berperan dalam pola fermentasi rumen dengan cara mencerna partikel-partikel pati sehingga dapat mempertahankan pH rumen atau sebagai buffer rumen. Protozoa mempunyai sifat memangsa bakteri untuk memenuhi kebutuhan protein, karena kemampuan protozoa untuk mensintesis asam amino sangat rendah.
Mikroba rumen sebagian besar dihuni oleh bakteri, jumlah bakteri dalam rumen mencapai 109 sel/ml sedangkan jumlah protozoa dalam rumen lebih sedikit dari bakteri yaitu sekitar 106 sel/ml (McDonald et al., 2002). Keberadaan protozoa dalam rumen sering mengganggu ekosistem bakteri, karena mempunyai sifat memangsa bakteri. Jika populasi protozoa tidak terkendali dapat menurunkan jumlah populasi bakteri dan mempengaruhi proses pencernaan serat pakan. Populasi protozoa dalam rumen dapat ditekan dengan penggunaan agen defaunasi. Salah satu agen defaunasi yang dapat digunakan untuk menekan populasi protozoa adalah saponin yang merupakan hasil metabolisme sekunder tanaman. Saponin dapat mengganggu perkembangan populasi protozoa karena saponin mampu membuat suatu ikatan dengan sterol pada permukaan membran sel protozoa. Hal tersebut menyebabkan membran sel protozoa pecah, sel mengalami lisis dan akhirnya mengakibatkan kematian pada protozoa.
14
Buah lerak (Sapindus rarak) yang diekstraksi dengan metanol mengandung saponin yang cukup tinggi yaitu mancapai 81,47%(Astuti et al., 2008). Kandungan saponin dalam buah lerak diharapkan dapat menekan pertumbuhan populasi protozoa dalam rumen sehingga mampu mengoptimalkan populasi bakteri dalam rumen dan meningkatkan kecernaan ransum.
Berdasarkan kemampuannya menekan pertumbuhan protozoa, maka secara tidak langsung ekstrak lerak diharapkan dapat menekan pertumbuhan bakteri metanogen. Hal ini dimungkinkan karena protozoa merupakan host bakteri metanogen. Pembentukan gas metan pada sistem rumen dapat menyebabkan hewan ruminansia mengalami kehilangan sebagian energi kimia yang tercerna, dengan penambahan ekstrak lerak dapat mengurangi pembentukan gas metan sehingga kehilangan energi dapat diminimalkan. Penurunan populasi protozoa diharapkan dapat meningkatkan populasi bakteri dan mempengaruhi karakteristik fermentasi rumen. Ekstrak lerak mempunyai rasa yang pahit, sehingga pemberian ekstrak lerak perlu disiasati agar lebih palatabel. Melalui penelitian ini dilakukan evaluasi ekstrak lerak yang ditambahkan dalam ransum sapi dalam bentuk pakan blok terhadap populasi protozoa, populasi bakteri dan karakteristik fermentasi rumen sapi PO (Peranakan Ongole) secara in vitro.
Tujuan
Tujuan dari penelitian ini adalah mengevaluasi pengaruh suplementasi ekstrak lerak terhadap populasi protozoa dan bakteri, konsentrasi VFA total dan proporsi molar VFA, konsentrasi NH3, kecernaan bahan kering dan bahan organik, serta produksi gas total pada rumen sapi PO secara in vitro.
15 TINJAUAN PUSTAKA
Lerak (Sapindus rarak)
Lerak merupakan jenis tumbuhan yang berasal dari Asia Tenggara yang dapat tumbuh dengan baik pada hampir segala jenis tanah dan keadaan iklim, dari dataran rendah sampai pegunungan dengan ketinggian 450-1500 m dari permukaan laut. Umumnya perkembangbiakan lerak dilakukan melalui penanaman biji, sedangkan perbanyakan dengan stek tidak menunjukkan hasil yang memuaskan (Afriastini, 1990).
Gambar 1. Buah dan Pohon Lerak
Lerak tergolong dalam famili Sapindaceae yang berbentuk pohon dan merupakan raksasa rimba dengan diameter 1 m dan mampu mencapai tinggi 42 m. Daun lerak bertangkai panjang dan merupakan daun majemuk menyirip yang terdiri atas anak-anak daun berbentuk bundar memanjang dengan ukuran panjang 4,5–15,5 cm dan lebar 1,5–4,0 cm. Daun muda umumnya berbulu halus dan bila umurnya meningkat bulu ini gugur dan warna daun menjadi hijau pucat. Ibu tulang daun sebelah bawah agak menonjol dan berwarna coklat. Pada ujung-ujung tangkainya terdapat karangan bunga berupa malai yang bergagang panjang (15-35 cm). Bunga berwarna kuning muda, berkelamin tunggal dan satu rumah, terdiri atas lima helai daun kelopak dengan panjang 2-3,5 mm, empat helai daun mahkota berbentuk lanset memanjang dengan tepi yang berambut rapat dan panjangnya 3,5-5 mm, dan 8 buah benang sari. Bakal buah berlekuk tiga dengan satu bakal biji pada setiap ruang. Buah
16
yang dihasilkan bulat mirip bola dengan diameter 2-2,5 cm, berminyak dan sedikit berkerut. Buah lerak yang masih muda berwarna hijau dan buah yang sudah tua berwarna coklat kehitaman (Heyne, 1987).
Daging buah pada lerak banyak mengandung air, mempunyai rasa pahit dan beracun. Tiap buah mempunyai satu biji yang berkulit keras berwarna hitam mengkilat dengan diameter kurang lebih 1 cm. Menurut Heyne (1987) buah lerak terdiri dari 75 persen daging buah dan 25 persen biji, pada bagian daging buah banyak terkandung senyawa saponin yang merupakan racun yang cukup kuat.
Kulit buah, biji, kulit batang dan daun lerak mengandung saponin dan flavonoida, disamping itu kulit buah juga mengandung alkaloida dan polifenol, sedangkan kulit batang dan daunnya mengandung tanin. Senyawa aktif yang telah diketahui dari buah lerak adalah senyawa – senyawa dari golongan saponin dan sesquiterpene (Wina et al., 2005a). Menurut Sunaryadi (1999) pengujian secara kualitatif daging buah lerak mengindikasikan cukup aman diberikan pada ternak. Kandungan senyawa yang terdapat pada daging buah diantara adalah triterpen, alkaloid dan steroid, sedangkan kandungan senyawa yang negatif diantaranya adalah antrakinon, tanin, fenol, flavonoid dan minyak atsiri.
Saponin
Saponin adalah suatu glikosida yang terdapat pada beberapa tanaman. Saponin ada pada seluruh tanaman dengan konsentrasi tinggi pada bagian-bagian tertentu, dan dipengaruhi oleh varietas tanaman dan tahap pertumbuhan. Fungsi saponin dalam tanaman untuk melindungi diri dari hama, saponin diketahui sebagai bentuk penyimpanan karbohidrat, atau merupakan waste product dari metabolisme tumbuh-tumbuhan. Sifat yang khas dari saponin antara lain berasa pahit, berbusa dalam air, mempunyai sifat detergen yang baik, beracun bagi binatang berdarah dingin, mempunyai aktivitas hemolisis (merusak sel darah merah), tidak beracun bagi binatang berdarah panas, mempunyai sifat anti eksudatif dan mempunyai sifat anti inflamatori. Berdasarkan sifat-sifat tersebut, senyawa saponin mempunyai kegunaan yang sangat luas, antara lain sebagai detergen, pembentuk busa pada alat pemadam kebakaran, pembentuk busa pada industri sampo dan digunakan dalam industri farmasi serta dalam bidang fotografi. Beberapa saponin bekerja sebagai antimikroba, saponin tertentu menjadi penting karena dapat diperoleh dari beberapa
17
tumbuhan yang digunakan sebagai bahan baku untuk sintesis hormon steroid yang digunakan dalam bidang kesehatan (Robinson, 1995).
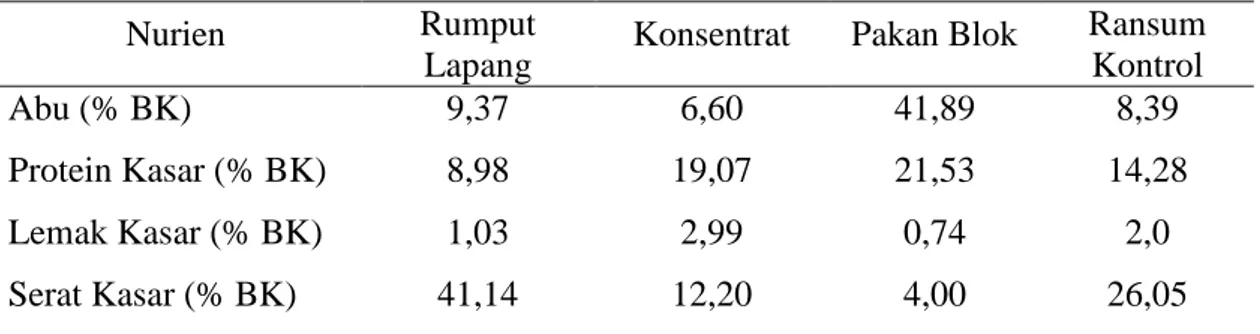
Saponin merupakan jenis glikosida yang terdiri atas gula sebagai bagian glikon yang terikat pada sapogenin yang merupakan bagian aglikonnya (Harborne, 1996). Berdasarkan struktur kimia, saponin dikelompokkan menjadi tiga kelas utama yaitu kelas steroid, kelas steroid alkaloid dan kelas triterpenoid (Wallace et al., 2002). Kerangka dasar sapogeninya adalah cincin pentasiklik sebagai triterpena. Sedangkan saponin steroid mempunyai struktur sapogenin berupa steroid C-27 dengan rantai samping spiroketal. Bagian aglikon saponin ini bercincin tetrasiklik seperti sterol, asam empedu, dan aglikon kardiak (Harbone, 1996).
Gambar 2. Struktur Kimia Kelas Utama dari Saponin (Wallace, 2002)
Saponin sebagian besar terkandung dalam tanaman, namun saponin juga terkandung dalam beberapa jenis hewan seperti sea cucumber. Saponin yang terkandung dalam tanaman banyak ditemukan pada bagian akar, umbi, kulit pohon, biji dan buah. Mayoritas saponin yang terdapat di alam terutama pada tumbuhan merupakan jenis saponin triterpena. Saponin terdapat pada berbagai spesies tanaman, baik tanaman liar maupun tanaman budidaya. Saponin juga banyak ditemukan dalam tanaman yang digunakan sebagai hijauan pakan ternak ruminansia dan tanaman yang berpotensi sebagai imbuhan pakan untuk ruminansia seperti Yuca shidigera, Quillaja
saponaria dan berbagai macam spesies Sapindus. Kandungan saponin dalam
tanaman yang digunakan sabagai hijauan pakan banyak terdapat pada bagian daun, seperti pada alfalfa, Enterolobium cyclocarpum, Mellitus alba, Sesbania sesban, S.
pachycarpa, Avena sativa dan Brachiaria decumbens (Wina et al., 2005b).
Spesies tanaman sapindus seperti Sapindus saponaria, S. rarak, S.
emarginatus, S. drummonii dan S. delavay pada umumnya mempunyai kandungan
18
tinggi dan dapat dimanfaatkan sebagai imbuhan pakan pada ruminansia adalah
Sapindus rarak (lerak). Buah lerak dalam bentuk hasil ekstraksi dengan metanol
telah dilaporkan mengandung saponin dengan kadar lebih tinggi daripada buahnya yang tanpa diekstrak (Thalib, 2004). Hal tersebut sesuai dengan hasil penelitian Astuti et al. (2008) menyatakan buah lerak (Sapindus rarak) yang diekstraksi dengan metanol mengandung saponin yang cukup tinggi yaitu mancapai 81,5%. Menurut Sunaryadi (1999) kandungan saponin total hasil ekstraksi tanaman lerak banyak terdapat di bagian daging buah yaitu sekitar 48,87%.
Pengaruh Saponin terhadap Sistem Rumen
Saponin mempunyai pengaruh yang lebih menguntungkan pada ternak ruminansia dibandingkan pada ternak non ruminansia. Pemberian bahan yang mengandung saponin dapat meningkatkan pertumbuhan, efisiensi pakan dan kesehatan ternak. Saponin dapat meningkatkan sintesis protein mikroba rumen dan menurunkan degradabilitas protein dalam rumen. Penurunan degradasi protein dalam rumen dapat terjadi karena terbentuknya kompleks protein-saponin yang sedikit tercerna dan terkait dengan kemampuan saponin sebagai agen defaunasi yang menyebabkan penurunan total populasi protozoa rumen. Saponin dapat mengganggu perkembangan protozoa dengan terjadinya ikatan antara saponin dengan sterol pada permukaan membran sel protozoa, menyebabkan membran pecah, sel lisis dan mati. Keberadaan kolesterol pada membran sel eukariotik (termasuk protozoa) tetapi tidak terdapat pada sel bakteri prokariotik, memungkinkan protozoa rumen lebih rentan terhadap saponin karena saponin mempunyai daya tarik menarik terhadap kolesterol. Populasi bakteri rumen tidak mengalami gangguan karena disamping bakteri tidak mempunyai sterol yang dapat berikatan dengan saponin, bakteri mempunyai kemampuan untuk memetabolisme faktor antiprotozoa tersebut yang menghilangkan rantai karbohidrat (Suparjo, 2008).
Akhir-akhir ini sudah mulai berkembang pemanfaatan tanaman yang mengandung saponin sebagai alternatif penggunaan bahan-bahan kimia industri/sintetik untuk menekan populasi protozoa dalam rumen (Thalib, 2004; Suparwi, 2000). Secara kimia saponin memiliki diversifikasi struktur yang luas, dan senyawa-senyawa saponin tertentu dengan sifat surfaktannya dapat menyebabkan terjadinya lisis pada dinding sel protozoa, dengan demikian dapat digunakan untuk defaunasi protozoa. Penggunaannya sebagai defaunator protozoa rumen dilaporkan
19
sangat efektif. Penelitian Thalib (2004) menyatakan bahwa ekstrak buah Sapindus
rarak digunakan untuk menghambat produksi gas CH4, dan efektivitasnya sebagai inhibitor metanogenesis.
Sistem Pencernaan Ternak Ruminansia
Pencernaan merupakan proses perubahan fisik dan kimia yang dialami bahan pakan dalam alat pencernaan. Proses pencernaan tersebut meliputi pencernaan mekanik, pencernaan hidrolitik dan pencernaan fermentatif. Pencernaan mekanik terjadi dalam mulut oleh gigi melalui proses mengunyah dengan tujuan untuk memperkecil ukuran, kemudian pakan masuk ke dalam perut dan usus melalui pencernaan hidrolitik, tempat zat makanan diuraikan menjadi molekul-molekul sederhana oleh enzim-enzim pencernaan yang dihasilkan oleh hewan (Sutardi, 1980). Hasil pencernaan fermentatif berupa Volatile Fatty Acid (VFA), NH3 dan air yang sebagian diserap dalam rumen dan sebagian lagi diserap dalam omasum. Selanjutnya pakan yang tidak dicerna disalurkan ke abomasum dan dicerna secara hidrolitik oleh enzim-enzim pencernaan, sama seperti yang terjadi pada monogastrik (Arora, 1989).
Sistem pencernaan ruminansia sangat tergantung pada perkembangan populasi mikroba yang mendiami rumen dalam mengolah setiap bahan pakan yang dikonsumsi. Mikroba tersebut berperan sebagai pencerna serat dan sumber protein. Mikroba rumen berperan mencerna pakan berserat yang berkualitas rendah dan dapat dimanfaatkan sebagai sumber protein bagi induk semang, sehingga kebutuhan asam-asam amino untuk ternak tidak sepenuhnya tergantung pada protein pakan yang diberikan (Sutardi, 1980).
Mikroba Rumen
Mikroba yang terdapat dalam rumen dibagi menjadi empat jenis mikroorganisme anaerob, yaitu bakteri, protozoa, fungi dan mikroorganisme lainnya seperti virus. Penghuni rumen yang fungsional paling penting adalah bakteri, dalam 1 ml getah rumen terkandung 109 sampai 1010 sel dan merupakan 5-10% massa kering isi perut besar (Schlegel, 1994). Jumlah protozoa dalam rumen lebih sedikit bila dibandingkan dengan jumlah bakteri yaitu sekitar 106 sel/ml. Ukuran tubuhnya lebih besar dengan panjang tubuh berkisar antara 20-200 mikron, oleh karena itu biomassa total dari protozoa hampir sama dengan biomassa total bakteri (McDonald et al., 2002) .
20
Faktor utama yang mempengaruhi pertumbuhan dan aktifitas populasi mikroba rumen adalah temperatur, pH, kapasitas buffer, tekanan osmitik, kandungan bahan kering dan potensial oksidasi reduksi (Dehority, 2004). Pola pertumbuhan bakteri dan protozoa rumen dipengaruhi oleh pola fermentasi yang ditunjukkan oleh proporsi molar VFA dan pH rumen. Perkembangan populasi mikroba rumen terutama bakteri akan dibatasi oleh kadar amonia cairan rumen yang rendah, karena ini sangat diperlukan oleh bakteri sebagai sumber N untuk membangun sel tubuhnya.
Bakteri Rumen
Spesies-spesies bakteri dan protozoa yang berbeda saling berinteraksi melalui hubungan simbiosa dan menghasikan produk - produk yang khas seperti selulosa, hemiselulosa, dan pati melalui pencernaan polimer tumbuhan. Bakteri rumen spesies tertentu seperti Ruminococcus flavifaciens, R. alubus, Butyrivibrio fibrisolvans, dan
Selenomonas ruminantium bertanggung jawab dalam fermentasi pregastrik
membentuk asetat, propionat, butirat, CO2 dan H2. Fermentasi akan diikuti meningkatnya pertumbuhan mikroba dan sintesis protein sel sebagai sumber protein untuk ternak. Bakteri dalam rumen mampu mensintesis vitamin – vitamin golongan B kompleks (Arora, 1989).
Bakteri merupakan biomassa terbesar di dalam rumen, terdapat sekitar 50% dari total bakteri hidup bebas dalam cairan rumen dan sekitar 30-40% menempel pada partikel makanan. Beberapa jenis bakteri dari spesies Micrococcus,
Staphylococcus, Streptococcus, Corynebacterium, Lactobacillus, Fusobacterium dan Propionibacteriun ditemukan menempel pada epitel dinding rumen, disamping itu
terdapat spesies bakteri methanogen yang hidup menempel pada protozoa (Dehority, 2004).
Bakteri rumen memiliki fungsi yang sangat penting terhadap fermentasi serat dan tanaman berpolimer (Arora, 1989). Bakteri mengurai karbohidrat polimer dalam pakan menjadi senyawa sederhana seperti asam lemak dan alkohol dari selulosa, amilum, fruktosan dan xilan (Schlegel, 1994).
Bakteri rumen terdiri dari jenis gram positif dan gram negatif. Perbedaan utama antara bakteri gram positif dan gram negatif terletak pada struktur dinding sel. Dinding sel bakteri gram negatif merupakan struktur berlapis, sedangkan bakteri gram positif mempunyai satu lapis yang tebal. Bakteri gram positif memiliki
21
kandungan peptidoglikan yang tinggi dibandingkan bakteri gram negatif, disamping itu kandungan lipid pada dinding sel bakteri gram positif lebih rendah dari dinding sel bakteri gram negatif (Waluyo, 2005). Spesies bakteri rumen yang termasuk dalam gram positif antara lain Lactibacillus ruminis, Lactobacillus vitulinus, Eubacterium
ruminantium, Clostridium polysaccarilyticum, Streptococcus bovis dan Butyrivibrio fibrisolvens, sedangkan yang termasuk dalam gram negatif antara lain Prevotella
sp., Ruminobacter amylophilus, Fibrobacter succinogenes, Selenomonas
ruminantium, Succinimonas amylolitica dan Treponema bryantii (Hobson dan
Stewart, 1997).
Protozoa Rumen
Protozoa merupakan mikroorganisme yang ada dalam rumen dengan jumlah lebih sedikit jika dibandingkan dengan jumlah bakteri yaitu sekitar 1 juta/ml (McDonald et al., 2002). Protozoa bersifat anaerob, apabila kadar oksigen atau pH isi rumen tinggi, maka protozoa tidak dapat membentuk cyste untuk mempertahankan diri dari lingkungan yang jelek, sehingga dengan cepat akan mati (Arora, 1989). Pada ruminansia, protozoa yang bersilia berkembang di dalam rumen dan membantu pencernaan zat – zat makanan dari rumput – rumputan yang kaya akan serat kasar. Protozoa jenis Holotrica terutama memecah gula terlarut seperti glukosa, maltosa, sukrosa dan pati terlarut dan melepaskan asam asetat, asam butirat, asam laktat, CO2, H2 dan amilopektin. Amilopektin sebagai simpanan energi bagi protozoa digunakan apabila substrat dalam lingkungan rumen berkurang.
Keadaan kelaparan atau kekurangan makanan jangka lama merupakan faktor utama penyebab berkurangnya jumlah protozoa. Rendahnya pH mengurangi populasi protozoa secara drastis. Protozoa mempunyai kemampuan sangat kecil untuk mensintesa asam amino dan vitamin B kompleks. Protozoa memperoleh dua golongan zat makanan tersebut dari bakteri dan dapat menghidrogenasi asam – asam lemak tak jenuh menjadi asam lemak jenuh (Arora, 1989). Sebagian besar protozoa memakan bakteri untuk memperoleh sumber nitrogen dan mengubah protein bakteri menjadi protein protozoa, bersamaan dengan itu memperoleh tambahan sumber protein dan pati dari ingesta rumen.
22 Kecernaan Bahan Kering dan Bahan Organik
Kecernaan adalah perubahan fisik dan kimia yang dialami pakan dalam alat pencernaan, perubahan tersebut berupa penghalusan pakan menjadi butir-butir atau partikel kecil. Kecernaan bahan organik merupakan faktor penting yang menentukan kualitas pakan. Setiap jenis ternak ruminansia memiliki mikroba rumen dengan kemampuan yang berbeda-beda dalam mendegradasi pakan, sehingga mengakibatkan perbedaan kecernaan dalam rumen (Sutardi, 1979). Kecernaan pakan didefinisikan sebagai bagian pakan yang tidak diekskresikan dalam feses sehingga diasumsikan bagian tersebut diserap oleh tubuh hewan. Kecernaan dinyatakan dengan dasar bahan kering (McDonald et al., 2002). Kecernaan in vitro dipengaruhi oleh pencampuran sampel pakan, cairan rumen, pH, pengaturan suhu fermentasi, lamaya waktu inkubasi, ukuran partikel sampel dan larutan penyangga (Selly, 1994). Derajat keasaman pH cairan rumen merupakan faktor penting dalam pemanfaatan bahan organik pada sistem pencernaan ruminansia, sedangkan faktor yang mempengaruhi degradasi ransum dalam saluran pencernaan ruminansia adalah struktur makanan, ruminasi, produk saliva dan pH optimum (Anggorodi, 1994).
Produksi Gas
Produksi gas yang dihasilkan menunjukkan adanya fermentasi pakan oleh mikroba rumen. Pada sistem rumen karbohidrat dihidrolisis menjadi disakarida dan non sakarida, kemudian difermentasi menjadi produk VFA terutama asetat, propionate dan butirat serta gas yang berupa gas metan (CH4), H2 dan CO2 (McDonald et al., 2002). Metode pengukuran gas (gas test) digunakan untuk mengevaluasi nilai nutrisi pakan. Hubungan antara kecernaan in vivo dan produksi gas (CO2 dan CH4) secara in vitro pada saat pakan diinkubasi dengan menggunakan cairan rumen selama 24 jam dapat digunakan untuk memperkirakan kecernaan bahan organik dan energi metabolis yang terkandung dalam pakan. Gas yang dihasilkan dari metode pengukuran gas ini secara langsung dihasilkan dari proses fermentasi, sedangkan gas yang dihasilkan secara tidak langsung berasal dari proses buffer dari VFA (Close dan Menke, 1986).
Produksi gas dalam sistem rumen dihasilkan dari proses fermentasi asetat, propionat dan butirat. Dalam sehari gas yang terbentuk dari seekor sapi sekitar 900 liter. Berdasarkan volumenya gas tersebut tersusun dari 65% karbon dioksida (CO2),
23
27% metan (CH4), 7% nitrogen (N) dan 0,18% hidrogen (H2) serta gas H2S (Schlegel, 1994).
Volatile Fatty Acid (VFA)
Proses pencernaan karbohidrat di dalam rumen ternak ruminansia akan menghasilkan energi berupa asam-asam lemak atsiri (VFA) antara lain yang utama yaitu asetat, propionat, butirat, valerat dan format dengan perbandingan di dalam rumen berkisar pada 50-70% asetat, 17-21% propionat, 14-20% butirat, valerat dan format hanya terbentuk dalam jumlah kecil (Schlegel, 1994). VFA berfungsi sebagai sumber energi bagi mikroba rumen, dan merupakan sumber kerangka karbon bagi pembentukan protein mikroba. Kisaran produksi total VFA cairan rumen yang mendukung pertumbuhan mikroba yaitu 80 sampai 160 mM (Sutardi, 1977).
Produksi VFA di dalam cairan rumen dapat digunakan sebagai tolak ukur fermentabilitas pakan (Hartati, 1998). VFA dapat diperoleh dari proses hidrolisis lemak oleh bakteri lipolitik menjadi asam lemak dan gliserol, kemudian gliserol tersebut difermentasikan lebih lanjut menjadi asetat, propionat, butirat dan valerat. VFA juga merupakan produk akhir fermentasi karbohidrat dan merupakan sumber energi utama ruminansia asal rumen. Peningkatan jumlah VFA menunjukkan mudah atau tidaknya pakan tersebut didegradasi oleh mikroba rumen. Komposisi VFA di dalam rumen berubah dengan adanya perbedaan bentuk fisik, komposisi pakan, taraf dan frekuensi pemberian pakan, serta pengolahan. Produksi VFA yang tinggi merupakan kecukupan energi bagi ternak (Sakinah, 2005).
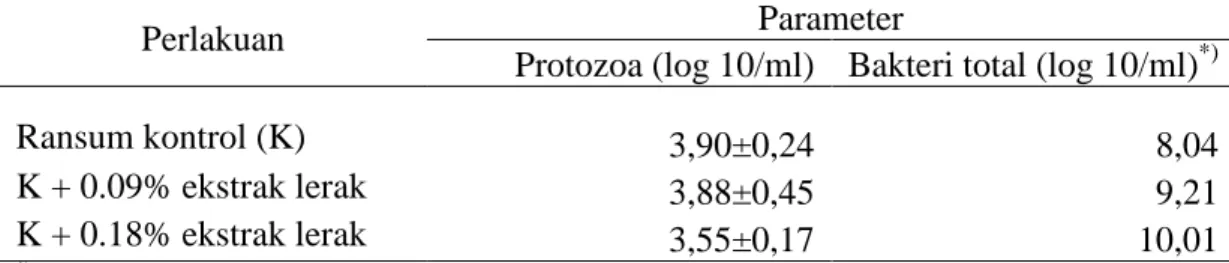
Ransum yang diberikan kepada ternak ruminansia sebagian besar terdiri dari karbohidrat. Di dalam rumen, polisakarida dihidrolisa menjadi monosakarida oleh enzim-enzim mikroba rumen. Kemudian monosakarida tersebut, seperti glukosa difermentasi menjadi VFA (Volatile Fatty Acid) berupa asetat, propionat, butirat dan gas CH4 serta CO2. VFA diserap melalui dinding rumen melalui penonjolan-penonjolan yang menyerupai jari yang disebut vili. Sekitar 75% dari total VFA yang diproduksi akan diserap langsung retikulo-rumen yang masuk ke darah, sekitar 20% diserap di abomasum dan omasum, dan sisanya sekitar 5% diserap di usus halus (McDonald et al., 2002). Proses metabolisme karbohidrat dan pembentukan VFA pada ternak ruminansia disajikan pada Gambar 3.
24
Gambar 3. Proses Metabolisme Karbohidrat dalam Rumen Ternak Ruminansia (McDonald et al., 2002)
Parakkasi (1999) menambahkan bahwa sebagian besar VFA diserap langsung melalui dinding rumen, hanya sedikit asetat, beberapa propionat dan sebagian besar butirat termetabolisme dalam dinding rumen. VFA yang terbentuk merupakan
Selulosa Selulosa Selubiosa Glukosa-1-phosphat Glukosa-6-phosphat Glukosa Maltosa Isomaltosa Pati Sukrosa Fruktan Fruktosa Fruktosa-6-phosphat Pektin Asam Uronat
Hemiselulosa Pentosa
Pentosan Fruktosa-1,6-diphosphat
Asam Piruvat Format
CO2 H2
Asetil CoA Laktat Oksaloasetat Metilmalonil CoA
Metan Malonil CoA Asetoasetil CoA ß-Hidroksibutiril CoA Asetil phosphat Krotonil CoA Butiril CoA Asetat Butirat Laktil CoA Akrilil CoA Propionil CoA Propionat Malat Fumarat
25
sumber energi yang merupakan salah satu ciri khas dari ruminansia. Hasil pencernaan fermentatif berupa VFA, NH3, dan air diserap sebagian di rumen dan sebagian lagi di omasum. Selanjutnya pakan yang tidak tercerna disalurkan ke dalam abomasum dan dicerna secara hidrolitik oleh enzim-enzim pencernaan sama seperti yang terjadi pada hewan monogastrik.
Amonia (NH3)
Mikroorganisme di dalam rumen dan retikulum ternak ruminansia dapat mensintesis asam-asam amino esensial untuk kebutuhannya. Untuk memenuhi hal itu, dibutuhkan protein makanan yang berkualitas baik, namun juga terdapat kelemahan dimana protein yang masuk akan dirombak oleh mikroba rumen menjadi amonia untuk sintesis protein tubuhnya (McDonald et al., 2002). Produksi NH3 berasal dari protein yang didegradasi oleh enzim proteolitik. Tingkat hidrolisis protein tergantung dari daya larutnya yang berkaitan dengan kenaikan kadar NH3 (Arora, 1989). Menurut Sutardi (1977), protein bahan makanan yang masuk ke dalam rumen mula-mula akan mengalami proteolisis oleh enzim-enzim protease menjadi oligopeptida, sebagian dari oligopeptida akan dimanfaatkan oleh mikroba rumen untuk menyusun protein selnya, sedangkan sebagian lagi akan dihidrolisa lebih lanjut menjadi asam amino yang kemudian secara cepat dideaminasi menjadi asam keto alfa dan amonia.
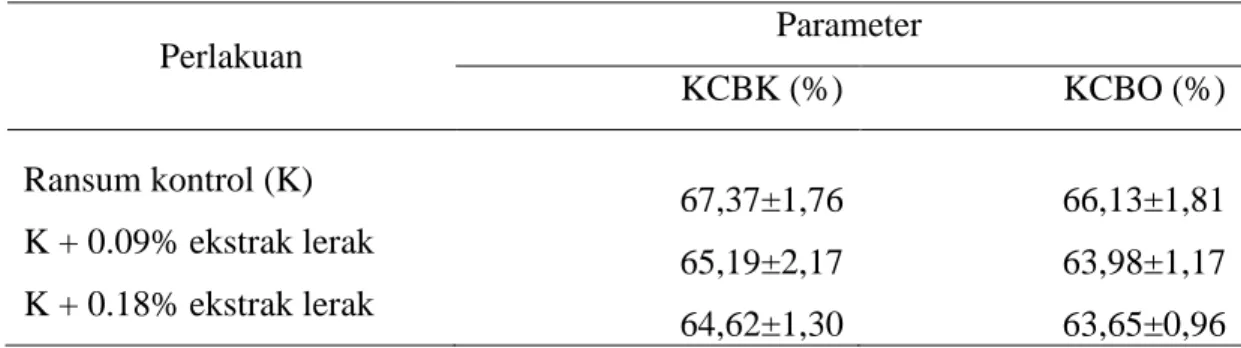
Amonia merupakan sumber nitrogen utama dan penting untuk sintesis protein mikroba (Sakinah, 2005). Menurut Astuti et al. (1993), sumbangan NH3 pada ternak ruminansia sangat penting mengingat bahwa prekusor protein mikroba adalah amonia dan senyawa sumber karbon, makin tinggi kadar NH3 di rumen maka kemungkinan makin banyak protein mikroba yang terbentuk sebagai sumber protein tubuh. Konsentrasi nitrogen amonia sebesar 5 mg persen setara dengan 3,57 mM sudah mencukupi kebutuhan nitrogen mikroba. Amonia hasil fermentasi tidak semuanya disintesis menjadi protein mikroba, sebagian akan diserap ke dalam darah. Amonia yang tidak terpakai dalam rumen akan dibawa ke hati diubah menjadi urea, sebagian dikeluarkan melalui urine dan yang lainnya dibawa ke kelenjar saliva. Proses metabolism protein dan pembentukan amonia (NH3) ditunjukkan pada Gambar 4. Untuk mencegah dampak yang buruk dari pemenuhan nitrogen amonia asal urea, produksi NH3 di dalam rumen akan diproduksi terus-menerus walaupun sudah terjadi akumulasi (Sutardi, 1977). Konsentrasi amonia yang optimum untuk
26
menunjang sintesis protein mikroba dalam cairan rumen sangat bervariasi, berkisar antara 6-21 mM (McDonald et al., 2002).
Gambar 4. Proses Metabolisme Protein dalam Rumen Ternak Ruminansia (McDonald et al., 2002) Pakan Protein Non-protein N Sulit Didegradasi Mudah Didegradasi Peptida Enzim protease Asam Amino Protein Mikroba Rumen Dicerna di Usus Halus Non-protein N Amonia Kelenjar Saliva Hati Enzim peptidase Diekskresikan (urine) NH3 urea Ginjal Deaminasi
27 METODE
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Juni sampai September 2008 di Laboratorium Biokimia, Fisiologi dan Mikrobiologi Fakultas Peternakan, Institut Pertanian Bogor, Bogor.
Materi
Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini antara lain neraca analitik, eksikator, syringe glass Hohenheim 100 ml, tabung gas CO2, termos, kain penyaring,
waterbath, cawan Conway, sentrifus, pompa vakum, labu penyuling, labu
Erlenmeyer, oven 105oC, tanur, gegep, sudip, magnetic stirrer, destilator, buret, kondensor, tabung fermentor, tutup karet, pipet volumetik, bulp dan cawan porselen.
Bahan yang diperlukan untuk pembuatan sampel ransum perlakuan adalah hijauan kering (rumput lapang), konsentrat, pakan blok dan ekstrak lerak. Bahan yang dibutuhkan untuk uji KCBK dan KCBO antara lain larutan HgCl2, kertas saring, dan aquadest. Bahan yang dibutuhkan untuk uji NH3 antara lain asam borat, Na2CO3 jenuh, dan H2SO4 0,005N. Bahan yang digunakan untuk uji VFA antara lain NaOH 0,5N, HCl 0,5N dan H2SO4 15%. Pengukuran produksi gas total diperlukan bahan sebagai berikut, larutan mikro mineral (CaCl2.2H2O, MnCl2.4H2O, CoCl2.6H2O dan FeCl3.6H2O), larutan buffer rumen (NH4HCO3 dan NaHCO3), larutan makro (NaHPO4, KH2PO4 dan MgSO4.7H2O), larutan resazurin 0,1% dan larutan pereduksi (NaOH 1N dan NaS.9H2O).
Cairan Rumen
Cairan rumen yang digunakan berasal dari sapi PO yang dipasang fistula pada bagian rumen yang dipelihara di Laboratorium Lapang Fakultas Peternakan, Institut Pertanian Bogor, Bogor.
Rancangan Percobaan
Perlakuan
Pada penelitian ini terdapat 3 perlakuan dengan 4 ulangan. Perlakuan tersebut antara lain :
28
P2 : K + ekstrak lerak 0,09% P3 : K + ekstrak lerak 0,18%
Model
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Kelompok (RAK) dengan 3 perlakuan dan 4 ulangan sebagai kelompok. Pengelompokan berdasarkan waktu pengambilan cairan rumen. Model matematik yang digunakan dalam analisa adalah :
Yij = µ + βi + τj + εij Keterangan :
Yij : nilai pengamatan perlakuan ke-i, blok ke-j µ : rataan umum
βi : efek perlakuan ke-i
τj : efek blok ke-j
εij : galat perlakuan ke-i dan blok ke-j
Peubah yang Diamati
Peubah yang diamati selama penelitian ini adalah produksi gas, konsentrasi NH3, konsentrasi VFA total dan proporsi molar VFA, kecernaan bahan kering (KCBK), kecernaan bahan organik (KCBO), serta populasi bakteri dan protozoa.
Analisis Data
Data dianalisa dengan analysis of variance (ANOVA) (Mattjik dan Sumertajaya, 2002). Selanjutnya, jika berbeda nyata dilakukan uji jarak Duncan.
Pembahasan proporsi molar VFA dan populasi bakteri, data dianalisis secara deskriptif karena pengujian sampel dilakukan tanpa ulangan.
Prosedur
Ekstraksi Lerak
Ekstrak lerak diperoleh dengan cara mengekstraksi buah lerak dengan metanol. Buah lerak dibersihkan, dikeringanginkan selama 30–36 jam (45oC), setelah itu dikeringkan dengan menggunakan oven (60oC). Buah lerak yang sudah kering digiling dan dimaserasi dengan perbandingan tepung lerak dan metanol 1 : 4. Hasil maserasi disaring dengan menggunakan kertas saring, kemudian supernatan yang dihasilkan dikeringbekukan agar menjadi bubuk menggunakan alat freeze drier.
29 Persiapan Sampel
Sampel ransum perlakuan yang dipergunakan adalah ransum yang mengandung ekstrak lerak yang terdiri atas hijauan, konsentrat dan pakan blok dengan perbandingan 48 : 50 : 2, serta hijauan tunggal dan konsentrat tunggal.
Pengambilan Cairan Rumen
Termos yang akan dipakai untuk tempat cairan rumen diisi dengan air panas sehingga suhunya mencapai 390C kemudian ditutup. Cairan rumen diambil dari sapi berfistula, kemudian diperas dengan menggunakan kain kasa dan dimasukkan ke dalam termos hangat. Sebelum digunakan untuk tempat cairan rumen, air panas yang ada di dalam termos dibuang terlebih dahulu. Untuk menjaga agar cairan rumen tetap dalam kondisi anaerob, termos harus segera ditutup rapat dan dialiri gas CO2 sebelum digunakan.
Pembuatan Larutan Mc Dougal (Saliva Buatan)
Untuk membuat larutan 6 liter, sebanyak 5 liter air destilasi dimasukkan ke dalam labu takar yang bervolume 6 liter kemudian dimasukkan bahan-bahan sbagai berikut NaHCO3 (58,8 gram), Na2HPO4.7H2O (42 gram), KCL (3,42 gram), NaCl (2,82 gram), MgSO4.7H2O (0,72 gram) dan CaCl2 (0,24 gram). Semua bahan tersebut dilarutkan kecuali CaCl2, setelah semua bahan larut ditambahkan CaCl2. Kemudian leher labu dicuci dengan air destilasi hingga permukaan air mencapai tanda tera. Campuran lalu dikocok dengan gas CO2 secara perlahan-lahan dengan cara melewatkannya.
Fermentasi Pakan
Tabung fermentor yang telah diisi dengan 0,5 gram sampel ransum perlakuan ditambahkan 10 ml cairan rumen dan 40 ml larutan McDougal. Tabung fermentor dikocok dengan cara mengaliri gas CO2 selama 30 detik (pH 6,5-6,9) dan ditutup dengan karet berventilasi. Tabung dimasukkan ke dalam shaker water bath dengan suhu 390C, dilakuan fermentasi selama 4 jam untuk sampel VFA/NH3 dan fermentasi 48 jam untuk sampel KCBK/KCBO. Untuk menghentikan fermentasi tutup karet berventilasi dibuka dan ditetesi 2 tetes HgCl2 untuk menghentikan aktivitas mikroba.
Pengukuran KCBK dan KCBO (Tilley & Terry, 1963)
Pembuatan Larutan Pepsin. Sebanyak 2,8 gram pepsin (1:7000) dilarutkan dalam
30
dimasukkan ke dalam labu takar. Air ditambahkan hingga permukaan mencapai tanda tera.
Pengukuran KCBK dan KCBO. Sampel dalam tabung fermentor yang sudah
diinkubasi 48 jam dan ditetesi HgCl2 disentrifusi dengan kecepatan 2500 rpm selama 20 menit. Supernatan dan endapan dipisahkan, kemudian endapan yang terbentuk ditambah 50 ml larutan pepsin-HCL 0,2%. Campuran tersebut diinkubasi selama 48 jam tanpa tutup karet. Setelah 48 jam campuran endapan-pepsin disaring menggunakan kertas saring whatman No.41 dengan bantuan pompa vacum. Hasil saringan (residu) dimasukkan ke dalam cawan porselen yang sebelumnya sudah diketahui bobot kosongnya. Bahan kering diperoleh dengan cara mengeringkan sampel dalam oven 1050C selama 24 jam. Selanjutnya bahan dalam cawan dipijarkan atau diabukan dalam tanur listrik selama 6 jam pada suhu 450-6000C. Sebagai blanko digunakan residu asal fermentasi tanpa sampel ransum perlakuan.
Koefisien Cerna Bahan Kering (KCBK) dan Koefisien Cerna Bahan Organik (KCBO) diitung dengan rumus :
BK sampel (gr) – (BK residu (gr) – BK blanko (gr))
% KCBK = x 100% BK sampel
BO sampel (gr) – (BO residu (gr) – BO blanko (gr))
% KCBO = x 100% BO sampel
Prosedur Pengukuran Konsentrasi NH3 (Metode Mikrodifusi Conway)
Pengukuran konsentrasi NH3 menggunakan metode Mikrodifusi Conway (General Laboratory Procedures, 1966). Sebelum digunakan bibir cawan Conway diolesi dengan vaselin. Supernatan yang dihasilkan dari proses fermentasi dengan inkubasi 4 jam diambil 1 ml, kemudian ditempatkan pada salah satu ujung alur cawan Conway, pada ujung satunya dimasukkan 1 ml Na2CO3 jenuh. Antara supernatan dan Na2CO3 tidak boleh bercampur. Larutan asam borat berindikator sebanyak 1 ml ditempatkan dalam cawan kecil yang terletak di tengah cawan Conway, kemudian cawan Conway langsung ditutup rapat hingga kedap udara. Setelah itu cawan Conway digoyang-goyangkan hingga supernatan dan NaCO3 tercampur rata, dan dibiarkan dalam suhu ruang selama 24 jam. Setelah 24 jam asam borat berindikator dititrasi dengan H2SO4 0,005 N sampai terjadi perubahan warna dari biru menjadi merah.
31
Konsentrasi NH3 dihitung dengan rumus:
Volume H2SO4 x N. H2SO4 x 1000 NH3 (mM) = Berat sampel x BK sampel
Prosedur Pengukuran Konsentrasi VFA
Pengukuran konsentrasi VFA dengan menggunakan metode steam destilasi (General Laboratory Procedures, 1966). Prosedur pengukuran VFA, pertama dipersiapkan alat destilasi yaitu dengan mendidihkan air dan mengalirkan air ke kondensor atau pendingin. Kemudian masukkan 5 ml sampel dan 1 ml H2SO4 15% ke dalam alat destilasi. VFA yang dihasilkan ditangkap dengan 5 ml NaOH 0,5 N yang dimasukkan dalam labu erlenmeyer. Cairan ditampung hingga mencapai 250-300 ml setelah itu dititrasi dengan larutan HCl 0,5 N.
Konsentrasi VFA dihitung dengan rumus (a-b) x N.HCl x 1000/5
VFA (mM) = Berat sampel x BK sampel a : volume titran blanko
b : volume titran contoh
Pengujian proporsi molar VFA menggunakan metode gas kromatografi dengan
salicilic acid sebagai standar. Pengujian dilakukan di Pusat Penelitian dan
Pengembangan Ternak, Bogor.
Prosedur Pengukuran Gas Test (Close dan Menke, 1986)
Pembuatan Larutan Media. Untuk pembuatan larutan media diperlukan :
• 0,1 ml larutan mineral mikro (13,2 gr CaCl22H2O + 10 gr MnCl24H2O + 1,0 gr CoCl26H2O + 8,0 gr FeCl36H2O + aquades hingga volumenya 100 ml). • 200 ml larutan buffer rumen (4,0 gr NH4HCO3 + 35,0 gr NaHCO3 + aquades
hingga volumenya 1000 ml).
• 200 ml larutan makro (5,7 gr Na2HPO4 anhydrous + 6,2 g KHPO4 anhydrous + 0,6 g MgSO4.7H2O, dan ditambah dengan aquadest hingga mencapai volume 1000 ml).
• 1,0 ml larutan resazurin 0,1% (w/v)
• 40 ml larutan pereduksi (4,0 ml NaOH 1 N + 625 mg Na2S.9H2) ditambah 95 ml aquades.
32
Larutan tersebut dicampur menjelang akan digunakan dan dijaga pada temperatur 39oC.
Persiapan Sampel Gas Test. Piston syringe diberi vaselin, kemudian 230 mg pakan
blok perlakuan yang sudah dihaluskan dimasukkan ke dalam syring dan piston kemudian dipasang. Larutan media yang sudah diaduk dan dialiri gas CO2 ditempatkan dalam waterbath 39oC. Selanjutnya, cairan rumen sebagai sumber inokulum diambil dan disaring. Satu bagian cairan rumen dicampur dengan 2 bagian media dan diaduk dengan magnetic stirrer lalu disimpan dalam waterbath dan dialiri gas CO2. Sebanyak 30 ml campuran cairan rumen dan media dimasukkan ke dalam
syringe menggunakan spuit. Udara yang ada di dalam syringe dikeluarkan dan klep syringe ditutup. Posisi piston pada waktu sebelum inkubasi dicatat (Gb0). Piston diinkubasi dalam waterbath selama 48 jam dan pencatatan posisi piston dilakukan pada jam ke 2, 4, 6, 8, 12, 24, dan 48.
Produksi gas diukur dengan rumus : Gb (ml/200 mg BK, 24 jam) =
((Gb24-Gb0) - (Gb24 blanko-Gb0 blanko)*200*((FH+FC)/2)/BK bahan) FH = produksi gas standar hijauan (Asumsi FH = 1)
FC = produksi gas standar konsentrat (Asumsi FC = 1)
Menghitung Populasi Protozoa dan Bakteri
Perhitungan Populasi Protozoa. Penghitungan populasi protozoa dilakukan dengan
menggunakan counting chamber dengan larutan garam formalin (formalin salin) yang dibuat dari campuran formalin dengan NaCl fisiologis (Ogimoto dan Imai, 1981). Sebanyak 1ml larutan formalin salin dimasukkan ke dalam tabung reaksi dan dicampur dengan cairan rumen segar atau cairan rumen yang telah mengalami inkubasi 4 jam kemudian diaduk secara merata. Sampel cairan diteteskan pada
counting chamber dan ditutup dengan cover glass sampai rata. Counting chamber
yang digunakan mempunyai ketebalan 0,1 mm, dengan luas kotak terkecil 0,0625 mm yang terdapat 16 kotak dan kotak yang dibaca sebanyak 5 kotak. Populasi protozoa diamati dengan mikroskop lensa obyektif dengan pembesaran 40x dan okuler 10x.
33
1
Populasi protozoa = x 1000 x C x Fp 0,1 x 0,065 x 16 x 5
Keterangan : C = jumlah koloni yang dihitung Fp = faktor pengencer ( 2 )
Perhitungan Populasi Bakteri Total. Populasi bakteri dihitung dengan metode
pencacahan koloni bakteri hidup. Prinsip perhitungannya adalah cairan rumen diencerkan secara serial, lalu disimpan dalam tabung Hungate. Media tumbuh yang digunakan untuk menghitung populasi bakteri total adalah media BHI (Brain Heart Infusion). Pembuatan media BHI yaitu dengan cara mencampurkan bahan-bahan seperti BHI powder, glukosa, sellulobiosa, pati, cystein, hemin dan resazurin, kemudian dimasukkan ke dalam botol yang telah disterilkan dengan autoclave. Campuran tersebut dipanaskan sampai terjadi perubahan warna dari coklat kekuningan menjadi coklat kemerahan dan berubah kembali menjadi coklat kekuningan, setelah itu didinginkan dan dialiri dengan gas CO2. Media BHI anaerob dimasukkan ke dalam tabung Hungate yang sebelumnya telah diisi bacto agar sebanyak 0,150 gram dengan volume masing – masing 4,9 ml.
Sampel (cairan rumen yang telah mengalami perlakuan dan inkubasi 4 jam) dipipet 0,05 ml dimasukkan ke dalam media pengencer. Pengenceran dilakukan sebagai berikut: 0,05 ml kultur bakteri dimasukkan ke dalam 4,95 ml media pengencer. Selanjutnya dari media pengencer diambil kembali sebanyak 0,05 ml, lalu dimasukkan ke dalam 4,95 ml media pengencer berikutnya, sehingga terdapat pengenceran 10-2, 10-4, 10-6 dan 10-8. Dari masing-masing seri tabung pengenceran diambil sebanyak 0,1 ml, kemudian dimasukkan ke media agar dan diputar sambil dialiri air pada roller, agar media dapat menjadi padat secara merata. Selanjutnya bakteri diinkubasi selama 24 jam.
Penghitungan populasi bakteri dilakukan dengan rumus : Populasi bakteri = Jumlah koloni
0,05 × 10x× 0,1 Keterangan :
34 HASIL DAN PEMBAHASAN
Kondisi Umum Penelitian
Ekstrak lerak merupakan hasil ekstraksi buah dan biji lerak dengan menggunakan pelarut metanol. Ekstrak lerak berbentuk serbuk dan mempunyai kandungan saponin yang sangat tinggi, selain saponin dalam ekstrak lerak juga mengandung tanin dan sarsaponin. Pada penelitian ini suplementasi ekstrak lerak dalam pakan blok untuk meningkatkan palatabilitas, karena ekstrak lerak mempunyai rasa yang pahit. Pengujian secara in vitro dilakukan pada suhu 39oC anaerob dengan kisaran pH 6,5-6,9, dimana kondisi tersebut menyerupai kondisi dalam rumen. Pada penelitian in vitro kondisi rumen dapat ditiru dengan cara memasukkan substrat yang dicampur dengan cairan rumen dan buffer (larutan Mcdougal) ke dalam tabung fermentor, kemudian diinkubasi dalam shaker waterbath. Substrat yang digunakan pada pengujian secara in vitro terdiri dari rumput lapang yang telah dikeringkan dan dihaluskan (BK 21,95%), konsentrat (BK 85,25%) dan pakan blok (Lerak Molasses Blok) yang telah dihaluskan (BK 86,4%). Komposisi pakan blok yang digunakan terdiri dari bahan mikro (urea, garam dan mineral mix), pollard, molasses dan kapur, Pada pengujian secara in vitro penggunaan pakan blok dicampur dengan konsentrat dan hijauan disusun menjadi ransum, yang selanjutnya disebut ransum kontrol. Ransum kontrol yang digunakan sebagai substrat dalam penelitian ini terdiri dari 48% hijauan, 50% konsentrat dan 2% pakan blok. Komposisi konsentrat yang digunakan yaitu bungkil kedelai, bungkil kelapa, onggok, pollard, molasses, DCP, NaCl dan kapur, sedangkan hijauan yang digunakan yaitu rumput lapang. Komposisi nutrien bahan yang digunakan dalam penyusunan ransum ransum kontrol dapat dilihat pada Tabel 1.
Tabel 1. Komposisi Nutrien Ransum dan Bahan Penyusun Ransum sebagai Substrat Fermentasi
Nurien Rumput
Lapang Konsentrat Pakan Blok
Ransum Kontrol Abu (% BK) 9,37 6,60 41,89 8,39 Protein Kasar (% BK) 8,98 19,07 21,53 14,28 Lemak Kasar (% BK) 1,03 2,99 0,74 2,0 Serat Kasar (% BK) 41,14 12,20 4,00 26,05
35
Penyusunan ransum kontrol didasarkan pada ransum sapi PO yang umumnya diberikan pada sapi yang dipelihara skala kecil atau secara tradisional. Ransum yang diberikan biasanya mengandung konsentrat lebih rendah, faktor harga konsentrat membuat peternak memberikan pakan hijauan lebih tinggi dari pada konsentrat. Pemberian hijauan (sumber serat) yang tinggi pada umumnya akan menurunkan kecernaan pakan, sehingga akan mempengaruhi performa dan produktivitas sapi PO. Suplementasi ekstrak lerak pada pakan tinggi serat dapat meningkatkan aktifitas bakteri pendegradasi serat sehingga dapat meningkatkan kecernaan pakan berserat tinggi.
Mutu hijauan yang ada di Indonesia cukup rendah, sehingga penggunaan hijauan harus diimbangi dengan pemberian konsentrat sebagai sumber energi. Pecampuran hijauan dan konsentrat dalam ransum diharapkan dapat memenuhi kebutuhan nutrisi ternak ruminansia dibandingkan hanya diberi pakan hijauan saja. Disamping itu penambahan pakan blok memberikan sumbangan mineral dan protein pakan. Kandungan protein kasar dari ransum sebesar 14,28% BK dan kadar protein tersebut masih dapat memenuhi kebutuhan protein sapi pedaging yang berkisar antara 14-16 %BK (NRC, 1984). Pencampuran hijauan dan konsentrat dalam ransum juga mempengaruhi kandungan serat kasar, dimana kandungan serat kasar ransum kontrol (26,05% BK) lebih rendah dari serat kasar hijauan (41,14% BK) sehingga mengakibatkan kecernaan ransum lebih tinggi dari pada kecernaan hijauan.
Populasi Protozoa
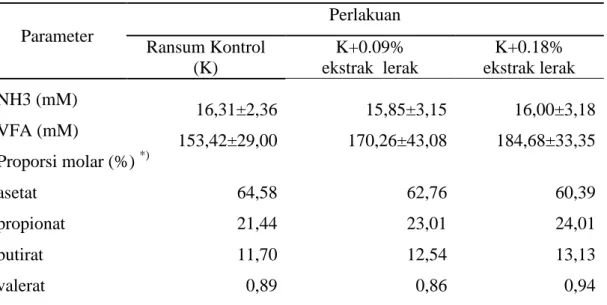
Hasil sidik ragam menunjukkan bahwa efek perlakuan tidak nyata menurunkan populasi protozoa. Hal tersebut disebabkan karena penghitungan populasi dilakukan pada inkubasi 4 jam, dimana pada jam ke 3-4 protozoa mengalami fase lag (pertumbuhan cepat) sehingga saponin dalam ekstrak lerak tidak mempengaruhi populasi protozoa. Suplementasi ekstrak lerak dengan taraf 0,09% dan 0,18% ke dalam ransum kontrol hanya menurunkan populasi protozoa sebesar 1% dan 9% (Tabel 2).
Saponin yang terkandung dalam ekstrak lerak dapat mempengaruhi perkembangan protozoa, karena saponin mampu membentuk ikatan dengan sterol yang terkandung dalam dinding sel protozoa, sehingga mempengaruhi tegangan permukaan membran sel protozoa. Hal tersebut mengakibatkan permeabilitas dinding sel meningkat dan akhirnya cairan dari luar sel akan masuk ke dalam sel protozoa.
36
Masuknya cairan dari luar sel mengakibatkan pecahnya dinding sel sehingga protozoa mengalami kematian atau lisis. Pada penelitian Hess et al. (2003) suplementasi saponin yang berasal dari Sapindus saponaria sebanyak 100 mg/g BK (kandungan saponin 120 mg/g BK) ke dalam ransum pada inkubasi 24 jam dapat menurunkan populasi protozoa hingga 54%.
Tabel 2. Pengaruh Perlakuan terhadap Populasi Protozoa dan Bakteri Total Perlakuan Parameter
Protozoa (log 10/ml) Bakteri total (log 10/ml)*)
Ransum kontrol (K) 3,90±0,24 8,04 K + 0.09% ekstrak lerak 3,88±0,45 9,21 K + 0.18% ekstrak lerak 3,55±0,17 10,01
*)
Keterangan : Pengambilan data dilakukan satu kali.
Protozoa merupakan salah satu mikroba rumen yang ikut berperan dalam fermentasi pakan dalam sistem rumen. Protozoa berkembang di dalam rumen dalam kondisi anaerob dan mempengaruhi proses fermentasi karbohidrat pakan. Protozoa penting keberadaanya karena dapat menstabilkan pH saat fermentasi berlangsung sehingga dapat berfungsi sebagai penyangga (Arora, 1989). Perkembangan protozoa dalam rumen juga sangat dipengaruhi kondisi pH rumen, rendahnya pH rumen dapat mengurangi populasi protozoa secara drastis.
Populasi Bakteri
Gambaran hasil penghitungan bakteri total memperlihatkan suplementasi ekstrak lerak dalam ransum kontrol dapat meningkatkan populasi bakteri (Tabel 2). Suplementasi ekstrak lerak dengan taraf 0,09% dan 0,18% mampu meningkatkan populasi bakteri hingga 100-200 kali dari kontrol, hal tersebut menandakan bahwa saponin cukup berperan dalam menstimulasi perkembangan populasi bakteri rumen. Peningkatan populasi bakteri tersebut kemungkinan dipengaruhi oleh perubahan populasi protozoa. Saponin yang ditambahkan dalam pakan ruminansia dapat membentuk komplek irreversibel dengan kolesterol. Kolesterol dan sterol merupakan komponen dalam membran sel semua jenis mikroorganisme kecuali mikroorganisme jenis prokariota (bakteri) (Cheeke, 2000). Hal tersebut mengakibatkan saponin hanya mampu melisiskan sel protozoa sehingga mengakibatkan kematian pada protozoa, namun saponin tidak berpengaruh terhadap sel bakteri. Berdasarkan gambaran populasi bakteri telihat bahwa kandungan saponin dan senyawa-senyawa lain yang
37
terdapat dalam ekstrak lerak tidak mengganggu populasi bakteri rumen, terlihat dari populasi bakteri berkisar antara 108-1010 sel/ml dimana populasi normal bakteri dalam rumen sekitar 1010 sel/ml.
Suplementasi saponin dalam pakan dapat menurunkan populasi protozoa dan meningkatkan populasi bakteri. Dalam ekosistem rumen protozoa mempunyai sifat memangsa bakteri, sehingga penurunan populasi protozoa dapat meningkatkan perkembangan populasi bakteri. Hal tersebut telah dibuktikan oleh beberapa penelitian antara lain penelitian yang dilakukan Thalib (2004), penambahan ekstrak metanol buah lerak (saponin 15%) ke dalam pakan (rumput raja) sebanyak (80 mg/100ml) pada inkubasi 48 jam dapat menurunkan populasi protozoa sampai 79% dan meningkatkan populasi bakteri sekitar 39% dari kontrol. Pada penelitian Diaz et
al. (1993) penambahan buah Sapindus saponaria pada pakan domba signifikan
meningkatkan bakteri total dan bakteri selulolitik pada rumen domba.
Peningkatan populasi bakteri total menunjukkan bahwa saponin tidak mempengaruhi permeabilitas dinding sel bakteri, namun tidak semua jenis bakteri tahan terhadap saponin. Wang et al. (2000) menyatakan bahwa pemberian saponin yang berasal dari ekstrak Yuca schidigera pada pakan tinggi biji-bijian dapat menekan Streptococcus bovis (gram positif) dalam mencerna pati. Hal tersebut juga telah dibuktikan dalam penelitian Wallace et al. (1994), saponin dari ekstrak Y.
schidigera dapat menstimulasi pertumbuhan populasi Prevotella ruminicola (gram
negatif) dan menekan pertumbuhan populasi S. bovis (gram positif). Menurut Cheeke (2000) saponin dapat menekan perkembangan populasi protozoa dan bakteri gram positif.
Peningkatan populasi bakteri memberikan efek positif terhadap fermentasi pakan, dimana laju fermentasi pakan menunjukkan adanya peningkatan. Peningkatan fermentasi pakan dapat dilihat dari konsentrasi VFA total yang merupakan produk dari fermentasi pakan yang dilakukan oleh bakteri dalam rumen.
Kecernaan Bahan Kering (KCBK)
Hasil analisa ragam menunjukkan bahwa perlakuan tidak signifikan mempengaruhi kecernaan bahan kering (KCBK), suplementasi ekstrak lerak dengan taraf 0,09% dan 0,18% menunjukkan hasil yang sama dengan kontrol (Tabel 3). Hal tersebut menandakan bahwa suplementasi ekstrak metanol lerak tidak mempengaruhi kecernaan pakan dan aktivitas mikroba rumen dalam mencerna pakan.
38
Tabel 3. Pengaruh Perlakuan terhadap Kecernaan Bahan Kering dan Bahan Organik Perlakuan Parameter KCBK (%) KCBO (%) Ransum kontrol (K) 67,37±1,76 66,13±1,81 K + 0.09% ekstrak lerak 65,19±2,17 63,98±1,17 K + 0.18% ekstrak lerak 64,62±1,30 63,65±0,96 Kecernaan zat-zat makanan merupakan salah satu ukuran dalam menentukan kualitas dari pakan. Semakin tinggi kecernaan bahan kering maka semakin tinggi juga peluang nutrisi yang dapat dimanfaatkan ternak untuk pertumbuhannya. Kecernaan pakan dipengaruhi oleh pencampuran pakan, cairan rumen dan inokulasi, pH kondisi fermentasi, pengaturan suhu fermentasi, lama waktu inkubasi, ukuran sampel dan larutan penyangga (Selly, 1994).
Nilai kecernaan bahan kering ransum kontrol adalah 67,37%, lebih tinggi dari nilai kecernaan dalam batas normal yang berkisar antara 50-60% (Sutardi, 1979). Suplementasi ekstrak lerak ke dalam ransum dengan taraf 0,09% dan 0,18% menurunkan kecernaan 3% dan 4%. Hal tersebut disebabkan karena adanya kandungan tanin dalam ekstrak lerak. Tanin dapat berikatan dengan protein pakan sehingga mengakibatkan protein sulit didegradasi oleh mikroba rumen. Buah lerak yang diekstrak menggunakan metanol mengandung tanin sebesar 8,20% (Astuti et
al., 2008). Kecernaan bahan kering juga dapat dipengaruhi oleh kandungan protein
pakan, karena setiap sumber protein memiliki kelarutan dan ketahanan degradasi yang berbeda-beda (Sutardi, 1980).
Kecernaan Bahan Organik (KCBO)
Hasil sidik ragam menunjukkan efek perlakuan tidak signifikan mempengaruhi kecernaan bahan organik. Pada penelitian ini nilai KCBO yang dihasilkan berbanding lurus dengan nilai KCBK (Tabel 3). Nilai KCBK akan sesuai nilai KCBO karena sebagian bahan kering dalam ransum terdiri dari bahan organik (Sutardi, 1980). Seperti halnya kecernaan bahan kering, kecernaan bahan organik (KCBO) juga dapat dijadikan tolok ukur dalam menilai kualitas ransum. Nilai kecernaan bahan organik suatu pakan dapat menentukan kualitas pakan (Sutardi,
39
1980). Rahmawati (2001) menambahkan bahwa bahan organik menghasilkan energi untuk pertumbuhan dan perkembangan ternak.
Nilai kecernaan pada penelitian ini sama dengan penelitian Hess et al. (2003) yang menyatakan bahwa kecernaan bahan organik ransum yang disuplementasi ekstrak Sapindus saponaria sebanyak 100 mg/g BK (kandungan saponin 120 mg/g BK) ke dalam ransum menunjukkan hasil yang tidak berbeda dengan kontrol. Hal yang sama juga ditunjukkan pada penelitian Thalib (2004), menyatakan bahwa suplementasi ekstrak metanol lerak dalam bentuk serbuk (80 mg/ 100 ml dengan kadar saponin 15%) pada ransum domba menunjukkan nilai kecernaan yang tidak berbeda dengan kontrol.
Produksi Gas Total
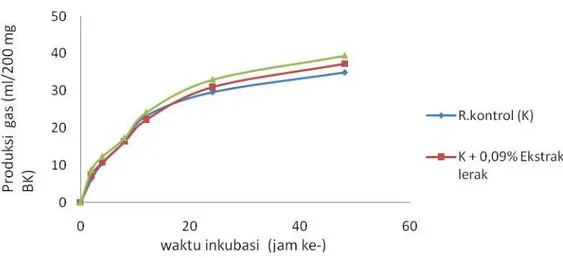
Hasil sidik ragam menunjukkan suplementasi ekstrak lerak kedalam ransum tidak nyata mempengaruhi produksi gas pada inkubasi 0-48 jam. Hal tesebut menandakan bahwa suplemenatsi ekstrak lerak dengan taraf 0,09% dan 0,18% dalam ransum kontrol belum mempengaruhi produksi gas total (Tabel 5).
Laju produksi gas menggambarkan peningkatan produksi gas terjadi pada waktu inkubasi 0–48 jam (Gambar 5). Pada jam inkubasi ke 24–48 suplementasi ekstrak lerak dapat meningkatkan produksi gas dibanding ransum kontrol. Hal tersebut menunjukkan bahwa suplementasi ekstrak lerak dapat meningkatkan laju fermentasi, terlihat dari peningkatan konsentrasi VFA sebesar 10% dan 20% pada ransum kontrol yang disuplementasi ekstrak lerak dengan taraf 0,09% dan 0,18%.
Produksi gas yang dihasilkan menunjukkan terjadinya proses fermentasi pakan oleh mikroba di dalam rumen. Gas-gas ini dihasilkan dari suatu proses fermentasi dan degradasi yang terjadi di dalam rumen dan merupakan gambaran banyaknya bahan organik yang dapat dicerna di dalam rumen (Firsoni, 2005). Gas yang terentuk dari proses fermentasi terdiri dari 56% CO2, 32% metan (CH4), 8,2% N2 dan 3,5%O2 (Arora, 1989).
40
Gambar 5. Grafik Pengaruh Ekstrak Lerak pada Produksi Gas
Suplementasi bahan yang mengandung saponin ke dalam pakan dapat menurunkan produksi CH4, hal tersebut disebabkan karena saponin dapat menurunkan populasi protozoa sehingga dapat menurukan aktivitas metanogen. Penurunan produksi gas CH4 pada bahan pakan yang disuplementasi saponin telah dibuktikan oleh Thalib (2004), bahwa ekstrak metanol lerak dapat digunakan sebagai inhibitor metanogenesis dan dapat menurunkan produksi gas CH4.
Tabel 5. Produksi Gas Total selama Inkubasi 0-48 Jam Waktu inkubasi
(jam ke -)
Produksi gas total (ml /200 mg BK) Ransum Kontrol (K) ekstrak lerak K + 0,09% K + 0,18% ekstrak lerak 0 0 0 0 2 6,36±4,62 7,37±1,79 8,82±2,91 4 10,62±5,80 10,81±2,94 12,37±2,34 8 16,43±5,09 16,30±4,31 17,32±3,29 12 23,29±8,81 22,24±3,90 24,25±4,35 24 29,59±10,03 30,92±4,59 33,02±4,85 48 34,90±11,24 37,17±5,57 39,46±4,26 Metan (CH4) merupakan gas yang dibentuk dari reaksi antara H2 dan CO2, sehingga penurunan produksi CH4 dapat meningkatkan proporsi gas H2 yang dapat digunakan untuk pembentukan propionat. Wina et al. (2005b) menyatakan bahwa H2 tersedia untuk pembentukan CH4 kemungkinan bersaing dengan kebutuhan H2 untuk pembentukan propionat, sehingga jika konsentrasi propionat dalam rumen meningkat