21 LAMPIRAN
Lampiran 1. Pembuatan reagen-reagen untuk tahapan ekstraksi DNA a. Reagen FeCl3 200 mM
Bahan-bahan yang dibutuhkan : FeCl3 2,7 g
Akuades 5 ml Cara pembuatan :
FeCl3 dilarutkan ke dalam akuades yang telah disterilisasi menggunakan
autoklaf selama 15 menit.
b. Reagen SDS 20%
Bahan-bahan yang dibutuhkan : SDS 10 g
Akuades 50 ml Cara pembuatan :
SDS dilarutkan ke dalam akuades yang telah disterilisasi menggunakan autoklaf selama 15 menit.
c. Reagen NaCl 2 M
Bahan-bahan yang dibutuhkan : NaCl 11,7 g Akuades 10 ml Cara pembuatan :
NaCl dilarutkan ke dalam akuades yang telah disterilisasi menggunakan autoklaf selama 15 menit.
d. Reagen TE 1X (Tris 10 mM, EDTA 1 mM)
Bahan-bahan yang dibutuhkan : Tris-HCl 1,576 g EDTA 0,2922 g Akuades 1 l Cara pembuatan :
Tris-HCl dilarutkan kedalam 800 ml akuades kemudian dihomogenkan dan diatur pH sampai 8. EDTA ditambahkan ke dalam larutan. Akuades ditambahkan
22
hingga volume larutan 1 l. Larutan TE 1X disterilisasi menggunakan autoklaf 15 menit.
e. Reagen kloroform : isoamil alkohol (24:1)
Bahan-bahan yang dibutuhkan : Kloroform 24 ml Isoamil alkohol 1 ml Cara pembuatan :
Kloroform 24 ml dicampurkan dengan isoamil alkohol 1 ml kemudian dihomogenkan dengan cara dikocok.
23 Lampiran 2. Elektroforesis gel agarosa a. Pembuatan TAE 50X
Bahan-bahan yang dibutuhkan : Tris base 242 g Asam asetat glasial 57,1 ml EDTA 0,5 M (pH 8) 100 ml Akuades sampai 1 l Cara pembuatan :
Semua bahan dicampurkan dan dihomogenkan dengan hotplate dan stirrer. TAE 50X yang sudah homogen disterilisasi dengan autoklaf selama 15 menit.
b. Pembuatan gel agarosa 1,5%
Bahan-bahan yang dibutuhkan : Agarosa 6 g TAE 1X 40 ml DNA Fluorosafe 4 µl Cara pembuatan :
Agarosa dimasukkan ke dalam TAE 1X lalu dihomogenkan menggunakan
hotplate dan stirrer. Campuran yang telah homogen dibiarkan hingga hangat kemudian ditambahkan DNA fluorosafe. Gel dituangkan ke dalam cetakan yang telah dipasang selotip pada kedua ujungnya dan diberi sisir pembuat sumuran. Selotip dan sisir pembuat sumuran dilepas setelah gel memadat dan gel siap digunakan.
c. Persiapan running elektroforesis
Cara kerja :
Tangki elektroforesis diisi dengan TAE 1X. Gel agarosa yang telah memadat dimasukkan ke dalam tangki elektroforesis. Pastikan gel agarosa dalam posisi terendam TAE 1X. Sampel dicampurkan dengan loading dye 6X dengan perbandingan antara sampel dan loading dye 5:1. Satu per satu sampel dimasukkan ke dalam sumuran. Tutup pengaman tangki elektroforesis dipasang kemudian disambungkan kabel listrik antara tangki dengan adapter. Pastikan pemasangan kabel positif dan negatif tidak terbalik. Adapter dinyalakan kemudian atur voltase pada 100 V, kuat arus 400 mA dan waktu 50 menit. Tombol run
ditekan untuk memulai running.
24
Lampiran 3. Pembuatan reagen denaturing gradient gel electrophoresis a. Larutan 40% acrylamide/bis (37.5:1)
Bahan-bahan yang dibutuhkan :
Acrylamide 38.93 g Bis-acrylamide 1.07 g
Akuades sampai 100 ml Cara pembuatan :
Semua bahan dicampurkan dalam botol gelap dan dihomogenkan dengan cara dikocok. Larutan disimpan pada suhu 4oC.
b. Larutan 0% denaturan gel acrylamide/bis 8%
Bahan-bahan yang dibutuhkan :
40% Acrylamide/Bis 20 ml 50x TAE buffer 2 ml dH2O 78 ml Cara pembuatan :
Semua bahan dicampurkan dalam botol gelap dan dihomogenkan dengan cara dikocok. Larutan disimpan pada suhu 4oC.
c. Larutan 100% denaturan gel acrylamide/bis 8%
Bahan-bahan yang dibutuhkan :
40% Acrylamide/Bis 20 ml 50x TAE buffer 2 ml Formamide (deionized) 40 ml Urea 42 g Akuades sampai 100 ml Cara pembuatan :
Semua bahan dicampurkan dalam botol gelap dan dihomogenkan dengan cara dikocok. Larutan disimpan pada suhu 4oC.
d. Ammonium persulfate 10%
Bahan-bahan yang dibutuhkan :
Ammonium persulfate 0.1 g Akuades 1.0 ml
25
Cara pembuatan :
Semua bahan dicampurkan dalam tabung microcentrifuge 1,5 ml dan dihomogenkan dengan cara tabung dibolak-balik 20 kali.
e. Pembuatan gel akrilamid/bis dengan konsentrasi denaturan 25% dan 60%
Denaturing Solution 25% 60%
100% 5 ml 12 ml
0% 15 ml 8 ml
Volume total 20 ml 20 ml
26
Lampiran 4. Pre-heating running buffer TAE 1X Cara kerja :
a. Tangki elektroforesis diisi dengan 7 l buffer TAE 1X.
b. Temperature control module diletakkan di atas tangki elektroforesis. Arus listrik disambungkan ke temperature control module dan nyalakan alat, pemanas dan pompa (gambar 7.1).
Gambar 7.1. Proses pre-heating buffer TAE 1X
c. Pengaturan suhu diatur menjadi 60oC dan ditunggu hingga buffer mencapai suhu yang diinginkan.
Temperature control module Tangki elektroforesis Power Pompa Pemanas
bio.unsoed.ac.id
27
Lampiran 5. Perakitan alat cetakan parallel gradient gel Cara kerja :
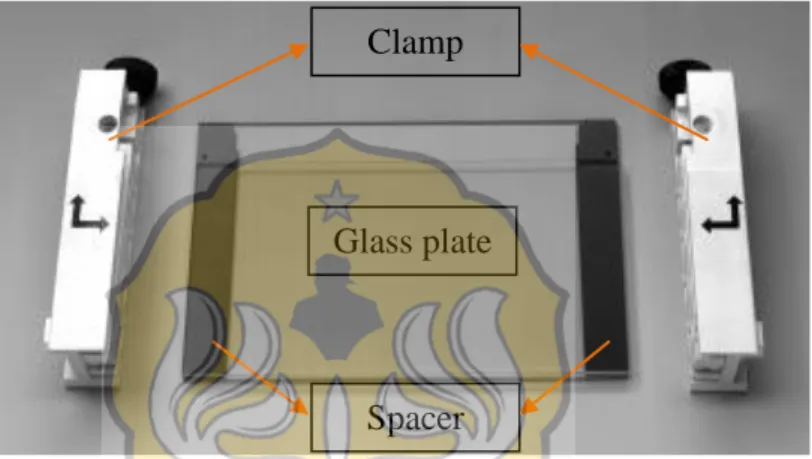
a. Clamp, glass plate dan spacer dipersiapkan ditempat yang rata dan bersih. Pastikan glass plate yang lebih panjang berada di bawah dan kedua glass plate dipisahkan oleh spacer membentuk sandwich (gambar 7.2).
Gambar 7.2. Posisi clamp, glass plate dan spacer yang akan dirakit
b. Clamp dipasangkan pada kedua ujung sandwich (gambar 7.3). Clamp
dikencangkan dengan cara memutar screw yang ada di atas clamp.
Gambar 7.3. Proses pemasangan clamp pada sandwich
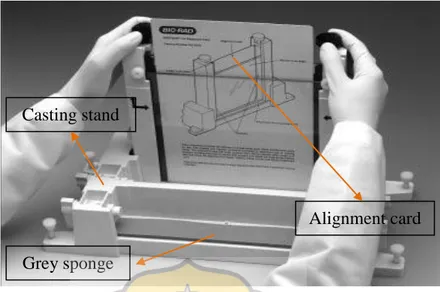
c. Sandwich diletakkan pada salah satu alignment slot dari casting stand. Pastikan aligment slot telah diberi grey sponge. Clamp dikendorkan dan
alignment card dimasukkan ke dalam cetakan gel untuk mengatur spacer
berada ditempat yang tepat (gambar 7.4). Clamp dikencangkan kembali. Clamp
Glass plate
Spacer
Screw
28
Gambar 7.4. Pengaturan posisi spacer pada sandwich dengan alignment card
d. Alignment card dikeluarkan dari cetakan gel. Cetakan gel diisi dengan akuades steril untuk memastikan cetakan tidak bocor. Apabila cetakan masih bocor maka penyusunan cetakan gel diulangi dari awal kembali.
e. Cetakan yang sudah baik dilepaskan dari casting stand untuk mengeluarkan akuades steril kemudian dipasang kembali pada casting stand.
Alignment card Casting stand
Grey sponge
29
Lampiran 6. Mencetak parallel denaturing gradient gel Cara kerja :
a. Gradient delivery system dirakit (gambar 7.5).
Gambar 7.5. Gradient delivery system yang telah dirakit
b. Low density solution (gel 25% denaturan) dan high density solution (gel 60% denaturan) disiapkan dalam tabung disposable 50 ml. DCode Dye solution
100 µL ditambahkan pada high density gel. Ammonium persulfat 40 µL dan TEMED 40 µL ditambahkan ke dalam Low density gel dan high density gel
kemudian dihomogenkan dengan cara dikocok.
c. Low density solution dan high density solution dimasukkan ke masing-masing
syringe. Pastikan tidak ada gelembung udara yang terperangkap. Syringe
ditekan hingga gel solution mencapai ujung long tygon tubing.
d. Masing-masing syringe dipasang kembali pada gradient delivery system.
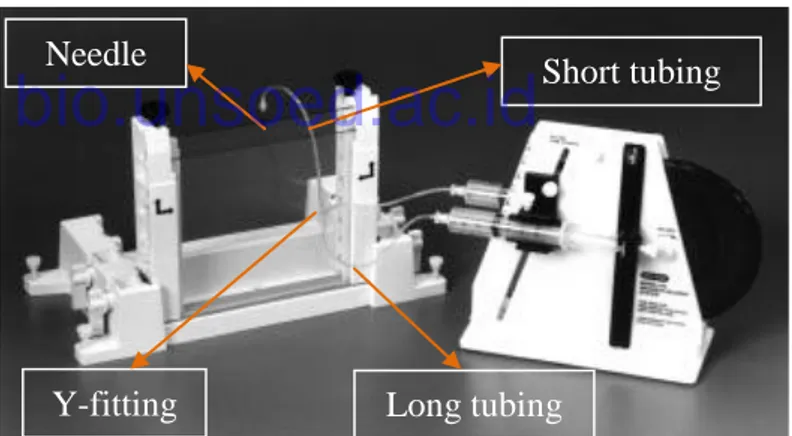
Long tygon tubing kedua syringe dipasang pada Y-fitting short tygon tubing. Ujung needle diletakkan di atas bagian tengah cetakan gel (gambar 7.6).
Gambar 7.6. Proses penuangan gel ke dalam cetakan
Short tubing Needle
Long tubing Y-fitting
30
e. Cam diputar perlahan untuk memintahkan gel ke dalam cetakan. Setelah gel berada pada cetakan, sisir pembuta sumuran dipasang di atas cetakan (gambar 7.7).
Gambar 7.7. Pemasangan sisir pada gel yang telah dituang
f. Gel dibiarkan memadat sekitar 60 menit. Setelah gel memadat, sisir dilepas dari cetakan dan gel beserta cetakannya dilepas dari casting stand. Gel siap dielektroforesis.
Sisir
31
Lampiran 7. Denaturing gradient gel electrophoresis Cara kerja :
a. Sandwich berisi gel dan core diletakkan pada permukaan yang datar dan bersih.
b. Sandwich berisi gel dipasang pada core (gambar 7.8).
Gambar 7.8. Pemasangan sandwich pada core
c. Temperature control module dimatikan ketika buffer mencapai suhu 60oC.
Temperature control module dipindahkan pada DCode lid. Core berisi
sandwich diletakkan pada tangki elektroforesis dengan posisi bulatan merah berada pada sisi kanan dan bulatan hitam pada sisi kiri.
d. Sumuran dibersihkan dengan buffer untuk menghilangkan sisa gel yang tidak terpolimerisasi. Sampel dimasukkan ke dalam sumuran menggunakan mikropipet secara hati-hati.
e. Temperature control module dipasang kembali pada tangki elektroforesis kemudian power, heater dan pompa dinyalakan (gambar 7.9).
Gambar 7.9. Posisi core yang telah dimasukkan pada tangki DGGE
Core
32
f. Kabel disambungkan pada adapter kemudian power dinyalakan. Voltase diatur pada 130 V kemudian tekan tombol run untuk memulai elektroforesis.
33
Lampiran 8. Pewarnaan gel dengan etidium bromida Cara kerja :
a. Sumber arus listrik dimatikan setelah elektroforesis selesai dilakukan.
Temperature control module diletakkan pada DCode Lid Stand (gambar 7.10).
Gambar 7.10. Posisi temperature control module pada DCode lid stand
b. Core berisi sandwich diambil dan diletakkan pada permukaan yang rata.
Sandwich dilepaskan dari core (gambar 7.11).
Gambar 7.11. Proses pelepasan sandwich dari core
c. Kedua clamp dilepaskan dari glass plate. Glass plate yang pendek dilepas secara perlahan-lahan. Kedua spacer dilepaskan dan gel dimasukkan ke dalam baki yang berisi 250 ml buffer TAE 1X dan 25 µL EtBr 10 mg/ml. Gel diwarnai selama 15 menit.
34
d. Gel yang telah diwarnai diambil dan dimasukkan ke dalam baki berisi 250 ml TAE 1X selama 20 menit untuk proses destaining.
e. Gel diambil kemudian diletakkan pada UV transilluminator untuk didokumentasikan.
35 Lampiran 9. Spesifikasi peralatan dan bahan
SPESIFIKASI PERALATAN DAN BAHAN No
. Nama Alat Merek/Tipe Kegunaan Tempat
1. Gelas ukur Iwaki PYREX Mengambil dan menakar larutan dengan volume tertentu
Lab.
Mikrobiologi
2. Labu Erlenmayer Iwaki PYREX Menyimpan dan menghomogenkan reagen Lab. Mikrobiologi 3 Botol - Menyimpan sampel sedimen mangrove dan menyimpan reagen Lab. Mikrobiologi 4. pHindicator strips
Merck Mengukur pH Lab.
Mikrobiologi 5. Timbangan
Analitik
OHAUSS Menimbang bahan dengan berat maksimal 0,1 g – 200 g
Lab.
Mikrobiologi
6 Cool box Harvest Menyimpan
sampel pada saat pengambilan di lapangan
Lab.
Mikrobiologi
7. Hot Plate Stuart Memanaskan
larutan
Lab.
Mikrobiologi
8. Magnetic Stirer Stuart Menghomogenkan
larutan
Lab.
Mikrobiologi 9 Sarung tangan
karet
Safeguard Melindungi tangan pada saat bekerja dan mencegah kontaminasi
Lab.
Mikrobiologi
10. Autoklaf Hirayama Mensterilisasi dengan uap panas bertekanan
Lab.
Mikrobiologi 11 Masker IBS Melindungi diri
dari bahan-bahan kimia berbahaya dan mencegah kontaminasi Lab. Mikrobiologi 12 Tabung mikrosentrifuge 1,5 ml
Biologix Meletakkan sampel pada saat diisolasi DNA
Lab.
Mikrobiologi 13 Tabung reaksi Iwaki PYREX Tempat preparasi
sampel pada saat akan mengisolasi DNA
Lab.
Mikrobiologi
14. Water bath Heidolph Membantu Lab.
36
melisiskan sel Mikrobiologi
15. Alumunium foil Klim pak Sebagai penutup
erlenmayer , reagen dan botol sampel
Lab.
Mikrobiologi
16 Tabung
disposable 50 ml
Falcon Menampung dan meracik reagen DGGE
Lab. Biosains
17 Mikropipet 100-1000 µL
Eppendorf Mengambil larutan dengan volume 100-1000 µL Lab. Biologi Molekuler 18 Mikropipet 20-200 µL
Eppendorf Mengambil larutan dengan volume 20-200 µL Lab. Biologi Molekuler 19 Mikropipet 0,5-10 µL
Eppendorf Mengambil larutan dengan volume 0,5-10 µL
Lab. Biologi Molekuler 20 Tip biru Biologix Mengambil larutan
dengan volume 100-1000 µL
Lab. Biologi Molekuler 21 Tip kuning Biologix Mengambil larutan
dengan volume 20-200 µL
Lab. Biologi Molekuler 22 Tip putih Biologix Mengambil larutan
dengan volume 0,5-10 µL Lab. Biologi Molekuler 23 Alat elektroforesis CBS Scientific EPS 300X Memisahkan DNA berdasarkan ukuran dan bentuk Lab. Biologi Molekuler 24 UV transilluminator MultiDoc-It 120 Imaging System Visualisasi hasil elektroforesis Lab. Biologi Molekuler 25 Nano spektrofotometri Implen Mengukur kuantitas dan kemurnian DNA Lab. Terpadu 26 Tabung PCR 0,2 ml
Biologix Meletakkan sampel yang akan
diamplifikasi
Lab. Biologi Molekuler 27 Alat PCR Thermal Cycler
Techne (TC-5000) Mengamplifikasi fragmen DNA target Lab. Terpadu
28 Alat DGGE Biorad Memisahkan DNA berdasarkan urutan basanya
Lab. Biosains
29 Vorteks IKA MS3 Digital Menghomogenkan larutan dan proses
beadbeating
Lab. Biologi Molekuler 30 Kertas Parafilm M-Parafilm Mencampurkan
sampel DNA dengan loading dye
Lab.
Mikrobiologi
37
No. Nama Bahan Spesifikasi Kegunaan
1. Sedimen Mangrove - Sebagai sampel untuk penelitian
2 Buffer Tris-HCl Powder Sebagai buffer
3 Asam asetat glasial Cair Sebagai sumber elektrolit 4 EDTA Powder Sebagai anti DNAse
5 FeCl3 Powder Sebagai pengikat asam humat
6 SDS Powder Merusak dinding dan membran sel bakteri 7 Kloroform Cair Menghilangkan protein 8 Isoamyl alcohol Cair Menghilangkan protein 9 Akuades Cair Sebagai pelarut reagen 10 Alkohol absolut Cair Mengendapkan DNA 11 Alkohol 70% Cair Mencuci DNA dari lemak 12 NaCl Powder Mengendapkan DNA 13 Agarosa Powder Membuat gel untuk
elektroforesis agarosa 14 DNA fluorosafe Cair Mewarnai DNA 15 EtBr Cair Mewarnai DNA
16 Primer 27F Cair Mengamplifikasi fragmen DNA target
17 Primer 1540R Cair Mengamplifikasi fragmen DNA target
18 Primer 968F-GC Cair Mengamplifikasi fragmen DNA target
19 Primer 1406R Cair Mengamplifikasi fragmen DNA target
20 Akuabides Cair Mengencerkan DNA 21 Kappa PCR master mix Cair Mengamplifikasi fragmen
DNA target
22 Akrilamid Powder Membuat gel akrilamid untuk DGGE
23 Bis-akrilamid Powder Membuat gel akrilamid untuk DGGE
24 UREA Powder Sebagai denaturan DNA 25 Formamide Cair Sebagai denaturan DNA 26 TEMED Cair Memadatkan gel akrilamid 27 Ammonium persulfat Powder Memadatkan gel akrilamid 28 Biorad Dye solution Cair Membuat gradasi warna pada
gel akrilamid
29 Loading dye Cair Sebagai pemberat DNA 30 Marka DNA 100 bp Cair Sebagai penentu ukuran
DNA