MODUL IV : SPEKTROSKOPI MASSA
1. Pengantar
Spektroskopi massa, tidak seperti metoda spektroskopi yang lain, tidak melibatkan interaksi antara cahaya dan materi. Spektrometer massa : adalah alat atau instrumen yang digunakan untuk menentukan struktur kimia dari molekul organik berdasarkan perhitungan massa molekul tersebut (BM) serta pola fragmentasinya. Spektrometri massa (MS) adalah suatu teknik analisis yang mengukur rasio massa terhadap muatan dari partikel-partikel bermuatan. MS bekerja dengan mengionkan senyawa untuk menghasilkan molekul bermuatan atau fragment-fragment molekul dan terukur rasio massa terhadap muatannya.
2. Tujuan Instruksional Umum
Setelah menyelesaikan mata kuliah ini mahasiswa akan mampu mengelusidasi struktur molekul suatu senyawa dengan cara menginterpretasi spektra uv-vis, infra merah, Resonansi Magnet Inti dan spektroskopi massa.
3. Tujuan Instruksional Khusus
Setelah mengikuti mata kuliah ini mahasiswa dapat menjelaskan tentang spektroskopi MS dan menginterpretasi spektra MS.
4. Kegiatan Belajar
4.1. Kegiatan Belajar 1 : INSTRUMENTASI Uraian
Prosedur dalam MS adalah :
1. Sampel dimasukkan dalam instrument MS dan diuapkan
2. Komponen sampel dionisasi salah satu dari beberapa metode (antara lain dengan ditembak dengan aliran elektron), sehingga menyebabkan pembentukan partikel bermuatan (ion-ion).
3. Ion-ion tersebut dipisahkan sesuai dengan rasio massa terhadap muatannya dalam suatu analizer oleh medan elektromagnetik
4. Ion-ion tersebut dideteksi, biasanya secara metode kuantitatif 5. Signal ion selanjutnya diproses menjadi spectra massa
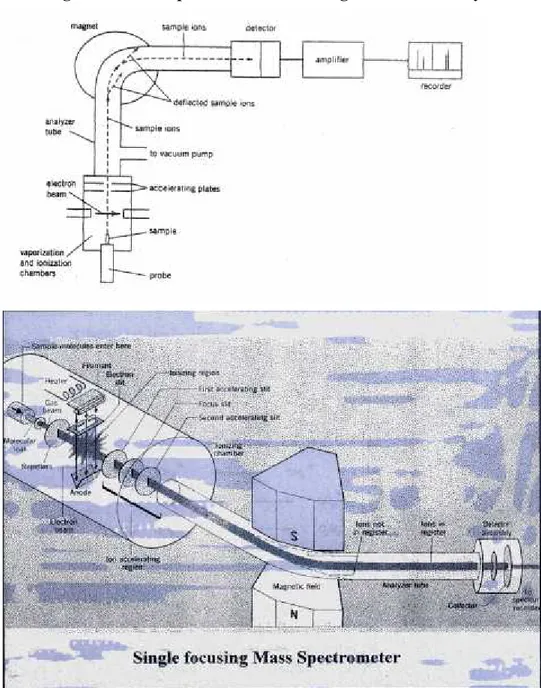
Diagram of mass spektrometer with magnetic sector analyzer.
Bagian yang khas dari spektrometer massa terdiri dari :
* Ruang penguapan, dimana sampel diuapkan di bawah vakum * Ruang ionisasi, dimana komponen sampel dionisasi
* Analiser, tempat dimana fragmen dipisahkan sesuai dengan rasio massa terhadap muatannya
* Detektor, tempat pengumpul (kolektor) fragmen-fragmen bermuatan
* Amplifier, yang menguatkan arus listrik yang dihasilkan oleh fragmen-fragmen * Rekorder, menyajikan data.
Perbedaan dari beberapa tipe spektrometer massa yang ada terutama terletak pada bagaimana sampel diuapkan, diionisasi dan dipisahkan.
Salah satu tipe spektrometer massa yang biasanya digunakan adalah spektrometer massa sektor magnetik, dimana menggunakan medan magnet untuk memisahkan ion-ion fragmen (Gambar diatas).
Cara kerja alat :
Sampel diuapkan di bawah vakum dan diionkan dengan menggunakan berkas elektron.
Ion sampel dipercepat menggunakan medan listrik memasuki tabung penganalisis (analiser).
selanjutnya mereka dilalukan/dilewatkan dalam suatu medan magnet yang akan merubah jalan/lintasan dari ion-ion tersebut. Dalam kekuatan medan magnet yang diberikan, hanya ion-ion dengan rasio massa/muatan (m/z) tertentu akan difokuskan ke detektor, sedang ion-ion yang lain akan dibelokkan ke dinding tabung. Dengan memvariasi kekuatan medan magnet yang digunakan, maka ion dengan m/z lebih besar akan mencapai detektor lebih dulu diikuti m/z yang lebih kecil. Dalam analisator magnetik ini, ion fragmen yang terlalu berat tidak akan terbelokkan sedangkan yang terlalu ringan akan sangat mudah terbelokkan ke arah yang tidak semestinya sehingga mereka tidak sampai detektor maka tidak dapat diketahui informasi massanya.
Ion fragmen yang dapat dibelokkan dengan tepat akan masuk ke kolektor sesuai dengan kelimpahannya.
Arus listrik yang diterima detektor akan diperkuat dan spektum massa dari sampel akan direkam.
4.2. Kegiatan Belajar 2 : TEORI SPEKTROSKOPI MASSA Uraian
Prinsip Dasar
Dalam spektrometer massa, molekul sampel dalam fase uap dibombardir dengan elektron berenergi tinggi (70 eV) menyebabkan lepasnya satu elektron kulit valensi suatu arom dari molekul tersebut. Molekul yang kehilangan satu elektron akan menjadi suatu kation radikal [: kation karena mempunyai muatan positif (+), radikal karena jumlah elektronnya ganjil (•)]. Kation radikal tersebut mengandung semua atom-atom (atau merupakan isotop atom yang paling melimpah) dari molekul asal dimana berkurang satu elektron, disebut ion molekul (molecular ion), dan dinyatakan dengan (M+•).
Proses lepasnya elektron dari molekul menghasilkan ion molekul dapat digambarkan sebagai berikut :
M + e– M+• + 2 e–
molekul Ion molekul (kation radikal) Misal : CH3CH2CCH3 O e CH3CH2CCH3 O 2 e
Sebagai hasil dari tabrakan dengan elektron berenergi tinggi, ion molekul akan mempunyai energi yang tinggi sehingga ikatan dalam kation radikal tersebut dapat putus menjadi fragmen yang lebih kecil berupa kation, radikal, atau molekul netral (fragmentasi).
M+• m1+ + m2• atau M+• m1+• + m2
kation radikal kation radikal molekul netral Terjadinya fragmentasi merupakan usaha untuk stabilisasi akibat adanya pemberian energi yang berlebih.
Ion molekul, ion fragmen, dan ion radikal fragmen yang dihasilkan dalam proses fragmentasi ini dipisahkan dengan menggunakan medan magnet yang dapat divariasi sesuai dengan perbandingan massa/muatannya (m/z), dan menghasilkan arus listrik (arus ion) pada kolektor/detektor yang sebanding dengan kelimpahan relatifnya. Fragmen dengan harga m/z yang besar akan turun terlebih dahulu diikuti fragmen dengan harga m/z yang lebih kecil. Partikel netral (yang tidak bermuatan atau radikal) yang dihasilkan dalam fragmentasi tidak dapat dideteksi secara langsung dalam spektrometer massa.
M
ABC
fragmentasi
AB
C
fragmentasi
A
B
ion molekul
ABC
molekul
- e
-1kation
radikal
kation
netral
Spektrometer massa hanya mendeteksi kation radikal (ABC+•), dan kation (AB+dan B+). Kebanyakan kation yang dihasilkan dalam spektrometer massa mempunyai muatan = 1 (z = 1), sehingga harga m/z secara langsung menunjukkan massa dari fragmen kation radikal atau kation tersebut.
Spektrum Massa
Spektrum massa adalah suatu plot antara intensitas sinyal (sesuai dengan kelimpahan relatif fragmen) sebagai sumbu y vs massa ion fragmen (m/z) sebagai sumbu x. Kelimpahan dari fragmen tergantung pada kesetimbangan antara kecepatan pembentukan dan kecepatan dekomposisinya. Fragmen yang melimpah terbentuk dengan mudah dan mempunyai tendensi yang rendah untuk terfragmentasi lebih lanjut, atau dengan kata lain, relatif stabil. Fragmen yang paling melimpah dinyatakan mempunyai kelimpahan relatif (relative abundance = RA) 100 % dan disebut dengan puncak dasar (base peak). Kelimpahan fragmen-fragmen yang lain dinyatakan relatif terhadap base peak (%). Dikarenakan semua fragmen yang ada diturunkan dari ion molekul, maka puncak kation radikal yang tidak terfragmentasi disebut puncak induk (parent peak) atau molecular ion (M+•).
Spektrum massa butanon
Parent peak pada m/z = 72 (M+• = ion molekul)
Base peak pada m/z = 43 (kelimpahan 100 % tetapi bukan m/z tertinggi)
A = Relative abundance = kelimpahan relatif
m/z = massa/muatan4.3. Kegiatan Belajar 3 : PRODUKSI DAN ANALISIS ION Uraian
Berdasarkan pola ionisasinya, jenis spektrometer massa antara lain : 1. EI-MS : Electron Impact-Mass Spektrometer.
Pola ionisasi sampel dengan berkas elektron berenergi tinggi (electron bombardment).
Karena energinya tinggi, maka fragmentasi banyak dan kelimpahan ion molekul (M+•) relatif kecil dimana intensitas
puncak ion molekul kecil, bahkan sering tidak nampak, sehingga menyulitkan interpretasi spektra.
M e-1 M 2 e-1
molekul
(elektron genap) kation radikal anion radikal (elektron gasal) (elektron gasal) M e-1 M molekul (elektron genap) (1000 x lebih mungkin) (1 x kemungkinan)
2. CI-MS : Chemical Ionization-Mass Spektrometer.
Pola ionisasinya menggunakan gas (misal : metan, isobutan atau ammonia) yang diionkan. Energi ionisasinya lebih kecil dibandingkan EI-MS, sehingga fragmentasinya lebih kecil dan kelimpahan relatif ion molekul (M+•) tinggi.
Dalam spektra CI, informasi mengenai BM molekul sampel diperoleh dari protonasi molekul sampel, dan harga m/z yang diperoleh adalah satu unit lebih besar dibanding BM yang sesungguhnya.
Gas diionkan menghasilkan ion primer yang bereaksi dengan gas menghasilkan ion sekunder, selanjutnya ion sekunder bereaksi dengan uap sampel (M).
CH
4e
-1CH
42 e
-1CH
4H
CH
4CH
4CH
5+CH
3+CH
3CH
3+CH
4C
2H
5+H
2CH
5+C
2H
5+M
M
[M + H]
+C
2H
4[M + H]
+CH
4m/z lebih besar 1 unit
3. FAB-MS : Fast Atom Bombardment-Mass Spektrometer.
Pola ionisasinya menggunakan fast atoms, berkas atom misalnya He, Ne, atau Ar yang berenergi tinggi.
Biasanya sampel dilarutkan dulu dalam suatu low-volatility
matrix, misalnya gliserol.
4. FD-MS : Field Desorption-Mass Spektrometer.
5. FI-MS : Field Ionization-Mass spektrometer. 6. PD-MS : Plasma Desorption-Mass Spektrometer. 7. LD-MS : Laser Desorption-Mass Spektrometer. 8. ESI-MS : Electrospray Ionization-Mass Spektrometer. 9. MALDI : (Matrix Assisted Laser Desorption/Ionization)
4.4. Kegiatan Belajar 4 : SPEKTROSKOPI MASSA RESOLUSI TINGGI Uraian
Sejauh ini kita menggunakan massa atom : untuk atom H = 1, atom N = 14, atom O = 16 dan seterusnya. Dengan tingkat perkiraan tersebut, molekul dengan rumus 12C
21H4 dan 12C16O mempunyai massa yang sama yaitu 28 massa unit, tetapi
sebenarnya kedua molekul tersebut mempunyai massa yang sedikit berbeda, yaitu :
Suatu spektrometer massa yang dapat membedakan sampai empat tempat desimal disebut high-resolution mass spectrometer. Dengan instrument ini, rumus molekul dari suatu senyawa akan ditentukan dengan tegas.
Misalnya suatu ion molekul terukur pada m/z = 70,0535 ± 0,0005, ada 5 kemungkinan rumus molekul dengan C, H, O, dan N dengan massa 70, meskipun demikian hanya ada satu yang sesuai, yaitu : C3H6N2
Rumus Molekular Massa
C2H2N2O 70,0167
C3H2O2 70,0055
C
3H
6N
270,0531
C4H6O 70,0419
C5H10 70,0783
4.5. Kegiatan Belajar 5 : ATURAN NITROGEN Uraian
Senyawa yang mengandung nitrogen dengan jumlah atom nitrogen gasal akan mempunyai BM gasal, dan apabila jumlah atom nitrogennya genap atau tidak mempunyai nitrogen, maka senyawa tersebut akan mempunyai BM genap.
4.6. Kegiatan Belajar 6 : KELIMPAHAN ISOTOP Uraian
Tahap pertama dalam interpretasi spektrum massa adalah mengidentifikasi puncak ion molekuler (M+•) dalam spektrum massa, sehingga bobot molekul senyawa dapat ditentukan. Ion molekuler (M+•) mengandung semua atom-atom yang menyusun molekul, dengan memperhatikan kelimpahan relative isotop-isotopnya (terdiri dari isotop atom-isotop atom yang paling melimpah).
Ingat : ini adalah bobot molekul untuk sebuah molekul yang mengandung isotop-isotop tunggal dan bukanlah suatu bobot molekul rata-rata).
Suatu spektrometer massa mendeteksi partikel yang mengandung masing-masing isotop selaku spesi individu, maka tidak dapat digunakan massa isotop rata-rata dalam menafsirkan spektrum massa, tidak seperti bila menghitung stoikiometri reaksi kimia.
Massa dan kelimpahan beberapa isotop di alam adalah penting dalam spektrometri massa.
Atom Cl yang terdapat di alam merupakan campuran 75,77 % 35Cl dan 24,23%37Cl.
Dalam stoikiometri berat atom Cl = 35,5 = 0,76 x 35 + 0,24 x 37.
Dalam spektrum massa dihitung sebagai massa isotop tunggal. Molekul yang mengandung isotop bermassa rendah (35Cl) dianggap sebagai ion molekulnya (M+•)
dan molekul yang mengandung isotop yang lainnya (37Cl) disebut puncak M+2 (ion molekul + 2 satuan massa), dengan intensitas relative dari dua puncak adalah 76 : 24 atau sekitar 3 : 1.
Maka massa suatu fragmen atau ion molekul akan muncul tidak hanya berupa satu puncak saja tetapi terdapat kumpulan puncak-puncak lain karena adanya perbedaan massa isotop-isotop atom C, H, N, O dan atom lain yang ada dalam molekul tersebut. Contoh : suatu molekul metana (CH4), akan terdapat beberapa kombinasi isotop,
sehingga mempunyai ring massa dari 16 - 21 :
Tetapi spektrometer mampu memisahkan massa-massa tersebut dan mengukur kelimpahan relatifnya.
Spektrum massa dari metana menunjukkan puncak ion molekul (M+•) pada m/z = 16, dan puncak yang lain yaitu puncak (M+1) pada m/z = 17, puncak (M+2) pada m/z = 18, puncak (M+3) pada m/z = 19, puncak (M+4) pada m/z = 20 dan puncak (M+5) pada m/z = 21. Puncak-puncak ini merupakan isotopic cluster. Secara konvensi puncak ion molekul yang menunjukkan BM molekul tersebut adalah puncak (M+•) pada m/z = 16 dengan massa paling rendah.
Dari semua puncak isotopic cluster dalam metana, yang menunjukkan kelimpahan yang bermakna adalah hanya puncak (M+•) dan (M+1), karena kelimpahan isotop 12C
= 99% sedang kelimpahan isotop13C = hanya 1% sehingga kelimpahan13CH
4(m/z =
17) hanya 1% dari kelimpahan 12CH
4 (m/z = 16). Terdapatnya 12CH3D pada m/z =
17 lebih kecil daripada 13CH
4 karena kelimpahan relatif Deuterium (D atau 2H)
hanya 0,015% dibanding 1H = 99,985%. Maka kelimpahan spesies 13CH3D (m/z =
18),12CH2D2(m/z = 18),13CH2D2(m/z = 19) dan yang lain, dimana dengan dua atau
lebih isotop-isotop yang kelimpahannya sangat rendah, DIABAIKAN.
Maka dalam spektrum massa, ion bermuatan tunggal yang mengandung atom karbon akan memberikan puncak (M+•) dan puncak pada satu massa unit lebih tinggi (M+1). Ini disebabkan adanya kelimpahan13C di alam (1,1%). Untuk ion yang mengandung
n atom karbon, kelimpahan puncak isotop ini adalah n x 1,1%. Sayangnya,
kemungkinan untuk menemukan dua atom 13C dalam satu ion adalah sangat kecil,
sehingga kelimpahan puncak M+2 sangat rendah. Pengaruh Kelimpahan isotop pada corak spektra massa : Spesies dengan satu atom C :
Spesies dengan dua atom C :
Pengaruh kelimpahan isotop-isotop atom Cl dan Br mempengaruhi corak spektrum massa.
Pola corak pada sejumlah halogen Cl dan Br :
Beynon telah menyusun daftar table yang dapat membantu pemilihan rumus molekul yang cocok terhadap pengukuran massa serta kelimpahan isotop tertentu yang memberikan kelimpahan puncak (M+1) dan (M+2). Daftar ini kemudian diperluas hingga massa 500, dapat dipergunakan bagi spektrometri massa daya pisah tinggi. Daftar terbatas pada senyawa yang mengandung C, H, O dan N.
4.7. Kegiatan Belajar 7 : ATURAN REAKSI FRAGMENTASI Uraian
Proses Ionisasi dan Fragmentasi Suatu Molekul Organik dalam Spektroskopi Massa adalah sebagai berikut :
Karena energi berlebih maka ion molekul (M+) mengalami fragmentasi dimana terjadi pemutusan ikatan. Cara pemutusan ikatan dibedakan proses:
1. Homolitik : pergeseran 1 elektron (tanda pancing, )
X
Y
X
Y
2. Heterolitik : pergeseran 2 elektron (tanda panah, )
X
Y
X
Y
3. Hemi Heterolitik : pemutusan ikatan sigma yang sudah terion ( )
X
Y
X
Y
- e
-1X Y
σ
4.8. Kegiatan Belajar 8 : KLASIFIKASI REAKSI FRAGMENTASI Uraian
Jenis-Jenis Reaksi Fragmentasi : 1. Reaksi disosiasi ikatan sigma (σ)
2. Reaksi pemutusan alfa (α) (α – cleavage) 3. Reaksi pemutusan induksi (i) (i – cleavage) 4. Reaksi dekomposisi struktur siklik
5. Reaksi penataan ulang (rearrangement) sisi radikal Beberapa istilah : M+; OE+; EE+; EE0; R
Catatan :
Reaksi 1 dan 2 diinisiasi dari tempat radikal positif (OE+) Reaksi 3 diinisiasi dari tempat bermuatan positif (EE+)
Kaidah Reaksi Fragmentasi bagi OE+
1. Pemutusan satu ikatan tunggal di OE+selalu akan menghasilkan EE+
2. Pemutusan dua ikatan tunggal di OE+hanya memberikan OE+lain
3. Pemutusan tiga ikatan tunggal sekaligus di OE+akan terbentuk fragmen-fragmen :
EE+, EE0 dan R
Kaidah Reaksi Fragmentasi bagi EE+ (Kaidah Karni – Mandelbaum)
= fragmentasi yang diinisiasi dari EE+ selalu cenderung mengarah ke pembentukan
EE+yang lain dan EE0
4.9. Kegiatan Belajar 9 : DISOSIASI IKATAN SIGMA Uraian
Jika elektron yang lepas pada ionisasi berasal dari ikatan tunggal, maka fragmentasi pada lokasi tersebut tentu akan dipilih. Ion positif (karbokation, C+) yang lebih stabil akan mempunyai limpahan yang lebih besar.
R ∙ + CR3 [R∙] + [+CR3] atau [R+] + [∙CR3]
lebih disukai
4.10. Kegiatan Belajar 10 : Reaksi Pemutusan Alfa (α) (α – cleavage) Uraian
Adalah reaksi fragmentasi yang diawali dari tempat radikal positif, dan terjadi karena adanya kecenderungan elektron gasal pada muatan radikal positif untuk kembali berpasangan. Hal ini disertai dengan pemutusan ikatan lain terhadap atom karbon alfa (α)
α
α
α
α
Jenis-jenis pemutusan alfa (α) (α – cleavage) adalah : a. α – Cleavage pada ikatan jenuh hetero atom
R
CH
2XR
R
CH
2XR
CH
2XR
* Lepasnya radikal alkyl terbesar akan lebih disukai ditunjukkan dengan kelimpahan ion yang tinggi
b. α – Cleavage pada ikatan tidak jenuh hetero atom
R CH XR R CH XR CH XR
c. α – Cleavage pada sistem alkena
R CH2 CH CH2 R CH2 CH CH2
CH2 CH CH2
* Adanya resonansi sistem kationik allilik menyebabkan stabilitas yang tinggi dari ion tersebut ditunjukkan kelimpahannya tinggi.
d. α – Cleavage pada sistem benzilik CH2 R R CH2 ... CH2 CH2 CH2 CH2 CH2 ion tropilium (C7H7)
4.11. Kegiatan Belajar 11 :PEMUTUSAN INDUKTIF (i) (i – cleavage) Uraian
Reaksi pemutusan induksi selalu diinisiasi dari tempat radikal positif (OE+), atau dapat pula dari tempat bermuatan positif (EE+). Reaksi pemutusan induksi selalu melibatkan penarikan sepasang elektron, sehingga cenderung untuk menghasilkan mekanisme migrasi muatan (charge migration). Reaksi pemutusan induksi cenderung menghasilkan fragmen ion EE+
Jenis-jenis reaksi pemutusan induksi yang diinisiasi dari OE+:
a.
OE+Ikatan JenuhR XR i R XR
b.
OE+Ikatan Tidak JenuhXR R C R i R C XR R XR C R
Jenis-jenis reaksi pemutusan induksi yang diinisiasi dari EE+: a. EE+Ikatan Jenuh (umumnya terjadi pada spektrometer CI – MS)
R
XH
2i
R
XH
2b. EE+Ikatan Tidak Jenuh
CH
2X
i
R
X
CH
2R
4.12. Kegiatan Belajar 12 : DEKOMPOSISI STRUKTUR SIKLIK Uraian
a. Cincin Jenuh
Pemutusan satu ikatan tunggal sigma (σ) dalam cincin hanya menghasilkan ion isomer. Pemutusan dua ikatan tunggal sigma (σ) diperlukan untuk menghasilkan ion fragmen. EI-MS - e-1
pemutusan
1 ikatan tunggal
(1)
pemutusan ikatan tunggal
(2)
etilen
(EE
0)
OE
OE
OE
b. Cincin Tidak Jenuh Retro Diels-Alder
Pemutusan alfa (α) Retro Diels-Alder (analisis mundur reaksi Diels-Alder) terjadi retensi muatan (muatan positif tetap). Pemutusan induksi (i) Retro Diels-Alder (analisis mundur reaksi Diels-Alder) terjadi migrasi muatan (muatan positif berpindah).
EI-MS - e-1
OE
OE
A. Retensi muatan
B. Migrasi muatan
OE
OE
(EE
0)
(EE
0)
4.13. Kegiatan Belajar 13 : PENATAULANGAN SISI RADIKAL Uraian
a. Penataan ulang Mc. Lafferty
Pemindahan satu atom Hidrogen gamma (γ) ke arah gugus fungsi yang tidak jenuh (misalnya : C=O, C=N, C≡N, dsb.), yang kemudian diikuti oleh reaksi alfa (α) sehingga terjadi pemutusan ikatan berposisi β, sehingga akan terjadi retensi muatan.
H
H
2C
H
2C
C
H
2O
H
r H
CH
2H
2C
C
H
2OH
H
CH
2CH
2OH
C
H
2C
H
OE
OE
(EE
0)
Jika diikuti oleh reaksi induksi (i) akan terjadi migrasi muatan.
OE
H
H
2C
H
2C
C
H
2O
H
r H
CH
2H
2C
C
H
2OH
H
CH
2CH
2OH
C
H
2C
H
OE
(EE
0)
b. Penataan ulang atom hidrogen (H) ke atom heteroatom pada ikatan jenuh, yang kemudian diikuti dengan pemutusan samping.
Reaksi dapat berlangsung tanpa memandang apakah atom H tersebut adalah α, β, γ, δ, dst.
Juga tidak diperlukan struktur segi enam bagi berlangsungnya penataan ulang.
c. Reaksi penggantian (displacement reaction)
4.14. Kegiatan Belajar 14 : INTREPRETASI SPEKTRA MASSA Uraian
5. Referensi
1. Williams, D.H., and I. Fleming, 1996, Spectrometrix Methods in Organic Chemistry.
2. De Hoffmann, E., Charette J., Stroobant, V., 1996, Mass Spectrometry. Principle and Applications.
3. Silverstein, R.M., Blasser G.C. and Morril T.C., 1991, Spectrometric Identification of Organic Compounds.