i
SINTESIS DAN SIMULASI ATOMIK OKSIDA AURIVILLIUS
TESIS
Karya tulis sebagai salah satu syarat Untuk memperoleh gelar Magister dari
Institut Teknologi Bandung
Oleh:
Rolan Rusli
NIM: 20504020
Program Studi Kimia
INSTITUT TEKNOLOGI BANDUNG
2007
ii ABSTRAK
SINTESIS DAN SIMULASI ATOMIK OKSIDA AURIVILLIUS
Oleh: Rolan Rusli NIM: 20504020
Studi yang banyak dilakukan pada oksida Aurivillius adalah sintesis oksida Aurivillius dengan menggunakan kation d0 pada posisi B. Saat ini dikembangkan usaha sintesis oksida Aurivillius dengan substitusi kation dn pada kation d0. Penelitian ini untuk mensubstitusi kation dn (Fe3+) pada posisi d0 (Ti4+). Oksida Aurivillius yang telah disintesis dengan menggunakan metode reaksi kimia padat adalah Sr2Bi4Ti5-xFexO18, Sr2+0,5xBi4Ti5-xFexO18, Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24. Data difraksi sinar-X serbuk dianalisis menggunakan metode Le Bail pada program Rietica. Oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 memiliki grup ruang B2cb, Z = 4, sedangkan Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 memiliki grup ruang A21am, Z = 4 dan I4/mmm, Z = 2. Substitusi secara acak
kation Fe3+ pada posisi Ti4+ pada oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 didukung dengan terjadinya peningkatan volume sel dan momen magnet oksida ini dengan meningkatnya substitusi kation Fe. Hasil simulasi pada beberapa oksida Aurivillius seperti: Bi2Mo0,25W0,75O6; Bi2+xLaxTiNbO9 (x = 0–1), ABi2Ta2O9 (A = Sr, Ba, Ca); Bi2-xSr2+xNb2TiO12 (x = 0; 0,2); AxSr2-xBi2Nb2TiO12 (A = Ba, Ca; dan x = 0; 0,5); dan Bi5Ti1,5W1,5O15 menunjukkan bahwa terdapat kecocokan antara simulasi dan data studi difraksi sinar-X dengan perbedaan sebesar 0,03%. Persamaan Yoder Flora dapat digunakan untuk menghitung energi kisi oksida Aurivillius.
Kata kunci: Oksida Aurivillius; Reaksi kimia padat; Metode Le Bail; Momen magnet, Simulasi atomik.
iii ABSTRACT
SYNTHESIS AND ATOMIC SIMULATION OF AURIVILLIUS OXIDES
By: Rolan Rusli NIM: 20504020
Most of studies in Aurivillius oxide have been synthesized of Aurivillius oxides with d0 cation as B cation. Recently, attempts to substitute d0 with dn cation at perovskite layered has been started. In this work attempt to substitute (Ti4+) with (Fe3+) has been carried out. Aurivillius oxides Sr
2Bi4Ti5-xFexO18, Sr2+0,5xBi4Ti5-xFexO18, Pb2Bi5Ti5FeO21 and Pb3Bi5Ti6FeO24 have been synthesized using the solid state reaction method. X-ray Diffraction powder data were refined using Le Bail method implemented in Rietica. Sr2Bi4Ti5-xFexO18, and Sr2+0,5xBi4Ti5-xFexO18 oxides have space group B2cb, Z = 4; whilst Pb2Bi5Ti5FeO21 and Pb3Bi5Ti6FeO24 oxides have space group A21am, Z = 4 and
I4/mmm, Z = 2. The random substitution of cation Fe3+ at Ti4+ position in these Aurivillius oxides was showed by the increase of lattice volume and magnetic moment in these oxides with increasing Fe substitution. The results of atomic simulation indicate that there were goal agreements between the simulated and experimental structural parameter for several Aurivillius oxides like Bi2Mo0.25W0.75O6, Bi2+xLaxTiNbO9 (x = 0–1), ABi2Ta2O9 (A = Sr, Ba, Ca), AxSr2-xBi2Nb2TiO12 (A = Ba, Ca; and x = 0, 0.5), and Bi5Ti1.5W1.5O15, with the differences less than 0.03 %. Yoder Flora equation can be used to determine lattice energy of Aurivillius oxides.
Keywords: Aurivillius oxides; Solid state reaction; Le Bail method; Magnetic moment, Atomic Simulation.
iv
SINTESIS DAN SIMULASI ATOMIK OKSIDA AURIVILLIUS
Oleh
Rolan Rusli
NIM: 20504020
Program Studi Kimia
Menyetujui
Tanggal………...
Pembimbing,
Dr. Ismunandar NIP. 132084475
v
PEDOMAN PENGGUNAAN TESIS
Tesis S2 yang tidak dipublikasikan terdaftar dan tersedia di Perpustakaan Institut Teknologi Bandung, dan terbuka untuk umum dengan ketentuan bahwa hak cipta ada pada pengarang dengan mengikuti HaKI yang berlaku di Institut Teknologi Bandung. Referensi kepustakaan diperkenankan dicatat, tetapi pengutipan atau peringkasan hanya dapat dilakukan seizin pengarang dan harus disertai dengan kebiasaan ilmiah untuk menyebutkan sumbernya.
Memperbanyak atau menerbitkan sebagian atau seluruh tesis haruslah seizin Direktur Program Pascasarjana, Institut Teknologi Bandung
vi
Tesis ini kupersembahkan buat Ayahanda, Ibunda, Kakak, Adik, Ipar dan Kemenakan, Keluarga, Almamater, Nusa, dan Bangsa, serta Agamaku
vii
UCAPAN TERIMA KASIH
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah SWT, karena dengan Rahmat dan Hidayah-Nya sehingga tesis ini dapat diselesaikan. Shalawat dan salam kepada Rasulullah Muhammad SAW, beserta keluarga dan sahabat.
Berbahagia sekali rasanya setelah tersusun sebuah Tesis sebagai syarat memperoleh gelar Magister, untuk itu penulis mengucapkan terima kasih yang setinggi-tingginya kepada semua pihak yang telah banyak memotivasi penulis dalam pelaksanaan penelitian hingga rampungnya penulisan tesis ini, khususnya kepada:
1. Dr. Ismunandar, selaku pembimbing yang selama ini telah membimbing dan mengarahkan penulis dalam penyelesaian tesis ini.
2. Dr. Muhammad A. Martoprawiro dan Dr. Bambang Prijamboedi atas arahannya.
3. Staf dosen program studi Kimia ITB pada umumnya dan Kimia Anorganik pada khususnya atas ilmu yang telah diberikan kepada penulis.
4. Staf administrasi dan Laboran di program studi kimia ITB atas segala kemudahan yang diberikan kepada penulis.
5. Drs. Haeruddin, M.Si., yang selama ini memberikan dorongan moril kepada penulis.
6. Ayahanda dan Ibunda tercinta, serta Kakak, Adik, Ipar dan Kemenakan, serta Keluargaku yang senantiasa memberikan dorongan baik moril maupun materil selama ini kepada penulis.
7. Teman-teman di Laboratorium Kimia Anorganik seperti Dudi, Ida, Linda, Ellen, Ibu Fahimah, Ibu Iis, Pak Zul, Akram, Sundari, Emil, Fika, dan yang lainnya yang tidak dapat disebutkan satu persatu.
viii
9. Teman-teman seperjuangan seperti Herman, Salam, Ahmad, Dahia, dan Edi, serta yang lainnya yang tidak dapat disebutkan satu persatu.
Akhirnya penulis mengharapkan semoga penelitian ini dapat memberikan sumbangan berarti dalam khasanah ilmu pengetahuan. Amin.
Bandung, Februari 2007
ix DAFTAR ISI
ABSTRAK ... ii
ABSTRACT ... iii
LEMBAR PENGESAHAN ... iv
PEDOMAN PENGGUNAAN TESIS ... v
LEMBAR PERSEMBAHAN ... vi
UCAPAN TERIMA KASIH ... vii
DAFTAR ISI ... ix
DAFTAR GAMBAR DAN ILUSTRASI ... xi
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
Bab I Pendahuluan ... 1
I.1 Latar Belakang ... 1
I.2 Tujuan Penelitian ... 3
Bab II Tinjauan Pustaka ... 4
II.1 Oksida-oksida Aurivillius ... 4
II.1.1. Oksida Aurivillius A2Bi4Ti5O18 (A=Ca, Sr, Ba and Pb) ... 6
II.1.2. Oksida Aurivillius Sr2Bi4Ti5-xMnxO18 (x = 0,25; 0,5; 0,75; dan 1) .. 7
II.2 Reaksi Kimia Padat ... 8
II.3 Difraksi Sinar-X ... 9
II.3.1. Hukum Bragg ... 11
II.3.2. Difraksi Sinar-X Serbuk ... 12
II.3.3. Metode Le Bail ... 13
II.4 Sifat Magnetik ... 13
II.5 Simulasi Atomik dengan Software GULP ... 15
II.5.1. Potensial Range Panjang ... 16
x
Bab III Metodologi Penelitian ... 18
III.1 Tempat Penelitian ... 18
III.2 Alat dan Bahan ... 18
III.2.1. Sintesis ... 18
III.2.2. Perhitungan Energi Kisi ... 18
III.3 Prosedur Kerja ... 20
III.3.1. Sintesis Oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 dengan x = 0,25; 0,5; 0,75 dan 1, serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 melalui reaksi kimia padat ... 20
III.3.2. Difraksi Sinar X serbuk ... 21
III.3.3. Pengukuran Sifat Magnetik ... 22
Bab IV Hasil dan Pembahasan ... 23
IV.1 Sintesis ... 23
IV.1.1 Penghalusan Struktur (Refinement) ... 23
IV.1.2 Sifat Magnet ... 29
IV.2 Simulasi Atomik ... 30
IV.3 Penentuan Energi Kisi dengan Persamaan Yoder-Flora ... 31
Bab V Kesimpulan ... 33
Daftar Pustaka ... 34
xi
DAFTAR GAMBAR DAN ILUSTRASI
Gambar II.1 Representasi struktur oksida Aurivillius n = 2, 3, dan 4 ... 5
Gambar II.2 Skema reaksi kimia padatan antara senyawa A dan B menghasilkan senyawa baru C ... 9
Gambar II.3 Pembentukan sinar-X ... 10
Gambar II.4 Spektrum panjang gelombang sinar-X pada logam ... 10
Gambar II.5 Pemantulan berkas sinar-X monokromatis oleh dua bidang kisi dalam kristal ... 12
Gambar II.6 Skema difraktometer sinar-X serbuk ... 12
Gambar II.7 Pembelahan orbital d pada kompleks oktahedaral Fe3+ ... 15
Gambar IV.1 Plot Le Bail oksida Sr2Bi4Ti5-xFexO18 (x = 0,25–1) ... 24
Gambar IV.2 Plot Le Bail oksida Sr2+0.5xBi4Ti5-xFexO18 (x = 0,25–1) ... 25
Gambar IV.3 Plot Le Bail Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 ... 26
Gambar IV.4 Hubungan antara nilai x kation Fe dengan volume sel satuan pada oksida Aurivillius Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 ... 28
Gambar IV.5 Hubungan antara x kation Fe dengan nilai pameter sel a, b dan c pada oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18. ... 28
xii
DAFTAR TABEL
Tabel II.1 Data Kristalografi Oksida Aurivillius CaBi4Ti4O15 dan BaBi4Ti4O15. ... 5 Tabel II.2 Parameter sel oksida A2Bi4Ti5O18 (A = Ca, Sr, Ba dan Pb) ... 7 Tabel II.3 Nilai momen magnet oksida Aurivillius Sr2Bi4Ti5-xMnxO18
dengan x = 0,25; 0,5; 0,75; 1 ... 8 Tabel II.4 Bentuk fungsional potensial interatomik pada GULP ... 17 Tabel III.1 Potensial interatomik untuk oksida Aurivillius ... 19 Tabel III.2 Data jumlah pereaksi untuk sintesis Sr2Bi4Ti5-xFexO18 dan
Sr2+0,5xBi4Ti5-xFexO18 serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6O24 .... 21 Tabel IV.1 Parameter sel oksida Aurivillius Sr2Bi4Ti5-xFexO18 ... 26 Tabel IV.2 Parameter sel oksida Aurivillius Sr2+0,5xBi4Ti5-xFexO18 ... 27 Tabel IV.3 Parameter sel Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 ... 27 Tabel IV.4 Momen magnet (μ) oksida Sr2Bi4Ti5-xFexO18 dan
Sr2+0.5xBi4Ti5-xFexO18 serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6O24 pada temperatur ruang ... 29 Table IV.5 Parameter struktur hasil simulasi dan eksperimen untuk
beberapa oksida Aurivillius ... 31 Tabel IV.6 Perbandingan energi kisi hasil perhitungan energi kisi simulasi
atomik dan persamaan sederhana Yoder Flora ... 32 Tabel A.1 Data perhitungan momen magnet ... 37 Tabel A.2 Koreksi diamagnetik (tetapan Pascal) yang digunakan pada
perhitungan nilai momem magnet ... 38 Tabel B.1 Parameter struktur hasil simulasi atomik dan eksperimen ... 39 Tabel C.1 Energi kisi oksida biner ... 42
xiii
DAFTAR LAMPIRAN
Lampiran A Perhitungan Momen Magnet ... 37 Lampiran B Parameter Sel Hasil Simulasi Atomik ... 39 Lampiran C Energi Kisi Oksida Biner ... 42
Bab I Pendahuluan
I.1 Latar Belakang
Oksida Aurivillius merupakan suatu senyawa dengan struktur berlapis yang terdiri atas lapisan [Bi2O2]2+ dan lapisan perovskit dengan rumusan umum lapisan [An-1BnO3n+1]2-. Logam A pada lapisan perovskit merupakan kation yang berukuran besar, bermuatan +1, +2, atau +3, diantaranya adalah logam alkali, alkali tanah, unsur tanah jarang atau campurannya yang mempunyai koordinasi dodekahedral. Sedangkan logam B merupakan unsur transisi yang berukuran lebih kecil dari kation A dengan koordinasi oktahedral dan n adalah bilangan bulat yang menunjukkan jumlah oktahedral pada lapisan perovskit (1 < n < 5).
Oksida ini telah banyak disintesis, karena memiliki banyak sifat yang menarik untuk dikaji dan dikembangkan lebih lanjut, antara lain sebagai material feroelektrik yang dapat diaplikasikan sebagai penyimpan memori Fe-RAM, kapasitor, piezoelektrik, konduktor, katalis, dan sebagai material magnetik.
Studi yang dilakukan pada oksida Aurivillius selama ini adalah sintesis oksida Aurivillius dengan menggunakan kation d0 pada posisi B di lapisan perovskitnya. Beberapa oksida tersebut antara lain adalah CaxBi4Ti3+xO12+3x (x = 1 dan 2) (Moure, et. al. 2005), BaBi4Ti4O15 (Kennedy, et. al., 2003), dan CaBi4Ti4O15 (Tellier, et. al. 2004), SrBi4Ti4O15 (Zhang, et. al., 2001 dan Ferrer, et. al., 2004), Bi4Srn-3TinO3n+3 (n = 4 dan 5) (Ferrer, et. al. 2005), CaBi4 - xNdxTi4O1 5 (x = 0; 0,25; 0,50; 0,75) (Zeng, et. al., 2005), Bi4-xBaxTi3-xNbxO12 (Jennet, et. al. 2005), dan A2Bi4Ti5O18 (A = Ca, Sr, Ba dan Pb) (Ismunandar, et. al., 2004).
Saat ini upaya yang banyak dikembangkan adalah sintesis oksida Aurivillius dengan substitusi kation dnpada kation d0 di lapisan perovskit oksida Aurivillius. Sintesis oksida Aurivillius yang telah dilakukan dengan mensubstitusi kation dn pada lapisan perovskit antara lain adalah Bi5Ti3FeO15 dan Bi6Ti3Fe2O18, Bi7Ti3Fe3O21, Bi8Ti3Fe4O21, Bi9Ti3FeO27 dan LaBi4Ti3FeO15 (Srinivas, et. al.
2
1999 – 2004, Digamber, et. al , 2006, Fuentes, et. al., 2006, dan Hervoches, et. al., 2002), Bi2Sr2Nb2MnO12- (Yu, et. al. 1999), dan Bi2Sr1,4La0,6Nb2MnO12 (McGabe dan Greaves, 2005), serta Sr2Bi4Ti5-xMnxO18 (x = 0,25; 0,5; ,75 dan 1) (Aziz, 2006).
Sintesis oksida Aurivillius dengan substitusi kation dn pada lapisan perovskit dilakukan mengingat penelitian ini masih kurang. Pada penelitian ini dilakukan subtitusi dengan adanya defek pada oksida Aurivillius. Beberapa peneliti mengatakan bahwa tidak dimungkinkan adanya defek pada oksida Aurivillius. Namun telah ada yang melakukan sintesis dengan adanya defek pada oksida Aurivillius, antara lain pada Bi2Sr2Nb2MnO12- (Yu, et. al. 1999).
Oleh karena itu dilakukan sintesis dengan adanya defek pada oksida Aurivillius Sr2Bi4Ti5O18 dengan mensubstitusi kation dn pada kation d0 di lapisan perovskit, dalam hal ini adalah substitusi kation Fe pada kation Ti dengan komposisi Sr2Bi4Ti5-xFexO18 (x = 0,25; 0,5; 0,75 dan 1). Dilakukan pula sintesis oksida Sr2Bi4Ti5-xFexO18 (x = 0,25; 0,5; 0,75 dan 1), dengan menambahkan jumlah stronsiumnya, dimana akan dilihat apakah dihasilkan senyawa atau struktur yang berbeda dengan adanya defek. Selain itu dilakukan pula sintesis oksida Aurivillius Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24.
Selain itu, untuk mendukung keberhasilan sintesis oksida Aurivillius perlu diketahui data termodinamikanya, dalam hal ini adalah energi kisi karena kestabilan termodinamika penting untuk meramalkan keberhasilan suatu sintesis. Energi kisi dapat ditentukan dengan eksperimen dan simulasi atomik. Penentuan energi kisi dapat dilakukan berdasarkan hasil eksperimen kalorimetri (termokimia) dan perhitungan menggunakan Hukum Coulomb. Berdasarkan hasil eksperimen kalorimetri, energi kisi dapat ditentukan melalui siklus Born-Haber, sedangkan berdasarkan penurunan Hukum Coulomb dapat dihitung melalui pendekatan tiga persamaan energi kisi yang berlaku untuk senyawa ionik, yakni persamaan Born-Lande, Born Mayer dan Kapustinskii.
3
Penentuan energi kisi oksida Aurivillius baik dengan eksperimen maupun dengan menggunakan persamaan sederhana atau dengan menggunakan simulasi atomik, belum banyak dikaji. Sebagai langkah awal dalam meramalkan kestabilan termodinamika oksida Aurivillius, maka perlu dilakukan simulasi atomik oksida-oksida Aurivillius yang telah dilaporkan. Hasil pekerjaan ini akan menjadi acuan untuk sintesis dan simulasi oksida Aurivillius di masa yang akan datang, terutama adalah untuk meramalkan adanya defek, dan substitusi d0 dengan dn pada lapisan perovskit oksida Aurivillius.
Persamaan Yoder Flora telah banyak dikembangkan untuk memprediksi kestabilan termodinamika dari oksida dalam hal ini energi kisinya. Beberapa peramalan energi kisi menggunakan persamaan Yoder Flora yang telah dilakukan antara lain oleh Dede (Suhendar, dan Ismunandar 2006), Helna (Tehubijuluw, 2006), dan Sundari (Wirasmi, dan Ismunandar 2006), sehingga dilakukan pula perhitungan energi kisi menggunakan persamaan sederhana Yoder-Flora, dan dibandingkan dengan hasil simulasi atomik untuk oksida Aurivillius.
I.2 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mensitesis dan mengkarakterisasi sifat magnetik oksida Aurivillius lapis lima Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 dengan x = 0,25; 0,5; 0,75 dan 1 serta lapis enam dan tujuh yaitu Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24.
2. Menghitung energi kisi oksida Aurivillius seperti Bi2Mo0,25W0,75O6, Bi2+xLaxTiNbO9 (x = 0–1), ABi2Ta2O9 (A = Sr, Ba, Ca), AxSr2-xBi2Nb2TiO12 (A = Ba, Ca; dan x = 0; 0,5), dan Bi5Ti1,5W1,5O15, dengan menggunakan simulasi atomik dan persamaan sederhana Yoder Flora.
4
Bab II Tinjauan Pustaka
Pada bagian ini diuraikan mengenai oksida-oksida Aurivillius, terutama oksida Aurivillius yang akan menjadi acuan untuk sintesis dalam penelitian ini, yakni (A2Bi4Ti5O18, A = Ca, Sr, Ba dan Pb). Penjelasan mengenai metode sintensis kimia padatan yang digunakan dalam mensintesis oksida Aurivillius serta karakterisasinya dengan menggunakan difraksi sinar-X, juga akan diberikan. Selain itu diberikan pula penjelasan mengenai sifat magnetik material oksida dan teknik simulasi atomik.
II.1. Oksida-oksida Aurivillius
Oksida Aurivillius pertama kali disintesis oleh Aurivillius (1949), sehingga senyawa ini lebih dikenal dengan nama oksida Aurivillius. Oksida Aurivillius merupakan suatu senyawa dengan struktur berlapis yang terdiri atas lapisan [Bi2O2]2+ dan lapisan perovskit dengan rumusan umum lapisan [An-1BnO3n+1]2-. Logam A pada lapisan perovskit merupakan kation yang berukuran besar, bermuatan +1, +2 atau +3, seperti logam alkali, alkali tanah, unsur tanah jarang atau campurannya. Logam A dalam senyawa ini berkoordinasi dodekahedral. Sedangkan logam B merupakan unsur transisi yang berukuran lebih kecil dari kation A, berkoordinasi oktahedral, dan n adalah bilangan bulat yang menunjukkan jumlah oktahedral pada lapisan perovskit (1 < n < 5). Representasi dari struktur oksida Aurivillius ini dapat diberikan pada Gambar II.1.
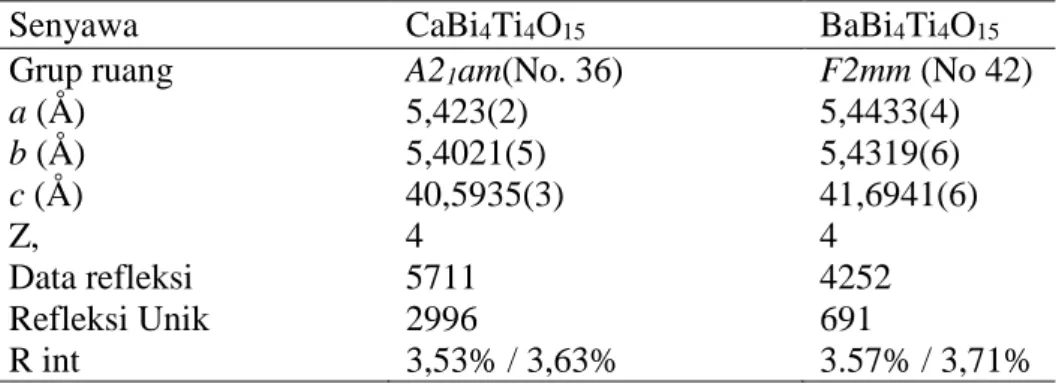
Oksida-oksida Aurivillius ini memiliki banyak sifat yang menarik seperti sifat feroelektrik, kapasitor, piezoelektrik, konduktor, katalis, dan lain-lain. Beberapa oksida Aurivillius yang telah disintesis dan ditunjukkan memiliki sifat feroelektrik antara lain oksida Aurivillius lapis empat CaBi4Ti4O15 dan BaBi4Ti4O15. Data struktural untuk kedua oksida ini diberikan di Tabel II.1.
5
Gambar II.1 Representasi Struktur Oksida Aurivillius n = 2, 3, dan 4.
a = Lapisan [An-1BnO3n+1]2- (lapisan Perovskit), kation A berada di tengah pada lapisan perovskit dan kation B berada di tengah oktahedral dan atom oksigen berada pada sudut-sudut oktahedral, b = Lapisan [Bi2O2]2+.
Tabel II.1 Data Kristalografi Oksida Aurivillius CaBi4Ti4O15 dan BaBi4Ti4O15. (diadopsi dari Tellier J., et. al., 2004)
Senyawa CaBi4Ti4O15 BaBi4Ti4O15
Grup ruang A21am(No. 36) F2mm (No 42)
a (Å) 5,423(2) 5,4433(4) b (Å) 5,4021(5) 5,4319(6) c (Å) 40,5935(3) 41,6941(6) Z, 4 4 Data refleksi 5711 4252 Refleksi Unik 2996 691 R int 3,53% / 3,63% 3.57% / 3,71%
Oksida Aurivillius SrBi4Ti4O15 yang dibuat dalam bentuk lapis tipis pun telah ditunjukkan dapat bersifat sebagai material feroelektrik. Oksida CaxBi4Ti3+xO12+3x (x = 1 dan 2) telah disintesis dengan teknik sintesis kimia padat, oksida ini dapat
2 3 4
b a
6
bersifat sebagai material piezoelektrik pada temperatur tinggi (Moure, et. al. 2005). Sedangkan oksida CaBi4-xNdxTi4O15 (x = 0; 0,25; 0,50; 0,75) dilaporkan
memiliki sifat elektrik (Zeng, et. al., 2005). Oksida Aurivillius Bi4-xBaxTi3-xNbxO12 juga dilaporkan memiliki sifat feroelektrik (Jennet, et. al.
2005). Xie dan Pan, (2003) melaporkan bahwa oksida Aurivillius BaBi4Ti4O15 yang dibuat melalui metode sol-gel dalam bentuk serbuk skala nano juga bersifat feroelektrik. Borg, dan Svensson, (2001), telah melaporkan oksida Aurivillius lapis dua Bi2,5Me0,5Nb2O9 (Me = Na dan K). Penghalusan strukturnya dilakukan dengan metode Rietveld dari data difraksi neutron serbuk dalam grup ruang A21am (ortorombik). Dilaporkan pula bahwa oksida Aurivillius lapis tiga
Bi2ANaNb3O12 (A = Sr, Ca) dan Bi2CaNaTa3O12, memiliki aktivitas fotokatalisis (Kudo, et. al. 2004).
Setelah pembahasan mengenai oksida Aurivillius tersebut di atas, maka akan dibahas mengenai oksida Aurivillius yang akan menjadi acuan dalam penelitian ini yaitu oksida Aurivillius A2Bi4Ti5O18 (A = Ca, Sr, Ba dan Pb). Dibahas pula oksida Aurivillius Sr2Bi4Ti5-xMnxO18 (x = 0,25; 0,5; ,75; 1), yang telah dilakukan dengan mensubstitusi kation dn pada kation d0, dalam hal ini adalah substitusi kation Mn pada kation Ti di lapisan perovskit oksida Aurivillius.
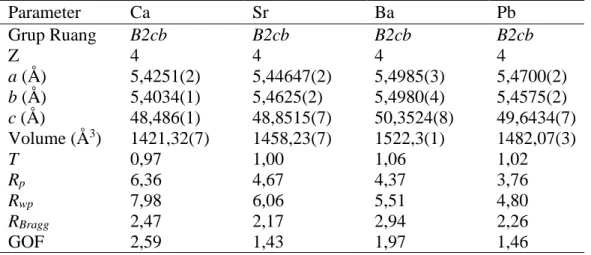
II.1.1 Oksida Aurivillius A2Bi4Ti5O18 (A = Ca, Sr, Ba dan Pb)
Penelitian yang telah dilakukan pada oksida Aurivillius lapis lima, A2Bi4Ti5O18 (A= Ca, Sr, Ba and Pb), menunjukkan bahwa oksida ini memiliki sifat feroelektrik yang baik. Studi struktur telah dilakukan pada oksida Aurivillius lapis lima A2Bi4Ti5O18 (A= Ca, Sr, Ba and Pb) dengan menggunakan difraksi neutron yang dianalisis dengan menggunakan program Rietica. Dari studi ini diperoleh parameter sel seperti tertera dalam Tabel II.2 (Ismunandar, et. al., 2004). Data hasil difraksi oksida ini digunakan sebagai data acuan (input data) untuk proses penghalusan dengan menggunakan metode Le Bail pada program Rietica untuk oksida target hasil sintesis Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 dengan x = 0,25; 0,5; 0,75 dan 1.
7
Tabel II.2 Parameter sel Oksida A2Bi4Ti5O18 (A = Ca, Sr, Ba and Pb) (diadopsi dari Ismunandar, et. al., 2004)
Parameter Ca Sr Ba Pb Grup Ruang B2cb B2cb B2cb B2cb Z 4 4 4 4 a (Å) 5,4251(2) 5,44647(2) 5,4985(3) 5,4700(2) b (Å) 5,4034(1) 5,4625(2) 5,4980(4) 5,4575(2) c (Å) 48,486(1) 48,8515(7) 50,3524(8) 49,6434(7) Volume (Å3) 1421,32(7) 1458,23(7) 1522,3(1) 1482,07(3) T 0,97 1,00 1,06 1,02 Rp 6,36 4,67 4,37 3,76 Rwp 7,98 6,06 5,51 4,80 RBragg 2,47 2,17 2,94 2,26 GOF 2,59 1,43 1,97 1,46
II.1.2 Oksida Aurivillius Sr2Bi4Ti5-xMnxO18 (x = 0,25; 0,5; ,75; 1)
Pada penelitian yang telah dilakukan oleh Abdul Aziz (Aziz, 2006) pada oksida Aurivillius lapis lima Sr2Bi4Ti5O18 dengan mensubstitusikan kation Mn pada kation Ti diperoleh oksida Aurivillius Sr2Bi4Ti5-xMnxO18 (x = 0,25; 0,5; ,75; 1). Oksida Aurivillius ini memiliki nilai kemagnetan yang semakin meningkat dengan meningkatnya jumlah Mn, yang dapat dilihat dalam Tabel II.3.
Tabel II.3 Momen Magnet Oksida Sr2Bi4Ti5-xMnxO18 (x = 0,25; 0,5; ,75; 1). (diambil dari Aziz, 2006)
Oksida µ (BM)
Sr2Bi4Ti4,75Mn0,25O18 2,41 Sr2Bi4Ti4,5Mn0,5O18 3,45 Sr2Bi4Ti4,25Mn0,75O18 4,38 Sr2Bi4Ti4MnO18 5,58
Hasil pengukuran kerentanan magnet menunjukkan bahwa semakin besar fraksi Mn dalam oksida Sr2Bi4Ti5-xMnxO18 akan meningkatkan nilai momen magnetnya. Pada substitusi atom Mn dengan jumlah fraksi satu, diperoleh nilai momen
8
magnetnya sebesar 5,58 BM, sehingga dapat dikatakan bahwa oksida ini berada pada keadaan spin tinggi. Namun nilai ini memiliki perbedaan dengan nilai secara teoritis, ini diduga karena adanya interaksi antar atom selain interaksi dari spin serta orientasi atom-atomnya dalam oksida Aurivillius tersebut.
II.2. Reaksi Kimia Padat
Reaksi kimia padat merupakan teknik yang secara luas digunakan dalam sintesis padatan-padatan polikristalin, yang secara langsung dari pereaksi-pereaksinya yang berwujud padat, umumnya menggunakan suhu yang relatif tinggi sampai 1500 oC. Pada suhu tinggi tersebut maka reaksi yang berlangsung akan memiliki laju yang cukup.
Beberapa faktor yang menyebabkan reaksi kimia padat harus dilakukan pada suhu tinggi, yaitu:
adanya perbedaan struktur kristal antara pereaksi-pereaksi dengan produk reaksi yang dihasilkan, ion-ion harus melakukan migrasi/difusi,
ion-ion pereaksi yang akan bereaksi terjebak pada kisi kristalnya sehingga sukar untuk berdifusi ke antar muka kristal antara masing-masing pereaksi,
terjadi penyusunan ulang struktur kristal pada proses pembentukan produk reaksi yang meliputi peristiwa pemutusan dan pembentukan ikatan-ikatan kimia, serta
difusi ion-ion pada jarak yang signifikan bagi skala ionik/ atomik.
Dalam reaksi kimia padat, peristiwa pelelehan pereaksi harus dihindari, karena sering diikuti oleh peristiwa penguapan yang dapat mengubah komposisi campuran pereaksi. Hal yang dapat dilakukan untuk mempercepat reaksi adalah proses penggerusan, yang mengurangi rongga antar partikel pereaksi dan memperkecil ukuran partikel-partikel serbuknya, sehingga akan memperbesar luas total permukaan partikel yang bereaksi.
9
Pada Gambar II.2 diilustrasikan secara skematik pembentukan oksida C dari pereaksi A dan B, terjadi reaksi kimia keadaan padat antara tiga permukaan kristal pereaksi yang saling bersentuhan. Setelah ion-ion dapat melepaskan diri dari perangkap pada kisi kristal karena pemberian energi panas sampai suhu tertentu, maka ion-ion tersebut akan bergerak sepanjang kristalnya, membentuk produk C.
Gambar II.2 Skema reaksi kimia padat antara senyawa A dan B menghasilkan senyawa baru C.
Senyawa A dan B = oksida awal/ reaktan, C = oksida target/ hasil.
Selanjutnya akan dibahas mengenai difraksi sinar-X, hukum Bragg dan difraksi sinar-X serbuk yang akan dipakai dalam karakterisasi oksida target hasil sintesis.
II.3. Difraksi Sinar-X
Difraksi sinar-X merupakan teknik yang digunakan untuk menganalisis padatan kristalin. Sinar-X merupakan radiasi gelombang elektromagnetik dengan panjang gelombang sekitar 1 Å, berada di antara panjang gelombang sinar gama () dan sinar ultraviolet. Sinar-X dihasilkan jika elektron berkecepatan tinggi menumbuk suatu logam target (Gambar II.3).
Sinar-X yang diperoleh memberikan intensitas puncak tertentu yang bergantung pada kebolehjadian transisi elektron yang terjadi. Transisi K lebih mungkin terjadi dan memiliki intensitas yang lebih tinggi daripada transisi K, sehingga radiasi K yang digunakan untuk keperluan difraksi sinar-X. Sinar-X juga dapat dihasilkan oleh proses perlambatan elektron pada saat menembus logam sasaran. Proses perlambatan ini menghasilkan sinar-X yang biasa disebut sebagai radiasi
10
putih. Hasil dari semua proses tadi untuk logam tertentu adalah spektrum khas sinar-X, seperti yang ditunjukkan pada Gambar II.4. Terdapat bentuk dasar yang terbentuk oleh radiasi putih dan puncak khas tajam yang bergantung pada kuantisasi transisi elektron.
Gambar II.3 Pembentukan sinar-X.
Elektron berkecepatan tinggi yang mengenai elektron pada orbital 1s akan menyebabkan elektron tereksitasi menyebabkan kekosongan (□) pada orbital 1s tersebut, dengan adanya pengisian elektron pada orbital kosong tersebut dari orbital yang lebih tinggi energinya akan memberikan pancaran sinar-X.
Gambar II.4 Spektrum panjang gelombang sinar-X pada logam.
Terdapat beberapa jenis pancaran panjang gelombang yang dihasilkan dengan intensitas yang berbeda, dimana panjang gelombang Kα1 memiliki intensitas yang lebih tinggi, sehingga digunakan dalam difraksi sinar-X.
Sinar-X yang monokromatis sangat diperlukan dalam suatu eksperimen difraksi sinar-X. Untuk tujuan itu salah satunya dapat digunakan filter, yang secara selektif
11
meneruskan panjang gelombang yang ingin digunakan. Untuk sinar-X dari tabung tembaga, biasanya digunakan lembaran nikel sebagai filter. Nikel sangat efektif dalam meneruskan radiasi Cu K,, karena radiasi Cu K memiliki cukup energi untuk mengionisasi elektron 1s Nikel, sedangkan radiasi Cu K tidak cukup untuk mengionisasi. Dengan demikian, lembaran nikel tersebut akan mengabsorpsi semua panjang gelombang termasuk radiasi putih, kecuali radiasi Cu K.
II.3.1 Hukum Bragg
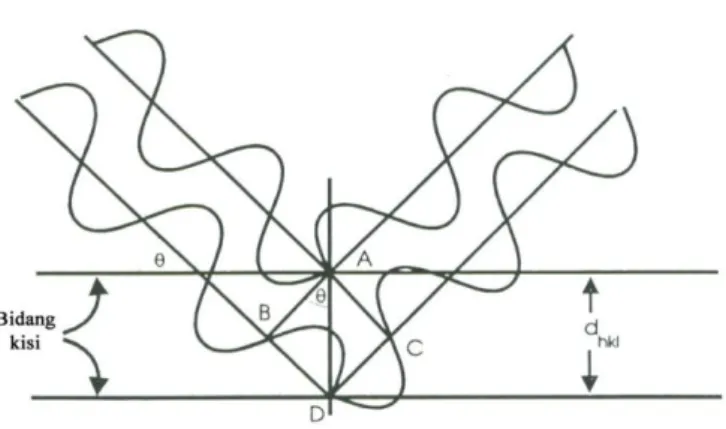
Suatu kristal memiliki susunan atom yang tersusun secara teratur dan berulang, memiliki jarak antar atom yang ordenya sama dengan panjang gelombang sinar-X. Akibatnya, bila seberkas sinar-X ditembakkan pada suatu material kristalin maka sinar tersebut akan menghasilkan pola difraksi khas. Pola difraksi yang dihasilkan sesuai dengan susunan atom pada kristal tersebut.
Menurut pendekatan Bragg, kristal dapat dipandang terdiri atas bidang-bidang datar (kisi kristal) yang masing-masing berfungsi sebagai cermin semi transparan. Jika sinar-X ditembakkan pada tumpukan bidang datar tersebut, maka beberapa akan dipantulkan oleh bidang tersebut dengan sudut pantul yang sama dengan sudut datangnya, seperti yang diilustrasikan dalam Gambar II.5, sedangkan sisanya akan diteruskan menembus bidang.
Perumusan secara matematik dapat dikemukakan dengan menghubungkan panjang gelombang sinar-X, jarak antar bidang dalam kristal, dan sudut difraksi:
n = 2d sin (Persamaan Bragg) (II.1)
adalah panjang gelombang sinar-X, d adalah jarak antar kisi kristal, adalah sudut datang sinar, dan n = 1, 2, 3, dan seterusnya adalah orde difraksi. Persamaan Bragg tersebut digunakan untuk menentukan parameter sel kristal. Sedangkan untuk menentukan struktur kristal, dengan menggunakan metoda komputasi kristalografik, data intensitas digunakan untuk menentukan posisi-posisi atomnya.
12
Gambar II.5 Pemantulan berkas sinar-X monokromatis oleh dua bidang kisi dalam kristal, dengan sudut sebesar θ dan jarak antara bidang kisi sebesar dhkl
II.3.2 Difraksi Sinar-X Serbuk
Salah satu teknik yang digunakan untuk menentukan struktur suatu padatan kristalin, adalah metoda difraksi sinar-X serbuk (X-ray powder diffraction). Sampel berupa serbuk padatan kristalin yang memiliki sejumlah besar kristal kecil dengan diameter butiran kristalnya sekitar 10-7 – 10-4 m ditempatkan pada suatu plat kaca dalam difraktometer seperti terlihat pada Gambar II.6.
Gambar II.6 Skema difraktometer sinar-X serbuk. Tabung sinar-X akan mengeluarkan sinar-X yang yang difokuskan sehingga mengenai sampel oleh pemfokus, detektor akan bergerak sepanjang lintasannya, untuk merekam pola difraksi sinar-X.
13
Pola difraksi yang dihasilkan berupa deretan puncak-puncak difraksi dengan intensitas relatif yang bervariasi sepanjang nilai 2θ tertentu. Besarnya intensitas relatif puncak dari deretan puncak tersebut bergantung pada jumlah atom atau ion yang ada, dan distribusinya di dalam sel satuan material tersebut. Pola difraksi setiap padatan kristalin khas, yang bergantung pada kisi kristal, unit parameter, dan panjang gelombang sinar-X yang digunakan. Dengan demikian, sangat kecil kemungkinan dihasilkan pola difraksi yang sama untuk suatu padatan kristalin yang berbeda.
II.3.3 Metode Le Bail
Pada pola difraksi sinar-X serbuk sering terjadi adanya overlap pada puncak difraksi terutama pada nilai 2 yang tinggi. Dengan adanya overlap tersebut menyebabkan sulitnya pemisahan intensitas dari tiap-tiap pemantulan sinar, sehingga penentuan struktur sukar dilakukan. Namun, dengan metoda Rietveld, kini dimungkinkan untuk menentukan struktur kristal, terutama untuk struktur yang relatif sederhana, dari data difraksi serbuk.
Sebagai langkah awal penggunaan metoda Rietveld, sering digunakan metoda Le Bail. Pada metode Le Bail, intensitas dari berbagai puncak difraksi dihitung dengan hanya menggunakan parameter sel satuan dan parameter yang mendefinisikan puncak. Dari analisis Le Bail akan didapatkan parameter sel dan plot Le Bail mirip plot Rietveld.
II.4. Sifat Magnetik
Sifat magnet suatu senyawa timbul akibat adanya atom dengan elektron yang tidak berpasangan. Elektron merupakan suatu magnet elementer dengan muatan negatif yang bergerak mengelilingi inti pada lintasannya. Kontribusi sifat magnetik diberikan oleh kontribusi spin, S dan kontribusi orbital, L. Kombinasi
14
= [4S (S + 1) + L (L + 1)]1/2 BM (II.2)
Dimana S = bilangan kuantum spin
L = bilangan kuantum momen magnet orbital
Untuk atom Fe3+, momen orbitalnya bernilai nol, sehingga yang diperhitungkan adalah momen magnet spinnya saja:
S = 2[S(S+1)]1/2 BM (II.3)
Karena S = 1/2, 1, 3/2, … untuk 1, 2, 3, …elektron tidak berpasangan, maka persamaan di atas menjadi :
S = {n(n+2)}1/2 (II.4)
dimana n = jumlah elektron tak berpasangan
Ukuran sifat kemagnetan disebut kerentanan magnet (magnetic susceptibility) atau
, yaitu gaya yang dialami per unit berat sampel akibat adanya medan magnet terpasang. Hubungan antara kerentanan magnet dengan momen magnet dinyatakan dengan hukum Curie:
= 2,828 (Mcorr . T)1/2 (II.5)
Mcorr adalah kerentanan magnet molar yang telah dikoreksi terhadap sifat
diamagnetik:
Mcorr = M - D (II.6)
dimana M = kerentanan magnet molar
D = koreksi diamagnetik
T = suhu (K)
Berdasarkan teori medan kristal, jumlah elektron yang tidak berpasangan ditentukan oleh kekuatan medan ligan. Dalam medan oktahedral, orbital d akan mengalami pembelahan tingkat energi. Akibat dari pembelahan orbital d menjadi orbital t2g dan eg, maka ion-ion logam khususnya deret pertama logam transisi
dengan konfigurasi d4 sampai d7 dapat berada dalam keadaan spin tinggi (HS) atau spin rendah (LS) tergantung pada kekuatan medan ligan. Pada konfigurasi spin rendah (LS), akan didapatkan jumlah elektron yang tidak berpasangan menjadi lebih sedikit, sehingga akan memiliki nilai kemagnetan yang kecil atau
15
bahkan sama dengan nol. Sedangkan untuk konfigurasi spin tinggi (HS), akan terdapat sejumlah elektron yang tidak berpasangan sehingga momen magnetnya akan menjadi lebih besar.
Dalam medan oktahedral kation Fe3+ dapat memiliki dua keadaan spin, yaitu pada keadaan spin tinggi dan spin rendah tergantung kekuatan ligannya. Pada keadaan spin rendah, kation Fe3+ akan memiliki momen magnet sekitar 1,73 BM, karena semua elektron dari kation Fe3+ akan berpasangan semua dan terdapat satu elektron tak berpasangan. Sedangkan pada keadaan spin tinggi, kation Fe3+ akan memiliki nilai momen magnet yang lebih besar sekitar 5,92 BM karena memiliki lima elektron yang tidak berpasangan seperti terlihat pada gambar II.7.
Gambar II.7 Pembelahan Orbital d pada kompleks oktahedaral Fe3+.
a). Konfigurasi spin rendah pada koordinasi oktahedral dari Fe3+, elektronnya semua berada pada orbital t2g.
b). Konfigurasi spin tinggi, terjadi pemisahan elektron yaitu pada orbital t2g sebanyak 3 elektron dan orbital eg sebanyak 2 elektron.
II.5. Simulasi Atomik dengan Software GULP
Gale (1997) dari Royal Institute – Inggris, mengembangkan software GULP, yang merupakan program simulasi mekanika klasik, salah satunya adalah untuk perhitungan energi kisi. Teknik simulasi ini dilakukan atas dasar model potensial interatomik, yang menyatakan total energi sistem merupakan fungsi koordinat
a). spin rendah b). spin tinggi eg
t2g
eg
16
atom. Interaksi antar ion dibagi ke dalam dua bagian yaitu interaksi Coulomb long-range dengan short-range berupa tolakan Pauli. Perhitungan energetika secara teoritis melibatkan evaluasi dari interaksi antara semua spesies, baik inti, kulit atau satuan atom dalam sel satuan.
III.5.1 Potensial Long Range
Energi elektrostatik merupakan bentuk kontribusi energi yang paling dominan untuk beberapa material anorganik, terutama oksida, dan penting untuk mengevaluasi secara akurat. Untuk sistem yang kecil sampai sedang melibatkan jarak yang ditulis dalam bentuk transformasi Laplace terdiri dari dua kelompok yakni, reciprocal-space dan real-space yang dikontrol melalui parameter . Oleh karena itu dihasilkan energi:
ij j i j i G recip xqqGr G G V E 4
exp/4
exp 2 1 2 2
(II.7)
i j ij ij j i real r r erfc q q E 2 / 1 2 1
(II.8) dimana G adalah vektor kisi reciprocal. Elektrostatik maksimum dibatasi oleh real dan reciprocal-space dapat ditulis dalam bentuk nilai dari optimum:2 1 max opt f R (II.9) 2 1 max2f opt G
(II.10)
2 1 lnA f (II.11)dimana, A adalah parameter ketelitian yang mengontrol besaran yang dapat diabaikan. Nilai A adalah 10-8 sebagai dasar untuk memberikan ketelitian hasil pada sistem, dengan sel satuan yang besar dan nilainya meningkat.
17
III.5.2 Potensial Interatomik
Pada beberapa material ionik potensial short-range yang digunakan adalah potensial Buckingham terlihat pada Tabel II.4, yang berisi suatu eksponensial repulsive dan suatu bentuk penguraian antara spesies-spesies yang berhubungan.
Tabel II.4 Bentuk fungsional potensial interatomik pada GULP (Gale, 1997)
Nama Potensial Rumusan Satuan Input
Buckingham A exp( r/) – C r – 6 A,eV; ,Å; C,eV Å6
Lennard-Jones A r -m B r -n atau A,eV Åm; B,eV Ån
c1(/r)m c2(/r)n , eV; , Å c1n/(mn)*(m/n)**m/(mn) c2m/(mn)*(m/n)**n/(mn) Harmonic (k3/k4) 1/2 k2(r ro)2 + k2, eV Å-2; ro, Å 1/6 k3(r ro)3 + k3, eV Å-3 1/12 k4(r ro)4 k4, eV Å-4
Morse D(1 exp a(r ro)22 1 D, eV; a, Å-2
Spring (core-shell) 1/2 k2 r2 + 1/24 k4 r4 k2, eV Å-2 ; k4, eV Å-4
General A exp( r/) r -m – C r – n A,eV Åm
; ,Å ; C,eV
Ån
Stillinger-Weber (2-body)
A exp /( r rmax) (B r –4 1) A,eV; ,Å; B, Å4
Stillinger-Weber (3-body)
K exp /(r1 2 rmax)+ /(r13 rmax) cos(2 1 3) – cos(o)2 K,eV ; ,Å Three-body harmonic 1/2 k2(o)2 + k2, eV rad-2; o, derajat 1/6 k3(o)3 + k3, eV rad-3 1/12 k4(o)4 k4, eV rad-4 Three-body harmonic + Exponential 1/2 k2(2 1 3o)2 x exp( r1 2 /) exp( r1 3 /) k2, eV rad-2; o, derajat ,Å
Axilrod-Teller K( 1 + 3 cos 2 1 3 cos 123
cos 1 3 2)/( r1 2 r1 3 r2 3)3
K,eV Å9
Three-body exponential A exp(r1 2 /)exp /(r1 3/ ) exp(r2 3/ ) A,eV; ,Å
Urey-Bradley 1/2 k (r2 3 ro)2 k, eV Å-2 ; ro, Å
Four-body
k 1 + cos( n o ) k, eV ; o , derajat
Ryckaert-Bellemans kn(cos )n kn , eV
r adalah jarak antara dua atom i dan j, ijk adalah sudut antara dua vektor interatomik i-j dan j-k dan ijkl sudut distorsi antara bidang ijk dan jkl
18
Bab III Metodologi Penelitian
III.1 Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Anorganik, Program Studi Kimia, Institut Teknologi Bandung.
III.2 Alat dan Bahan
III.2.1 Sintesis
Peralatan yang digunakan dalam penelitian ini adalah mortar dan pestel agate, neraca analitis, krus alumina yang inert terhadap pereaksi dan tahan terhadap suhu yang tinggi, tungku (furnace) daerah kerja suhu sampai 1150ºC tipe 48000 buatan Barnstead Thermolyne, difraktometer sinar-X (XRD) dengan panjang gelombang CuKα tipe PW1710 (Philips Analytical X-Ray B.V.) atau tipe X'Pert High Score (PANalytical B.V., 2005), dan Magnetic Susceptibility Balance (MSB) (Sherwood Scientific, 1992).
Bahan-bahan yang digunakan dalam penelitian ini adalah stronsium karbonat (SrCO3) (Aldrich, 99,9%), bismut oksida (Bi2O3) (Aldrich, 99,999%), titanium oksida (TiO2) (BDH Chem. LTD, 99,9%), besi oksida (Fe2O3) (BDH Chem. LTD, 99,9%), dan timbal oksida (Pb2O3) (Aldrich, 99,9%), serta aseton p.a.
III.2.2 Perhitungan Energi Kisi
GULP merupakan suatu perangkat lunak yang menggunakan compiler Fortran 77 pada sistem operasi linux. Optimasi ditulis dalam bentuk kode untuk membuat lebih efisien dan memberikan tingkat kecepatan lebih dari 50% tergantung bagaimana kode optimasi diberikan.
19
Untuk melakukan simulasi dengan perangkat lunak GULP dilakukan pengumpulan data difraksi sinar-X, dan harga potensial energi dari masing-masing atom/unsur. Parameter potensial interatomik yang digunakan dalam simulasi terlihat dalam Tabel III.1.
Tabel III.1 Potensial Interatomik untuk Oksida Aurivillius. a) Short-range A (eV) (Å) C (eV Å6)
Ba2+... Ba2+ 2663,7 0,3428 0,0 Ba2+... O2- 2096,8 0,3522 0,0 Sr2+... O2- 957,1 0,3721 0,0 Ca2+… O2- 1614,6 0,2981 0,0 Bi3+... Bi3+ 24244,50 0,3284 0,0 Bi3+... O2- 49529,35 0,2223 0,0 La3+...O2- 5436,827 0,2939 0,0 Ti4+… O2- 760,47 0,3789 0,0 Mo4+ ...O2- 1223,97 0,3470 0,0 Nb5+... O2- 1796,30 0,34598 0,0 Ta5+... O2- 1315,57 0,36905 0,0 W5+... O2- 767,43 0,4386 0,0 O2-… O2- 9547,96 0,2192 32,0 b) Shell model
Species K (eV Å2) Shell (e)
Ba2+ 29,1 1,848 Sr2+ 71,7 3,251 Ca2+ 34,05 1,281 Bi3+ 359,55 -5,51 La3+ 173,90 -2,149 Ti4+ 39,5 2,89 Mo4+ 0 4,00 Nb5+ 1358,58 -4,497 Ta5+ 5916,77 -4,596 W5+ 7,69 5,89 O2- 6,3 -2,04
20
III.3 Prosedur Kerja
Penelitian ini terdiri dua tahapan kerja yang berbeda yaitu: (1) tahapan sintesis Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 dengan x = 0,25; 0,5; 0,75 dan 1 serta sintesis Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 melalui reaksi kimia padat dan karakterisasinya, serta (2) simulasi atomik beberapa oksida Aurivillius seperti Bi2Mo0,25W0,75O6 (Castro, et. al., 2003), Bi2+xLaxTiNbO9 (x = 0–1) (Nalini, et. al., 2003), ABi2Ta2O9 (A = Sr, Ba, Ca) (Marquart, et. al., 2001), AxSr2-xBi2Nb2TiO12 (A = Ba, Ca; dan x = 0; 0,5) (Haluska dan Misture, 2004), Bi5Ti1,5W1,5O15 (Tellier, et. al., 2005), dan penentuan energi kisi dengan menggunakan persamaan Yoder Flora. Hasil dari simulasi ini kemudian dibandingkan dengan energi kisi persamaan sederhana Yoder Flora. Penentuan energi kisi dengan persamaan Yoder-Flora berdasarkan anggapan bahwa energi kisi adalah gabungan energi kisi komponen garam-garam tunggalnya (dapat dilihat pada Lampiran C), yaitu dengan menggunakan persamaan:
Energi Kisi Garam Rangkap = Jumlah Energi Kisi Garam Sederhana
Energi Kisi AxByOz = Energi Kisi AxOm + Energi Kisi ByOn (z = m + n) (III.1) Contoh:
Energi Kisi BaBi2Ta2O9 = Energi Kisi (BaO + Ta2O5 +Bi2O3)
= {(-3054) + (-40496,971) + (-14610,566)} kJ/mol = -58161,537 kJ/mol
III.3.1 Sintesis Oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 dengan x = 0,25; 0,5; 0,75 dan 1, serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 melalui reaksi kimia padat
Pereaksi ditimbang dengan jumlah tertentu (seperti yang dirangkum dalam Tabel III.2) sesuai dengan perbandingan stokiometri material yang akan disintesis. Campuran pereaksi ditambahkan aseton p.a., kemudian digerus dengan menggunakan mortar dan pestel untuk memperkecil ukuran partikel agar mudah berinteraksi. Campuran yang sudah homogen kemudian dimasukkan ke dalam krus alumina dan dibakar dalam tungku pada suhu 800, 950 dan 1100 oC untuk
21
Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18, sedangkan Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 dibakar dalam tungku pada suhu 800, 950 dan 1000 C secara bertahap selama masing-masing 24 jam. Penggerusan ulang dilakukan setelah sampel selesai didinginkan di akhir tiap tahap pembakaran.
Tabel III.2 Data Jumlah Pereaksi untuk Sintesis Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6O24 Oksida Target SrCO3 (g) Bi2O3 (g) TiO2 (g) Fe2O3 (g) Sr2Bi4Ti4Fe1O18 0,1909 0,6026 0,2066 0,0516 Sr2Bi4Ti4,25Fe0,75O18 0,1912 0,6034 0,2198 0,0388 Sr2Bi4Ti4,5Fe0,5O18 0,1914 0,6042 0,2330 0,0259 Sr2Bi4Ti4,75Fe0,25O18 0,1917 0,6050 0,2463 0,0130 Sr2,5Bi4Ti4Fe1O18 0,2310 0,5870 0,2012 0,0503 Sr2,25Bi4Ti4,25Fe0,75O18 0,2221 0,5917 0,2156 0,0380 Sr2,125Bi4Ti4,5Fe0,5O18 0,2112 0,5965 0,2301 0,0256 Sr2,0625Bi4Ti4,75Fe0,25O18 0,2011 0,6015 0,2450 0,0129 Oksida Target PbO (g) Bi2O3 (g) TiO2 (g) Fe2O3 (g) Pb2Bi5Ti5FeO21 0,2135 1,1144 0,1911 0,0764 Pb3Bi5Ti6FeO24 0,2797 0,9733 0,2002 0,0667
III.3.2 Difraksi Sinar-X serbuk
Produk hasil sintesis Sr2Bi4Ti5-xFexO18 dengan x = 0,25; 0,5; 0,75 dan 1 dikarakterisasi menggunakan difraksi sinar-X serbuk, yang terdapat di Program Studi Teknik Pertambangan ITB Bandung, dengan sumber radiasi Cu – Kα. Difraksi dilakukan pada sudut 2θ antara 10o – 90o dengan interval kenaikan sudut sebesar 0,02o. Produk hasil sintesis Sr2+0,5xBi4Ti5-xFexO18 dengan x = 0,25; 0,5; 0,75 dan 1 dikarakterisasi dengan menggunakan difraksi sinar-X serbuk yang terdapat di Sydney University Australia, dengan sumber radiasi Cu – Kα. Difraksi dilakukan pada sudut 2θ antara 10o sampai 90o dengan interval kenaikan sudut sebesar 0,06o. Sedangkan Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 dikarakterisasi menggunakan difraksi sinar-X serbuk, yang terdapat di Laboratorium Geologi Pusat Penelitian dan Pengembangan Geologi Kelautan Bandung, dengan sumber
22
radiasi Cu – Kα. Difraksi dilakukan pada sudut 2θ antara 10o sampai 90o dengan interval kenaikan sudut sebesar 0,017o. Pola difraksi yang diperoleh kemudian dianalisis dengan menggunakan metode Le Bail pada program komputer Rietica.
III.3.3 Pengukuran Sifat Magnetik
Sifat magnetik diukur dengan menggunakan alat Magnetic Susceptibility Balance (MSB) atau neraca kerentanan magnet menggunakan metode Gouy. Tabung MSB kosong ditimbang (data Mo dalam g), dimasukkan dalam medan magnet pada alat MSB, dibaca kerentanan magnetnya (data Ro). Tabung MSB kemudian dikeluarkan dan diisi sampel dengan ketinggian antara 1,5 - 3,0 cm (data L), kemudian ditimbang (data M dalam gram). Kerentanan magnet sampel diukur dan dicatat (data R). Dilakukan juga pengukuran suhu (data T dalam K). Momen magnet efektif oksida Aurivillius dapat dihitung dengan rumus:
= 2,828 (Mcorr . T)1/2 (III.2)
Mcorr adalah kerentanan magnet molar yang telah dikoreksi terhadap sifat
diamagnetik:
Mcorr = M - D (III.3)
dimana M = kerentanan magnet molar
D = koreksi diamagnetik
23
Bab IV Hasil Dan Pembahasan
Pada bab ini diberikan penjelasan mengenai hasil sintesis oksida Aurivillius yang dikarakterisasi dengan difraksi sinar-X dan dianalisis dengan menggunakan metode Le Bail pada program komputer Rietica, serta sifat magnetnya yang diukur dengan menggunakan neraca kerentanan magnet. Hasil simulasi atomik menggunakan software GULP beserta penentuan energi kisi dengan persamaan sederhana dibahas di bagian akhir.
IV.1 Sintesis
Pada penelitian ini dicoba sintesis oksida Aurivillius dengan komposisi Sr2Bi4Ti5-xFexO18 (x = 0,25–1) yaitu Sr2Bi4Ti4,75Fe0,25O18, Sr2Bi4Ti4,5Fe0,5O18, Sr2Bi4Ti4,25Fe0,75O18, Sr2Bi4Ti4FeO18, dan Sr2+0.5xBi4Ti5-xFexO18 (x = 0,25–1) yaitu Sr2,125Bi4Ti4,75Fe0,25O18, Sr2,25Bi4Ti4,5Fe0,5O18, Sr2,375Bi4Ti4,25Fe0,75O18, Sr2,5Bi4Ti4FeO18, serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24. Oksida-oksida Aurivillius ini dikarakterisasi dengan menggunakan difraksi sinar-X serbuk, menggunakan radiasi CuK. Pola difraksi sinar-X oksida Aurivillius yang disintesis, menunjukkan pola difraksi khas oksida Aurivillius.
IV.1.1 Penghalusan Struktur (Refinement)
Refinement yang dilakukan untuk oksida lapis lima menggunakan data parameter sel dari oksida Aurivillius lapis lima A2Bi4Ti5Ol8 (A = Ca, Sr, Ba dan Pb) yang memiliki struktur ortorombik dan grup ruang B2cb (Ismunandar et. al., 2004). Sedangkan untuk lapis enam dan tujuh digunakan data struktur dari Pb4Bi4Ti7O27 (PDF Nomor 34-1312).
24
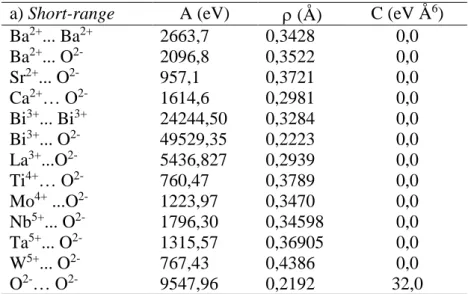
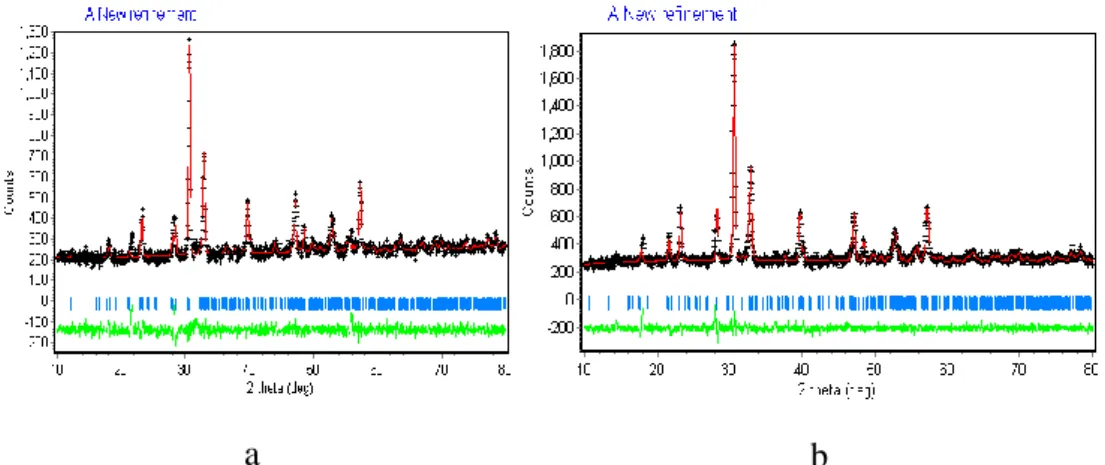
Gambar IV.1 Plot Le Bail oksida Sr2Bi4Ti5-xFexO18 (x = 0,25–1)
(a) Sr2Bi4Ti4 , 7 5Fe0 , 2 5O1 8, (b) Sr2Bi4Ti4 , 5Fe0 , 5O1 8, (c) Sr2Bi4Ti4,25Fe0,75O18, dan (d) Sr2Bi4Ti4FeO18. Tanda + yang
berwarna hitam merupakan data pengamatan hasil difraksi sinar-X, garis merah adalah hasil kalkulasi, garis vertikal warna biru adalah posisi Bragg yang diharapkan, garis hijau adalah perbedaan antara hasil kalkulasi dan data pengamatan difraksi sinar-X (perbedaan antara tanda + berwarna hitam dan garis merah)
Hasil refinement dengan metode Le Bail terhadap data difraksi sinar-X untuk oksida Sr2Bi4Ti5-xFexO18 pada rentang 2θ antara 15° – 80° dan untuk oksida Sr2+0.5xBi4Ti5-xFexO18 pada rentang 2θ antara 10° – 80° dalam sistem kristal ortorombik grup ruang B2cb dan Z = 4, menunjukkan kecocokan antara data hasil difraksi sinar-X (titik hitam) dan kalkulasi (garis merah) dimana titik-titik difraksi terjangkau oleh garis kalkulasi dan perbedaan keduanya sangat kecil (garis hijau yang mendatar), yang ditunjukkan pada Gambar IV.1 dan Gambar IV.2. Hasil refinement diperoleh nilai Rp, Rwp dan χ yang berada pada rentang yang masih
a b
25
dapat diterima untuk suatu proses refinement. Dengan demikian terdapat kesesuaian antara struktur oksida hasil sintesis ini dengan struktur oksida acuan.
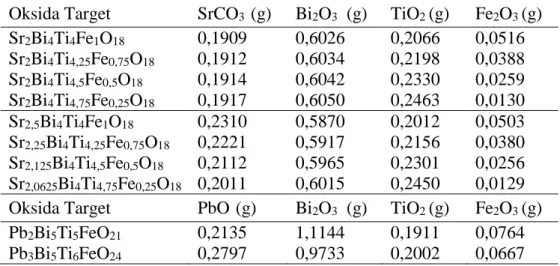
Gambar IV.2 Plot Le Bail oksida Sr2 + 0 . 5 xBi4Ti5 - xFexO1 8 (x = 0,25–1) (a) Sr2 , 1 2 5Bi4Ti4 , 7 5Fe0 , 2 5O1 8, (b) Sr2 , 3 5Bi4Ti4 , 5Fe0 , 5O1 8, (c) Sr2,35Bi4Ti4,25Fe0,75O18, dan (d) Sr2,5Bi4Ti4FeO18. Format yang sama seperti dalam gambar IV.1 digunakan di sini.
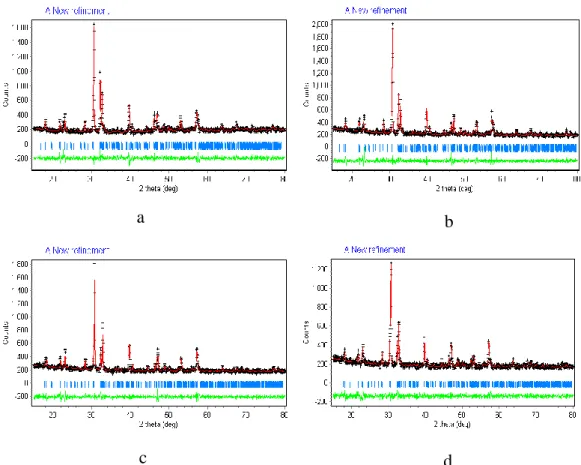
Hasil refinement dengan metode Le Bail terhadap data difraksi sinar-X oksida Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24 pada rentang 2θ antara 10° – 80° dalam sistem kristal ortorombik dan tetragonal dengan grup ruang A21am, Z = 4 dan
I4/mmm, Z = 2 menunjukkan kecocokan antara data hasil difraksi sinar-X dan kalkulasi dimana titik-titik difraksi terjangkau oleh garis kalkulasi, yang ditunjukkan pada Gambar IV.3. Hasil refinement diperoleh nilai Rp, Rwp dan χ yang berada pada rentang yang masih dapat diterima untuk suatu refinement.
a b
26
Dengan demikian terdapat kesesuaian antara struktur oksida hasil sintesis ini dengan struktur oksida acuan.
Gambar IV.3 Plot Le Bail Oksida (a) Pb2Bi5Ti5FeO21 dan (b) Pb3Bi5Ti6FeO24. Format yang sama seperti dalam gambar IV.1 digunakan di sini.
Parameter sel senyawa hasil refinement sesuai dengan data model acuan dapat dilihat pada Tabel IV.1, Tabel IV.2, dan Tabel IV.3.
Tabel IV.1 Parameter sel Oksida Aurivillius Sr2Bi4Ti5-xFexO18.
Parameter Sel SBT SBTF-1 SBTF-2 SBTF-3 SBTF-4 Sistem Kristal Ortorombik Ortorombik Ortorombik Ortorombik Ortorombik
Grup ruang B2cb B2cb B2cb B2cb B2cb a (Å) 5,4647(2) 5,542(8) 5,565(5) 5,596(3) 5,623(6) b (Å) 5,4625(2) 5,474(9) 5,491(9) 5,518(5) 5,534(4) c (Å) 48,8515(7) 48,947(1) 49,097(1) 49,332(6) 49,510(30) V (Å3) 1458,23(7) 1485,39(50) 1501,82(20) 1523,53(46) 1537,13(83) Rp (%) 4,67 5,48 5,86 5,710 6,063 Rwp (%) 6,06 7,18 7,69 7,633 8,718 χ2 1,43 0,245 0,348 0,343 0,348 Z 4 4 4 4 4 Keterangan: SBT = Sr2Bi4Ti5O18, SBTF-1 = Sr2Bi4Ti4,75Fe0,25O18, SBTF-2 = Sr2Bi4Ti4,5Fe0,5O18, SBTF-3 = Sr2Bi4Ti4,25Fe0,75O18, dan SBTF-4 = Sr2Bi4Ti4FeO18. a b
27
Tabel IV.2 Parameter sel Oksida Aurivillius Sr2+0,5xBi4Ti5-xFexO18.
Parameter Sel SBT SBTF-5 SBTF-6 SBTF-7 SBTF-8 Sistem Kristal Ortorombik Ortorombik Ortorombik Ortorombik Ortorombik
Grup ruang B2cb B2cb B2cb B2cb B2cb a (Å) 5,4647(2) 5,545(5) 5,563(7) 5,623(6) 5,644(2) b (Å) 5,4625(2) 5,479(1) 5,491(2) 5,527(1) 5,5469(8) c (Å) 48,8515(7) 48,908(4) 48,989(6) 49,343(6) 49,530(6) V (Å3) 1458,23(7) 1486,04(99) 1496,70(61) 1533,69(10) 1550,40(99) Rp (%) 4,67 11,112 12,132 12,611 11,609 Rwp (%) 6,06 9,521 11,959 11,754 11,278 χ2 1,43 1,209 1,251 0.973 0,303 Z 4 4 4 4 4 Keterangan: SBT = Sr2Bi4Ti5O18, SBTF-5 = Sr2,5Bi4Ti4FeO18, SBTF-6 = Sr2,35Bi4Ti4,25Fe0,75O18, SBTF-7 = Sr2,35Bi4Ti4,5Fe0,5O18, dan SBTF-8 = Sr2,125Bi4Ti4,75Fe0,25O18.
Tabel IV.3 Parameter sel Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24. Parameter Sel Pb2Bi5Ti5FeO21 Pb3Bi5Ti6FeO24 Sistem Kristal Ortorombik Tetragonal
Grup ruang A21am I4/mmm
a (Å) 5,421(8) 3,882(1) b (Å) 5,561(3) 3,882(1) c (Å) 58,600(5) 65,879(4) V (Å3) 1765,47(85) 992,84(87) Rp (%) 5,173 4,706 Rwp (%) 7,790 7,121 χ2 0,451 0,644 Z 4 2
Aluran parameter sel a, b, c dan volume sel satuan sebagai fungsi x diberikan di gambar IV.4 dan gambar IV.5. Terlihat bahwa meningkatnya jumlah kation Fe yang menggantikan kation Ti, diikuti dengan peningkatan volume sel satuan dari oksida tersebut, dengan peningkatan yang hampir linear. Hal ini sesuai dengan yang diharapkan, karena jari-jari ionik Ti4+ lebih kecil daripada Fe3+, dalam koordinasi oktahedral jari-jari ionik Ti4+ (0,605 Å) sedang Fe3+ (0,645 Å). Besar kemungkinan substitusi yang terjadi adalah random, seperti terlihat dari keseragaman peningkatan parameter a, b, c.
28 1450 1470 1490 1510 1530 1550 0 0,25 0,5 0,75 1 x (mol) V o lu m e S e l (Å 3 )
Gambar IV.4 Hubungan antara nilai x kation Fe dengan volume sel satuan pada oksida Aurivillius Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18 oksida Aurivillius Sr2Bi4Ti5-xFexO18, oksida Aurivillius Sr2+0,5xBi4Ti5-xFexO18 5,45 5,5 5,55 5,6 5,65 5,7 0 0,25 0,5 0,75 1 x (mol) a ( Å ) 5,45 5,47 5,49 5,51 5,53 5,55 0 0,25 0,5 0,75 1 x (mol) b ( Å ) 48,8 49 49,2 49,4 49,6 0 0,25 0,5 0,75 1 x (mol) c (Å)
Gambar IV.5 Hubungan antara x kation Fe dengan nilai parameter sel a, b dan c pada oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0,5xBi4Ti5-xFexO18.
29
Dari hasil plot Le Bail dan volume sel satuan tersebut terlihat bahwa pada sintesis oksida target Sr2+0,5xBi4Ti5-xFexO18 dan Sr2Bi4Ti5-xFexO18 kemungkinan besar dihasilkan oksida yang sama. Rumus tepat oksida ini harus ditentukan lebih lanjut, mengingat kemungkinan adanya defek. Keberadaan defek oksigen tidak dapat ditentukan dari data difraksi sinar-X, karena pada difraksi sinar-X tidak dapat memberikan intensitas yang berarti bagi atom oksigen karena banyaknya atom berat pada oksida tersebut. Hal ini dapat dijelaskan lebih lanjut jika dengan menggunakan data difraksi neutron. Hal ini disarankan untuk dilakukan di penelitian selanjutnya.
IV.1.2 Sifat Magnet
Hasil perhitungan momen magnet pada oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0.5xBi4Ti5-xFexO18 serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6O24 dapat dilihat pada Tabel IV.4, sedangkan data perhitungan dari momen magnet tersebut dapat dilihat pada lampiran A.
Tabel IV.4 Momen magnet (μ) oksida Sr2Bi4Ti5-xFexO18 dan Sr2+0.5xBi4Ti5-xFexO18 serta Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6O24 pada
temperatur ruang.
Oksida μhit. (BM) μeksp. (BM)
Sr2Bi4Ti4FeO18 5,92 4,66 Sr2Bi4Ti4,25Fe0,75O18 4,44 4,04 Sr2Bi4Ti4,5Fe0,5O18 2,96 3,30 Sr2Bi4Ti4,75Fe0,25O18 1,48 2,77 Sr2,5Bi4Ti4FeO18 5,92 5,37 Sr2,35Bi4Ti4,25Fe0,75O18 4,44 4,41 Sr2,25Bi4Ti4,5Fe0,5O18 2,96 3,70 Sr2,125Bi4Ti4,75Fe0,25O18 1,48 2,79 Pb2Bi5Ti5FeO21 5,92 4,50 Pb3Bi5Ti6FeO24 5,92 5,05
30
Dari hasil nilai momen magnet tersebut, ternyata perhitungan nilai momen magnet untuk senyawa ini hanya memperhatikan keadaan spin saja tidak cocok dengan hasil eksperimen, ini berarti bahwa perhitungan momen magnet tidak hanya dari spin saja, karena perhitungan momen magnet berdasarkan spin saja, tanpa melihat adanya interaksi dari atom-atom tersebut. Secara teoritis diperoleh nilai Kemagnetan untuk kation Fe3+ adalah 5,92 BM, merupakan nilai teoritis untuk kation Fe3+ dalam keadaan tanpa adanya interaksi dari atom lain (Cotton dan Wilkinson, 1972). Hasil perhitungan momen magnet yang diperoleh untuk oksida Aurivillius terdapat perbedaan nilai antara perhitungan dan pengamatan, ini diduga terdapat interaksi antara kation dan anion pada oksida Aurivillius yang disintesis, sehingga diperoleh nilai yang berbeda antara teoritis dan hasil pengamatan. Untuk menentukan interaksi magnetik dari oksida Aurivillius ini, tidak dapat dijelaskan dengan menggunakan data dari neraca kerentanan magnetik.
IV.2 Simulasi Atomik
Metode simulasi atomik dalam menentukan konfigurasi energi terendah pada struktur kristal menggunakan proses minimalisasi energi. Perhitungan dilakukan secara spesifik pada model potensial interatomik, yang memperlihatkan fungsi energi total sistem koordinat inti.
Energi kisi yang dihitung menggunakan software GULP dihitung dengan menggunakan input data parameter struktur oksida dan potensial interatomiknya. Hasil perhitungan energi kisi dan parameter sel hasil simulasi dan hasil difraksi sinar-X oksida Aurivillius ditunjukkan dalam Tabel IV.5.
Pada Tabel IV.5 (lebih lengkapnya untuk semua oksida yang disimulasi dapat dilihat pada Tabel B.1 Lampiran B) terlihat bahwa selisih nilai parameter sel hasil studi difraksi sinar-X dengan perhitungan simulasi GULP sangat kecil, kurang dari 0,03%. Hal ini menunjukkan adanya kesesuaian antara parameter sel satuan
31
hasil difraksi sinar-X dan simulasi atomik, sehingga simulasi atomik dapat digunakan untuk meramalkan struktur oksida Aurivillius.
Tabel IV.5 Parameter struktur hasil simulasi dan eksperimen untuk beberapa oksida Aurivillius.
Parameter Simulasi Eksperimen Perbedaan %
Bi2Mo0,25W0,75O6
a (Å) 5,445652 5,44547(7) 0,00
b (Å) 16,370665 16,3731(2) -0,01
c (Å) 5,466733 5,46659(7) 0,00
= = (°) 90 90 0,00
Energi Kisi (kJ/mol) -66975,54973 Bi2,6La0,4TiNbO9
a (Å) 5,440095 5,4392(2) 0,02
b (Å) 5,415222 5,4145(2) 0,01
c (Å) 25,067332 25,0705(11) -0,01
= = (º) 90 90 0,00
Energi Kisi (kJ/mol) -54488.3224 Bi3TiNbO9
a (Å) 5,424028 5,4248(2) -0,01
b (Å) 5,385471 5,3864(2) -0,02
c (Å) 25,040667 25,0392(9) 0,01
= = (º) 90 90 0,00
Energi Kisi (kJ/mol) -53898.7954
IV.3 Penentuan Energi Kisi dengan Persamaan Yoder-Flora
Penentuan energi kisi dengan persamaan Yoder-Flora (Yoder-Flora, 2005) berdasarkan anggapan bahwa energi kisi adalah gabungan energi kisi komponen garam-garam tunggalnya. Pada penentuan energi kisi dengan menggunakan persamaan ini adalah merupakan gabungan dari persamaan energi kisi siklus Born-Haber dan persamaan Kapustinskii. Tabulasi hasil perhitungan energi kisi beberapa oksida Aurivillius dengan menggunakan pendekatan persamaan Yoder-Flora dan hasil simulasi serta perbedaan keduanya dapat dilihat dalam Tabel IV.6.
32
Tabel IV.6 Perbandingan energi kisi hasil perhitungan energi kisi simulasi atomik dan persamaan sederhana
Oksida Aurivillius Energi Kisi (kJ/mol) %
Perbedaan Persamaan Yoder Flora Simulasi Atomik
Bi2Mo0.25W0.75O6 -71310,44039 -66975,54973 6,08 Bi2.2La0.8TiNbO9 -53450,90811 -53475,16288 -0,05 Bi2.4La0.6TiNbO9 -53666,76473 -53126,72468 1,01 Bi2.6La0.4TiNbO9 -53882,62135 -54488,32243 -1,12 Bi2.8La0.2TiNbO9 -54098,47797 -57241,22705 -5,81 Bi3TiNbO9 -54314,3346 -53898,7954 0,77 BaBi2Ta2O9 -58161,53674 -54781,4922 5,81 SrBi2Ta2O9 -58330,53674 -55701,1903 4,51 CaBi2Ta2O9 -58508,53674 -56094,1318 4,13 Bi2SrCaNb2TiO12 -73881,5367 -72995,4434 1,20 Bi2Sr1.5Ca0.5Nb2TiO12 -73792,5367 -73115,7988 0,92 Bi2Sr2Nb2TiO12 -73703,5367 -74761,1932 -1,44 Bi2Sr1.5Ba0.5Nb2TiO12 -73610,0367 -72523,8193 1,48 Bi2SrBaNb2TiO12 -73528,5367 -70464,341 4,17 Bi5Ti1.5W1.5O15 -97223,90506 -92931,96043 4,41
Pada Tabel IV.6 terlihat bahwa selisih nilai antara energi kisi dengan menggunakan simulasi atomik dan persamaan sederhana Yoder Flora, memiliki selisih dengan rentang yang masih dapat diterima yaitu sekitar 6%. Hal ini sama seperti yang telah diperoleh oleh peneliti sebelumnya pada sistem yang berbeda, yakni piroklor (Suhendar dan Ismunandar, 2006 dan Wirasmi dan Ismunandar, 2006), perovskit (Tehubijuluw, 2006).
33
Bab V Kesimpulan
Kesimpulan yang dapat diambil berdasarkan hasil penelitian ini adalah:
1. Oksida Aurivillius lapis lima yang berhasil disintesis adalah Sr2Bi4Ti5-xFexO18 (x = 0,25 – 1) yaitu Sr2Bi4Ti4,75Fe0,25O18, Sr2Bi4Ti4,5Fe0,5O18,
Sr2Bi4Ti4,25Fe0,75O18, dan Sr2Bi4Ti4FeO18 serta Sr2+0.5xBi4Ti5-xFexO18 (x = 0,25 – 1) yaitu Sr2,125Bi4Ti4,75Fe0,25O18, Sr2,25Bi4Ti4,5Fe0,5O18,
Sr2,375Bi4Ti4,25Fe0,75O18, dan Sr2,5Bi4Ti4FeO18. Rumus tepat oksida ini masih harus ditentukan lebih lanjut. Oksida Aurivillius ini memiliki struktur ortorombik dengan grup ruang B2cb dan Z = 4. Oksida Aurivillius ini berada pada keadaan spin tinggi.
2. Oksida Aurivillius lapis enam dan tujuh yang berhasil disintesis adalah Pb2Bi5Ti5FeO21 dan Pb3Bi5Ti6FeO24. Oksida ini memiliki struktur tetragonal dan ortorombik dengan grup ruang A21am, Z = 4 dan I4/mmm, Z = 2 dengan
parameter kisi a = 5,421(8), b = 5,561(3) dan c = 58,600(5) untuk Pb2Bi5Ti5FeO21 serta a = 3,882(1) dan c = 65,879(4) untuk Pb3Bi5Ti6FeO24. Oksida Aurivillius ini berada pada keadaan spin tinggi
3. Perhitungan energi kisi dengan menggunakan simulasi atomik untuk oksida Aurivillius Bi2Mo0,25W0,75O6; Bi2+xLaxTiNbO9 (x = 0–1), ABi2Ta2O9 (A = Sr, Ba, Ca); AxSr2-xBi2Nb2TiO12 (A = Ba, Ca; dan x = 0; 0,5); dan Bi5Ti1,5W1,5O15 diperoleh nilai energi kisi antara –53000 sampai –93000 kJ/mol.
4. Perhitungan energi kisi dengan menggunakan persamaan Yoder Flora dapat digunakan untuk menghitung energi kisi oksida Aurivillius.
34
DAFTAR PUSTAKA
Aziz A. (2006). Sintesis dan Karakterisasi Fasa Aurivillius Sr2Bi4Ti5-xMnxO18
(x = 0,25; 0,5; 0,75; dan 1), dan SrBi5Ti4MO18 (M = Fe atau Ni). Tesis Magister.
Institut Teknologi Bandung.
Borg S., Svensson G. (2001). Crystal Structure of Bi2.5Me0.5Nb2O9 (Me = Na, K): A Powder Neutron Diffraction Study. J. Solid State Chem. 157, 160 – 165.
Castro, A., Bégué, P., Jiménez, B., Ricote, J., Jiménez, R., and Galy,. (2003). New Bi2Mo1-xWxO6 Solid Solution: Mechanosynthesis, Structural Study and Ferroelectric Properties of the x = 0.75 Member. J. Chem. Mater. 15, 3395 – 3401.
Cotton, F.A., dan Wilkinson, G., (1972). Advanced Inorganic Chemistry. A Comprehensive Text. 3rd Ed. Interscience Publishers. New York.
Dann, S.E., (2000). Reaction and Characterization of Solids. Royal Society of Chemistry. United Kingdom.
Digamber, G.P., Maggard, P.A., (2006). Synthesis of Textures Bi5Ti3FeO15 and LaBi4Ti3FeO15 Ferroelectric Layered Aurivillius Phases by Molten-salts Flux Methods. Mater. Res Bull. 41, 1513 – 1519.
Ferrer P., Iglesias J.E., Castro A. (2004). Synthesis of the Aurivillius Phase SrBi4Ti4O15 by a Mechanochemical Activation Route. Chem. Mater. 16, 1323 – 1329.
Ferrer P., Iglesias J.E., Ayala A.P., Guedes I., Castro A. (2005). Study of the Aurivillius Phases Bi4Srn-3TinO3n+3 (n = 4, 5) synthesized by mechanochemical activation. Solid State Commun. 136, 621 – 626.
Fuentes, L., Garcia, M., Bueno, D. Fuentes, M.E. and Munoz, A., (2006). Magnetoelectric Effect in Bi5Ti3FeO15 Ceramics Obtained by Molten Salts Synthesis. Ferroelectrics. 336, 81 – 89.
Gale, J.D., (1997). GULP: A Computer Program for the Symmetry-Adapted Simulation of Solids. J. Chem. Soc., Faraday Trans. 93, 629 – 637.
Haluska, M.S. and Misture, S.T., (2004). Crystal Structure Refinements of the Three-Layer Aurivillius Ceramics Bi2Sr2-xAxNb2TiO12 (A = Ca, Ba, x = 0, 0.5, 1) using Combined X-ray and Neutron Powder Diffraction. J. Solid State Chem. 177, 1965 – 1975.
Hervoches, C.H., Snedden, A., Riggs, R., Kicoyne, S.H., Manuel, P., and Lightfoot, P., (2002). Structural Behavior of the Four-Layer Aurivillius-Phase Ferroelectrics SrBi4Ti4O15 and Bi5Ti3FeO15. J. Solid State Chem. 164, 280 – 291.