SECARA IN VITRO
SKRIPSI
Oleh :
SUPRIYONO NPM : 0625010039
PROGRAM STUDI AGROTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS PEMBANGUNAN NASIONAL “VETERAN”
JAWA TIMUR
DAFTAR ISI
II. TINJAUAN PUSTAKA A. Penyakit Layu Bakteri Pada Tanaman Solanaceae ……….……… 4
1. Arti penting penyakit layu bakteri ………. 4
2. Gejala penyakit layu bakteri ………..… 4
3. Penyebab layu bakteri ……….... 6
4. Pengendalian penyakit layu bakteri ………... 8
a. Pengendalian Hayati ……….. 9
b. Pengendalian dengan menggunakan Pseuodomonad fluoresen ……… 10
c. Pengendalian dengan menggunakan Actinomycetes ……….…… 11
d. Pengendalian hayati dengan mengkombinasikan dua agensia hayati ………... 13
B. Hipotesis ………. 14
III. BAHAN DAN METODE A. Tempat dan Waktu Penelitian ………...…... 16
B. Bahan dan Alat ……….…... 15
C. Metode Penelitian ………... 15
D. Pelaksanaan Penelitian ……….. ... 16
1. Isolasi bakteri R. solanaceae ………..…..………... 17
2. Uji antagonisme Pseudomonad flouresen terhadap R. solanaceae secara in vitro ... 17
3. Uji antagonisme Actinomycetes terhadap R. solanaceae secara in vitro ... 18
4. Mekanisme Penghambatan Actinomycetes ………....……. 18
5. Kompatibilitas antara pseudomonad fluoresen dan Actinomycetes ... 19
6. Uji Pengaruh Kombinasi Antara Pseudomonad fluoresen dan Actinomycetes yang kompatibel terhadap pertumbuhan R. Solanaceae ... 20
7. Analisis Data ……….……... 20
IV. HASIL DAN PEMBAHASAN 1. Gejala Penyakit Layu R. solanacearum Pada Tanaman Tomat di Lapang ………..…….. 22
2. Hasil isolasi bakteri R. solanaceae ……….. 24
a. Uji Gram Pada Bakteri R. solanacearum ……… 24
b. Uji Katalase Pada Bakteri R. solanacearum ………... 25
c. Uji Oksidase Pada Bakteri R. solanacearum ………... 26
3. Bakteri agensia hayati Pseudomonad fluoresen ………... 27
a. Uji Gram Pada Bakteri Pseudomonad fluoresen …………... 28
b. Uji Katalase Pada Bakteri Pseudomonad fluoresen …..…..…… 29
c. Uji Oksidase Pada Bakteri Pseudomonad fluoresen …….…... 30
v
4. Uji antagonis Pseudomonad fluoresen terhadap pertumbuhan
bakteri R. solanacearum ………..………... 31
5. Uji mekanisme penghambatan Pseudomonad fluoresen isolat Pf-122 dan Pseudomonad fluoresen isolat Pf-142 terhadap
R. solanacearum secara in vitro ……….. 34
a. Uji mekanisme penghambatan Pseudomonad fluoresen
isolat Pf-122 terhadap R. solanacearum ... 34
b. Uji mekanisme penghambatan Pseudomonad fluoresen
isolat Pf-142 terhadap R. solanacearum ……… 34
6. Bakteri agensia hayati Actinomycetes ………... 37
7. Uji antagonisme Actinomycetes Wajak dan Actinomycetes
Pare 8 terhadap R. solanacearum ...……….. 38
8. Uji kompatibilitas antara Pseudomonad fluoresen dengan
Actinomycetes ... 40
9. Uji pengaruh kombinasi antara Pseudomonad fluoresen dan Actinomycetes yang kompatibel terhadap pertumbuhan
R. solanacearum ... 41
V. KESIMPUAN DAN SARAN
A. Kesimpulan... 44
B. Saran ... 44
hidayahNya yang telah dilimpahkan sehingga penulis dapat menyelesaikan Skripsi,
dengan judul “Uji Kompatibilitas Dan Kemampuan Dua Agensia Hayati
Pseudomonad flouresen dan Actinomycetes Dalam Menghambat Pertumbuhan
Ralstonia solanacearum Secara In vitro” Penyusunan Skripsi ini merupakan salah
satu syarat dalam memenuhi sebagian persyaratan dalam memperoleh gelar Sarjana
Pertanian Program Studi Agroteknologi di Fakultas Pertanian UPN “Veteran” Jawa
Timur.
Dengan disertai harapan semoga laporan dalam penyusunan Skripsi ini dapat
diterima, maka dalam kesempatan ini penulis menyampaikan terima kasih sebesar
besarnya kepada :
1. Ibu Dr. Ir. Yenny Wuryandari, MP, selaku dosen pembimbing utama.
2. Bapak Ir. Tri Mujoko, MP, selaku dosen pembimbing pendamping.
3. Kedua orang tua, saudara, Sena, teman dan segenap pihak yang telah membantu
terselesainya Skripsi ini.
4. Bapak Ir. Mulyadi, MS, selaku Ketua Prorgam Studi Ilmu Agrotekonologi
5. Bapak Dr. Ir. Ramdan Hidayat MS, selaku Dekan Fakultas Pertanian UPN
“Veteran” Jawa Timur Surabaya.
Penulis menyadari bahwa dalam penyusunan Skripsi ini masih jauh dari
sempurna, untuk itu penulis mengharapkan adanya kritik dan saran dari semua pihak
ii
Surabaya, Desember 2010
I. PENDAHULUAN
A. Latar Belakang
Tanaman dari famili Solanaceae merupakan tumbuhan yang memiliki nilai
ekonomi tinggi bagi manusia. Beberapa anggotanya seperti: tomat, cabai, serta
kentang memiliki nilai dagang yang tinggi dan menjadi bagian utama bahan
pangan manusia di berbagai belahan dunia. Jenis-jenisnya dimanfaatkan pula
sebagai tumbuhan model bagi penelitian serta tumbuhan industri.
Dalam budidaya tanaman Solanaceae sering dijumpai hambatan baik itu
dalam segi budidaya maupun dari segi pengendalian dari serangan hama dan
penyakit. Salah satunya yaitu penyakit layu bakteri yang merupakan penyakit
yang disebabkan oleh bakteri Ralstonia solanacearum (R. solanacearum) yang
sangat berpengaruh terhadap pertumbuhan dan perkembangan tanaman famili
Solanaceae sehingga sangat merugikan dalam hasil panen (Rao, 1976; Rukmana,
1997).
Selama ini pencegahan yang dilakukan selalu menuju ke pemberantasan
dengan pupuk dan bahan kimia yang sangat berdampak negatif dan berbahaya
pada lingkungan yang mana makin lama akan menjadikan lingkungan semakin
rusak. Maka dari itu dibutuhkan pencegahan secara hayati yang tidak
membahayakan bagi kehidupan manusia serta ramah lingkungan sehingga
lingkungan akan tetap lestari baik dimasa sekarang ataupun untuk masa yang akan
datang (Baker dan Cook, 1974). Penggunaan pestisida yang kurang bijaksana
seringkali menimbulkan masalah kesehatan, pencemaran lingkungan dan
pengendalian yang lebih ramah lingkungan semakin lebih besar untuk
menurunkan penggunaan pestisida sintetis (Suparyono, 1995; Reinjes et al, 1999).
Salah satu pencegahan penyakit layu bakteri yang disebabkan bakteri R.
solanacearum dengan cara biologi adalah dengan peran serta agensia hayati yang
menggunakan Pseudomonad fluoresen yang telah diteliti sebagai agen
pengendalian hayati penyakit tumbuhan khusunya jenis tanaman Solanaceae
(Hebbar et al. 1992; Weller 1983).
Dari 10 isolat Pseudomonad yang diuji daya hambatnya terhadap
perkembangan penyakit layu R. solanacearum di rumah kaca, menunjukkan hasil
yang bervariatif. Salah satunya adalah isolat Pseudomonad fluoresen isolat
Pf-122 yang mampu menghambat perkembangan penyakit layu bakteri yang
disebabkan oleh bakteri R. solanacearum yaitu dengan indeks penyakitnya hanya
49,9%, sehingga Pseudomonad fluoresen dapat menekan pertumbuhan R.
solanacearum sampai 51,1% (Wuryandari et al., 2005).
Untuk itu Agensia Hayati Pseuodomonad fluoresen perlu diadakan
penelitian atau percobaan lebih lanjut untuk menambah tingkat kemampuan
antibiotik terhadap penyakit layu bakteri pada tanaman jenis Solanaceae dengan
salah satu alternatifnya yaitu dengan mengkombinasikan agensi hayati yang lain.
Dari penelitian sebelumnya (Mujoko, 2005) menjelaskan bahwa salah satu isolat
Actinomycetes dapat menekan pertumbuhan Fusarium sampai dengan 100 %.
Agensia hayati Actinomycetes Adalah sebagai salah satu Agrobacterium yang
berperan dalam pengendalian hayati pada tanaman jenis Solanaceae (pada
tanaman lombok) untuk pengendalian penyakit layu Fusarium (Hasanuddin,
fluoresen yang dapat menekan pertumbuhan layu bakteri yang disebabkan oleh R.
solanacearum 60 % (Wuryandari, 2005) dengan Actinomycetes yang dapat
menekan pertumbuhan penyakit layu Fusarium sampai 60% pada tanaman tomat
(Mujoko, 2005) akan meningkatkan kemampuanya dalam menekan pertumbuhan
R. solanacearum secara in vitro.
B. Maksud dan Tujuan
Penelitian ini diharapkan dapat memberikan jawaban apakah agensia
hayati Psedoumonad fluoresen yang dikombinasikan dengan agensia hayati
Actinomycetes dapat ditingkatkan kemampuan agensia hayati Psedoumonad
fluoresen dalam menekan pertumbuhan R. solanacearum secara in vitro.
C. Rumusan Masalah
Berdasarkan latar belakang tersebut, dapat dirumuskan permasalahan yang terjadi
yaitu :
1. Apakah agensia hayati Actinomycetes dapat menekan pertumbuhan penyakit R.
solanacearum secara in vitro.
2. Apakah kemampuan antagonistik agensia hayati Pseuodomonad fluoresen
dalam menekan pertumbuhan penyakit R. solanacearum bisa ditingkatkan
II. TINJAUAN PUSTAKA
A. Penyakit Layu Bakteri Pada Tanaman Solanaceae 1. Arti Penting Penyakit Layu Bakteri
Penyakit pada tanaman Solanaceae sangat beragam. Dari beberapa
penyakit tersebut diantaranya adalah penyakit layu bakteri, penyakit tersebut
hingga saat ini, masih merupakan faktor pembatas produksi tanaman jenis
Solanaceae. Penyakit tersebut disebabkan oleh R. solanacearum yang bisa
menyerang pada lebih 200 jenis tanaman inang. Keragaman patogen yang
demikian luas menyebabkan penyakit layu bakteri sulit ditangani. Penyakit
tersebut mampu menyerang tanaman dengan intensitas hingga 35 % (Anonim,
2001).
Penyakit layu bakteri sulit ditangani karena pengelompokan patogen yang
rumit. Dengan sebaran inang yang luas maka penanganan penyakit yang menimpa
suatu tanaman belum tentu cocok diterapkan untuk tanaman lainnya. Selama ini
para peneliti menggunakan dua sistem berbeda dalam mengelompokan P.
solanacearum yakni sistem ras dan biovar (Suryadi, 1996).
2. Gejala Penyakit Layu Bakteri
Gejala awal adalah tanaman mulai layu. Kemudian menjalar ke daun
bagian bawah. Gejala lebih lanjut : seluruh tanaman layu, daum menguning
sampai coklat kehitam-hitaman, dan akhirnya tanaman mati. Serangan pada umbi
menimbulkan gejala dari luar tampak bercak-bercak kehitam-hitaman, terdapat
lelehan putih keruh (massa bakteri) yang keluar dari mata tunas atau ujung stolon.
bagian bawah menguning merupakan ciri khas gejala penyakit layu bakteri.
Meskipun tak sebanyak penyakit akibat jamur, namun secara umum penyakit
bakteri lebih sukar dikendalikan (Rukmana, 1997).
Berdasarkan inangnya ada lima kelompok R. solanacearum. Meskipun
inangnya sama sangat mungkin isolat patogennya berbeda. Sebagai contoh isolat
R. solanacearum asal jahe dan kacang tanah tidak patogenik terhadap kecipir atau
sebaliknya. Deteksi dan identifikasi patogen sangat diperlukan untuk mencegah
kerusakan tanaman akibat penyakit tersebut. Mengetahui sifat dan karakteristik
masing-masing isolat patogen akan mempermudah pengendalian penyakit layu
bakteri (Mahmud,1998).
Menurut Yadi (1996), ada beberapa cara untuk mendeteksi penyakit layu
bakteri. Belakangan ini dikenal dua teknik identifikasi baru berdasarkan reaksi
fisiologi atau biokimia yang dirakit menjadi sistem bactid dan biolog. Sistem
bactid digunakan untuk memudahkan mengeliminasi pencemar saprofit atau
mikroorganisme nonsasaran lainnya. Sedangkan sistem biolog mengelompokkan
berdasarkan taksa dan kemudian menelaah sifat dan karakteristik setiap taksa.
Cara lain yang juga banyak dikembangkan adalah dengan pengelompokan
berdasarkan karakteristik protein dan asam lemak yang dikandung masing-masing
isolat patogen.
Bakteri ini mempunyai banyak ras dan dapat diisolasi dengan baik pada
medium yang mengandung 2, 3, 5- trifenil-tetra sodium klorida (Medium TTK).
Infeksi terutama melalui luka pada bagian tanaman. Bakteri terangkut dalam
pembuluh kayu dan pada batang yang lunak, masuk dalam ruang antar sel dalam
yang relatif tinggi mendukung perkembangan penyakit. Di dataran rendah
penyakit timbul lebih berat karena suhu udara relatif tinggi. Bakteri berkembang
baik di tanah alkalis yang suhunya agak tinggi di saat banyak hujan. Intensitas
penyakit sangat dipengaruhi oleh tanaman terinfeksi pada musim sebelumnya.
Penyakit ini banyak dijumpai di Jawa, Sumatera dan Sulawesi khususnya di
Sulawesi Utara (Semangun, 1995).
Beberapa mekanisme kerusakan Ekstraseluler Polisakarida sebagai
penyebab layu antara lain: penyebaran patogen dalam xylem, pembentukan
senyawa ekstraseluler polisakarida hanya pada isolat yang virulen dan pemberian
dengan senyawa metabolit dari patogen pada tanaman. Aspek-aspek penyebab
layu adalah : pengaliran terbatas dan transportasi air ke daun menjadi terhambat,
viskositas cairan dalam jaringan pembuluh meningkat, terjadi penyumbatan
terhadap transport air, bagian yang paling kritis adalah tangkai dan tulang daun,
terjadinya kerusakan pada membran luar dan membran dalam dalam sel dan
keluarnya elektrolit dari dalam sel (Habazar dan Rivai, 2000).
3. Penyebab Penyakit Layu Bakteri
Klasifikasi bakteri R. solanacearum penyakit layu pada tanaman
Solanaceae menurut E.F. Smith dalam Buchman dan Gibbions (1974), Yabuuch,
et.al (1995) adalah :
Kingdom : Prokariotik
Divisio : Gracilicutes
Kelas : Schizomycetes
Ordo : Eubacteriales
Genus : Ralstonia
Spesies : Ralstonia solanacearum
R. solanacearum adalah bakteri aerobik, berbentuk batang, berukuran (0,5
– 1,0 x 1,5 – 2,5) µm, gram negatif, bergerak dengan satu flagel yang terletak
diujung sel. Umumnya isolat yang virulen memiliki flagella sedangkan isolat non
virulen flagelnya panjang (Goto, 1992). Bakteri ini diketahui mempunyai banyak
ras yang berbeda virulensinya. Ras 1 menyerang terung-terungan dan tanaman
lain, seperti tomat, tembakau, dan kacang tanah. Ras 2 menyerang pisang dan
Heliconia. Ras 3 khususnya menyerang tanaman kentang (Semangun, 1996).
Bakteri ini mampu menghidrolisa gelatin dan twin 80, mampu mereduksi nitrat,
dapat menghasilkan asam sukrosa, arginin, dehidrolase negatif, jumlah guanin,
dan sitosin dalam DNA 66-69%. Mengandung poly B-hidroksibutirat. Beberapa
strain dapat menghasilkan gas dan nitrat (Hayward, 1983).
Bakteri mempunyai generasi waktu yang sangat pendek pada keadaan
optimal < 20 menit. Selama pertumbuhan, bakteri dalam media cair akan
membentuk suspensi yang keruh sedangkan pada media padat akan membentuk
koloni yang bervariasi bergantung pada jenisnya (Habazar dan Rivai, 2000).
Strain virulen dengan koloni berlendir atau fluidal yang kemudian berubah
menjadi tidak virulen dengan koloni yang berbintik kecil-kecil, perbedaan bentuk
koloni dengan derajat virulensinya dihubungkan dengan produksi cairan yang
mengandung polisakarida. Pembentukan pigmen seringkali dihasilkan dalam
media yang mengandung tirosin (Hutagalung, 1984).
Virulensi merupakan kapasitas relatif patogen untuk merusak tanaman
menetukan kecepatan pertumbuhan dan penyebarannya pada inang dan
meningkatkan kerusakan pada jaringan tanaman. Faktor virulensi yang
disekresikan dapat berupa toksin termasuk Ekstraseluler Polisakarida, enzim, dan
hormon tumbuh yang menginduksi seperti jenis gejala seperti menguning, busuk
lunak, hiperplasia, nekrosis dan layu (Habazar dan Rivai, 2000).
Pada bakteri R. solanacearum, ekstraseluler Polisakarida sangat berperan
dalam patogenis, utamanya dalam menghambat translokasi unsur hara dan air,
juga menjadi pelindung bakteri dari keadaan yang ekstrim, dapat menetralisir
senyawa-senyawa yang dikeluarkan oleh tanaman (Wydra dan Rudolph, 1993).
4. Pengendalian Penyakit Layu Bakteri
Cara efektif untuk mengendalikan penyakit-penyakit bakteri yaitu dengan
penggunaan kultivar yang resisten atau toleran terhadap penyakit tersebut,
sertifikasi benih dan rotasi tanaman. Kultivar baru yang memiliki resistensi tinggi
terhadap serangan penyakit bisa diperoleh melalui persilangan konvesional dan
teknik rekayasa genetika. Tetapi kekuranganya teknik persilangan konvensional
terbentur pada masalah gen resisten. Umumnya pemuliaan mengambil gen-gen
resisten dari tanaman lain (Plantus, 2008).
a. Pengendalian Hayati
Pengendalian hayati adalah pengendalian dengan memanfaatkan musuh
alami untuk mengendalikan OPT termasuk memanipulasi inang, lingkungan atau
musuh alami itu sendiri. Pengendalian hayati memiliki arti khusus , karena pada
membahayakan kesehatan manusia maupun lingkungan dan tidak memerlukan
input luar. Pengendalian ini secara terpadu diharapkan dapat menciptakan kondisi
yang tidak mendukung bagi kehidupan organisme penyebab penyakit atau
mengganggu siklus hidupnya (Baker dan Cook, 1974; Reintjes et al. 1999).
Salah satu komponen utama dalam pengendalian terpadu penyakit adalah
dengan agensia hayati yang mana tidak berbahaya bagi manusia dan ramah
lingkungan. Teng (1990). Pemakaian agensia hayati atau organisme hidup untuk
memberantas organisme lain (Rao, 1994). Pengendalian Hayati adalah kegiatan
untuk menurunkan kepadatan pathogen atau parasit dalam kondisi aktif atau
kondisi dorman atau istirahat (Cook dan Baker, 1991).
Agensia pengendalian hayati penyakit tanaman adalah mikroorganisme
yang hidup dan diperoleh dari alam yang dapat berupa jamur, bakteri dan virus
yang dapat digunakan untuk menekan, menghambat dan memusnakan OPT
(Upadhyay, 1987).
Kelebihan pengendalian secara hayati adalah sebagai berikut: Ramah
lingkungan dan tidak membahayakan bagi manusia baik di masa sekarang ataupun
di masa yang akan datang, pengendalian akan mengenai sasaran dengan tepat
tanpa membahayakan bagi mikroorganisme lain, lebih menyuburkan tanah dan
memperbaiki struktur tanah, dapat memperbanyak dan menjaga kehidupan
mikroorganisme dalam tanah yang bermanfaat bagi tanaman, menjamin dan
menjaga lahan pertanian dimasa yang akan datang (Upadhyay dan Ray, 2987).
Selanjutnya Howell dan Stipanovic (1979) mengatakan bahwa perlakuan
bakteri Pseudomonad fluoresen pada tanah yang terkontaminasi R. solanacearum
persen, sedangkan perlakuan antibiotik pyrrolnitrin menambah ketahanan 13-70
persen. Ini berarti bakteri Pseudomonad fluoresen berpotensi sebagai agen
pengendalian hayati penyakit tumbuhan. Tetapi tidak semua Pseudomonad
fluoresen yang diisolasi dari risosfer tanaman bersifat antagonistik terhadap R.
solanacearum (Arwiyanto, 1997).
b. Pengendalian Dengan Menggunakan Agensia Hayati Pseuodomonad fluoresen
Penyakit layu bakteri pada tomat yang disebabkan oleh R. solanacearum
dikendalikan secara hayati dengan organisme rizosfer yaitu Pseuodomonad
fluoresen. Berdasarkan hasil penelitian Wuryandari (2006) menjelaskan dari 10
isolat Pseudomonad flouresen yang diuji daya hambatnya terhadap perkembangan
penyaki layu R. solanacearum di rumah kaca, menunjukkan hasil yang bervariatif.
Salah satunya adalah isolat Pseudomonad fluoresen strain Pf -122 yang mampu
menghambat perkembangan penyakit layu yang disebabkan oleh bakteri R.
solanacearum yaitu sampai hari ke-30 indeks penyakitnya hanya 49,9 %. Isolat
Pf-122 menunjukkan kemampuan yang paling tinggi dalam menekan
perkembangan penyakit layu R. solanacearum terbukti dengan rendahnya laju
infeksi atau rendahnya kecepatan perkembangan penyakit layu bakteri. Isolat yang
kedua adalah Isolat Pf-142 yang dapat menekan mengendalikan pertumbuhan R.
solanacearum secara bakteriosida. Isolat Pseudomonad fluoresen yang di gunakan
mempunyai kemampuan yang berbeda-beda dalam menekan perkembangan
penyakit layu bakteri yang disebabkan oleh R. solanacearum Adanya perbedaan
kemampuan isolat-isolat Pseudomonad fluoresen dalam menghambat
perkembangan penyakit layu mungkin disebabkan karena pseudomonad fluoresen
itu juga memiliki kemampuan kompetisi nutrisi dengan R. solanacearum dan
mokroorganisme lain dalam tanah lebih baik.
c. Pengendalian Dengan Menggunakan Actinomycetes
Actinomycetes merupakan mikroorganisme tanah yang umum dijumpai
pada berbagai jenis tanah. Populasinya berada pada urutan kedua setelah bakteri,
bahkan kadangkadang hampir sama (Alexander, 1977; Elbeon, 2000).
Actinomycetes hidup sebagai safrofit dan aktif mendekomposisi bahan organik,
sehingga dapat meningkatkan kesuburan tanah (Nonomura dan Ohara, 1969a,b).
Actinomycetes merupakan salah satu mikroorganisme yang mampu mendegradasi
selulosa disamping bakteri, kapang, dan khamir (Abe et al, 1979; Nakase et al,
1994; Xu et al, 1996).
Actinomycetes adalah merupakan organisme gram positif yang merupakan
peralihan antara jamur dan bakteri. Jenis Actinomycetes tergantung pada tipe
tanah (Davies dan Williams, 1970), karakteristrik fisik, kadar bahan organik, dan
pH lingkungan (Xu et al., 1996). Jumlah Actinomycetes meningkat dengan
adanya bahan organik yang mengalami dekomposisi (Nonomura dan Ohara,
1971). Pada umumnya Actinomycetes tidak toleran terhadap asam dan jumlahnya
menurun pada keadaan lingkungan dengan pH di bawah 5,0 (Jiang dan Xu, 1985;
Jiang et al., 1988).
Tanah yang tergenang air tidak cocok untuk pertumbuhan Actinomycetes,
sedangkan tanah gurun yang kering atau setengah kering dapat mempertahankan
populasi dalam jumlah cukup besar, karena adanya spora (Nonomura dan Ohara,
1971a,b,c,d; Alexander, 1961). Temperatur yang cocok untuk pertumbuhan
dapat tumbuh dalam jumlah cukup besar, khususnya genus Thermoactinomyces
dan Streptomyces (Rao, 1994).
Selama ini actinomycetes telah banyak diteliti dan dimanfaatkan orang
dibidang kesehatan karena kemampuanya dalam menghasilkan antibiotik. Maka
actinomycetes dapat digunakan untuk agensia hayati atau antagonis terhadap
patogen tanaman. Namun demikian di bidang pertanian terutama di Indonesia
penelitian dan pemanfaatan actinomycetes sebagai agen hayati jarang dilakukan,
berbeda dengan bakteri, jamur dan virus yang telah dilakukan banyak orang. Di
luar negeri, pemanfaatan Actinomycetes sebagai agen hayati telah cukup
berkembang, bahkan ada yang mempormulasikan dan dikemas sebagai biokontrol
yang dipasarkan. (Baker dan Cook, 1974).
Mujoko (2005), menjelaskan bahwa isolat Actinomycetes yang didapatkan
dilapang sebanyak 22 isolat actinomycetes yaitu 6 isolat Wajak, 6 isolat Pare 3, 6
isolat Pare 8, dan 4 isolat Pare 5. Dari 22 isolat yang diteliti ternyata isolat dari
Pare 8 dan Wajak sangat efektif dalam menekan pertumbuhan Fusarium sampai
100% dan menghasilkan berat buah terbesar. Penurunan populasi Fusarium
diduga karena adanya antibiotik yang dikeluarkan oleh isolat actinomycetes yang
merusak atau menghambat pertumbuhan Fusarium.
Mekanisme antagonisme yang dilakukan actinomycetes meliputi: a).
antibiosis yaitu dengan mengeluarkan berbagai macam antibiotik. b). Kompetisi,
terutama terhadap penggunaan sumber karbon. c). Parasitisme yaitu mampu
mengeluarkan enzim chitinase untuk merusak dinding sel jamur (Robert, 2002).
Pemanfaatan kombinasi antagonis dalam pengendalian penyakit tanaman
merupakan langkah perbaikan pendekatan pengendalian hayati. Kombinasi
antagonis ini diharapkan dapat meningkatkan kemampuan antagonis tingkat
perlindungan yang lebih tinggi, karena dapat mengurangi variabilitas antagonis
(Guetsky et al., 2001) dan mempunyai kemampuan penekanan patogen secara
mekanisme terpadu dari setiap antagonis (Jetiyanon dan Kloepper, 2002 dalam
Boer et al., 2003).
Serta dengan adanya penelitian yang terdahulu, seperti hasil pengujian
pengendalian penyakit layu bakteri nilam di lapang menunjukkan bahwa
kombinasi strain Bacillus spp. Bc 26 dan Pseudomonad fluoresen 101 mempunyai
kemampuan antagonistik tertinggi dalam mengendalikan penyakit layu bakteri
nilam dengan penekanan perkembangan penyakit, yaitu dari intensitas penyakit
63,90% menjadi 8,57%. (Chrisnawati, 2009).
Hasil pengujian Bacillus spp. dan Pseudomonad fluoresen secara in vitro
pada medium PDA dapat menekan pertumbuhan R. solanacearum (Chrisnawati et
al., 2006). Dan juga Pseudomonad fluoresen dapat mengendalikan penyakit layu
R. solanacearum pada tanaman radish melalui induksi ketahanan sistemik dengan
menghasilkan asam salisilat pada kondisi Fe rendah (Press et al., 2001).
Pseudomonas fluorescens dan Bacillus pumilis dapat mengendalikan Botrytis
cinerea pada stroberi yang menghasilkan senyawa volatile dengan pengaruh
fungistatik (Guetsky et al., 2002).
Hasil penelitian dari penggabungan dua mikroba dalam media Potatoes
sp. Dapat hidup berdampingan, dengan kecepatan pertumbuhan secara visual
Trichorderma sp. tumbuh lebih cepat dibandingkan dengan Pseudomonas putida.
B. Hipotesis
1. Agensi hayati Actinomycetes dapat menghambat pertumbuhan bakteri R.
solanacearum secara in vitro.
2. Dengan kombinasi antara agensia hayati Pseudomonad fluoresen isolat
Pf-122 dan 142 dengan Actinomycetes akan dapat meningkatkan kemampuan
dalam menghambat pertumbuhan bakteri R. solanacearum secara in vitro.
III. BAHAN DAN METODE
A. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Hama dan Penyakit Tumbuhan
program studi Agroteknologi Fakultas Pertanian UPN “Veteran” Jawa Timur.
Yang dilaksanakan pada bulan Juni sampai Nopember 2010.
B. Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian adalah agensia hayati
Yenny Wuryandari, MP, 2006) dan Agensi hayati Actinomycetes (isolat koleksi
Ir. Tri Mujoko, MP), Pathogen R. solanacearum yang telah di isolasikan dari
tanaman Solanaceae, alat tulis, cawan petri, tabung reaksi, pinset, jarum ose steril,
alat dan ruang steril, lemari es, bunsen, laminar air flow.
C. Metode Penelitian
Penelitian ini merupakan percobaan faktorial yang disusun dalam
Rancangan Acak Lengkap ( RAL ) yang terdiri dari 2 faktor, di ulang 3 kali.
Faktor I: Bakteri Pseuodomonas fluoresen , terdiri dari 2 isolat yaitu:
P1 : Pseuodomonas fluoresen isolat Pf-122
P2 : Pseuodomonas fluoresen isolat Pf-142
Faktor II: Bakteri Actinomycetes, terdiri dari 2 isolat yaitu:
A1 : Actinomycetes isolat Wajak
A4 : Actinomycetes isolat Pare 8
Terdapat 4 perlakuan kombinasi dan diulang sebanyak 3 kali sehingga
diperoleh 12 unit percobaan. Masing-masing unit percobaan terdiri atas 2 isolat
Pseudomonad fluoresen dan 2 isolat Actinomycetes, sehingga dalam penelitian ini
melibatkan 12 isolat Pseuodomonad fluoresen dan 12 isolat Actinomycetes. Jadi
kombinasi agensia hayati Pseuodomonad fluoresen dan Actinomycetes adalah
sebagai berikut:
Tabel 1. Kombinasi 2 isolat Pseuodomonad fluoresen dan 2 jenis Actinomycetes
Faktor A1 A2
P1 P1A1 P1A2
P1A1 = Kombinasi Pseudomonad fluoresen isolat Pf-122 dan Actinomycetes isolat wajak
P1A2 = Kombinasi Pseudomonad fluoresen isolat Pf-122 dan Actinomycetes isolat Pare 8
P2A1 = Kombinasi Pseudomonad fluoresen isolat Pf-142 dan Actinomycetes isolat wajak
P2A2 = Kombinasi Pseudomonad fluoresen isolat Pf-142 dan Actinomycetes isolat Pare 8
Luas zona hambatan diukur dengan menggunakan penggaris dengan cara :
Zona Hambatan : Dv + Dh 2 Keterangan:
Dv: Diameter Vertikal (terpanjang) Dh: Diameter Horizontal (terpendek)
D. Pelaksanaan Penelitian
Dalam penelitian ini dilakukan beberapa tahap yaitu :
1. Isolasi Bakteri R. solanacearum
Pengamatan gejala penyakit layu bakteri pada tanaman tomat dilakukan di
desa lamong kecamatan Pare Kabupaten Kediri. Pada lahan tomat yang berumur ±
2 bulan menunjukkan adanya gejala layu. Sedangakan warna daun dan batangnya
tetap berwarna hijau. Apabila pada akar atau batang tanaman tomat tersebut
dipotong dan kita menunggu beberapa saat, kemudian keluar massa bakteri
berwarna putih susu, maka bisa diperkirakan tanaman tersebut sudah terserang
penyakit layu bakteri yang disebabkan oleh bakteri R. solanacearum.
Tanaman tomat dengan gejala di atas selanjutnya didisolasi yang
dilakukan di Laboratorium Hama dan Penyakit Tumbuhan program studi
2. Uji Antagonis Pseudomonad flouresen Terhadap R. solanacearum Secara
In vitro.
Isolat Pseudomonad flouresen ditumbuhkan dengan cara dititik pada
permukaan media King’s B dalam cawan petri dengan jarak proporsional. Setelah
masa inkubasi selama 24 jam pada suhu 30°C cawan petri dibalik dan pada
tutupnya dituangi dengan 1 ml kloroform. Dua jam kemudian cawan petri dibalik
kembali pada posisi semula. Pada permukaan medium tersebut dituangkan
suspensi R. solanacearum yang dicampurkan dalam 4 ml 0,6 % agar air yang
mencair pada suhu 45°C dan diratakan. Biakan diinkubasikan selama 24 jam pada
suhu 30°C kemudian zona hambatan yang terbentuk diukur. Strain-strain yang
konsisten menghambat pertumbuhan R. solanacearum secara in vitro kemudian
disimpan.
3. Uji Antagonisme Actinomycetes Terhadap R. solanacearum Secara
In vitro.
Platting media PDA pada cawan petri. Setelah itu inokulasi kertas yang
sudah direndam suspensi Actinomycetes. Diinkubasikan selama 3 hari,
selanjutnya pada permukaan medium tersebut dituangkan suspensi R.
solanacearum yang dicampurkan dalam 4 ml 0,6 % agar air yang mencair pada
suhu 45°C dan diratakan. Biakan diinkubasikan selama 48 jam pada suhu 30°C
kemudian zona hambatan yang terbentuk diukur. Strain-strain yang konsisten
menghambat pertumbuhan R. solanacearum secara in vitro kemudian disimpan.
4. Mekanisme Penghambatan Actinomycetes.
Pemberian Actinomycetes yang mempunyai sifat antagonis, mampu
dilaboratorium, Actinomycetes dapat menyebabkan terjadinya hambatan
pertumbuhan jamur Fusarium melalui mekanisme antibiotis dan kompetisi.
Mujoko (2005). Dalam menentukan sifat penghambatan adalah sebagai berikut :
mengambil media pada zona penghambatan seluas ± 0,25 cm, selanjutnya
memasukkan dalam air steril pada tabung reaksi (10 ml), Menghancurkan media
tersebut sehingga larutan menjadi homogen. Mengambil dengan jarum ose steril
pada suspensi larutan tersebut dan menyeterilkan ke media YPGA pada cawan
petri. Menunggu ± 1 - 10 hari untuk melihat pertumbuhan R. solanacearum.
Apabila R. solanacearum tumbuh pada media tersebut, maka sifat penghambatan
Actinomycetes bersifat menghambat atau bakteriostatik. Apabila R. solanacearum
tersebut tidak tumbuh pada media tersebut, maka sifat penghambatan
Actinomycetes bersifat membunuh atau bakterisida.
5. Kompatibilitas Antara Pseudomonad fluoresen Dengan Actinomycetes
Pengujian ini untuk mendapatkan isolat Actinomycetes yang menghasilkan
antibiotika yang menghambat R. solanacearum yang kompatibel dengan
Pseudomonad fluoresen. Diharapkan akan diperoleh isolat Actinomycetes yang
tidak menghambat pertumbuhan Pseudomonad fluoresen dan tidak dihambat
pertumbuhannya oleh Pseudomonad fluoresen isolat. Pada tahap pertama
pengujian dilakukan pengaruh Actinomycetes terhadap pseudomonad fluoresen.
Medium King’s B dituang ke cawan petri setelah dingin 0,2 ml suspensi bakteri Pf
dituangkan pada medium 0,6 % agar air yang mencair kemudian dituangkan ke
cawan petri tersebut di atas. Selanjutnya antibiotika Actinomycetes berupa bulatan
kertas yang telah direndam dalam suspensi Actinomycetes, diambil dan diletakkan
kemudian zona hambatan yang terbentuk diukur. Pada tahap kedua, langkah di
atas dibalik. Isolat pseudomonad fluoresen ditumbuhkan dengan cara dititik pada
permukaan media King’s B dalam cawan petri dengan jarak proporsional. Setelah
masa inkubasi selama 48 jam pada suhu 300 C cawan petri dibalik dan pada
tutupnya dituangi dengan 1 ml kloroform. Dua jam kemudian cawan petri dibalik
kembali pada posisi semula. Pada permukaan medium tersebut dituangkan
suspensi Actinomycetes ( 0,2 ml suspensi air steril dalam 4 ml 0,6% agar air pada
suhu 450 C). Biakan diinkubasikan selama 24 jam pada suhu 300 C kemudian zona
hambatan yang terbentuk diukur. Isolat Actinomycetes yang kompatibel dengan
pseudomonad fluoresen dicatat dan disimpan.
6. Uji Pengaruh Kombinasi Antara Pseudomonad fluoresen dan Actinomycetes yang Kompatibel Terhadap Pertumbuhan R.
solanacearum
Medium YPGA dituang ke cawan petri setelah dingin 0,2 ml suspensi
bakteri R. solanacearum dituangkan ke cawan petri. Selanjutnya campuran
suspensi Actinomycetes dan Pseudomonad fluoresen yang kompatibel yaitu
berupa bulatan kertas yang telah direndam suspensi kedua bakteri tersebut ditaruh
diatas permukaan R. solanacearum dalam cawan petri yang diletakkan di tengah
medium. Biakan diinkubasikan selama 24 jam pada suhu 300 C kemudian zona
hambatan yang terbentuk diukur. Strain yang mampu menghambat diuji sebanyak
dua kali lagi dengan medium dan metode yang sama. Strain-strain yang konsisten
menghambat pertumbuhan R. solanacearum secara in vitro kemudian disimpan.
7. Analisa Data
Data hasil percobaan dianalisis dengan menggunakan analisis sidik ragam
Pengaruh kombinasi diuji dengan uji F. Perlakuan dinyatakan berbeda nyata
apabila F hitung lebih besar dari pada F tabel zona atau wilayah penghambatan
(panjang diameter). Apabila Semakin panjang diameter yang dibentuk, maka
terbukti bahwa Pseudomonad fluoresen dan Actinomycetes kemampuanya
semakin tinggi dalam menghambat pertumbuhan R. solanacearum. Apabila
semakin kecil, pendek ataupun bahkan tidak adanya diameter pada zona yang
dibentuk oleh Actinomyctes dan Pseudomonad fluoresen maka tingkat
antibiotiknya dalam menghambat pertumbuhan R. solanacearum semakin rendah.
Kekuatan antibiotik dalam menghambat pertumbuhan mikroorganisme
lain berbeda-beda. Ketentuan pengukuran kekuatan antibiotik menurut metode
Davis Stout (1978 dalam Rachdiati, 2000), ialah sebagai berikut:
1. Daerah hambatan 20 mm atau lebih : sangat kuat
2. Daerah hambatan 10 mm – 20 mm : kuat
3. Daerah hambatan 5 mm – 10 mm : sedang
IV. HASIL DAN PEMBAHASAN
1. Gejala Penyakit Layu R. solanacearum Pada Tanaman Tomat di Lapang
Gejala penyakit layu pada tanaman tomat di lapang, tampak atau terlihat daun
muda pada pucuk dan daun tua menjadi layu, serta bagian bawah menguning tetapi
daun bagian atas dan batangnya tetap berwarna hijau. Pengamatan gejala layu ini
sesuai dengan hasil penelitian Rukmana (1997) yang menyatakan bahwa adanya daun
muda pada pucuk dan daun tua tanaman akan menjadi layu, daun bagian bawah
menguning merupakan ciri khas gejala penyakit layu bakteri. Gejala penyakit layu R.
solanacearum pada tanaman tomat terlihat seperti pada Gambar 1.
Gambar 1. Daun Layu agak Menguning Pada Tanaman Tomat Gejala Penyakit Layu Bakteri R. solanacearum.
Pengamatan pada gejala bagian dalam dilakukan pemotongan tanaman tomat
membujur pada bagian akar atau batang bagian bawah setelah ditunggu ±5 menit
keluar massa bakteri berwarna putih susu kotor. Perlakuan ini sesuai dengan pendapat
atau akar tanaman tomat dipotong dan ditekan akan keluar massa bakteri berwarna
putih kotor.
Apabila dilihat dari morfologi akar tanaman tomat yang sudah terserang
penyakit layu R. solanacearum sangat berbeda dengan akar tanaman yang sehat,
seperti terlihat pada Gambar 2.
(a) (b)
Gambar 2. Akar Tanaman Tomat yang Terserang Bakteri R. solanacearum Warnanya Kehitam-hitaman (a) dan Tidak Terserang Layu Baktaeri R. solanacearum Warnanya Putih Bersih (tanaman sehat) (b)
Batang dan akar tanaman tomat yang terserang penyakit layu R. solanacearum
kelihatan berwarna coklat kehitaman-hitaman, permukaan kulitnya basah, pada
permukaan kulit yang parah keluar massa bakteri serta permukaan kulit pada akarnya
sebagian mengelupas.
Apabila dilihat dari morfologi pada batang tanaman tomat yang sehat akan
tetap terlihat hijau, tidak lembab, serta pada akar warnanya putih dan kelihatan segar,
serta setelah dilakukan pemotongan membujur pada tanaman tomat yang sehat pada
bagian akar atau batang dan menunggu ±5 menit tidak keluar massa bakteri berwarna
2. Hasil Isolasi Bakteri R. solanacearum
Hasil isolasi bakteri dari akar dan batang tanaman tomat yang menunjukkan
gejala layu R. solanacearum pada media YPGA dalam cawan petri yang
ditumbuhkan selama 48 jam terlihat seperti pada Gambar 3.
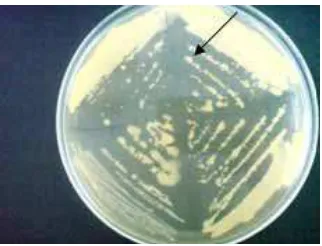
Gambar 3. Koloni Bakteri R. solanacearum di Media YPGA Pada Cawan Petri
Pada gambar diatas (Gambar 3) terlihat bahwa R. solanacearum mempuyai
ciri sebagai berikut: koloni R. solanacearum berwarna putih susu kotor, koloni
berbentuk fluidal dan tidak beraturan, apabila dihadapkan lampu tidak tembus
cahaya, kenampakan koloni selalu kelihatan basah, dan berlendir. Ciri-ciri tersebut
sesuai dengan penelitian yang dilakukan oleh Wuryandari & Arwiyanto (1999) yang
menyatakan bahwa bakteri R. solanacearum memiliki ciri berwarna putih, fluidal
dan berbentuk tidak teratur bila ditumbuhkan pada media YPGA.
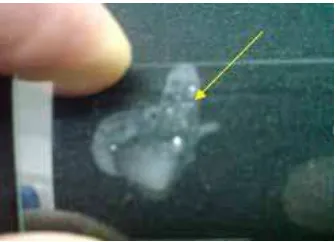
a. Uji Gram Pada Bakteri R. solanacearum
Uji Gram dengan KOH 3 % pada gelas objek ternyata membentuk benang
(berlendir), hal ini membuktikan bahwa bakteri R. solanacearum bersifat Gram
yaitu bakteri R. solanacearum adalah bersifat Gram negatif seperti terlihat pada
Gambar 4.
Gambar 4. Bakteri R. solanacearum berlendir pada Hasil Uji Gram
Menurut peneliti Buck, John D. (1982) bakteri R. solanacearum bisa berlendir
pada uji Gram dikarenakan gram (+) memiliki dinding sel yang tebal dan lemak yang
tipis sedangkan gram (-) berlemak tebal dan berdinding sel tipis yang berada di ruang
periplasma. KOH akan masuk ke dalam lemak (bilayer lipid) ini dan membuat sel
gram (-) pecah. Pecahnya sel melepaskan materi genetik (DNA) yang merupakan
substansi melimpah di dalam sel bakteri. Molekul DNA sangat panjang bersifat
menyerupai lendir, getah atau dapat berarti lengket yang memberikan hasil seperti
lendir saat diangkat dengan jarum inokulum.
b. Uji Katalase Pada Bakteri R. solanacearum
Pada uji katalase dengan H2O2 5 %, ternyata terdapat gelembung-gelembung
kecil setelah menunggu ±60 detik, hal ini membuktikan bahwa bakteri R.
solanacearum ini bersifat katalase positif. Pengujian di atas sesuai dengan pendapat
bakteri R. solanacearum adalah bersifat katalase positif. Hasil pengujian seperti
terlihat pada Gambar 5.
Gambar 5. Gelembung-Gelembung Kecil Hasil Uji Katalase Pada Bakteri R. solanacearum
Menurut Austin B. (1988) berpendapat bahwa terjadinya
gelembung-gelembung kecil karena adanya pemecahan H2O2 (hidrogen peroksida) oleh enzim
katalase yang dihasilkan oleh bakteri itu sendiri. Komponen H2O2 ini merupakan
salah satu hasil respirasi aerobik bakteri.
c. Uji Oksidase Pada Bakteri R. solanacearum
Pada uji Oksidase pada permukaan kertas Kovac’s, setelah menunggu 10-60
detik ternyata warna yang telah digoreskan berubah warna menjadi biru keunguan,
maka sifat dari bakteri ini adalah bersifat oksidase positif. Hal ini sesuai dengan hasil
penelitian Wuryandari & Arwiyanto (1999) yaitu bakteri R. solanacearum adalah
Gambar 6. Warna Keunguan pada Hasil Uji Kovac’s Oksidase Pada Bakteri R.solanacearum.
Enzim oksidase dihasilkan oleh bakteri aerob, fakultatif anaerob, dan
mikroaerofilik. Mikroorganisme ini menggunakan oksigen, sebagai akseptor elektron
terakhir selama penguraian karbohidrat untuk menghasilkan energi. Kemampuan
bakteri memproduksi sitokrom oksidase dapat diketahui dari reaksi yang ditimbulkan
setelah pemberian reagen oksidase pada koloni bakteri. Reagen yang digunakan
adalah tetramethyl-D-phenylenediamine dihydrocloride. Reagen akan mendonorkan
elektron terhadap enzim ini sehingga akan teroksidasi membentuk senyawa yang
berwarna biru kehitaman. Positif tertunda (warna biru muncul antara 10-60 detik
setelah ditetesi) menandakan bahwa bakteri uji memiliki sedikit enzim. Tidak adanya
perubahan warna mengindikasikan bahwa uji yang dilakukan negatif. Jika warna
berubah menjadi biru keunguan maka hasil uji positif, sedangkan bila tidak terjadi
perubahan maka hasil uji negatif (Buck, John D. 1982).
3. Bakteri Agensia Hayati Pseudomonad fluoresen
Isolasi Pseudomonad fluoresen isolat Pf-122 dan Pseudomonad fluoresen isolat
Pf-142 diperoleh dari isolat dari koleksi Dr. Ir. Yenny Wuryandari, MP. Bakteri
pada media King’B pada cawan petri. Ciri-ciri bakteri Pseudomonad fluoresen
adalah: Koloni berbentuk bulat, bertepi rata dan berpendar hijau kekuningan. Hasil ini
sesuai dengan pendapat peneliti sebelumnya (Stolp &Godkari, 1981) bahwa
Pseudomonad fluoresen menghasilkan pigmen fluoresen yang berwarna kuning hijau
terlarut dalam air dan dapat berdifusi. Koloni Pseudomonad fluoresen isolat Pf-122
dan Pseudomonad fluoresen isolat Pf-142 adalah seperti Gambar 7.
Gambar 7. Bakteri Pseudomonad fluoresen Berpendar Hijau Kekuningan.
Dari hasil uji diantaranya: uji Gram dengan KOH 3%, Katalase dengan H2O2
5%, dan Kovac’s oksidase, hasil yang diperoleh bakteri bahwa sifat Pseudomonad
fluoresen adalah: Gram negatif, Katalase positif, dan Oksidase positif.
a. Uji Gram Pada Bakteri Pseudomonad fluoresen
Hasil uji Gram dengan menggunakan KOH 3 % menunjukkan bahwa bakteri
Pseudomonad fluoresen bersifat Gram negatif, hai ini dibuktikan dengan adanya ternyata
suspensi Pseudomonad fluoresen menjadi berlendir dan membentuk benang saat
diangkat dengan jarum inokulum. Hal ini sesuai dengan hasil penelitian Wuryandari
& Arwiyanto (1999) yaitu bakteri Pseudomonad fluoresen adalah bersifat oksidase
Gambar 8. Bakteri Pseudomonad fluoresen berlendir Pada Hasil Uji Gram
Menurut peneliti Buck, John D. (1982) bakteri R. solanacearum bisa berlendir
pada uji Gram dikarenakan gram (+) memiliki dinding sel yang tebal dan lemak yang
tipis sedangkan gram (-) berlemak tebal dan berdinding sel tipis yang berada di ruang
periplasma. KOH akan menyerang lemak (bilayer lipid) ini dan membuat sel gram (-)
pecah. Pecahnya sel melepaskan materi genetik (DNA) yang merupakan substansi
melimpah di dalam sel bakteri. Molekul DNA sangat panjang bersifat sticky strings
(menyerupai lendir, getah atau dapat berarti lengket) yang memberikan hasil seperti
lendir saat diangkat dengan jarum inokulum.
b. Uji Katalase Pada Bakteri Pseudomonad fluoresen
Pada uji Katalase dengan meneteskan H2O2 5 % pada gelas objek ternyata
muncul gelembung-gelembung kecil, hal ini membuktikan bahwa bakteri
Pseudomonad fluoresen ini bersifat katalase positif. Pengujian ini sesuai dengan
pendapat peneliti sebelumnya oleh Wuryandari & Arwiyanto (1999) yang
menyatakan bahwa bakteri Pseudomonad fluoresen adalah bersifat katalase positif.
Gambar 10. Gelembung-Gelembung Kecil Hasil Uji Katalase Pada Bakteri R. solanacearum
Menurut Austin B. (1988) berpendapat bahwa terjadinya
gelembung-gelembung kecil karena adanya pemecahan H2O2 (hidrogen peroksida) oleh enzim
katalase yang dihasilkan oleh bakteri itu sendiri. Komponen H2O2 ini merupakan
salah satu hasil respirasi aerobik bakteri.
c. Uji Oksidase Pada Bakteri Pseudomonad fluoresen
Pada uji Oksidase, ternyata warna yang telah digoreskan tadi berubah warna
menjadi biru marun (kehitaman), maka kemungkinan sifat dari bakteri ini adalah
bersifat oksidase positif. Hal ini sesuai dengan hasil penelitian Wuryandari &
Arwiyanto (1999) yaitu bakteri Pseudomonad fluoresen adalah bersifat Oksidase
positif seperti terlihat pada Gambar 9.
Menurut Buck, John D. (1982) enzim oksidase memegang peranan penting
dalam transport elektron selama respirasi aerobik. Enzim oksidase dihasilkan oleh
bakteri aerob, fakultatif anaerob, dan mikroaerofilik. Mikroorganisme ini
menggunakan oksigen, sebagai akseptor elektron terakhir selama penguraian
karbohidrat untuk menghasilkan energi. Kemampuan bakteri memproduksi sitokrom
oksidase dapat diketahui dari reaksi yang ditimbulkan setelah pemberian reagen
oksidase pada koloni bakteri. Reagen yang digunakan adalah
tetramethyl-D-phenylenediamine dihydrocloride. Reagen akan mendonorkan elektron terhadap
enzim ini sehingga akan teroksidasi membentuk senyawa yang berwarna biru
kehitaman. Positif tertunda (warna biru muncul antara 10-60 detik setelah ditetesi)
menandakan bahwa bakteri uji memiliki sedikit enzim. Tidak adanya perubahan
warna mengindikasikan bahwa uji yang dilakukan negatif. Jika warna berubah
menjadi biru marun maka hasil uji positif, sedangkan bila tidak terjadi perubahan
maka hasil uji negatif. Hasil uji positif tertunda jika warna biru muncul antara 10-60
detik setelah ditetesi.
4. Uji Antagonis Pseudomonad fluoresen Terhadap Pertumbuhan Bakteri R.
solanacearum
Dari hasil uji antagonis Pseudomonad fluoresen isolat Pf-122 terhadap
pertumbuhan R. solanacearum diperoleh hasil adanya zona penghambatan berupa
Gambar 11. Zona Hambatan Pf-122 Terhadap Pertumbuhan R. solanacearum
Adanya zona berbentuk lingkaran di sekitar titik Pf-122 yang berwarna bening
membuktikan bahwa Pseudomonad fluoresen isolat Pf-122 dapat menghambat
pertumbuhan bakteri R. solanacearum. Disekitar inokulum Pseudomonad fluoresen
isolat Pf-122 bakteri R. solanacearum tidak dapat tumbuh atau terhambat
pertumbuhanya kemungkinan dikarenakan Pseudomonad fluoresen isolat Pf-122
mengeluarkan senyawa antibiotik di area sekitarnya sehingga pertumbuhan bakteri R.
solanacearum terhambat. Menurut peneliti sebelumnya Arwiyanto (1997) bahwa
proses antibiosis atau proses penghambatan Pseudomonad fluoresen terhadap R.
solanacearum karena senyawa penghambat.
Hasil pada pengamatan zona hambat uji antagonis Pseudomonad fluoresen
Gambar 12. Zona Hambatan Pseudomonad fluoresen Isolat Pf-142 Terhadap Pertumbuhan Bakteri R. solanacearum
Besar zona hambat Pseudomonad fluoresen isolat Pf-142 terhadap pertumbuhan
bakteri R. solanacearum mungkin sedikit berbeda terhadap uji isolat Pf-122.
Disamping zona yang terbentuk lebih kecil, warna transparan yang terbentuk dari zona
penghambatan terlihat lebih terang dan jelas serta luas zona yang terbentuk lebih kecil
dibandingkan dengan Pseudomonad fluoresen isolat Pf-122. Hal ini mungkin
disebabkan sifat penghambatan yang dilakukan Pf-142 berbeda dengan Pf-122,
kemungkinan makin besar zona hambatan yang dibentuk, makin tinggi pula
kemampuan Pseudomonad fluoresen dalam mengendalikan pertumbuhan bakteri R.
solanacearum.
Hasil pengamatan terhadap besar zona hambat bakteri Pseudomonad fluoresen
Tabel 1. Hasil Pengamatan Zona Hambatan Pseudomonad fluoresen Isolat Pf-122 dan Pseudomonad fluoresen Isolat Pf-142 Terhadap Pertumbuhan Bakteri R. solanacearum
Pf-122 Pf-142
Ulangan Ulangan
I II III I II III
Diamater
zona (mm) 20 21 20 16 17 17
Rata-rata 20 17
Dari Tabel 1. Terlihat bahwa Pf-122 adalah sebesar 20 mm, sedangkan
besarnya zona hambat oleh Pf-142 adalah sebesar 17 mm. Sesuai ketentuan
pengukuran kekuatan antibiotik menurut metode Davis Stout (1978 dalam Rachdiati,
2000) apabila daerah hambatan 10 mm – 20 mm adalah tergolong kuat, sedangkan
hambatan 20 mm atau lebih adalah tergolong sangat kuat. Jadi kekuatan antibiotik
Pf-122 adalah tergolong sangat kuat, sedangkan zona hambat oleh Pf-142 adalah
tergolong kuat.
5. Uji Mekanisme Penghambatan Pseudomonad fluoresen Isolat Pf-122 dan Pseudomonad fluoresen Isolat Pf-142 Terhadap R. solanacearum.
Hasil uji mekanisme penghambatan menunjukkan bahwa masih ada
pertumbuhan bakteri R. solanacearum pada media YPGA dari uji penghambatan oleh
Pseudomonad fluoresen isolat Pf-122, sedangkan pada uji mekanisme Pseudomonad
fluoresen isolat Pf-142 tidak ada pertumbuhan R. solanacearum sama sekali. Hasil
Tabel 2. Hasil Pengamatan Pertumbuhan Jumlah Koloni Pada Uji Mekanisme Pseudomonad fluoresen Isolat 122 dan Pseudomonad fluoresen Isolat Pf-142 Terhadap Pertumbuhan R. solanacearum
Pf-122 Pf-142
Mekanisme Bakteriostatik Bakterisida
Hasil uji mekanisme penghambatan Pseudomonad fluoresen isolat Pf-122
terhadap pertumbuhan R. solanacearum adalah bersifat bakteriostatik atau bersifat
menghambat karena masih ada pertumbuhan inokulum bakteri R. solanacearum
(Tabel 2), hal itu terlihat setelah bakteri digoreskan pada media YPGA pada cawan
petri setelah 10 hari ternyata masih terdapat pertumbuhan R. solanacearum. Dari
hasil uji mekanisme penghambatan Pseudomonad fluoresen isolat Pf-122 terhadap
(a) (b)
Gambar 13. Koloni R. solanacearum(a) Perbesaran Koloni R. solanacearum(b)
Pada uji mekanisme penghambatan Pseudomonad fluoresen isolat Pf-142
terhadap pertumbuhan R. solanacearum adalah bersifat bakterisida atau bersifat
membunuh, karena setelah diamati selama 10 hari tidak ada pertumbuhan inokulum
bakteri R. solanacearum sama sekali (Tabel 2) pada media YPGA di cawan petri. Hal
ini kemungkinan antibiotik yang dikeluarkan Pseudomonad fluoresen isolat Pf-142
adalah sangat kuat sehingga bakteri R. solanacearum tidak dapat tumbuh lagi atau
mati. Hal ini sesuai dengan pendapat peneliti sebelumnya oleh Wuryandari dkk
(2007), hal tersebut terlihat dengan melakukan streak kembali di media YPGA pada
cawan petri setelah menunggu 1-10 hari ternyata tidak ada pertumbuahan R.
solanacearum seperti trelihat pada Gambar 14.
Sifat penghambatan Pseudomonad fluoresen isolat Pf-122 terhadap R.
solanacearum adalah bersifat bakteriostatik, yang dimungkinkan dalam menghambat
pertumbuhan bakteri R. solanacearum tidak dapat membunuh, tetapi hanya
menghambat pertumbuhan R. solanacearum saja dalam kurun waktu tertentu,
sehingga hasilnya kurang maksimal. Sedangkan sifat penghambatan Pseudomonad
fluoresen isolat Pf-142 terhadap R. solanacearum adalah bersifat bakterisida, yang
mungkin dalam mempengaruhi pertumbuhan bakteri R. solanacearum adalah bersifat
membunuh, sehingga pertumbuhan bakteri R. solanacearum tidak muncul lagi.
Menurut Wuryandari dkk (2007) berpendapat bahwa Isolat Pseudomonad
fluoresen yang mempunyai kemampuan menghambat dengan mekanisme penghambatan
bakterisida kemungkinan akan lebih berpotensi sebagai agensia hayati dari pada yang
bersifat yang bersifat bakteriostatik.
6. Bakteri Agensia Hayati Actinomycetes
Isolat Actinomycetes diperoleh dari koleksi peneliti sebelumnya oleh Ir.
Trimujoko MP. Isolat Actinomycetes diremajakan kembali pada media PDA.
Diinkubasikan pada suhu ruang selama satu minggu, atau selama pertumbuhan koloni
memenuhi cawan petri. Gambar koloni Actinomycetes yang didapatkan seperti
Gambar 15. Koloni Bakteri Actinomycetes Wajak
Gambar 16. Koloni Bakteri Actinomycetes Pare 8
7. Uji antagonisme Actinomycetes Wajak (W) dan Actinomycetes Pare 8 (P) Terhadap R. solanacearum.
Pengujian antagonis Actinomycetes tidak terdapat adanya zona penghambatan
atau R. solanacearum tumbuh menyeluruh di sekitar antibiotika, sehingga dapat
disimpulkan antibiotika Actinomycetes tidak dapat menghambat pertumbuhan
bakteri R. solanacearum secara in vitro. Hasil pengujian seperti terlihat pada Gambar
Gambar 17. R. solanacearum Tumbuh Merata di Sekitar Antibiotik Actinomycetes Wajak
Gambar 18. R. solanacearum Tumbuh Merata di Sekitar Antibiotik Actinomycetes Pare 8
Uji antagonisme Actinomycetes terhadap R. solanacearum tidak
menghasilkan zona hambatan sama sekali. Hal ini dimungkinkan sifat dan senyawa
antibiotika yang dikeluarkan dari agensia hayati antara Pseudomonad fluoresen
dengan agensia hayati Actinomycetes adalah berbeda, dari hasil penelitian
sebelumnya (Stolp & Godkari, 1991).
Menurut pendapat Baker dan Cook ( 1974) Pseudomonad fluoresen dapat
menghasilkan senyawa diantaranya : HCN, monoacetyl phloroglucinol, siderofor,
puoluserin, asam salisilat yang dapat menghambat pertumbuhan R. solanacearum,
sedangkan Actinomycetes tidak dapat menghasilkan senyawa-senyawa tersebut tetapi
jamur. Sehingga dari kemungkinan-kemungkinan ini agensia hayati Actinomycetes
tidak dapat mengendalikan pertumbuhan R. solanacearum.
8. Uji Kompatibilitas Antara Pseudomonad fluoresen Dengan Actinomycetes
Dari hasil uji kompatibilitas antara agensia hayati Pseudomonad fluoresen
terhadap pertumbuhan Actinomycetes dan sebaliknya terlihat seperti pada Gambar
19. dan Gambar 20.
a. b.
Gambar 19. (a) Bakteri Pseudomonad fluoresen
(b) Actinomycetes Tumbuh Merata di Sekitar Pseudomonad fluoresen
Antibiotika Pseudomonad fluoresen yang dititikkan dengan jarak proporsional
tidak menghambat pertumbuhan agensia hayati Actinomycetes yang tumbuh di
sekitar Antibiotika Pseudomonad fluoresen dengan merata.
a. b.
Gambar 20. (a) Bakteri Actinomycetes
Tidak adanya zona disekitar antibiotika Actinomycetes membuktikan bahwa
antara Actinomycetes dan Pseudomonad fluoresen, tidak saling menghambat atau
dengan kata lain kompatibel. Hal tersebut kemungkinan disebabkan karena senyawa
antibiotik yang dikeluarkan baik Pseudomonad fluoresen ataupun Actinomycetes
saling tidak berpengaruh terhadap pertumbuhan keduanya, sehingga Pseudomonad
fluoresen maupun Actinomycetes bisa hidup saling berdampingan atau tidak saling
menghambat.
9. Uji Pengaruh Kombinasi Antara Pseudomonad fluoresen dan Actinomycetes yang Kompatibel Terhadap Pertumbuhan Bakteri R.
solanacearum.
Dari hasil pengujian yang dilakukan dengan mengkombinasikan antara
agensia hayati Pseudomonad fluoresen dan Actinomycetes terhadap pertumbuhan
bakteri R. solanacearum tidak terdapat zona atau area hambatan di sekitar inokulum
campuran suspensi. Adapun hasil pengujian terlihat pada Gambar 21.
Gambar 21. Bakteri R. solanacearum Tumbuh Merata di Sekitar Antibiotik Kombinasi Antara Pseudomonad fluoresen dan Actinomycetes
Dari uji pengaruh kombinasi antara Pseudomonad fluoresen dan
kemungkinan dipengaruhi dari jenis media dasarnya yaitu Yeast Peptone Glukose
Agar (YPGA) yang digunakan, ternyata setelah diuji dengan media dasar lain
diantaranya: media King’B dan media Potato Dextrose Agar (PDA) hasilnya masih
tetap sama tidak terdapat zona, sehingga perlakuan jenis media dasar pada pengujian
ini tidak berpengaruh terhadap terbentuknya zona hambatan.
Dalam uji ini kemungkinan Pseudomonad fluoresen tidak dapat
mengekspresikan senyawa antibiotika penghambat untuk mengendalikan bakteri R.
solanacearum, kemungkinan karena adanya senyawa antibiotika yang dikeluarkan
oleh Actinomycetes sehingga antibiotika yang dimiliki Pseudomonad fluoresen
terhambat oleh antibiotika yang dikeluarkan oleh Actinomycetes. Menurut pendapat
penelitian sebelumnya oleh Arwiyanto dkk (2007) dalam penelitianya yang berjudul
“Phenotypic Charactheristics of Fluorescent Pseudomonss, Biological Control
Agent of Lincat Disease of Temanggung Tobacco” telah dijelaskan Pseudomonad
fluoresen merupakan kelompok bakteri yang mampu menghasilkan berbagai senyawa
penghambat pada medium buatan di laboratorium. Dijelaskan juga bahwa
Pseudomonad fluoresen isolat Temanggung juga mampu menghasilkan senyawa
penghambat yang mampu menghambat pertumbuhan bakteri saprofit lainnya.
Kemampuan masing-masing isolat berbeda-beda, isolat pf22 hanya menghambat
petumbuhan satu isolat dari genus lain yang diuji yaitu Stre67 sedangkan isolat pf23
mampu menghambat semua bakteri lain. Isolat Bacillus (Ba) dan Streptomyces (Stre),
merupakan bakteri antagonis terhadap patogen penyakit lincat tembakau selain
untuk mendapatkan kombinasi antar isolat yang tidak saling menghambat satu dengan
V. KESIMPUAN DAN SARAN
A.
Kesimpulan
1. Agensia hayati Actinomycetes tidak dapat mengendalikan pertumbuhan
bakteri R. solanacearum secara in vitro.
2. Kombinasi antara agensia hayati Pseudomonad fluoresen dengan
Actinomycetes tidak dapat meningkatkan kemampuan Pseudomonad
fluoresen dalam mengendalikan pertumbuhan bakteri R. solanacearum.
B.
Saran
Perlu dilakukan penelitian lebih lanjut kemampuan antibiotik
Pseudomonad fluoresen dalam mengendalikan penyakit layu R. solanacearum
DAFTAR PUSTAKA
Abe, 1979. Plant Pathologi. MC. Graw Hil, Book Comp, Ltd. New York, hal 717.
Alexander, M. 1977. Introduction to Soil Microbiology, Second Edition, John Willy and Sons, New York.
Anonim, 1995. Pengendalian Penyakit R. Solanaceae, Part 3.
Anonim, 2001. Total Unmanufactured Tobacco Planeted Area For Selected Countries. United State Department Of Agriculture.
Arwiyanto T., 1997. Seleksi Pseudomonas fluoresen Secara Langsung di Lapangan untuk Pengendalian Penyakit Lincat pada Tembakau, Jurnal Hama Penyakit Tumbuhan Tropika (in press).
Arwiyanto T., Yms Maryudani, Azizah N., 2007. Phenotypic charactheristics of fluorescent pseudomonss, biological control agent of lincat disease of temanggung tobacco. Biodiversitas.Volume 8, Halaman: 147-151
Atie Srie Duriet, 1993. Pengendalian Hayati Virus yang Menyerang Sayuran. dalam Kongres Nasional dan Seminar Ilmiah Fitopatologi IndonesiaYogyakarta, 6-8 September 1993, hal 76.
Austin B. (1988). Marine Micro-biology. Cambridge University Press. Cambridge, England. 222p.
Baker dan Cook, 1974. Biological Control of Plant Pathogens, dalam USU digital library, hal. 23-38.
Brock & Madigan, 1988. Peranan Psedoumonad Fluoresence (Pseuodomonad fluoresens) Dalam Pengendalian Biologi, hal. 2.
Buck, John D. 1982. Non Staining KOH Method for Determination of Gram Reaction Of Marine Bacteria. Applied and Environtmental Microbiology. Vol 44. No 4, p.992-993.
Chrisnawati, 2009. Pengendalian penyakit layu bakteri nilam menggunakan bacillus spp dan pseudomonad fluoresen, hal. 116 - 123.
Cook & Baker, 1991. The Nature and Practice Of Biological Control Of Plant Pathogen. APS Press, St. Paul Minnesota, 539 p.
Cook R.J dan K. F. Baker dalam buku The Nature and Practice of Biological Control of Plant Pathogens, hal. 60
Goto, M., 1992. Fundamental of Bacterial Plant Pathology, Academic Press, Tokyo, 324 p.
Guetsky, R., D. Shitienberg, Y. Elad, E. Fischer, and A. Dinoor. 2002. Improving biological control by combining biocontrol agents each with several mechanisms of disease suppression, Phytopathology. 92 : 979-985.
Habazar dan Rivai, 2000. Mekanisme Kerusakan Ekstraseluler Polisakarida Sebagai Penyebab Layu Bakteri, Hal. 30-31.
Hasanuddin, 2003. Penyakit-penyakit tanaman Holtikultura di Indonesia. Gadjah Mada University Press. Yogyakarta. 850 Hal.
Hayward, 1983.Plant Pathogenic Ralstonia Species. Nanamanickam. P. 573-643.
Hebbar, 1992. Induced Resistance and Phytoalexin Accumulation by Biological Control of Fusarium Wilt of Carnation by Pseudomonas sp. Strain WCS 41r. Phytopathol. 81:728-734.
Howell & Stipanovic 1979. Desease, Pest and Weeds in Tropical Crops. New York. 666 p.
Hutagalung, 1984. CompendiumOf Tomatto Desease. APS Press. 100h.
Jetiyanon dan Kloepper, 2002. Mycotoxins Reported From Fusarium. dalam Boer et al., 2003
Jiang dan Xu, 1985. Botany For Degree Students Part II. Ram Nagar. Page 450-453.
Machmud, 1998. Bacterial Wilt in Indonesia, Persley, p. 30-34. Bacterial With Disease in Asia and The South Pasific, Philipines, p. 282.
Mujoko, 2005. Pemanfaatan Atinomycetes antagaonis sebagai pengendali hayati fusarium oxysporum f.sp. lycopersici pada tanaman tomat, Hal 15-40.
Nonomura dan Ohara, 1971. Current Concept of Active Defense in Plants. Rev. Phitopathol. 36: 59-90.
Plantus, 2008. Tanaman Jenis Solanaceae dalam Anekaplantasia, Cybermediaclips.
Rao, 1976. Biological Control of Damping off Diseases with Seed Treatments. p. 145-155
Reinjes et al, 1999. Ralstonia solanacearum Growing, Part 2.
Robert, M.A. 2002. Actinomycetes Biocontrol Questions and Answer, On line Micro2.
Rukmana, R. 1997. Penyakit Tanman dan Teknik Pengendalian, Kanisius, Yogyakarta, 96 hal.
Sastrosupadi, 1995. Rumus Rancangan Acak Lengkap, Home Page.
Semangun H, 1995. Pengantar Ilmu Penyakit Tumbuhan, Gajah Mada Universitas Press, Yogyakarta, Hal 37.
Stanier, 1965. Laporan Sarjana Hasanuddin dalam USU digital library, 2003.
Stolp, H. and D. Gadkari. 1983. Nonpathogenic Members of the Genus Pseudomonas. In: M.P. Starr, H.G. Troper, A. Ballows, and H.G. Schiegel. (eds.). The Prokaryotes A Handbook on Habitat, Isolation and Identification of Bacteria. Springer-Verlag. New York.
Suparyono, 1995. Upaya Pengendalian Penyakit Tanaman Tembakau. Ekspose Hasil Penelitian PTPN X
Suryadi, 1996. Dua sistem yang berbeda dalam mengelompokan P. solanacearum, Hal 16.
Teng, 1990. Water on Particle Surface. in Greenland, p. 405 - 408.
Upadhyay, R.S. & B. Rai. 1987. Studies on antagonism between Fusarium udum Aspiras, R.B. p. 89-92.
Wuryandari, Y., A. Purnawati, T. Arwiyanto, B. Hadisutrisno, 2005. Perlakuan Benih Tomat Secara Biologi dengan Pseudomonad fluoresen untuk Pengendalian Penyakit Layu Bakteri, Laporan Hibah Pekerti.
Wuryandari Y, A. Purnawati, T. Arwiyanto, B. Hadisutrisno, 2007. Kemampuan Antagonis Beberapa Isolat Pseudomonad fluoresen Terhadap Bakteri R. solanacearum Penyebab Penyakit Layu pada Tomat, Seminar Nasional Pengendalian Hayati. Fak. Pertanian Universitas Jember.
Wuryandari, Y., dan T. Arwiyanto, 1999. Karakter Ralstonia solanacearum dari Beberapa Inang Solanaceae di Yogyakarta. Fakultas Pertanian UGM. Yogyakarta. Hal 387-393
Wydra dan Rudolph, 1993. Peran Ekstraseluler Polisakarida Dalam Patogenis, Hal 11.