ISOTERM ADSORPSI KATION Mg(II) OLEH SILIKA GEL DARI
BAGASSE TEBU
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi
Sebagian Persyaratan guna Memperoleh Gelar Sarjana
Oleh: Muthia Khadijah
12307141019
PROGRAM STUDI KIMIA JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
HALAMAN MOTTO
Boleh jadi kamu
membenci
sesuatu, padahal ia amat
baik
bagimu, dan boleh jadi (pula) kamu
menyukai
sesuatu,
padahal ia amat
buruk
bagimu. Allah mengetahui, sedang kamu
tidak mengetahui.
(QS. Al
-Baqarah: 216)
Man Jadda Wa Jada
(Siapa yang
bersungguh-sungguh
akan
berhasil
)
Man Shobaro Zafiro
(Siapa yang
bersabar
akan
beruntung
)Man Saaro 'Alaa Darbi Washola
HALAMAN PERSEMBAHAN
Alhamdulillah.. Alhamdulillah.. Alhamdulillahirabbil’alamin..
Sujud syukur ku persembahkan kepada Allah yang Maha Pengasih dan Maha Penyayang. Atas karunia serta kemudahan yang Engkau berikan padaku
akhirnya Tugas Akhir Skripsi ini dapat terselesaikan.
Karya tulis sederhana ini, Ku persembahkan untuk Ayah Ibu dan keluargaku tercinta yang tiada hentinya selama ini memberiku nasihat, doa, dukungan,
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT, karena dengan rahmat, karunia, serta taufik dan hidayah-Nya penulis dapat menyelesaikan laporan Tugas Akhir Skripsi (TAS) yang berjudul “Isoterm Adsorpsi Kation Mg(II) oleh Silka Gel dari Bagasse Tebu”.
Dalam menyelesaikan laporan ini penulis banyak mendapatkan bimbingan, pengarahan, dan bantuan yang sangat berharga dari berbagai pihak. Oleh karena itu, penulis mengucapkan terimakasih kepada:
1. Bapak Prof. Dr. Rochmat Wahab, M.PD. M.A selaku Rektor Universitas Negeri Yogyakarta.
2. Bapak Dr. Hartono selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta.
3. Bapak Jaslin Ikhsan, Ph.D sebagai Ketua Jurusan Pendidikan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta, sekaligus Dosen Penguji Pendamping yang telah memberikan pertanyaan, saran dan nasihat untuk penulis dalam menyelesaikan tugas akhir skripsi. 4. Ibu Dr. Siti Sulastri, M.S. selaku Dosen Pembimbing saya yang telah banyak
memberi saran dan nasihat untuk penulis dalam menyelesaikan tugas akhir skripsi.
6. Bapak Erfan Priyambodo, M.Si selaku Dosen Pembimbing Akademik dan Sekretaritaris Penguji yang telah memberikan bimbingan, nasehat, serta saran kepada penulis dalam menyelesaikan tugas akhir skripsi.
7. Orang tua dan keluarga yang selalu mendoakan, mendukung, dan memberi semangat dalam melaksanakan kegiatan dan penyelesaian Tugas Akhir Skripsi.
8. Seluruh pihak yang tidak dapat penulis sebutkan satu per satu yang telah membantu penulis dalam menyelesaikan Tugas Akhir Skripsi ini.
Penulis menyadari bahwa laporan tugas akhir skripsi ini masih jauh dari kata sempurna. Oleh sebab itu, penulis mengharap kritik dan saran yang membangun demi kesempurnaan tugas akhir ini. Semoga tugas akhir skripsi ini dapat digunakan sebagaimana mestinya dan bermanfaat bagi pembaca dan penulis dalam perbaikan pendidikan di masa yang akan datang.
Yogyakarta, 26 September 2016
DAFTAR ISI
A. Latar Belakang Masalah ... 1
B. Identifikasi Masalah ... 3
C. Pembatasan Masalah ... 3
D. Rumusan Masalah ... 4
E. Tujuan Penelitian ... 4
F. Manfaat Penelitian ... 4
7. Kesetimbangan Adsorpsi ... 16
8. Difraksi Sinar-X ... 21
9. Spektroskopi FTIR ... 23
10. Spektroskopi Serapan Atom (SSA) ... 26
B. Penelitian yang Relevan ... 29
C. Kerangka Berpikir ... 30
BAB III METODE PENELITIAN ... 31
A. Subyek dan Obyek Penelitian ... 31
B. Variabel Penelitian ... 31
C. Tahapan Pelaksanaan ... 31
1. Alat ... 31
2. Bahan ... 32
3. Prosedur Penelitian ... 32
D. Pengelolaan Data ... 36
1. Teknik Pengumpulan Data ... 36
2. Teknik Analisis Data ... 37
BAB IV HASIL PENELITIAN DAN PEMBAHSAN ... 40
A. Hasil Penelitian ... 40
1. Hasil Sintesis Silika Gel dari Bagasse tebu ... 40
2. Hasil Analisis Secara Difraksi Sinar-X (XRD) ... 40
3. Hasil Analisis Secara Spektroskopi FTIR ... 41
4. Kesetimbangani Kation Mg2+ oleh Silika Gel pada Berbagai Konsentrasi Sorbat ... 42
5. Model Isoterm Adsorpsi Kation Mg2+ oleh Silika Gel ... 43
B. Pembahasan ... 46
1. Hasil Sintesis Silika Gel dari Bagasse tebu ... 46
2. Hasil Karakterisasi Secara Difraksi Sinar-X ... 53
3. Hasil Karakterisasi Secara Spektroskopi FTIR ... 53
4. Kesetimbangan Adsorpsi Kation Mg2+ oleh Silika Gel pada Berbagai Konsentrasi Sorbat ... 55
BAB V KESIMPULAN DAN SARAN ... 59
A. Kesimpulan ... 59
B. Saran ... 59
DAFTAR PUSTAKA ... 60
DAFTAR TABEL
DAFTAR GAMBAR
Halaman
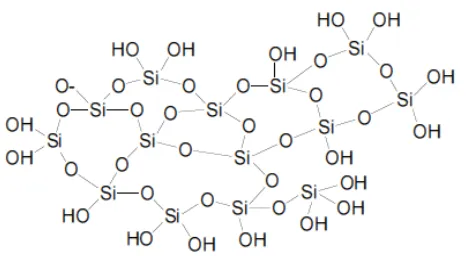
Gambar 1. Struktur Kimia Silika Gel ... 9
Gambar 2. Kurva Isoterm Adsorpsi Freundlich ... 17
Gambar 3. Ilustrasi Adsorpsi pada Isoterm Langmuir ... 19
Gambar 4. Kurva Isoterm Adsorpsi Langmuir ... 20
Gambar 5. Proses Atomisasi ... 26
Gambar 6. Kurva Kalibrasi ... 27
Gambar 7. Hasil Karakterisasi Secara Difraksi Sinar-X Silika Gel ... 41
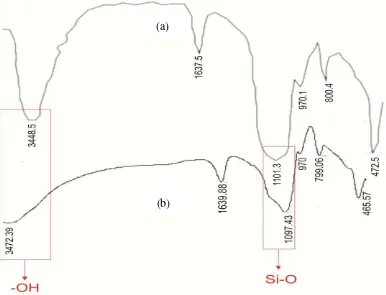
Gambar 8. Spektra FTIR (a) silika Kiesel gel 60 Merck, (b) silika gel dari Bagasse Tebu ... 42
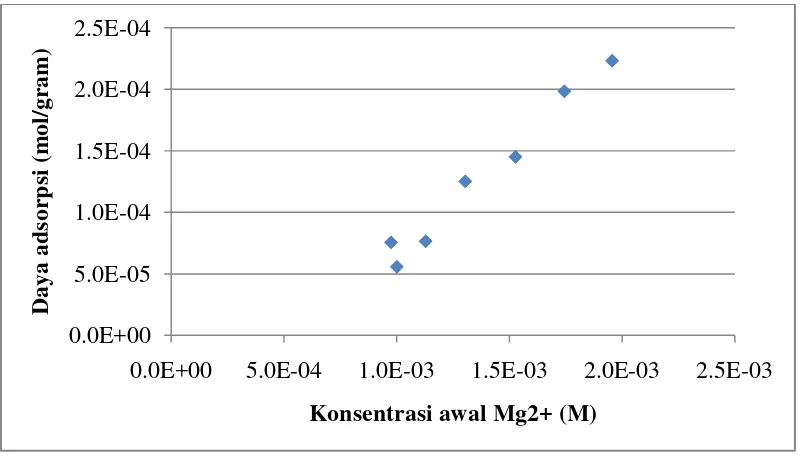
Gambar 9. Grafik Hubungan Antara Daya Adsorpsi Silika dari Bagasse Tebu Terhadap Konsentrasi Awal Mg2+ ... 43
Gambar 10. Pola Isoterm Langmuir Adsorpsi Ion Mg2+ ... 45
Gambar 11. Pola Isoterm Freundlich Adsorpsi Ion Mg2+ ... 45
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Sintesis Silika Gel ... 69
Lampiran 2. Perhitungan Larutan Eksperimen Adsorpsi ... 71
Lampiran 3. Pembuatan Kurva Standar Larutan Mg2+ ... 76
Lampiran 4. Perhitungan Parameter Isoterm Freundich dan Langmuir ... 77
Lampiran 5. Skema Penelitian ... 82
Lampiran 6. Hasil Karakterisasi Secara XRD, FTIR, dan AAS ... 86
Isoterm Adsorpsi Kation Mg(II) oleh Silika Gel dari Bagasse Tebu Oleh :
Muthia Khadijah NIM 12307141019
Pembimbing : Dr. Siti Sulastri, M.S. ABSTRAK
Penelitian ini bertujuan untuk menentukan karakter silika gel dari bagasse
tebu, mengetahui pengaruh konsentrasi Mg2+ terhadap daya adsorpsi, serta mengetahui model isoterm adsorpsi kation Mg2+ oleh silika gel.
Silika gel dari bagasse tebu telah dibuat melalui proses sol-gel dengan cara menambahkan HCl 1 M ke dalam larutan natrium silikat hingga pH 7 dan terbentuk gel. Gel yang terbentuk dikeringkan menggunakan oven pada suhu 80oC. Silika gel yang didapat dikarakterisasi secara XRD, FTIR, serta diuji kemampuannya untuk adsorpsi kation Mg2+ pada berbagai konsentrasi.
Hasil karakterisasi secara Difraksi Sinar-X menunjukkan bahwa silika gel berstruktur amorf, sedangkan untuk karakterisasi FTIR menunjukkan bahwa silika gel telah berhasil disintesis ditandai dengan munculnya puncak serapan pada panjang gelombang 1097,43 yang mengindikasikan adanya gugus Si-O dan puncak serapan pada panjang gelombang 3472,39 yang mengindikasikan adanya gugus –OH. Analisa AAS menunjukkan bahwa penambahan konsentrasi Mg2+ menyebabkan daya adsorpsi silika meningkat. Model isoterm yang sesuai pada adsorpsi silika gel adalah isoterm Langmuir. Hal ini dikarenakan harga R isoterm Langmuir lebih besar daripada harga Rpada isotherm Freundlich, yaitu sebesar 0.952.
.
Isotherm Adsorption of Mg(II) Kation by Gel Silica from Sugarcane Bagasse By :
Muthia Khadijah NIM 12307141019
Supervisior : Dr. Siti Sulastri, M.S. ABSTRACT
This research aims to determine the character of gel silica from sugarcane bagasse, to determine the effect of Mg2+ concentration on the adsorption capacity, and to determine the model of adsorption isotherms Mg2+ cation by gel silica.
Gel silica from sugarcane bagasse have been prepared through sol-gel method with addition of HCl 1 M to a solution of sodium silicate until pH 7 and formed gel. The gel dried in oven at 80 °C. Gel silica were characterized with XRD, FTIR and used for Mg2+ adsorption for various concentrations.
The results of X-Ray Diffraction characterization showed that gel silica had amorphous structure, while the results of FTIR showed that the gel silica have been successfully synthesized which were indicated by the appearance of absorption peaks at wavelengths of 1097.43 indicating the Si-O group and the absorption peak at a wavelength of 3472.39 indicating the -OH group. AAS analysis showed that increasing the concentration of Mg2+ cation caused the increasing adsorption capacity of silica. Isotherm model suitable of adsorption gel silica is Langmuir isotherm, from which the value of R Langmuir isotherm is greater than the value of R on Freundlich isotherm that is 0.952.
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Ampas atau bagasse tebu adalah zat yang didapatkan dari sisa pengolahan tebu pada industri pengolahan gula pasir. Proses produksi gula menghasilkan bagasse tebu sebesar 90%, gula yang dimanfaatkan hanya 5% dan sisanya berupa tetes tebu (molase) dan air (Witono, 2003). Bagasse tebu merupakan limbah pabrik gula yang pemanfaatannya belum maksimal.
Bagasse tebu mengandung serat (selulosa, pentosan, dan lignin), abu, dan air (Syukur, 2006). Beberapa penelitian dilakukan agar nilai dan fungsi dari
bagasse tebu semakin bertambah, misalnya digunakan sebagai biomassa (Worathanakul dkk., 2009), untuk membuat silika aerogel (Akhinov, 2010; Arizanova, 2012; Nazriati, 2011), sebagai sumber energi pembakaran (Saechu, 2009), untuk bahan bata (Madurwar et. al., 2014) dan sebagai adsorben (Kanawade, 2011). Kaur (2008) mengemukakan bahwa bagasse tebu juga dapat dimanfaatkan sebagai adsorben logam berat seperti Zn2+ (90%), Cd2+ (70%), Pb2+ (80%), dan Cu2+ (55%).
Penelitian ini dimaksudkan untuk memanfaatkan silika yang terkandung dalam bagasse, yang persentasenya sangat tinggi, yaitu berkisar 70-80% dari abu kering bagasse (Susila, 2011) menjadi pengemban unsur hara (kation) yang kuat, sehingga tidak serta merta dilepaskan kembali. Ekstraksi SiO2 dari bagasse tebu ini dilakukan dengan menggunakan NaOH
hingga pH 7 agar diperoleh gel (Dian Meirawati dkk., 2013). Selain dapat menjadi penjerap yang baik, silika juga mampu melepaskan kembali (desorpsi) sorbat yang telah diikatnya dengan laju tertentu. Potensi silika yang memiliki kemampuan melepaskan kembali sorbat yang diikatnya dapat diimplementasikan terhadap laju unsur hara yang lambat, dimana unsur hara yang telah terjerap oleh silika dapat dilepaskan secara perlahan sesuai dengan laju penyerapan tanaman. Hal tersebut dapat diaplikasikan melalui prinsip pupuk Slow Release Fertilizer (SRF).
Berdasarkan uraian singkat di atas, melalui penelitian ini peneliti ingin mengkaji model isoterm adsorpsi kation Mg2+ oleh sorben silika gel dari
bagasse tebu.
B. Identifikasi Masalah
Berdasarkan latar belakang yang telah diuraikan diatas, pokok permasalahan yang dapat diidentifikasi dalam penelitian ini adalah:
1. Jenis adsorben yang digunakan dalam penelitian. 2. Jenis adsorbat yang diteliti dalam penelitian.
3. Variasi konsentrasi Mg2+ yang digunakan selama proses adsorpsi.
C. Pembatasan Masalah
Berdasarkan identifikasi masalah diatas, maka perlu diberikan pembatasan masalah, yaitu:
1. Jenis adsorben yang digunakan dalam penelitian ini adalah silika gel yang berasal dari baggasse tebu, yang didapat dari pedagang es Sunday Morning.
2. Jenis adsorbat yang digunakan dalam penelitian ini adalah kation Mg2+. 3. Konsentrasi Mg2+ divariasi dengan cara menambahkan larutan Mg2+
D. Rumusan Masalah
Berdasarkan pembatasan masalah diatas, maka rumusan masalah dari penelitian ini adalah:
1. Bagaimana karakter silika gel dari bagasse tebu?
2. Bagaimanana pengaruh konsentrasi kation Mg2+ terhadap daya adsorpsi Mg2+ oleh silika gel dari bagasse tebu?
3. Bagaimana model isoterm yang sesuai untuk adsorpsi kation Mg2+ oleh silika gel dari bagasse tebu?
E. Tujuan Penelitian
Berdasarkan rumusan masalah diatas, maka tujuan dari penelitian ini adalah sebagai berikut:
1. Mengetahui karakter silika gel dari bagasse tebu.
2. Mengetahui pengaruh konsentrasi kation Mg2+ terhadap daya adsorpsi Mg2+ oleh silika gel dari bagasse tebu.
3. Mengetahui model isoterm yang sesuai untuk adsorpsi kation Mg2+ oleh silika gel dari bagasse tebu.
F. Manfaat Penelitian
1. Bagi peneliti
a. Memberikan informasi tentang karakter silika dari Bagasse Tebu b. Memberikan informasi tentang pengaruh konsentrasi kation Mg2+
terhadap daya adsorpsi Mg2+ oleh silika gel dari bagasse tebu. c. Memberikan informasi tentang model isoterm yang sesuai untuk
adsorpsi kation Mg2+ oleh silika gel dari bagasse tebu. 2. Bagi masyarakat
Hasil penelitian ini diharapkan dapat memberi manfaat untuk masyarakat sebagai upaya meningkatkan nilai ekonomis bagasse tebu, sehingga limbah hasil produksi gula tidak mencemari lingkungan.
3. Bagi akademisi
BAB II KAJIAN TEORI
A.Deskripsi Teori 1. Bagasse Tebu
Tebu (Sacharum officinarum, Linn.) merupakan tanaman bahan baku pembuatan gula yang hanya dapat ditanam di daerah beriklim tropis. Umur tanaman sejak ditanam sampai bisa dipanen mencapai kurang lebih satu tahun. Tebu termasuk keluarga Graminae atau rumput-rumputan dan cocok ditanam pada daerah dengan ketinggian 1 sampai 1.300 meter di atas permukaan air laut. Di Indonesia terdapat beberapa jenis tebu, di antaranya tebu hitam (cirebon), tebu kasur, POJ 100, POJ 2364, EK 28, dan POJ 2878. Tebu dari perkebunan diolah menjadi gula di pabrik gula. Dalam proses produksi gula, dari setiap tebu yang diproses, dihasilkan bagasse tebu sebesar 90%, gula yang dimanfaatkan hanya 5% dan sisanya berupa tetes tebu (molase) dan air (Witono, 2003).
Bagasse tebu adalah bahan sisa berserat dari batang tebu yang telah mengalami ekstraksi niranya dan banyak mengandung parenkim serta tidak tahan disimpan karena mudah terserang jamur. Serat sisa dan bagasse tebu kebanyakan digunakan sebagai bahan bakar untuk menghasilkan energi yang diperlukan untuk pembuatan gula (Slamet, 2004).
memungkinkan digunakannya bagasse tebu sebagai pakan ternak, tetapi adanya lignin dengan kandungan cukup tinggi (19.7%) dan kadar protein yang rendah (28%) menyebabkan penggunaannya sangat terbatas (Balai Informasi Pertanian, 2005). Pentosan merupakan salah satu polisakarida yang terdapat dalam bagasse tebu dengan persentase sebesar 20-27%. Kandungan pentosan yang cukup tinggi tersebut memungkinkan bagasse
tebu diolah menjadi furfural yang memiliki aplikasi cukup luas dalam beberapa industri terutama untuk mensintesis senyawa-senyawa turunannya seperti furfuril alkohol, furan dan lain-lain (Witono, 2003). Kaur (2008) mengemukakan bahwa bagasse tebu juga dapat dimanfaatkan sebagai adsorben logam berat seperti Zn2+ (90%), Cd2+ (70%), Pb2+ (80%), dan Cu2+ (55%).
2. Unsur Makro Mg2+ dalam tanaman
Unsur hara Mg2+ merupakan unsur hara makrosekunder yang berperan penting sebagai bahan pembentuk molekul klorofil dan komponen enzim esensial (Rankine dan Fairhurst, 1999; dan Havlin et. al., 2004). Kekurangan elemen ini dapat dilihat dengan menguningnya daun.
3. Silika Gel
Silika adalah senyawa hasil polimerisasi asam silikat yang tersusun tidak teratur dari gelobula-gelobula rantai satuan SiO4 tetrahedral dan
beragregasi membentuk kerangka tiga dimensi yang lebih besar (sekitar 1-25 µm) dengan formula umum SiO2. Di alam senyawa silika ditemukan
dalam beberapa bahan alam seperti pasir, kuarsa, gelas, dan sebagainya. Silika sebagai senyawa yang terdapat di alam berstruktur kristalin, sedangkan sebagai senyawa sintetis adalah amorf (Siti dan Susila, 2010). Menurut Bhatia silika mempunyai kelebihan dibandingkan dengan bahan lain, yaitu bersifat inert, hidrofobik, dan transparan (Sriyanti, 2005).
Silika gel merupakan padatan anorganik yang memiliki kestabilan termal dan kestabilan mekanik yang cukup dan relatif tak mengembang dalam pelarut organik (Sriyanti dkk., 2005). Silika gel merupakan suatu bentuk dari silika yang dihasilkan melalui penggumpalan sol natrium silikat. Sol mirip agar–agar ini dapat didehidrasi sehingga berubah menjadi padatan atau butiran mirip kaca yang bersifat tidak elastis. Sifat ini menjadikan silika gel dimanfaatkan sebagai zat penyerap, pengering dan penopang katalis. Silika gel dapat mencegah terbentuknya kelembaban yang berlebihan sebelum terjadi (Sri Hartuti, 2011).
Rumus kimia silika gel secara umum adalah SiO2.xH2O. Struktur
satuan mineral silika pada dasarnya mengandung kation Si4+ yang terkoordinasi secara tetrahedral dengan anion O2-. Susunan tetrahedral SiO4
Menurut Aergerter, silika gel memiliki karakteristik yang unik, yaitu porositas tinggi (80-90%), dengan densitas rendah (0,003-0,35 g/cm3), konduktivitas termal rendah (< 0,005 W/mK), indeks bias rendah (~1.05), dan luas permukaan yang tinggi (500-1600 m2/g) (Angelina Rosmawati dkk., 2013).
Gambar 1. Struktur Kimia Silika Gel
Menurut Scott (1993), pembuatan silika gel dapat dilakukan melalui beberapa tahapan, yaitu :
a. Pembentukan natrium silikat (Na2SiO3) dari reaksi SiO2 yang terdapat
dalam suatu bahan dengan NaOH.
b. Reaksi pembentukan silika hydrosol dari reaksi antara Na2SiO3 dengan
asam.
c. Reaksi pembentukan silika hidrogel, yaitu polimerisasi asam silikat. Pemanasan silika hidrogel menghasilkan silika gel.
dalam sintesis silika gel adalah natrium hidroksida. Penggunaan natrium hidroksida sebagai pereaksi dikarenakan natrium hidroksida merupakan pereaksi yang sangat kuat dan cenderung untuk membentuk buih saat dipanaskan karena sifatnya yang mudah menyerap air atau hidroskopis (Johnson dkk., 1991). Reaksi hidrolisis berlangsung secara baik pada kondisi asam. Pengasaman terhadap larutan natrium silikat akan membentuk silika hydrosol yang apabila didiamkan akan membentuk hidrogel. Pemanasan pada suhu 100oC mengakibatkan dehidrasi pada hidrogel dan terbentuklah silika gel (SiO2.xH2O).
Silika gel dibagi menjadi tiga tipe, yaitu regular density gel
diproduksi dengan pencampuran di media asam, mempunyai diameter sangat kecil dan specific surface area yang sangat tinggi. Jenis yang kedua adalah intermedite density gel yang mempunyai ukuran diameter 12-16 nm dan memiliki SSA 300 – 350 m2/g. Jenis ketiga adalah low density gel. Penggunaan produk ini untuk mencegah timbulnya jamur, bau dan kelembaban (Welveni, 2010).
Menurut Oscik, sifat silika gel ditentukan oleh orientasi dari ujung tempat gugus hidroksil berkombinasi (Siti dan Susila, 2010). Pada silika gel terdapat dua jenis gugus aktif hidroksil (-OH) (Shriver,1990), yaitu:
1. Gugus –OH bebas, jarak antara –OH dengan –OH lainnya 0,50-0,52 nm 2. Gugus –OH terikat, dengan jarak –OH dengan –OH yang lain antara
Adanya gugus aktif dan sifat-sifat fisik silika gel tersebut maka silika gel secara umum sering digunakan sebagai adsorben, desikan dan pengisi pada kromatografi (sebagai fase diam) (Ishizaki et. al., 1998). Kelemahan silika gel adalah jenis situs aktif silika gel hanya berupa gugus silanol (-SiOH) dan siloksan (Si-O-Si). Silika gel murni dengan adanya gugus silanol dan siloksan telah dilaporkan dapat mengabsorbsi ion logam keras seperti Na+, Mg2+, Ca2+, dan Fe2+ (Cestari, 2000). Menurut Tokman, gugus silanol ini mempunyai sifat keasaman yang rendah, disamping mempunyai oksigen sebagai atom donor yang sifatnya lemah (Siti dan Susila, 2010). Menurut Morrow dan Gay gugus siloksan ada dua macam, yaitu Si-O-Si rantai lurus dan gugus siloksan yang membentuk struktur lingkar dengan empat anggota (Siti dan Susila, 2010),. Jenis Si-O-Si rantai lurus tidak reaktif dengan pereaksi pada umumnya, tetapi sangat reaktif terhadap senyawa logam alkali. Jenis gugus siloksan yang membentuk lingkar dengan empat anggota mempunyai reaktivitas yang tinggi, dapat mengadakan kemisorpsi dengan air, amoniak dan metanol. Reaksi dengan air akan menghasilkan dua gugus Si-OH, reaksi dengan amonia akan menghasilkan gugus Si-NH2 dan silanol, sedangkan reaksi dengan metanol akan
menghasilkan gugus silanol dan Si–O-CH3. Jumlah gugus silanol dan gugus
4. Metode Sol-Gel
Metode sol-gel adalah metode preparasi padatan dengan teknik temperatur rendah yang melibatkan transisi dari suatu sistem dengan partikel-partikel mikroskopik yang terdispersi dalam suatu cairan (sol) menjadi material makroskopik (gel). Prinsip dari metode sol gel yaitu penambahan bahan yang dimobilisasikan pada saat matriks berbentuk sol menuju ke arah pembentukan padatan (gel) (Agus dkk., 2013).
Menurut Ihda dkk. (2012), silika dapat disintesis dengan metode sol-gel karena metode ini pembuatannya mudah. Selain itu, hasil sintesis dengan metode sol gel juga memiliki homogenitas yang tinggi (Sriyanti, 2005). Penelitian tentang sol-gel yang telah ada menunjukkan bahwa proses sol-gel tidak hanya menghasilkan material yang homogen, tetapi dapat juga digunakan untuk sintesis berbagai macam material campuran antara organik dan anorganik (Bandyopadhyay et al., 2005). Metode sol-gel juga lebih unggul dibandingkan dengan metode yang lain karena untuk memperoleh komposit padat yang homogen dilakukan melalui proses gelasi sol pada suhu ruang (Lee Chou dkk., 2007).
Proses sol-gel diawali dengan mengasamkan larutan natrium silikat hingga terbentuk gel karena silika memiliki kelarutan yang tinggi, yaitu pada pH lebih dari 10 (Scott, 1993). Penambahan asam bertujuan untuk mendapatkan silika hidrosol (H2SiO3) diikuti reaksi pembentukan sol asam
Si(OH)4 selanjutnya dikeringkan akan membentuk silika gel. Reaksi yang
Na2SiO3 + 2HCl H2SiO3 + 2NaCl (1)
H2SiO3 + H2O Si(OH)4 (2)
Penambahan HCl pada larutan Na2SiO3 mengakibatkan terjadinya
penurunan pH, sehingga konsentrasi H+ dalam Na2SiO3 semakin meningkat.
Hal ini menyebabkan silikat berubah menjadi asam silikat (H2SiO3). Pada
kondisi ini sebagian gugus siloksan (S-O-) membentuk gugus silanol (Si-(OH)4). Gugus ini terpolimerasi membentuk ikatan silang Si-O-Si
hingga terbentuk gel silika melalui proses kondensasi.
Pada penelitian ini, pengasaman natrium silikat yang dilakukan menggunakan asam klorida. Menurut Sriyanti (2005), pengasaman natrium silikat dengan HCl menyebabkan pembentukan gel yang sangat cepat, hal ini terjadi di sekitar pH 9-7. Penambahan HCl terus menerus akan menyebabkan gel melarut kembali.
5. Adsorpsi
sebagian besar berdifusi lanjut ke dalam pori-pori adsorben (difusi internal). Bila kapasitas adsorpsi masih sangat besar, sebagian besar akan teradsorpsi dan terikat di permukaan, namun bila permukaan sudah jenuh atau mendekati jenuh dengan adsorbat, dapat terjadi dua hal.
1. Terbentuk lapisan adsorpsi kedua dan seterusnya di atas adsorbat yang telah terikat di permukaan, gejala ini disebut adsorpsi multilayer.
2. Tidak terbentuk lapisan kedua dan seterusnya sehingga adsorbat yang belum teradsorpsi berdifusi keluar pori dan kembali ke arus fluida (Sihombing, 2007).
Beberapa faktor yang mempengaruhi adsorpsi antara lain (Asep Saepudin, 2009):
1. Sifat fisika dan kimia adsorben, yaitu luas permukaan, pori-pori, dan komposisi kimia.
Semakin luas permukaan adsorben maka semakin banyak adsrobat yang teradsorpsi sebab semakin banyak pula situs-situs aktif yang tersedia pada adsorben untuk kontak dengan adsorbat. Luas permukaan sebanding dengan jumlah situs aktif adsorben.
2. Sifat fisika dan kimia adsorbat, yaitu ukuran molekul, polaritas molekul, dan komposisi kimia.
Molekul yang besar akan lebih mudah teradsorpsi daripada molekul yang kecil, namun pada difusi pori molekul-molekul yang besar akan mengalami kesulitan untuk teradsorpsi akibat konfigurasi yang tidak mendukung. Sehingga adanya batas ukuran molekul tertentu pada setiap adsorpsi.
3. Konsentrasi adsorbat dalam fase cair (larutan).
Konsentrasi adsorbat yang tinggi akan menghasilkan daya dorong (driving force) yang tinggi bagi molekul adsorbat untuk masuk ke dalam situs aktif adsorben.
4. Sifat fase cair, seperti pH dan temperatur.
teradsorpsi. Asam organik lebih mudah teradsorpsi pada pH rendah sedangkan basa organik terjadi pada pH tinggi.
5. Lamanya proses adsorpsi tersebut berlangsung.
Waktu pengadukan yang relatif lama akan memberikan waktu kontak yang lebih lama terhadap adsorben untuk berinteraksi dengan adsorbat.
6. Kesetimbangan Adsorpsi
Kesetimbangan adsorpsi adalah suatu keadaan dimana tidak terjadi lagi perubahan konsentrasi adsrobat. Kesetimbangan adsorpsi dapat ditunjukkan dengan cara menganalisis kurva isoterm adsorpsi. Kurva ini merupakan fungsi konsentrasi zat terlarut yang terjerap pada padatan terhadap konsentrasi larutan. Adsorpsi fase cair-padat pada umumnya menganut tipe isoterm Freundlich dan Langmuir (Atkins, 1997). Adsorben yang baik memiliki kapasitas adsorpsi dan persentase penjerapan yang tinggi. Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus:
Q = (�1−�2) ��
Persentase penjerapan dapat dihitung menggunakan rumus: Jumlah ion teradsorpsi (%) = �1−�2
�1 � 100%
Keterangan:
Q = kapasitas adsorpsi per bobot molekul (mol/g) V = volume larutan (ml)
C1 = konsentrasi awal larutan (mol/L)
(1)
C2 = konsentrasi larutan saat setimbang (mol/L) m = bobot adsorben (g)
a. Model Isoterm Freundlich
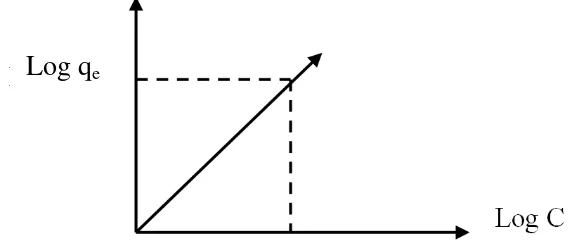
Model isoterm yang paling umum digunakan adalah model isoterm Freundlich. Model ini menggambar proses adsorpsi yang terjadi secara fisisorpsi pada banyak lapisan Model isoterm adsorpsi Freundlich mengasumsikan bahwa terdapat lebih dari satu lapisan permukaan (multilayer) dan situs bersifat heterogen, yaitu adanya perbedaan energi pengikat pada tiap-tiap situs (Schnoor, 1996). Kurva pada model isoterm Freundlich merupakan hubungan antara log qe terhadap log Ce seperti
yang disajikan pada Gambar 3 berikut:
Gambar 2. Kurva Isoterm Adsorpsi Freundlich (Murni, 2009)
qe adalah jumlah zat terlarut per gram adsorben (mol/g) dan Ce
adalah konsentrasi zat terlarut dalam larutan (mol/L), sehingga dari konsep tersebut dapat diperoleh persamaan sebagai berikut.
/ m = Kf. � 1/
log qe = log Kf + 1/n . log Ce
Keterangan:
= jumlah zat yang diadsorpsi (mol) m = berat adsorben (g)
qe = jumlah adsorbat yang teradsorp oleh adsorben pada saat
setimbang (mol/g)
�e = konsentrasi zat pada saat setimbang (mol/L)
Berdasarkan persamaan tersebut, jika dibuat kurva log qe terhadap
log Ce akan diperoleh persamaan linier dengan intersep log k dan kemiringan 1/n, sehingga nilai k dan n dapat diketahui (Murni, 2009). KF
adalah indikator kapasitas adsorpsi, dan n adalah intensitas adsorpsi (Tony, 1985). Berdasarkan isoterm ini, akan diketahui kemampuan adsorben untuk menyerap kation. Apabila harga 0<1/n<1 maka dapat dinyatakan bahwa adsorpsi bersifat favorabel dan menandakan adsorpsi yang kooperatif. Kekuatan interaksi antara adsorben dan adsorbat dapat dilihat dari nilai 1/n, semakin kecil nilai 1/n maka semakin kuat interaksi antara adsorben dengan adsorbat. Kemampuan relatif dari suatu adsorben dalam mengadsorpsi adsorbat dapat dilihat dari nilai KF,
semakin besar nilai KF maka semakin besar kemampuan suatu adsorben
dalam mengadsorpsi (Delle, 2001).
b. Model Isoterm Langmuir
yang ada pada permukaan memiliki energi yang sama, serta adsorpsi bersifat balik (Atkins, 1997). Menurut Sriyanti (2005), permukaan adsorben terdiri atas situs aktif, pada model isoterm ini semua adsorbat hanya teradsorpsi pada situs aktif dan tidak terjadi interaksi antar adsorbat, sehingga yang terbentuk adalah lapisan adsorpsi monomolekuler dengan jumlah molekul yang teradsorpsi tidak akan melebihi jumlah situs aktif.
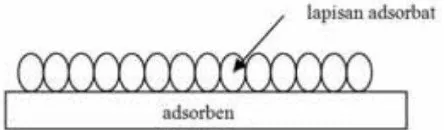
Tipe isoterm Langmuir merupakan proses adsorpsi yang berlangsung secara kemisorpsi satu lapisan. Adsorpsi satu lapisan terjadi karena ikatan kimia biasanya bersifat spesifik, sehingga permukaan adsorben mampu mengikat adsorbat dengan ikatan kimia. Model isoterm adsorpsi Langmuir didasarkan atas beberapa asumsi, yaitu: (a) pada masing-masing situs aktif hanya dapat mengadsorpsi satu molekul saja, dengan demikian adsorpsi terbatas pada pembentukan lapis tunggal (monolayer), illustrasinya dapat dilihat pada Gambar 3. (b) panas adsorpsi tidak tergantung pada penutupan permukaan, dan (c) semua situs dan permukaannya bersifat homogen (Oscik, 1982).
Gambar 3. Ilustrasi Adsorpsi pada Isoterm Langmuir
molekul zat yang diadsorpsi pada permukaan adsorben dengan molekul-molekul zat yang tidak teradsorpsi.
Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut:
�
= 1
� . +
�
�
Keterangan:
� = konsentrasi Mg2+ pada saat setimbang (mol/L)
qe = jumlah adsorbat yang teradsorp oleh adsorben pada saat setimbang
(mol/g)
� = kapasitas adsorpsi maksimum (mol/g)
= konstanta isoterm Langmuir (L/mol)
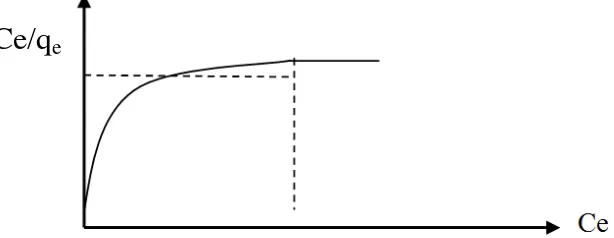
Gambar 4. Kurva Isoterm Adsorpsi Langmuir (Murni, 2009)
Besar kecilnya nilai qmax dan KL dapat diketahui dengan cara
mensubtitusikan persamaan linear yang diperoleh dari kurva hubungan Ce/N terhadap Ce (Gambar 4) ke dalam persamaan 4 (Murni Handayani dan Eko Sulistiyono, 2009; Maria Angela dkk., 2015).
(4)
7. Difraksi Sinar-X (X-Ray Diffraction/XRD)
Difraksi Sinar-X merupakan salah satu metode karakterisasi material yang paling tua dan paling sering digunakan hingga saat ini. Teknik ini digunakan untuk mengidentifikasi suatu material berdasarkan fasa kristalin dalam material dengan cara menentukan parameter kisi dan untuk menganalisis sifat-sifat struktur (seperti stress, ukuran butir, fasa komposisi orientasi kristal, dan cacat kristal) dari tiap fasa. (Auda, 2009).
Metode ini menggunakan seberkas sinar-X yang terdifraksi seperti sinar yang direfleksikan dari setiap bidang, berturut-turut dibentuk oleh atom-atom kristal dari material tersebut. Pola difraksi yang terbentuk menyatakan karakteristik dari sampel. Susunan ini diidentifikasi dengan membandingkannya dengan sebuah data base internasional (Zakaria, 2003). Prinsip kerja XRD adalah jika seberkas sinar-X di jatuhkan pada sampel kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang dibiaskan akan ditangkap oleh detektor kemudian diterjemahkan sebagai puncak difraksi. Semakin banyak bidang kristal yang terdapat pada sampel, makin kuat intensitas pembiasan yang dihasilkannya (Auda, 2009).
saling menghilangkan karena fasenya berbeda dan ada juga yang saling menguatkan karena fasenya sama (Jamaluddin, 2010).
Berkas sinar-X yang saling menguatkan disebut berkas difraksi. Persyaratan yang harus dipenuhi agar berkas sinar-X yang dihamburkan merupakan berkas difraksi dikenal sebagai Hukum Bragg. Hukum Bragg menyatakan bahwa perbedaan lintasan berkas difraksi sinar-X harus merupakan kelipatan panjang gelombang. Dasar dari penggunaan XRD untuk mempelajari kisi kristal berdasarkan persamaan Bragg berikut (Ismunandar, 2006):
n = d.sinθ
Keterangan:
n = bilangan bulat (1, 2, 3, ..dst) d = jarak antara dua bidang kisi (nm)
θ = sudut antara sinar datang dengan bidang normal
= panjang gelombang sinar-X yang digunakan (nm)
Hasil yang didapatkan dari difraksi sinar-X adalah berupa
puncak-puncak intensitas dan bentuk puncak-puncak difraksi dengan sudut hamburan (2θ)
tertentu. Tingkat kristalinitas struktur komponen ditunjukkan oleh tinggi rendahnya intensitas puncak. Analisa secara XRD pada penelitian ini bertujuan untuk mengetahui struktur serbuk silika hasil sintesis.
8. Spektroskopi FTIR
Metode spektroskopi FTIR digunakan untuk mengidentifikasi gugus-gugus fungsional yang terdapat pada suatu molekul, seperti silika gel. Selain itu, spektrum FTIR memiliki kegunaan yang lebih penting yaitu untuk memberikan keterangan tentang suatu molekul. Setiap gugus fungsional pada suatu molekul memiliki serapan yang karakteristik pada bilangan gelombang tertentu sehingga dapat diidentifikasi secara kualitatif menggunakan spektroskopi FTIR (Hardjono, 1992).
Spektroskopi FTIR adalah teknik pengukuran untuk mengumpulkan spektrum FTIR. Energi yang diserap sampel pada berbagai frekuensi sinar inframerah direkam, kemudian diteruskan ke interferometer. Sinar pengukuran sampel diubah menjadi interferogram. Perhitungan secara matematika untuk sinyal tersebut akan menghasilkan spekrum yang identik pada spektroskopi FTIR. Spektrofotometer FTIR terdiri dari 5 bagian utama, yaitu (Griffiths,1975):
a. Sumber sinar, yang terbuat dari filamen Nerst atau globar yang dipanaskan menggunakan listrik hingga temperatur 1000-1800 oC. b. Beam splitter, berupa material transparan dengan indeks relatif, sehingga
menghasilkan 50% radiasi akan direfleksikan dan 50% radiasi akan diteruskan.
d. Daerah cuplikan, dimana cuplikan masuk ke dalam daerah cuplikan dan masing-masing menembus sel cuplikan secara bersesuaian.
e. Detektor berfungsi mengubah sinyal radiasi FTIR menjadi sinyal listrik. Selain itu, detektor dapat mendeteksi adanya perubahan panas yang terjadi karena adanya pergerakan molekul.
Mekanisme yang terjadi pada alat FTIR dapat dijelaskan sebagai berikut: sinar yang datang dari sumber sinar akan diteruskan, kemudian akan dipecah oleh pemecah sinar menjadi dua bagian sinar yang saling tegak lurus. Sinar ini kemudian dipantulkan oleh dua cermin yaitu cermin diam dan cermin bergerak. Sinar hasil pantulan kedua cermin akan dipantulkan kembali menuju pemecah sinar untuk saling berinteraksi. Sebagian sinar akan diarahkan menuju cuplikan dan sebagian menuju sumber. Gerakan cermin yang maju mundur akan menyebabkan sinar yang sampai pada detektor akan berfluktuasi. Sinar akan saling menguatkan ketika kedua cermin memiliki jarak yang sama terhadap detektor, dan akan saling melemahkan jika kedua cermin memiliki jarak yang berbeda. Fluktuasi sinar yang sampai pada detektor ini akan menghasilkan sinyal pada detektor yang disebut interferogram. Interferogram ini akan diubah menjadi spektra FTIR dengan bantuan komputer berdasarkan operasi matematika (Tahid, 1994).
Berdasarkan penelitian Siti Sulastri (2013), silika gel yang diperoleh dari abu sekam padi memiliki puncak-puncak serapan yang menunjukkan
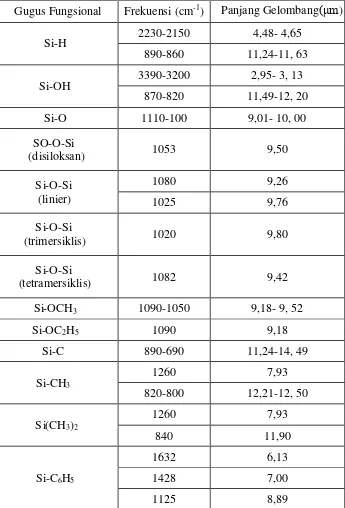
Karakterisasi ini diharapkan dapat digunakan untuk indikasi kualitatif keberhasilan sintesis silika gel. Serapan karakteristik senyawa-senyawa karbon-silikon ditunjukkan pada Tabel 1.
Tabel 1. Serapan Karakteristik Senyawa-Senyawa Organo-Silikon (Hardjono, 1992)
Gugus Fungsional Frekuensi (cm-1) Panjang Gelombang( m)
Si-H 2230-2150 4,48- 4,65
(trimersiklis) 1020 9,80
Si-O-Si
(tetramersiklis) 1082 9,42
9. Spektroskopi Serapan Atom (SSA)
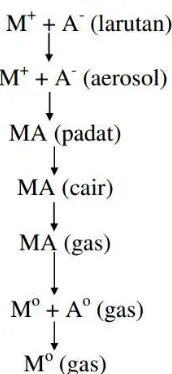
Spektroskopi serapan atom (SSA) adalah analisis kuantitatif terhadap unsur-unsur logam. Alat yang digunakan untuk analisis secara spektroskopi serapan atom disebut Spektrofotometer Serapan Atom. Alat ini memiliki sensitifitas yang sangat tinggi, sehingga sering dijadikan sebagai pilihan utama dalam menganalisis unsur logam yang konsentrasinya sangat kecil (ppm bahkan ppb). Prinsip dasar pengukuran dengan SSA adalah penyerapan energi (sumber cahaya) oleh atom-atom dalam keadaan dasar menuju ke keadaan tereksitasi. Pembentukan atom-atom dalam keadaan dasar atau proses atomisasi pada umumnya dilakukan dalam nyala. Cuplikan yang mengandung logam M sebagai ion M+ dalam bentuk larutan garam M+ dan A- akan melalui serangkaian proses dalam nyala, sebelum akhirnya menjadi atom logam dalam keadaan dasar M0 seperti terlihat pada Gambar 5.
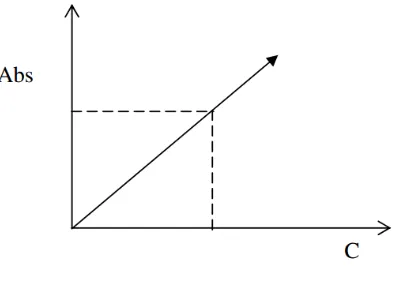
Atom-atom dalam keadaan dasar (Mo) akan menyerap sumber energi berupa lampu katoda berongga. Jumlah energi yang diserap adalah sebanding dengan populasi atau konsentrasi atom-atom dalam sampel (Welz, 1985). Penentuan konsentrasi unsur logam dalam sampel dapat dilakukan dengan bantuan kurva kalibrasi yang merupakan aluran antara absorbansi terhadap konsentrasi larutan standar. Kurva kalibrasi dapat dilihat pada Gambar 6.
Gambar 6. Kurva Kalibrasi
Hal ini sesuai dengan Hukum Lambert-Beer yang menyatakan bahwa jumlah energi yang diserap (absorbansi) adalah sebanding dengan konsentrasi (C). Hukum Lambert-Beer dapat dilihat pada persamaan 6 (Khopkar, 2003) .
A = ϵ . b . c Keterangan: A = absorbansi
b = tebal larutan (tebal kuvet diperhitungkan juga umumnya 1 cm) c = konsentrasi larutan yang diukur
ε = tetapan absorptivitas molar (jika konsentrasi larutan yang diukur dalam molar)
Hukum Lambert –Beer terpenuhi apabila kurva baku berupa garis lurus dan nilai R yang dihasilkan dari persamaan linear memiliki rentang 0.7-1.0. Berdasarkan persamaan linear maka diperoleh slope yang merupakan nilai ε (tetap absorptivitas molar). Menurut Dachriyanus (2004), Hukum Lambert-Beer terbatas karena sifat kimia dan faktor instrumen. Penyebab non linearitas ini adalah:
a. Deviasi koefisien ekstingsi pada konsentrasi tinggi (>0,01 M), yang disebabkan oleh interaksi elektrostatik antara molekul karena jaraknya yang terlalu dekat.
b. Hamburan cahaya karena adanya partikel dalam sampel. c. Flouresensi atau fosforesensi sampel.
d. Berubahnya indeks bias pada konsentrasi yang tinggi.
e. Pergeseran kesetimbangan kimia sebagai fungsi dari konsentrasi.
f. Radiasi non-monokromatik; deviasi bisa digunakan dengan menggunakan bagian datar pada absorban yaitu pada panjang gelombang maksimum.
B.Penelitian yang Relevan
Menurut Siti Sulastri (2013), dalam penelitiannya yang berjudul
“Sintesis dari Abu Sekam Padi Melalui Proses Sol Gel sebagai Penukar Kation Logam Berat dalam Larutan” menyebutkan bahwa adanya puncak serapan
gugus fungsi silanol (≡Si-OH) dan siloksan (=Si-O-Si=) pada silika gel saat dikarakterisasi menggunakan spektrofotometer FTIR.
Menurut Fahmiati dkk. (2006) dalam penelitiannya yang berjudul
“Termodinamika Adsorpsi Cd(II), Ni(II) dan Mg(II) pada Silika Gel yang
Terimobilisasi dengan 3-Merkapto-1,2,4-triasol” juga menyebutkan bahwa pola adsorpsi ion Mg2+ pada adsorben silika gel mengikuti isoterm adsorpsi Langmuir yang membentuk lapis tunggal.
Penelitian yang telah dilakukan oleh Isni Rosetya (2009) berjudul
“Modifikasi Silika Gel dari Abu Sekam Padi dengan Gugus Sulfonat Melalui Senyawa Epoksi untuk Adsorpsi Ion Logam Magnesium dan Besi” menyebutkan bahwa silika gel dari abu sekam padi dapat digunakan untuk adsorpsi Mg2+ dan Fe3+. Silika gel memiliki kemampuan adsorpsi terhadap Mg2+ sebesar 1,154 mmol/g.
C.Kerangka Berpikir
Penelitian ini dimaksudkan untuk memanfaatkan silika yang terkandung dalam bagasse tebu, yang persentasenya sangat tinggi, yaitu berkisar 70-80% (Susila, 2011) menjadi pengemban unsur hara (kation) yang kuat (dalam penelitian ini kation Mg2+), sehingga tidak serta merta dilepaskan kembali. Selain dapat menjadi penjerap yang baik, silika juga mampu melepaskan kembali (desorpsi) sorbat yang telah diikatnya dengan laju tertentu. Potensi silika yang memiliki kemampuan melepaskan kembali sorbat yang diikatnya dapat diimplementasikan terhadap laju Mg2+ yang lambat, dimana Mg2+ yang telah terjerap oleh silika dapat dilepaskan secara perlahan sesuai dengan laju penyerapan tanaman. Hal tersebut dapat diaplikasikan melalui prinsip pupuk
Slow Release Fertilizer (SRF). Semakin besar daya jerap dan kekuatan ikatan, maka semakin baik adsorben dimanfaatkan sebagai bahan pupuk Slow Release Fertilizer (SRF) karena dapat menjerap unsur hara yang dibutuhkan dan melepaskannya secara perlahan.
BAB III
METODE PENELITIAN
A.Subyek dan Obyek Penelitian
1. Subyek dari penelitian ini adalah silika gel hasil sintesis dari bagasse tebu. 2. Obyek penelitian ini adalah kesetimbangan adsorpsi dari silika gel terhadap
adsorpsi kation Mg2+.
B.Variabel Penelitian
1. Variabel bebas: konsentrasi kation Mg2+ (jumlah larutan kation Mg2+ yang ditambahkan adalah 1, 3, 4,5, 5, dan 5 mL)
2. Variabel terikat: model isoterm adsorpsi dari silika gel..
3. Variabel terkontrol: massa adsorben 0,2 gram, pH 5, suhu 25 oC dan waktu adsorpsi 30 menit.
C.Tahapan Pelaksanaan 1. Alat
a. Alat-alat gelas b. Ayakan 200 mesh
c. Lumpang porselen dan alu d. Penyaring Buchner
e. Kertas saring Whatman No. 42 f. Shaker
g. Magnetic stirrer dan pemanas h. Timbangan analitik
j. Muffle Furnace
k. Termometer
l. pH-meter atau pH-stick
m.Alumunium foil
n. Spektrofotometer FTIR o. Difraktometer Sinar-X
p. Spektrofotometer Serapan Atom
2. Bahan
a. Bagasse tebu
b. Kristal NaOH p.a. Merck c. Larutan HCl p.a. Merck d. Aqua demineralisata
e. Larutan HCl 0,01 M dan NaOH 0,01 M untuk penyesuaian pH f. Kristal Mg(NO3)2. 6H2O sebagai sumber Mg2+
3. Prosedur Penelitian Pembuatan Larutan
a. Larutan NaOH 1 M sebanyak 1000 mL
Ditimbang 40 gram kristal NaOH, selanjutnya dilarutkan dengan aqua demineralisata dalam labu takar 1000 mL hingga tanda batas. Larutan NaOH 1 M siap digunakan.
Larutan HCl p.a diambil sebanyak 83 mL, selanjutnya dimasukkan dalam labu takar 1000 mL dan dilarutkan dengan aqua demineralisata hingga tanda batas. Larutan HCl 1 M siap digunakan.
c. Larutan HCl 0,1 M sebanyak 1000 mL
Larutan HCl 1 M diambil sebanyak 100 mL, selanjutnya dimasukkan dalam labu takar 1000 mL dan dilarutkan dengan aqua demineralisata hingga tanda batas. Larutan HCl 0,1 M siap digunakan.
d. Larutan HCl 0,01 M sebanyak 1000 mL
Larutan HCl 1 M diambil sebanyak 10 mL, selanjutnya dimasukkan dalam labu takar 1000 mL dan dilarutkan dengan aqua demineralisata hingga tanda batas. Larutan HCl 0,01 M siap digunakan.
Perhitungan secara rinci untuk pembuatan larutan yang digunakan dapat dilihat pada Lampiran 1 (halaman 71).
Sintesis Silika Gel dari Bagasse Tebu a. Preparasi Sampel Bagasse Tebu
1) Mengeringkan sampel tebu dalam terik matahari selama satu hari kemudian dibakar.
2) Sampel diabukan di dalam muffle furnace pada suhu 600oC selama 5 jam.
3) Sampel hasil pengabuan ditumbuk dan diayak pada ukuran 100 mesh hingga diperoleh sampel bagasse halus.
1) 20 gram abu bagasse yang telah dihaluskan direndam dalam 1 liter 0,1 M HCl.
2) Campuran diaduk dengan magnetic stirrer selama 2 jam, dan dibiarkan semalam.
3) Campuran disaring dengan penyaring Buchner, dan dicuci dengan air sampai netral.
4) Hasil pencucian dikeringkan dalam oven pada suhu 80oC sampai massa konstan.
5) 6 gram abu bagasse yang telah dicuci HCl direaksikan dengan larutan 1 M NaOH dalam wadah teflon.
6) Campuran dipanaskan sampai mendidih selama 1 jam sambil diaduk dengan magnetic stirrer.
7) Filtrat dipisahkan dari endapannya dengan menyaring campuran menggunakan kertas saring Whatman no. 42. Cairan yang diperoleh adalah natrium silikat.
c. Pembuatan sorben silika gel
1) Menambahkan 0,1 M HCl tetes demi tetes ke dalam larutan natrium silikat hasil sintesis sambil diaduk hingga pH netral dan terbentuk gel. 2) Campuran dibiarkan selama 18 jam.
3) Hasilnya ditambah 20 mL aquades dan diaduk selama 15 menit. 4) Endapan dipisahkan dari larutannya melalui proses penyaringan
5) Gel silika yang diperoleh, dikeringkan dalam oven pada suhu 80oC, kemudian ditimbang sampai massa konstan.
d. Adsorpsi Mg2+ oleh silika gel
1) Pembuatan larutan Mg(NO3)2. 6H2O untuk eksperimen adsorpsi
a) Larutan 0,1 M Mg2+
Melarutkan 2,565 gram kristal Mg(NO3)2 . 6H2O dalam aqua
demineralisata kemudian diencerkan menggunakan labu ukur 100 mL hingga tanda batas. Hasil yang diperoleh adalah 100 mL larutan Mg2+ 0,1 M.
b) Larutan 0,001 M Mg2+
Memasukkan 1 mL larutan 0,1 M Mg(NO3)2 . 6H2O ke dalam labu
ukur 100 mL. Kemudian diencerkan hingga tanda batas. Hasil yang diperoleh adalah 100 mL larutan 0,001 M Mg2+.
Perhitungan secara rinci untuk pembuatan larutan Mg2+ dapat dilihat pada Lampiran 2 (halaman 73).
2) Adsorpsi kation Mg2+ oleh silika gel dari bagasse tebu pada berbagai variasi konsentrasi.
Prosedur adsorpsi yang dilakukan berdasarkan pada prosedur penelitian Jaslin Ikhsan dkk. (2015), yaitu sebagai berikut:
1) Sorben silika gel dengan massa 0,2 gram dilarutkan dalam 200 mL aqua demineralisata pada suhu konstan dan diaduk dengan
2) Larutan 0,001 M Mg2+, ditambahkan sedikit demi sedikit (1, 3, 4, 5, 5, dan 5 mL) ke dalam campuran suspensi.
3) Pada setiap penambahan larutan 0,001 M Mg2+, pH dipertahankan pada pH 5 dengan menambahkan HCl dan NaOH kemudian diaduk selama 30 menit.
4) 5 mL sampel diambil lalu disaring, kemudian filtratnya dianalisis secara AAS untuk mengetahui konsentrasi Mg2+. Perbedaan konsentrasi awal dan konsentrasi sisa Mg2+ merupakan jumlah Mg2+ yang terjerap oleh silika gel pada konsentrasi tersebut.
D.Pengelolaan Data
1. Teknik Pengumpulan Data
Data yang diperoleh dari penelitian ini berupa data kualitatif maupun kuantitatif.
a. Data Kualitatif
b. Data Kuantitatif
Data kuantitatif diperoleh dari data hasil analisis secara AAS. Data yang dihasilkan berisi informasi tentang pengukuran konsentrasi (kadar) sorbat yaitu kation Mg2+.
Data yang diperoleh berupa data konsentrasi Mg2+ sebelum dan sesudahadsorpsi. Data sorpsi tersebut kemudian dianalisis untuk membandingkan daya adsorpsi dan konstanta keseimbangan. Data dari hasil penelitian tersebut diolah secara kuantitatif untuk menentukan nilai konstanta keseimbangan (k).
2. Teknik Analisis Data
a. Penentuan konsentrasi larutan Mg2+
Konsentrasi larutan Mg2+ setelah proses adsorpsi dapat diketahui dengan mensubstitusikan pada persamaan garis linier yang diperoleh dari kurva standar. Kurva standar merupakan kurva hubungan antara konsentrasi larutan standar dengan hasil absorbansi standar. Masing-masing harga absorbansi larutan sampel yang dihasilkan dari pengukuran secara AAS disubstitusikan ke dalam persamaan linear yang didapat dari kurva standar:
Y= a + bX
=( − )
Berdasarkan persamaan 7 maka konsentrasi larutan Mg2+ dalam larutan dapat ditentukan. Perhitungan dilakukan secara
otomatis oleh program komputerisasi dari alat Spektrofotometer Serapan Atom.
b. Penentuan jumlah ion Mg2+ terikat(dalam %)
Jumlah ion Mg2+ terikat (dalam %) dihitung dengan menggunakan data konsentrasi sisa tersebut. Jumlah ion Mg2+ terikat (dalam %) dihitung dengan persamaan berikut:
Jumlah ion Mg2+ terikat(dalam %) = (Cawal – Csisa )
C awal x 100%
c. Perhitungan daya adsorpsi (N)
Penentuan daya adsorpsi dihitung dengan persamaan sebagai berikut:
N = M teradsorp
massa adsorben – total volume diambil x massa adsorben
Volume suspensi
Keterangan:
N = Jumlah adsorbat teradsorp oleh adsorben pada saat setimbang (mol/gram adsorben)
M = Jumlah ion Mg2+ terikat (mol) d. Penentuan Model Isoterm Adsorpsi
Model isoterm adsorpsi ditentukan berdasarkan dua model isoterm yaitu Langmuir dan Freundlich. Model isoterm adsorpsi yang sesuai ditentukan dari nilai R (pada grafik) yang paling besar. Persamaan model isoterm Langmuir dan Freundlich dapat dilihat pada persamaan 9 dan 10.
(8)
Persamaan Isoterm Langmuir
�
= 1
. � +
�
�
Keterangan:
� = Konsentrasi Mg2+ pada saat setimbang (mol/L)
q3 = Jumlah adsorbat yang teradsorp oleh adsorben pada saat
setimbang (mol/g)
� = Kapasitas adsorpsi maksimum (mol/g)
= Konstanta isoterm Langmuir (L/mol) Persamaan Isoterm Freundlich
log qe = log � + 1
log � Keterangan:
� = Konsentrasi Mg2+ pada saat setimbang (mol/L)
qe = Jumlah adsorbat yang teradsorp oleh adsorben pada saat
setimbang (mol/g)
= Kapasitas atau intensitas adsorpsi
� = Konstanta isoterm Freundlich (L/g)
(10)
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A.Hasil Penelitian
1. Hasil Sintesis Silika Gel dari Bagasse tebu
Bahan yang digunakan dalam penelitian ini adalah bagasse tebu.
Bagasse tebu diperoleh dari penjual es tebu Sunday Morning. Penelitian ini bertujuan untuk memperoleh silika gel dari bagasse tebu.
Tahap pertama dalam penelitian ini adalah preparasi sampel. Bagasse
tebu dibakar lalu diabukan dalam muffle furnace pada suhu 600oC, diperoleh abu bagasse tebu berwarna putih. Selanjutnya abu direaksikan dengan NaOH menghasilkan natrium silikat. Natrium silikat ini yang digunakan sebagai prekursor dalam pembuatan silika gel. Silika gel yang diperoleh berbentuk serbuk berwarna putih.
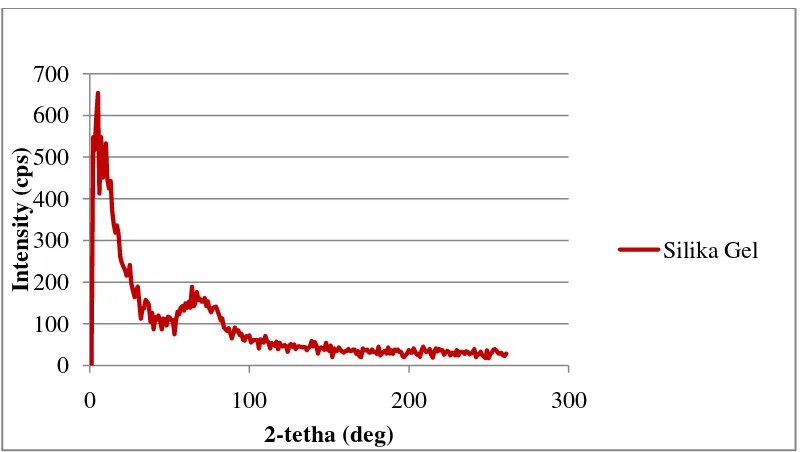
Hasil sintesis silika dari bagasse tebu tersebut dikarakterisasi secara difraksi sinar X dan spektoskopi FTIR. Karakterisasi secara difraksi sinar X bertujuan untuk mengetahui struktur kristal dari silika, sedangkan karakterisasi secara spektroskopi FTIR bertujuan untuk mengetahui gugus fungsi pada berbagai silika sehingga dapat diketahui keberhasilan sintesis. 2. Hasil Analisis Secara Difraksi Sinar-X (XRD)
Gambar 7. Hasil Karakterisasi Secara Difraksi Sinar-X Silika Gel
3. Hasil Analisis Secara Spektroskopi FTIR
Karakterisasi secara spektroskopi FTIR bertujuan untuk mengetahui gugus fungsi yang terdapat pada silika hasil sintesis sehingga dapat dipastikan keberhasilan proses sintesis.
Gambar 8. Spektra FTIR (a) silika Kiesel gel 60 Merck, (b) silika gel dari
Bagasse Tebu
4. Kesetimbangan Adsorpsi Kation Mg2+ oleh Silika Gel pada Berbagai Konsentrasi Sorbat
Variabel tetap pada eksperimen ini adalah suhu, waktu pengadukan, pH, dan massa adsorben. Pada penelitian ini dilakukan pada suhu 25oC dengan lama pengadukan 30 menit dan pH dibuat tetap yaitu 5. Sebanyak 0,2 gram adsorben dilarutkan ke dalam aqua dimineralisata, kemudian ditambahkan larutan 0,001 M Mg2+. Konsentrasi Mg2+ divariasi dengan menambahkan larutan Mg2+ ke dalam aqua dimineralisata sebanyak 1, 4, 8, 13, 18, dan 23 mL. Grafik hubungan antara daya adsorpsi sorben silika gel terhadap konsentrasi awal Mg2+ dapat dilihat pada Gambar 8. Perhitungan
(a)
Gambar 9. Grafik Hubungan Antara Daya Adsorpsi Silika dari Bagasse
Tebu Terhadap Konsentrasi Awal Mg2+
5. Model Isoterm Adsorpsi Kation Mg2+ oleh Silika Gel
Penentuan model isoterm adsorpsi diperoleh dari eksperimen adsorpsi pada berbagai variasi konsentrasi adsorbat. Model isoterm adsorpsi yang sering digunakan adalah isoterm Langmuir dan isoterm Freundlich. Penentuan isoterm adsorpsi Langmuir dilakukan dengan menganalisis kurva hubungan antara Ce (konsentrasi Mg2+ saat kesetimbangan) terhadap Ce/qe
(konsentrasi Mg2+ saat kesetimbangan/daya adsorpsi) sesuai dengan persamaan 12. Penentuan isoterm adsorpsi Freundlich ditentukan dari kurva hubungan antara log Ce terhadap log qe sesuai dengan persamaan
13. Kurva yang menunjukkan harga R yang paling mendekati 1 merupakan isotermal adsorpsi Mg2+ yang paling sesuai.
0.0E+00
0.0E+00 5.0E-04 1.0E-03 1.5E-03 2.0E-03 2.5E-03
Persamaan Isoterm Langmuir:
� = Kapasitas adsorpsi maksimum (mol/g)
= Konstanta isoterm Langmuir (L/mol) Persamaan Isoterm Freundlich:
= Kapasitas atau intensitas adsorpsi
� = Konstanta isoterm Freundlich (L/g)
Pola isoterm Langmuir dan isoterm Freundlich oleh silika gel ditunjukkan pada Gambar 10 dan Gambar 11. Perhitungan dapat dilihat pada Lampiran 4 (halaman 79).
(12)
Gambar 10. Pola Isoterm Langmuir Adsorpsi Ion Mg2+
Gambar 11. Pola Isoterm Freundlich Adsorpsi Ion Mg2+
y = 19034x - 1.778
0.0E+00 1.0E-04 2.0E-04 3.0E-04 4.0E-04 5.0E-04
B.Pembahasan
1. Hasil Sintesis Silika Gel dari Bagasse tebu a. Silika gel
Tahap pertama dalam penelitian ini adalah preparasi sampel. Preparasi bagasse tebu dilakukan berdasarkan penelitian Miftakhul Huda. (2012). Bagasse tebu dikeringkan dibawah sinar matahari selama sehari untuk mengeliminasi kandungan air dalam bagasse tebu dengan menguapkan air dari permukaan sehingga memudahkan tahap pembakaran. Pengeringan dengan sinar matahari menyebabkan penyebaran panas ke dalam bahan berlangsung secara bertahap dan menyeluruh sehingga penguapan air ke udara lebih merata. Tidak demikian halnya dengan pengeringan dengan oven. Ketika bahan mulai terkena panas dari oven, laju pengeringan berlangsung secara cepat, sehingga saat laju pengeringan mulai menurun, masih tersisa kandungan air pada bahan. Adanya sisa kandungan air dalam abu bagasse tebu dapat menghalangi proses difusi komponen kimia yang terkandung dalam bagasse tebu saat dipanaskan (Harsono, 2002).
Selanjutnya bagasse tebu dibakar, menghasilkan abu bagasse tebu berwarna hitam. Abu tersebut ditumbuk hingga halus untuk memperkecil ukuran abu agar mempermudah tahap pengabuan. Selanjutnya, abu bagasse
(pengotor) yang ada di dalam bagasse tebu, sehingga yang tersisa hanya fraksi anorganiknya saja. Selain itu aktivasi fisik dengan cara pemanasan bertujuan untuk membuka dan menambah pori-pori silika gel dan meningkatkan luas permukaan silika gel sehingga kapasitas penyerapannya menjadi bertambah besar. Pengabuan dilakukan pada temperatur di bawah 800oC untuk mencegah terjadinya transformasi silika yang berstruktur amorf menjadi kristalin, dan di atas 500oC untuk mempercepat waktu pembakaran. Semakin rendah temperatur pembakaran maka waktu yang diperlukan untuk menghasilkan abu bagasse tebu berwarna putih menjadi lebih lama. Hal ini dikarenakan pembakaran fraksi organik dalam bagasse
tebu pada temperatur yang rendah memiliki kecepatan pembakaran yang rendah (Chakraverty et.al., 1988). Temperatur yang dikontrol dengan baik dan lingkungan yang sesuai saat pembakaran dapat menghasilkan kualitas abu bagasse tebu yang lebih baik karena ukuran partikel dan luas spesifik permukaannya dipengaruhi oleh kondisi pembakaran. Bagasse tebu yang terbakar sempurna akan berwarna abu hingga putih, sementara abu bagasse
tebu yang tidak terbakar sempurna akan berwarna hitam (Chakraverty et. al., 1988).
Abu tersebut diayak menggunakan ayakan 200 mesh agar diperoleh abu dengan ukuran yang sama dan memperluas permukaan dari silika gel. Reaksi pengabuan yang terjadi menurut Nuryono dkk., (2004) adalah sebagai berikut:
Sebanyak 20 gram abu bagasse tebu yang diperoleh dari tahap pengabuan direndam dengan 1 liter HCl 0,1 M. Abu bagasse harus diaktifkan dengan larutan asam untuk menghilangkan oksida logam dan komponen dalam abu bagasse tebu yang tidak diperlukan sekaligus meningkatkan porositas dan aktivitas adsorpsi (Savita, 1997). Zat -zat anorganik dalam bagasse tebu seperti mineral-mineral dalam jumlah yang sedikit dapat dihilangkan melalui perlakuan dengan H2SO4, HCl, atau
HNO3. Menurut Chandrasekhar et. al. (2006), asam klorida merupakan
bahan kimia yang sangat efektif untuk mengurangi zat-zat anorganik yang terdapat di dalam bagasse tebu.
Abu hasil rendaman HCl disaring dengan penyaring Buchner
kemudian dicuci sampai netral lalu dikeringkan dalam oven pada suhu 80oC sampai massa konstan. Hasil yang diperoleh dari 20 gram abu bagasse tebu setelah direndam HCl adalah 12,123 gram. Berat abu bagasse tebu yang hilang merupakan berat komponen pada abu bagasse tebu yang tidak diperlukan.
Selanjutnya, 6 gram abu yang telah direndam HCl direaksikan dengan 200 ml NaOH 1 M. Campuran dipanaskan hingga mendidih sambil diaduk dengan pengaduk magnet (magnetik stirer) pada kecepatan konstan selama 1 jam. Pengadukan dilakukan untuk mempercepat pencampuran antara NaOH dan abu. Natrium hidroksida digunakan pada penelitian ini karena silika larut dalam larutan alkali terutama NaOH. Pada SiO2,
dan terbentuk intermediet [SiO2OH]- yang tidak stabil, kemudian terjadi
dehidrogenasi dan ion hidroksil yang kedua akan berikatan dengan hidrogen membentuk molekul air. Menurut Nuryono dan Narsito (2006), pada sistem ini terdapat anion silikat sebagai gugus reaktif dengan ion natrium sebagai penyeimbang muatan. Dua ion Na akan menyeimbangkan muatan negatif yang terbentuk dan berinteraksi dengan ion SiO32- sehingga terbentuk
natrium silikat (Na2SiO3). Persamaan reaksi pembentukan larutan natrium
silikat dapat dilihat pada persamaan 4.
SiO2 (s) + 2 NaOH(aq) Na2SiO3(aq) + H2O (l)
Proses yang terjadi adalah pelarut NaOH menembus kapiler-kapiler dalam abu dan melarutkan silika. Selanjutnya, dengan cara difusi akan terjadi keseimbangan konsentrasi antara larutan silika yang ada dalam abu tersebut dengan larutan NaOH. Adanya gaya adhesi antara silika dengan NaOH menyebabkan terjadi pemisahan larutan yang mengandung silika dalam kuantitas tertentu didalam abu. Larutan silika yang terbentuk ini adalah natrium silikat yang merupakan reaksi antara NaOH dan silika pada abu bagasse tebu (Welveni, 2010).
Larutan natrium silikat yang diperoleh sebanyak 180 mL. Larutan ini berwarna bening kekuningan. Larutan yang diperoleh merupakan prekursor dari pembuatan silika gel. Setelah itu, larutan natrium silikat disaring dengan kertas saring Whatman 42. Filtrat natrium silikat didinginkan pada suhu kamar.
Tahap selanjutnya adalah tahap sol-gel. Proses sol gel dimulai dengan mengasamkan 100 mL larutan natrium silikat sambil diaduk dengan
magnetic stirrer sampai terbentuk gel karena silika mempunyai kelarutan yang tinggi pada pH > 10 ( Scott, 1993). Menurut Ilham Pratomo dkk. (2010), penambahan HCl 1 M pada larutan natrium silikat dengan teknik pengadukan dapat meningkatkan kadar silika yang dihasilkan. Pada kondisi awal, larutan natrium silikat bersifat sangat basa (pH 11-12) dalam bentuk Si-O- sehingga kondensasi tidak dapat berlangsung (Agus Prastiyanto dkk., 2010). Setelah penambahan asam yang berlebih menyebabkan berkurangnya gugus Si-O- dan bertambahnya gugus Si-OH. Penambahan HCl 1 M pada larutan Na2SiO3 dilakukan tetes demi tetes hingga pH 7. Pada penelitian ini,
HCl yang diperlukan untuk mendapatkan larutan natrium silikat dengan pH 7 sebanyak 310 ml. Menurut Sriyanti dkk. (2005) penambahan HCl pada larutan natrium silikat menyebabkan pembentukan gel yang sangat cepat, terjadi di sekitar pH 9-7, namun jika HCl ditambahkan terus menerus maka gel akan melarut kembali.
pembentukan H2SiO3. Reaksi yang terjadi dapat digambarkan sebagai
berikut:
Na2SiO3(aq) + 2HCl(aq) ⟶ H2SiO3(aq) + 2NaCl(aq)
Gel yang terbentuk kemudian didiamkan selama 18 jam. Agar gel yang dihasilkan terbentuk secara sempurna. Selanjutnya, gel ditambahkan aqua demineralisata sebanyak 40 ml sehingga menghasilkan reaksi pembentukan sol asam Si(OH)4. Reaksi yang terjadi dapat digambarkan
sebagai berikut:
H2SiO3(aq) + H2O(l) ⟶ Si(OH)4(aq)
Reaksi pembentukan silika gel digambarkan pada Gambar 12 (Scott,1993).
Si OH +
Gambar 12. Reaksi Pembentukan Silika Gel
Penambahan HCl 1 M pada larutan Na2SiO3 mengakibatkan
terjadinya penurunan pH, sehingga konsentrasi H+ dalam Na2SiO3 semakin
meningkat. Hal ini menyebabkan silikat berubah menjadi asam silikat (H2SiO3) yang menyebabkan sebagian gugus siloksan (S-O-) membentuk
(5)
ikatan silang ≡Si-O-Si≡ hingga terbentuk gel silika melalui proses kondensasi, sesuai persamaan reaksi di bawah ini:
≡Si-O- + H+⟶≡Si-OH
≡Si-OH + ≡Si-O-⟶≡Si-O-Si≡ + OH-
Menurut Sriyanti dkk. (2005), asam silikat bebas akan membentuk suatu dimer, trimer, hingga terbentuk polimer asam silikat. Agregat polimer akan bergabung membentuk bola polimer yang disebut primary silica particle. Primary silica particle pada ukuran tertentu akan mengalami kondensasi membentuk fasa padatan yang disebut alkogel. Alkogel yang didiamkan akan mengalami pelepasan NaCl sehingga dihasilkan gel yang kaku disebut hidrogel.
Gel yang terbentuk disaring dengan penyaring Buchner kemudian dicuci dengan aquades. Pencucian dengan aquades bertujuan agar gel bebas dari ion Cl- yang terbentuk dari penambahan HCl tadi. Jika larutan hasil pencucian direaksikan dengan AgNO3 menghasilkan filtrat yang berwarna
keruh maka disimpulkan masih adanya ion Cl- di dalam gel. Pencucian dilakukan sampai larutan hasil pencucian tetap bening jika direaksikan dengan AgNO3.
Setelah bebas dari ion Cl-, residu dikeringkan dalam oven pada suhu 80oC sampai massa konstan. Serbuk yang dihasilkan merupakan silika gel kering atau xerogel yang akan digunakan sebagai adsorben. Selanjutnya, silika gel digerus menggunakan mortar agar memperluas permukaan pori silika sebelum digunakan untuk adsorben.
2. Hasil Analisis Secara Difraksi Sinar-X
Analisa secara difraksi sinar-X ini bertujuan untuk mengetahui struktur dari serbuk silika hasil sintesis. Berdasarkan hasil analisis secara difraksi sinar-X, dapat dinyatakan bahwa silika gel memiliki puncak landai
pada sudut 2θ = 22 dan 20,96. Menurut Kalaphaty (2000), puncak di
sekitar 2θ = 21-22 menunjukkan puncak untuk silika. Sedangkan bukit yang landai ini menunjukkan bahwa abu bagasse tebu memiliki struktur padatan amorf. Struktur amorf dalam silika gel dari bagasse tebu sangat bergantung pada suhu pengabuan saat pemurnian silika.
3. Hasil Analisis Secara Spektroskopi FTIR
Tabel 2. Interpretasi Spektra FTIR Silika Kiesel Gel 60 Merck dan Silika
molekul air 1637,5 1639,88
Vibrasi ulur Si-O dari Si-OH 970,1 970
Vibrasi tekuk Si-O-Si 472,5 465,57
Vibrasi ulur –CH2 - -
Vibrasi ulur –SH - -
Vibrasi –SO dari –SO3H - -
Berdasarkan Tabel 2, hasil spektra FTIR silika gel dari bagasse
gelombang 799,06 cm-1 merupakan vibrasi ulur simetri dari –Si-O yang ada pada siloksan (Silverstein, 1991). Munculnya pita serapan pada 970 cm-1 menunjukkan adanya vibrasi ulur Si-O pada gugus silanol. Vibrasi tekuk gugus –OH pada molekul air yang terikat ditunjukkan pada bilangan gelombang 1639,88 cm-1, sedangkan vibrasi tekuk dari gugus siloksan (Si-O-Si) ditunjukkan pada bilangan gelombang 465,57 cm-1 (Hardjono, 1992). Secara umum, gugus fungsional pada silika gel adalah silanol (Si-OH) dan siloksan (Si-O-Si). Adanya kemiripan pola serapan pada silika gel hasil sintesis dan silika pembanding untuk gugus silanol dan siloksan dapat disimpulkan bahwa silika gel dari bagasse tebu memiliki kemiripan gugus fungsional dengan Kiesel gel 60. Hal ini menunjukkan bahwa
bagasse tebu dapat dijadikan bahan untuk pembuatan silika gel.
4. Kesetimbangan Adsorpsi Silika Gel terhadap Kation Mg2+
adsorben dilarutkan ke dalam aqua dimineralisata, kemudian ditambahkan larutan 0,001 M Mg2+. Konsentrasi Mg2+ divariasikan dengan menambahkan larutan Mg2+ ke dalam aqua dimineralisata, sebanyak 1, 4, 8, 13, 18, dan 23 mL.
Berdasarkan hasil perhitungan dari data yang diperoleh, didapatkan grafik hubungan antara konsentrasi awal Mg2+ dengan daya adsorpsi yang ditunjukkan pada Gambar 9 (halaman 45). Berdasarkan grafik dapat disimpulkan bahwa semakin besar konsentrasi awal Mg2+ maka semakin besar daya ikat adsorpsinya.
5. Model Isoterm Adsorpsi Kation Mg2+ oleh Silika Gel
Kesetimbangan adsorpsi dapat ditunjukkan dengan cara menganalisis kurva isoterm adsorpsi. Kurva ini merupakan fungsi konsentrasi zat terlarut yang terjerap pada padatan terhadap konsentrasi larutan. Adsorpsi fase cair-padat pada umumnya menganut tipe isoterm Freundlich dan Langmuir (Atkins, 1997). Menurut Serly Sekewael dkk. (2013), pola isoterm adsorpsi dapat menentukan kapasitas atau kemampuan jerap adsorben. Menurut Kusmiyati dkk. (2012) jumlah adsorbat yang teradsorp per satuan berat adsorben meningkat seiring dengan bertambahnya konsentrasi.