BIOSORPSI BIRU METILENA OLEH KULIT BUAH KAKAO
ZULFIKAR ALAMSYAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2007
ABSTRAK
ZULFIKAR ALAMSYAH. Biosorpsi Biru Metilena oleh Kulit Buah Kakao. Dibimbing oleh CHARLENA dan BETTY MARITA SOEBRATA
Kajian tentang biosorben zat warna semakin dikembangkan sejak ditemukannya kekurangan teknik konvensional dalam penurunan konsentrasi zat warna dari limbah industri dan penemuan biomassa pertanian yang dapat dimanfaatkan sebagai biosorben. Penelitian ini memanfaatkan selulosa dan tanin dari kulit buah kakao sebagai biosorben zat warna. Perlakuan terhadap kulit buah kakao meliputi modifikasi asam terimpregnasi basa, modifikasi basa, dan tanpa modifikasi. Modifikasi asam menggunakan asam nitrat 0.6 M sedangkan modifikasi basa menggunakan natrium hidroksida 0.1 M.
Adsorpsi dilakukan dengan ragam waktu adsorpsi, bobot biosorben, pengaruh kuat ion, isoterm, pH, dan diaplikasikan pada limbah industri zat warna. Waktu dan bobot biosorben optimum adsorpsi untuk biosorben tanpa modifikasi adalah 60 menit dengan bobot biosorben 2 g, pengaruh kuat ion 0.01 M, dan pH 3.02. Waktu dan bobot biosorben optimum adsorpsi modifikasi asam terimpregnasi basa adalah 45 menit dengan bobot 1 g, pengaruh kuat ion 1 M, dan pH 3.04. Biosorben modifikasi basa optimum pada menit 30, bobot 2 g, pengaruh kuat ion 1 M, dan pH 5.01. Adsorpsi biru metilena oleh biosorben kulit buah kakao tanpa modifikasi mengikuti tipe isoterm Freundlich dengan nilai n sebesar 0.3886 dan k sebesar 7.5474, sama halnya dengan biosorben modifikasi asam impregnasi basa mengikuti tipe isoterm Freundlich dengan nilai n 0.6263 dan nilai k sebesar 9.3389 dan biosorben modifikasi basa mengikuti tipe isoterm Langmuir dengan nilai α sebesar 0.0138 dan nilai β sebesar 3.4518. Aplikasi biosorben terhadap limbah industri zat warna menunjukkan kapasitas adsorpsi sebesar 1069.5697 µg/g biosorben. Arang aktif digunakan sebagai pembanding menunjukkan kapasitas adsorpsi sebesar 3150.7858 µg/g biosorben.
Berdasarkan penelitian ini kulit buah kakao dapat digunakan sebagai biosorben alternatif penjerap limbah zat warna bermuatan positif. Hasil penelitian ini juga menunjukkan bahwa variasi konsentrasi dengan KNO3, tipe biosorben tanpa modifikasi,
biosorben modifikasi asam terimpregnasi basa, biosorben modifikasi basa, dan interaksi antara keduanya memberikan pengaruh yang nyata terhadap kapasitas adsorpsi zat warna.
ABSTRAK
ZULFIKAR ALAMSYAH. Biosorption of Methylene Blue by cacao Rind. Supervised by CHARLENA and BETTY MARITA SOEBRATA
Study of coloring agent biosorbent is developed due to disadvantages in conventional technique that were found in reduction of coloring agent from industrial waste and the discovery of agricultural biomass that is potential to be utilized as a biosorbent. This research made use of cellulose and tannins from cacao rind as coloring agent biosorbent. Treatments toward cacao rind were base-impregnated acid modification using nitric acid 0.6 M, base modification using sodium hydroxide 0.1 M, and without modification.
Adsorption was carried out with variations of adsorption time, biosorbent weight, activity ion effect, isotherm, pH, and to be applicated wastewater industry of coloring agent. The optimum adsorption time, biosorbent weight, activity ion effect, and pH for unmodified biosorbent were 60 minutes, 2 g, 0.01 M, and 3.02, respectively. On the other hand, for base-impregnated acid modified biosorbent were 45 minutes, 1 g, 1 M, and 3.04 plus for base modified biosorbent were 30 minutes, 2 g, 1 M, and 5.01. The adsorption of metylene blue by unmodified and base-impregnated acid modified biosorbent was in accordance with Freundlich isotherm with n and k values of 0.3886 and 7.5474 and also 0.6263 and 9.3389, correspondingly. On the other hand, base modified biosorbent corresponded to Langmuir isotherm with α and β value of 0.0138 and 3.4518, respectively. Application of biosorbent toward industrial coloring agent waste showed an adsorption capacity of 1.069,5697 µg/g biosorbent, whereas charcoal (as a reference) exhibited a capacity of 3.150,7858 µg/g biosorbent.
This research showed that cacao rind was able to be used as a positive charged alternative coloring agent waste biosorbent plus variation of consentration KNO3 for each
BIOSORPSI BIRU METILENA OLEH KULIT BUAH KAKAO
ZULFIKAR ALAMSYAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2007
Judul : Biosorpsi Biru Metilena oleh Kulit Buah Kakao
Nama : Zulfikar Alamsyah
NIM : G44202019
Menyetujui:
Pembimbing I, Pembimbing II,
Dra. Charlena, M.Si Betty Marita Soebrata, S.Si, M.Si
NIP 132 088 359 NIP 131 694 523
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131 473 999
PRAKATA
Bismillahirrahmanirrahim…Alhamdulillah, segala puji bagi Allah SWT karena atas rahmat dan karunia-Nya
penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini berjudul Biosorpsi Biru Metilena oleh Kulit Buah Coklat, yang dilaksanakan pada bulan November 2006 sampai dengan Mei 2007 bertempat di laboratorium Kimia Fisik dan lingkungan, IPB.
Penulis mengucapkan terima kasih kepada Dra. Charlena, M.Si. dan Ibu Betty Marita, S.Si, M.Si. selaku pembimbing yang telah memberikan masukan dan pengarahan kepada penulis. Ungkapan terima kasih dihaturkan kepada Papa, Mama tercinta, Leni, Vivi, Mamak Ito, Mamak Iin, Mamak Agus, Tante Rani, Tante Risna, dan nenek saya tercinta atas doa dan dorongan semangat, dan kasih sayang kepada penulis. Ucapan terima kasih juga disampaikan Kepada Ibu Tun Tedja, Ibu Suminar, Bapak Zainal Hasan, Ibu Ai, Bapak Nano, Bapak Mail,Bapak Eman, Bapak Didi, dan Mas Heri. Saya haturkan banyak terima kasih kepada Lukman, Obie, David, Tri, Angga, Fahrizal, Amar, Rio, Steven, dan Kak Mamak atas kerjasamanya dan kebaikannya selama ini, dan kepada teman-teman angkatan 39 atas dukungan dan kenangan manisnya selama ini.
Akhir kata, penulis menyampaikan semoga karya ilmiah ini bermanfaat bagi ummat manusia pada umumnya dan dunia pendidikan Indonesia pada khususnya. Amin
Bogor, Mei 2007
Zulfikar Alamsyah
RIWAYAT HIDUP
Penulis dilahirkan di Kotanopan pada tanggal 21 Desember 1983 sebagai anak pertama dari tiga bersaudara, putra dari pasangan Amir Wahni dan Afni Junida.
Tahun 2002 penulis lulus dari SMU Negeri 3 plus Sipirok YPMHB, Padang Sidimpuan dan memperoleh kesempatan melanjutkan studi di Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur Ujian Seleksi Masuk IPB (USMI).
Tahun 2005 penulis melaksanakan Praktik Lapangan di Proses Kontrol Laboratorium dan Lingkungan PT Dystar Colour Indonesia, Ciwandan-Cilegon dengan judul Analisis Limbah Cair PT Dystar Colour Indonesia dengan nilai sangat memuaskan.
Selama mengikuti perkuliahan penulis aktif di dalam organisasi kampus di IPB. Priode kepengurusan 2005/2006 menjadi staf di Departemen Olahraga, Ikatan Mahasiswa Kimia (Imasika) IPB. Penulis juga sangat aktif dalam mengikuti seminar-seminar baik yang berbasis IPTEK dan wirausaha selama mengikuti perkuliahan di IPB.
DAFTAR ISI
Halaman DAFTAR TABEL ... iv DAFTAR GAMBAR ... iv DAFTAR LAMPIRAN ... iv PENDAHULUAN ... 1 TINJAUAN PUSTAKA Tanaman dan Limbah Perkebunan Kakao ... 2Modifikasi Biosorben ... 2
Adsorpsi dan Isoterm Adsorpsi ... 3
Karbon Aktif ... 4
Kuat Ion dan pH ... 4
Zat Warna ... 4
BAHAN DAN METODE Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN Penentuan Kondisi Optimum BTM ... 7
Penentuan Kondisi Optimum BMATB ... 9
Penentuan Kondisi Optimum BMB ... 10
Adsorpsi pada Limbah Industri ... 12
Isoterm Adsorpsi ... 12
SIMPULAN DAN SARAN Simpulan ... 14
Saran ... 14
DAFTAR PUSTAKA ... 14
DAFTAR TABEL
Halaman
1 Kondisi optimum BTM ... 9
2 Kondisi optimum BMATB ... 10
3 Kondisi optimum BMB ... 12
4 Nilai konstanta n dan k dari persamaan Freundlich ... 13
5 Nilai konstanta α dan β dari persamaan Langmuir... 13
DAFTAR GAMBAR
Halaman 1 Buah kakao... 22 Struktur biru metilena [2,7-bis (diamin tetrametil) ... 5
3 Biosorben kulit buah kakao ... 7
4 Waktu optimum adsorpsi biru metilena oleh BTM ... 8
5 Bobot optimum adsorpsi biru metilena oleh BTM ... 8
6 Adsorpsi larutan biru metilena oleh BTM dengan pengaruh kuat ion ... 8
7 Kapasitas adsorpsi biru metilena pada berbagai variasi pH oleh BTM ... 9
8 Waktu optimum adsorpsi biru metilena oleh BMATB ... 9
9 Bobot optimum adsorpsi biru metilena oleh BMATB ... 9
10 Adsorpsi larutan biru metilena oleh BMATB dengan pengaruh kuat ion... 10
11 Kapasitas adsorpsi biru metilena pada berbagai variasi pH oleh BMATB... 10
12 Waktu optimum adsorpsi biru metilena oleh BMB ... 10
13 Bobot optimum adsorpsi biru metilena oleh BMB ... 11
14 Adsorpsi larutan biru metilena oleh BMB dengan pengaruh kuat ion... 11
15 Kapasitas adsorpsi biru metilena pada berbagai variasi pH oleh BMB ... 11
16 Kapasitas adsorpsi limbah industri pada kondisi optimum... 12
17 Isoterm Langmuir adsorpsi biru metilena oleh BTM pada suhu 28oC... 12
18 Isoterm Freundlich adsorpsi biru metilena oleh BTM pada suhu 28oC ... 13
19 Isoterm Langmuir adsorpsi biru metilena oleh BMATB pada suhu 28oC ... 13
20 Isoterm Freundlich adsorpsi biru metilena oleh BMATB pada suhu 28oC ... 13
21 Isoterm Langmuir adsorpsi biru metilena oleh BMB pada suhu 28oC ... 13
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 17 2 Kadar air kulit buah kakao kering ... 18 3 Konsentrasi dan absorbans larutan biru metilena pada pembuatan kurva standar biru
metilena (λ maksimum = 665 nm) ... ... 18 4 Konsentrasi dan absorbans larutan biru metilena pada pembuatan kurva standar biru
metilena untuk limbah industri (λ maksimum = 665 nm) ... 18 5 Efektivitas dan kapasitas adsorpsi (Q) biosorben kulit buah coklat tanpa modifikasi
pada penentuan waktu optimum adsorpsi biru metilena ... 19 6 Efektivitas dan kapasitas adsorpsi (Q) biosorben kulit buah coklat modifikasi asam
terimpregnasi basa penentuan waktu optimum adsorpsi biru metilena …... 19 7 Efektivitas dan kapasitas adsorpsi (Q) biosorben kulit buah coklat modifikasi basa Penentuan waktu optimum adsorpsi biru metilena ... 19 8 Pengaruh bobot biosorben tanpa modifikasi pada kapasitas
adsorpsi biru metilena ... 20 9 Pengaruh bobot biosorben modifikasi asam terimpregnasi basa pada kapasitas
adsorpsi biru metilena ... 20 10 Pengaruh bobot biosorben modifikasi basa pada kapasitas adsorpsi
biru metilena ... 20 11 Pengaruh pH terhadap kapasitas adsorpsi biru metilena
oleh biosorben tanpa modifikasi .. ... 21 12 Pengaruh pH terhadap kapasitas adsorpsi biru metilena oleh biosorben
modifikasi asam terimpregnasi basa ... 21 13 Pengaruh pH terhadap kapasitas adsorpsi biru metilena
oleh biosorben modifikasi basa . . ... 21 14 Data kuat ion ... 22 15 Statistik uji Duncan ... 23 16 Kapasitas adsorpsi (Q) zat warna dalam limbah industri tekstil oleh
biosorben kulit buah kakao pada perlakuan optimum ... 26 17 Kapasitas adsorpsi (Q) zat warna biru metilena oleh
biosorben kulit buah kakao pada perlakuan optimum... 26 18 Isoterm Langmuir untuk adsorpsi biru metilena dengan
biosorben tanpa modifikasi ... 26 19 Isoterm Freundlich untuk adsorpsi biru metilena dengan biosorben
tanpa modifikasi ... 27 20 Isoterm Langmuir untuk adsorpsi biru metilena dengan biosorben modifikasi
asam terimpregnasi basa ... 27 21 Isoterm Freundlich untuk adsorpsi biru metilena dengan biosorben modifikasi
asam terimpregnasi basa ... 28 22 Isoterm Langmuir untuk adsorpsi biru metilena dengan biosorben
modifikasi basa .. ... 28 23 Isoterm Freundlich untuk adsorpsi biru metilena dengan biosorben
PENDAHULUAN
Usaha tanaman kakao (cokelat) di Indonesia mempunyai arti penting dalam aspek sosial ekonomi. Selain merupakan sumber devisa negara, usaha ini juga merupakan tempat tersedianya lapangan kerja bagi penduduk dan sumber penghasilan bagi para petani kakao, terutama di daerah-daerah sentral produksi.
Data departemen pertanian sejak awal tahun 1980-an mengemukakan bahwa perkebunan kakao di Indonesia mengalami perkembangan pesat. Tahun 2002 areal perkebunan kakao Indonesia tercatat seluas 914,051 ha, sebagian besar (87.4%) dikelola oleh rakyat dan selebihnya 6.0% merupakan perkebunan besar pemerintah serta 6.7% perkebunan besar swasta (BPS 2005).
Prospek pemasaran kakao di luar negeri dan dalam negeri cukup baik dan terus meningkat. Banyaknya buah kakao yang diolah menyebabkan bertambahnya limbah kulit buah kakao yang dapat menambah pencemaran lingkungan dan memerlukan proses lebih lanjut untuk mengatasi limbah tersebut.
Indonesia berhasil menempatkan diri sebagai produsen kakao terbesar kedua setelah Pantai Gading tahun 2002, meskipun tergeser oleh Ghana pada tahun 2003. Selain itu, dengan kondisi harga kakao dunia yang relatif stabil dan cukup tinggi, maka luas perkebunan kakao Indonesia diperkirakan akan terus meningkat, sehingga tahun 2010 produksi kakao Indonesia akan mencapai 1.1 juta ha serta menghasilkan produksi 730 ribu ton/tahun biji kakao (BPS 2005). Prestasi tersebut selain menimbulkan peluang, juga menimbulkan masalah bagi pemerintah, yaitu cara memanfaatkan limbah kulit buah kakao menjadi bahan yang lebih berguna.
Limbah kulit buah kakao berhasil diproses menjadi bahan makanan ternak, namun limbah kulit buah kakao yang ditambahkan langsung pada ternak tidak sesuai yang diharapkan, yaitu berat badan ternak menjadi menurun sehingga pemanfaatan kulit buah kakao (KBK) untuk pakan ternak sangat terbatas karena KBK mengandung zat anti nutrisi yang antara lain dapat menurunkan secara signifikan nilai nutrisi pakan ternak (Otchere et al. 1983 dalam Amirroenas 1990). Selain itu tanin memiliki aktivitas antinutrisi karena senyawa ini mengikat protein sehingga protein tidak dapat dicerna. Sekitar 60% dari total protein pada KBK diikat oleh tanin (Anonim 2001). Menurut Joseph (1996)
berbagai larutan basa telah digunakan untuk menurunkan efek antinutrisi pada tumbuhan, misalnya pada biji gandum. Penggunaan senyawa alkali NaOH mengakibatkan kelebihan natrium pada hewan. Kelebihan natrium dapat mengganggu fungsi ginjal dan tekanan osmotik darah sehingga membahayakan kesehatan ternak. Keadaan ini memunculkan ide adanya pemanfaatan KBK sebagai suatu adsorben, baik itu limbah zat warna maupun logam berat. Menurut Gufta (1998) adsorben dapat menjerap berbagai polutan baik senyawa organik (zat warna) maupun anorganik (logam berat), dengan mekanisme adsorpsi, filtrasi, penukar ion, dan endapan. Akan tetapi metode tersebut mahal dan tidak efektif terutama pada konsentrasi larutan limbah yang tinggi. Oleh karena itu, metode bioteknologi seperti biosorpsi atau bioakumulasi menjadi metode alternatif untuk mengatasi pencemaran logam berat dan zat warna.
Arus utama dalam penelitian adsorben ialah pemanfaatan produk samping pertanian sebagai biosorben logam berat. Marshall & Mitchell (1996) juga telah melaporkan beberapa produk samping pertanian yang berpotensi sebagai biosorben, yaitu tongkol jagung, gabah padi, gabah kedelai, biji kapas, jerami, ampas tebu, serta kacang tanah. Hasil penelitian Wu & Paul (1998) bahwa asam nitrat telah digunakan untuk memodifikasi karbon aktif dan hasilnya pun lebih baik daripada karbon aktif tidak termodifikasi. Hasil penelitian Dewi (2005) kulit singkong termodifikasi asam nitrat dapat digunakan sebagai bioremoval logam Pb(II) dan Cd(II). Hasil penelitian Rahmawati (2006) bahwa karbon aktif yang termodifikasi ZnCl2 dapat digunakan mengadsorpsi senyawa klorin dengan mengikuti kaidah isoterm Freundlich. Hasil penelitian Amirullah (2006) bahwa ganggang cokelat dapat digunakan sebagai biosorben limbah zat warna. Selain itu, menurut Sunanto (1992) kulit buah kakao mempunyai potensi menjadi biosorben karena mengandung selulosa yang cukup tinggi dan senyawa lain yang umum terdapat dalam tumbuhan. Penelitian ini bertujuan membuat dan memodifikasi adsorben dari kulit buah kakao, menentukan waktu optimum adsorpsi, bobot optimum adsorpsi, pengaruh kuat ion, isoterm, pH, dan mengaplikasikannya kelimbah zat warna. Hipotesis dari penelitian ini adalah kulit buah kakao yang mengandung selulosa dan tanin dapat digunakan sebagai biosorben zat warna.
2
TINJAUAN PUSTAKA
Tanaman dan Limbah Perkebunan KakaoTanaman kakao termasuk famili
Steruliaceae yang banyak diusahakan oleh
perkebunan rakyat, swasta, dan negara. Tumbuhan kakao diklasifikasikan sebagai berikut: divisi : Spermatophyta subdivisi : Angiospermae kelas : Dicotyledoneae ordo : Dialypetalae famili : Sterculiaceae spesies : Theobroma cacao L
Tanaman kakao dapat tumbuh subur dan berbuah banyak di daerah yang mempunyai ketinggian 1-600 m di atas permukaan laut, walaupun demikian tanaman kakao dapat tumbuh sampai ketinggian 800 m di atas permukaan laut (Gambar 1).
Gambar 1 Buah kakao.
Tanaman kakao tumbuh baik di hutan tropis, sebab pertumbuhan tanaman kakao sangat dipengaruhi oleh kelembapan yang cukup, suhu yang tidak terlalu tinggi, dan angin yang tidak terlalu kencang. Suhu harian yang baik bagi kakao sekitar 24-28oC dengan letak di antara 20oLU dan 20oLS serta kelembapan udara yang konstan dan relatif tinggi, yaitu sekitar 80% (Sunanto 1992).
Buah kakao terdiri atas 73.37% pod (kulit buah), 2.00% plasenta, dan 24.20% biji (Haryati & Hardjosuwito 1984). Adegbola (1997) menyatakan bahwa 75% bahan kering keseluruhan buah kakao merupakan pod (kulit buah) dan kuantitas kulit biji kakao hanya 10% dari bobot biji. Warna buah kakao pada dasarnya hanya dua macam, yaitu buah muda berwarna hijau putih dan bila masak menjadi berwarna kuning, dan buah muda yang berwarna merah setengah masak menjadi jingga. Kakao termasuk tanaman kaulifori yang artinya bunga dan buah tumbuh pada batang dan cabang tanaman. Biji dibungkus oleh daging buah atau pulp yang berwarna putih dan rasanya manis.
Buah kakao yang matang berisi 30-40 biji yang diselubungi oleh daging buah dan biji terdiri atas kulit biji dan kepingan biji.
Kulit limbah pod adalah bagian dinding buah yang mencakup kulit terluar sampai dinding buah sebelum kumpulan biji dengan tekstur kasar, tebal, dan agak keras. Menurut Devendra (1997) kulit biji kakao mengandung protein kasar 22.30%. Kulit buah kakao tersusun oleh selulosa, serat, protein, dan lemak (Sunanto 1992). Limbah yang bermanfaat dari kakao adalah kulit dan plasenta yang mengandung serat, protein, lemak, dan sejumlah asam organik yang berpotensi sebagai bahan pakan ternak kambing (Deptan 2007). Jika produktivitas limbah kakao per tahun per hektar untuk varietas landak mencapai 1000-1250 kg, maka limbah yang dihasilkan cukup untuk memelihara 4-5 ekor kambing dengan asumsi kebutuhan pakan kambing 2 kg/ekor/hari tanpa diberi makanan tambahan. Selain itu pemanfaatan limbah menjadi bahan baku bagi proses produksi berikutnya merupakan upaya memperpanjang rantai nutrisi dan energi yang dalam kontek ekologi merupakan tindakan efisien yang sangat bermanfaat terkait dengan kesesuaian pertanian (Deptan 2007).
Modifikasi Biosorben
Modifikasi adsorben bertujuan meningkatkan kapasitas dan efisiensi adsorpsi dari adsorben. Modifikasi dapat dilakukan dengan memberi perlakuan kimia seperti direaksikan dengan asam dan basa juga dengan perlakuan fisika seperti pemanasan dan pencucian (Marshall & Mitchell 1996). Modifikasi adsorben dengan asam paling umum dilakukan dan terbukti sangat efektif dalam meningkatkan kapasitas dan efisiensi adsorben (Gufta 1998). Asam yang digunakan pada percobaan ini asam nitrat yang akan mengaktifkan gugus hidroksi pada selulosa. Asam nitrat merupakan salah satu asam yang sering digunakan untuk memodifikasi biomassa, selain HCl, dan asam fosfat. Modifikasi basa pada penelitian ini digunakan NaOH yang bertujuan mengaktifkan gugus hidroksi pada senyawa fenolik seperti tanin.
Tanin adalah beberapa senyawa fenolik dengan bobot molekul yag cukup tinggi dan mengandung gugus hidroksi fenolik dan gugus lain yang cocok (seperti karboksil) untuk membentuk kompleks yang stabil dengan protein dan makromolekul lain secara efektif dalam kondisi yang sesuai. Tanin tidak larut dalam pelarut non polar seperti eter,
3
kloroform, dan benzena, tetapi dengan mudah larut dalam pelarut polar, seperti air, aseton, alkohol, dan sedikit larut dalam pelarut etil asetat (Deshpandi et al. 1986). Kristal tanin berwarna putih-kuning sampai cokelat muda bila terkena cahaya matahari dan berwarna cokelat tua apabila teroksidasi.
Adsorpsi dan Isoterm Adsorpsi
Adsorpsi merupakan peristiwa terakumulasinya partikel pada suatu permukaan (Atkins 1999). Partikel yang terakumulasi dan diserap oleh permukaan disebut adsorbat dan material tempat terjadinya adsorpsi disebut adsorben (Satake dan Nagahiro 1990). Adsorben yang terbuat dari material biomassa disebut sebagai biosorben.
Ukuran pori dan luas permukaan biosorben merupakan hal yang sangat penting dalam adsorpsi (Lynch 1990). Perbesaran luas permukaan biosorben dapat dilakukan dengan pengecilan partikelnya. Biosorben polar cenderung mengadsorpsi adsorbat polar secara kuat, dan mengadsorpsi adsorbat non polar secara lemah. Sebaliknya biosorben non polar cenderung untuk mengadsorpsi secara kuat adsorbat non polar dan mengadsorpsi adsorbat polar secara lemah (Bird 1993). Aktivitas biosorben akan menaikkan energi pada permukaannya sehingga dapat meningkatkan tarikan terhadap molekul terlarut (Jason 2004). Koefisien adsorpsi menjadi nilai yang sangat penting dalam proses penghilangan kontaminan di dalam air. Jason (2004) mendefinisikan koefisien adsorpsi sebagai nilai saat kontaminan terhilangkan dari fase cair (adsorbat) menuju fase padat (biosorben).
Proses adsorpsi berlangsung melalui tiga tahapan, yaitu makrotransport, mikrotransport, dan sorpsi. Makrotransport meliputi perpindahan adsorbat melalui air menuju interfase cair-padat dengan proses pemanasan dan difusi. Mikrotransport meliputi difusi adsorbat melalui sistem makropori dan submikropori. Sorpsi adalah istilah untuk menjelaskan kontak adsorbat terhadap adsorben. Istilah ini digunakan karena sulitnya membedakan proses yang berlangsung, apakah fisiosorpsi atau kimisorpsi. Kapasitas adsorpsi suatu biosorben untuk sebuah kontaminan dapat ditentukan dengan menghitung isoterm adsorpsi (Tchobanogglous & Franklin 1991).
Faktor-faktor yang mempengaruhi proses adsorpsi antara lain sifat fisis dan kimia adsorben misalnya luas permukaan, ukuran
partikel, komposisi kimia, sifat fisis, dan kimia adsorbat, misalnya ukuran molekul dan komposisi kimia, serta konsentrasi adsorbat dalam fase cairan. Semakin kecil ukuran partikel, maka semakin besar luas permukaan padatan persatuan volume tertentu sehingga akan semakain banyak zat yang diadsorpsi (Atkins 1999).
Adsorpsi sering dirangkaikan dengan istilah isoterm yang menunjukkan hubungan antara aktivitas (konsentrasi) fase cair dari adsorbat dan jumlah adsorbat pada suhu konstan. Isoterm menggambarkan kesetimbangan yang tercapai setelah permukaan biosorben mengadakan kontak dengan adsorbat dalam jangka waktu tertentu dan suhu yang tetap. Persamaan yang biasa digunakan untuk menjelaskan data percobaan isoterm dikaji dan dikembangkan oleh Freundlich dan Langmuir.
Isoterm Freundlich
Isoterm Freundlich disebut juga adsorpsi fisika terjadi bila gaya intramolekul lebih besar dari gaya tarik antar molekul atau gaya tarik menarik yang relatif lemah antara adsorbat dengan permukaan adsorben. Gaya ini disebut gaya van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben. Isoterm yang paling umum digunakan adalah isoterm Freundlich (Jason 2004). Menurut Atkins (1999) pada proses adsorpsi zat terlarut oleh permukaan padatan diterapkan isoterm Freundlich yang diturunkan secara empiris dengan persamaan sebagai berikut:
m
x
= k C1/n
Apabila dilogaritmakan, persamaan akan menjadi : Log
m
x
= Log k +n
1
Log C Keterangan:m
x
= jumlah adsorbat teradsorpsi per unit m = bobot biosorben
C = Konsentrasi keseimbangan adsorben dalam larutan
k, n = konstanta empiris.
Isoterm Freundlich tidak mampu memperkirakan adanya sisi-sisi pada permukaan yang mampu mencegah adsorpsi pada saat keseimbangan tercapai dan hanya
4
ada beberapa sisi aktif saja yang mampu mengadsorpsi molekul terlarut (Jason 2004).
Isoterm Langmuir
Isoterm Langmuir disebut juga adsorpsi kimia karena adanya reaksi antara molekul-molekul adsorbat dengan adsorben yang membentuk ikatan kovalen dan ion. Isoterm Langmuir diturunkan berdasarkan persamaan berikut ini:
m
x
=C
C
β
αβ
+
1
Isoterm Langmuir dibuat untuk menggambarkan pembatasaan sisi adsorpsi dengan asumsi bahwa sejumlah tertentu sisi sentuh biosorben ada pada permukaannya dan semuanya memiliki energi yang sama, serta bahwa adsorbsi bersifat dapat balik (Atkins 1999).
Konstanta α,
β
dapat ditentukan dari kurva hubunganm
x
C
terhadap C dengan persamaanm
x
C
/
=αβ
1
+α
1
C Karbon AktifStruktur karbon aktif dapat digambarkan lebih tepat sebagai jaringan yang tumpang tindih dari dataran lapisan karbon dengan ikatan silang oleh gugus jembatan alifatik. Difraksi sinar-X memperlihatkan bahwa karbon aktif bersifat amorf. Hal ini memberikan suatu sifat yang unik, yaitu memiliki struktur pori internal yang mudah dipenetrasi. Mikropori merupakan jenis pori yang dianggap penting karena sebagaian besar adsorpsi terjadi didalamnya. Mikropori adalah ruang dua dimensi yang terbentuk dari dua dinding seperti grafit, yaitu bidang planar kristalit yang disusun oleh gugus aromatik atom-atom karbon. Karbon aktif memiliki struktur kristalin yang kurang teratur yang disebut struktur turbostatik. Mikropori ini merupakan salah satu kelebihan dari karbon aktif.
Keistimewaan lain dari karbon aktif adalah gugus fungsional pada permukaannya. Gugus komplek oksigen yang terletak di permukaan membuat permukaan karbon aktif menjadi reaktif secara kimiawi dan menentukan sifat adsorpsinya seperti
hidrofilik, keasaman, dan potensial negatif (Setiadi & Sugiharso 1999).
Kuat Ion dan pH
Suatu permukaan harus mengadsorpsi pasangan ionnya untuk mempertahankan kenetralan listriknya. Muatan permukaan dan pasangan ionnnya ini membentuk lapisan listrik rangkap. Pasangan ion teradsorpsi melalui gaya tarik Coulomb atau elektrostatik pada permukaan karena melawan ion-ion penentu potensial.
Ionisasi permukaan pada proses adsorpsi menyebabkan permukaan menjadi bermuatan. Permukaan ini dinetralkan muatannya dan diamati sebagai fungsi pH dan kuat ion. Kuat ion dipengaruhi oleh konsentrasi dari seluruh spesies yang ada dan muatannya. Makin besar kuat ion, aktivitas ion makin berbeda.
Ion-ion H+ dan OH- memegang peranan penting sebagai reaktan dalam proses ionisasi pusat-pusat permukaan dan dalam pelarut air. Besarnya muatan permukaan akan meningkat dan potensial permukaan menurun dengan meningkatnya kuat ion (Anggraningrum 1996).
pH adalah istilah yang digunakan untuk menggambarkan aktivitas ion hidrogen dari suatu sistem. Nilai pH mempengaruhi keefektifan adsorpsi selain kuat ion, aktivitas adsorben, dan konsentrasi larutan (Wu & Paul 1998). Menurut Wu & Paul (1998) bahwa semakin tinggi pH maka adsorpsi ion tembaga oleh karbon aktif juga semakin besar. Citroreksoso et al. (1994) menyimpulkan bahwa daya adsorpsi optimum terhadap anion kromat bergantung pada pH dan jenis biosorben.
Zat Warna
Zat warna tekstil merupakan senyawa organik yang keberadaanya dalam perairan dapat mengganggu ekosistem di dalamnya sebelum dibuang ke perairan. Limbah cair yang berwarna ini akan diproses terlebih dahulu sampai konsentrasinya cukup aman jika berada di perairan. Sebagai contoh, sebuah pabrik tekstil menurunkan kadar zat warna reaktif dalam limbahnya dari 225 ppm hingga 0.17 ppm setelah melalui proses koagulasi.
Biru metilena digunakan sebagai pewarna dalam bakteriologi, sebagai reagen analitis, indikator oksidasi-reduksi, antimeteglobin, antidot sianida, dan sebagai antiseptik. Biru
5
metilena juga dikenal dengan nama dimetilamino-klorida.
Dosis tinggi dari biru metilena dapat menyebabkan mual, muntah, nyeri pada perut dan dada, sakit kepala, keringat berlebihan, dan hipertensi (RSC 1992). Interaksi biru metilena dengan air akan menghasilkan ion dari biru metilena yang bermuatan positif. Kation yang dihasilkan akan berinteraksi dengan biosorben sehingga dapat menurunkan intensitas warna larutan.
Gambar 2 Biru metilena [2,7 bis (diamin tetrametil) (Raghuvanshi et al. 2004).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan adalah kulit buah kakao, HCl 0.1 N, NaOH 0.1 N, HNO3 0.6 M, kristal kalium nitrat, serbuk biru metilena, campuran limbah industri zat warna, air deionisasi, dan karbon aktif komersial.
Alat-alat yang digunakan adalah spektrofotometer 20D+, pH meter, neraca analitik, shaker, oven, eksikator, plat pemanas, dan alat-alat kaca.
Metode Penelitian Preparasi Sampel
Kulit kakao dicuci dengan air mengalir sampai bersih, setelah itu dikeringkan di dalam oven lalu digiling sampai berukuran 100 mesh (Horsfall et al. 2003). Serbuk kulit buah kakao ini selanjutnya disebut biosorben tanpa modifikasi (BTM).
Analisis Kadar Air Kulit Buah Kakao Kulit buah kakao yang kering, ditimbang sebanyak 2 g. Setelah itu ditempatkan dalam cawan petri yang dikeringkan di dalam oven yang telah diketahui bobot kosongnya. Cawan petri berisi sampel dikeringkan dalam oven pada suhu 105oC selama 3 hari dan didinginkan. Setelah dingin, disimpan dalam eksikator lalu ditimbang. Pengeringan
dilakukan beberapa kali selama 3 jam sampai diperoleh bobot tetap. Analisis dilakukan sebanyak tiga ulangan.
Kadar air dihitung sebagai berikut: Kadar Air =
c
b
a
−
× 100% Keterangan:a = bobot sampel dan cawan petri sebelum dikeringkan (g)
b = bobot sampel dan cawan petri sesudah dikeringkan (g) N S N CH3 CH3 N H3C CH3 c = bobot sampel (g)
Pembuatan Larutan Zat Warna Larutan stok zat warna sebanyak 100 ppm dibuat dengan cara melarutkan 100 mg serbuk biru metilena dalam air destilata dan diencerkan hingga satu liter. Kemudian dibuat kurva standar dari larutan biru metilena dengan konsentrasi 0.5, 1.0, 2.0, 3.0, 4.0, dan 5.0 ppm.
Modifikasi Basa
Sebanyak 100 g kulit kakao yang telah dihaluskan dimasukkan ke dalam gelas piala 4 L lalu ditambahkan 2 L NaOH 0.1 N. Campuran dikocok selama 20 menit sambil dipanaskan pada suhu 80oC kemudian disaring dan airnya dibuang. Setelah itu, dicuci dengan menggunakan air deionisasi untuk menghilangkan kelebihan basa. Sampel dikeringkan dalam oven pada suhu 50oC selama 24 jam (Marshall & Mitchell 1996). Sampel yang dihasilkan selanjutnya disebut biosorben modifikasi basa (BMB).
Modifikasi Asam Terimpregnasi Basa Sampel dimasukkan dalam gelas piala 1 L lalu ditambahkan 660 ml asam nitrat 0.6 M. Campuran dikocok selama 30 menit kemudian disaring. Sampel dikeringkan dalam oven pada suhu 50oC selama 24 jam kemudian suhu dinaikkan menjadi 105oC lalu didinginkan. Setelah itu, larutan direndam dalam air panas untuk menghilangkan kelebihan asam dan dikeringkan pada suhu 50oC selama 24 jam (Marshall & Mitchell 1996). Kemudian sampel ditambahkan 2 L NaOH 0.1 N. Campuran dikocok selama 20 menit sambil dipanaskan pada suhu 80oC kemudian disaring dan airnya dibuang. Setelah itu, dicuci dengan menggunakan air deionisasi untuk menghilangkan kelebihan
6
basa. Sampel dikeringkan dalam oven pada suhu 50oC selama 24 jam (Marshall & Mitchell 1996). Sampel yang dihasilkan selanjutnya disebut biosorben dengan biosorben modifikasi asam terimpregnasi basa (BMATB) .
Penentuan Kondisi Optimum Waktu Adsorpsi
Sebanyak 1 g biosorben BTM, BMB, dan BMATB dimasukkan ke dalam 50 ml larutan biru metilena dengan konsentrasi 4 ppm kemudian larutan dikocok dengan shaker. Adsorpsi dilakukan dengan variasi waktu adsorpsi 0, 15, 30, 45, 60, 75, dan 90 menit (Raghuvanshi et al. 2004), dilihat perubahan warna yang terjadi. Waktu optimum ditentukan dengan menghitung efisiensi dan kapasitas adsorpsi maksimum.
Penentuan Kondisi Optimum Bobot Biosorben
Variasi bobot biosorben BTM, BMATB, dan BMB yang digunakan adalah 1.0, 1.5, 2.0, 2.5 dan 3.0. Masing-masing dimasukkan ke dalam 100 ml larutan biru metilena 4 ppm kemudian dikocok dengan shaker. Adsorpsi dila ukan pada waktu optimum. k
Efektivitas (%) =
Co
Ca
Co
)
100
%
(
−
×
Keterangan :Co = Konsetrasi awal larutan (ppm) Ca = Konsentrasi akhir larutan (ppm)
Q =
m
Ca
Co
V
(
−
)
Keterangan :Q = Kapasitas adsorpsi per bobot biosorben
(µg/g bioremoval)
a perlakuan kondisi optimum dimasukkan pada limbah zat warna 100 ml yang terlebih dahulu diketahui konsentrasinya. Campuran dikocok kemudian didiamkan pada waktu optimum adsorpsi. Campuran disaring dan filtrat yang diperoleh diukur absorbannya pada panjang gelombang 665 nm.
V = Volume larutan (ml)
Co = Konsentrasi awal larutan (ppm) Ca = Konsentrasi akhir larutan (ppm) m = massa biosorben (g)
Pengaruh Kuat Ion terhadap Adsorpsi Tiga Erlenmeyer yang berisi masing-masing 100 ml larutan biru metilena konsentrasi 4 ppm serta 10 ml KNO3 0.01, 0.1, dan 1 M, ditambahkan bobot optimum biosorben (dalam gram yang diperoleh dari data penentuan bobot optimum) biosorben BTM, BMB, dan BMATB. Campuran dikocok kemudian didiamkan pada waktu
filtrat yang diperoleh diukur absorbansinya pada panjang gelombang 665 nm.
optimum adsorpsi. Campuran disaring lalu
Pengaruh pH terhadap Adsorpsi Bo t optimum biosorben BTM, BMATB, dan
Penentuan Isoterm Adsorpsi
Erlenmeyer yang ber bobot optimum bio
ang gelombang maksimum untuk laru
Penentuan Kapasitas Adsorpsi Limbah TM, BMATB, dan BMB yang didapat pad
bo
BMB yang diperoleh ditambahkan ke dalam Erlenmeyer yang berisi 100 ml larutan biru metilena 4 ppm dengan pH 3.0, 5.0, 7.0, dan 9.0. Campuran dikocok dan didiamkan pada waktu optimum adsorpsi kemudian disaring dan diukur absorbannya pada panjang gelombang 665 nm.
isi
sorben BTM, BMB, dan BMATB dilarutkan dalam 100 ml zat warna pada berbagai konsentrasi, yaitu 0.0, 1.0, 5.0, 10.0, 25.0, 50.0, 100.0 ppm pada kondisi pH optimum, waktu optimum, dan kuat ion optimum untuk masing-masing biosorben. Kemudian diukur kapasitas adsorpsi (Q) dan konstanta afinitas dihitung dengan model isoterm Langmuir dan Freundlich (Atkins 1999).
Panj
tan biru metilena adalah 665 nm. Arang aktif sebagai pembanding diperlakukan sama seperti halnya kulit buah kakao.
Industri B
7
HASIL DAN PEMBAHASAN
Kulit buah kakao yang sudah tidak dimanfaatkan, dibuat sebagai biosorben zat warna, yaitu biru metilena. Perlakuan terhadap kulit buah kakao meliputi modifikasi asam kemudian diimpregnasikan dengan basa, modifikasi basa, dan tanpa modifikasi. Basa yang yang digunakan adalah natrium hidroksida sedangkan asam yang digunakan adalah asam nitrat. Basa berfungsi untuk mengaktifkan gugus hidroksi pada senyawa fenolik sehingga membentuk garam dari asam lemah yang bermuatan negatif dan dapat mengikat zat warna yang bermuatan positif. Asam nitrat berfungsi untuk mengaktifkan gugus hidroksi pada molekul selulosa. Menurut Dewi (2005) pencucian asam nitrat lebih meningkatkan kapasitas adsorpsi terhadap logam dibandingkan dengan menggunakan asam fosfat. Impregnasi basa dan modifikasi asam dilakukan secara bertahap. Modifikasi dilakukan terlebih dahulu untuk mengaktifkan gugus hidroksi pada selulosa, diikuti dengan impregnasi untuk membuat gugus hidroksi bermuatan negatif dan juga untuk mengaktifkan sampai ke dalam pori dan bukan hanya terbatas pada permukaan. Menurut Wing (1997) asam nitrat dapat mengaktifkan gugus hidroksi pada selulosa sehingga dapat mengikat zat warna dan logam berat. Mekanisme reaksi modifikasi biosorben KBK dengan menggunakan asam nitrat dapat dilihat pada reaksi di bawah ini:
N O N O O O H n 1 5 0oC H : : N O N O O H O H n : : S e lu lo sa O H + N O N O O H O H n : : O H S e lu lo s a -H+ N O N O O H O H n : O S e lu lo s a .. .. .. H+ N O N O O H OH2 n : : O Selulosa -H2O N O N O: O H O S elulosa : .. N O N O O n : O S e lu losa . . - OH H + N O N O - O O - O H S e lu lo s a n N O N O O O H n 1 5 0oC H : : N O N O O H O H n : : S e lu lo sa O H + N O N O O H O H n : : O H S e lu lo s a -H+ N O N O O H O H n : O S e lu lo s a .. .. .. H+ N O N O O H OH2 n : : O Selulosa -H2O N O N O: O H O S elulosa : .. N O N O O n : O S e lu losa . . - OH H + N O N O - O O - O H S e lu lo s a n
Kulit buah cokelat dengan kadar air kering berkisar 9.81% (Lampiran 2) yang telah dikeringkan di dalam oven kemudian dihaluskan hingga berukuran 100 mesh. Selama proses modifikasi, biosorben hilang sekitar 10-20%. Biosorben tanpa modifikasi berwarna cokelat muda, biosorben modifikasi
asam terimpegnasi basa berwarna kuning, dan biosorben modifikasi basa berwarna cokelat tua Gambar 3a,3b, dan 3c). (
Gambar 3 Biosorben kulit buah kakao BTM (a), BMATB (b), BMB (c), dan standar arang aktif (d).
Penentuan Kondisi Optimum BTM
BTM dapat mengikat biru metilena, baik dari larutan tunggal maupun limbah industri. Hasil penelitian menunjukkan bahwa adsorpsi BTM dalam biru metilena dapat menurunkan konsentrasi biru metilena dari 4 ppm menjadi 0.8883 ppm (Lampiran 5). Lamanya proses adsorpsi ditentukan berdasarkan kapasitas adsorpsinya selama rentang waktu 0-90 menit. Data selengkapnya diberikan pada Lampiran 5.
Adsorpsi biru metilena dengan menggunakan BTM optimum pada menit 60 untuk mencapai kapasitas maksimumnya, yaitu sebesar 174.8251 µg/g biosorben (Tabel 1). Kondisi ini terjadi akibat tapak aktif dari biosorben maksimum dalam menjerap adsorbat. Setelah waktu optimum adsorpsi,
A
B
8
kapasitas adsorpsi (Q) cenderung menurun (Gambar 4). Hal ini disebabkan oleh menjadi jenuhnya tapak aktif biosorben. Pori-pori telah terisi penuh oleh adsorbat sehingga dapat terjadi proses desorpsi.
155.5228 167.5994 174.8251 164.0279 163.7995 156.8829 157.6669 150 155 160 165 170 175 180 0 15 30 45 60 75 90 105
Waktu adsorpsi (menit)
Q ( μg/ gr am b ios or be n) BTM
Gambar 4 Waktu optimum adsorpsi biru metilena oleh BTM.
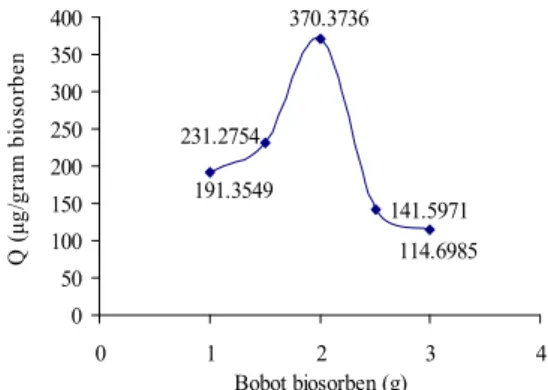
Bobot biosorben mempengaruhi kapasitas adsorpsi dan % efektivitas adsorpsi (Lampiran 8). Kapasitas adsorpsi maksimum BTM terhadap adsorpsi biru metilena 4 ppm diperlihatkan pada Tabel 1. Pada saat bobot BTM divariasikan dari 1-2 gram terjadi kenaikan kapasitas adsorpsi dari 191.3549 µg/g biosorben menjadi 370.3736 µg/g biosorben dan ketika ditambahkan bobot biosorben mencapai 3 gram terjadi penurunan kapasitas adsorpsi yang signifikan menjadi 114.6985 µg/g biosorben (Gambar 5). Peningkatan kapasitas adsorpsi disebabkan oleh pembukaan tapak aktif yang lebih besar sehingga biosorben lebih banyak mengikat adsorbat. Hal ini menyebabkan kapasitas adsorpsi akan meningkat sedangkan penurunan kapasitas adsorpsi disebabkan oleh adanya sisi aktif biosorben yang belum semuanya berikatan dengan adsorbat (Rahmawati 2006). 141.5971 231.2754 114.6985 370.3736 191.3549 0 50 100 150 200 250 300 350 400 0 1 2 3 4 Bobot biosorben (g) Q ( μg/ gr am bi os or be n BTM
Gambar 5 Bobot optimum adsorpsi biru
metilena oleh BTM.
Penambahan ion dapat meningkatkan jumlah larutan zat warna yang diadsorpsi. Berdasarkan hasil penelitian, konsentrasi optimum BTM sebesar 0.01 M dengan kapasitas adsorpsi 130.6705 µg/g biosorben. Hal ini disebabkan BTM belum dimodifikasi dan belum diimpregnasi, sehingga kation biru metilena hanya sedikit membutuhkan ion-ion nitrat dari KNO3 untuk berikatan dengan ion N+ dari biru metilena melalui jembatan garam. Kenaikan konsentrasi KNO3 menjadi 1 M menyebabkan terjadinya penurunan kapasitas adsorpsi menjadi 126.9213 µg/g biosorben (Gambar 6) dan data selengkapnya dapat dilihat pada lampiran 14. Hal ini disebabkan oleh spesies ionik, baik dari KNO3 dan biru metilena yang teradsorpsi pada permukaan biosorben melalui jembatan garam menjadi berkurang. Hal ini menyebabkan kapasitas ads rpsi menjadi menurun. o
122.9348 130.6705 130.263 126.9213 118 120 122 124 126 128 130 132 Kontrol 0.01 M 0.1 M 1M
Konsentrasi kalium nitrat
Q ( μg/ gr am bi os or be n
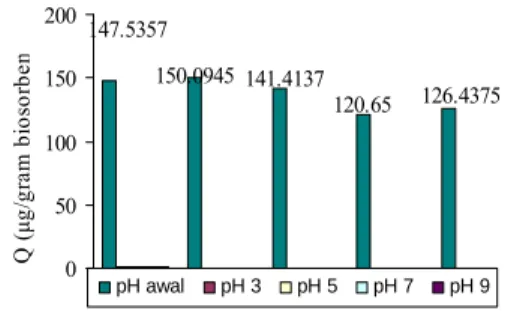
Gambar 6 Adsorpsi larutan biru metilena oleh BTM dengan pengaruh kuat ion. pH dapat mempengaruhi kapasitas adsorpsi dan bergantung pada jenis biosorben yang digunakan (Jason 2004). pH memegang peranan penting dalam ciri adsorpsi karena pH yang rendah akan menyediakan jumlah ion H+ yang disukai dalam jumlah besar. Variasi pH yang diujicobakan pada larutan biru metilena yang dapat mempengaruhi kapasitas adsorpsi adalah pH 3, 5, 7, dan 9 (Lampiran 11). pH optimum dicapai pada pH 3.02 dengan kapasitas adsorpsi maksimum 150.0945 µg/g biosorben (Gambar 7). Kondisi ini dicapai karena adanya sifat kationik dari biru metilena baru akan tampak pada pH asam, yaitu setelah banyaknya gugus hidroksi pada senyawa selulosa dan tanin yang teraktifkan, sehingga banyak biru metilena yang terikat pada biosorben.
9
147.5357 150.0945 141.4137 120.65 126.4375 0 50 100 150 200 Q ( μg/ gr am bi os or be n pH awal pH 3 pH 5 pH 7 pH 9Gambar 7 Kapasitas adsorpsi biru metilena pada berbagai variasi pH oleh BTM. Tabel 1 Kondisi optimum BTM.
Parameter optimum Kondisi Kapasitas adsorpsi (µg/g biosorben) Waktu Bobot Kuat ion pH 60 menit 2 gram 0.01 M 3.02 174.8251 370.3736 130.6705 150.0945 Penentuan Kondisi Optimum BMATB
Adsorpsi biru metilena oleh BMATB hanya memerlukan waktu 45 menit untuk mencapai kapasitas maksimumnya, yaitu sebesar 189.4221 µg/g biosorben (Tabel 2). Data selengkapnya mengenai kapasitas adsorpsi dengan berbagai variasi waktu dapat dilihat pada Lampiran 6. Kondisi optimum ini dicapai akibat adsorbat yang terakumulasi pada permukaan optimum dalam mengasorpsi biru metilena. Hal ini juga mengindikasikan bahwa makin banyak pori yang dimiliki oleh biosorben sehingga kecepatan adsorpsi semakin meningkat (Setiadi & Sugiharso 1999). Setelah waktu optimum adsorpsi tercapai, kapasitas adsorpsi (Q) cenderung tetap, setelah itu sedikit menurun (Gambar 8). Hal ini juga disebabkan pori-pori telah terisi penuh oleh adsorbat sehingga dapat terjadi proses desorpsi atau pelepasan kembali setelah pengocokan. 169.751 182.2471 189.4221 188.5323 187.5837 186.7063 187.2563 165 170 175 180 185 190 195 0 15 30 45 60 75 90 105 Waktu optimum (menit)
BMATB Q (μ g/ gr am b ios or be n) Q (μ g/ gr am b ios or be n)
Gambar 8 Waktu optimum adsorpsi biru metilena oleh BMATB.
Peningkatan bobot BMATB dari 1 hingga 3 gram menyebabkan penurunan kapasitas adsorpsi secara signifikan (Gambar 9). Hal ini disebabkan oleh jumlah biosorben yang berikatan dengan adsorbat sudah dalam keadaan jenuhnya sehingga apabila ditambahkan biosorben yang berlebih menyebabkan terjadinya proses desorpsi atau pelepasan kembali antara biosorben dan adsorbat. Kondisi optimum BMATB dicapai pada bobot 1 gram dengan kapasitas adsorpsi 357.9818 µg/g biosorben. Hal ini disebabkan oleh bobot 1 gram sudah optimum dalam mengadsorpsi biru metilena pada permukaan biosorben. Data selengkapnya mengenai kapasitas adsorpsi dengan berbagai variasi bobot oleh BMATB dapat dilihat pada Lampiran 9. 357.9818 224.8667 97.0021 126.038 155.2744 0 50 100 150 200 250 300 350 400 0 1 2 3 4 Bobot biosorben (g) Q ( μg /g ra m bi os or be n BMATB
Gambar 9 Bobot optimum adsorpsi biru metilena oleh BMATB.
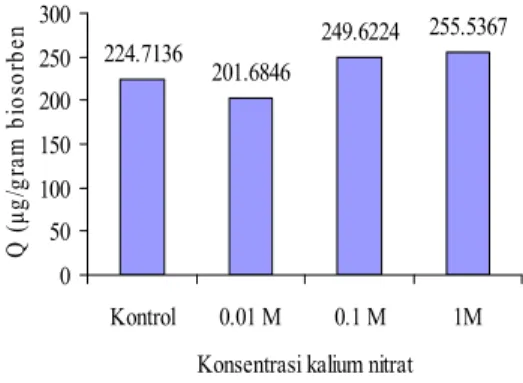
Kuat ion pada BMATB dapat meningkatkan kapasitas adsorpsinya dari 224.7136 µg/g menjadi 255,5367 µg/g biosorben dengan penambahan KNO3 1 M. Variasi KNO3 yang digunakan adalah 0-1M (Gambar 10). Kondisi optimum dicapai pada konsentrasi 1 M dengan kapasitas adsorpsi 255,5367 µg/g biosorben (Tabel 2) dan data selengkapnya dapat dilihat pada Lampiran 14. Hal ini disebabkan semakin banyak ion nitrat yang diadsorspsi oleh pasangan ion N+dari biru metilena maka kenetralan lisitrik akan semakin stabil dan masa desorpsi antara biosorben dan absorbat dapat diperpanjang waktunya. Hal ini dapat menyebabkan kapasitas adsorpsi akan meningkat seiring dengan penambahan KNO3. Faktor lain yang dapat meningkatkan kapasitas adsorpsi adalah permukaan harus mengadsorpsi pasangan ionnya untuk mempertahankan kenetralan listriknya (Anggraningrum 1996 ).
10
224.7136 201.6846 249.6224 255.5367 0 50 100 150 200 250 300 Kontrol 0.01 M 0.1 M 1M Konsentrasi kalium nitratQ ( μg/ gr am b ios or be n 262.2835 299.9206 311.8384 331.8348 325.4904 0 50 100 150 200 250 300 350 Q ( μg /gr am bi os or be n) pH awal pH 3 pH 5 pH 7 pH 9
Gambar 10 Adsorpsi larutan biru metilena oleh BMATB deng n pengaruh kuat ion. a pH yang digunakan pada larutan biru metilena yang dapat mempengaruhi kapasitas adsorpsi antara BMATB dan biru metilena adalah 3, 5, 7, dan 9. pH optimum dicapai pada pH 3.04 (Tabel 2) dengan kapasitas adsorpsi 331.8348 µg/g biosorben (Gambar 11) dan data selengkapnya dapat dilihat pada Lampiran 12. Hal ini dikarenakan pada pH 3.04 gugus amina terprotonasi dalam jumlah yang lebih banyak dibandingkan pH 5 yang menyebabkan kondisi menjadi lebih asam dan tersedianya ion H+ dalam jumlah besar. Hal tersebut menyebabkan banyaknya gugus hidroksi dari selulosa yang teraktifkan, sehingga dimungkinkan lebih banyak adsorbat yang teradsorpsi pada permukaan. pH basa tidak dapat meningkatkan kapasitas adsorpsi disebabkan gugus amino tidak dapat diprotonasi, sehingga tidak dapat menyediakan ion H+ dalam jumlah besar, yang menyebabkan gugus hidroksi pada selulosa tidak dapat diaktifkan.
Gambar 11 Kapasitas adsorpsi biru metilena pada berbagai variasi pH oleh BMATB.
Tabel 2 Kondisi optimum BMATB.
Parameter optimum Kondisi Kapasitas adsorpsi (µg/g biosorben) Waktu Bobot Kuat ion pH 45 menit 1 gram 1 M 3.04 189.4221 357.9818 255.5367 331.8348 Penentuan Kondisi Optimum BMB Adsorpsi biru metilena oleh BMB memerlukan waktu 30 menit untuk mencapai kapasitas adsorpsi maksimumnya, yaitu, 185.8956 µg/g biosorben (Tabel 3) dan data selengkapnya terdapat pada Lampiran 10. Hal ini disebabkan semakin banyak jumlah biosorben maka ketersediaan pori dan luas permukaan aktif semakin meningkat. Bertambahnya pori dan sisi aktif dari permukaan memungkinkan adsorpsi terjadi di banyak tempat dari permukaan biosorben sehingga penjerapan menjadi optimum. Hal ini ditandai dengan tingginya kapasitas adsorpsi antara biosorben dan adsorbat. Setelah waktu optimum adsorpsi tercapai, kapasitas adsorpsi (Q) cenderung menurun drastis (Gambar 12). Hal ini disebabkan pori-pori lebih cepat terisi oleh adsorbat sehingga proses desorpsi lebih cepat terjadi.
180.2348 182.6319 185.8956 176.9846 178.4672 177.2123 176.3068 174 176 178 180 182 184 186 188 0 15 30 45 60 75 90 105
Waktu adsorpsi (menit)
Q ( μ g/gr am bios or be n) BMB
Gambar 12 Waktu optimum adsorpsi biru metilena oleh BMB.
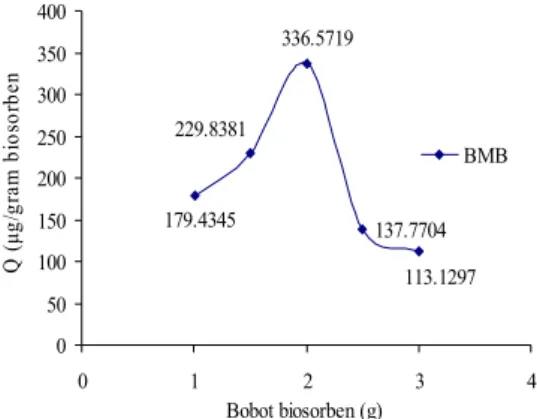
Variasi bobot BMB dari 1 sampai dengan 2 gram terjadi kenaikan kapasitas adsorpsi dari 179.4345 µg/g menjadi 336.5719 µg/g biosorben. Ketika ditambahkan bobot biosorben 2.5 dan 3 gram terjadi penurunan kapasitas adsorpsi menjadi 113.1297 µg/g biosorben (Gambar 13) dan data selengkapnya dapat dilihat pada Lampiran 10. Peningkatan kapasitas adsorpsi disebabkan oleh pembukaan tapak aktif yang lebih besar. Penurunan kapasitas adsorpsi tersebut disebabkan oleh proses desorpsi lebih cepat terjadi (Rahmawati 2006).
11
137.7704 179.4345 229.8381 336.5719 113.1297 0 50 100 150 200 250 300 350 400 0 1 2 3 4 Bobot biosorben (g) Q ( μg /g ra m bi os or be n BMBGambar 13 Bobot optimum adsorpsi biru metilena oleh BMB.
Penambahan jumlah ion dapat meningkatkan jumlah biru metilena yang diadsorpsi. Variasi KNO3 yang dilakukan adalah 0-1 M (Gambar 14). Variasi tesebut dilakukan untuk menentukan kuat ion optimum yang diaplikasikan untuk isoterm dan limbah industri zat warna. Kuat ion optimum terjadi pada konsentrasi 1 M dengan kapasitas adsorpsi 166.3049 µg/g biosorben (Tabel 3) dan data selengkapnya dapat dilihat pada Lampiran 14. Hal yang sama dilakukan pada arang aktif sebagai pembanding, terjadi peningkatan kapasitas adsorpsi dari 655.2257 µg/g menjadi 664.0005µg/g biosorben (Gambar 15). Pengaruh peningkatan KNO3 untuk adsorpsi zat warna sebagai jembatan garam dan menetralkan muatan listrik, saat terjadi pembentukan ikatan antara biosorben dengan biru metilena sehingga ikatan akan semakin stabil dengan adanya io-ion nitrat.
158.1046 163.5515 162.7135 166.3049 154 156 158 160 162 164 166 168 Kontrol 0.01 M 0.1 M 1M Konsentrasi kalium nitrat
Q ( μg/ gr am bi os or be n BMB
Gambar 14 Adsorpsi larutan biru metilena oleh BMB dengan pengaruh kuat ion.
655.2257 648.0082 656.1219 664.0005 640 645 650 655 660 665 670 Kontrol 0.01 M 0.1 M 1M
Konsentrasi kalium nitrat
Q ( μg /gr am bi os or be n
Gambar 15 Adsorpsi larutan biru metilena oleh arang aktif dengan pengaruh
kuat ion.
BMB optimum pada pH 7.5 dengan kapasitas adsorpsi 180.2716 µg/g biosorben dan data selengkapnya terdapat pada Lampiran 13. Seharusnya kondisi optimum tersebut terjadi pada pH 3 yang menyediakan H+ dalam jumlah besar sehingga gugus hidroksi pada tanin dapat diaktifkan untuk dapat meningkatkan kapasitas adsorpsi (Gambar 16). Hal ini tidak terjadi dan sebaliknya terjadi pada pH 7.5. Hal tersebut disebabkan oleh biosorben yang langsung diimpregnasi dengan basa dapat meningkatkan kinetika dan kapasitas adsorpsi (Wu & Paul 1998). Arang aktif sebagai pembanding, kenaikan kapasitas adsorpsinya
apat dilihat pada Gambar 17. d 180.2716 170.0324 161.6098 161.3673 172.2946 0 50 100 150 200 Q ( μg/ gr am bi os or be n) pH awal pH 3 pH 5 PH 7 pH 9
Gambar 16 Kapasitas adsorpsi biru metilena pada berbagai variasi pH oleh BMB. 658.7709 659.3058640.1911 646.3694 604.5225 0 100 200 300 400 500 600 700 Q ( μg/ gr am bi os or be n pH awal pH 3 pH 5 pH 7 pH 9
Gambar 17 Kapasitas adsorpsi biru metilena pada berbagai variasi pH oleh arang aktif.
12
Tabel 3 Kondisi optimum BMB.
Parameter optimum Kondisi Kapasitas adsorpsi (µg/g biosorben) Waktu Bobot Kuat ion pH 30 menit 2 gram 1 M 7.5 185.8956 336.5719 166.3049 180.2716 0 500 1000 1500 2000 2500 3000 3500
BTM BMATB BMB Arang aktif
Jenis biosorben Q ( μg /gr am bi os or ben )
Adsorpsi Limbah Industri
Kemampuan penjerapan biosorben kulit buah kakao juga dicobakan terhadap limbah industri zat warna pada kondisi optimum masing-masing biosorben (Lampiran 16). Perlakuan dilakukan pada kondisi waktu optimum, bobot optimum, kuat ion optimum, dan pH optimum yang didapat dari hasil penelitian larutan tunggal biru metilena.
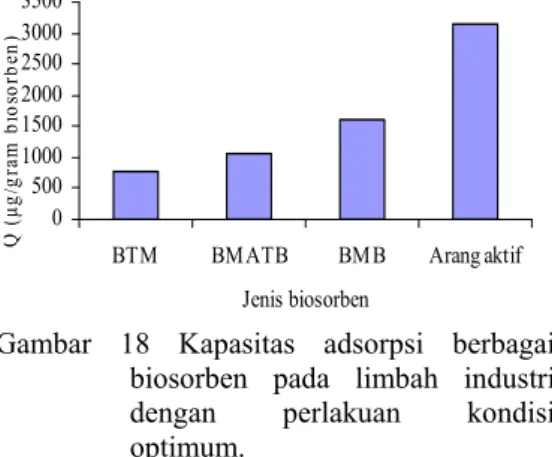
Kapasitas adsorpsi yang didapat pada limbah industri dengan menggunakan biosorben BTM, BMATB, BMB, dan arang aktif berturut-turut adalah 775.2534, 1069.5697, 1605.9921, dan 3150.7858 µg/g biosorben (Gambar 18). Kapasitas adsorpsi biosorben tertinggi diperlihatkan oleh BMB. Hal ini berkaitan dengan konsep pembukaan pori–pori dan bertambahnya tapak aktif pada permukaan BMB. Hasil ini sesuai dengan teori bahwa semakin banyak pori yang dimiliki suatu adsorben, maka kecepatan adsorpsi makin meningkat sehingga kapasitas adsorpsi juga dapat meningkat (Setiadi & Sugiharso 1999). Apabila hasil tersebut dibandingkan dengan arang aktif, kapasitas adsorpsi dari arang aktif masíh lebih besar daripada ketiga biosorben tersebut. Hal ini disebabkan oleh arang aktif mempunyai struktur mikropori yang mudah dipenetrasi.
Gambar 18 Kapasitas adsorpsi berbagai biosorben pada limbah industri dengan perlakuan kondisi optimum.
Kapasitas adsorpsi zat warna di dalam limbah industri zat warna relatif lebih kecil dibandingkan dengan larutan tunggalnya. Hal
ini disebabkan oleh keberadaan zat warna lain di dalam limb0ah industri yang berkompetisi untuk teradsorpsi oleh biosorben.
Isoterm Adsorpsi
Tipe isoterm adsorpsi dapat digunakan untuk mempelajari penjerapan. Adsorpsi fase padat-cair pada umumnya mengacu pada tipe isoterm Freundlich dan Langmuir (Atkins 1999). Data konsentrasi kesetimbangan, konsentrasi adsorbat terjerap dan bobot BTM digunakan dalam pembuatan kurva regresi linear untuk tipe isoterm Langmuir (Lampiran 18) dan isoterm Freundlich (Lampiran 19), data konsentrasi kesetimbangan, konsentrasi adsorbat terjerap, dan bobot BMATB dalam pembuatan kurva regresi linear untuk tipe isoterm Langmuir (Lampiran 20) dan isoterm Freundlich (Lampiran 21) sedangkan untuk BMB dalam pembuatan kurva regresi linear untuk tipe isoterm Langmuir (Lampiran 22) dan Isoterm Freundlich (Lampiran 23).
Biosorben kulit buah kakao tanpa modifikasi memberikan lineritas 94.32% untuk isoterm Langmuir (Gambar 19) dan 98.94% (Gambar 20) untuk isoterm Freundlich. Biosorben kulit buah kakao modifikasi asam terimpregnasi basa memberikan lineritas 87,86% untuk isoterm Langmuir (Gambar 21) dan 96.71% (Gambar 22) untuk isoterm Freundlich. Adsorpsi biru metilena oleh kulit buah kakao tanpa modifikasi dan kulit buah kakao modifikasi asam terimpregnasi basa mengikuti persamaan Freundlich karena lineritas untuk tipe isoterm Freundlich lebih besar sedangkan biosorben modifikasi basa memberikan lineritas 98.85% untuk isoterm Langmuir (Gambar 23) dan 86.70% (Gambar 24) untuk isoterm Freundlich, mengikuti persamaan Langmuir karena memiliki lineritas yang lebih besar.
y = 36.004x - 28.51 R2 = 0.9432 0 10 20 30 40 50 0 0.5 1 1.5 2 2.5 C (ppm) X/ M
Gambar 19 Isoterm Langmuir adsorpsi biru metilena oleh biosorben tanpa modifikasi pada suhu 28oC.
13
y = 2.573x + 0.8778 R2 = 0.9894 0 0.5 1 1.5 2 -0.15 -0.05 0.05 0.15 0.25 0.35 Log C Lo g X/ M y = 3.4397x + 1.9554 R2 = 0.867 -1 -0.5 0 0.5 1 1.5 2 -0.6 -0.5 -0.4 -0.3 -0.2 -0.1 0 Log C Lo g X/ M y = 20.974x - 7.8246 R2 = 0.8786 0 20 40 60 80 100 -0.5 0.5 1.5 2.5 3.5 4.5 C (ppm) X/ MGambar 20 Isoterm Freundlich adsorpsi biru metilena oleh biosorben tanpa modifikasi pada suhu 28oC.
Gambar 21 Isoterm Langmuir adsorpsi biru metilena oleh biosorben modifikasi asam terimpregnasi basa pada suhu 28oC. y = 1.5968x + 0.9703 R2 = 0.9671 -0.5 0 0.5 1 1.5 2 2.5 -1 -0.5 0 0.5 1 Log C Lo g X/ M y = 71.974x - 20.992 R2 = 0.9885 0 10 20 30 40 50 0 0.2 0.4 0.6 0.8 1 C (ppm) X/ M
Gambar 22 Isoterm Freundlich adsorpsi biru metilena oleh biosorben modifikasi asam terimpregnasi basa pada suhu 28oC.
Gambar 23 Isoterm Langmuir adsorpsi biru metilena oleh biosorben modifikasi basa pada suhu 28oC.
Nilai konstanta k, α, n, β dan yang diperoleh dari persamaan regresi Langmuir dan Freundlich menggambarkan besaran nilai zat warna atau limbah yang dapat diadsorpsi pada sisi permukaan biosorben.
Gambar 24 Isoterm Freundlich adsorpsi biru metilena oleh biosorben modifikasi basa pada suhu 28oC.
Adsorpsi berlangsung secara kimisorpsi satu lapisan jika isoterm yang dianut adalah Langmuir. Jika isoterm yang dianut adalah Freundlich maka adsorpsi terjadi secara fisisorpsi banyak lapisan (Anggraningrum 1996). Freundlich mengasumsikan adsorpsi fase padat-cair berlangsung secara adsorpsi multilayer. Dalam fisisorpsi, ikatan antara adsorbat dengan adsorben bersifat lemah karena hanya melibatkan ikatan van der Waals. Berdasarkan kedua isoterm, mekanisme fisisorpsi berlaku untuk biosorben tanpa modifikasi dan biosoben modifikasi asam terimpregnasi basa sedangkan untuk biosorben modifikasi basa berlaku mekanisme kimisorpsi yang kekuatan ikatannya lebih kuat dibandingkan dengan fisisorpsi. Nilai konstanta n, k, α, dan β dapat dihitung dari persamaan regresi Freundlich dan Langmuir
ang didapat (Tabel 4 dan 5). y
Tabel 4 Nilai konstanta n dan k dari persamaan Freundlich.
Tabel 5 Nilai konstanta α dan β dari persamaan Langmuir. Biosorben n
k
R BTM 0.3886 7.5474 98.94 BMATB 0.6263 9.3389 96.71 BMB- -
98.85 Biosorben α β R BTM - - 98.94 BMATB - - 96.71 BMB 0.0138 3.4518 98.8514
SIMPULAN DAN SARAN
SimpulanKulit buah kakao, baik dengan modifikasi maupun tanpa modifikasi dapat digunakan sebagai biosorben. Tetapi kapasitas adsorpsi terbesar dicapai dengan melakukan modifikasi asam terimpregnasi basa atau pun dengan melakukan modifikasi basa. Waktu adsorpsi tercepat dicapai oleh biosorben modifikasi basa sedangkan bobot optimum tercepat dicapai oleh biosorben modifikasi asam terimpregnasi basa.
Perubahan kuat ion dan pH mempengaruhi daya adsorpsi kulit buah kakao. Hal tersebut dapat dilihat dari peningkatan kapasitas adsorspsi sebelum dan sesudah perlakuan pH dan kuat ion.
Adsorpsi larutan biru metilena oleh biosorben BTM dan BMATB diperkirakan berlangsung secara fisisorpsi sedangkan biosorben BMB diperkirakan berlangsung secara kimisorpsi. Hasil analisis ragam pada α 5% menyatakan bahwa konsentrasi KNO3, tipe biosorben, dan interaksi keduanya memberikan pengaruh yang berbeda nyata terhadap kapasitas adsorpsi.
Saran
Berdasarkan penelitian ini, maka tahapan selanjutnya yang perlu dilakukan adalah melakukan variasi luas permukaan untuk menentukan luas permukaan optimum, menguji coba kemampuan adsorpsi kulit buah kakao terhadap zat warna bermuatan negatif dan netral, mencirikan lebih lanjut biosorben kulit buah kakao, seperti menentukan kapasitas desorpsi setiap biosorben, serta mengkaji lebih lanjut kebenaran mekanisme reaksi penjerapannya.
DAFTAR PUSTAKA
Adegbola AA. 1997. Utilization of
Agro-industrial by Product in Africa. Rome:
FAO Animal Production and Health Paper.
Amirroenas DE. 1990. Mutu Ransum Berbentuk Pellet dengan Bahan Serat Biomassa POD Cokelat (Theobroma
Cacao L) untuk Pertumbuhan Sapi
Perah Jantan [tesis]. Bogor: Fakultas Pascasarjana, Institut Pertanian Bogor.
Amirullah. 2006. Biosorpsi Biru Metilena oleh Ganggang Cokelat (Sargassum
binderi). [skripsi]. Bogor: Fakultas
Matematika dan IPA, Institut Pertanian Bogor.
Anggaraningrum IT. 1996. Model adsorpsi ion kompleks koordinasi nikel (II) pada permukaan alumina [tesis]. Jakarta: Fakultas Matematika dan IPA, Universitas Indonesia.
Anonim. 2001. Tanin: Interaction with other
Macromolecul.
http://www.ansci.cornell.edu/plants/tox
icagents/ tannin/ ocurance.htmt. [12 Desember 2003].
Atkins PW. 1999. Kimia Fisika Jilid 1. Irma I
Kartohadiprojo, penerjemah; Rohhadyan T, Hadiyana K, editor.
Jakarta: Erlangga. Terjemahan dari:
physical Chemistry.
Bird T. 1993. Kimia Fisik untuk Universitas. Jakarta: Gramedia Pustaka Utama. BPS. 2005. Statistik pertanian indonesia.
Jakarta: Biro Pusat Statistik.
Citrorekoso P et al. 1994. Daya adsorpsi arang aktif terhadap anion kromium (VI) pada perubahan jenis dan bobot serta pH contoh. Prosiding Seminar
Nasional III Kimia dalam Industri dan Lingkungan; Yogyakarta, 5-6 Des
1994. Jakarta: Jaringan Kerjasama Kimia Analitik Indonesia.
Deptan. 2007. Kulit Buah Kakao Limbah Bermanfaat.http://www.litbang.depta n.go.id/jurnal [04 Jun 2007].
Deshpandi SS, Cheriyan M, Stalunkhe DK. 1986. Tannins analysis of food products. CRC Critical Rev Food Sci
Nutrition 24: 401-449.
Devendra C. 1997. The Utilization of Cacao Pod Husk by Sheep. The Malaya Agr J 5: 179-185.
Dewi IR. 2005. Modifikasi Asam terhadap Kulit Singkong Sebagai Bioremoval Logam Pb(II) dan Cd(II) [skripsi]. Bogor: Fakultas Matematika dan IPA, Institut Pertanian Bogor.
15
Gufta FK. 1998. Utilization of bagasse fly ash generated in the sugar industry for removal and recovery of phenol and p-Nitrophenol from wastewater. J
Chem Tech Biotechnology 70: 180-186.
Haryati T, Hardjisuwito B. 1984. Pemanfaatan Limbah kakao sebagai Bahan Dasar Pembuatan Pektin. J Perkebunan 3:175-180.
Horsfall M Jnr, Abia AA, Spiff Al. 2003. Removal of Cu(II) and Zn(II) ions from wastewater by cassava (Manihot
esculenta Crantz) waste biomass. African J Biotech 2: 360-364.
Jason PP. 2004. Activated carbon and some aplications for the remediation soil and ground water pollution. http//www.ce.edu/program areas. [8 Jun 2004].
Joseph G. 1996. Status Asam Basa dan Metabolisme Mineral pada Ternak Kerbau Lumpur yang diberi Pakan Jerami Padi dan Konsentrat dengan Penambahan Natrium [tesis]. Bogor: Fakultas Pascasarjana, Institut Pertanian Bogor.
Kumar VK, Sivanesen S, Ramamurthi V. 2004. Adsorption of methylene blue onto Phitophora sp Environ Technol. http://www.greenpages. The global directory for environmental technology. Index.html [19 Juli 2005].
Low KS, Lee CK, Tan KK. 1995. Biosorption of basic Dyes by Water Hyacinth Roots. Bioresources of Technology 52:79-83.
Lynch CT. 1990. Practical Handbook of
Material Sciens. Ed. ke-2. New York:
CRC Pr.
Marshall WE, Mitchell M J. 1996. Agriculture by-product as metal adsorbent: Sorption properties and resistance to Mechanical abrasion. J
Chem Techn Biotechnology 66:
192-198.
Raghuvanshi SP et al. 2004. Kinetics study of methylene blue dye biadsorption on
baggase. App Ecol Env Researches. 2: 35-43.
Rahmawati E. 2006. Adsorpsi Senyawa Residu Klorin pada Karbon Aktif Termodifikasi Zink Klorida [skripsi]. Bogor: Fakultas Matematika dan IPA, Institut Pertanian Bogor.
[RSC] Royal Society of Chemiestry. 1992.
The Dictionary of Substances and Their Effects. Vol. Ke-1. London: Clays.
Satake M, Nagahiro T. 1990. Modern
Dictionary Physical Chemistry. New
Delhi: Discovering.
Setiadi, Sugiarso E. 1999. Pengaruh impregnan NaOH terhadap luasan permukaan karbon aktif dan kemampuan adsorpsi terhadap CO2. Di dalam: Fundamental dan Aplikasi
Teknik Kimia. Prosiding Seminar Nasional; Surabaya, 24-25 Nov 1994.
Depok : Universitas Indonesia A17:1-7. Sunanto H. 1992. Cokelat: Budidaya,
Pengolahan Hasil, dan Aspek Ekonominya. Yogyakarta: Kanisius.
Tchobanoglous G, Franklin LB. 1991.
Wastewater Engineering: Treatment, Disposal, and Reuse. Singapura:
McGraw-Hill.
Wing RE. 1997. Cellulosic Citrates: Preparation and ion exchange properties. J pol mater. 71: 803-805. Wu S, Paul C. 1998. Modification of
commercial activated carbon for metal adsorption by several approaches [makalahpribadi].http//www.cee.vt.edu/ journal/ shunnianchen [20 Jan 2004].
17
Lampiran 1 Bagan alir penelitian
Analisis kadar air T = 105oC,t= 36 jam
Kulit buah kakao
+Dicuci dengan air mengalir lalu dikering udarakan + Ditumbuk
±
100 MeshPembuatan biosorben Biosorben tanpa
modifikasi
Pencucian dengan air deionisasi
Pengaruh kuat ion terhadap adsorpsi zat warna
Pengaruh pH terhadap adsorpsi zar warna
Penentuan isoterm adsorpsi
Uji statistik Biosorben
modifikasi basa Biosorben modifikasi asam terimpregnasi basa
18
Lampiran 2 Kadar air kulit buah kakao kering.
Ulangan a b c Kadar air
(%) 1 48.8154 48.6208 0.1946 9.71 2 51.3082 51.1087 0.1995 9.96 3 41.7986 41.6030 0.1956 9.76 rataan 9.81 Keterangan:
a: bobot sampel dan cawan petri sebelum dikeringkan b: bobot sampel dan bobot timbang sesudah dikeringkan c: bobot sampel.
Contoh perhitungan: Kadar air (%) =
c b a− x 100% = 0045 . 2 6208 . 48 8154 . 48 − x 100% = 9.81%
Lampiran 3 Konsentrasi dan absorbans larutan biru metilena pada pembuatan
kurva standar biru metilena (λ maksimum = 665 nm).
Lampiran 4 Konsentrasi dan absorbans larutan biru metilena pada pembuatan
kurva standar biru metilena untuk limbah industri (λ maksimum =
665 nm).
Kode Konsentrasi (ppm) Absorbans std 1 std 2 std 3 std 4 std 5 std 6 C awal 0.5 1.0 2.0 3.0 4.0 5.0 4.0 0.1046 0.2725 0.5058 0.7799 0.9830 1.3372 0.2175 y = 0.2633x - 0.0164 R2 = 0.9952 0 0.2 0.4 0.6 0.8 1 1.2 1.4 0 1 2 3 4 5 Konsentrasi (ppm) Ab so rb an Kode Konsentrasi (ppm) Absorbans y = 0.0214x + 0.8685 R2 = 0.966 0 0.5 1 1.5 0 5 10 15 20 Konsentrasi (ppm) Ab so rb an std 1 std 2 std 3 std4 5.0 10.0 15.0 20.0 0.9829 1.0550 1.2218 1.283919
Lampiran 5 Efektivitas dan kapasitas adsorpsi (Q) biosorben kulit buah kakao
tanpa modifikasi pada penentuan waktu optimum adsorpsi biru
metilena.
t (menit ke-) A [Biru Metilena] (ppm) Efektivitas (%) Q (μg Biru metilena/ g biosorben) 0 0.2175 0.8883 77.79 155.5228 15 0.1726 0.7178 82.05 164.0279 15* 0.0088 0.0957 97.72 203.3079 30 0.1739 0.7227 81.93 163.7995 45 0.1537 0.6460 83.85 167.5994 60 0.1158 0.5021 87.44 174.8251 75 0.2104 0.8614 78.46 156.8829 90 0.2062 0.8454 78.86 157.6669Keterangan: * Arang aktif
Waktu optimum biosorben tanpa modifikasi
Lampiran 6
Efektivitasdan kapasitas adsorpsi (Q) biosorben kulit buah kakao
modifikasi asam terimpregnasi basa pada penentuan waktu optimum
adsorpsi biru metilena.
t (menit ke-) A [Biru Metilena] (ppm) Efektivitas (%) Q (μg Biru metilena/ g biosorben) 0 0.1427 0.6043 84.89 169.7510 15 0.0767 0.3536 91.16 182.2471 30 0.0438 0.2286 94.28 188.5323 45 0.0391 0.2108 94.73 189.4221 60 0.0506 0.2545 93.64 187.2563 75 0.0535 0.2655 93.36 186.7063 90 0.0487 0.2472 93.82 187.5837
Keterangan: Waktu optimum biosorben modifikasi asam terimpregnasi basa
Lampiran 7 Efektivitas dan kapasitas adsorpsi (Q) biosorben kulit buah kakao
modifikasi basa pada penentuan waktu optimum adsorpsi biru
metilena.
t (menit ke-) A [Biru Metilena] (ppm)Efektivitas
(%) Q (μg Biru metilena/ g biosorben) 0 0.0872 0.3935 90.16 180.2348 15 0.0747 0.3459 91.35 182.6319 30 0.0549 0.2806 92.98 185.8956 45 0.1046 0.4596 88.51 176.9846 60 0.0969 0.4303 89.24 178.4672 75 0.1035 0.4554 88.62 177.2123 90 0.1079 0.4721 88.19 176.306820
Contoh Perhitungan: efektivitas (%) 100 %
0 0 x C C C − a = = 100 % 0000 . 4 7178 . 0 0000 . 4 x − = 82.05 % Q = m C C V ( 0− a) = g ml 0005 . 1 ) 7178 . 0 0000 . 4 ( 50 −
= 164.0279 μg biru metilena/g biosorben
Lampiran 8 Pengaruh bobot biosorben tanpa modifikasi pada efektivitas adsorpsi
biru metilena dan kapasitas adsorpsi.
Bobot (g) A [Biru Metilena]
(ppm) Efektivitas (%) Q (μg Biru metilena/ g biosorben) 1.0089 0.0545 0.2693 93.32 191.3549 1.5031 0.1215 0.5237 86.91 231.2754 2.0046 0.0268 0.1641 95.89 370.3736 2.5033 0.1035 0.4554 88.62 141.5971 3.0003 0.1307 0.5587 86.03 114.6985
Keterangan: Bobot optimum biosorben tanpa modifikasi
Lampiran 9 Pengaruh bobot biosorben modifikasi asam terimpregnasi basa pada
efektivitas adsorpsi biru metilena dan kapasitas adsorpsi.
Bobot (g) A [Biru Metilena] Efektivitas (%)
Q (μg Biru metilena/ g biosorben) 1.0029 0.0915 0.4098 89.76 357.9818 1.5000 0.1487 0.6270 84.32 224.8667 2.0046 0.2175 0.8883 77.79 155.2744 2.5071 0.2048 0.8401 78.99 126.0380 3.0054 0.2692 1.0847 72.88 97.0021
Keterangan: Bobot optimum biosorben modifikasi asam terimpregnasi basa
Lampiran 10 Pengaruh bobot biosorben modifikasi basa pada efektivitas biru
metilena dan kapasitas adsorpsi.
Bobot (g) A [Biru Metilena]
(ppm) Efektivitas (%) Q (μg Biru metilena/ g biosorben) 1.0035 0.1475 0.6225 84.44 179.4345 1.5011 0.1284 0.5499 86.25 229.8381 2.0053 0.0894 0.4018 89.96 336.5719 2.5009 0.1296 0.5545 86.14 137.7704 3.0016 0.1427 0.6043 84.89 113.1297