PELINDIAN BIJIH LATERIT DENGAN ASAM KLORIDA
PRATAMA ARINALDO
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PELINDIAN BIJIH LATERIT DENGAN ASAM KLORIDA
Skripsi
Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
PRATAMA ARINALDO 1110096000059
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH HASIL KARYA SAYA SENDIRI DAN BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, Juni 2016
Pratama Arinaldo NIM: 1110096000059
v
KATA PENGANTAR
Assalamu’alaikum Warahmatullahi Wabarakatuh,
Alhamdulillahirabbil ‘alamin, segala puji dan syukur kepada Allah SWT, Tuhan Pemilik Alam Semesta karena atas nikmat dan rizkinya penulis dapat menyelesaikan penelitian dengan judul Pelindian Bijih Laterit dengan Asam Klorida.
Shalawat serta salam selalu tercurahkan kepada Baginda Rasulullah SAW yang telah membimbing kita dari jalan yang gelap menuju jalan yang terang benderang dengan syariat Islamnya. Penulis sadar bahwa skripsi ini masih jauh dari kata sempurna dan tidak pernah lepas dari bantuan berbagai pihak dalam menyelesaikannya. Maka dari itu, penulis ingin mengucapkan terima kasih kepada:
1. Dr. Solihin, M.Eng selaku pembimbing I yang telah memberikan segala pengetahuan, bimbingan, serta arahan selama penulisan skripsi.
2. Nanda Saridewi, M.Si selaku pembimbing II yang telah memberikan bimbingan dalam penulisan skripsi.
3. Nurhasni, M.Si dan Dr. Sri Yadial Chalid, M.Si selaku penguji I dan penguji II yang memberikan saran serta masukan.
4. Drs. Dede Sukandar, M.Si selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
5. Dr. Agus Salim, M.Si selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
vi
6. Kedua orangtua dan adikku Adityawarman Wibisono yang selalu memberikan kehangatan serta kasih sayang, motivasi, dukungan serta doa yang tak pernah putus sehingga penulis dapat menyelesaikan penelitian.
7. Bu Eki, Bu Nita, Pak Endro, Pak Atet, Pak Fuad, Mas Angga dan seluruh jajaran peneliti, staf dan karyawan Pusat Penelitian Geoteknologi LIPI Bandung yang telah memberikan kesempatan dan fasilitas kepada penulis untuk melaksanakan penelitian.
8. Teman-teman penelitian Aulia, Dani dan Irwan yang selalu memberikan bantuan dan semangat selama melakukan penelitian.
9. Teman-teman Polideka Kimia UIN Jakarta yang telah memberikan dukungan serta motivasi.
Akhir kata, penulis menyadari dalam penyusunan skripsi ini tidak lepas dari kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun demi perbaikan dan penyempurnaan di kemudian hari.
Wassalamu’alaikum Warahmatullahi Wabarakatuh,
Jakarta, Mei 2016
ABSTRAK
Pratama Arinaldo. Pelindian Bijih Laterit dengan Asam Klorida. Dibawah bimbingan Solihin dan Nanda Saridewi.
Pelindian bijih laterit dengan asam klorida telah dilakukan. Penelitian ini dilakukan untuk menentukan suhu dan konsentrasi HCl optimum pelindian bijih laterit dari Sulawesi Tenggara serta kinetika pelindian yang bertujuan untuk mengetahui nilai energi aktivasi dan model pelindian yang terjadi. Pelindian dilakukan dengan variasi suhu 30, 50, 70 dan 90 °C, serta variasi konsentrasi asam klorida 1,7; 2,4; 4; dan 6 M. Pelindian untuk kinetika reaksi dilakukan dengan variasi suhu 30, 50, 70 dan 90 °C, konsentrasi asam klorida 4 M serta variasi waktu 3, 5, 10, 20, 30, 60, 120 dan 240 menit. Residu pelindian dikarakterisasi dengan XRD dan XRF, sedangkan filtrat dianalisis dengan AAS. Hasil karakterisasi XRD dan XRF menunjukkan bahwa kadar besi dalam bijih laterit dapat terekstrak dengan baik pada suhu pelindian 90 °C dan konsentrasi asam klorida 4 M. Diperoleh nilai energi aktivasi sebesar 6,88 kJ mol-1 serta model
shrinking-core berupa diffusion through product layer.
ABSTRACT
Pratama Arinaldo. Laterite Ore Leaching by Hydrochloric Acid. Supervised by Solihin and Nanda Saridewi.
Leaching laterite ore by hydrochloric acid has been done. This research was conducted to determine the optimum condition of temperature and hydrochloric acid concentration for leaching laterite ore from Southeast Sulawesi and also leaching kinetic to find out energy activation value from the conducted leaching and the leaching model. Leaching was conducted by variation of temperature variation at 30, 50, 70 and 90 °C, and hydrochloric acid concentration variation at 1,7; 2,4; 4; and 6 M. Leaching for reaction kinetic was conducted by variation of temperature at 30, 50, 70 and 90 °C, hydrochloric acid concentration was 4 M also time variation at 3, 5, 10, 20, 30, 60, 120 and 240 minutes. Residues of this leaching were characterized by XRD and XRF, while the filtrate were analyzed by AAS. Characterization with XRD and XRF indicate that the iron content of laterite ore was well extracted with leaching temperature of 90 °C and hydrochloric acid concentration was 4 M. Energy activation value obtained at 6,88 kJ mol-1 and the shrinking-core model was diffusion through product layer. Keywords: leaching, laterite, kinetic, shrinking-core model
ix
DAFTAR ISI
Halaman KATA PENGANTAR ··· v DAFTAR ISI ··· ix DAFTAR GAMBAR ··· xiDAFTAR TABEL ··· xiii
DAFTAR LAMPIRAN ··· xiv
BAB I PENDAHULUAN ··· 1 1.1. Latar belakang ··· 1 1.2. Rumusan masalah ··· 3 1.3. Hipotesis penelitian ··· 3 1.4. Tujuan penelitian ··· 3 1.5. Manfaat penelitian ··· 4
BAB II TINJAUAN PUSTAKA ··· 5
2.1. Senyawa besi ··· 5
2.2. Bijih laterit ··· 5
2.3. Pelindian ··· 7
2.4. Kinetika kimia ··· 9
2.5. Model shrinking core ··· 11
2.6. X-Ray diffraction (XRD) ··· 14
2.7. X-Ray fluorescence (XRF) ··· 16
2.8. Atomic absorption spectrophotometer (AAS) ··· 17
x
3.1. Waktu dan tempat penelitian ··· 21
3.2. Alat dan bahan ··· 21
3.2.1. Alat ··· 21
3.2.2. Bahan ··· 21
3.3. Prosedur kerja ··· 21
3.3.1. Pelindian dengan variasi suhu ··· 21
3.3.2. Pelindian dengan variasi konsentrasi HCl ··· 22
3.3.3. Kinetika pelindian ··· 22
3.3.4. Tahap karakterisasi akhir ··· 22
BAB IV HASIL DAN PEMBAHASAN ··· 24
4.1. Karakterisasi bijih laterit ··· 24
4.2. Pengaruh suhu ··· 25
4.3. Pengaruh konsentrasi ··· 28
4.4. Kinetika pelindian ··· 30
BAB V KESIMPULAN DAN SARAN ··· 37
5.1. Kesimpulan ··· 37
5.2. Saran ··· 37
DAFTAR PUSTAKA ··· 38
xi
DAFTAR GAMBAR
Halaman
Gambar 1. Profil laterit pada daerah tropis...7
Gambar 2. Perubahan yang terjadi ketika padatan mengalami reaksi ...10
Gambar 3. Model shrinking-core ...12
Gambar 4. Konsentrasi reaktan dan produk pada model shrinking core ...14
Gambar 5. Instrumentasi XRD ...15
Gambar 6. Instrumentasi XRF ...17
Gambar 7. Skema kerja instrumentasi AAS ...19
Gambar 8. Pola difraksi sinar-X bijih laterit sebelum pelindian ...24
Gambar 9. Pola difraksi sinar-X pelindian bijih laterit dengan variasi suhu ...26
Gambar 10. Hasil analisis residu hasil pelindian variasi suhu dengan XRF ...27
Gambar 11. Pola difraksi sinar-X pelindian bijih laterit dengan variasi konsentrasi HCl ...28
Gambar 12. Hasil analisis residu pelindian variasi konsentrasi HCl dengan XRF...30
Gambar 13. Grafik pengaruh ln k1 terhadap suhu resiprokal ...35
Gambar 14. Grafik pengaruh ln k2 terhadap suhu resiprokal ...36
Gambar 15. Pola difraksi sinar-X bijih laterit sebelum pelindian ...48
Gambar 16. Pola difraksi sinar-X pelindian bijih laterit suhu 30 °C ...49
Gambar 17. Pola difraksi sinar-X pelindian bijih laterit suhu 50 °C ...49
Gambar 18. Pola difraksi sinar-X pelindian bijih laterit suhu 70 °C ...50
Gambar 19. Pola difraksi sinar-X pelindian bijih laterit suhu 90 °C ...50
Gambar 20. Pola difraksi sinar-X pelindian bijih laterit konsentrasi HCl 6 M ...51
xii
Gambar 21. Pola difraksi sinar-X pelindian bijih laterit konsentrasi
HCl 4 M ...51 Gambar 22. Pola difraksi sinar-X pelindian bijih laterit konsentrasi
HCl 2.4 M ...52 Gambar 23. Pola difraksi sinar-X pelindian bijih laterit konsentrasi
xiii
DAFTAR TABEL
Halaman Tabel 1. Variasi pelindian bijih laterit ...23 Tabel 2. Hasil analisis komposisi kimia dengan XRF bijih laterit ...25 Tabel 3. Persentase senyawa hasil pelindian dengan variasi suhu ...27 Tabel 4. Persentase senyawa hasil pelindian dengan variasi konsentrasi
HCl ...29 Tabel 5. Fraksi mol besi terekstrak selama pelindian...31 Tabel 6. Nilai model kinetika chemical reaction controlled terhadap
waktu pelindian ...32 Tabel 7. Nilai model kinetika diffusion reaction controlled terhadap
waktu pelindian ...33 Tabel 8. Nilai konstanta terhadap suhu resiprokal ...33 Tabel 9. Nilai ln k terhadap suhu resiprokal...34 Tabel 10. Konsentrasi besi dalam filtrat hasil pelindian dengan variasi
waktu ...43 Tabel 11. Fraksi mol besi dalam filtrat hasil pelindian dengan variasi
waktu ...44 Tabel 12. Nilai model shrinking core filtrat hasil pelindian variasi
waktu ...46 Tabel 13. Persen Ekstraksi besi filtrat hasil pelindian bijih laterit ...48
xiv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Bagan alir proses penelitian ...41 Lampiran 2. Perhitungan dalam proses pelindian ...42 Lampiran 3. Pola difraksi sinar-X bijih laterit beserta residu hasil pelindian ...48 Lampiran 4. Hasil analisis komposisi kimia bijih laterit ...53 Lampiran 5. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan
suhu 30 °C ...54 Lampiran 6. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan
suhu 50 °C ...55 Lampiran 7. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan
suhu 70 °C ...56 Lampiran 8. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan
suhu 90 °C ...57 Lampiran 9. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan
konsentrasi HCl 6 M ...58 Lampiran 10. Hasil analisis komposisi kimia bijih laterit setelah pelindian
dengan konsentrasi HCl 4 M ...59 Lampiran 11. Hasil analisis komposisi kimia bijih laterit setelah pelindian
dengan konsentrasi HCl 2.4 M ...60 Lampiran 12. Hasil analisis komposisi kimia bijih laterit setelah pelindian
1
BAB I
PENDAHULUAN
1.1. Latar Belakang
Besi merupakan salah satu logam yang digunakan dalam industri material. Keberadaan besi di Indonesia cukup melimpah, dimana besi biasanya diperoleh dalam bentuk bijih laterit. Endapan besi yang ditemukan di Indonesia umumnya terdiri dari tiga jenis endapan yaitu bijih laterit, besi primer dan pasir besi (Ishlah, 2009). Besi laterit di Indonesia memiliki jumlah yang melimpah yaitu mencapai 1 miliar ton, namun dalam besi laterit ini terdapat karbonat, silikat, besi, hematit dan magnetit sehingga kadar besinya rendah (40-60 %) (Sutisna, 2007). Salah satu cadangan bijih laterit terbesar berada di Sulawesi Tenggara. Menurut data dari Badan Geologi per akhir 2014, sumber daya bijih besi Indonesia sebesar 2.797.984.832 ton dan cadangan sebesar 1.677.631.061 ton. Sumber daya tersebut tersebar di seluruh wilayah Indonesia, dimana jumlah terbesar terdapat di Propinsi Kalimantan Barat dengan total sumber daya sebesar 1.133.254.428 ton disusul dengan Sulawesi Tenggara sebesar 26.304.000 ton (Kementerian ESDM, 2015).
Eksplorasi yang dilakukan di Indonesia terhadap sumber daya besi masih tergolong rendah dan hingga saat ini belum terdapat pertambangan besi yang memasuki tahap studi kelayakan. Industri baja seperti PT Krakatau Steel, BHP Steel dan Gunung Steel sangat bergantung pada bahan impor. Krakatau Steel memerlukan 4,5 ton bijih besi magnetit per tahun yang diimpor dari Brazil dan Swedia, dan 8 juta ton besi spon dan scrap per tahun (Ishlah, 2009).
2
Berdasarkan data dari Kementerian Perindustrian, sebanyak 3.87 juta ton bijih besi primer diimpor dari Venezuela dan Abu Dhabi untuk memenuhi kebutuhan bijih besi sektor industri domestik pada tahun 2014 (Kementerian ESDM, 2015).
Pemerintah melalui UU No. 4 Tahun 2009 tentang Minerba dan PP No. 23 tahun 2010 tentang pelaksanaan Kegiatan Usaha Pertambangan Mineral dan Batubara telah mewajibkan bagi semua perusahaan tambang untuk membangun smelter/sistem pengolahan produknya di dalam negeri. Hal ini bertujuan agar tidak ada lagi penjualan atau ekspor dalam bentuk raw material (Wikarya, 2012).
Besi dari bijih laterit dapat diekstrak dengan cara pirometalurgi dan hidrometalurgi. Hidrometalurgi adalah metode ekstraksi logam dari bijih dengan menggunakan cairan atau pelarut. Hidrometalurgi terdiri dari
atmospheric leaching (AL) dan high pressure acid leaching (HPAL) (Köse,
2011). Proses pirometalurgi melibatkan temperatur tinggi saat proses ekstraksi logam seperti pengeringan, kalsinasi, pemanggangan (roasting) atau reduksi, peleburan. Havlik (2008), menyatakan bahwa hidrometalurgi lebih ekonomis dibandingkan dengan pirometalurgi. Hidrometalurgi lebih ramah lingkungan dibandingkan dengan pirometalurgi dikarenakan lebih sedikit menghasilkan cemaran. Rodrigues (2013) mengungkapkan bahwa pirometalurgi membutuhkan instrumen dengan konsumsi energi dan biaya perawatan yang lebih mahal. Pada penelitian ini digunakan proses hidrometalurgi dengan jenis
Atmospheric Leaching (AL), agar proses ekstraksi logam dengan cara
3
Proses pelindian dipengaruhi oleh jenis pelarut. Pelarut yang biasa digunakan untuk proses pelindian antara lain adalah asam sulfat (H2SO4) dan asam klorida (HCl). Besi dapat diekstrak lebih banyak dengan HCl dibandingkan dengan HNO3 dan H2SO4 (Baba, 2011), oleh karena itu dilakukan penelitian tentang pelindian terhadap bijih laterit dengan HCl, sehingga diharapkan dapat diperoleh suhu dan konsentrasi HCl optimum untuk mengekstrak besi dari bijih laterit.
1.2. Rumusan Masalah
1. Kondisi optimum pelindian bijih laterit pada konsentrasi HCl dan suhu pelindian yang bervariasi belum diketahui.
2. Kinetika reaksi pelindian besi dari bijih laterit dalam media HCl belum diketahui.
1.3. Hipotesis Penelitian
1. Kondisi optimum pelindian bijih laterit diperoleh saat konsentrasi HCl serta suhu pelindian tinggi.
2. Kinetika reaksi pelindian besi dari bijih laterit tidak dipengaruhi oleh adanya unsur-unsur lain yang terlarut dari bijih laterit.
1.4. Tujuan Penelitian
1. Mengetahui kondisi optimum pelindian besi dari bijih laterit.
4
1.5. Manfaat Penelitian
Data yang diperoleh dari penelitian ini diharapkan dapat digunakan sebagai acuan untuk mengembangkan industri pengolahan bijih laterit dalam negeri.
5
BAB II
TINJAUAN PUSTAKA
2.1. Senyawa Besi
Besi (Fe) merupakan unsur dengan kelimpahan terbanyak keempat di lapisan bumi. Besi yang terdapat di alam pada dasarnya adalah campuran dengan unsur logam lain (Cu, Zn, Ni dan Co) yang bervariasi dalam Contohnya seperti
chalcopyrite (CuFeS2), bornite (Cu6FeS4) untuk tembaga dan pentlandite ((Fe,Ni)9S8) untuk nikel (Ferron, 2006). Cardarelli (2008) menyatakan bahwa besi pada umumnya terbagi atas oksida antara lain,
a. Hematite (Fe2O3, rhombohedral dengan 70 % berat Fe) b. Magnetite (Fe3O4, kubik dengan 72,4 % berat Fe)
c. Limonite (Fe2O3.H2O, orthorhombic dengan 63 % berat Fe) d. Siderite (FeCO3, rhombohedral dengan 48,2 % berat Fe) e. Pyrite (FeS2, kubik dengan 47 % berat Fe)
f. Marcasite (FeS2, orthorhombic dengan 47 % berat Fe)
2.2. Bijih Laterit
Bijih laterit merupakan tanah merah yang dihasilkan dari pelapukan batuan asal (induk) di daerah tropis atau sub tropis. Laterit kaya akan kaolinite, goethite, dan kwarsa, sehingga komposisi dari laterit sangat kompleks. Secara kimia, laterit dicirikan oleh adanya besi, nikel dan silika sebagai sisa-sisa proses pelapukan batuan induk (Firdiyono et al, 1983).
6
Evans (1989) menyatakan bahwa kebanyakan laterit terbentuk dari batuan yang kaya akan besi seperti hematite dan goethite yang berwarna merah, kuning atau coklat. Laterit terdapat di wilayah beriklim tropis dan subtropis yang memiliki suhu tinggi dan curah hujan yang cukup, seperti di Brasil, Filipina, India, Afrika Selatan, Amerika Serikat dan Indonesia (Sulawesi Tenggara) serta beberapa wilayah lain yang memiliki iklim tropis dan subtropis (Sari, 2013).
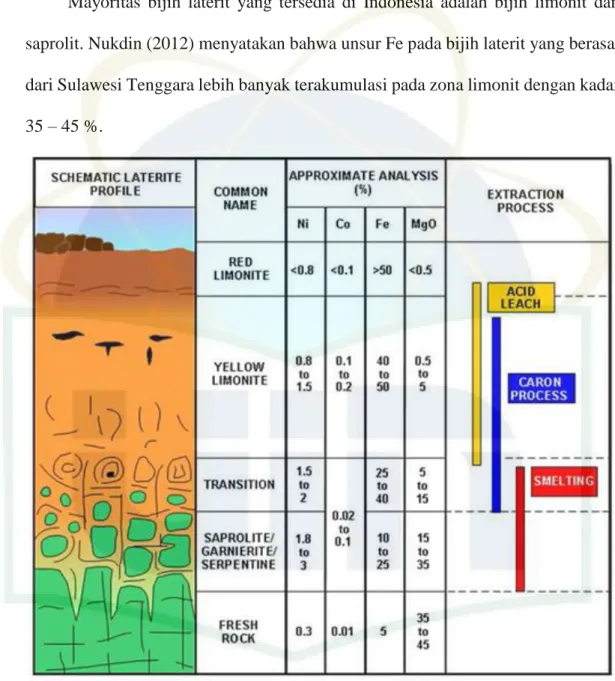
Secara umum, profil endapan laterit ditampilkan pada Gambar 1 atau dapat dijabarkan sebagai berikut (Elias, 2002):
a. Limonite Zone
Pada daerah ini umumnya endapan berwarna merah hingga merah kecoklatan, kaya akan besi yang jumlahnya kurang lebih 20-50 %. Umumnya mengandung mineral hematite dan goethite. Limonite zone memiliki struktur yang sangat halus (clay). Pada daerah ini juga terdapat bagian transisi yang merupakan peralihan antara daerah limonit dan daerah saprolit yang umumnya berwarna merah.
b. Saprolite Zone
Daerah ini umumnya berwarna abu-abu hingga hijau kecoklatan. mengandung mineral serpentin dan olivin. Daerah ini memiliki kandungan Ni diatas 2%. Batuan pada saprolite zone berukuran halus hingga boulder (besar). Boulder ini biasanya merupakan bagian dari proses pelapukan batuan induk yang belum sempurna.
c. Bedrock Zone
Daerah ini merupakan bagian terbawah dari profil laterit. Bedrock Zone tidak dapat ditambang, karena daerah ini merupakan batuan dasar yang tidak
7
ekonomis. Berbeda dengan bijih di lapisan atas, bedrock zone memiliki kadar nikel dan besi yang rendah.
Mayoritas bijih laterit yang tersedia di Indonesia adalah bijih limonit dan saprolit. Nukdin (2012) menyatakan bahwa unsur Fe pada bijih laterit yang berasal dari Sulawesi Tenggara lebih banyak terakumulasi pada zona limonit dengan kadar 35 – 45 %.
Gambar 1. Profil laterit pada daerah tropis (Elias, 2002)
2.3. Pelindian
Hidrometalurgi merupakan proses ekstraksi yang melibatkan proses pelarutan logam dalam padatan ke dalam suatu larutan dan kemudian dilanjutkan dengan
8
presipitasi atau isolasi logam yang dibutuhkan (Moore, 1990). Beberapa proses dalam hidrometalurgi yang biasa digunakan untuk mengekstraksi logam adalah presipitasi, membran cair, pertukaran ion, serta proses ekstraksi padat-cair dan ekstraksi cair-cair.
Pelindian atau leaching merupakan ekstraksi mineral dari padatan dengan media cair. Proses ini terdiri dari tiga tahap. Pertama, perubahan fase dari padatan yang dilarutkan dalam pelarut untuk proses pelindian. Kedua, difusi dari pelarut pada pori-pori padatan menuju lapisan terluar partikel. Ketiga, perpindahan produk dari pelarut yang terkena partikel menuju bagian luar pelarut atau menuju luar padatan (Coulson et al, 2002).
Banyak faktor yang mempengaruhi laju proses pelindian (Kumar, 2003) antara lain,
1. Laju pelindian meningkat dengan berkurangnya ukuran bijih yang dilarutkan, karena semakin kecil partikel maka luas permukaan per unit berat semakin besar.
2. Laju pelindian meningkat dengan meningkatnya temperatur.
3. Laju pelindian meningkat dengan meningkatnya konsentrasi dari zat
leaching.
4. Laju pelindian meningkat dengan berkurangnya massa jenis pulp (campuran bijih dengan air).
5. Jika terbentuk suatu produk yang tidak dapat larut selama pelindian, maka lajunya akan dipengaruhi oleh sifat dari produk itu sendiri. Jika terbentuk lapisan yang nonporous, maka laju pelindian akan menurun drastis.
9
Tetapi jika produk padatan yang terbentuk adalah porous, maka produk tersebut tidak mempengaruhi laju pelindian.
2.4. Kinetika Kimia
Kinetika kimia merupakan studi untuk menganalisis seberapa cepat sebuah reaksi berjalan (Berry et al, 2000). Faktor penting yang mempengaruhi suatu reaksi kimia adalah suhu, tekanan, serta konsentrasi dari unsur atau senyawa kimia yang sedang bereaksi. Katalis dan inhibitor juga dapat mempengaruhi kinetika reaksi kimia. Segala reaksi kimia biasa muncul sebagai berikut,
pA + qB rC + sD (1)
Di mana A, B, C, D adalah unsur atau senyawa dalam reaksi dan p, q, r, s adalah koefisien dari unsur atau senyawa yang bereaksi. Secara umum, laju dalam perubahan konsentrasi terhadap waktu dinyatakan sebagai berikut,
𝑙𝑎𝑗𝑢 = [𝑝𝑟𝑜𝑑𝑢𝑘]
𝑑𝑡 (2)
Satuan laju reaksi ini dinyatakan dalam mol dm-1 s-1 atau M-1 s-1 yang juga menyatakan perubahan konsentrasi tiap detik.
Jika reaksi kimia yang terjadi misalkan,
A + B C
Maka rumus laju reaksi dapat dinyatakan sebagai berikut,
𝑣 =
∆𝑀𝑡 (3)
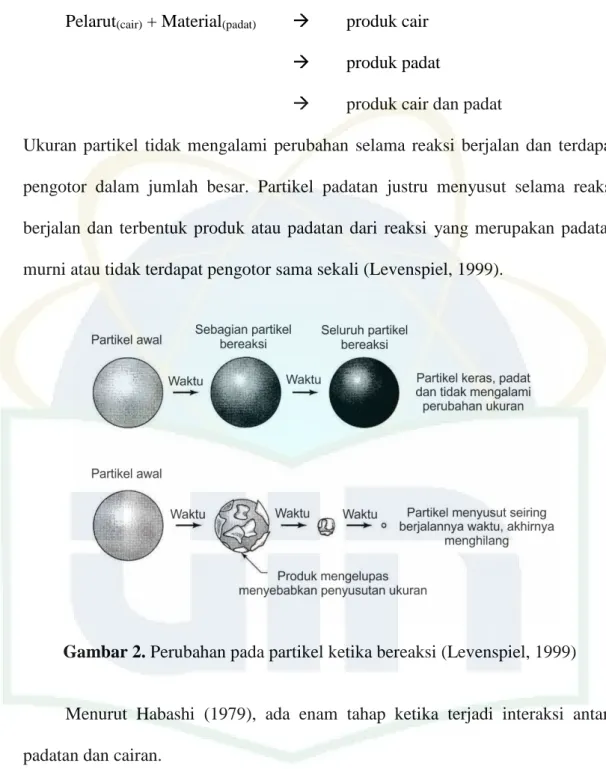
Pada proses pelindian, terjadi reaksi heterogen antara pelarut dan material padat. Hasil reaksi dari kedua benda tersebut antara lain dalam bentuk cair, padatan, ataupun berupa cairan dan padatan.
10
Pelarut(cair) + Material(padat) produk cair
produk padat
produk cair dan padat
Ukuran partikel tidak mengalami perubahan selama reaksi berjalan dan terdapat pengotor dalam jumlah besar. Partikel padatan justru menyusut selama reaksi berjalan dan terbentuk produk atau padatan dari reaksi yang merupakan padatan murni atau tidak terdapat pengotor sama sekali (Levenspiel, 1999).
Gambar 2. Perubahan pada partikel ketika bereaksi (Levenspiel, 1999)
Menurut Habashi (1979), ada enam tahap ketika terjadi interaksi antara padatan dan cairan.
1. Difusi reaktan dari larutan atau reaktan itu sendiri menuju lapisan terluar dari partikel yang mengalami pelindian.
2. Adsorpsi reaktan pada permukaan partikel.
3. Reaksi kimia dari reaktan yang teradsorpsi menuju produk yang teradsorpsi.
11
5. Difusi produk dari lapisan dalam menuju lapisan terluar partikel. 6. Difusi produk dari permukaan partikel menuju reaktan.
Laju reaksi sangat ditentukan oleh suhu atau temperatur. Pada suhu kamar, nilai konstanta meningkat dua atau tiga kali lipat setiap kenaikan 10 °C (Levine, 2009). Pada tahun 1889, kimiawan Swedia bernama Arrhenius menemukan sebuah rumus yang dipakai untuk memasukkan data reaksi kimia dalam jumlah yang banyak ke dalam satu persamaan.
𝑘 = 𝐴 𝑒−𝐸𝑎⁄𝑅𝑇 (4)
Dimana k adalah konstanta, R adalah konstanta gas, Ea adalah energi aktivasi dari reaksi yang berjalan, dan A adalah tetapan Arrhenius. Energi aktivasi menggunakan satuan kJ/mol atau kkal/mol.
Persamaan Arrhenius mencakup hampir semua reaksi homogen. Secara sederhana, dua molekul yang saling bertubrukan memerlukan energi kinetik tertentu untuk memecah ikatan kimia dari molekul tersebut dan membentuk molekul baru.
Apabila dari suatu reaksi terdapat energi aktivasi yang rendah, maka reaksi tersebut berjalan dengan cepat. Begitu juga sebaliknya, apabila suatu reaksi memiliki energi aktivasi tinggi, maka reaksi tersebut berjalan lambat.
2.5. Model Shrinking-Core
Reaksi antara zat padat dan zat cair pada proses pelindian menyebabkan terjadinya perubahan ukuran pada inti partikel padatan yang bereaksi. Model ini dikembangkan oleh Yagi dan Kunii pada tahun 1955 dan 1961 (Levenspiel, 1999).
12
Levenspiel menyatakan bahwa, terdapat reaksi antara reaktan dengan lapisan dari produk yang dihasilkan yang disebut “debu” atau lapisan inert.
Dari Gambar 3 dapat dilihat, reaksi berjalan dari lapisan partikel paling luar. Reaksi berlanjut ke lapisan dalam partikel dan menghasilkan lapisan luar yang keras dan inert. Lapisan luar yang mengeras ini disebut sebagai “debu”. Pada model ini, cairan atau reaktan dianggap sebagai gas.
Gambar 3. Model shrinking-core (Levenspiel, 1999)
Dari proses penyusutan ukuran partikel (shrinkage proses) terdapat hubungan antara fraksi mol dari partikel padatan yang bereaksi (α) dengan lama reaksi atau waktu pelindian (t). Menurut Szubert (2006), jika reaksi dikontrol oleh difusi reaktan melalui lapisan yang menyelubungi partikel, maka:
𝑡𝑓 𝑡𝑓∗ = 1 − ( 𝑟𝑐 𝑅) 3 = 𝛼 (5)
di mana 𝑡𝑓∗ adalah waktu yang diperlukan partikel untuk bereaksi seluruhnya, 𝑟𝑐 adalah inti partikel yang tidak bereaksi selama pelindian, dan 𝑅 adalah radius awal
13
partikel atau jarak dari pusat partikel ke sekelilingnya. Jika reaksi dikontrol oleh difusi lapisan produk (difusi lapisan inert), maka:
𝑡𝑎 𝑡𝑎∗ = 1 − 3 ( 𝑟𝑐 𝑅) 2 + 2 (𝑟𝑐 𝑅) 3 = 1 − 3(1 − 𝛼)2⁄3+ 2(1 − 𝛼) (6)
di mana, sama dengan persamaan (1), 𝑡𝑎∗ adalah waktu yang diperlukan partikel untuk bereaksi seluruhnya. Ketika proses dikontrol oleh reaksi kimia, maka:
𝑡𝑟 𝑡𝑟∗= 1 − ( 𝑟𝑐 𝑅) = 1 − (1 − 𝛼) 1 3 ⁄ (7)
Persamaan (1) dan persamaan (2) biasa digunakan sebagai persamaan model kinetika seperti yang dilakukan Alafara et al (2009) untuk memperoleh model kinetika yang sesuai dengan penelitian yang dilakukan. Kedua persamaan ini masing-masing dapat disederhanakan menjadi persamaan berikut,
1 − (1 − 𝛼)1⁄3 = 𝑘1𝑡 (8) untuk kontrol proses secara kimiawi dan,
1 + 2(1 − 𝛼) − 3(1 − 𝛼)2⁄3 = 𝑘2𝑡 (9)
Untuk kontrol proses secara difusi. Persamaan (1) dan (4) serta persamaan (2) dan (3) adalah sama. Hanya terdapat 𝑘1 yang merupakan konstanta laju kontrol proses kimia dan 𝑘2 merupakan konstanta laju kontrol proses difusi.
14
Gambar 4. Konsentrasi reaktan dan produk pada model shrinking core (Levenspiel, 1999)
2.6. X-Ray Diffraction (XRD)
XRD merupakan sebuah instrumen yang digunakan untuk menganalisis struktur suatu material kristalit maupun non-kristalit dengan menggunakan sinar-X. Secara umum XRD dibagi menjadi dua, yaitu single-crystal dan powder.
Single-crystal diffractometer biasa digunakan untuk menentukan struktur molekul sebuah
material. Sedangkan Powder Diffractometer biasa digunakan untuk analisis identifikasi dan kuantitatif. Sebuah XRD pada umumnya terdiri dari sumber sinar-X, goniometer, detektor, komputer untuk analisis data dan lain-lain.
Sampel berupa serbuk padatan kristalin yang memiliki ukuran 10-7 – 10-4 m ditempatkan pada suatu plat. Sinar X diperoleh dari elektron yang keluar dari filamen panas dalam keadaan vakum dan tegangan tinggi, sehingga menumbuk permukaan logam (umumnya tembaga (Cu)) dengan kecepatan tinggi. Sinar-X
15
tersebut menembak sampel padatan kristalin, kemudian mendifraksikan sinar ke segala arah dengan memenuhi Hukum Bragg. Detektor bergerak dengan kecepatan sudut yang konstan untuk mendeteksi berkas sinar-X yang terdifraksi oleh sampel. Sampel serbuk atau padatan kristalin memiliki bidang-bidang kisi yang tersusun secara acak dengan berbagai kemungkinan orientasi, begitu pula partikel-partikel kristal yang terdapat di dalamnya. Cara kerja instrumen XRD ditampilkan pada Gambar 5.
Gambar 5. Instrumentasi XRD
Setiap bidang kisi tersebut memiliki beberapa sudut orientasi tertentu, sehingga difraksi sinar-X memnuhi Hukum Bragg,
𝑛 𝜆 = 2 𝑑 sin 𝜃 (10) dengan, n = orde difraksi (1, 2, 3,....)
𝜆 = Panjang gelombang sinar-X d = Jarak kisi
𝜃 = Sudut difraksi
Hasil analisis dari difraktometer dapat berupa data analog atau digital. Rekaman data analog berupa grafik garis-garis yang terekam per menit sinkron,
16
dengan detektor dalam sudut 2𝜃 per menit, sehingga sumbu-x setara dengan sudut 2𝜃 . Sedangkan rekaman digital menginformasikan intensitas sinar-X terhadap jumlah intensitas cahaya per detik.
Pola difraktogram yang dihasilkan berupa deretan puncak-puncak difraksi dengan intensitas relatif bervariasi sepanjang nilai 2𝜃 tertentu. Besarnya intensitas relatif dari deretan puncak-puncak tersebut bergantung pada jumlah atom atau ion yang ada, serta distribusinya di dalam sel satuan material tersebut. Pola difraksi setiap padatan kristalin sangat khas, yang bergantung pada kisi kristal, unit parameter dan panjang gelombang sinar-X yang digunakan. Dengan demikian, sangat kecil kemungkinan dihasilkan pola difraksi yang sama untuk suatu padatan kristalin yang berbeda (Warren, 1969).
2.7.X-Ray Fluorescence (XRF)
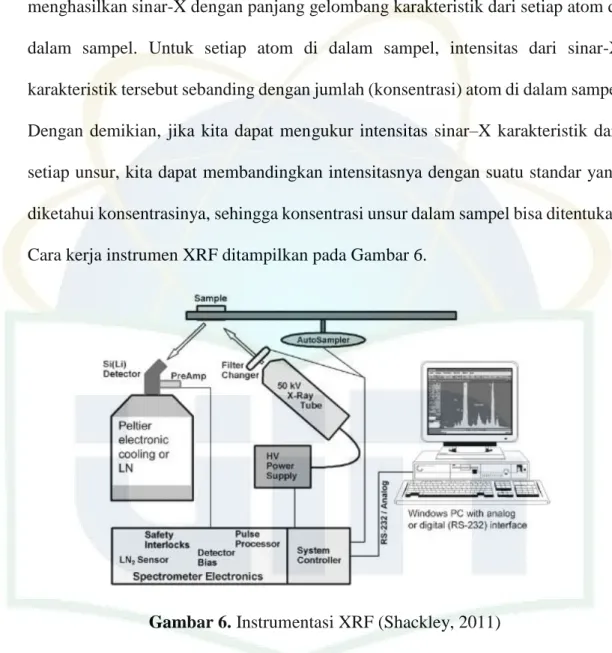
XRF merupakan spektrometri atom yang didasari oleh atom yang tereksitasi akibat pancaran radiasi sinar-X. Instrumen ini digunakan untuk mengidentifikasi suatu material berdasarkan panjang gelombang sinar-X dari elektron yang berpindah kulit saat ditembakkan dengan sinar-X. Selain mengidentifikasi suatu material, XRF juga dapat menentukan intensitas atau kadar suatu unsur dalam material yang diuji (Settle, 1997).
Pada teknik difraksi sinar-X suatu berkas elektron digunakan. Sinar-X dihasilkan dari tembakan berkas elektron terhadap suatu unsur di anoda untuk menghasilkan sinar-X dengan panjang gelombang yang diketahui. Peristiwa ini terjadi pada tabung sinar-X. Pada teknik XRF, digunakan sinar-X dari tabung pembangkit sinar-X untuk mengeluarkan elektron dari kulit bagian dalam untuk
17
menghasilkan sinar-X baru dari sampel yang dianalisis. Seperti pada tabung pembangkit sinar-X, elektron dari kulit bagian dalam suatu atom pada sampel analit menghasilkan sinar-X dengan panjang gelombang karakteristik dari setiap atom di dalam sampel. Untuk setiap atom di dalam sampel, intensitas dari sinar-X karakteristik tersebut sebanding dengan jumlah (konsentrasi) atom di dalam sampel. Dengan demikian, jika kita dapat mengukur intensitas sinar–X karakteristik dari setiap unsur, kita dapat membandingkan intensitasnya dengan suatu standar yang diketahui konsentrasinya, sehingga konsentrasi unsur dalam sampel bisa ditentukan. Cara kerja instrumen XRF ditampilkan pada Gambar 6.
Gambar 6. Instrumentasi XRF (Shackley, 2011)
2.8. Atomic Absorption Spectrophotometer (AAS)
Spektrometri merupakan suatu metode analisis kuantitatif yang pengukurannya berdasarkan radiasi yang dihasilkan atau diserap oleh spesi atom atau molekul analit. Salah satu bagian dari spektrometri adalah Atomic Absorption
18
metode analisis unsur secara kualitatif yang pengukurannya berdasarkan penyerapan cahaya dengan panjang gelombang tertentu oleh atom logam dalam keadaan bebas (Skoog et al, 2000).
Teknik ini mempunyai beberapa kelebihan dibandingkan dengan metode spektroskopi emisi konvensional. Pada metode konvensional emisi tergantung pada sumber eksitasi, bila eksitasi dilakukan secara termal maka ia akan tergantung pada temperatur sumber. Selain itu eksitasi termal tidak selalu spesifik, dan eksitasi secara serentak terjadi pada berbagai spesies dalam suatu campuran. Sedangkan dengan nyala, eksitasi unsur-unsur dengan tingkat energi eksitasi yang rendah dapat dimungkinkan, tentu saja perbandingan banyaknya atom yang tereksitasi terhadap atom yang berada pada tingkat dasar harus cukup besar, karena metode serapan atom hanya tergantung pada perbandingan ini dan tidak bergantung pada temperatur. Metode serapan sangatlah spesifik,logam-logam yang membentuk campuran kompleks dapat dianalisa dan selain itu tidak selalu diperlukan sumber energi yang besar (Khopkar, 1990).
Apabila cahaya dengan panjang gelombang tertentu dilewatkan pada suatu sel yang mengandung atom-atom bebas yang bersangkutan maka sebagian cahaya tersebut akan diserap dan intensitas penyerapan akan berbanding lurus dengan banyaknya atom bebas logam yang berada dalam sel. Hubungan antara absorbansi dengan konsentrasi diturunkan dari:
1. Hukum Lambert: Bila suatu sumber sinar monokromatik melewati medium transparan, maka intensitas sinar yang diteruskan berkurang dengan bertambahnya ketebalan medium yang mengabsorpsi.
19
2. Hukum Beer: Intensitas sinar yang diteruskan berkurang secara eksponensial dengan bertambahnya konsentrasi spesi yang menyerap sinar tersebut.
It = Io.e-(εbc) (11) atau,
A = - Log It/Io = εbc (12) Dimana : Io = Intensitas sumber sinar
It = Intensitas sinar yang diteruskan ε = Absortivitas molar
b = Panjang medium
c = Konsentrasi atom-atom yang menyerap sinar A = Absorbansi
Dari persamaan di atas, dapat disimpulkan bahwa absorbansi cahaya berbanding lurus dengan konsentrasi atom.
Pada alat SSA terdapat dua bagian utama yaitu suatu sel atom yang menghasilkan atom-atom gas bebas dalam keadaaan dasarnya dan suatu sistem optik untuk pengukuran sinyal. Skema kerja AAS secara umum ditampilkan pada Gambar 7.
Gambar 7. Skema Kerja Instrumentasi AAS
Atom dari suatu unsur pada keadaan dasar akan diberi radiasi, sehingga atom tersebut akan menyerap energi dan mengakibatkan elektron pada kulit terluar naik
20
ke tingkat energi yang lebih tinggi atau tereksitasi. Jika suatu atom diberi energi, maka energi tersebut akan mempercepat gerakan elektron sehingga elektron tersebut akan tereksitasi ke tingkat energi yang lebih tinggi dan dapat kembali ke keadaan semula. Atom-atom dari sampel akan menyerap sebagian sinar yang dipancarkan oleh sumber cahaya. Penyerapan energi oleh atom terjadi pada panjang gelombang tertentu sesuai dengan energi yang dibutuhkan oleh atom tersebut.
Sampel analisis berupa cairan dihembuskan ke dalam nyala api burner dengan bantuan gas bakar yang digabungkan bersama oksidan (bertujuan untuk menaikkan temperatur) sehingga dihasilkan kabut halus. Atom-atom keadaan dasar yang terbentuk dalam kabut dilewatkan pada sinar dan panjang gelombang yang khas. Sinar diserap sebagian, yang kemudian disebut sebagai absorbansi dan sinar yang diteruskan merupakan emisi. Penyerapan yang terjadi berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala. Pada kurva absorpsi, terukur besarnya sinar yang diserap, sedangkan pada kurva emisi, terukur intensitas sinar yang dipancarkan (Skoog et al, 2000).
21
BAB III
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan mulai dari bulan Juli 2014 - Februari 2016 di Pusat Penelitian Geoteknologi LIPI Bandung.
3.2. Alat dan Bahan 3.2.1. Alat
Alat yang digunakan adalah peralatan gelas, plastik tahan panas, kertas saring, desikator, termometer, lemari asam, neraca analitik,
hot-plate stirrer, oven, statif dan klem, botol, XRD Shimadzu XRD-7000,
XRF Thermo Niton XL3t, dan AAS Shimadzu AA-7000. 3.2.2. Bahan
Bahan yang digunakan adalah bijih laterit yang diperoleh dari daerah Sulawesi Tenggara dan sudah dihaluskan hingga ukuran 100 mesh, akuades dan HCl 37% Merck.
3.3. Prosedur Kerja
3.3.1. Pelindian dengan variasi suhu
Dibuat 4 buah larutan asam klorida dengan konsentrasi 4 M dengan volume 150 mL. Bijih laterit sebanyak 15 gram dimasukkan ke dalam masing-masing larutan HCl yang sudah dipanaskan hingga suhu 30, 50, 70 dan 90 °C. Larutan diaduk dengan magnetic stirrer 250 rpm selama 4 jam.
22
3.3.2. Pelindian dengan variasi konsentrasi HCl
Dibuat 4 larutan HCl bervolume 150 mL dengan 4 variasi konsentrasi berbeda yaitu 1,7; 2,4; 4; dan 6 M. Kemudian larutan dipanaskan hingga suhu 90 °C. Sebanyak 15 gram bijih laterit yang sudah dihaluskan dimasukkan kedalam masing-masing larutan yang sudah dipanaskan dan diaduk dengan magnetic stirrer 250 rpm selama 4 jam.
3.3.3. Kinetika pelindian
Dibuat 4 larutan HCl konsentrasi 4 M bervolume 150 mL. Kemudian keempat larutan HCl dipanaskan hingga suhunya masing-masing 30, 50, 70 dan 90 °C. Sebanyak 1 gram bijih laterit kemudian dimasukkan kedalam masing-masing larutan HCl yang sudah dipanaskan. Selama pelindian berlangsung, setiap interval waktu yang sudah ditentukan (3, 5, 10, 20, 30, 60, 120 dan 240 menit) sebanyak 2 mL filtrat pelindian diambil dan dimasukkan ke dalam tabung reaksi untuk didinginkan.
3.3.4. Tahap karakterisasi akhir
Hasil pelindian disaring, sehingga diperoleh residu beserta filtratnya. Residu pelindian terlebih dahulu dikeringkan dan kemudian dihaluskan untuk dianalisis dengan XRD dan XRF, sedangkan filtrat pelindian diencerkan untuk dianalisis dengan AAS.
Pelindian yang dilakukan diberi kode A-X-X untuk membedakan pelindian dengan variasi suhu dan pelindian dengan variasi konsentrasi HCl. Kode A-2-X digunakan untuk pelindian variasi suhu, sedangkan
23
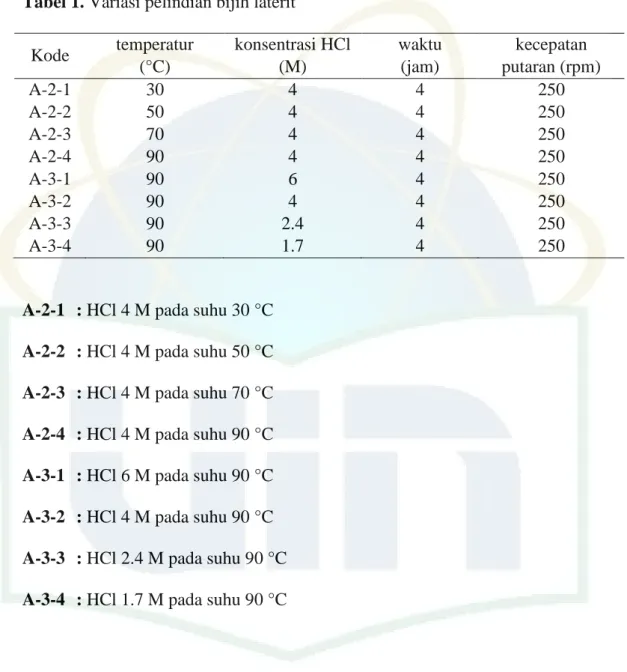
kode A-3-X digunakan untuk pelindian variasi konsentrasi HCl. Variasi pelindian bijih laterit ditunjukkan oleh Tabel 1.
Tabel 1. Variasi pelindian bijih laterit Kode temperatur (°C) konsentrasi HCl (M) waktu (jam) kecepatan putaran (rpm) A-2-1 30 4 4 250 A-2-2 50 4 4 250 A-2-3 70 4 4 250 A-2-4 90 4 4 250 A-3-1 90 6 4 250 A-3-2 90 4 4 250 A-3-3 90 2.4 4 250 A-3-4 90 1.7 4 250
A-2-1 : HCl 4 M pada suhu 30 °C A-2-2 : HCl 4 M pada suhu 50 °C A-2-3 : HCl 4 M pada suhu 70 °C A-2-4 : HCl 4 M pada suhu 90 °C A-3-1 : HCl 6 M pada suhu 90 °C A-3-2 : HCl 4 M pada suhu 90 °C A-3-3 : HCl 2.4 M pada suhu 90 °C A-3-4 : HCl 1.7 M pada suhu 90 °C
24
BAB IV
HASIL DAN PEMBAHASAN
4.1. Karakterisasi Bijih Laterit
Pola difraksi yang dihasilkan dari bijih laterit yang dikarakterisasi dengan XRD dan XRF ditampilkan pada Gambar 8. Pola difraksi tersebut dianalisis dengan menggunakan Software Match! (Demo Version 2).
Gambar 8. Pola difraksi sinar-X bijih laterit sebelum pelindian
Pola difraksi laterit yang diperlihatkan Gambar 8 mengandung senyawa besi Fe2O3 (hematite), FeOOH (goethite) (Baba et al, 2009; Putra, 2012), dan Fe3O4 (magnetite) (Maryono et al, 2014). Bijih laterit yang dianalisis sebelum pelindian juga terkandung senyawa SiO2 dan Mg3Si2O5. Sama halnya yang dinyatakan oleh Firdiyono et al (1983) bahwa selain besi, dalam laterit juga dapat ditemukan SiO2 (silika). Untuk menentukan komposisi kimia dari laterit yang digunakan dilakukan analisis XRF (Tabel 2).
25
Tabel 2. Hasil analisis komposisi kimia dengan XRF bijih laterit
Unsur Persen (%) Mo 0,003 Pb 0,004 Zn 0,039 Ni 3,297 Co 0,149 Fe 30,111 Mn 0,556 Cr 0,803 Cd 0,114 Ag 0,161 Pd 0,061 Unsur lain 64,702 Total 100
Pada hasil analisis XRF (Tabel 2) dapat disimpulkan bahwa unsur Fe adalah penyusun laterit terbesar dengan kadar sebesar 30,11 %. Sedangkan unsur Ni menjadi unsur terbesar kedua dengan kadar sebesar 3,29 %. Evans (1989) menyatakan bahwa batuan laterit kaya dengan kandungan besi, seperti senyawa
hematite dan goethite.
4.2. Pengaruh Suhu
Pola difraksi sinar-X residu hasil pelindian bijih laterit dengan variasi suhu ditampilkan pada Gambar 9.
26
Gambar 9. Pola difraksi sinar-X pelindian bijih laterit dengan variasi vuhu
Hubungan pola difraksi sinar-X bijih laterit dengan variasi suhu dinyatakan pada Gambar 9, dimana dapat disimpulkan bahwa semakin tinggi suhu pelindian, maka intensitas puncak pada residu semakin kecil. Hal ini dapat dilihat dari Gambar 9 dimana residu bijih laterit hasil pelindian didominasi senyawa SiO2 dan FeOOH, baik sebelum pelindian maupun sesudah pelindian. Kemudian setelah dilakukan pelindian dengan variasi suhu, terbentuk senyawa Fe2O3. Kumar (2003) menyatakan bahwa suhu sangat mempengaruhi kemampuan penyeleksian zat dalam suatu mineral pada proses pelindian. Laju reaksi pelindian dapat meningkat dua sampai tiga kali lipat setiap kenaikan suhu 10 oC (Levine, 2009). Selain pola difraksi sinar-X, dianalisis juga persentase senyawa besi dalam residu hasil pelindian dengan software Match! pada Tabel 3.
27
Tabel 3. Persentase senyawa hasil pelindian dengan variasi suhu
Suhu pelindian (°C) Hematite (%) Magnetite (%) Goethite (%) Quartz (%)
30 17.6 16.6 47.4 18.4
50 17.8 12.4 31.6 38.2
70 9.6 6.3 23.9 60.2
90 8.6 6.9 21.3 63.1
Persentase senyawa besi dalam residu bijih laterit hasil pelindian cenderung berkurang seiring dengan suhu pelindian yang tinggi. Ini menunjukkan bahwa besi dalam bijih laterit larut dalam filtrat hasil pelindian. Hal ini juga didukung oleh data pada Gambar 10, dimana analisis unsur besi dalam residu dilakukan dengan XRF dan diperoleh bobot yang semakin menurun seiring dengan meningkatnya suhu pelindian bijih laterit.
Gambar 10. Hasil analisis residu hasil pelindian variasi suhu dengan XRF
Suhu pelindian ditingkatkan dari 30 oC hingga 90 oC , dan bobot besi dalam residu berkurang ketika dari 4.05 menjadi 0.42 gram. Pengurangan bobot ini
4,05 1,37 0,63 0,42 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 30 50 70 90 B ob ot b esi d alam r esid u (gr am ) Suhu pelindian (°C)
28
terjadi karena besi sudah terlarut atau terekstrak ke dalam pelarut yang digunakan, sehingga besi yang berada pada residu berpindah ke filtrat. Ayanda et al (2011) menyatakan bahwa temperatur meningkatkan laju reaksi sehingga terjadi interaksi antar molekul yang lebih tinggi dan senyawa-senyawa dalam bijih laterit menjadi lebih mudah larut pada pelarut media asam. Dari pelindian yang dilakukan, diperoleh suhu 90 oC sebagai suhu optimal untuk ekstraksi bijih laterit melalui pelindian.
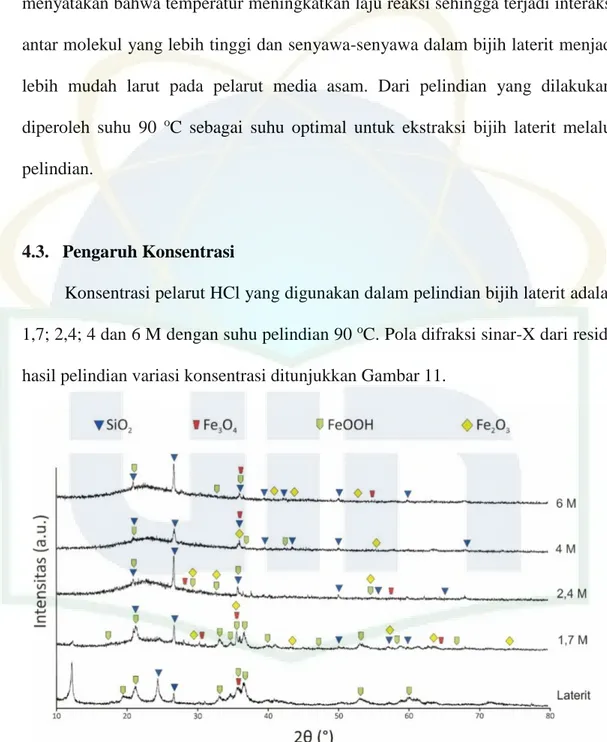
4.3. Pengaruh Konsentrasi
Konsentrasi pelarut HCl yang digunakan dalam pelindian bijih laterit adalah 1,7; 2,4; 4 dan 6 M dengan suhu pelindian 90 oC. Pola difraksi sinar-X dari residu hasil pelindian variasi konsentrasi ditunjukkan Gambar 11.
Gambar 11. Pola difraksi sinar-X pelindian bijih laterit dengan variasi konsentrasi HCl
Selain pola difraksi sinar-X, dari hasil analisa menggunakan software Match! juga diperoleh persentase senyawa besi dalam residu hasil pelindian seperti yang
29
ditampilkan pada Tabel 4. Ketika konsentrasi HCl dinaikkan hingga 6 M, persentase senyawa besi seperti hematite, magnetite, dan goethite cenderung menurun sedangkan senyawa kuarsa mengalami hal yang sebaliknya. Hal ini menunjukkan bahwa unsur Fe dalam bijih laterit larut dalam filtrat pada saat pelindian dengan konsentrasi HCl tinggi. Semakin meningkat konsentrasi pelarut yang digunakan, maka jumlah mineral yang terlarut menjadi semakin bertambah (Kumar, 2003).
Tabel 4. Persentase senyawa hasil pelindian dengan variasi konsentrasi HCl Konsentrasi HCl (M) Hematite (%) Magnetite (%) Goethite (%) Quartz (%) 1.7 17.0 7.7 47.9 27.4 2.4 7.1 4.5 22.5 65.9 4 15.9 3.4 25.6 55.0 6 7.0 7.1 23.8 62.2
Kemudian dianalisis kadar besi yang terdapat di dalam residu dengan menggunakan XRF. Bobot besi yang terdapat pada residu hasil pelindian dapat dilihat pada Gambar 12. Kenaikan konsentrasi pelarut HCl menyebabkan bobot besi dalam residu semakin menurun dari 2.09 gram (HCl 1,7 M) menjadi 0.43 gram (HCl 4 M), Tapi kemudian bobot besi dalam residu meningkat kembali menjadi 0.68 gram pada pelindian dengan konsentrasi HCl 6 M. Hal ini disebabkan oleh sebagian besi dalam bijih laterit tidak larut ke dalam filtrat atau larutan jenuh, sehingga pada konsentrasi 6 M nilai besi dalam residu menjadi tinggi kembali. Kenaikan konsentrasi meningkatkan jumlah besi yang terekstrak (Ayanda et al, 2011). Berdasarkan pelindian yang dilakukan, konsentrasi HCl 4 M menjadi konsentrasi optimal untuk melarutkan besi dalam bijih laterit.
30
Gambar 12. Hasil analisis residu pelindian variasi konsentrasi HCl dengan XRF
4.4. Kinetika Pelindian
Lamanya waktu pelindian bijih laterit dianalisis untuk mengetahui banyaknya unsur besi yang terekstrak selama proses pelindian. Terdapat empat variasi suhu berbeda yaitu 30, 50, 70 dan 90 °C. Keempat variasi suhu pelindian yang berbeda juga dilakukan dengan interval waktu dari mulai 3, 5, 10, 20, 30, 60, 120 dan 240 menit. Variasi suhu dengan interval waktu pada pelindian bijih laterit dilakukan untuk menentukan nilai energi aktivasi dari pelindian yang dilakukan. Fraksi mol besi yang terekstrak pada filtrat hasil pelindian bijih laterit dengan interval waktu pelindian ditampilkan pada Tabel 5.
Fraksi mol besi yang terekstrak dengan nilai tertinggi diperlihatkan Tabel 5 berada pada suhu 90 °C dengan waktu kontak 240 menit. Semakin tinggi suhu dan waktu kontak maka fraksi mol besi yang terekstrak semakin tinggi. Waktu kontak yang lama dan suhu yang tinggi dapat meningkatkan kadar besi yang terekstraksi
2,09 0,66 0,43 0,68 0 0,5 1 1,5 2 2,5 1,7 2,4 4 6 B ob ot b esi d alam r esid u (gr am ) Konsentrasi HCl (mol/l)
31
selama proses pelindian (Ayanda et al (2011); Baba et al (2005); Baba et al (2009); dan Baba et al (2011)).
Tabel 5. Fraksi mol besi yang terekstrak selama pelindian
Waktu Pelindian (Menit) Fraksi Mol Besi Terekstraksi (x10 -3) 30° C 50° C 70° C 90° C 3 0,73 2,49 5,72 13 5 0,92 5,96 6,95 14 10 0,96 3,98 14 21 20 1,2 6,95 16,2 16 30 1,37 7,44 15,9 18 60 2,31 12 18 30 120 3,24 16 16,3 19,3 240 6,95 18 19 19,6
Fraksi mol yang diperoleh dapat digunakan untuk menentukan kinetika reaksi. Kinetika reaksi merupakan studi untuk menentukan kecepatan suatu reaksi (Berry et al, 2000). Penghitungan kinetika dengan menggunakan model
shrinking-core dengan persamaan di bawah ini,
1 − (1 − 𝛼)1⁄3 = 𝑘1𝑡 (1) 1 + 2(1 − 𝛼) − 3(1 − 𝛼)2⁄3 = 𝑘2𝑡 (2)
Persamaan (1) dan (2) digunakan untuk menghitung perilaku pelindian. Simbol α adalah fraksi mol besi terlarut saat proses pelindian terhadap mol HCl dan t adalah lama pelindian dalam menit. Persamaan (1) menunjukkan laju pelindian dikontrol oleh reaksi kimia (chemical reaction control) sedangkan persamaan (2) menunjukkan laju pelindian dikontrol oleh difusi melalui lapisan produk (diffusion through product layer control) (Levenspiel, 1999). Data dari
32
persamaan (1) dan (2) akan dibuat ke dalam persamaan garis lurus, sehingga dapat diperoleh nilai konstanta dari keempat suhu pelindian yang dilakukan.
𝑦 = 𝑚𝑥 + 𝑐 (3)
Nilai 1 − (1 − 𝛼)1⁄3 terhadap waktu pelindian ditampilkan pada Tabel 6. Pada suhu 90 °C dan waktu pelindian 240 menit, diperoleh nilai 1 − (1 − 𝛼)1⁄3 yang tinggi dibandingkan dengan suhu pelindian dan lama waktu kontak yang rendah. Data pada Tabel 6 diperoleh hasil bahwa semakin lama kontak waktu pelarut dengan bijih laterit serta suhu pelindian yang tinggi, maka nilai 1 − (1 − 𝛼)1⁄3 yang diperoleh juga tinggi.
Tabel 6. Nilai model kinetika chemical reaction controlled terhadap waktu pelindian Waktu (Menit) 1 − (1 − 𝛼) 1 3 ⁄ x10-3 30° C 50° C 70° C 90° C 0 0 0 0 0 3 0,24 0,83 1,91 4,35 5 0,3 1,99 2,32 4,69 10 0,32 1,33 4,69 7,05 20 0,39 2,32 5,43 5,36 30 0,46 2,49 5,33 6,04 60 0,77 4,02 6,04 10,1 120 1,08 5,36 5,46 6,47 240 2,32 6,04 6,37 6,58
Kemudian fraksi mol besi terekstrak dimasukkan ke dalam persamaan 2, dan nilai 1 + 2(1 − 𝛼) − 3(1 − 𝛼)2⁄3 terhadap waktu pelindian ditunjukkan Tabel 6. Nilai persamaan 1 + 2(1 − 𝛼) − 3(1 − 𝛼)2⁄3 tinggi diperoleh pada suhu pelindian 90 °C serta waktu pelindian 240 menit. Dari Tabel 7 dapat dilihat bahwa,
33
waktu kontak bijih laterit yang lama serta suhu pelindian tinggi menghasilkan nilai 1 + 2(1 − 𝛼) − 3(1 − 𝛼)2⁄3 yang tinggi (Ayanda et al, 2011).
Tabel 7. Nilai model kinetika diffusion reaction controlled terhadap waktu pelindian Waktu (Menit) 1 + 2(1 − 𝛼) − 3(1 − 𝛼) 2 3 ⁄ x 10-6 30° C 50° C 70° C 90° C 0 0 0 0 0 3 0,18 2,07 10,93 56,66 5 0,28 11,87 16,15 65,74 10 0,31 5,29 65,74 148,39 20 0,47 16,15 88,11 85,94 30 0,63 18,51 84,87 108,87 60 1,78 48,26 108,87 304,07 120 3,5 85,94 89,21 125,24 240 16,15 108,87 121,36 129,18
Tabel 6 dan Tabel 7 memperlihatkan bahwa nilai persamaan (1) dan persamaan (2) semakin meningkat. Data pada Tabel 6 dan Tabel 7 kemudian dihitung nilai konstantanya, sehingga dapat digunakan untuk menghitung nilai energi aktivasi (Havlik, 2008) dari pelindian bijih laterit yang dilakukan serta ditentukan model pelindian yang terjadi pada pelindian bijih laterit.
Tabel 8. Nilai konstanta terhadap suhu resiprokal
Suhu (°C) Konstanta Korelasi (R
2) k1 (x10-3) k2 (x10-6) k1 k2 30 0,2147 1,298 0,7065 0,4664 50 0,7162 12,885 0,9233 0,794 70 0,7368 15,414 0,8326 0,8826 90 0,7082 19,327 0,5182 0,3925
34
Langkah selanjutnya adalah pembuatan grafik ln k terhadap 1/T sesuai persamaan (3) dimana sumbu X adalah 1/T dan sumbu Y adalah ln k. Huruf T melambangkan suhu absolut (Kelvin). Penghitungan terhadap nilai konstanta laju dilakukan dengan menggunakan logaritma natural atau ln. Nilai konstanta pada Tabel 8 diperoleh dari data pada Tabel 6 dan Tabel 7.
Tabel 9. Nilai ln k terhadap suhu resiprokal
Suhu (K) 1/T x 10-3 (K-1) ln k1 ln k2
363 2,75 -8,45 -13,55
343 2,9 -7,24 -11,26
323 3,09 -7,21 -11,08
303 3,3 -7,25 -10,85
Dari hasil perhitungan dapat diperoleh nilai konstanta k1 dan k2, serta perhitungan nilai logaritma natural (ln) dari masing-masing konstanta. Data pada Tabel 9 dibentuk menjadi persamaan garis yang gradiennya digunakan untuk mencari nilai energi aktivasi dari pelindian yang dilakukan (Ayanda et al (2011); Baba et al (2005); Baba et al (2009)). Penentuan energi aktivasi dilakukan dengan cara membuat grafik dari ln k terhadap 1/T berdasarkan persamaan Arrhenius yakni,
𝑘 = 𝐴 𝑒−𝐸𝑎⁄𝑅𝑇 (4) Atau bisa diubah menjadi,
ln 𝑘 = ln 𝐴 −𝐸𝑎
𝑅𝑇 (5)
Dengan nilai ln k pada sumbu Y serta nilai 1/T pada sumbu X dari Tabel 9, diperoleh Gambar 13 dan Gambar 14. Kemudian dari Gambar 13 dan Gambar 14 diambil nilai gradien atau kemiringannya, untuk dihitung berapa besar energi
35
aktivasi yang dihasilkan dari pelindian bijih laterit sesuai persamaan Arrhenius (Havlik, 2008).
Nilai koefisien korelasi pada Gambar 13 lebih rendah dibandingkan dengan nilai koefisien korelasi pada Gambar 14. Hal ini diperlihatkan dari nilai ln k yang tidak linear dengan meningkatnya nilai 1/T. Ini artinya model shrinking-core dalam pelindian bijih laterit yang dilakukan, yaitu kontrol secara kimia pada Gambar 13 kurang berhubungan dibandingkan dengan kontrol secara difusi pada Gambar 14.
Gambar 13. Grafik pengaruh ln k1 terhadap suhu resiprokal
Setelah dilakukan perhitungan dengan persamaan Arrhenius, energi aktivasi yang diperoleh bernilai kecil. Pada persamaan k1, diperoleh energi aktivasi sebesar 3.02 kJ mol-1. Sedangkan pada persamaan k2, diperoleh energi aktivasi sebesar 6.88 kJ mol-1. -7,25 -7,21 -7,24 -8,45 y = -0,363x - 6,63 R² = 0,593 -9 -8 -7 -6 -5 -4 -3 -2 -1 0 2,75 2,91 3,09 3,3 ln k1 1/T x 10-3(K-1)
36
Havlik (2008) menyatakan bahwa, besar energi aktivasi pada reaksi yang dikontrol secara kimia berada di atas 42 kJ mol-1 dan secara difusi berada di kisaran 4-13 kJ mol-1. Free (2013) juga menyatakan bahwa reaksi yang dikontrol secara difusi memiliki energi aktivasi kurang dari 15 kJ mol-1. Dari penjelasan tersebut, dapat dikatakan bahwa model shrinking-core yang mempengaruhi proses pelindian bijih laterit Sulawesi Tenggara adalah kontrol secara difusi. Pelindian yang dilakukan memiliki nilai energi aktivasi yang rendah, yang menunjukkan bahwa pelindian bijih laterit dilakukan dengan spontan.
Gambar 14. Grafik pengaruh ln k2 terhadap suhu resiprokal
-10,85 -11,08 -11,26 -13,55 y = -0,828x - 9,615 R² = 0,7259 -16 -14 -12 -10 -8 -6 -4 -2 0 2,75 2,91 3,09 3,3 ln k2 1/T x 10-3(K-1)
37
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari penelitian yang dilakukan dapat disimpulkan bahwa,
1. Konsentrasi optimum proses pelindian bijih laterit diperoleh pada konsentrasi HCl 4 M dan suhu pelindian pada 90 °C.
2. Berdasarkan model kinetika reaksi kimia heterogen, pelindian bijih laterit Sulawesi Tenggara dikontrol oleh model shrinking core melalui reaksi
diffusion through product layer, dimana energi aktivasi dari pelindian yang
dilakukan bernilai 6,88 kJ mol-1. Hasil ini menunjukkan bahwa pelindian bijih laterit dalam media HCL dapat berjalan dengan spontan dan signifikan karena energi aktivasi reaksi pelindian yang relatif rendah.
5.2. Saran
Untuk membandingkan performa antar media asam pada pelindian bijih laterit, diperlukan penelitian lanjutan mengenai pelindian bijih laterit dengan menggunakan media asam jenis lain.
41
LAMPIRAN
42
Lampiran 2. Perhitungan dalam proses pelindian A. Pengenceran Asam Klorida sebagai Pelarut
1. Diambil sebanyak 100 ml aquades ke dalam gelas beaker 2. Diambil juga HCl pekat (37% atau 12 M) sebanyak 50 ml
3. Kedua larutan dicampur sehingga diperoleh larutan HCl yang encer V1 x M1 = V2 x M2 150 mL x M1 = 50 mL x 12 M 𝑀1 = 50 𝑚𝐿 𝑥 12 𝑀 150 𝑚𝐿 M1 = 4 M 𝑀 = 𝑛 𝑉 4 𝑀 = 𝑛 0,15 𝐿 𝑛 = 4 𝑀 𝑥 0,15 𝐿 𝑛 = 0,6 𝑚𝑜𝑙
B. Penghitungan Konsentrasi Filtrat
𝑚𝑜𝑙 𝐹𝑒 = 𝐹𝑒 𝑑𝑎𝑙𝑎𝑚 𝑓𝑖𝑙𝑡𝑟𝑎𝑡 (𝑝𝑝𝑚) 𝑥 𝐹𝑃 𝑥 1
𝐴𝑟 𝐹𝑒𝑥 𝑉𝑜𝑙𝑢𝑚𝑒 𝑝𝑒𝑙𝑎𝑟𝑢𝑡 (𝐿)
𝑚𝑜𝑙 𝐹𝑒 = 𝑝𝑝𝑚 𝐹𝑒 𝑥 𝐹𝑃 𝑥 1
43
Tabel 10. Konsentrasi besi dalam filtrat hasil pelindian dengan variasi waktu Suhu (°C) Waktu (menit) Konsentrasi (ppm) Faktor Pengenceran Konsentrasi sebenarnya (mol) 30 3 0,65 250x 4,36 x 10-4 5 0,82 250x 5,50 x 10-4 10 0,86 250x 5,77 x 10-4 20 1,07 250x 7,18 x 10-4 30 1,23 250x 8,25 x 10-4 60 2,07 250x 1,39 x 10-3 120 2,91 250x 1,95 x 10-3 240 1,27 1250x 4,2 x 10-3 50 3 2,44 250x 1,5 x 10-3 5 1,1 1250x 3,6 x 10-3 10 3,71 250x 2,4 x 10-3 20 1,27 1250x 4,2 x 10-3 30 1,36 1250x 4,5 x 10-3 60 1,1 2500x 7,35 x 10-3 120 1,47 2500x 9,9 x 10-3 240 1,64 2500x 0,011 70 3 1,05 1250x 3,45 x 10-3 5 1,27 1250x 4,2 x 10-3 10 1,28 2500x 8,55 x 10-3 20 1,49 2500x 9,9 x 10-3 30 1,46 2500x 9,75 x 10-3 60 1,65 2500x 0,011 120 1,59 2500x 0,01 240 1,81 2500x 0,012 90 3 1,24 1250x 8,25 x 10-3 5 1,3 2500x 8,7 x 10-3 10 1,92 2500x 0,013 20 1,57 2500x 0,01 30 1,65 2500x 0,011 60 2,82 2500x 0,019 120 1,76 2500x 0,01185 240 1,81 2500x 0,012
44
C. Fraksi Mol Besi Terhadap Mol HCl
Tabel 11. Fraksi mol dalam filtrat hasil pelindian dengan variasi waktu Suhu
(°C)
Waktu (menit)
Konsentrasi
(mol) Fraksi Mol
30 3 4,36 x 10-4 7.26 x 10-4 5 5,50 x 10-4 9.16 x 10-4 10 5,77 x 10-4 9.6 x 10-4 20 7,18 x 10-4 1.19 x 10-4 30 8,25 x 10-4 1.37 x 10-4 60 1,39 x 10-3 2.31 x 10-3 120 1,95 x 10-3 3.24 x 10-3 240 4,2 x 10-3 6.95 x 10-3 50 3 1,5 x 10-3 2.49 x 10-3 5 3,6 x 10-3 5.96 x 10-3 10 2,4 x 10-3 3.98 x 10-3 20 4,2 x 10-3 6.95 x 10-3 30 4,5 x 10-3 7.44 x 10-3 60 7,35 x 10-3 0.012 120 9,9 x 10-3 0.016 240 0,011 0.018 70 3 3,45 x 10-3 5.72 x 10-3 5 4,2 x 10-3 6.95 x 10-3 10 8,55 x 10-3 0.014 20 9,9 x 10-3 0.0162 30 9,75 x 10-3 0.0159 60 0,011 0.018 120 0,01 0.0163 240 0,012 0.019 90 3 8,25 x 10-3 0.013 5 8,7 x 10-3 0.014 10 0,013 0.021 20 0,01 0.016 30 0,011 0.018 60 0,019 0.03 120 0,01185 0.0193 240 0,012 0.0196
45
𝑋𝐹𝑒 = 𝑛𝐹𝑒 𝑛𝐹𝑒+ 𝑛𝐻𝐶𝑙 Dimana,
XFe = Fraksi mol besi
nFe = Mol besi
nHCl = Mol HCl
D. Kinetika Pelindian
1. Fraksi mol tiap interval waktu pelindian dimasukkan ke dalam dua persamaan shrinking-core yaitu model chemical reaction control (1-(1-α)1/3) dan model diffusion reaction control (1+2(1-α)-3(1-α)2/3) sehingga diperoleh dua tabel data. Fraksi mol dinyatakan dengan simbol α.
2. Dibuat grafik dari dua tabel tersebut menggunakan Microsoft Excel dengan interval waktu pelindian sebagai sumbu X dan hasil perhitungan dengan persamaan shrinking-core sebagai sumbu Y.
3. Dari grafik yang ditampilkan, terdapat persamaan seperti y = mx + c. Nilai
m merupakan gradien atau kemiringan garis. Nilai m ini digunakan sebagai
nilai k atau konstanta untuk menghitung energi aktivasi yang dihasilkan dari pelindian yang dilakukan.
4. Pelindian yang dilakukan menggunakan empat variasi suhu yaitu 30°, 50°, 70° dan 90° C, sehingga terdapat 4 grafik dan ditambah 4 grafik lagi dikarenakan terdapat dua persamaan model shrinking-core yang digunakan untuk mencari nilai konstanta.
46
Tabel 12. Nilai model shrinking core filtrat hasil pelindian variasi waktu Suhu (°C) Waktu (menit) Fraksi Mol 1-(1-α) 1/3 1+2(1-α)-3(1-α)2/3 30 0 7.26 x 10-4 0 0 3 9.16 x 10-4 0,24 0,18 5 9.6 x 10-4 0,3 0,28 10 1.19 x 10-4 0,32 0,31 20 1.37 x 10-4 0,39 0,47 30 2.31 x 10-3 0,46 0,63 60 3.24 x 10-3 0,77 1,78 120 6.95 x 10-3 1,08 3,5 240 2.49 x 10-3 2,32 16,15 50 0 5.96 x 10-3 0 0 3 3.98 x 10-3 0,83 2,07 5 6.95 x 10-3 1,99 11,87 10 7.44 x 10-3 1,33 5,29 20 0.012 2,32 16,15 30 0.016 2,49 18,51 60 0.018 4,02 48,26 120 5.72 x 10-3 5,36 85,94 240 6.95 x 10-3 6,04 108,87 70 0 0.014 0 0 3 0.0162 1,91 10,93 5 0.0159 2,32 16,15 10 0.018 4,69 65,74 20 0.0163 5,43 88,11 30 0.019 5,33 84,87 60 0.013 6,04 108,87 120 0.014 5,46 89,21 240 0.021 6,37 121,36 90 0 0.016 0 0 3 0.018 4,35 56,66 5 0.03 4,69 65,74 10 0.0193 7,05 148,39 20 0.0196 5,36 85,94 30 7.26 x 10-4 6,04 108,87 60 9.16 x 10-4 10,1 304,07 120 9.6 x 10-4 6,47 125,24 240 1.19 x 10-4 6,58 129,18
5. Keempat nilai gradien dari masing-masing grafik tiap persamaan model
shrinking core digunakan sebagai nilai konstanta. Nilai konstanta
dimasukkan ke dalam persamaanln 𝑘 = ln 𝐴 −𝐸𝑎
47
sumbu Y dan 1/T sebagai sumbu X. Hasil perhitungan persamaan
shrinking core dapat dilihat pada Tabel 9.
6. Dari grafik yang ditampilkan akan muncul persamaan sama seperti dengan
y = mx + c. Nilai m dari persamaan baru ini adalah−𝐸𝑎
𝑅 dimana R adalah konstanta gas (8,314 J/mol K) dan Ea adalah Energi aktivasi. Nilai m untuk menghitung energi aktivasi dapat dilihat pada Gambar 11 dan 12.
𝑚 = −𝐸𝑎 𝑅 𝑚 = − 𝐸𝑎 8,314 𝐽 𝑚𝑜𝑙 𝐾 K1 (1-(1-α)1/3) 𝐸𝑎 = −8.314 𝐽 𝑚𝑜𝑙−1𝐾−1 𝑥 − 0.363 𝑥 1000 𝐾 𝐸𝑎 = 3017.982 𝐽 = 3.02 𝑘𝐽 𝑚𝑜𝑙−1 K2 (1+2(1-α)-3(1-α)2/3) 𝐸𝑎 = −8.314 𝐽 𝑚𝑜𝑙−1𝐾−1 𝑥 − 0.828 𝑥 1000 𝐾 𝐸𝑎 = 6883.992 = 6.88 𝑘𝐽 𝑚𝑜𝑙−1 E. Persen Ekstraksi
Nilai persen ekstraksi dalam filtrat hasil pelindian diperoleh dari banyaknya besi terekstrak dari proses pelindian dengan HCl. Lebih lanjut persen ekstraksi dijelaskan oleh rumus berikut,
% 𝑒𝑘𝑠𝑡𝑟𝑎𝑘𝑠𝑖 𝑏𝑒𝑠𝑖 = 𝑏𝑒𝑠𝑖 𝑦𝑎𝑛𝑔 𝑑𝑖𝑝𝑒𝑟𝑜𝑙𝑒ℎ (𝑔𝑟𝑎𝑚)
48
Persen ekstraksi besi dalam filtrat hasil pelindian bijih laterit dengan HCl ditampilkan pada tabel 13. Kadar besi dalam bijih laterit 15 gram yang dianalisis dengan XRF berjumlah 30,11 % atau berjumlah 4,51 gram. Persen ekstraksi dihitung dari filtrat besi saat diambil pada menit ke-240.
𝑚 = 𝑛 𝑥 𝐴𝑟
Dimana, m = massa unsur (gram) n = mol zat Ar = massa atom relatif unsur
Tabel 13. Persen ekstraksi besi filtrat hasil pelindian bijih laterit Suhu pelindian
(°C)
Mol besi Jumlah besi dalam filtrat (gram) Persen ekstraksi (%) 30 4.2 x 10-3 0.23 5.09 50 0.11 0.61 13.52 70 0.012 0.67 14.85 90 0.012 0.67 14.85
Lampiran 3. Pola difraksi sinar-X bijih laterit beserta residu hasil pelindian
49
Gambar 16. Pola difraksi sinar-X pelindian bijih laterit suhu 30 °C
50
Gambar 18. Pola difraksi sinar-X pelindian bijih laterit suhu 70 °C
51
Gambar 20. Pola difraksi sinar-X pelindian bijih laterit konsentrasi HCl 6 M
52
Gambar 22. Pola difraksi sinar-X pelindian bijih laterit konsentrasi HCl 2.4 M
53
54
Lampiran 5. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan suhu 30 °C
55
Lampiran 6. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan suhu 50 °C
56
Lampiran 7. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan suhu 70 °C
57
Lampiran 8. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan suhu 90 °C
58
Lampiran 9. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan konsentrasi HCl 6 M
59
Lampiran 10. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan konsentrasi HCl 4 M
60
Lampiran 11. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan konsentrasi HCl 2.4 M
61
Lampiran 12. Hasil analisis komposisi kimia bijih laterit setelah pelindian dengan konsentrasi HCl 1.7 M