I. Nama Percobaan : Daya Hantar Listrik
II. Tujuan Percobaan :
1. Mengukur daya hantar listrik berbagai senyawa
2. Mempelajari pengaruh konsentrasi terhadap daya hantar listrik larutan elektrolit.
III. Landasan Teori
Daya hantar listrik adalah ukuran seberapa kuat suatu larutan dapat menghantarkan listrik. Daya hantar listrik merupakan kebalikan dari hambatan listrik (R), dimana:
R = ρ L/A
Suatu hambatan dinyatakan dalam ohm disingkat Ω, oleh karena itu daya hantar listrik dinyatakan : DHL = 1/R = k A/L
Dimana, k = 1/R x L/A
Daya hantar listrik disebut konduktivitas. Satuannya ohm-1 disingkat Ω-1, tetapi secara resmi satuan yang digunakan adalah siemen, disingkat S, dimana S = Ω-1
maka satuan k adalah Sm-1 atau SCm-1.
Konduktivitas digunakan untuk ukuran larutan / cairan elektrolit. Konsentrasi elektrolit sangat menentukan besarnya konduktivitas, sedang konduktivitas sendiri tidak dapat dapat digunakan untuk ukuran suatu larutan. Ukuran yang lebih spesifik yaitu konduktivitas molar (∆m). Konduktivitas molar adalah konduktivitas suatu larutan apabila konsentrasi larutan sebesar satu molar, yang dirumuskan sebagai:
∆m = k/C Dimana:
k : Konduktivitas spesifik (SCm-1) C : Konsentrasi larutan (mol/L)
∆m: Hantaran molar (SCm2
mol-1)
Jika satuan volume yang digunakan adalah cm3 maka persamaan yang digunakan adalah ∆m = 1000k
C
Dimana satuan-satuannya sama dengan diatas.
Besarnya daya hantar jenis dapat dicari dari tahanan larutan. Jadi dengan mengukur tahanan larutan dapat ditentukan daya hantar ekivalen. Untuk ini biasanya dipakai jembatan wheat stone.
Faktor-faktor yang mempengaruhi kecepatan ion adalah: Berat dan muatan ion
Adanya hidrasi
Orientasi atmosfer pelarut Gaya tarik antar ion Temperatur
Viskositas
Jika larutan diencerkan maka untuk elektrolit lemah α-nya semakin besar dan untuk elektrolit kuat gaya tarik antar ion semakin kecil. Pada pengenceran tidak terhingga, daya hantar ekivalent elektrolit hanya tergantung pada jenis ionnya. Masing-masing ion mempunyai daya hantar ekivalent yang tergantung pada:
- Jumlah ion yang ada
- Kecepatan ion pada beda potensial antara kedua elektroda yang ada
Jumlah ion yang ada tergantung dari jenis elektrolit (kuat/lemah) dan konsentrasi selanjutnya pengenceran baik untuk elektrolit lemah/kuat memperbesar daya hantar dan mencapai harga maksimum pada pengenceran tak berhingga.
Penghantar logam disebut penghantar kelas utama, dalam penghantar ini listrik mengalir sebagai electron. Tekanan dari penghantar ini bertambah dengan naiknya temperatur. Larutan elektrolit juga dapat menghantarkan listrik, penghantar ini disebut
penghantar kedua. Dalam penghantar ini disebabkan oleh gerakan dari ion-ion kutub satu ke kutub lainnya. Berbeda dengan penghantar logam, penghantar elektrolit tahanannya berkurang bila temperature naik.
Daya hantar listrik suatu larutan tergantung dari: 1. Jumlah ion yang ada
Jumlah ion yang ada tergantung dari elektrolit (kuat/lemah) dan konsentrasi. Pengenceran larutan baik untuk elektroda memperbesar daya hantar dan mencapai harga maksimal pada pengancaran tak tarhingga.
2. Kecepatan dari ion pada beda potensial antara kedua elektroda.
Pengukuran daya hantar listrik mempunyai arti penting dalam proses-proses kimia. Pada pembuatan akuades, efisiensi dari penghilang zat terlarut yang berupa garam-garam dapat diikuti dengan mudah dengan cara mengukur daya hantar larutan selama titrasi dan dengan menggunakan grafik dapt digunakan untuk menentukan titik akhir titrasi. Derajat ionisasi elektrolit lemah dapat ditentukan dengan pengukuran daya hantarnya. Seperti diketahui, daya hamtar berbanding lurus dengan jumlah ion yang ada dalam larutan.
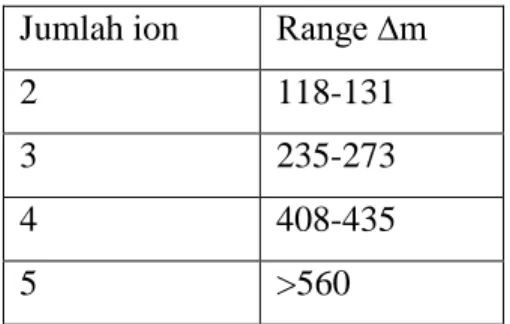
Tabel jumlah ion dan ∆m dalam pelarut air Jumlah ion Range ∆m
2 118-131
3 235-273
4 408-435
5 >560
Tabel jumlah ion dan∆m dalam pelarut DMF Jumlah ion Range ∆m
1:1 65-90
3:1 200-240
4:1 >300
Daya hantar ekuivalen didefenisikan sebagai daya hantar satu gram ekuivalen suatu zat terlarut diantara 2 elektroda dengan jarak kedua elektroda 1 cm. Daya hantar ekuivalen pada larutan encer diberi symbol “0″ yang harganya tertentu untuk setiap ion.
Pengaruh konsentrasi pada daya hantar ekuivalen, misal:
Konduktivitas molar elektrolit tidak tergantung pada konsentrasi. Jika K tepat sebanding dengan konsentrasi elektrolit. Walaupun demikian pada praktiknya, konduktivitas molar bervariasi terhadap konsentrasi, salah satu alasannya adalah jumlah ion dalam larutan mungkin tidak sebanding dengan konsentrasi larutan elektrolit, misalnya konsentrasi ion dalam larutan asam lemah tergantung pada konsentrasi asam secara rumit dan penduakalian konsentrasi nominal asam itu tidak menduakalikan jumlah ion tersebut. Kedua, karena ion saling berinteraksi dengan kuat, maka konduktivitas larutan tidak tepat sebanding dengan jumlah ion yang ada.
Pengukuran konduktivitas mula-mula pada konsentrasi menunjukkan adanya dua golongan elektrolit yaitu:
1. Elektrolit kuat
Konduktivitas mula-mula elektrolit kuat hanya sedikit berkurang dengan bertambahnya konsentrasi
2. Elektrolit lemah
Konduktivitas molar elektrolit lemah normal pada konsentrasi mendekati nol, tetapi turun tajam sampai nilai terendah saat konsentrasi bertambah.
Konsentrasi NaCl 0
0,1 106,7
0,01 118,5
0,001 123,7
Berdasarkan sifat daya hantar listriknya, larutan dibagi menjadi dua yaitu larutan elektrolit dan larutan non elektrolit. Sifat elektrolit dan non elektrolit didasarkan pada keberadaan ion dalam larutan yang akan mengalirkan arus listrik. Jika dalam larutan terdapat ion, larutan tersebut bersifat elektrolit. Jika dalam larutan tersebut tidak terdapat ion larutan tersebut bersifat non elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Hantaran listrik melalui larutan dapat dtunjukkan dengan alat uji elektrolit seperti pada Gambar 7. Jika larutan menghantarkan arus listrik, maka lampu dalam rangkaian tersebut akan menyala dan timbul gas atau endapan pada salah satu atau kedua elektroda.
Contoh lain adalah, bila NaCl dilarutan dalam air akan terurai menjadi ion positif dan ion negatif. Ion positif yang dihasilkan dinamakan kation dan ion negatif yang dihasilkan dinamakan anion. Larutan NaCl adalah contoh larutan elektrolit. Perhatikan reaksi berikut.
Bila gula dilarutkan dalam air, molekul-molekul gula tersebut tidak terurai menjadi ion tetapi hanya berubah wujud dari padat menjadi larutan. Larutan gula adalah contoh dari larutan non elektrolit. Perhatikan reaksi berikut:
Dalam kehidupan sehari-hari kita banyak menemukan contoh larutan elektrolit maupun non elektrolit. Contoh larutan elektrolit: larutan garam dapur, larutan cuka makan, larutan asam sulfat, larutan tawas, air sungai, air laut. Contoh larutan non elektrolit adalah larutan gula, larutan urea, larutan alkohol, larutan glukosa.
Daya hantar listrik larutan elektrolit bergantung pada jenis dan konsentrasinya. Beberapa larutan elektrolit dapat menghantarkan arus listrik dengan baik meskipun konsentrasinya kecil, larutan ini dinamakan elektrolit kuat. Sedangkan larutan elektrolit yang mempunyai daya hantar lemah meskipun konsentrasinya tinggi dinamakan elektrolit lemah.
Perhatikan hasil uji elektrolit yang ditunjukkan pada Gambar 8. Pada larutan elektrolit lampu yang digunakan menyala dan timbul gas pada elektrodanya. Beberapa larutan elektrolit dapat mengahantarkan listrik dengan baik sehingga lampu menyala terang dan gas yang terbentuk relatif banyak (Gambar 8a). Larutan ini dinamakan elektrolit kuat, beberapa elektrolit yang lain dapat menghantarkan listrik tetapi kurang baik, sehingga lampu nyala, redup atau bahkan tidak menyala dan gas yang terbentuk relatif sedikit. (Gambar 8b). Dari uraian di atas kita dapat golongkan larutan elektrolit menjadi dua macam, yaitu elektrolit kuat dan elektrolit lemah.
Larutan elektrolit kuat adalah larutan yang dapat menghantarkan arus listrik dengan baik. Hal ini disebabkan karena zat terlarut akan terurai sempurna (derajat ionisasi ? = 1) menjadi ion-ion sehingga dalam larutan tersebut banyak mengandung ion-ion. Sebagai contoh larutan NaCl. Jika padatan NaCl dilarutkan dalam air maka NaCl akan terurai empurna menjadi ion Na+ dan Cl-. Perhatikan reaksi berikut.
Dari reaksi diatas jika 100 mol NaCl dilarutkan dalam air akan terbentuk 100 mol ion Na+ dan 100 mol ion Cl-. Jadi jika 100 mol NaCl dilarutkan akan terbentuk 200 mol ion. Larutan elektrolit lemah adalah larutan yang dapat menghantarkan arus listrik dengan lemah. Hal ini disebabklan karena zat terlarut akan terurai sebagian (derajat ionisasi ? << 1) menjadi ion-ion sehingga dalam larutan tersebut sedikit mengandung ion. Tabel berikut menggambarkan larutan-larutan yang termasuk elektrolit kuat, elektrolit lemah dan non elektrolit.
Daya Hantar Listrik Senyawa Ion
Sebagai contoh dari kegiatan percobaan yang tergolong larutan elektrolit yang berikatan ion adalah garam dapur.
Dapatkah Anda membedakan daya hantar listrik untuk garam pada saat kristal, lelehan dan larutan?
Cobalah perhatikan uraian berikut.
NaCl adalah senyawa ion, jika dalam keadaan kristal sudah sebagai ion-ion, tetapi ion-ion itu terikat satu sama lain dengan rapat dan kuat, sehingga tidak bebas bergerak. Jadi dalam keadaan kristal (padatan) senyawa ion tidak dapat menghantarkan listrik, tetapi jika garam yang berikatan ion tersebut dalam keadaan lelehan atau larutan, maka ion-ionnya akan bergerak bebas, sehingga dapat menghantarkan listrik.
Pada saat senyawa NaCl dilarutkan dalam air, ion-ion yang tersusun rapat dan terikat akan tertarik oleh molekul-molekul air dan air akan menyusup di sela-sela butir-butir ion tersebut (proses hidasi) yang akhirnya akan terlepas satu sama lain dan bergerak bebas dalam
larutan.
NaCl (s) + air Na+(aq) + Cl-(aq)
Proses pelarutan padatan Kristal
Pada percobaan akan ditentukan jumlah muatan larutan sampel dengan metode pengukuran daya hantar listriknya kemudian dilakukan pendekatan antara larutan sampel tehadap larutan standar elektrolit yang juga telah diketahui jumlah muatan ionnya. Daya hantar listrik pada larutan diukur dengan menggunakan konduktivity meter menghasilkan harga konduktivitas larutan dalam satuan µscm-1
Pengukuran konduktivitas larutan standar yang telah diketahui jumlah muatan ionnya dilakukan pada beberapa jenis larutan baik elektrolit kuat dan elektrolit lemah. Suatu larutan elektrolit kuat memiliki konduktivitas lebih tinggi dari pada larutan elektrolit lemah. Karena dalam elektrolit kuat, zat elektrolit akan terdisosiasi sempurna menjadi ion-ionnya. Jumlah ion pada suatu larutan juga berpengaruh pada nilai konduktivitas larutan.
Daya hantar listrik (konduktivitas) adalah ukuran seberapa kuat suatu larutan dapat menghantarkan listrik. Konduktivitas digunakan untuk ukuran larutan atau cairan elektrolit. Semakin besar jumlah ion dari suatu larutan maka akan semakin tinggi nilai konduktivitasnya. Jumlah muatan dalam larutan sebanding dengan nilai hantar molar larutan dimana hantaran molar juga sebading dengan konduktivitas larutan. Konsentrasi elektrolit sangat menentukan besarnya konduktivitas molar (∆m). Konduktivitas molar
adalah konduktivitas suatu larutan apabila konsentrasi larutan sebesar satu molar, sehingga secara matematis dirumuskan :
∆m = k/C
Jika satuan volume yang digunakan adalah cm3 maka persamaan yang menjadi
∆m = 1000k C
Dimana: k : Konduktivitas spesifik (SCm-1) C : Konsentrasi larutan (mol/L) ∆m: Hantaran molar (SCm2mol-1)
Dalam percobaan digunakan larutan standar dan larutan sampel dengan konsentrasi sama, sehingga C dianggap constant. Jika nilai C konstan, maka hantaran molar (∆M) hanya diperbaharui oleh konduktivitas larutan (K), dimana ∆M sebanding dengan nilai K. Nilai K didapat dari hasil percobaan. Jadi, semakain tinggi konduktivitas larutan maka hantaran molar (∆M) larutan tsb akan meningkat. Jumlah muatan juga berpengaruh pada hantaran molarnya. Pada kosentrasi yang sama, semakin besar jumlah muatan suatu larutan, maka akan semakin besar pula hantaran molarnya (∆M).
Dalam suatu larutan elektrolit bila diberi dua batang elektroda inert dan diberi tegangan listrik diantaranya, maka anion-anion akan bergerak ke elektroda negatif (katoda). Proses ini merupakan fenomena transport seperti halnya yang terjadi dalam molekul gas adalah adanya pengaruh medan listrik dan molekul pelarut. Analisis kimia yang didasarkan pada daya hantar listrik berhubungan dengan pergerakan suatu ion didalam larutan ion yang mudah bergerak mempunyai daya hantar listrik yang besar.
Langkah pertama yang dilakukan adalah membuat larutan KCl 0,01M sebagai larutan yang mengkalibrasi alat konduktivitymeter. Konduktivitymeter dikalibrasi hingga menunjukkan sekitar angka 1413 µs (bias kurang atau lebih/mendekati). Dalam hal ini
pelarut yang digunakan adalah aquadest. Pada percobaan ini juga menggunakan larutan blanko yaitu larutan KCL 0,01 M , yang dalam teoritis memiliki konduktivitas 1413 µScm
-1
, sehingga sebelum digunakan alat harus kalibasi dengan larutan. KCL 0,01 M dan diseting untuk menunjukan angka 1413 µScm-1 larutan alat digunakan. Hal ini dilakukan untuk mengetahui kesensitifan konduktivitymeter, apabila pengukuran larutan KCl menunjukkan 1413 µs, maka alat tersebut sensitif/baik. Untuk membuat larutan KCl 0,01M, diambil 4ml KCl 0,25 lalu diencerkan dengan akuades hingga volume 100ml. Larutan ini kemudian digunakan untuk kalibrasi alat. Dimana larutan blanko KCl dimasukkan dalam gelas beker, lalu dimasukkan sebuah magnet dan diletakkan di atas stirrer. Kemudian stirrer dihidupkan, fungsi dari stirrer dan memasukkan magnet adalah agar larutan homogen. Kemudian elektroda di masukkan dalam larutan, lalu di ukur dengan konduktymeter dan di setting hingga menunjukkan angka 1413 µScm-1. . Dalam hal ini, diantara 2 elektroda terdapat 2 elektroda, yaitu katoda dan anoda, Antara kedua elektroda tersebut terdapat beda potensial akibat dari desakan electron atau aktivitas elektron. Bila kedua elektroda tersebut dihubungkan, maka akan terjadi ariran listrik dari kutub negatif ke kutub positif melalui hubungan luar.
Setelah itu dibuat larutan standar. Larutan standar yang pertama, dibuat dengan mengambil 2ml larutan KCl, NaCl, KNO3, CuSO4.5H2O, NiSO4.6H2O, MgCl2,
CuCl2.2H2O, AlCl3.6H2O masing-masing mempunyai konsentrasi 0,25 gram yang
diencerkan dengan 100ml akuades untuk menjadika konsentrasi 5.10-3M. Semua larutan dalam konsentrasi sama yaitu 5.10-3M, sehingga dalam percobaan ini konsentrasi dianggap konstan.
Larutan standar yang kedua, dibuat dengan mengambil 2ml larutan KCl, NaCl, KNO3, CuSO4.5H2O, NiSO4.6H2O, MgCl2, CuCl2.2H2O, AlCl3.6H2O masing-masing
mempyunyai konsentrasi 0,125 yang diencerkan dengan 50ml metanol untuk menjadika konsentrasi 5.10-3M. Hal ini sesuai persaman
Dalam percobaan digunakan konsentrasi larutan sama yaitu 5.10-3M. Konsentrasi elektrolit sangat menentukan besarnya konduktivitas suatu larutan. Dari harga konduktivitas yang terukur dapat digunakan untuk mencari harga konduktivitas molarnya sehingga dapat diketahui jumlah muatan yang terdapat dalam larutan standar.
Pada larutan encer, ion-ion dalam larutan tersebut mudah bergerak sehingga daya hantarnya semakin besar. Pada larutan yang pekat, pergerakan ion lebih sulit sehingga daya hantarnya menjadi lebih rendah. Hal lain yang mempengaruhi daya hantar listrik selain konsentrasi adalah jenis larutan. Pengukuran ketergantungan konduktivitas molar pada konsentrasi tertentu menunjukkan adanya 2 golongan elektrolit, yaitu elektrolit lemah dan elektrolit kuat. Sifat umum dari elektrolit kuat adalah konduktivitas akan berkurang dengan bertambahnya konsentrasi, sedangkan elektrolit lemah konduktivitas molarnya normal pada konsentrasi mendekati nol, tetapi turun tajam sampai nilai yang rendah pada saat konsentrasi bertambah. Larutan elektrolit kuat mempunyai konduktiviyaslebih tinggi daripada elektrolit lemah, hal ini karena zat elektrolit terdisosiasi secara sempurna didalam larutan, berarti larutan elektrolit kuat dapat menghantarkan listrik dengan baik. Penggolongan dengan cara ini juga bergantung pada zat terlarut dari pelarut yang digunakan.
Jumlah ion dan ∆m dalam pelarut air sesuai literatur:
Jumlah ion Range ∆m
2 3 4 5 118-131 235-273 408-435 >560
Dalam pengukuran konduktivitas spesifik larutan dipilih harga yang paling konstan karena harga konduktivitas cenderung berubah setiap saat sehingga harga yang paling konstan merupakan harga yang mendekati harga sebenarnya. Setiap pergantian larutan, alat cuci dengan akuades. Pengukuran disertai dengan pengukuran akuades (pelarut) karena harga konduktivitas spesifik merupakan koreksi dari konduktivitas larutan dengan konduktivitas pelarut
k= klarutan - kpelarut
Dari konduktivitas spesifik, dicari harga antara molarnya sehingga dapat ditentukan jumlah ion yang ada dalam sampel.
Berdasarkan daya hantar listriknya, larutan dibedakan menjadi :
a.Larutan Elektrolit.
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Zat terlarutnya disebut elektrolit. Contoh : natrium klorida (NaCl), hidrogen klorida (HCl), natrium hidroksida (NaOH), dan amoniak (NH3).
b.Larutan Nonelektrolit.
Larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Zat terlarutnya disebut nonelektrolit. Contoh : air suling, larutan gula, dan alkohol.
Pada tahun 1884, Svante Arrchenius mengajukan teorinya bahwa dalam larutan elektrolit, yang berperan menghantarkan arus listrik adalah partikel-partikel bermuatan (ion) yang bergerak bebas di dalam larutan. Ia menemukan bahwa zat elektrolit dalam pelarut air akan terurai menjadi ion, sedangkan nonelektrolit dalam pelarut air tidak terurai menjadi ion-ion.
Daya Hantar Arus Listrik Dalam Larutan Elektrolit.
Berdasarkan kekuatan daya hantarnya, larutan elektrolit dibedakan menjadi dua, yaitu elektrolit kuat dan elektrolit lemah.
1.Elektrolit Kuat.
Elektrolit kuat adalah elektrolit yang dapat menghasilkan larutan dengan daya hantar listrik yang baik. Senyawa NaCl, HCl, dan H2SO4 dapat terurai sempurna dalam
pelarut air membentuk banyak ion.
2.Elektrolit Lemah.
Elektrolit lemah adalah elektrolit yang dapat menghasilkan larutan dengan daya hantar listrik yang buruk. Senyawa CH3COOH dan NH3 hanya terurai sebagian kecil dalam
pelarut air membentuk sedikit ion. Secara kuantitatif, kuat atau lemahnya suatu larutan elektrolit dapat dinyatakan dengan derajat ionisasi (α).
Untuk larutan elektrolit kuat; α = 1 atau α mendekati 1. Untuk larutan elektrolit lemah; 0
Untuk larutan nonelektrolit; α = 0.
Jenis Larutan Jenis Zat Terlarut (dengan Pelarut
Air)
Nyala Lampu Contoh Larutan
Elektrolit Kuat ØSenyawa ion Øsenyawa kovalen
polaryang terhidrolisis sempurna/hampir
sempurna
terang Natrium klorida (NaCl)
Asam nitrat (HNO3)
Asam sulfat (H2SO4)
Natrium hidroksida (NaOH)
Kalium asetat (CH3COOK)
Elektrolit Lemah ØSenyawa kovalen polar yang terhidrolisis sebagian
kecil
Redup Asam cuka
Amonia (NH3)
Asam karbonat (H2CO3)
Nonelektrolit ØSenyawa kovalen polar yang tidak terhidrolisis
Tidak Menyala Sukrosa (C12H22O11)
Etanol (C2H5OH) Urea (CO(NH2)2) Glukosa (C6H12O6) Gliserin (C3H5(OH)3) Etilen glikol (C2H4(OH)2)
Menurut Michael Faraday, elektrolit merupakan suatu zat yang dapat menghantarkan listrik jika berada dalam bentuk larutan atau lelehannya.
Jenis Senyawa Padatan Lelehan Larutan (dalam
Pelarut Air)
Senyawa ion Tidak dapat
menghantarkan arus listrik, karena dalam bentuk padatan, ion-ionnya tidak dapat bergerak bebas.
Dapat
menghantarkan arus listrik, karena dalam bentuk lelehan, ion-ionnya dapat bergerak jauh lebih bebas dibandingkan ion-ion dalam zat
Dapat
menghantarkan arus listrik, karena dalam bentuk larutan, ion-ionnya dapat bergerak bebas
padat Senyawa kovalen polar Tidak dapat menghantarkan arus listrik, karena padatannya terdiri dari molekul-molekul netral meskipun bersifat polar Tidak dapat menghantarkan arus listrik, karena lelehannya terdiri dari
molekul-molekul netral meski Dapat bergerak lebih bebas
Dapat
menghantarkan arus listrik, karena dalam larutan molekul-molekulnya dapat terhidrolisis menjadi ion-ion yang Dapat bergerak bebas
Peran larutan elektrolit dan larutan nonelektrolit dalam kehidupan sehari-hari sangat penting, contohnya :
1.Aki
Sel aki terdiri anoda Pb dan katoda PbO2 dengan larutan elektrolit H2SO4. adanya larutan
elektrolit memungkinkan terjadinya reaki kimia yang menghasilkan arus listrik untuk menghidupkan kendaraan.
2.Air sungai dan air tanah
Air sungai dan air tanah mengandung ion-ion sehingga dapat menghantarkan listrik. Sifat ini digunakan untuk menangkap ikan atau belut di sungai atau di persawahan dengan cara setrum listrik.
3.Air suling
Merupakan larutan nonelektrolit, karena mengandung ion-ion dalam jumlah yang sangat kecil. Air suling digunakan untuk membuat larutan dalam percobaan kimia nonelektrolit.
4.Cairan tubuh
Cairan tubuh mengandung komponen larutan elektrolit. Komponen larutan elektrolit memungkinkan terjadinya daya hantar listrik yang diperlukan untuk kerja impuls. Orang yang kekurangan cairan tubuh (dehidrasi) harus mengkonsumsi larutan elektrolit, seperti larutan oralit.
IV. Alat Dan Bahan Alat: 1. Multimeter / voltmeter 2. Elektroda platina 3. Baterai 4. Beaker glass 100 ml, 250 ml 5. Labu Takar 50 ml 6. Pipet volume 5ml 7. Botol Semprot Bahan: 1. Aquadest 2. Minyak Tanah 3. Asam asetat 4. Kristal NaCl 5. Lautan NaCl 6. NH4OH 7. HCl 8. NaOH 9. NaBr 10. NH4Cl 11. NaI V. Prosedur Kerja
A. Menentukan daya hangtar listrik berbagai senyawa
1. Sediakan lima buah beker glass ukuran 100ml, kemudian masing-masing diisi 50 ml minyak tanah,asam cuka, aquadest, larutan NaCl dan kristal NaCl.
2. Cucilah elektrode dengan HNO3 (1:1) kemudian bilas dengan aquadest danbilas lagi dengan aseton, keringkan dengan kertass tissue atau alat pengering (hati-hati permukaan elektrode sangat tipis dan mudah patah)
3. Celupkan elekttrode tersebut ke dalam larutan yang akan diamati gunakan klem dan usahakan elektrode tidak menyentuh dasar beker glass/bejana
4. Sebelum pengamatan suhu catatlah percobaan dan jaga agar suhu percobaan konstan.
5. Ukurlah daya listrik setiap larutan diatas
6. Setelah pengamatan daya hantar, elektrode dicuci kembali seperti langkah 2.
B. Mempelajari pengaruh konsentasi terhadap daya hantar listrik larutan elektrolit
1. Bualah masing-masing 50ml larutan dibawah ini dengan konsentrasi 0,001 M, 0,005 M, 0,01 M, 0,05 M.
Kelompok I : CH3COOH, NH4OH, HCl, NaOH
Kelompok II: NaCl, NaBr, NaI, NH4Cl
2. Mencuci elektrode (seperti langkah 1-2) 3. Celupkan elektrode kedalam larutan tersebut 4. Amati suhu permukaan
5. Ukurlah daya hantar masing-masing larutan. Pengukuran selalu dimulai dari larutan yang paling encer.
6. Mencuci elektrode (langkah 1 dan 2 ) bia elektrode tidak digunakan lagi, rendamlah dalam aqudest.
VI. Data Hasil Pengamatan
Daya Hantar Listrik pada berbagai konsentrasi 1. Elektrolit kelompok I Konsentrasi NaOH L (Ohm -1) 0,001 M 0,16 0,005 M 1,04 0,01 M 1,53 0,05 M 8,19
2. Elektrolit kelompok II Konsentrasi NaCl L (Ohm -1) NaBr L (Ohm -1) 0,001 M 0,46 0,21 0,005 M 0,23 0,95 0,01 M 0,30 1,79 0,05 M 1,60 7,45
VII. Pengolahan Data
Menentukan grafik daya hantar listrik larutan elektrolit pada kelompok I dan II. A. Elektrolit Kelompok I
1. Larutan NaOH
Dimana: X= Konsentrasi
Y= Daya Hantar Listrik
No. X Y XY X2 1 0,001 0,16 0,00016 0,000001 2 0,005 1,04 0,0052 0,000025 3 0,01 1,53 0,0153 0,0001 4 0,05 8,19 0,4095 0,0025 ∑ 0,066 10,92 0,43016 0,00262 Slope (A) = = = = 162,64
Intersep (B) = = = = 0,046
Jadi, persamaannya adalah : Y=AX+B
Y=162,64X + 0,046 X 0 1 2 3 4 5 Y 0,046 162,686 325,326 487,966 650,606 813,246 B. Elektrolit Kelompok II 1. Larutan NaCl Dimana : X= Konsentrasi
Y= Daya Hantar Listrik
No. X Y XY X2 1 0,001 0,46 0,00046 0,000001 2 0,005 0,23 0,00115 0,000025 3 0,01 0,30 0,003 0,0001 4 0,05 1,60 0,08 0,0025 ∑ 0,066 2,59 0,08461 0,00262 Slope (A) = = = = 27,24
Intersep (B) = = = = 0,198
Jadi, persamaannya adalah : Y= AX+B
Y= 27,24X+0,198
X 0 1 2 3 4 5
Y 0,198 27,438 54,678 81,918 109,158 136,398
2. Larutan NaBr
Dimana : X= Konsentrasi
Y= Daya Hantar Listrik
No. X Y XY X2 1 0,001 0,21 0,00021 0,000001 2 0,005 0,95 0,00475 0,000025 3 0,01 1,79 0,0179 0,0001 4 0,05 7,45 0,3725 0,0025 ∑ 0,066 10,4 0,39536 0,00262 Slope (A) = = = = 145,58
Intersep (B) = = = = 0,19
Jadi, persamaannya adalah : Y= AX+B
Y= 145,58X + 0,19
X 0 1 2 3 4 5
Y 0,19 145,77 291,35 436,93 582,51 728,09
VIII. Pembahasan
Pada percobaan yan terang telah dilakukan terlihat bahwa semakin besar konsentrasi maka daya hantar listrik larutan akan bertambah besar. Hal ini terjadi pada tiap larutan yang di uji yaitu NaOH, NaCl dan NaBr. Begitu juga pada larutan dengan konsentrasi kecil, maka daya hantar listriknya akan semakin kecil.
Untuk melihat perbedaan tersebut, sebelumnya dilakukan dahulu pengenceran yang tujuannya adalah untuk memperbesar derajat ionisasi dari elektrolit lemah dan memperkecil daya tarik antar ion-ion pada elektrolit kuat. Oleh karena itu, daya hantar semakin besar pada pengenceran dan akan mencapai harga yang tertinggi pada saat pengenceran tak hingga.
Untuk elektrolit kuat, daya hantar listrik akan naik dengan cepat dengan naiknya konsentrasi suatu zat. Sedangkan untuk elektrolit lemah,daya hantar naik secara perlahan-lahan dengan naiknya konsentrasi. Perbedaan ini disebabkan karena elektrolit kuat akan terurai secara sempurna, sedangkan elektrolit lemah tidak mengalami hal yang serupa. Namun,baik pada elektrolit kuat maupun elektrolit lemah daya hantarnya akan semakin naik pada saat pengenceran dan mencapai harga yang maksimal pada pengenceran tak hingga.
Tetapi, pada percobaan kami hanya menguji pada tiga larutan yaiyu NaOH, NaCl, dan NaBr. Hal ini, karena pada saat praktikum mengalami banyak sekali kendala yaitu karena waktu untuk praktikum yang sedikit juga karena pada saat itu terjadi pemadaman listriik. Sehingga, kami kekurangan waktu untuk menguji semeua larutan yang seharusnya diuji pada praktikum kali ini.
Dari ketiga larutan tadi yaitu NaOH, NaCl dan NaBr telah kita ketahui bahwa ketiga larutan tersebut jenis larutan elektrolit kuat. Sehingga pada hasil percobaan dapat kita lihat bahwa daya hantar listriknya naik dengan cepat pada setiap kenaikan konsentrasi. Hal ini terjadi karena larutan elektrolit tersebut terionisasi secara sempurna.
Karena,pada praktikum ini kami tidak menggunakan larutan elektrolit lemah karena adanya kendala tadi, maka kami tidak dapat membedakan daya hantar listrik pada elektrolit kuat dengan larutan elektrolit lemah secar praktik.
Pada percobaan ini kita menggunakan NaCl dalam bentuk larutan bukan berupa padatan. Hal ini dilakukan karena NaCl dalam bentuk padatan tidak dapaat menghantarkan arus listrik, karena dalam bentuk padatan ion-ionnya tidak dapat bergerak bebas. Tetapi pada larutan NaCl ion-ionnya dapat bergerak dengan bebas karena pada saat NaCl dilarutkan dalam air, ion-ionnya yang tersusun rapat akan tertarik oleh molekul-molekul air dan air akan menyusup di sela-sela butir-butir ion tersebut yang kemudian terlepas satu sama lain dan bergerak bebas dalam larutan sehingga larutan NaCL dapat menghantarkan listrik.
Pada larutan NaCl dapat kita lihat bahwa daya hantar listriknya naik secara perlahan-lahan dengan naiknya konsentrasi. Hal ini berbeda pada larutan NaOH dan NaBr. Pada NaOH dan NaBr daya hantar listriknya naik dengan cepat pada konsentrasi yang lebih besar. Padahal ketiga larutan tersebut sama-sama merupakan larutan elektrolit kuat.
Terlihat pada larutan NaOH, nilai daya hantar listriknya berturut-turut 0,16 ; 1,04 ; 1,53 dan 8,19. Pada larutan NaBr daya hantar listrinya berturut-turut 0,21 ; 0,95 ; 1,79 dan 7,45. Dari hasil tersebut terlihat bahwa daya hantar listriknya naik dengan cepat. Sedangkan pada larutan NaCl nilai daya hantar listriknya berturut-turut 0,46 ; 0,23 ; 0,30 ;1,60. Dari hasil tersebut terlihat bahwa daya hantar listriknya naik turun dan juga pada setiap kenaikan konsentrasi daya hantar listriknya bergerak secara perlahan.
Pada penjabaran tersebut, dapat dinyatakan bahwa pada larutan NaCl tersebut terdapat kesalahan atau kekeliruan, entah itu kesalahan pada saat melihat skala pada konduktometer atau kesalahan praktikan saat melakukan pengenceran pada larutan tersebut. Kesalahan ini mungkin saja terjadi karena praktikan melakukan praktikum dalam ruangan yang gelap dan memungkinkan kesalahan dalam pembacaan skala dan juga waktu yang sedikit sehingga praktikan terlaru terburu-buru sehingga kurang teliti saat praktikum.
Dari hasil grafik yang didapat pada ketiga larutan terlihat bahwa grafik menunjukkan garis lurus dari kiri bawah ke kanan atas. Hal ini menunjukkan hubungan antara konsentrasi dengan nilai daya hantar listrik. Dimana semakin besar konsentrasi maka akan semakin besar pula nilai daya hanta listriknya.
IX. Kesimpulan
1. Daya hantar pada elektrolit kuat lebih besar dibandingkan dengan elektrolit lemah. Karena elektrolit kuat terionisasi secara sempurna.
2. Pengenceran dilakukan untuk memperbesar derajat ionisasi dari elektrolit lemah, dan memperkecil gaya tarik antar ion pada elektrolit kuat.
3. Untuk larutan elektrolit kuat, daya hantar listriknya naik dengan cepat pada konsentrasi yang lebih besar.
4. Untuk elektrolit lemah, daya hantarnya naik secara perlahan-lahan dengan naiknya konsentrasi.
5. Jumlah muatan suatu larutan berbanding lurus dengan daya hantar listriknya (DHL) , semakin besar jumlah muatan maka daya hantar listriknya (DHL) juga semakin besar.
X. Grafik 0 100 200 300 400 500 600 700 800 900 0 1 2 3 4 5 6
NaOH
Y 0 20 40 60 80 100 120 140 160 0 1 2 3 4 5 6NaCl
YXI. Daftar Pustaka
Agustina, Tuty emilia. 2011. Penuntun Praktikum Kimia Fisika II. Indralaya: LDB Universitas Sriwijaya.
Daniel . 1978. Kimia Fisika II. Jakarta:Erlangga
Keenan, Charles W, dkk. 1984. Kimia Untuk Universitas. Jakarta Erlangga. S.K, Dogra. 1999. Kimia Fisika. Jakarta: Universitas Indonesia.
0 100 200 300 400 500 600 700 800 0 1 2 3 4 5 6