PERCOBAAN VII
PENENTUAN DAYA HANTAR SUATU SENYAWA
I. Tujuan Percobaan
Menentukan jumlah muatan pada larutan sampel
II. Alat dan Bahan Alat yang digunakan
1. Conductivity meter 1 buah
2. Gelas beker 100 ml 8 buah
3. Gelas beker 600 ml 1 buah
4. Labu ukur 100 ml 2 buah
5. Labu ukur 50 ml 2 buah
6. Pengaduk kaca 2 buah
7. Gelas beker 250 ml 2 buah
8. Cawan kaca 1 buah
9. Pipet tetes 2 buah
Bahan yang digunakan
1. KCl 0,0556 gram 2. NaCl 0,0436 gram 3. KNO3 0,0753 gram 4. CuSO4. 5H2O 0,1873 gram 5. NiSO4.5H2O 0,1968 gram 6. CuCl2. 2H2O 0,1276 gram 7. MgCl2 0,1524 gram 8. FeCl3. 6H2O 0,2029 gram Gambar Alat
III. Dasar Teori
Di dalam penghantar besarnya arus listrik yaitu jumlah elektron yang mengalir persatuan waktu kecuali tergantung beda potensial juga tergantung dari tahanan penghantar. Tahanan penghantar ini tergantung dari jenis penghantar, temperature, penampung penghantar dan panjang penghantar (Sukardjo, 1990) :
R = ρ L/A
Suatu hambatan dinyatakan dalam ohm disingkat Ω, oleh karena itu DHL dinyatakan : DHL = 1/R = k A/L
Dimana:
k = 1/R x L/A
DHL disebut konduktivitas. Satuannya ohm-1 disingkat Ω-1, tetapi secara resmi satuan yang digunakan adalah siemen, disingkat S, dimana S = Ω-1 maka satuan k adalah Sm-1 atau SCm-1. Konduktivitas digunakan untuk ukuran larutan/cairan elektrolit. Konsentrasi elektrolit sangat menentukan besarnya konduktivitas, sedang konduktivitas sendiri tidak dapat dapat digunakan untuk ukuran suatu larutan. Ukuran yang lebih spesifik yaitu konduktivitas molar (∆m). Konduktivitas molar adalah konduktivitas suatu larutan apabila konsentrasi larutan sebesar satu molar, yang dirumuskan sebagai:
∆m = k/C Dimana,
k : Konduktivitas spesifik (SCm-1)
C : Konsentrasi larutan (mol/L)
∆m : Hantaran molar (SCm-2mol-1)
Jika satuan volume yang digunakan adalah cm3 maka persamaan yang digunakan adalah(Tim Kimia Anorganik II, 2013):
∆m = 1000k/C
Larutan elektrolit juga dapat menghantarkan arus listrik. Dalam menghantarkan arus listrik terjadi karena disebabkan oleh gerakan-gerakan ion kutub satu dengan kutub yang lain. Berbeda dengan penghantar logam, penghantar elektrolit tahanan akan berkurang bila temperature
naik. Jika larutan diencerkan, maka untuk elektrolit lemah, α-nya semakin besar dan untuk elektrolit kuat, daya tarik antar ion semakin kecil, karena itu A semakin besar pada pengenceran tak terhingga. Daya hantar pada pengenceran tak terhingga disimbolkan dengan ∆o (Rivai, 1995)
Konduktivitas molar elektrolit tidak tergantung pada konsentrasi. Jika K tepat sebanding dengan konsentrasi elektrolit. Walaupun demikian pada prakteknya, konduktivitas molar bervariasi terhadap konsentrasi, salah satu alasannya adalah jumlah ion dalam larutan mungkin tidak sebanding dengan konsentrasi larutan elektrolit, misalnya konsentrasi ion dalam larutan asam lemah tergantung pada konsentrasi asam secara rumit dan penduakalian konsentrasi nominal asam itu tidak mendua kalikan jumlah ion tersebut. Kedua, karena ion saling berinteraksi dengan kuat, maka konduktivitas larutan tidak tepat sebanding dengan jumlah ion yang ada. Pengukuran konduktivitas mula-mula pada konsentrasi menunjukkan adanya dua golongan elektrolit yaitu(Atkins, 1997).:
- Elektrolit kuat, konduktivitas mula-mula elektrolit kuat hanya sedikit berkurang dengan bertambahnya konsentrasi
- Elektrolit lemah, konduktivitas molar elektrolit lemah normal pada konsentrasi mendekati nol, tetapi turun tajam sampai nilai terendah saat konsentrasi bertambah
Daya hantar listrik suatu larutan tergantung dari (Bird, 1997):
1. Jumlah ion yang ada
Jumlah ion yang ada tergantung dari elektrolit (kuat/lemah) dan konsentrasi. Pengenceran larutan baik untuk elektroda memperbesar daya hantar dan mencapai harga maksimal pada pengancaran tak terhingga.
2. Kecepatan dari ion pada beda potensial antara kedua elektroda
Derajat ionisasi elektrolit lemah dapat ditentukan dengan pengukuran daya hantarnya. Seperti diketahui, daya hamtar berbanding lurus dengan jumlah ion yang ada dalam larutan.
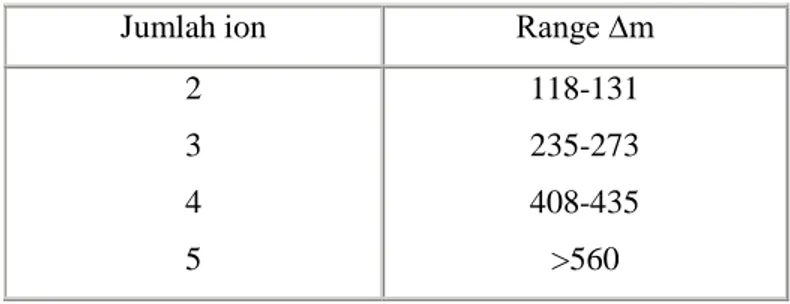
Tabel jumlah ion dan ∆m dalam pelarut air
Jumlah ion Range ∆m
2 3 4 5 118-131 235-273 408-435 >560
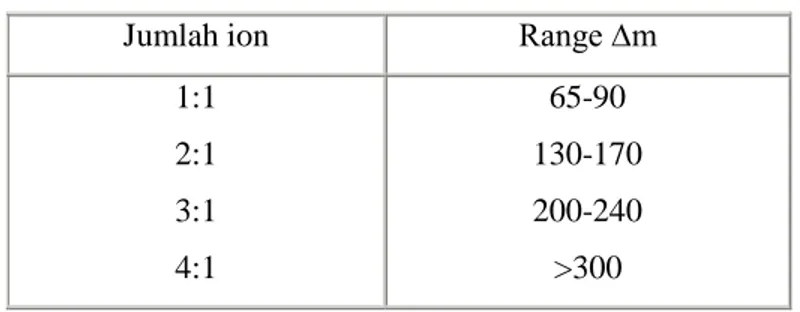
Tabel jumlah ion dan ∆m dalam pelarut DMF
Jumlah ion Range ∆m
1:1 2:1 3:1 4:1 65-90 130-170 200-240 >300
Daya hantar ekuivalen didefinisikan sebagai daya hantar satu gram ekuivalen suatu zat terlarut diantara 2 elektroda dengan jarak kedua elektroda 1 cm. Daya hantar ekuivalen pada larutan encer diberi simbol “0″ yang harganya tertentu untuk setiap ion (Sumar Hendayana, 1994).
IV. Cara Kerja
1. Menimbang sampel yang akan dilarutkan sesuai hasil perhitungan
2. Membuat larutan standart sampel (KCl, NaCl, KNO3, CuSO4.5H2O, NiSO4.6H2O, MgCl2, CuCl2.2H2O, dan FeCl3.6H2O) masing masing sebesar 5.10
-3
M dengan melarutkan sampel dalam labu ukur 100 ml dengan menambahkan aquades hingga batas
3. Menguji konduktifitas pelarut dengan mencelupkan konduktivity meter pada pelarut tersebut 4. Menguji konduktifitas larutan standart sampel dengan mencelupkan konduktivity meter pada
larutan tersebut
5. Mencatat hasil pengukuran pada tabel data percobaan
6. Membilas alat konduktivity meter dengan pelarut sebelum digunakan untuk menguji sampel yang lain
7. Mengolah data hasil percobaan untuk mengetahui konduktivitas molar suatu senyawa dalam pelarut aquades
V. Hasil Percobaan
VI. Pembahasan
Percobaan ini bertujuan untuk menentukan jumlah muatan pada larutan sampel. Untuk mengetahui jumlah muatan pada suatu larutan terlebih dahulu harus mengetahui hantaran molar larutan tersebut, hantaran molar larutan terbeut dapat diketahui nilainya dengan mencari nilai konduktifitas spesifik larutan menggunakan alata konduktimeter. Adapun prinsip dari percobaan adalah penentuan muatan pada suatu senyawa melalui pengukuran besarnya konduktifitas senyawa dalam pelarut tertentu dengan menggunakan alat konduktimeter (conductivity meter).
Larutan upun lemah mempunyai harga daya hantar listrik. Larutan elektrolit kuat mempunyai konduktifitas yang lebih besar karena ion-ion pada elektrolit kuat akan terdisosiasi sempurna menjadi ion yang menghantarkan arus. Disosiasi merupakan proses reversibel yang nilainya berbeda-beda pada setiap larutan.
Adapun senyawa yang akan dihitung konduktivitasnya adalah larutan standar dari KCl; NaCl; KNO3; CuSO4.5H2O; NiSO4.6H2O; CuCl2.2H2O; FeCl3.6H2O; MgCl2.6H2O. Penggunaan larutan standar tersebut dikarenakan larutan-larutan tersebut merupakan larutan elektrolit, yang dapat menghantarkan listrik. Adapun pelarut yang digunakan dalam percobaan ini adalah aquades
Konduktivitas Molar Akuades (s) Etanol (s)
0,07 x 10-3 0,00018 x 10-3
Larutan Konduktivitas Molar
Akuades (s) Etanol (s) MgCl2.6H2O 0,728 x 10 -3 0,0833 x 10-3 NiSO4.6H2O 0,924 x 10-3 0 KCl 0,763 x 10-3 0,1225 x 10-3 KNO3 0,686 x 10 -3 0,061 x 10-3 CuSO4.5H2O 0,955 x 10 -3 0,0413 x 10-3 NaCl 0,957 x 10-3 0,1191 x 10-3 FeCl3.6H2O 1,853 x 10 -3 0,1088 x 10-3 CuCl2.2H2O 0,844 x 10 -3 0,0183 x 10-3
dan etanol yang nantinya akan digunakan sebagai perbandingan besarnya konduktivitas pada pelarut yang berbeda.
Pembuatan larutan standar dilakukan dengan melarutkan sejumlah sampel dalam pelarut (baik aquades maupun etanol). Untuk pelarut aquades, larutan diencerkan menjadi 100 ml, sedangkan untuk pelarut etanol, larutan diencerkan menjadi 50 ml. Masing-masing larutan standar dibuat konsentrasinya menjadi 5x10-3 M.
Pengukuran dilakukan dengan alat konduktimeter. Prinsip dari alat konduktimeter yaitu pengukuran daya hantar listrik (DHL) dari larutan elektrolit sehingga dapat diketahui seberapa kuat suatu larutan dapat menghantarkan listrik. Konduktivitimeter memiliki dua buah elektroda inert. Apabila ke dalam larutan elektrolit diberikan dua buah elektroda inert dan diberikan tegangan listrik diantaranya maka anion anion akan bergerak ke elektroda positif (anoda) dan sebaliknya, kation-kation akan bergerak ke elektroda negative (kation).
Pada saat pengukuran, alat harus dikalibrasi terlebih dahulu dengan pelarut yang digunakan untuk melarutkan senyawa tersebut. Berdasarkan percobaan, diketahui besarnya konduktivitas pelarut aquades adalah 70 s dan konduktivitas pelarut etanol sebesar 1,8 s. Setelah diketahui konduktivitas dari masing-masing larutan standard dan pelarut yang digunakan, maka besarnya konduktivitas larutan yang sebenarnya dapat diketahui dengan persamaan:
K = Klarutan – Kpelarut
Konduktivitas larutan yang sebenarnya ditentukan dengan persamaan tersebut dikarenakan ion hidrogen dan hidroksi selalu ada dalam jumlah yang sedikit. Dengan
menggunakan persamaan: maka besarnya harga dapat diketahui sehingga jumlah muatan dari masing-masing sampel dapat ditentukan dan dapat dibandingkan secara teori. Semakin banyak jumlah ion, semakin banyak pula ion yang dapat menghantarkan listrik dalam larutan berarti semakin besar daya hantarnya. Beda potensial dari dua elektroda yaitu kecepatan ionnya dan perbedaan nilai DHL antara sesama elektrolit kuat ditentukan oleh seberapa banyak ion-ion nya terdisosiasi dapat pula mempengaruhi konduktivitas.
Dari persamaan menjelaskan bahwa konsentrasi larutan akan berbanding terbalik dengan nilai konduktifitasnya, hal tersebut terjadi karena dalam larutan yang pekat ion ion tidak akan terdisosiasi sempurna, sebaliknya jika larutan tersebut encer atau konsentrasinya kecil maka ion ionnya akan terdisosiasi sempurna pada pelarut yang digunakan sehingga ion ion tersebut akan menuju elektroda pada konduktimeter sehingga menunjukan nilai konduktifitas yang lebih besar, semakin banyak larutan terdisosiasi maka semakin banyak ion ionnya.
Beradasarkan perhitungan, diperoleh besarnya konduktivitas spesifik dan jumlah ion sebagai berikut:
Range daya hantar berdasarkan literatur:
Jumlah ion m (Scm2/mol) dlm pelarut
air Jumlah ion
m (Scm2/mol) dlm pelarut etanol 2 118-131 1 <25 3 235-273 2 30-100 4 408-435 3 110-130 5 > 560 4 >160
Sehingga berdasarkan percobaan
Berdasarkan teori
Larutan Hantaran Molar (Scm2/mol)
Jumlah Ion
Akuades Etanol Akuades Etanol KCl 138,6 24,14 3 1 NaCl 163,4 23,46 3 1 KNO3 123,2 11,86 2 1 CuSO4.5H2O 154,8 3,3 3 1 NiSO4.6H2O 170,8 -0,36 3 - CuCl2.2H2O 163 7,9 3 1 MgCl2.6H2O 131,6 16,3 3 1 FeCl3.6H2O 356,6 21,4 4 1
Beradasarkan percobaan dapat terlihat bahwa, besarnya konduktivitas atau daya hantar suatu senyawa akan berbanding lurus dengan besarnya muatan suatu senyawa, jadi semakin besar muatan senyawa maka semakin besar pula konduktivitasnya.
Adanya perbedaan harga hantaran molar dan jumlah ion secara literatur pada jumlah ion yang sama, hal ini dapat disebabkan karena larutan standar yang digunakan telah terkontaminasi, hal ini dapat terlihat pada saat pembuatan larutan standar, beberapa senyawa yang digunakan sudah berubah bentuk dari yang awalanya padatan kristal menjadi cair.
Dapat terlihat bahwa besarnya daya hantar molar masing-masing senyawa berbeda-beda, hal ini dapat disebabkan karena adanya perbedaan jari-jari atom dan jumlah ion, semakin besar jari-jari atom dan jumlah ion maka daya hantarnya semakin besar pula.
Berdasarkan pelarut yang digunakan, daya hantar dari setiap senyawa berbeda-beda. Senyawa dengan pelarut akuades memiliki daya hantar yang lebih besar daripada pelarut etanol, hal ini dapat disebabkan karena adanya perbedaan sifat pelarut yang digunakan, dimana aquades bersifat polar dan etanol bersifat semipolar. Pelarut dengan kepolaran lebih tinggi dapat menghantarkan listrik lebih kuat, berarti banyak ion ion yang terdapat di pelarut tersebut.
VII.Kesimpulan
1. Daya hantar listrik (konduktivitas) berbanding lurus dengan jumlah ion. Semakin besar jumlah ion dari suatu larutan, maka akan semakin tinggi nilai konduktivitas.
2. Pelarut mempengaruhi hantaran molar larutan karena adanya perbedaan sifat pelarut. Pelarut yang bersifat polar akan menghantarkan listrik lebih kuat sehingga hantaran molarnya lebih besar. Aquades lebih polar dibandingkan etanol.
3. Dari data hasil percobaan diperoleh konduktivitas dan jumlah ion pada larutan:
Larutan Hantaran Molar (Scm2/mol)
Jumlah Ion
Akuades Etanol Akuades Etanol
KCl 138,6 24,14 3 1 NaCl 163,4 23,46 3 1 KNO3 123,2 11,86 2 1 CuSO4.5H2O 154,8 3,3 3 1 NiSO4.6H2O 170,8 -0,36 3 - CuCl2.2H2O 163 7,9 3 1 MgCl2.6H2O 131,6 16,3 3 1 FeCl3.6H2O 356,6 21,4 4 1
Daftar Pustaka
Atkins, PW. 1997. Kimia Fisika Jilid 2 Edisi 4. Jakarta: Erlangga
Bird, Tony. 1987. Kimia Fisika untuk Universitas. Jakarta: Erlangga
Rivai, Harrizul. 1995. Asas Pemeriksaan Kimia. Jakarta : UI Press
Hendayana, Sumar. 1994. Kimia Analitik Instrumen Edisi Kesatu. Semarang : IKIP Semarang Press
Tim Kimia Anorganik. 2013. Modul Praktikum Kimia Anorganik II. Surakarta: FMIPA UNS
Sukardjo. 1990. Kimia Anorganik. Jakarta: PT. Rineka Cipta
Lampiran 1. Perhitungan 2. Laporan sementara
Surakarta, 4 Juni 2013 Mengetahui,
Asisten Pembimbing Praktikan