LAPORAN
PERSAMAAN ARRHENIUS DAN ENERGI AKTIVASI
I. Tujuan Percobaan
1. Mempelajari pengaruh suhu terhadap laju reaksi
2. Menghitung energi aktivasi (Ea) dengan menggunakan persamaan Arrhenius
II. Dasar Teori
Proses untuk mencapai keadaan transisi kompleks membutuhkan energi yang disuplai dari luar sistem. Energi inilah yang disebut dengan energi aktivasi (dalam kimia, disebut juga sebagai energi permulaan). Pada reaksi endoterm ataupun eksoterm, keduanya memiliki energi aktivasi yang positif, karena keadaan transisi kompleks memiliki tingkat energi yang lebih tinggi dari reaktan (Castellan, 1982)
Energi aktivasi adalah energi minimum yang dibutuhkan oleh suatu reaksi kimia agar dapat berlangsung. Energi aktivasi memiliki simbol Ea dengan E menotasikan energi dan a yang ditulis subscribe menotasikan aktivasi. Kata aktivasi memiliki makna bahwa suatu reaksi kimia membutuhkan tambahan energi untuk dapat berlangsung (Vogel,1994).
Dalam reaksi endoterm, energi yang diperlukan untuk memutuskan ikatan dan sebagainya disuplai dari luar sistem. Pada reaksi eksoterm, yang membebaskan energi, ternyata juga membutuhkan suplai energi dari luar untuk mengaktifkan reaksi tersebut (Atkins,1999).
Energi aktivasi biasanya dinotasikan dalam Ea, dan diberikan dalam satuan kj/mol. Menurut Arrhenius, tetapan laju bergantung pada suhu dan energi aktivasi berdasarkan persamaan berikut.
K = konstanta laju reaksi A = faktor frekuensi Ea = energi aktivasi
Persamaan tersebut analog dengan persamaaan garis lurus, yang sering disimbolkan dengan y = mx + c, maka hubungan antara energi aktivasi suhu dan laju reaksi dapat dianalisis dalam bentuk grafik ln k vs 1/T dengan gradien – (Ea/RT) dan intersep ln A (Tim Dosen Kimia Fisik,2011)
III. Alat dan Bahan 1. Alat
a. Rak tabung reaksi 1 buah b. Tabung reaksi 10 buah c. Gelas piala 600 ml 1 buah d. Pipet ukur 10 ml
e. Stopwatch
IV. Cara Kerja
a. Menyiapkan sistem sesuai yang tertera di bawah ini :
Tabung 1 berisi 5 mL lar.H2O2 dan 5 mL air
Tabung 2 berisi 10 mL lar.KI, 1 mL lar. Na2S2O3 dan 1 mL kanji
b. Kedua tabung reaksi diletakkan dalam gelas piala 600 ml yang berisi air sesuai dengan suhu pengamatan, sampai masing-masing tabung 1 dan tabung 2 suhunya sama sesuai dengan suhu pengamatan, untuk suhu pengamatan 0oC-20oC dilakukan dengan bantuan es.
2. Bahan
a. Na2S2O8 atau H2O2 0,04 M b. KI 0,1 M
V. Hasil Percobaan dan Pembahasan
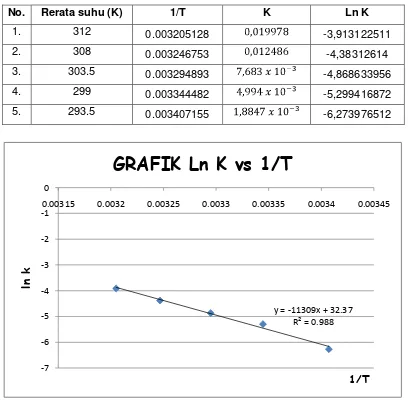
No. Rerata suhu (K) 1/T K Ln K
1. 312 0.003205128 -3,913122511
2. 308 0.003246753 -4,38312614
3. 303.5 0.003294893 -4,868633956
4. 299 0.003344482 -5,299416872
5. 293.5 0.003407155 -6,273976512
Percobaan ini dilakukan dengan mereaksikan antara larutan H2O2 yang diencerkan dengan aquades pada tabung 1 dan campuran KI, Na2S2O3 dan larutan amilum 1% pada tabung 2. Percobaan ini bertujuan untuk mempelajari pengaruh suhu terhadap laju reaksi dan menghitung energi aktivasi menggunakan persamaan Arrhenius. Sistem yang terdiri dari tabung 1 dan tabung 2 pertama kali harus disamakan suhunya. Suhu pengamatan dalam percobaan ini yaitu suhu 40˚C , 35˚C, 30˚C, 25˚C dan 20˚C.
Larutan amilum dalam percobaan ini digunakan sebagai indikator adanya I2. I2 akan bereaksi dengan amilum setelah Na2S2O3 pada campuran habis bereaksi dan hal ini dijadikan sebagai waktu akhir reaksi, waktu dimana muncul warna biru pertama kali (waktu awal reaksi saat kedua tabung dicampur). Larutan amilum yang digunakan dibuat sesaat sebelum percobaan karena larutan ini mudah rusak.
y = -11309x + 32.37
0.00315 0.0032 0.00325 0.0033 0.00335 0.0034 0.00345
ln
k
1/T
H2O2 berfungsi sebagai oksidator yang akan menjadi H2O sedangkan KI sebagai penghasil I2 jika direaksikan dengan H2O2. Reaksi yang diukur adalah reaksi hidrogen peroksida dengan ion iodida. Dalam hal ini, hidrogen peroksida dicampurkan bersamaan dengan iodida, ion tiosulfat dan amilum.
Ion iodida dan hidrogen peroksida akan bereaksi membentuk gas I2, gas tersebut akan bereaksi kembali dengan ion tiosulfat membentuk kembali ion iodida. Namun, dalam reaksi ini, tidak akan ada yodium yang dibebaskan sampai semua ion tiosulfat habis bereaksi. Dengan tambahan amilum, ion iodida yang terbentuk kembali akan bereaksi dengan amilum dan menghasilkan warna biru pada larutan.
Dari percobaan tersebut, variabel bebasnya adalah suhu sedangkan variabel terikatnya adalah waktu. Dan diperoleh semakin tinggi suhunya maka waktu reaksinya akan semakin cepat. Hal ini terjadi karena semakin tinggi suhu maka energi kinetik suatu partikel akan meningkat. Sehingga pergerakan partikel untuk menimbulkan tumbukan efektif semakin besar juga. Dan sebaliknya, jika reaksi dilakukan pada suhu rendah, reaksi akan semakin lambat. Suhu maksimum yang digunakan dalam percobaan ini adalah 40oC sebab pada suhu lebih dari 40oC, larutan amilum yang ada akan rusak, sehingga ion iodida yang terbentuk dari perubahan iodium tidak dapat terdeteksi dengan baik.
Dari percobaan diperoleh untuk suhu 40°C, waktu yang diperlukan yaitu 5 sekon, suhu 35°C = 8 sekon, 30°C = 13 sekon, suhu 25°C = 20 sekon, dan suhu 20°C = 53 sekon. Dari lima sistem dapat disimpulkan bahwa temperatur berbanding terbalik dengan waktu sesuai dengan teori karena reaksi berlangsung lebih cepat jika suhu tinggi akibat tumbukan semakin banyak karena gerakan yang semakin cepat dan komposisi H2O2 yang berubah menyebabkan waktu yang diperlukan lebih sedikit.
Perubahan suhu umumnya mempengaruhi harga tetapan laju k. Jika suhu dinaikan maka harga k akan meningkat dan sebaliknya. Dari harga k tersebut maka akan dapat dihitung energi aktivasi. Melalui proses perhitungan (analisis data pada lampiran) didapat data dalam grafik berikut.
Dari grafik Ln k dan 1/T tersebut diperoleh Ea = 94,023026 kJ/mol. Hubungan energi aktivasi dengan laju reaksi adalah berbanding terbalik. Semakin besar energi aktivasi maka laju reaksinya semakin lambat karena energi minimum untuk terjadi reaksi semakin besar.
semakin kecil dan semakin sedikit waktu yang diperlukan sehingga akan memperbesar harga laju reaksi. Hal ini sesuai dengan teori dimana energi aktivasi berbanding terbalik dengan laju reaksi.
Reaksi yang terjadi dalam percobaan ini yaitu : 2H2O2 2H2O + O2
I2 + 2S2O32- 2I- + S4O6
2-2H2O2 + 2I- + S4O62- I2 + 2H2S2O3 + 2O2
VI. Simpulan dan Saran 1. Simpulan
a) Peningkatan suhu pada rentang 20oC-40oC ternyata mempercepat laju reaksi
b) Energi aktivasi (Ea) reaksi dalam praktikum ini sebesar 94,023026 kJ/mol 2. Saran
Penggunaan termometer dan pengamatan perubahan warna (pada saat campuran larutan menjadi biru) harus benar-benar dilakukan dengan cermat untuk mendapatkan hasil praktikum yang akurat.
VII. Daftar Pustaka
Atkins PW. 1999. Kimia Fisika. “Ed ke-2 Kartahadiprodjo Irma I, penerjemah ; Indarto Purnomo Wahyu, editor. Jakarta : Erlangga. Terjemahan dari :
Physichal Chemistry.
Castellan GW. 1982. Physichal Chemistry. Third Edition. New York : General Graphic Services.
Tim Dosen Kimia Fisik. 2011. Diktat Petunjuk Praktikum Kimia Fisik. Semarang : Jurusan Kimia FMIPA UNNES.
Vogel. 1994. Kimia Analisis Kuantitatif Anorganik. Jakarta : Penerbit Buku Kedokteran (EGC).
Semarang, 24 September 2012 Mengetahui,
Dosen Pengampu Praktikan
Ir. Sri Wahyuni, M.Si Ana Yustika
VIII. Lampiran
No Suhu Awal (K) Suhu Akhir
Campuran (K)
Rata-Rata suhu (K)
Waktu reaksi (s) Tabung 1 Tabung 2 Campuran
1 313 313 313 311 312 5
2 308 308 308 308 308 8
3 303 303 303 304 303.5 13
4 298 298 298 300 299 20
5 293 293 293 294 293.5 53
1. Analisis Data (lengkap) a. Perhitungan
mgrek H2O2 = M . V . val
= 0,04 x 5 x 2 = 0,4 mgrek mgrek KI = M . V . val
= 0,1 x 10 x 1 = 1 mgrek mgrek Na2S2O3 = M . V . val
= 0,001 x 1 x 1 = 0,001 mgrek (pereaksi pembatas) Mgrek H2O2 yang bereaksi = mgrek Na2S2O3
b. Menghitung nilai k
Untuk t = 5 s
Untuk t = 8 s
Untuk t = 13 s
Untuk t = 20 s
c. Menghitung nilai 1/T Untuk T = 312 K
Untuk T = 308 K
Untuk T = 303,5 K
Untuk T = 299 K
Untuk T = 293,5 K
d. Perhitungan Ea
Dari kurva diperoleh persamaan y = - 11309 x + 32,37 ( y = mx + b ) m = -11309
Maka m = - Ea/R Ea = - ( m x R )
= - (-11309 x 8,314) = 94.023,026 J/mol = 94,023026 kJ/mol
2. Jawaban Pertanyaan