LAPORAN PRAKTIKUM KIMIA ORGANIK Judul : Ekstraksi Pigmen dan Analisia TLC-nya
Tujuan : - Mempelajari teknik pemisahan senyawa pigmen (karotenoid) dari sampel padatan - Mempeljari teknik pemisahan thin layer chromatography (TLC)
Pendahuluan
Tomat (Solanum lycopersicum syn. Lycopersicum esculentum) adalah tumbuhan keluarga Solanaceae, berasal dari Amerika Tengah dan Selatan, dari Meksiko sampai Peru. Tanaman tomat menyebar ke seluruh Amerika,terutama ke wilayah yang beriklim tropik, sebagai gulma. Penyebaran tanaman tomat ini dilakukan oleh burung yang makan buah tomat dan kotorannya tersebar kemana-mana.Penyebaran tomat ke Eropa dan Asia dilakukan oleh orang Spanyol. Tomat ditanam di Indonesia sesudah kedatangan orang Belanda. Tanaman tomat sudah tersebar ke seluruh dunia, baik di daerah tropik maupun subtropik. (Pracaya, 2012).
Tomat banyak mengandung senyawa-senyawa yang baik bagi kesehatan tubuh, namun demikian belum ada penelitian yang mengungkapkan tentang aktivitas ekstrak buah tomat sebagai penstabil oksigen singlet. Berdasarkan data tersebut, dilakukan penelitian yang bertujuan untuk menentukan aktivitas ekstrak buah tomat apel dan tomat biasa sebagai penstabil oksigen singlet menggunakan pelarut air dan etanol 40% dalam reaksi fotooksidasi asam linoleat dengan eritrosin sebagai sensitizer. Likopen atau yang sering disebut sebagai α-karoten adalah suatu karotenoid pigmen merah terang, suatu fitokimia yang banyak ditemukan dalam buah tomat dan buah-buahan lain yang berwarna merah. Pada penelitian makanan dan phytonutrien yang terbaru, likopen merupakan senyawa yang paling banyak diteliti. Karotenoid ini telah dipelajari secara ekstensif dan ternyata merupakan antioksidan yang sangat kuat dan memiliki kemampuan anti-kanker (Arab dan Steck, 2000).
adalah proses pemisahan pigmen dari suatu bahan campurannya dalam jaringan tumbuhan menggunakan suatu pelarut (Hendayana, 2006).
Ekstraksi pigmen dapat dilakukan dengan beberapa teknik, salah satunya adalah dengan menggunakan teknik kromatografi lapis tipis. Kromatografi adalah prinsip pemisahan campuran senyawa atas komponen-komponen berdasarkan perbedaan kecepatan migrasi komponen pada dua fase, yakni fase diam dan fase gerak. Perbedaan kemampuan masing-masing komponen diadsorpsi dan perbedaan distribusi dua fase yang tidak saling bercampur (partisi). Sampel dalam teknik kromatografi yang merupakan campuran dari berbagai macam komponen ditempatkan dalam situasi dinamis dalam sistem yang terdiri dari fase diam dan fase gerak. Semua pemisahan pada kromatografi tergantung pada gerakan relatif dari masing-masing komponen diantara kedua fase tersebut. Senyawa atau komponen yang tertahan lebih lemah oleh fase diam akan bergerak lebih cepat daripada komponen yang satu dengan lainnya disebabakan oleh perbedaan dalam adsorbsi, partisi, kelarputan atau penguapan diantara kedua fase (Hendayana, 2006).
Kromatografi kertas secara umum dilakukan dengan menotolkan larutan yang berisi sejumlah komponen pada jarak 0,5 sampai 1cm dari tepi kertas. Kertas tersebut bagian bawahnya dicelupkan dalam larutan pengambang (developing solution) setelah penetesan larutan pada kertas. Larutan ini umumnya terdiri atas campuran beberapa pelarut organik yang telah dijenuhkan dengan air. Sistem ini akan terserap oleh kertas dan sebagai akibat dari gaya kapiler akan merambat sepanjang kertas tersebut. Rambatan ini dapat diusahakan dalam modus naik atau menurun. Proses pemisahan yang sedang dilakukan, sistem secara keseluruhannya akan disimpan dalam tempat tertutup, ruang didalamnya telah jenuh dengan uap sistem pelarut ini (Day & Underwood, 2006). Aplikasi TLC sangat luas. Senyawa–senyawa yang tidak menguap serta terlalu labil untuk kromatografi cair dapat dianalisis dengan TLC. TLC juga dpat memeriksa adanya zat pengotor dalam pelarut. Ahli kimia forensik menggunakan TLC untuk bermacam–macam pemisahan. Pemisahan berguna dari plastiaser, antioksidan dan tinta. TCL ini penggunaannya juga meluas dalam pemisahan organik (Khopkar, 1990).
Material Safety Data Sheet (MSDS) Aseton (C3H6O)
sedangkan titik lelehnya adalah -95,35 °C. Temperatur kritis aseton adalah 235 °C. massa jenis aseton adalah 0,79 (air=1). Tekanan uap aseton pada suhu 20 °C adalah 24 kPa, sedangkan densitas uapnya adalah 2. Aseton mudah larut dalam air dingin dan air panas. Pertolongan pertama jika aseton terkena mata adalah segera cuci mata dengan air mengalir selama 15 menit (Anonim, 2017).
Heksana (C6H14)
Sifat fisik dan kimia heksana adalah berwujud cair, berbau seperti petroleum, tidak berasa dan tidak berwarna. Titik didi heksana adalah 68°C, sedangkan titik lelehnya adalah -95°C. massa jenis heksana adalah 0,66 (air=1). Tekanan uap heksana adalah 17,3 kPa pada suhu 20°C. Densitas uap heksana adalah 2,97 (air=1). Heksana mudah larut dalam dietil eter dan aseton. Heksana tidak mudah larut dalam air panas atau air dingin. Pertolongan pertama jika terhirup heksana segera pindah ke ruang terbuka dan beri oksigen jika sulit bernafas (Anonim,2017).
Prinsip Kerja
Prinsip kerja dari percobaan adalah memisahkan zat warna dari ekstrak tumbuhan menggunakan kromatografi kertas berdasarkan gaya kapilaritas sehingga diperoleh kromatogram.
Alat
Mortar, pestle, spatula, tabung reaksi, chamber TLC, gelas ukur, pipet tetes, pinset, penggaris, lampu UV.
Bahan
Aseton, kertas saring, pelarut aseton:heksana (3:7), lempeng silika
Prosedur Kerja
dalam tabung reaksi atau vial 5 mL (sampel 1). Siapkan kolom kromatografi dengan melarutkan atau membentuk bubur silika terlebih dahulu. Kemudian bubur silika dimasukkan kedalam kolom (pipet Pasteur yang telah disumbat dengan kapas pada bagian ujung bawahnya). dialirkan eluen atau pelarut aseton:heksana (3:7) kedalam kolom silika sehingga penampakan packing kolom baik dan rapat. Dimasukkan sampel 1 sebanyak 1 mL kedalam kolom, lalu lewatkan eluen jika sampel sudah tersisa sedikit diatas kolom. Ditampung isolat pigmen (sampel 2) dalam gelas ukur sesuai dengan warna pita ekstrak yang lewat dalam kolom. Siapkan chamber TLC dan ditempatkan pada pelarut aseton:heksana (3:7) kira-kira setinggi 0.5 cm. Diletakkan lempeng silika ukuran tertentu, yang sebelumnya telah ditotolkan sedikit sampel ekstrak: sampel 1 dan sampel 2 (±1 cm dari batas bawah kertas), pada TLC chamber. Lalu tutup chamber dan tunggu pergerakan pelarut hingga sampai batas atas (± 0.5 cm dari batas atas kertas). Ambil lempeng dengan menggunakan pinset dan keringanginkan, jika sudah kering, amati pemisahan pigmen yang terjadi pada lempeng menggunakan sinar UV. Diukur jarak yang ditempuh senyawa dan pelarut tersebut. Dihitung factor retensi (Rf) untuk masing-masing komponen.
Waktu yang dibutuhkan
No Kegiatan Waktu
1 Preparasi alat dan bahan 15 menit
2 Memasukkan sampel pada kolom dan menampung isolate pigmen
65 menit
3 Pengamatan ekstrak pada chamber TLC 20 menit 4 Pengamatan spot menggunakan sinar UV 20 menit
Waktu total
Data dan Perhitungan
Perhitungan Nilai Rf (faktor retensi) untuk Setiap Komponen
Rf = jarak yang ditempuh ole h fasa gerak darititik asaljarak yang ditempu h ole h senyawa dari titik awal
Rf = 0,45cmcm
Tabel Hasil No
. Perlakuan Hasil Gambar
1 Proses penghalusan
bayam Bayam lembut
2 +5 mL aseton Ekstrak bayam berwarna hijau tua
3 Proses kromatografi lapis tipis
4 Penotolan sampel hasil KLT pada plat silika
Jarak noda sebesar = 0.4 cm
Jarak asal pelarut = 5 cm
5. Hasil dari KLT dibawah
pengamatan sinar UV Jarak noda terlihat
Pembahasan
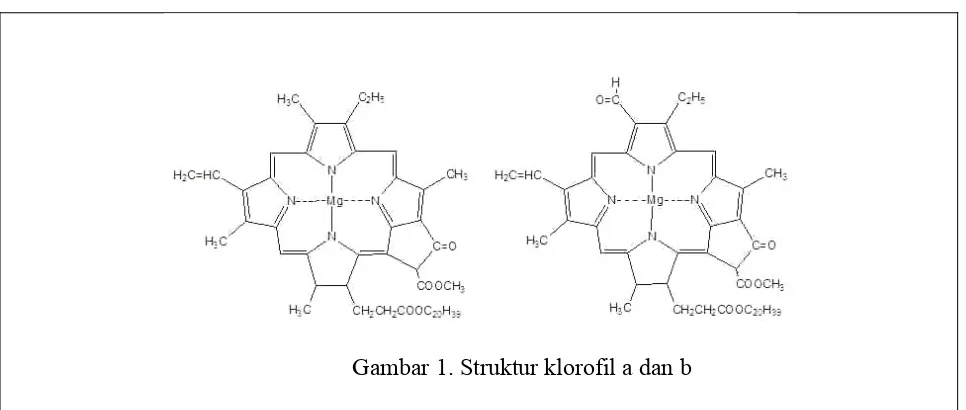
Gambar 1. Struktur klorofil a dan b
Prinsip kerja dari percobaan ini adalah memisahkan zat warna dari ekstrak tumbuhan menggunakan kromatografi kertas berdasarkan gaya kapilaritas sehingga diperoleh kromatogram. Kapilaritas merupakan peristiwa naik turunnya permukaan zat cair dalam suatu pipa kapiler, namun dalam praktikum ini digunakan pelat silika sebagai media pergerakan zat cair. Pemisahan campuran senyawa atas komponen-komponen juga berdasarkan perbedaan kecepatan migrasi komponen pada dua fase, yakni fase diam dan fase gerak. Perbedaan kemampuan masing-masing komponen diadsorpsi dan perbedaan distribusi dua fase yang tidak saling bercampur (partisi) antara fase gerak dan fase diam.
Perlakuan pertama dilakukan pembuatan atau ekstraksi pigmen dari sampel. Sampel terlebih dahulu dihaluskan. Sampel dihaluskan untuk memudahkan proses ekstraksi. Sampel setelah dihaluskan dilakukan penimbangan seberat 10 g. proses setelah penimbangan adalah ekstraksi. Ekstraksi adalah proses pemisahan suatu bahan dari campurannya, biasanya dengan menggunakan pelarut. Ekstraksi dapat dilakukan dengan berbagai cara. Ekstraksi menggunakan pelarut didasarkan pada kelarutan komponen terhadap komponen lain dalam campuran. Pelarut polar akan melarutkan solut yang polar dan pelarut non polar akan melarutkan solut yang non. Ekstraksi pigmen pada sayur bayam pada bagian daunnya digunakan pelarut aseton sebanyak 10 mL. Tahapan setelah ekstraksi adalah pemisahan padatan dengan pigmen yang telah terlarut dalam aseton melauli metode filtrasi menggunakan kertas saring. Filtrat yang didapat ditampung dalam tabung reaksi. Filtrat inilah yang merupakan pigmen dari daun sayur bayam.
bagian bawahnya dicelupkan dalam larutan pengambang (developing solution) setelah penetesan larutan pada kertas. Larutan ini umumnya terdiri atas campuran beberapa pelarut organik yang telah dijenuhkan dengan air. Larutan pengembang dalam percobaan ini adalah aseton : heksan 7:3. Larutan pengembang akan terserap oleh kertas pelat silika dan sebagai akibat dari gaya kapiler larutan pengembang akan merambat sepanjang kertas pelat silika tersebut. Rambatan ini dapat diusahakan dalam modus naik dengan cara meletakkan pelat silika sedikit miring dala chamber. Proses pemisahan yang sedang dilakukan, diusahakan sistem secara keseluruhannya disimpan dalam tempat tertutup menggunakan wrapping plastic, ruang didalamnya dibuat jenuh dengan uap sistem pelarut ini. Hal ini bertujuan untuk menghindari terjadinya penguapan larutan pengembang serta adanya gangguan dari kondisi di luar chamber
Proses setelah larutan pengembang merambat sampai tanda batas, kertas pelat silika diangkat dari chamber dan dikeringkan dalam suhu ruang. Uji kualitatif noda-noda (spot-spot) fase diam dalam kertas pelat silika dapat dilakukan dengan dua cara, yaitu dengan cara kimia dan fisika. Cara kimia dilakukan dengan mereaksikan noda kromatogram (spot dalam kertas pelat silika) dengan pereaksi tertentu yang memberikan warna spesifik. Uji kualitatif noda kromatogram cara fisika adalah dengan menggunakan sinar UV, dimana terjadi proses adsorpsi radiasi oleh noda kromatogram atau fluoresensi. Percobaan kali ini uji kualitatif dilakukan dengan cara fisika. Kertas pelat silika yang terdapat noda kromatogram diuji menggunakan sinar UV. Pigmen yang terkandung dalam daun sayur bayam jika dilihat dari warna spot yang didapat adalah klorofil b. hal ini dikarenakan warna spot pada klorofil adalah hija kekuningan. Hasil jarak yang didapat dari pergerakan fase diam dari tik awal adalah sepanjang 0,4 cm. Nilai Rf sampel yang didapat dari hasil perhitungan adalah sebesar 0,08 cm . nilai Rf yang didapat dari hasil percobaan ini tidak sesuai dengan nilai Rf berdasarkan standar yang nilainya berkisar antara 0,48-0,56. Hal ini dapat terjadi karena proses ekstraksi yang kurang sempurna. Ekstraksi yang kurang sempurna dikarenakan pigmen yang terkestrak tidak keseluruhan akibat kurangnya pengadukan saat proses ekstraksi.
Kesimpulan
didasarkan pada kelarutan komponen terhadap komponen lain dalam campuran. Pelarut polar akan melarutkan solut yang polar dan pelarut non polar akan melarutkan solut yang non polar. Ekstraksi pigmen dapat dilakukan dengan beberapa teknik, salah satunya adalah dengan menggunakan teknik kromatografi lapis tipis. Kromatografi adalah prinsip pemisahan campuran senyawa atas komponen-komponen berdasarkan perbedaan kecepatan migrasi komponen pada dua fase, yakni fase diam dan fase gerak dalam suatu pelat silika. Kromatografi lapis tipis dapat ditentukan nilai Rf nya. Berdasarkan percobaan nilai Rf yang diperoleh adalah sebesar 0,08 cm.
Referensi
Arab L dan Steck S. 2000. Lycopene and cardiovascular disease. Am J Clin Nutr: 71(suppl):1691S–5S. American Society for Clinical Nutrition.
Day, R. A. and A. L. Underwood. 2002. Analisis Kimia Kuantitatif Edisi Keenam. Jakarta: Erlangga.
Hendayana, Sumar. 2006. Kimia Pemisahan Metode Kromatografi dan Elektrolisis Modern, Bandung: PT. Remaja Rosdakarya.
Khopkar. SM. 1990. Konsep Dasar Kimia Analitik, Jakarta: Universitas Indonesia Press. Pracaya, Ir. 2012. Bertanam Tomat. Yogyakarta: Kanisius
Saran
Saran dari praktikum ekstraksi pigmen dan analisa TLC nya yaitu pada saat proses ekstraksi pengadukan dilakukan lebih teiti lagi, sehingga lebih banyak pigmen yang terlarut. Praktikan harus memahami langkah kerja dari percobaan ini dan mempelajari literatur lain yang berhubungan dengan percobaan ini.