1
I. TUJUAN PERCOBAAN
1.1 Memahami prinsip distilasi.
1.2 Memisahkan campuran aseton-air (1:1) dengan distilasi biasa dan distilasi bertingkat.
1.3 Memurnikan larutan metanol-air (1:1) dengan distilasi azeotrop.
1.4 Menentukan indeks bias zat murni hasil distilasi biasa, distilasi bertingkat, dan distilasi azeotrop.
II. WAKTU PERCOBAAN
Hari, Tanggal : Jumat, 07 Februari 2014 Pukul : 13.00 s.d. 17.00 WIB
III. DASAR TEORI
Distilasi merupakan salah satu metode yang sangat baik untuk memurnikan zat cair. Pada percobaan ini akan dilakukan pemisahan campuran zat cair dengan cara distilasi biasa, distilasi bertingkat, dan distilasi azeotrop. Distilasi sederhana adalah proses distilasi yang tidak melibatkan kolom fraksinasi atau proses yang biasanya untuk memisahkan salah satu komponen zat cair dari zat-zat non-valatil atau zat cair lainnya yang perbedaan titik didihnya paling sedikit 75oC. Kondensat pada dasarnya akan memiliki perbandingan mol fasa cair yang sama dengan fasa uap pendidihan dari fasa cairnya. Distilasi sederhana tidak efektif untuk memisahkan komponen-komponen dalam campuran yang perbedaan titik didihnya tidak terlalu besar.
Jika suatu kolom fraksinasi digunakan dala perangkat distilasi, maka pemisahan senyawa-senyawa yang memiliki titik didih berdekatan dapat dipisahkan dengan baik. Proses distilasi ini disebut distilasi bertingkat. Kolom fraksinasi biasanya diisi dengan material berpori yang menyediakan luas permukaan lebih besar untuk proses kondensasi berulang. Pengembunan uap bertitik didih tinggi melepaskan kalor yang menyebabkan penguapan zat cair bertitik didih lebih rendah pada kolom, sehingga komponen bertitik didih rendah ini bergerak ke atas menuju kolom, sementara komponen bertitik didih tinggi bergerak ke bawah ke arah kondensor, walaupun sebagian kecil ada yang kembali turun ke dalam labu distilasi.
2 Pemasangan termometer pada set peralatan distilasi pun perlu diperhatikan, baik distilasi sederhana maupun bertingkat. Ujung termometer harus tepat berada di persimpangan menuju kondensor agar suhu yang teramati adalah benar-benar suhu uap senyawa yang diamati. Pada proses destilasi, penyimpangan pengukuran dapat terjadi karena adanya pemanasan yang berlebihan (superheating) serta kesalahan dalam penempatan pengukur suhu (termometer) tidak pada posisi yang benar. Pada percobaan ini termometer kami pasangkan sebaik mungkin.
Azeotrop merupakan larutan dari dua atau lebih komponen dengan perbandingan
tertentu, di mana komposisi ini tetap/tidak bisa diubah lagi dengan cara destilasi sederhana. Kondisi ini terjadi karena ketika azeotrop di didihkan, uap yang dihasilkan juga memiliki perbandingan konsentrasi yang sama dengan larutannya semula akibat ikatan antar molekul pada kedua larutannya. Seperti saat kita mendestilasi memisahkan alkohol dengan etanol dengan distilasi biasa. Pada hasilnya etanol dengan air tetap bercampur. Keadaan ini terjadi karena ketika azeotrop dididihkan, uap yang dihasilkan juga memiliki perbandingan konsentrasi yang sama dengan larutannya semula akibat ikatan antar molekul pada kedua larutannya. Pada dasarnya azeotrop dibagi menjadi dua jenis :
a. Azeotrop positif
Jika titik didih campuran azeotrop kurang dari titik didih salah satu larutan konstituennya, contoh campuran 95,63 etanol dan 4,37 % air, etanol mendidih pada suhu 78,4 OC sedangkan air mendidih pada suhu 100 OC, tetapi campurannya/ azeotropnya mendidih pada suhu 78,2 OC.
b. Azeotrop Negatif
Jika titik didih campuran azeotrop lebih dari titik didih konstituennya atau salah satu konstituennya. Contoh campuran asam klorida pada konsentrasi 20,2 % dan 79,8 % air. Asam klorida (murni) mendidih pada suhu -84OC, tetapi campuran azeotropnya memiliki titik didih 110OC.
Salah satu teknik untuk memecah titik azeotrop adalah dengan penambahan komponen lain untuk menghasilkan azeotrop heterogen yang dapat mendidih pada suhu lebih rendah, misalnya penambahan toluen ke dalam campuran air dan alkohol. Contoh campuran heterogen yang mengandung titik azeotrop yang paling populer adalah
3 campuran ethanol-air, campuran ini dengan metode distilasi biasa tidak bisa menghasilkan ethanol teknis (99% lebih) melainkan maksimal hanya sekitar 96,25 %. Hal ini terjadi karena konsentrasi yang lebih tinggi harus melewati terlebih dahulu titik azeotrop, dimana komposisi kesetimbangan cair-gas ethanol-air saling bersilangan.
IV. SIFAT FISIK DAN KIMIA BAHAN
4.1 Metanol (CH3OH)
- Mudah terbakar, mudah menguap, terlarut sempurna dalam air
- Nama IUPAC : metanol - Momen dipol : 1,69 D - Massa molar : 32,04 g/mol - Densitas : 0,7918 g/mL - Titik Lebur : -97oC - Titik didih : 64,7oC - Indeks bias metanol : 1,726
4.2 Aseton (CH3COCH3)
- Cairan tidak berwarna, mudah terbakar, cairan pembersih, pelarut
- Nama IUPAC : propanon - Momen dipol : 2,91 D - Massa molar : 58,08 g/mol - Densitas : 0,79 g/mL - Titik Lebur : -94,9oC - Titik didih : 56,53oC - Indeks bias aseton murni : 1,360
4.3 Toluena (C6H5CH3)
- Cairan tidak berwarna, aromatik, obat inhalan, dapat memabukkan
- Nama IUPAC : methylbenzene - Momen dipol : 0,36 D - Massa molar : 92,14 g/mol - Densitas : 0,8669 g/mL
4 - Titik Lebur : -93oC - Titik didih : 110,6oC 4.4 Benzena (C6H6)
- Cairan tidak berwarna, mudah terbakar, aromatik, dapat menyebabkan iritasi kulit.
- Nama IUPAC : 1,3,5-sikloheksatriena - Momen dipol : 0D - Massa Molar : 78,1121 g/mol - Densitas : 0,8786 g/mL - Titik Lebur : 5,5oC - Titik Didih : 80,1oC - Kelarutan (dalam air): 0,8 g/L (25oC)
V. BAGAN ALIR PERCOBAAN
5.1 Kalibrasi Termometer
Gelas kimia 400 mL diisi air dan es (10cm)
celup termometer (7-8 cm)
catat suhu Jika skala suhu
stabil -1oC s.d. 1oC Dalam trayek termometer layak digunakan Diluar trayek ganti, ulangi kalibrasi
5 5.2 Distilasi Sederhana
5.3 Distilasi Bertingkat
Set peralatan distilasi sederhana
40 mL aseton-air dalam
labu + pengaduk magnet panaskan
tetesan pertama keluar catat
suhunya ganti penampung dengan
yang bersih dan kering
catat suhu dan volume distilat
pada selang volume tertentu dalam labu 3-4 mLvoluem cairan
hentikan distilasi ukur indeks bias
distilat bandingkan
Set peralatan distilasi bertingkat
40 mL aseton-air dalam
labu + pengaduk magnet panaskan
tetesan pertama keluar catat
suhunya ganti penampung dengan
yang bersih dan kering
catat suhu dan volume distilat pada selang volume tertentu
voluem cairan dalam labu 3-4 mL
hentikan distilasi ukur indeks bias
distilat bandingkan
6 5.4 Distilasi Azeotrop
VI. ALAT DAN BAHAN
6.1 Alat
- Set peralatan distilasi sederhana - Set peralatan distilasi bertingkat - Gelas Kimia
- Termometer
- Labu bundar - Gelas ukur
- Batang pengaduk magnet - Pemanas listrik 6.2 Bahan - Es - Air/aquades - Aseton - Benzena/Toluena - Metanol
Set peralatan distilasi bertingkat
25 mL metanol-air dalam labu
+ toluene + pengaduk magnet panaskan
tetesan pertama keluar catat
suhunya ganti penampung dengan
yang bersih dan kering
catat suhu dan volume distilat
pada selang volume tertentu terbentuk 2 fasa cairan
ambil fasa atas dengan pipet lanjutkan distilasi
jika volume cairan dalam labu
3-4 mL
hentikan
7
VII. CARA KERJA DAN PENGAMATAN
Cara Kerja Pengamatan
4.1 Kalibrasi Termometer
a) Gelas kimia 400 mL diisi dengan bongkahan es kecil
hingga kedalaman 10 cm. -
b) Menambahkan sedikit air dingin sampai sebagian
bongkahan mengambang di permukaan air. - c) Termometer dicelupkan (kedalaman 7-8 cm) -
d) Air es diaduk pelan-pelan dengan termometer. Amati penurunan skala pada termometer.
Skala pada termometer turun secara perlahan.
e) Ketika suhu tidak turun lagi (stabil dalam 10–15 detik), catat skala suhu yang teramati.
Termometer pertama : Termometer kedua : f) Jika skala suhu terbaca berada pada trayek -1oC s.d.
1oC, termometer layak pakai. Jika berada di luar trayek, ganti termometer dan kalibrasi ulang.
Skala termometer yang pertama tidak berada pada trayek -1oC s.d 1oC, sehingga kami mengganti termometernya dengan yang baru 4.2 Distilasi Sederhana
a) Memasang peralatan distilasi sederhana. Pemasangan peralatan distilasi agak lama, karena fitting antara statif, klem, dan alat lainnya kurang pas. b) Memasukkan 40 mL campuran aseton-air (1:1) ke
dalam labu (maksimum setengah volume labu). - c) Batang pengaduk magnet dimasukkan. - d) Mulai lakukan pemanasan dengan pemanas listrik
sambil pengadukan otomatis. -
e) Atur pemanasan agar distilat menetes secara teratur. Skala suhu pada display digital alat pemanas diatur dari suhu 200-300. Skala yang ditampilkan pada display pemanas listrik meragukan.
8 g) Ganti penampung dengan yang bersih dan kering
untuk menampung distilat murni.
Penampung tidak diganti karena sebelumnya sudah dibersihkan dan kami anggap sudah bersih dan kering.
h) Catat suhu dan volume distilat secara teratur setiap selang jumlah penampungan tertentu.
(data hasil percobaan ditulis pada bab berikutnya)
i) Hentikan distilasi apabila sisa campuran dalam labu
tinggal 3-4 mL (jangan sampai kering). - 4.3 Distilasi Bertingkat
a) Memasang peralatan distilasi bertingkat. Pemasangan peralatan distilasi agak lama, karena fitting antara statif, klem, dan alat lainnya kurang pas. b) Memasukkan 40 mL campuran aseton-air (1:1) ke
dalam labu (maksimum setengah volume labu). - c) Lakukan proses distilasi seperti proses pengerjaan
distilasi sederhana.
Tetesan pertama jatuh pada T=33oC (data hasil percobaan ditulis pada
bab berikutnya) 4.4 Distilasi Azeotrop
a) Memasang peralatan distilasi bertingkat. Set peralatan percobaan distilasi bertingkat digunakan kembali. b) Masukkan ± 25 mL metanol-air (1:1) ke dalam labu
bundar 100 mL, lalu tambahkan toluena sebanyak setengah dari volume tersebut.
-
c) Lakukan distilasi secara teratur, dengan mencatat suhu setiap selang tertentu volume distilat yang didapat.
(data hasil percobaan ditulis pada bab berikutnya)
d) Ganti penampung saat kira-kira sudah mencapai titik didih zat murni.
Penampung tidak diganti karena sebelumnya sudah dibersihkan dan kami anggap sudah bersih dan kering.
9 e) Jika distilat yang tertampung membentuk dua fasa
cairan, pisahkan fasa atas dan tampung di wadah yang bersih dan kering.
Ketika volume distilat kira-kira 3 mL, dua fasa cairan terlihat jelas. Namun semakin bertambahnya distilat, terlihat hanya satu fasa cairan (dua fasa saling melarutkan). f) Ukur volume masing-masing fasa secara terpisah. Fasa atas distilat tidak kami
pisahkan. Distilasi dilanjutkan sampai akhir.
g) Hentikan distilasi apabila sisa campuran dalam labu
tinggal 3-4 mL (jangan sampai kering). -
VIII. PENGOLAHAN DATA HASIL PERCOBAAN
8.1 Distilasi Sederhana
Tetesan pertama jatuh pada T = 34,0oC
Tabel Suhu danVolume Distilat Hasil Distilasi Sederhana Volume Distilat (mL) Suhu (oC)
5,0 52,0
10,0 54,0
15,0 55,0
18,6 56,0
19,5 56,0
Indeks bias distilat :
Pengukuran pertama : 1,360
Pengukuran kedua : 1,358
Rata-rata, : 1,359 (ndistilat) Indeks bias aseton murni : 1,360 (naseton) Error :
𝐸𝑟𝑟𝑜𝑟 =|𝑛𝑑𝑖𝑠𝑡𝑖𝑙𝑎𝑡− 𝑛𝑎𝑠𝑒𝑡𝑜𝑛|
𝑛𝑎𝑠𝑒𝑡𝑜𝑛 𝑥 100% =
|1,359 − 1,360|
10 8.2 Distilasi Bertingkat
Tetesan pertama jatuh pada T = 33,0oC
Tabel Suhu danVolume Distilat Hasil Distilasi Bertingkat Volume Distilat (mL) Suhu (oC)
5 mL 32,0
Indeks bias distilat : 1,351(ndistilat) Error : 𝐸𝑟𝑟𝑜𝑟 = |𝑛𝑑𝑖𝑠𝑡𝑖𝑙𝑎𝑡− 𝑛𝑎𝑠𝑒𝑡𝑜𝑛| 𝑛𝑎𝑠𝑒𝑡𝑜𝑛 𝑥 100% = |1,351 − 1,360| 1,360 𝑥 100% = 0,66% 8.3 Distilasi Azeotrop
Tetesan pertama jatuh pada T = 63,0oC
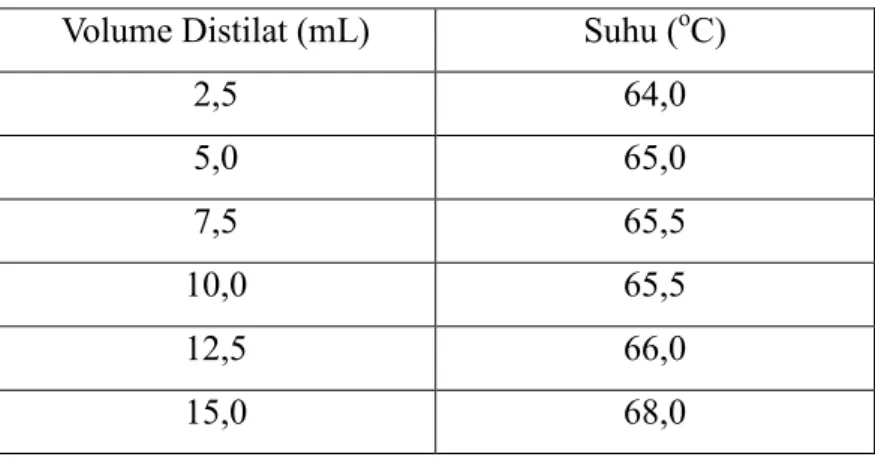
Tabel Suhu danVolume Distilat Hasil Distilasi Azeotrop Volume Distilat (mL) Suhu (oC)
2,5 64,0 5,0 65,0 7,5 65,5 10,0 65,5 12,5 66,0 15,0 68,0
Indeks bias distilat :
Pengukuran pertama : 1,340
Pengukuran kedua : 1,350
Rata-rata, : 1,345 (ndistilat) Indeks bias metanol : 1,726 (nmetanol) Indeks bias toluena : 1,477 (ntoluena)
11
IX. PEMBAHASAN
9.1 Prinsip Distilasi
Prinsip dasar destilasi yakni perbedaan titik didih dari komponen-komponen yang terdapat dalam campuran zat cair tersebut sehingga zat (senyawa) yang memiliki titik didih terendah akan menguap lebih dahulu, kemudian apabila didinginkan akan mengembun pada kolom kondensor lalu menetes sebagai zat murni atau destilat (pada kenyataannya masih terkandung komponen lainnya, namun sedikit). Fungsi kondensor yang terselubung air mengalir di bagian luarnya yaitu untuk mempercepat proses pengembunan uap yang mencapai kolom kondensor. Distilasi bertingkat dapat digunakan dalam pemisahan zat/senyawa yang memiliki perbedaan titik didih yang berdekatan dengan zat lain dalam campuran tersebut. Sedangkan distilasi sederhana hanya dapat digunakan untuk campuran yang komponen-komponennya memiliki perbedaan titik didih yang cukup jauh. Hal ini disebabkan karena adanya kolom fraksinasi pada distilasi bertingkat. Pada percobaan ini, pemisahan campuran aseton-air (perbedaan titik didihnya 43,47oC) diuji dengan destilasi sederhana dan destilasi bertingkat.
9.2 Kalibrasi Termometer
Pada percobaan ini, termometer pertama yang kami uji tidak layak, karena trayek skala yang teramati ketika skala suhu stabil berada di atas 1oC, yakni ± 1,5oC. Hal ini mungkin disebabkan karena rusaknya termometer akibat seringnya penggunaan. Oleh karena itu kami ganti dengan termometer lain dan mengkalibrasinya. Skala suhu yang teramati ketika skala stabil yakni ± 0,5oC, sehingga layak untuk digunakan (berada pada trayek -1oC s.d. 1oC) untuk percobaan selanjutnya.
9.3 Percobaan Distilasi Sederhana
Berdasarkan data hasil percobaan, tetesan pertama yang keluar (suhu yang teramati 34oC) berbeda sejauh 22,5oC dengan titik didih aseton (56,5oC). Tetesan pertama yang kami amati ini bukan tetesan distilat yang diharapkan, karena selisih suhu yang sangat jauh. Tetesan tersebut kemungkinan besar adalah embun air pada kolom kondensor (dinding dalam) yang sudah ada sebelum percobaan dan tidak
12 kami keringkan dahulu. Tetesan yang kami anggap distilat mulai menetes optimal pada skala suhu mendekati 52oC. Pada saat tersebut, selisih skala suhu yang teramati dengan titik didih aseton yakni sebesar 4,5oC, tetesan distilat tidak menetes pada suhu mendekati titik didih aseton. Hal ini dapat terjadi diantaranya karena tidak pasnya pemasangan termometer yang menyebabkan suhu yang terdeteksi tidak sesuai dengan prinsip.
Dari hasil percobaan, galat antara indeks bias distilat dengan indeks bias aseton murni hanya 0,136%. Hal ini mengindikasikan bahwa distilat mengandung kira-kira 99,864% aseton murni. Bila dilihat dari perbedaan titik didih aseton dengan air yang cukup jauh, pemisahan aseton-air sangat baik walaupun hanya dengan proses distilasi sederhana.
9.4 Percobaan Distilasi Bertingkat
Percobaan distilasi bertingkat yang kami lakukan tidak berjalan dengan lancar, pemasangan peralatan yang kurang baik menyebabkan kami melakukan percobaan distilasi ini hanya sampai perolehan distilat 5mL. Set peralatan tidak erat dan hampir lepas, sehingga kami memberhentikannya dan membetulkan set peralatan distilasi bertingkat untuk digunakan pada percobaan berikutnya (distilasi azeotrop). Hal ini menyebabkan data percobaan yang didapat kurang baik pada sesi ini. Namun galat yang terjadi berdasarkan perbedaan indeks bias distilat dengan aseton murni kecil, yakni 0.66% saja. Hal ini menunjukkan bahwa distilat yang dihasilkan belum benar-benar murni, mungkin saja ada air yang ikut terkondensasi.
10.5 Percobaan Distilasi Azeotrop
Pada sesi percobaan ini, campuran azeotrop metanol-air (1:1) akan dipisahkan. Sebelum didistilasi, campuran ditambah dengan toluena. Hal ini bertujuan agar metanol cenderung membentuk azeotrop dengan toluene, sehingga pemisahan metanol dengan air akan lebih mudah.
Setelah didihkan, distilat pertama mulai menetes pada temperature 63oC. Secara organoleptis, distilat pada suhu 64oC berupa cairan dua fasa yang keruh, artinya temperature ini merupakan titik didih dari campuran azeotrop antara ketiga komponen, yakni air, metanol dan toluene. Terbentuknya dua fasa cairan
13 disebabkan karena perbedaan kepolaran. Diduga pada saat distilat baru sedikit terbentuk, dua fasa itu adalah toluena (nonpolar, momen dipol=0,36D), dan metanol (polar, momen dipol=1,69D) serta sedikit air. Pada saat tersebut kami tidak memisahkan kedua fasa tersebut dengan pipet, distilasi malah dilanjutkan. Seharusnya kami memisahkan dahulu kedua fasa tersebut. Semakin bertambahnya jumlah distilat, distilat menjadi satu fasa dan semakin bening.
Indeks bias distilat (1,345) bukan merupakan indeks bias metanol (1,726), toluena (1,477), maupun air. Hal ini dapat terjadi diantaranya karena tidak dipisahkannya dua fasa cair ketika distilat pertama terbentuk, atau mungkin juga jumlah toluene yang ditambahkan masih kurang untuk memperkecil ikatan antarmolekul metanol dan air.
X. KESIMPULAN
Prinsip dasar destilasi yakni perbedaan titik didih dari komponen-komponen yang terdapat dalam campuran zat cair tersebut sehingga zat (senyawa) yang memiliki titik didih terendah akan menguap lebih dahulu, kemudian apabila didinginkan akan mengembun pada kolom kondensor lalu menetes sebagai zat murni atau destilat (pada kenyataannya masih terkandung komponen lainnya, namun sedikit).
Proses distilasi sederhana hanya dapat memisahkan komponen-komponen yang memiliki perbedaan titik didih yang cukup jauh saja, sedangkan distilasi bertingkat dapat digunakan untuk komponen-komponen yang titik didihnya berdekatan juga.
Pada distilasi azeotrop metanol-air, penambahan toluene sangat perlu agar gaya antarmolekul metanol-air dapat terminimalkan dengan cenderungnya metanol membentuk azeotrop dengan toluene.
Indeks bias distilati hasil distilasi sederhana aseton-air (1:1) : 1,359 % Error = 0,136%
Indeks bias distilati hasil distilasi bertingkat aseton-air (1:1) : 1,351 % Error = 0,66%
14
XI. DAFTAR PUSTAKA
Mayo, D.W., Pike, R.M., Trumper, P.K., (1999), Microscale Organic Laboratory with Multistep and Multiscale Syntheses, 4th edition, John Wiley and Sons, Inc., New York, hal. 169-179.
http://eksplorasisemesta.blogspot.com
diakses pada tanggal 13 Februari 2014, Pukul 14.30 WIB.
http://www.chem-is-try.org/materi_kimia/kimia.kesehatan/senyawa-hidrokarbon/sifat-sifat