1
SINTESIS DAN KARAKTERISASI SENYAWA KOMPLEKS DARI PERAK NITRAT DENGAN LIGAN CAMPURAN
TRI-o-TOLILFOSFINA DAN TIOUREA Sukma Hidayatullah, Fariati,Effendy
Jurusan Kimia, FMIPA,Universitas Negeri Malang Jalan Semarang 5, Malang 65145
E-mail: [email protected]
ABSTRAK: Sintesis senyawa kompleks dari AgNO3 dengan ligan campuran otp dan tu
pada perbandingan stoikiometri sebesar 1 : 1 : 1 dalam pelarut campuran 4 mL metanol dan 3 mL asetonitril, menghasilkan kristal-kristal tidak berwarna. Hasil pengukuran daya hantar listrik dan uji kualitatif ion nitrat berdasarkan metode Aliase Devarda menunjukkan bahwa senyawa kompleks hasil sintesis merupakan senyawa ionik. Analisis EDX memberikan rumus empiris C22H25AgN3O3PS. Berdasarkan rumus
empiris tersebut maka senyawa hasil sintesis merupakan senyawa kompleks ionik yang terdiri dari AgNO3, otp, dan tu dengan perbandingan 1 : 1 : 1. Kemungkinan rumus
kimia dari senyawa kompleks hasil sintesis adalah [Ag(otp)(tu)]NO3 dan
[Ag(otp)(μ-tu)]2(NO3)2. Perhitungan energi bebas menunjukkan bahwa senyawa
kompleks [Ag(otp)(μ-tu)]2(NO3)2 memiliki energi bebas lebih rendah. Berdasarkan fakta
tersebut dapat disimpulkan bahwa senyawa kompleks hasil sintesis adalah [Ag(otp)(μ-tu)]2(NO3)2, dengan kation kompleks [Ag(otp)(μ-tu)]22+ memiliki geometri
trigonal planar terdistorsi di sekitar atom pusatnya.
Kata kunci:struktur, sintesis,senyawa kompleks, AgNO3, tri-o-tolilfosfina, tiourea
ABSTRACT: Synthesis coordination compound of AgNO3 with mixed ligands of otp
and tu on 1 : 1 : 1 stoichiometry ratio in mixed solvent consisting of 4 mL methanol and 3 mL acetonitrile, produces colorless crystals. Result of electrical conductivity measurement and qualitative nitrate test based on Devarda Aliase method indicate that the obtained compound is an ionic one. EDX analysis gives empirical formula of C22H25AgN3O3PS. Based on this empirical formula, the compound obtained is an ionic
coordination compound consisting of AgNO3, otp, and tu with 1 : 1 : 1 ratio. The
possible chemical formulas of this compound are [Ag(otp)(tu)]NO3 and
[Ag(otp)(μ-tu)]2(NO3)2. Calculation of free energy indicates that [Ag(otp)(μ-tu)]2(NO3)2
has lower free energy. Based on the fact, it can be concluded that the coordination compound obtained is [Ag(otp)(μ-tu)]2(NO3)2 with the cation of [Ag(otp)(μ-tu)]22+
having distorted trigonal planar geometry about its center atom.
Keywords: synthesis, structure, coordination compound, AgNO3, tri-o-tolylphosphine
and thiourea
Perak nitrat dapat membentuk senyawa kompleks dengan ligan PPh3 (Stein
dan Knobler, 1977; Harker dan Tiekink, 1989; Ajibade, 2013; Bruce dan Duffy, 1986; Barron dkk., 1986) dan ligan tu (Ahmad dkk., 2002 dan Bowmaker dkk., 2009). Selain itu, AgNO3 juga dapat membentuk senyawa kompleks dengan ligan
campuran PPh3 dan tu pada stoikiometri sebesar 1 : 1 : 1 yang memiliki rumus
kimia [Ag(PPh3)(μ-tu)(ONO2)]2.[Ag(PPh3)(μ-tu)]2(NO3)2 (Isab dkk.,2010). Dalam
kisi kristal senyawa kompleks tersebut terdapat dua macam senyawa, yaitu dimer molekuler [Ag(PPh3)(μ-tu)(ONO2)]2 yang memiliki geometri tetrahedral
terdistorsi di sekitar atom pusatnya dan dimer ionik [Ag(PPh3)(μ-tu)]2(NO3)2
dengan kation kompleks [Ag(PPh3)(μ-tu)]22+ yang memiliki geometri trigonal
planar terdistorsi di sekitar atom pusatnya. Pada kedua dimer tersebut tu berlaku sebagai ligan jembatan.
2
Tri-o-tolilfosfina (otp) merupakan turunan dari PPh3. Otp merupakan ligan
yang lebih ruah dibandingkan PPh3 karena adanya substituen gugus metil di posisi
orto pada gugus fenil. Adanya substituen tersebut akan menghasilkan dua macam
efek, yaitu efek sterik dan efek elektronik. Efek sterik akan menyebabkan atom P pada ligan otp lebih sulit didonorkan ke atom pusat dibandingkan atom P pada ligan PPh3. Efek elektronik dihasilkan oleh gugus metil karena ia merupakan
gugus pendorong elektron (gugus +I). Efek elektronik ini menyebabkan rapatan elektron pada atom P di ligan otp lebih besar dibandingkan rapatan elektron pada atom P di ligan PPh3. Efek sterik menyebabkan ligan otp cenderung lebih lemah
dibandingkan ligan PPh3. Sebaliknya, efek elektronik menyebabkan ligan otp
cenderung lebih kuat dibandingkan ligan PPh3.
Hasil-hasil penelitian menunjukkan bahwa pada ligan otp efek sterik lebih dominan dibandingkan efek elektronik (Di Nicola dkk., 2007). Hal tersebut
berdasarkan data perbandingan panjang ikatan Ag-P pada senyawa kompleks [Ag(O2NO)(N,N’-bq)(PPh3)] dan [Ag(O2NO)(N,N’-bq)(otp)] (Di Nicola dkk.,
2007). Panjang ikatan Ag-P pada senyawa kompleks [Ag(O2NO)(N,N’-bq)(otp)]
adalah 2,419 Å. Ikatan tersebut adalah lebih panjang daripada ikatan Ag-P pada senyawa kompleks [Ag(O2NO)(N,N’-bq)(PPh3)], yaitu sebesar 2,363 Å karena
untuk mengurangi efek tolakan antarligan akibat lebih ruahnya struktur ligan otp daripada PPh3.
Senyawa kompleks [Ag(PPh3)(μ-tu)(ONO2)]2.[Ag(PPh3)(μ-tu)]2(NO3)2
disintesis dengan menggunakan AgNO3 : PPh3 : tu dengan perbandingan mol
sebesar 1 : 1 : 1 (Isab dkk., 2010). Senyawa kompleks dari AgNO3 dengan ligan
otp dan tu untuk stoikiometri 1 : 1 : 1 belum disintesis. Kekuatan ligan PPh3 dan
otp dapat dianggap tidak banyak berbeda. Hal ini dapat dijadikan sebagai alasan
bahwa senyawa kompleks dari AgNO3 dengan otp dan tu dapat disintesis pada
perbandingan mol sebesar 1 : 1 : 1. Tujuan penelitian adalah mensintesis senyawa kompleks tersebut dan menentukan strukturnya berdasarkan analisis EDX dan
HyperChem versi 8.0. Berdasarkan strukturnya maka dapat dijelaskan pengaruh
dari gugus metil terhadap struktur senyawa kompleks yang dihasilkan. Metodologi
Alat
Alat-alat yang digunakan adalah tabung reaksi, klem, statif, manice, spatula, kaca arloji, pipet tetes, corong kaca, alumunium foil, karet gelang, kertas saring, bak ultrasonik Branson 1510, neraca analitik Sartorius Element ELT 103, alat ukur titik lebur Fisher Scientific, konduktometer Omega Engineering INC, dan SEM-EDX FEI Inspect S-50-AMETEK.
Bahan
Bahan yang digunakan sebagian besar tergolong pro-analysis (p.a) Merck,
Germany, seperti AgNO3, tu, otp, CH3OH, CH3CN, dan KNO3, kecuali H2O yang
3 Eksperimen
Penelitian terdiri dari dua tahap, pertama sintesis senyawa kompleks dari AgNO3 dengan ligan campuran otp dan tu pada stoikiometri sebesar 1 : 1 : 1.
Kedua, karakterisasi senyawa hasil sintesis yang meliputi uji titik lebur, daya hantar listrik (DHL), uji kualitatif ion nitrat, SEM-EDX, dan analisis energi bebas menggunakan program HyperChem versi 8.0.
Sintesis Senyawa Kompleks
Sintesis senyawa kompleks dilakukan dengan menambahkan larutan tu (0,0190 g; 0,2500 mmol; 2 mL CH3OH) ke dalam tabung reaksi berisi campuran
AgNO3 (0,0425 g; 0,2500 mmol; 2 mL MeOH) dan otp (0,0760 g; 0,2500 mmol;
3 mL CH3CN). Campuran ditutup dengan aluminium foil dan digetarkan di bak
pencuci ultrasonik selama 30 menit pada temperatur 28 C. Aluminium foil
dilubangi sebesar jarum, kemudian dibiarkan pada temperatur 7 C (almari es) dan diperoleh kristal tidak berwarna setelah lima hari.
Karakterisasi Senyawa Kompleks Hasil Sintesis
Uji titik lebur digunakan untuk mengetahui terbentuk atau tidaknya senyawa baru. Jenis senyawa baru, ionik atau molekuler, diidentifikasi dengan membandingkan DHL senyawa kompleks yang diperoleh terhadap DHL pelarut dan AgNO3.Pelarut yang digunakan adalah campuran 6 mL metanol dan 4,5 mL
asetonitril. Uji kualitatif ion nitrat dilakukan untuk mendukung hasil analisis DHL. Rumus empiris senyawa kompleks didasarkan pada perbandingan terkecil persentase atom dan massa unsur penyusun senyawa hasil analisis SEM-EDX (Scanning Electron microscopy Energy Dispersive X-Ray). Kemungkinan struktur yang diperoleh berdasarkan hasil DHL dan rumus empiris dihitung energi bebas menggunakan program HyperChem versi 8.0. Struktur senyawa yang dipilih adalah yang memiliki energi bebas terendah.
Hasil dan Pembahasan
Sintesis Senyawa Kompleks AgNO3 : otp: tu
Data uji titik lebur menunjukkan bahwa reaski antara AgNO3, otpdan tu
dengan perbandingan mol sebesar 1 : 1 : 1 dalam pelarut campuran 4 mL metanol dan 3 mL asetonitril menghasilkan kristal-kristal tidak berwarna dan berbentuk prisma. Sesuai dengan teori medan kristal, kompleks dari ion logam d10 tidak berwarna karena orbital d terisi penuh sehingga tidak terjadi transisi elektron pada orbital d-d.
Karakterisasi Senyawa Hasil Reaksi antara AgNO3, otp,dantu
Karakterisasi senyawa hasil sintesis adalah didasarkan atas uji titik lebur, uji daya hantar listrik, uji kualitatif ion nitrat, analisis SEM-EDX, dan analisis
HyperChem versi 8.0. Hasil karakterisasi senyawa kompleks diberikan pada
4 ∆
Tabel 1. Hasil Karakterisasi Senyawa Kompleks Hasil Sintesis
Karakterisasi Hasil Titik lebur Kompleks AgNO3 otp tu (C)
Melebur pada 158, terdekomposisi pada 160 210-212
124-126 176-178
Analisis daya hantar listrik
Kompleks AgNO3
Pelarut (CH3OH dan CH3CN) Uji kualitatif ion nitrat
(μS) 153,867 124,867 5,490 Positif Analisis EDX Ag P S N O C (%At) 2,43 (3,23) 2,46 (3,23) 2,87 (3,23) 7,48 (9,68) 8,43 (9,68) 76,33 (70,95) Analisis EDX Ag P S N O C (%Wt) 16,53 (19,63) 4,96 (5,82) 5,61 (5,64) 8,51 (7,64) 6,60 (8,73) 57,79 (48,00)
Analisis HyperChem versi 8.0
Energi bebas
Kemungkinan struktur [Ag(tu)(otp)]NO3
Kemungkinan struktur [Ag(μ-tu)(otp)]2(NO3)2
(kkal/mol) -69115,971468 -141013,511503
Keterangan: %At = persentase atomik, %Wt = persentase massa angka yang dicetak miring merupakan persentase atom dan massa secara teoritis
Analisis daya hantar listrik yang diberikan pada Tabel 1, menunjukkan bahwa senyawa kompleks hasil sintesis merupakan senyawa ionik. Hal tersebut didukung oleh uji kualitatif ion nitrat berdasarkan metode Aliase Devarda. Keberadaan ion nitrat diidentifikasi dengan terbentuk gas NH3 yang dapat
membirukan kertas lakmus merah. Hasil uji kualitatif ion nitrat menunjukkan hasil positif. Reaksi uji kualitatif ion nitrat tersebut dituliskan pada persamaan reaksi (1).
3NO3-(aq)+ 8Al(s) + 5OH-(aq) + 18H2O(aq) → 3NH3(g) + 8[Al(OH)4]-(aq).
Persamaan reaksi uji kiualitatif ion nitrat (1)
Hasil analisis SEM-EDX didapatkan perbandingan persentase atom Ag : P : S sebesar 2,43 : 2,87 : 2,46 dengan perbandingan terkecil adalah 1 : 1 : 1, sehingga memiliki prediksi rumus empiris, yaitu C22H25AgN3O3PS. Dari rumus
empiris tersebut maka senyawa hasil sisntesis merupakan senyawa kompleks ionik yang terdiri dari AgNO3, otp dan tu dengan perbandingan 1 : 1 : 1. Senyawa
5
hasil sintesis merupakan senyawa kompleks dengan dua kemungkinan struktur, yaitu monomer ionik [Ag(otp)(tu)]NO3 dan dimer ionik [Ag(otp)(μ-tu)]2(NO3)2.
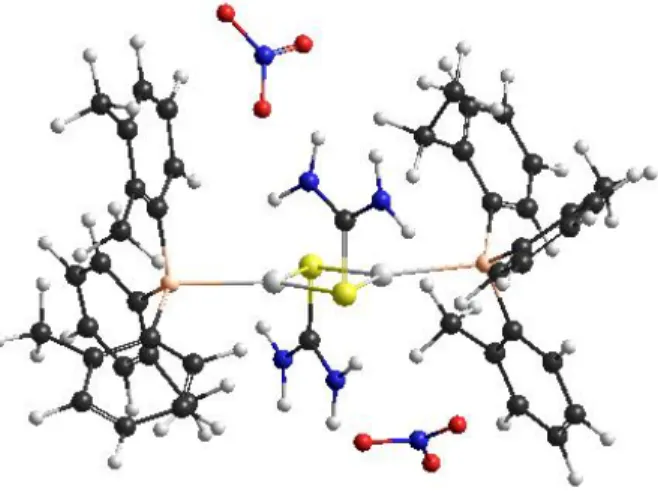
Berdasarkan hasil analisis HyperChem versi 8.0 melalui metode semi-empiris, energi bebas struktur monomer ionik (-69115,971468 kkal/mol)adalah lebih tinggi daripada struktur dimer ionik (-141013,511503 kkal/mol). Oleh karena itu, senyawa kompleks hasil sintesis memiliki kemungkinan struktur dimer ionik dengan tu sebagai ligan jembatan seperti yang diberikan pada Gambar 1.
Gambar 1. Kemungkinan Struktur Dimer Ionik Kompleks Hasil Sintesis Berdasarkan
HyperChem versi 8.0
Berdasarkan hasil karakterisasi dapat ditulis persamaan reaksi sintesis
menggunakan pelarut campuran 4 mL metanol dan 3 mL asetonitril seperti pada persamaan (2).
2 AgNO3 + 2 otp + 2 tu → [Ag(otp)(μ-tu)]2(NO3)2(s)
Analisis HyperChem versi 8.0 juga memberikan informasi panjang dan sudut ikatan kompleks hasil sintesis seperti yang ditunjukkan pada Tabel 2. Sudut ikatan P-Ag-S sebesar 132,372 lebih besar dari sudut normal trigonal planar (120). Berdasarkan sudut ikatan tersebut senyawa kompleks hasil sintesis memiliki struktur trigonal planar terdistorsi akibat struktur ligan tu dan otp yang ruah. Penyimpangan sudut normal trigonal planar pada senyawa kompleks hasil sintesis adalah lebih besar daripada kompleks [Ag(PPh3)(μ-tu)]2(NO3)2
(P-Ag-S = 127,583) (Isab dkk., 2010) akibat dari struktur otp yang lebih ruah daripada PPh3. Data panjang ikatan Ag-P hasil analisis HyperChem versi 8.0 pada
senyawa kompleks hasil sintesis adalah 2,45822 Å. Panjang ikatan Ag-P tersebut adalah lebih panjang daripada panjang ikatan Ag-P pada kompleks
[Ag(PPh3)(μ-tu)]2(NO3)2, yaitu 2,41571 Å (Isab dkk., 2010) karena untuk
mengurangi efek tolakan akibat ruahnya ligan otp. Berdasarkan hal tersebut dapat disimpulkan bahwa pada senyawa kompleks hasil sintesis efek sterik ligan otp lebih dominan daripada efek elektronik.
6
Tabel 2. Panjang dan Sudut Ikatan Senyawa Kompleks Hasil Sintesis
Parameter [Ag(otp)(μ-tu)]2(NO3)2
Panjang ikatan (Å) Ag(1)-P(1) Ag(2)-P(2) Ag(1)-S(1) Ag(1)-S(2) Ag(2)-S(1) Ag(2)-S(2) (Å) 2,45822 2,45579 2,36000 2,36000 2,36000 2,36000 Sudut ikatan () P(1)-Ag(1)-S(1) P(1)-Ag(1)-S(2) S(1)-Ag(1)-S(2) P(2)-Ag(2)-S(1) P(2)-Ag(2)-S(2) S(1)-Ag(2)-S(2) C(1)-S(1)-Ag(1) C(1)-S(1)-Ag(2) C(2)-S(2)-Ag(1) C(2)-S(2)-Ag(2) Ag(1)-S(1)-Ag(2) Ag(1)-S(2)-Ag(2) () 132,372 132,372 95,2564 132,372 132,372 95,2564 115,248 115,248 115,248 115,248 84,7436 84,7436 Penutup
Senyawa kompleks dari AgNO3 dengan ligan campuran otp dan tu pada
stoikiometri sebesar 1 : 1 : 1 merupakan senyawa kompleks ionik dengan rumus kimia [Ag(otp)(μ-tu)]2(NO3)2. Kation kompleks dari senyawa tersebut adalah
[Ag(otp)(μ-tu)]22+ yang merupakan dimer ionik dengan geometri di sekitar atom
pusat adalah trigonal planar terdistorsi. Perlu dilakukan analisis XRD-single
crystal untuk memperoleh struktur kompleks yang absolut.
Daftar Rujukan
Ahmad, S., Isab, A.A. & Perzanowski, H.P. 2002. Silver(I) Complexes of Thiourea. Transition Metal Chemistry, 27: 782-785.
Ajibade, P.A. 2013. Synthesis and Crystal Structure of
(Nitrato-O.O’)-bis(triphenylphosphine)-silver(I) Toluene Mono-solvate. International
Journal of Physical Siences, 8(1): 12-15.
Barron, P.F., Dyason, J.C. & Healy, P.C. 1986. Lewis Base Adducts of Group 11 Metal. Part 24. Co-ordination of Triphenylphosphine with Silver Nirate. A Solid-state Cross-polarization Magic Angle Spinning 31P Nuclear Magnetic Resonance, Crystal Structure, and Infra Red Spectroscopy Study of Ag(PPh3)nNO3 (n = 1-4). Dalton Transition, 5: 1965-1970.
Bowmaker, G.A., Skelton, B.W. & White, A.H. 2009. Structural and Infrared Spectroscopic Studies of some Novel Mechanochemically Accessed Adducts of Silver(I) Oxyanion Salts with Thiourea. Inorganic
7
Bruce, M.I. & Duffy, D.N. 1986. Chemistry of the Group-1B Metals. XVIII. Crystal and Molecular Structures of
Nitratotris(Triphenylphosphine)Silver(I), Ag(O2NO)(PPh3)3.Australian
Journal of Chemistry, 39(10): 1691-1695.
Di Nicola, C., Effendy, Marchetti, F., Pettinari, C., Skelton, B.W. & White, A.H. 2007. Synthesis and Structural Characterization of Adducts of Silver(I) Nitrate with ER3 (E = P, As, Sb; R = Ph, cy, o-tolyl, mes) of
2,2’-bipyridyl, L, AgNO3:ER3:L (1:1:1). Inorganica Chimica Acta, 360:
1433-1450.
Harker, C.S.W. & Tiekink, E.R.T. 1989. Nitratobis(triphenylphosphine)silver(I) Benzene Solvate (1/1). Acta Crystallography, C45: 1815-1817.
Isab, A.A., Nawaz, S., Saleem, M., Altaf, M., Monimmul-Mehboob, M., Ahmad, S. & Evans, H.S. 2010. Synthesis, Characterization and Antimicrobial Studies of Mixed Ligand Silver(I) Complexes of Thioureas and Triphenylphosphine; Crystal Structure of
{[Ag(PPh3)(tiourea)(NO3)]2.[Ag(PPh3)2(tiourea)]2(NO3)2}. Polyhedron,
29: 1251-1256.
Stein, R.A. & Knobler C. 1977. Crystal and Molecular Structure of a 1 : 1 Complex of Silver Nitrate and Triphenylphosphine, AgNO3.P(C6H5)3.