SINTESIS DAN KARAKTERISASI MATERIAL MAGNETIK BERBASIS SENYAWA KOMPLEKS INTI GANDA NIKEL(II) DENGAN 2,2’-BIPIRIDIN MENGGUNAKAN LIGAN JEMBATAN OKSALAT
SKRIPSI
NATALIA DWI CHRISTIANTI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
Pembimbing II
Harsasi Setyawati, S.Si, M.Si NIK. 139 080 769
Pembimbing I
Dra. Hartati, M.Si
NIP. 19591115 198703 2 002
SINTESIS DAN KARAKTERISASI MATERIAL MAGNETIK BERBASIS SENYAWA KOMPLEKS INTI GANDA NIKEL(II) DENGAN 2,2’-BIPIRIDIN MENGGUNAKAN LIGAN JEMBATAN OKSALAT
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada
Fakultas Sains dan Teknologi Universitas Airlangga
Oleh :
NATALIA DWI CHRISTIANTI
NIM : 080810630
Tanggal lulus :
6 Agustus 2012
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Sintesis dan Karakterisasi Material Magnetik Berbasis Senyawa Kompleks Inti Ganda Nikel(II) dengan 2,2’-Bipiridin Menggunakan Ligan Jembatan Oksalat Penyusun : Natalia Dwi Christianti
NIM : 080810630
Pembimbing I : Dra. Hartati M.Si
Pembimbing II : Harsasi Setyawati, S.Si, M.Si Tanggal ujian : 6 Agustus 2012
Disetujui Oleh :
Pembimbing I,
Dra. Hartati, M.Si NIP. 19591115 198703 2 002
Pembimbing II,
Harsasi Setyawati, S.Si, M.Si NIK. 139 080 769
Mengetahui,
Ketua Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seijin penyusun dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Segala puji dan syukur pada Tuhan Yesus Kristus yang telah mengaruniakan kasih karunia dan hikmat-Nya sehingga penyusun dapat menyelesaikan naskah skripsi ini dengan judul “ Sintesis dan Karakterisasi Material Magnetik Berbasis Senyawa Kompleks Inti Ganda Nikel(II) dengan
2,2’-Bipiridin Menggunakan Ligan Jembatan Oksalat”.
Dalam kesempatan ini penyusun ingin menyampaikan rasa terima kasih yang sebesar-besarnya kepada :
1. Dr. Alfinda Novi Kristanti, DEA selaku ketua Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga.
2. Dra. Hartati, M.Si selaku dosen wali dan dosen pembimbing I yang telah memberikan pengarahan, saran, nasehat dan bimbingan.
3. Harsasi Setyawati, S.Si, M.Si selaku dosen pembimbing II yang telah sabar memberikan pengarahan, saran, nasehat dan bimbingan dalam menyusun skripsi ini.
4. Seluruh dosen di jurusan kimia yang telah membagi ilmu serta pengalamannya kepada penulis.
5. Seluruh tenaga kerja di jurusan kimia yang telah membantu.
7. Nirma, Putri, Inna, Nikita, Febri yang telah memberi banyak semangat dan masukan dalam menyusun skripsi ini
8. Kak Jo yang dengan sabar telah banyak membantu dan memberi semangat dalam menyusun skripsi ini
9. Teman – teman angkatan 2008 yang senantiasa menemani dalam menuntut ilmu dan teman-teman angkatan 2006, 2007, 2009, dan 2010 yang telah memberikan banyak dukungan
10.Dan semua pihak yang telah membantu kelancaran dalam menyusun skripsi ini yang tidak dapat disebutkan satu-persatu.
Penulis masih menyadari masih terdapat banyak kekurangan dalam penyusunan skripsi ini, oleh karena itu penulis sangat mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan penulisan naskah skripsi ini agar bermanfaat bagi semua pihak.
Surabaya, Agustus 2012
Christianti, Dwi N., 2012, Sintesis dan Karakterisasi Material Magnetik Berbasis Senyawa Kompleks Inti Ganda Nikel(II) dengan 2,2’-Bipiridin Menggunakan Ligan Jembatan Oksalat. Skripsi ini di bawah bimbingan Dra. Hartati M.Si dan Harsasi Setyawati, S.Si, M.Si, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Penelitian ini bertujuan untuk sintesis dan karakterisasi material magnetik berbasis senyawa kompleks inti ganda nikel(II) dengan 2,2’-bipiridin menggunakan ligan jembatan oksalat Sintesis senyawa kompleks inti ganda nikel(II)-2,2’-bipiridin dengan ligan jembatan oksalat dilakukan dengan mensintesis senyawa kompleks inti tunggal terlebih dahulu. Sintesis senyawa kompleks inti tunggal diperoleh berdasarkan perbandingan mol nikel(II) : bipy = 1 : 3. Sedangkan senyawa kompleks inti ganda disintesis berdasarkan perbandingan mol nikel(II) : bipy : oksalat = 2 : 4 : 1. Senyawa kompleks inti ganda memiliki rumus kimia [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+ yang kristalnya berwarna merah muda. Senyawa hasil sintesis ini dikarakterisasi dengan spektroskopi UV-VIS, infrared (IR), Magnetic Susceptibility Balance (MSB), dan konduktometri. Hasil analisis spektroskopi UV-VIS diperoleh nilai panjang gelombang maksimum sebesar 523 nm. Spektrum IR senyawa kompleks inti ganda menunjukkan bahwa ikatan Ni-N terdapat pada daerah bilangan gelombang 354,90 cm-1,sedangkan ikatan Ni-O terletak pada bilangan gelombang 385,76 cm -1
. Analisis dengan Magnetic Susceptibility Balance diperoleh harga momen magnet sebesar 3,75 BM dan konduktansinya adalah 837 s.
Christianti, Dwi N., 2012, Synthesis and Characterization of Magnetic Material Binuclear Complex Compounds of Nickel(II) with 2,2’-Bipyridine using Oxalate Bridging Ligand. Final Project have been supervised by Dra. Hartati M.Si and Harsasi Setyawati, S.Si, M.Si, Chemistry Department, Technology and Science Faculty, Airlangga University, Surabaya.
ABSTRACT
The aim of the research is to synthesis and chracterization of magnetic material binuclear complex compounds of nickel(II) with 2,2’-bipyridine using oxalate bridging ligand. Synthesis nickel(II)-2,2’-bipyridine binuclear complex compound using oxalate bridging ligand was done by synthesize mononuclear complex compound first. Synthesis mononuclear complex compound obtained by mole ratio nickel(II) : bipy = 1 : 3. While binuclear complex compound were synthesized by mol ratio nickel(II) : bipy : oxalate = 2: 4 :1. The chemical formulae of binuclear complex compound is [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+ which pink crystal. This compound is characterized by UV-VIS spectroscopy, infrared (IR) spectroscopy, Magnetic Susceptibility Balance (MSB), and conductometry. Characterization of binuclear complex compound showed that maximum wavelength of compound were 523 nm. The infrared spectra of binuclear complex compound show that Ni-N bond found in the wavenumber 354,90 cm-1, while Ni-O bond is located at wavenumber 385,76 cm-1 . Magnetic Susceptibility Balance analysis of price obtained for the magnetic moment of 3.75 BM and the conductivity are 837 s.
DAFTAR ISI
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN... ii
LEMBAR PENGESAHAN ... iii
PEDOMAN PENGGUNAAN SKRIPSI... iv
KATA PENGANTAR ... v
2.8 Karakterisasi Hasil Sintesis Senyawa Kompleks ... 12
Ni(II) 10-2 M ... 21 4.1 Penentuan Stokiometri Senyawa Kompleks Inti Tunggal Nikel(II)-bipy... 28
4.2 Sintesis Senyawa Kompleks Inti Tunggal Nikel(II)-bipy... 29
4.3 Penentuan Stokiometri Senyawa Kompleks Inti Ganda Nikel(II)-bipy-oksalat... 30
4.4 Sintesis Senyawa Kompleks Inti Ganda Nikel(II)-bipy- Oksalat... 31
4.5 Karakterisasi dari Hasil Sintesis Senyawa Kompleks... 33
4.5.1 Analisis Spektra Senyawa Kompleks dengan Spektrofotometer UV-VIS... 33
4.5.2 Analisis Spektra senyawa Kompleks dengan Spektrofotometer Inframerah (IR)... 37
4.5.3 Analisis Sifat Kemagnetan dengan Menggunakan Magnetic Susceptibility Balance... 39
DAFTAR TABEL
Nomor Judul Tabel Halaman
2.1 Spektrum Cahaya Tampak dan Warna Komplementer 13
3.1 Penambahan larutan 2,2’-bipiridin 10-2 M secara bertahap 23 ke dalam larutan Ni(II) 10-2 M dengan perbandingan mol
3.2 Penambahan mol oksalat ke dalam larutan [Ni(bipy)3]2+ 24
4.1 Hasil momen magnet pada ketiga senyawa 39
DAFTAR GAMBAR
orbital d dalam struktur oktahedral
2.6 Diagram tingkat energi orbital molekul pada senyawa 12
4.2 Kristal hasil sintesis senyawa kompleks inti tunggal 30 4.3 Prediksi struktur senyawa kompleks inti tunggal 30 4.4 Penentuan stokiometri oksalat : Ni2+ pada 523 nm 31
dengan metode perbandingan mol
4.5 Kristal senyawa kompleks inti ganda 32
4.6 Prediksi struktur senyawa kompleks inti ganda 33 4.7 Spektrum sintesis senyawa kompleks inti tunggal 34
4.8 Transisi elektronik ion nikel(II) 35
No Judul Halaman
4.10 Perbandingan spektra sintesis senyawa kompleks inti tunggal 38 dengan inti ganda
DAFTAR LAMPIRAN
No Judul
1 Spektrum larutan Ni(II) konsentrasi 5.10-2
M di daerah uv-vis 2 Spektrum larutan Ni(II) konsentrasi 10-2 M di daerah uv-vis 3 Spektrum larutan 2,2’-bipiridin konsentrasi 10-2
M di daerah uv-vis 4 Spektrum larutan 2,2’-bipiridin konsentrasi 10-4
M di daerah uv-vis 5 Spektrum larutan oksalat konsentrasi 10-2 M di daerah uv-vis
6 Spektrum stokiometri senyawa kompleks inti tunggal [Ni(bipy)3]2+ 7 Spektrum larutan sintesis senyawa kompleks inti tunggal [Ni(bipy)3]2+ 8 Spektrum stokiometri senyawa kompleks inti ganda
[(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+
9 Spektrum larutan sintesis senyawa kompleks inti ganda [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+
10 Spektrum Inframerah (IR) NiSO4.7H2O 11 Spektrum Inframerah (IR) [Ni(bipy)3]2+
12 Spektrum Inframerah (IR) [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+ 13 Spektrum Inframerah (IR) 2,2’-bipiridin
14 Spektrum Inframerah (IR) oksalat
BAB I
PENDAHULUAN
1.1 Latar Belakang
Senyawa kompleks adalah senyawa yang tersusun dari atom pusat (logam) dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebas kepada atom pusat (House, 2008). Aplikasi senyawa kompleks sangat bervariasi. Di industri senyawa kompleks berguna untuk pemisahan logam dari bijihnya (Sukardjo, 1992), dalam bidang kesehatan senyawa kompleks dimanfaatkan sebagai senyawa pengontras Magnetic Resonance Imaging (MRI) yang dapat memperjelas visualisasi jaringan tubuh (Maulana, dkk., 2008), dan yang paling mutakhir saat ini senyawa kompleks banyak diaplikasikan sebagai material magnetik (Gomez, dkk., 2007). Senyawa kompleks sangat potensial untuk dijadikan material magnetik karena pada proses pembuatannya tidak memerlukan suhu tinggi (Martak, 2011).
Senyawa kompleks yang banyak dikembangkan sebagai material magnetik biasanya senyawa kompleks berinti ganda. Senyawa kompleks inti ganda adalah senyawa kompleks yang atom pusatnya lebih dari satu dengan melibatkan ligan gugus jembatan (Balzani, dkk., 1996). Senyawa kompleks berinti ganda ini terbukti memiliki sifat kemagnetan lebih baik jika dibandingkan senyawa kompleks berinti satu (Setiawan, 2008).
aplikasi penggunaan senyawa kompleks terutama dalam bidang material magnetik telah memainkan peranan dalam kemajuan bidang teknologi. Industri dengan teknologi mutakhir tersebut telah menghasilkan produk berupa media perekaman magnetik, pencitraan medis, tinta cetak, dll. (Gomez, dkk, 2007). Salah satu penelitian senyawa kompleks dalam bidang material magnetik pada senyawa kompleks nikel adalah epitaxial film dari bentuk memori magnetik bahan Ni2MnGa. Dalam penelitian tersebut, material magnetik pada senyawa kompleks nikel digunakan sebagai sensors free standing thin films atau sensor bebas film tipis (Jacob dan Elmers, 2006).
Untuk menambah kajian dan informasi ilmiah tentang sintesis dan karakterisasi tentang material magnetik senyawa kompleks inti ganda di Indonesia, maka dalam penelitian ini akan disintesis dan dikarakterisasi senyawa kompleks inti ganda Ni(II) dengan 2,2’-bipiridin dan ligan gugus jembatan oksalat.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah disampaikan, maka dapat dirumuskan masalah sebagai berikut.
1. Bagaimana cara mensintesis senyawa kompleks inti ganda Ni(II)-2,2-bipiridin dengan ligan jembatan oksalat ?
2. Bagaimana karakterisasi senyawa kompleks inti ganda Ni(II)-2,2-bipiridin dengan ligan jembatan oksalat ?
1.3 Tujuan Penelitian
1. Mempelajari cara mensintesis senyawa kompleks inti ganda Ni(II)-2,2-bipiridin dengan ligan jembatan oksalat.
2. Karakterisasi senyawa kompleks inti ganda Ni(II)-2,2-bipiridin dengan ligan jembatan oksalat .
1.4 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Material Magnetik
Senyawa kompleks sangat potensial untuk dijadikan material magnetik, karena pada proses pembuatannya tidak memerlukan suhu tinggi seperti material magnetik generasi sebelumnya. Dengan demikian diharapkan dapat lebih menghemat biaya (Martak, 2011). Aplikasi penggunaan senyawa kompleks terutama dalam bidang material magnetik telah memainkan peranan dalam kemajuan bidang teknologi. Industri dengan teknologi mutakhir tersebut telah menghasilkan produk berupa media perekaman magnetik, pencitraan medis, tinta cetak, dll.(Gomez, dkk., 2007). Salah satu contoh penggunaan senyawa kompleks dalam bidang material magnetik adalah epitaxial film dari bentuk memori magnetik bahan Ni2MnGa. Epitaxial atau epitaksi adalah pengendapan overlayer kristal pada substrat kristal. Dalam penelitian tersebut, material magnetik pada senyawa kompleks nikel digunakan sebagai sensors free standing thin films atau sensor bebas film tipis (Jacob dan Elmers, 2006).
2.2 Senyawa Kompleks
sebagai ligan dan akseptor pasangan elektron yang dapat berupa atom atau ion logam (House, 2008).
Senyawa kompleks melibatkan asam dan basa Lewis. Ion atau atom pusat penerima pasangan elektron bebas yang disumbangkan oleh ligan disebut asam Lewis. Ligan mempunyai paling sedikit sepasang elektron bebas yang dapat disumbangkan kepada ion atau atom pusat, sehingga ligan merupakan basa Lewis. Reaksi asam-basa Lewis dapat dituliskan sebagai berikut (House, 2008) :
A + :B A : B
asam basa senyawa kovalen koordinasi
Berdasarkan jumlah donor pasangan elektron yang dimilikinya, ligan dapat dikelompokkan sebagai berikut.
1. Ligan monodentat, yaitu ligan yang hanya memiliki satu donor pasangan elektron. Sebagai contoh adalah NH3, H2O, CO dan Cl .
2. Ligan bidentat, yaitu ligan yang memiliki dua donor pasangan elektron. Ligan bidentat bisa berupa senyawa netral (contohnya etilendiamin, 1,10-fenantrolin) atau anion seperti oksalat, karboksilat, ion glisinat, dan lain-lain.
3. Ligan polidentat, yaitu ligan yang mempunyai lebih dari dua donor pasangan elektron. Tergantung pada jumlah donor pasangan elektron yang disumbangkan, ligan ini disebut tridentat, tetradentat, pentadentat dan heksadentat (Effendy, 2007).
disingkat phen, ligan etilendiamintetraasetat disingkat EDTA, ligan metilglioksimat disingkat DMG, ligan pirazin disingkat pyz, dan sebagainya (Effendy, 2007).
2.3 Senyawa Kompleks Inti Ganda
Senyawa kompleks inti ganda (polynuclear complexes) merupakan senyawa kompleks yang mempunyai ion pusat lebih dari satu dan antara ion pusat yang satu dengan ion pusat yang lain dihubungkan oleh ligan gugus jembatan. Senyawa kompleks tunggal digunakan dalam pembuatan senyawa kompleks inti ganda, yaitu dengan mengganti satu atau lebih ligan dengan gugus jembatan dan menggabungkannya dengan senyawa kompleks tunggal yang lain (Balzani dkk., 1996). Umumnya momen magnetik senyawa kompleks berinti ganda (binuklir) lebih tinggi dari senyawa kompleks berinti tunggal (mononuklir) (Martak dan Elmila, 2011). Contoh penelitian senyawa kompleks inti ganda adalah sintesis, struktur kristal dan sifat magnetik dari jembatan oksalat-kompleks dibesi(III) {[FeIII(salapn)]2(C2O4)} (Jia, dkk., 2006).
2.4 Nikel
Nikel adalah logam putih perak yang keras. Logam ini bersifat liat, dapat ditempa, dan sedikit magnetis. Titik lebur nikel adalah 1455˚C (Svehla,1996).
28Ni = [Ar] 4s2 3d8 Ni pada keadaan dasar :
3 d 4 s
Ni2+ pada keadaan dasar :
3 d 4 s
Gambar 2.1 Konfigurasi elektron Ni dan ion Ni(II)
Jika Nikel(II) membentuk senyawa kompleks, biasanya memiliki bilangan koordinasi 6 atau 4, sehingga mampu membentuk senyawa dengan struktur oktahedral, tetrahedral, atau segiempat planar. Ion Ni(II) mampu membentuk senyawa kompleks dengan ligan karena ion ini mempunyai orbital d yang belum terisi penuh oleh elektron. Orbital-orbital tersebut dapat berfungsi sebagai penerima pasangan elektron dari ligan sehingga terbentuk senyawa kompleks jika telah kosong karena terjadi pengaturan elektron (King, 2005).
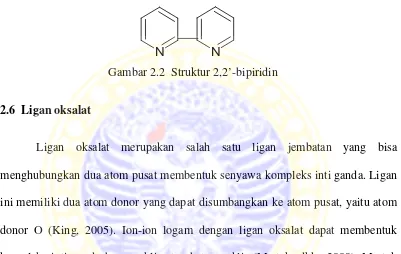
2.5 Senyawa 2,2’-Bipiridin
Ligan bipiridin cenderung mengompleks atom pusat yang sama (Effendy, 2007). Ligan ini dapat membentuk kompleks yang memiliki intensitas warna yang kuat sehingga ligan ini dapat dipakai luas dalam reaksi warna pada kompleks khelat yang stabil (Simamora, 1997).
Gambar 2.2 Struktur 2,2’-bipiridin
2.6 Ligan oksalat
Ligan oksalat merupakan salah satu ligan jembatan yang bisa menghubungkan dua atom pusat membentuk senyawa kompleks inti ganda. Ligan ini memiliki dua atom donor yang dapat disumbangkan ke atom pusat, yaitu atom donor O (King, 2005). Ion-ion logam dengan ligan oksalat dapat membentuk kompleks inti ganda homonuklir atau heteronuklir (Martak, dkk., 2009). Martak dan Elmila, 2011 menggunakan ligan oksalat pada peningkatan sifat magnetik kompleks polimer oksalat [N(C4H9)4][MnCr(C2O4)3] dengan menggunakan kation organik tetrabutil amonium yang mempunyai momen magnet sebesar 7,51 BM (Bohr Magneton).
C O
C O
O O
2-Gambar 2.3 Struktur ligan oksalat
2.7 Teori Pembentukan Senyawa Kompleks
Pembentukan senyawa kompleks dipelajari dalam tiga macam teori, yaitu teori ikatan valensi (Valence Bond Theory), teori medan kristal (Crystal Field Theory), dan teori orbital molekul (Molecular Orbital Theory).
2.7.1 Teori Ikatan Valensi (Valance Bond Theory)
Gambar 2.4 Pembent
complex) karena orbital yang digunakan oleh pa pati orbital 4d. Ion koordinasi ini disebut juga au free spin) (Housecroft dan Sharpe, 2005).
an Kristal (Crystal Field Theory)
n kristal dikembangkan oleh Bethe (1929) da nurut teori ini, ikatan antara atom pusat dan ligan
Pengaruh medan ligan terutama pada elektron orbital d ion pusat menyebabkan tingkat energi orbital d bertambah dan akhirnya terpisah dengan energi yang tidak sama. Pemisahan kelima orbital d ion pusat disebut pemisahan medan kristal (Housecroft dan Sharpe, 2005).
Pada Gambar 2.5 adalah contoh splitting orbital d dalam struktur oktahedral.
Gambar 2.5 Pemisahan medan kristal dan penempatan elektron pada orbital d (Huheey, 1993).
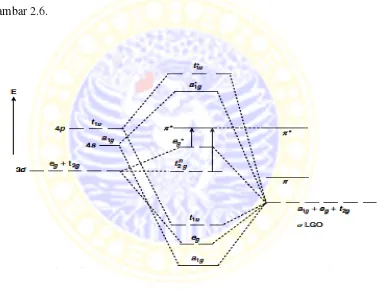
2.7.3 Teori Orbital M
al Molekul (Molecular Orbital Theory)
enjelaskan bahwa ikatan antara atom atau ion en. Ikatan kovalen tersebut terjadi karena adany dalam senyawa kompleks, yaitu orbital yan ion pusat dan orbital ligan (Effendy, 2007). ergi orbital molekul pada senyawa kompleks
orbital molekul orbital
am tingkat energi orbital molekul pada sen hedral (House, 2008).
asi Hasil Sintesis Senyawa Kompleks
bsorbsi Elektronik Senyawa Kompleks Logam
ultra ungu-tampak disebut juga spektrum ele interaksi radiasi ultra ungu-tampak dengan
mengakibatkan molekul tersebut mengalami transisi elektronik. Transisi ini pada umumnya terjadi antara orbital ikatan atau orbital pasangan bebas dan orbital anti ikatan. Selain itu juga karena adanya gugus berikatan rangkap atau terkonjugasi yang mengabsorbsi radiasi elektronik di daerah ultra ungu.
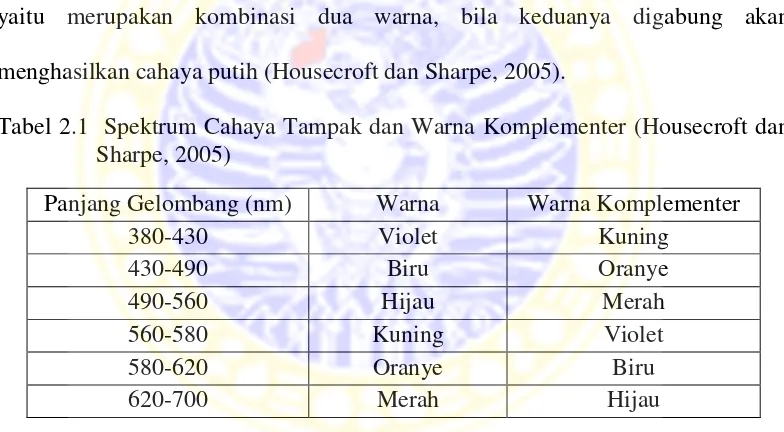
Sinar tampak mempunyai panjang gelombang 400-750 nm dan disebut cahaya sinambung. Artinya cahaya yang terdiri dari semua panjang gelombang yang mungkin terdapat dalam suatu jarak tertentu. Hubungan antara warna dan panjang gelombang terlihat pada Tabel 2.1 yang disertai warna komplementer, yaitu merupakan kombinasi dua warna, bila keduanya digabung akan menghasilkan cahaya putih (Housecroft dan Sharpe, 2005).
Tabel 2.1 Spektrum Cahaya Tampak dan Warna Komplementer (Housecroft dan Sharpe, 2005)
Panjang Gelombang (nm) Warna Warna Komplementer
380-430 Violet Kuning
Pada transisi elektronik, molekul-molekul menyerap radiasi dan tereksitasi sehingga elektron valensi bergerak dari orbital energi rendah ke orbital energi yang lebih tinggi (Robinson, dkk., 2005).
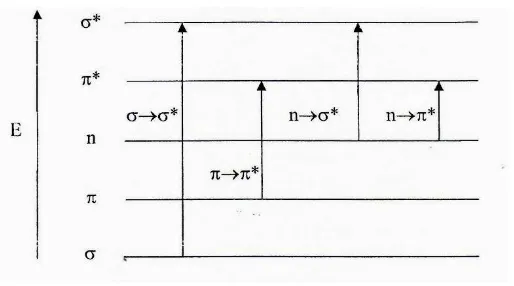
mengakibatkan terjadinya puncak-puncak serapan pada spektrum senyawa kompleks. Transisi elektronik yang terjadi pada senyawa kompleks antara lain transisi d-d, perpindahan muatan, dan perpindahan elektron dalam ligan.
Pada transisi elektronik d-d, elektron tereksitasi dari orbital d yang satu ke orbital d yang lain, misalnya dari orbital t2g ke orbital eg. Intensitas transisi d-d relatif rendah yang disebabkan pemisahan energi d-d yang relatif kecil. Warna larutan ion logam transisi pada umumnya diakibatkan adanya transisi d-d ini, misalnya pada senyawa kompleks akuo, transisi d-d terjadi di daerah tampak.
Jenis transisi elektronik lainnya adalah perpindahan muatan. Pada transisi jenis ini, elektron berpindah dari orbital ligan ke orbital ion logam dan disebut juga Ligand to Metal Charge Transfer (LMCT). Selain itu, ada perpindahan elektron dari orbital ion logam ke orbital ligan dan disebut juga Metal to Ligand Charge Transfer (MLCT). Jenis transisi LMCT terjadi pada ligan yang mudah teroksidasi dan ion logam berada pada bilangan oksidasi tinggi. Pita serapan perpindahan muatan berada di daerah ultra ungu, sedangkan pada transisi elektronik jenis MLCT, terjadi bila ligan mempunyai ikatan tidak jenuh dan ion logam berada pada bilangan oksidasi rendah, misalnya senyawa kompleks Cu(II), Fe(II), Cr(III) dengan ligan piridin, bipiridin dan fenantrolin (Huheey, 1993).
Gambar 2.7 Tingkat
kat energi elektronik molekul organik sebagai lig .
dengan elektron dalam ikatan sigma tereksita i dan akan memberikan serapan pada daerah di al dengan daerah ultra ungu vakum, karena boleh ada udara, sehingga sukar dilakukan dan j
angan untuk penentuan struktur. Contoh n di daerah ultra ungu vakum adalah CH4. berikatan rangkap dua atau tiga cukup mudah bih tinggi. Suatu transisi π π* terjadi apabi
eksitasi ke orbital π-anti ikatan. Absorbsi energ pada transisi * (Underwood, 1999). Sal rhasil menggunakan uji spektrofotometer
2.8.2 Tinjauan Umum Spektroskopi Inframerah
Radiasi inframerah adalah radiasi elektromagnetik pada daerah panjang gelombang yang berdekatan dengan sinar tampak dengan energi yang lebih rendah. Daerah inframerah berawal dari panjang gelombang 0,7-500 m. Radiasi inframerah yang terserap oleh molekul akan menyebabkan terjadinya vibrasi (getaran). Energi inframerah adalah energi terkuantisasi. Spektrum vibrasi yang muncul bukan sebagai garis-garis, namun sebagai pita-pita absorbsi yang kompleks. Hal ini dikarenakan energi inframerah yang terserap selain menimbulkan vibrasi juga menimbulkan gerakan rotasi pada molekul (pada daerah bilangan gelombang 4000-400 cm-1) (Patnaik, 2004).
2.8.2.1 Spektrum Inframerah Senyawa Kompleks
yang menunjukkan adanya oksalat sebagai ligan jembatan pada bilangan gelombang 1627,8 cm-1 untuk vas(C-O), 1384,8 cm-1 untuk vs(C-O), dan 810,0 cm -1
untuk δ(O-C-O) (Martak, dkk., 2009).
2.8.3 Sifat Kemagnetan Senyawa Kompleks
Sifat kemagnetan senyawa kompleks hasil sintesis dapat diamati berdasarkan nilai momen magnet yang terukur serta melihat banyaknya elektron yang tidak berpasangan untuk masing-masing senyawa kompleks. Besarnya momen magnet suatu senyawa kompleks dapat dihitung dengan menggunakan
Magnetic Susceptibility Balances. Secara eksperimen magnetic susceptibility
ditentukan dengan Gouy balance, dimana serbuk atau larutan zat yang diteliti digantungkan dalam sebuah tabung Gouy yang diletakkan diantara kutub-kutub magnet yang kuat. Adapun rumus yang digunakan dinyatakan dalam persamaan 2.1.
R = nilai tabung dan sampel yang terbaca R0 = nilai tabung kosong yang terbaca
m = massa sampel
Nilai ini dikonversi menjadi eff (momen magnet) dengan persamaan :
eff = 2,82 √ . " BM (2.3) Keterangan :
eff = momen magnet (Bohr Magneton/BM) Mr = massa molekul relatif sampel
T = suhu (K) (Magway, 2005).
Salah satu contoh penelitian yang berhasil menggunakan uji MSB adalah senyawa kompleks [Ni(HMP2NBu2)2]Br2 yang memiki momen magnet sebesar 3,18 BM (Saha, dkk., 2003).
2.8.4 Konduktometri
Kemampuan suatu larutan untuk menghantarkan listrik dapat memberikan informasi analitik tentang larutan. Sifat yang diukur adalah daya hantar listrik antara dua elektroda dari ion-ion dalam larutan. Semua ion dalam larutan menyumbangkan daya hantar listrik. Daya hantar listrik digunakan untuk memberikan analisis kualitatif, seperti kemurnian pelarut organik dan perbandingan kualitas air minum dalam hal jumlah ion kontaminan. Untuk mengukur daya hantar listrik pada suatu larutan menggunakan konduktometer (Robinson, dkk., 2005).
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Penelitian Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga mulai bulan Februari sampai dengan Juli 2012.
3.2 Bahan Penelitian
Bahan-bahan kimia yang digunakan pada penelitian ini memiliki derajat kemurnian pro analysis (p.a), meliputi garam Nikel sulfat heptahidrat, 2,2’-bipiridin, amonium oksalat, metanol, KCl, MgCl2.6H2O, FeCl3.6H2O dan akuabides.
3.3 Alat Penelitian
Sintesis senyawa kompleks inti tunggal Sintesis senyawa kompleks inti ganda
3.4 Diagram Alir Penelitian
Pembuatan larutan Ni(II) 10-2 M ; 2,2’-bipiridin 10-2 M ; oksalat 10-2 M
Penentuan panjang gelombang maksimum (λ maks): 1. Ni(II) 10-2 M
2. 2,2’-bipiridin 10-2 M 3. oksalat 10-2 M
Penentuan stoikiometri
Penentuan stoikiometri Penentuan stoikiometri Ni(II) : bipy Ni(II) : bipy : oksalat
Sintesis senyawa kompleks
Karakterisasi :
• Spektrofotometer UV-VIS
• Spektrofotometer FT-IR
• Magnetic Susceptibility Balance
• Muatan ion kompleks
3.5 Prosedur Penelitian
3.5.1 Pembuatan Larutan Ni(II) 10-2 M
Garam nikel sulfat heptahidrat (NiSO4.7H2O) kering ditimbang sebanyak 0,28069 gram kemudian dilarutkan dengan akuabides dalam gelas beker 100 ml. Setelah semua larut, dimasukkan ke dalam labu ukur 100 ml dan diencerkan dengan akuabides sampai tanda batas lalu dihomogenkan.
3.5.2 Pembuatan Larutan 2,2’-Bipiridin 10-2 M
Senyawa 2,2’-bipiridin monohidrat (C10H8N2) kering ditimbang sebanyak 0,156 gram lalu dilarutkan dengan akuabides dalam gelas beker 100 ml. Setelah larut,kemudian dimasukkan ke dalam labu ukur 100 ml dan diencerkan dengan akuabides sampai tanda batas lalu dihomogenkan.
3.5.3 Pembuatan Larutan Oksalat 10-2 M
Amonium oksalat [(NH4)2C2O4] ditimbang sebanyak 0,1240 gram kemudian dilarutkan dengan akuabides dalam gelas beker 100 ml. Setelah semua larut dimasukkan ke dalam labu ukur 100 ml dan ditambahkan akuabides sampai tanda batas lalu dihomogenkan.
3.5.4 Penentuan Panjang Gelombang Maksimum (λ maks) Ni(II) 10-2 M
3.5.5 Penentuan Panjang Gelombang Maksimum (λ maks) 2,2-Bipiridin 10-2 M
Larutan 2,2 bipiridin 10-2 M dimasukkan dalam kuvet yang telah disiapkan kemudian diukur panjang gelombang maksimum pada daerah dengan panjang gelombang 200-380 nm.
3.5.6 Penentuan Panjang Gelombang Maksimum (λ maks) Oksalat 10-2 M
Larutan (NH4)2C2O4 10-2 M dimasukkan dalam kuvet yang telah disiapkan kemudian diukur panjang gelombang maksimum pada daerah dengan panjang gelombang 200-380 nm.
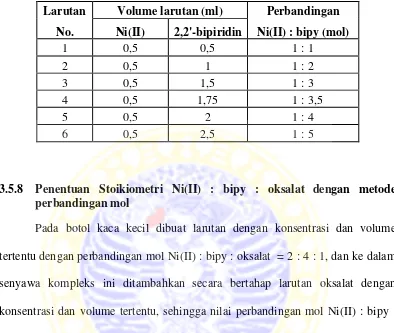
3.5.7 Penentuan stoikiometri Ni(II) : bipy dengan metode perbandingan mol
Tabel 3.1 Penambahan larutan 2,2’-bipiridin 10-2 M secara bertahap ke dalam larutan Ni(II) 10-2 M dengan metode perbandingan mol.
Larutan Volume larutan (ml) Perbandingan
Tabel 3.2 Penambahan mol oksalat ke dalam larutan [Ni(bipy)3]2+.
3.5.9 Sintesis Senyawa Kompleks
3.5.9.1 Sintesis Senyawa Kompleks Inti Tunggal
Gambar 3.2 Proses sintesissenyawa kompleks inti tunggal
3.5.9.2 Sintesis Senyawa Kompleks Inti Ganda
Sebanyak 1 mmol Ni(II) dari senyawa NiSO4.7H2O dilarutkan dalam akuabides sampai larut. Lalu sebanyak 2 mmol 2,2’-bipiridin dilarutkan dalam metanol sampai larut. Sebanyak 0,5 mmol oksalat dilarutkan dalam akuabides sampai larut. Kemudian larutan Ni(II) dicampurkan terlebih dahulu dengan larutan 2.2’-bipiridin ke dalam gelas beker. Kemudian dipanaskan sebentar pada suhu rendah dan didiamkan sampai suhu dingin. Selanjutnya ditambahkan larutan oksalat ke dalam gelas beker yang berisi campuran larutan tadi. Lalu dipanaskan lagi sebentar dengan suhu rendah dan diamkan sampai suhu dingin. Kemudian endapannya disaring. Kemudian larutan ini dtutup dengan kertas saring dan dibiarkan selama 1-2 minggu. Kristal yang dihasilkan selanjutnya diambil dengan hati-hati.
Larutan Bipy Larutan
Ni(II)
Gambar 3.3 Proses sintesis senyawa kompleks inti ganda
3.5.10 Prosedur Karakterisasi
3.5.10.1 Spektrum UV-VIS
Masing-masing kristal senyawa kompleks hasil sintesis dilarutkan dengan akuabides. Selanjutnya larutan senyawa kompleks hasil sintesis ditentukan spektrumnya di daerah UV-VIS (200-700 nm).
3.5.10.2 Spektrum Inframerah
Masing-masing padatan ligan 2,2’-bipiridin, ligan oksalat, dan senyawa kompleks hasil sintesis dicampur dengan KBr dan dibuat pelet. Selanjutnya seluruh padatan diukur serapan inframerahnya pada bilangan gelombang 4000-300 cm-1.
3.5.10.3 Analisis Dengan Magnetic Susceptibility Balance
Padatan senyawa kompleks hasil sintesis ditumbuk sampai halus kemudian dimasukkan ke dalam kuvet sampai homogen. Masing- masing padatan halus diukur momen magnetnya menggunakan Magnetic Susceptibility Balance.
[Ni(bipy)3]2+
3.5.10.4 Analisis Muatan Ion Kompleks
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Stoikiometri Senyawa Kompleks Inti Tunggal Nikel(II)-bipy
Gambar 4.1 Penentuan stoikiometri bipy : Ni(II) pada 521 nm dengan metode perbandingan mol
4.2 Sintesis Senyawa Kompleks Inti Tunggal Nikel(II)-bipy
a b
Gambar 4.2 Kristal hasil sintesis senyawa kompleks inti tunggal. Kristal dilihat secara fisik(a). Kristal dengan perbesaran 600x (b).
Ion [Ni(bipy)3]2+ memiliki bilangan koordinasi enam karena ligan bipiridin merupakan ligan bidentat dan memiliki struktur ruang oktahedral. Perkiraan struktur senyawa kompleks inti tunggal terlihat pada Gambar 4.3, yaitu satu mol nikel(II) mengikat tiga mol 2,2’-bipiridin.
Ni N N
N N N
N N
N Ni2+
+
3Gambar 4.3 Prediksi struktur senyawa kompleks inti tunggal
4.3 Penentuan Stoikiometri Senyawa Kompleks Inti Ganda Nikel(II)-bipy-oksalat
Penentuan stoikiometri nikel(II) : bipy : oksalat menggunakan metode
2 : 4 : 1 . Pada stoikiometri ini perpotongan kedua garis lurus pada kurva yang terdapat pada Gambar 4.4 adalah perbandingan mol oksalat : Ni(II) = 1. Dengan demikian perbandingan mol nikel(II) : oksalat = 1 : 1 atau 1 : 1. Hasil penentuan stoikiometri tersebut menunjukkan bahwa dua mol nikel(II) dapat berikatan dengan satu mol oksalat. Hasil penentuan stoikiometri oksalat : nikel(II) dapat terlihat grafiknya pada Gambar 4.4.
Gambar 4.4 Penentuan stoikiometri oksalat : Ni(II) pada 523 nm dengan metode perbandingan mol
4.4 Sintesis Senyawa Kompleks Inti Ganda Nikel(II)-bipy-oksalat
Setelah penentuan stoikiometri pada senyawa kompleks inti ganda didapatkan maka sintesis dapat dilakukan dengan perbandingan mol nikel(II) : bipy : oksalat = 2 : 4 : 1. Senyawa kompleks inti ganda ini merupakan kristal serbuk berwarna merah muda, lebih pudar dari pada kristal sintesis senyawa kompleks inti tunggal yang tercantum pada Gambar 4.5a. Secara fisik, ukuran kristal sintesis senyawa kompleks inti ganda lebih kecil daripada kristal sintesis
senyawa kompleks inti tunggal. Sedangkan pada Gambar 4.5b adalah gambar kristal dengan perbesaran 600 kali menggunakan mikroskop ultra berbentuk oktahedral yang bergandengan.
a b
Gambar 4.5 Kristal senyawa kompleks inti ganda. Kristal dilihat secara fisik (a). Kristal dengan perbesaran 600x (b).
bahwa ligan jembatan oksalat mengikat dua atom logam pada atom donor
Gambar 4.6 Prediksi struktur senyawa kompleks inti ganda
4.5 Karakterisasi dari Hasil Sintesis Senyawa Kompleks.
4.5.1 Analisis Spektra Senyawa Kompleks dengan Spektrofotometer UV-VIS
Gambar 4.7 Spektrum sintesis senyawa kompleks inti tunggal
Spektrum senyawa kompleks inti tunggal pada Gambar 4.7 berasal dari transisi d-d. Pada transisi d-d, elektron tereksitasi dari orbital d ke orbital d yang lain. Warna larutan ion logam transisi nikel(II) disebabkan adanya transisi d-d yang menyerap sinar di daerah tampak. Ion kompleks [Ni(bipy)3]2+ dengan ion nikel(II) sebagai ion pusat, memiliki konfigurasi d8 low spin dan pada keadaan dasar memiliki simbol elektronik 3F. Ion nikel(II) yang berada dalam pengaruh medan oktahedral maka keadaan dasar konfigurasi elektroniknya adalah 3A2g dan keadaan tereksitasinya ada tiga macam, yaitu 3A2g 3T2g, 3A2g 3T1g, 3
A2g 3T1g(P) (Brisdon, 2005). Transisi elektronik untuk ion nikel(II) dalam medan oktahedral tertera Gambar 4.8.
A
bs
or
ba
ns
i
T1g
T1g
T2g
3
3
3
3
3
F
3
P
A2g
Gambar 4.8 Transisi elektronik ion nikel(II)
Diagram pemecahan tingkat energi pada Gambar 4.8 menunjukkan adanya tiga transisi elektron, yang berarti diprediksi ada tiga puncak spektrum yang dapat diamati pada daerah tampak (Missler, 2003).
Gambar 4.9 Spektrum senyawa kompleks inti ganda
Pada senyawa kompleks inti ganda, satu ligan bipiridin disubstitusi oleh satu ligan oksalat. Proses substitusi ini menyebabkan senyawa kompleks inti tunggal yang semula simetris menjadi kurang simetris dan membentuk senyawa kompleks oktahedral semu atau disebut juga pseudooctahedral (Huheey, 1993). Hal ini yang menyebabkan spektrum yang terbentuk memiliki puncak yang tidak simetris dan nilai panjang gelombang maksimum menjadi lebih rendah. Begitu juga dengan senyawa kompleks inti ganda yang tertera pada Gambar 4.9 transisi yang terjadi tidak hanya dipengaruhi oleh transisi d-d, namun besar kemungkinan dipengaruhi oleh transisi elektron dalam ligan yang menyebabkan nilai panjang gelombang maksimumnya lebih rendah dibanding senyawa kompleks inti tunggal (Missler, 2003).
A
bs
or
ba
ns
i
4.5.2 Analisis Spektra senyawa Kompleks dengan Spektrofotometer Inframerah (IR)
Hasil analisis spektra inframerah dari garam nikel, senyawa kompleks inti tunggal, dan senyawa kompleks inti ganda masing-masing tertera pada Lampiran 10,11 dan 12. Spektrum spesifik yang menunjukkan adanya ikatan koordinasi antara ion logam transisi dengan ligan 2,2-bipiridin terukur pada daerah dengan frekuensi rendah dibawah 500 cm-1 (Nakamoto, 2009). Diduga spektrum tersebut merupakan ikatan koordinasi Ni-N dari ligan bipiridin. Untuk senyawa kompleks tunggal, vibrasi Ni-N dari ligan bipiridin muncul pada daerah bilangan gelombang 354,90 cm-1. Untuk senyawa kompleks inti ganda, vibrasi Ni-N dari ligan bipiridin juga muncul pada daerah bilangan gelombang 354,90 cm-1.
teoritis vibrasi ulur Ni-O muncul pada daerah bilangan gelombang 389 cm-1 (Nakamoto, 2009).
Vibrasi ulur O-H dari senyawa H2O yang terhidrat muncul pada senyawa kompleks inti tunggal dan inti ganda. Vibrasi tersebut terlihat jelas dengan ditandai adanya spektra yang lebar dan intensitas sangat kecil di daerah bilangan gelombang sekitar 3410,15 cm-1 pada senyawa kompleks inti tunggal dan ganda. Secara teoritis vibrasi ulur O-H terletak pada daerah bilangan gelombang 2500- 3500 cm-1 (Wade, 2006). Perbandingan spektra sintesis senyawa kompleks inti tunggal dengan inti ganda terlihat pada Gambar 4.10.
Gambar 4.10 Perbandingan spektra sintesis senyawa kompleks inti tunggal dengan inti ganda
Ni-O
4.5.3 Analisis Sifat Kemagnetan dengan Menggunakan Magnetic Susceptibility Balance
Analisis sifat kemagnetan pada garam nikel, sintesis senyawa kompleks inti tunggal dan sintesis senyawa kompleks inti ganda terdapat pada Lampiran 16, adapun hasilnya terangkum pada Tabel 4.1
Tabel 4.1 Hasil momen magnet pada ketiga senyawa
Nama Senyawa Momen magnet (BM)
NiSO4.7H2O secara teoritis 2,83–3,93
[Ni(bipy)3]2+ 2,97
[(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+ 3,75
Berdasarkan data pada Tabel 4.1 terlihat bahwa kedua senyawa tersebut memiliki harga momen magnet yang tidak jauh berbeda dan secara teoritis mendekati harga momen magnet 2,83–3,93 BM (Saha, dkk., 2003). Senyawa kompleks inti tunggal mempunyai harga momen magnet yang kecil yaitu 2,97 BM. Pada senyawa kompleks inti tunggal memiliki dua elektron bebas tidak berpasangan. Hal ini menjelaskan bahwa ligan bipiridin tidak mampu mendesak logam nikel(II) sehingga senyawa kompleks inti tunggal bersifat paramagnetik dan pembentukan senyawa kompleksnya adalah outer orbital complex. Hal ini juga disebabkan karena adanya faktor sterik atau halang rintang yang cukup besar yang dapat mempengaruhi kestabilan senyawa kompleks yang terbentuk.
Ni pada keadaan dasar
Ni2+ keadaan dasar
[Ni(bipy)3]2+
2 elektron bebas tidak berpasangan = 2 BM Gambar 4.11 Proses pembentukan [Ni(bipy)3]2+
Ni2+ keadaan dasar
(Ni(II)-bipy)1-ox
(Ni(II)-bipy)2-ox
Gambar 4.12 Proses pembentukan senyawa kompleks inti ganda
4.5.4 Analisis Muatan Ion Kompleks dengan Menggunakan Konduktometri
Pada analisis muatan ion kompleks, yang diukur terlebih dahulu adalah larutan standart. Larutan standart yang dipakai adalah KCl yang mewakili muatan +1, MgCl2 yang mewakili muatan +2, dan FeCl3 yang mewakili muatan +3. Hasil pengukuran larutan standar yaitu pada KCl 296 s, MgCl2 388 s dan FeCl3 912 s. Kemudian mengukur larutan hasil sintesis senyawa kompleks inti tunggal dan inti ganda. Pada larutan sintesis senyawa kompleks inti tunggal hasilnya adalah 318 s yang berarti senyawa kompleks ini bermuatan +1, karena termasuk dalam rentang larutan standar KCl. Sedangkan pada larutan sintesis senyawa kompleks
inti ganda hasilnya adalah 837 s yang berarti senyawa kompleks ini bermuatan +3 karena termasuk dalam rentang larutan standar FeCl3.
Tabel 4.2 Daya hantar pada setiap larutan
Rumus Senyawa Hantaran ( s) Prediksi Tipe
Elektrolit
Dengan membandingkan daya hantar larutan sampel dengan larutan standart, terlihat bahwa sampel larutan antara senyawa kompleks inti tunggal dan inti ganda memiliki daya hantar hasil sintesis yang berbeda. Senyawa kompleks nikel(II)-bipiridin dengan perbandingan muatan kation : anion = 2 : 1. Sehingga rumus senyawa kompleks inti tunggal yaitu [Ni(bipy)3]2+. Daya hantar larutan sampel kompleks [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]y diperkirakan perbandingan muatan kation : anion = 3 : 1. Hal ini dikarenakan hasil konduktansi senyawa kompleks inti ganda lebih besar dari hasil konduktansi senyawa kompleks inti tunggal (masuk dalam rentang muatan FeCl3). Dengan demikian dapat diperkirakan rumus senyawa kompleks inti ganda yaitu [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+
4.5.5 Analisis Komprehensif Terhadap Senyawa Kompleks Inti Tunggal dan Inti Ganda
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Berdasarkan hasil penelitian dan pembahasan dapat disimpulkan sebagai berikut.
1. Sintesis senyawa kompleks inti ganda nikel(II)-2,2’ bipiridin dengan ligan jembatan oksalat dilakukan dengan mensintesis senyawa kompleks inti tunggal terlebih dahulu. Sintesis senyawa kompleks inti tunggal diperoleh berdasarkan perbandingan mol nikel(II) : bipy = 1 : 3. Sedangkan senyawa kompleks inti ganda disintesis berdasarkan perbandingan mol nikel(II) : bipy : oksalat = 2 : 4 : 1.
senyawa kompleks inti ganda diduga memiliki rumus [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+.
5.2 SARAN
1. Penelitian sintesis senyawa kompleks inti ganda masih banyak yang perlu dikembangkan dan diteliti terutama pada logam-logam transisi dengan menggunakan dua atom yang berbeda ataupun dengan ligan yang berbeda-beda pula.
2. Untuk dapat mengetahui terbentuknya struktur dari senyawa kompleks inti ganda maka perlu dilakukan analisis ESR (Electron Spin Resonance) karena aplikasinya berhubungan dengan material magnetik dan dilakukan analisis difraksi kristal tunggal yang dilanjutkan dengan XRD kristalografi.
DAFTAR PUSTAKA
Balzani V., Juris A., Venturi M., 1996, Luminescent and Redox-Active Polynuclear Transition Metal Complexes, Chem Rev., 96, 759-833 Brisdon, K.A., 2005, Inorganic Spectroscopic Methods, Oxford University Press
Inc., New York
Budavari, S., 2001, The Merk Index : An Encyclopedia of Chemicals, Drugs, and Biologicals, 13th Edition, Merck Research Laboratories Inc, New York Chakraborty, S., Munshi, P., Lahiri, K.G., 1997, Dinuclear Ruthenium(II)
Bipyridine Complexes having Non-Symmetric ', '’-Diimine Based
Neutral Bridging Ligands. Synthesis, Spectroscopic and
Electrochemical Properties, Thesis, Departemen of Chemistry, Indian of Institute Technology, Bombay, Mumbai-400076, India
Effendy, 2007, Perspektif Baru Kimia Koordinasi, Jilid 1, Bayumedia Publishing, Malang
Fessenden and Fessenden, 1992, Kimia Organik, Jilid 1, Edisi Ketiga, Erlangga, Jakarta
Gomez, P.C., Gil A., Korili S.A., Landazabal, P.J.I., Recarte V., Trujillano R., Vincente M.A., 2007, Effect of the Metal Support Interactions on the Physicochemical and Magnetic Properties of Ni Catalysts, Journal of Magnetism and Magnetic Materials, Volume 316
Huheey, J.E., Keiter, E.A., Keiter R.L., 1993, Inorganic Chemistry, Principles of Structure and Reactivity, 4th Edition, Harpercollins College Publisher, New York
House, J.E., 2008, Inorganic Chemistry, Elsevier Inc, London
Housecroft, C.E., dan Sharpe, A.G., 2005, Inorganic Chemistry, 2nd Edition, Pearson Prentice Hall, England
Jia, H.P., Li W., Ju, F.Z., Jie, Z., 2007, Synthesis, Crystal Structure and Magnetic Properties of an Oxalate-Bridged Diiron(III) Complex {[FeIII(salapn)]2(C2O4)}, Journal of Molecular Structure, 833 (2007)
49-52
Juric, M., Planinic, P., Zilic, D., Rakvin, B., Prugovecki, B., Calogovic, D.M., 2008, A New Heterometallic (Ni2+ and Cr3+) Complex- Crystal Structure and Spectroscopic Characterization, Journal of Molecular Structure, Volume 924-926,73-80
King, R.B., 2005, Encyclopedia of Inorganic Chemistry, 2nd Edition, A John Wiley and Sons Inc, Canada
Lambert J.B., Herbert F.S., David A.L., Cooks R.G., 1998, Organic Structural Spectroscopy, Prentice Hall, United States of America
Magway, 2005, Magnetic Suspectibility Balance : Instructional Manual, Sherwood Scientific LTD., England
Maulana, I., Mulyasih, Y., Hastiawan, I., 2008, Pembentukan Senyawa
Kompleks dari Logam Gadolinium dengan Ligan Asam
Dietilentriaminpentaasetat (DTPA), Prosiding Skripsi, Laboratorium Anorganik, jurusan Kimia FMIPA Universitas Padjadjaran
Martak F. dan Elmila I., 2011, Peningkatan Sifat Magnetik Kompleks Polimer Oksalat [N(C4H9)4][MnCr(C2O4)3] dengan Menggunakan Kation
Organik Tetrabutil Amonium, Prosiding Skripsi, Jurusan Kimia Fakultas Sains dan Ilmu Pengetahuan Alam ITS, Surabaya
Martak, F., Onggo, D., Ismunandar., Nugroho, A.A., Mufti, N., Yamin, B.M., 2009, Synthesis and Characterization of a Bimetallic Oxalate-Based Magnet [(C4H9)4P][M(II)Cr(ox)3] M(II) = Mn, Fe, Co, Ni, Cu,
Inorganic and Physical Chemistry Group, volume (1) : 1-7
Martak, F., 2009, Studi Struktur Kompleks Ligan Karboksilat, Desertasi, Institut Teknologi Bandung, Bandung
Miessler, G.L., Tarr, D.A., 2003, Inorganic Chemistry, 3rd Edition, Prentice-Hall International Inc, New Jersey
Nakamoto, K., 2009, Infrared and Raman Spectra of Inorganic and Coordination Compounds, Part B : Application in Coordination, Organometallic and Bioinorganic Chemistry, 6th Edition, A John Wiley and Sons Inc, Canada Patnaik, P., 2004, Dean’s Analytical Chemistry Handbook, 2nd Edition, The
Rahadjeng, S., 1997, Sintesis dan Karakterisasi Senyawa Koordinasi Inti Ganda Krom(III)-Polipiridil dengan Ligan Gugus Jembatan 4,4’-Bipiridin dan Pirazin,Tesis, Program Pascasarjana UI, Depok
Reinoso, S., Victoria, P., Zorrilla, J.M.G., Lezama, L., Felices, L.S., and Beitia, J.I., 2005, Inorganic-Metalorganic Hybrids Based on Monosubstituted Keggin Polyanions and Dinuclear Copper(II)-Oxalate Complexes. Synthesis, X-ray Structural Characterization, and Magnetic Properties, Inorganic Chemistry, pp 9731-9742, 44 (26)
Robinson, W.J., Frame, E.M.S., Frame II, G.M., 2005, Undergraduate Instrumental Analysis, 6th Edition, Marcel Dekker, New York
Saha, C.N., Butcher, R.J., Chaudhuri, S., Saha, N., 2003, Synthesis and Spectroscopic Characterisation of Cobalt(III) and Nickel(II)
Complexes with
5-methyl-3-formylpyrazole-N(4)-dibutylthiosemicarbazone (HMPzNBu2): X-ray Crystallography of
[Co(MPzNBu2)2]NO3./H2O (I) and [Ni(HMPzNBu2)2](ClO4)2 (II), Polyhedron, 22 (2003) 383-390
Setiawan, N.C.E., 2008, Sintesis dan Karakterisasi Senyawa Kompleks dari Ion Logam Cu2+ dengan Ligan Isokuinolin dan Ion Kompleks [Co(SCN)6]4-, Skripsi, FMIPA, Universitas Negeri Malang
Silverstein, R.M., Bassler, G.C., Morril, T.C., 1991, Spectrometric Identification of Organic Compounds, 5th Edition, John Wiley & Sons, Canada
Simamora, 1997, Studi Pengompleksan Co(II) dan Mn(II) dengan Ligan 1,10-Fenantrolin, 4,7-Dimetil Fenantrolin dan Sianida, Sintesis dan Karakterisasi, Thesis, Jakarta, Universitas Indonesia
Sukardjo, 1992, Kimia Koordinasi, Cetakan Kedua, PT. Rineka Cipta, IKAPI, Jakarta
Svehla, G., 1996, Vogel : Buku Teks Analisis Anorganik Kuantitatif Makro dan Semimikro, Edisi Kelima, Cetakan Kedua, Terjemahan oleh L. Setiono dan A. Hadyana P., PT. Kalman Media Pusaka, Jakarta
Svehla, G., 1996, Vogel’s Qualitative Inorganic Analysis,7th Edition, Longman, England
Lampiran 1
Spektrum larutan Ni(II) konsentrasi 5.10-2 M di daerah uv-vis
Panjang Gelombang
A
b
so
rb
a
n
si
Lampiran 2
Spektrum larutan Ni(I
A
b
so
rb
a
n
si
(II) konsentrasi 10-2 M di daerah uv-vis
Lampiran 3
Spektrum larutan 2,2’-bipiridin konsentrasi 10-2 M di daerah uv-vis
Panjang Gelombang
A
b
so
rb
a
n
si
Lampiran 4
Spektrum larutan 2,2’-bipiridin konsentrasi 10-4 M di daerah uv-vis
Panjang Gelombang
A
b
so
rb
a
n
si
Lampiran 5
Spektrum larutan oksa
A
b
so
rb
a
n
si
n oksalat konsentrasi 10-2 M di daerah uv-vis
Lampiran 6
Spektrum stokiometri
A
b
so
rb
a
n
si
tri senyawa kompleks inti tunggal [Ni(bipy)3]2+
Panjang Gelombang
Lampiran 7
Spektrum larutan sintesis senyawa kompleks inti tunggal [Ni(bipy)3]2+
Panjang Gelombang
A
b
so
rb
an
si
Lampiran 8
Spektrum stokiom [(OH)(bipy)2Ni(ox)Ni
A
b
so
rb
an
si
okiometri senyawa kompleks )Ni(bipy)2(OH)]3+
Panjang Gelombang
Lampiran 9
Spektrum larutan sintesis senyawa kompleks inti ganda [(OH)(bipy)2Ni(ox)Ni(bipy)2(OH)]3+
Panjang Gelombang
A
b
so
rb
a
n
si
Lampiran 10
Lampiran 11
Lampiran 12
Lampiran 13
Lampiran 14
Lampiran 15
Penentuan stokiometri dengan metode perbandingan mol
1. Penentuan stokiometri bipy : Ni2+ pada 521 nm dengan metode perbandingan mol
Perpotongan kedua garis lurus pada perbandingan mmol adalah 3,18. Jadi perbandingan mmol bipy : Ni2+ = 3,18 : 1 atau 3 : 1
2. Penentuan stokiometri Ni2+ : bipy : oksalat pada 523 nm dengan metode perbandingan mol
Lampiran 16
Penentuan momen magnet senyawa kompleks hasil sintesis
Berdasarkan alat Magnetic Susceptibility Balance diperoleh nilai Xg dengan persamaan :
= ( − ))
10*
Nilai ini dikonversi menjadi +eff (momen magnet) dengan persamaan : Xm = Xg x Mr
+eff = 2,82 √ . " BM
1. Penentuan momen magnet [Ni(bipy)3]2+
2. Penentuan momen magnet [(H2O)(bipy)2Ni(ox)Ni(bipy)2(H2O)]3+ Untuk ion [(H2O)(bipy)2Ni(ox)Ni(bipy)2(H2O)]3+ dengan Mr = 1187,38 didapatkan data sebagai berikut :
Replikasi Cbalance l (cm) R0 R M (gram) T (°,)
1 1 1,8 -033 217 0,0873 299
2 1 1,9 -036 228 0,1041 300
Replikasi 1:
=1 1,8 (217 + 33)
10* . 0,0873 = 5,1546 . 10
= 5,1546 . 10 x 1187,38 = 6,1205 . 10 8 +344 = 2,8266,1205 . 10 8. 299 BM = 3,81 BM
Replikasi 2 :
=1 1,9 (288 + 36)
10*. 0,1041 = 4,8184 . 10
= 4,8184 . 10 1187,38 = 5,7213 . 10 8
+344 = 2,8265,7213 . 10 8. 300 9: = 3,69 9:
+344; < − ; < = 3,81 9: + 3,699:

![Gambar 2.4 Pembentbentukan ikatan hibrida pada [NiF6]4- (Housecrecroft dan Sharpe,](https://thumb-ap.123doks.com/thumbv2/123dok/4010472.1953892/25.595.118.512.124.513/gambar-pembentbentukan-ikatan-hibrida-pada-nif-housecrecroft-sharpe.webp)
![Tabel 3.2 Penambahan mol oksalat ke dalam larutan [Ni(bipy)3]2+.](https://thumb-ap.123doks.com/thumbv2/123dok/4010472.1953892/39.595.113.505.150.484/tabel-penambahan-mol-oksalat-dalam-larutan-ni-bipy.webp)