SINTESIS DAN KARAKTERISASI MATERIAL MAGNETIK BERBASIS SENYAWA KOMPLEKS INTI GANDA MANGAN(II) DENGAN 2,2’-BIPIRIDIN MENGGUNAKAN LIGAN JEMBATAN OKSALAT
SKRIPSI
NIRMAWATI EKA PUTRI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
SINTESIS DAN KARAKTERISASI MATERIAL MAGNETIK BERBASIS SENYAWA KOMPLEKS INTI GANDA MANGAN(II) DENGAN 2,2’-BIPIRIDIN MENGGUNAKAN LIGAN JEMBATAN OKSALAT
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada
Fakultas Sains dan Teknologi Universitas Airlangga
Oleh :
NIRMAWATI EKA PUTRI NIM. 080810626
Tanggal Lulus : 6 Agustus 2012
Disetujui oleh :
Pembimbing I,
Dra. Hartati, M.Si NIP. 19591115 198703 2 002
Pembimbing II,
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Sintesis dan Karakterisasi Material Magnetik Berbasis Senyawa Kompleks Inti Ganda Mangan(II) dengan 2,2’-Bipiridin Menggunakan Ligan Jembatan Oksalat Penyusun : Nirmawati Eka Putri
NIM : 080810626
Pembimbing I : Dra. Hartati, M.Si
Pembimbing II : Harsasi Setyawati, S.Si, M.Si Tanggal Ujian : 6 Agustus 2012
Disetujui oleh :
Pembimbing I, Pembimbing II,
Dra. Hartati, M.Si Harsasi Setyawati, S.Si, M.Si NIP. 19591115 198703 2 002 NIK. 139080769
Mengetahui, Ketua Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga. Diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seizin penulis dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Segala puji syukur kehadirat Allah SWT atas segala rahmat dan hidayah-Nya yang telah memberikan kemudahan dan kekuatan kepada penulis sehingga dapat menyelesaikan skripsi dengan judul “Sintesis dan Karakterisasi Material Magnetik Berbasis Senyawa Kompleks Inti Ganda Mangan(II) dengan 2,2’-Bipiridin Menggunakan Ligan Jembatan Oksalat”.
Di kesempatan kali ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Alfinda Novi Kristanti, DEA selaku ketua Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga.
2. Dra. Hartati, M.Si selaku dosen wali dan pembimbing I. Terima kasih atas bimbingan, masukan, dan perhatiannya terhadap penulis.
3. Harsasi Setyawati, S.Si, M.Si selaku dosen pembimbing II. Terima kasih atas bimbingan, ilmu, waktu, dan tenaga yang dengan ikhlas diberikan selama penyusunan skripsi ini.
4. Dra. Aning Purwaningsih, M.Si dan Dr. Ir. Suyanto, M.Si selaku penguji I dan II yang telah memberikan saran dan masukan yang membangun dalam kesempurnaan naskah skripsi ini.
5. Kedua orang tuaku tercinta, Bapak Amir dan Ibu Suharyati Suharsih yang senantiasa selalu memberikan kasih sayang, perhatian, doa, kekuatan dan dukungan yang sangat besar selama ini kepadaku. Terima kasih bapak, terima kasih ibu atas dukungannya kepadaku.
6. Adikku tercinta, Lila Mirna Tri Amaliyah yang selalu membuatku bersemangat dalam setiap waktuku.
7. Adikku Alm. M. Nur Suharyadi yang juga membuatku bersemangat dalam setiap waktuku.
9. Mbakku, Chory Angela Wijayanti yang senantiasa membantuku dalam penyusunan naskah skripsi ini.
10. Seluruh keluarga besarku yang telah memberikan doa dan bantuannya kepadaku.
11. Om Arif, yang senantiasa membantu dan memberikan doanya untukku. 12. Teman-temanku satu bimbingan, Natalia Dwi C., Putri Oktavia M., Inna
Noviyanti dan Hotma Wardani H. yang saling berbagi suka dan duka dalam penelitian dan penyusunan naskah skripsi ini.
13. Seluruh dosen dan tenaga kerja di departemen kimia yang telah membagi ilmu serta pengalamannya kepada penulis.
14. Mas Roch dan Pak Giman yang senantiasa membantuku selama penelitian di laboratorium lantai 1.
15. Semua teman-temanku kimia angakatan 2008 Universitas Airlangga yang senantiasa membantu.
16. Teman-teman kimia Universitas Airlangga angkatan 2009, 2010, dan 2011. Tentunya masih banyak kekurangan dalam penyusunan naskah skripsi ini. Oleh karena itu, penulis membuka selebar-lebarnya pemberian saran maupun kritik untuk kesempurnaan skripsi ini. Penulis sangat berharap agar skripsi ini dapat memberikan manfaat bagi semua pihak.
Surabaya, Agustus 2012 Penulis
Nirmawati Eka Putri, 2012. Sintesis dan Karakterisasi Material Magnetik Berbasis Senyawa Kompleks Inti Ganda Mangan(II) Dengan 2,2’-Bipiridin Menggunakan Ligan Jembatan Oksalat. Skripsi ini dibawah bimbingan Dra. Hartati, M.Si dan Harsasi Setyawati, S.Si, M.Si, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Penelitian ini bertujuan untuk mensintesis dan mengkarakterisasi senyawa kompleks inti ganda Mn(II)-bipiridin dengan oksalat sebagai ligan jembatan. Senyawa kompleks inti ganda disintesis melalui reaksi Mn(II) dari garam MnCl2.4H2O dengan ligan 2,2’-bipiridin dan ligan jembatan oksalat sesuai dengan perbandingan stoikiometri Mn(II) : bipy : oksalat = 2 : 4 : 1. Kristal senyawa kompleks inti ganda yang dihasilkan berwarna kuning-oranye. Senyawa kompleks inti ganda hasil sintesis dianalisis menggunakan spektrofotometer UV-Vis, spektrofotometer FT-IR, Magnetic Susceptibility Balance (MSB), dan konduktometer. Analisis menggunakan spektrofotometer UV-Vis diperoleh panjang gelombang maksimum senyawa kompleks inti ganda yaitu 521 nm. Analisis menggunakan spektrofotometer FT-IR menunjukkan adanya serapan Mn-N pada ligan 2,2’-bipiridin yang muncul pada 300,9 cm-1, sedangkan serapan Mn-O pada ligan jembatan oksalat muncul pada 408,91 cm-1. Analisis menggunakan Magnetic Susceptibility Balance (MSB) menunjukkan bahwa senyawa kompleks inti ganda bersifat paramagnetik dengan momen magnet sebesar 8,2085 BM. Analisis menggunakan konduktometer menunjukkan bahwa senyawa kompleks inti ganda memiliki muatan +3, sehingga rumus senyawa kompleksnya adalah [(OH)(bipy)2Mn(C2O4)Mn(bipy)2(OH)]3+.
Nirmawati Eka Putri, 2012. Synthesis and Characterization of Magnetic Material Based Binuclear Complex Compound Mangan(II) with 2,2’-Bipyridine Using Oxalate Bridging Ligand. It has been supervised by Dra. Hartati, M.Si and Harsasi Setyawati, S.Si, M.Si, Chemistry Department, Faculty of Science and Technology, Airlangga University, Surabaya.
ABSTRACT
The aim of the research is to synthesize and characterize the binuclear complex compound Mn(II)-bipyridine with oxalate as a bridging ligand. This binuclear complex compound synthesized through the reaction between Mn(II) of MnCl2.4H2O with 2,2’-bipyridine ligand and oxalate bridging ligand, according to the ratio of stoiciometric Mn(II) : bipy : oxalate = 2 : 4 : 1. The crystal colour of binuclear complex compound which produced is yellow-orange. The synthesized binuclear complex compound was analyzed by spectrophotometer UV-Vis, spectrophotometer FT-IR, Magnetic Susceptibility Balance (MSB) and conductometer. Analyze by the spectrophotometer UV-Vis has obtained the maximum wavelength of binuclear complex compound is 521 nm. Analyze by the spectrophotometer FT-IR has showed the band of Mn-N from bipyridine ligand, appeared at 300,9 cm-1. In the other hand, the band of Mn-O from oxalate bridging ligand appeared at 408,91 cm-1. Then, analyze by the Magnetic Susceptibility Balance(MSB) has showed that binuclear complex compound has a paramagnetic character with 8,2085 BM of magnetic moment. Analyze by conductometer showed that the binuclear complex compounds has +3 charge, so the formula of complex compound is [(OH)(bipy)2Mn(C2O4)Mn(bipy)2(OH)]3+.
DAFTAR ISI
Halaman
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang Masalah ... 1
1.2 Rumusan Masalah ... 2
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA... 4
2.1 Material Magnetik ... 4
2.2 Senyawa Kompleks ... 5
2.3 Mangan ... 6
2.4 Ligan 2,2’-bipiridin ... 7
2.5 Ligan Oksalat ... 7
2.6 Senyawa Kompleks Inti Ganda ... 8
2.7 Teori Pembentukan Senyawa Kompleks ... 9
2.7.1 Teori ikatan valensi ... 10
2.7.2 Teori medan kristal ... 11
2.7.3 Teori orbital molekul ... 13
2.8 Karakterisasi Hasil Sintesis Senyawa Kompleks ... 14
2.8.1 Spektroskopi UV-Vis ... 14
2.8.2 Spektroskopi inframerah ... 17
2.8.3 Analisis kemagnetan senyawa kompleks ... 19
2.8.4 Analisis secara konduktometri ... 20
BAB III METODOLOGI PENELITIAN ... 22
3.1 Pelaksanaan Penelitian ... 22
3.2 Bahan dan Peralatan Penelitian ... 22
3.2.1 Bahan penelitian ... 22
3.2.2 Peralatan penelitian ... 22
3.4.1 Pembuatan larutan Mn(II) 10-2M ... 24
3.4.2 Pembuatan larutan 2,2’-bipiridin 10-2M ... 24
3.4.3 Pembuatan larutan oksalat 10-2M ... 24
3.4.4 Penentuan panjang gelombang maksimum(λ maks) larutan Mn(II) 10-2M ... 24
3.4.5 Penentuan panjang gelombang maksimum(λ maks) larutan 2,2’-bipiridin 10-2M ... 25
3.4.6 Penentuan panjang gelombang maksimum(λ maks) larutan oksalat10-2M ... 25
3.4.7 Penentuan stoikiometri Mn(II) : bipy ... 25
3.4.8 Penentuan stoikiometri Mn(II) : bipy : oksalat ... 26
3.5 Sintesis Senyawa Kompleks ... 27
3.5.1 Sintesis senyawa kompleks inti tunggal ... 27
3.5.2 Sintesis senyawa kompleks inti ganda ... 28
3.6 Prosedur Karakterisasi ... 29
3.6.1 Spektroskopi UV-Vis ... 29
3.6.2 Spektroskopi FT-IR ... 29
3.6.3 Analisis kemagnetan ... 29
3.6.4 Analisis daya hantar listrik ... 29
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1 Penentuan stoikiometri senyawa kompleks inti tunggal ... 31
4.2 Sintesis senyawa kompleks inti tunggal ... 33
4.3 Penentuan stoikiometri senyawa kompleks inti ganda ... 34
4.4 Sintesis senyawa kompleks inti ganda ... 35
4.5 Karakterisasi senyawa kompleks inti tunggal dan inti ganda ... 37
4.5.1 Analisis spektra senyawa kompleks inti tunggal dan inti ganda menggunakan spektrofotometer UV-Vis .. 37
4.5.2 Analisis spektra senyawa kompleks inti tunggal dan inti ganda menggunakan spektrofotometer FT-IR ... 40
4.5.3 Analisis kemagnetan senyawa kompleks inti tunggal dan inti ganda menggunakan MSB ... 43
4.5.4 Analisis muatan senyawa kompleks inti tunggal dan inti ganda menggunakan konduktometer ... 46
4.6 Aplikasi material magnetik berbasis senyawa kompleks inti ganda ... 47
BAB V KESIMPULAN DAN SARAN ... 48
5.1 Kesimpulan ... 48
5.2 Saran ... 49
DAFTAR TABEL
Tabel Judul Tabel Halaman
2.1 Spektrum cahaya tampak dan warna-warna komplementer
17
3.1 Penambahan larutan 2,2’-bipiridin 10-2 M ke dalam larutan Mn(II) 10-2 M dengan metode perbandingan mol
26
3.2 Penambahan larutan oksalat 10-2 M secara bertahap ke dalam larutan Mn(II) 10-2 M dan larutan 2,2’-bipiridin 10-2 M dengan metode perbandingan mol
27
4.1 Panjang gelombang senyawa kompleks inti tunggal dan inti ganda hasil sintesis
37
4.2 Hasil momen magnet kristal senyawa kompleks inti tunggal dan inti ganda hasil sintesis
43
4.3 Data hantaran molar senyawa kompleks inti tunggal dan inti ganda hasil sintesis
DAFTAR GAMBAR
Gambar Judul Gambar Halaman
2.1 Struktur 2,2’-bipiridin 7
2.2 Struktur ion oksalat 8
2.3 Pembentukan senyawa kompleks [Mn(H2O)6]2+ 10 2.4 Pemisahan orbital 3d pada Co3+ sebagai medan
kuat dan medan lemah
12
2.5 Diagram orbital molekul pada senyawa kompleks dengan struktur ruang oktahedral
14
2.6 Spektra Mn-bipy dalam mesopori Al-MCM-41 16 4.1 Grafik perbandingan mol Mn(II) : bipy 32 4.2 Prediksi struktur senyawa kompleks inti tunggal 32 4.3 Kristal senyawa kompleks inti tunggal 33 4.4 Kristal senyawa kompleks inti tunggal dengan
perbesaran 600x
33
4.5 Grafik perbandingan mol Mn(II) : oksalat 34 4.6 Prediksi struktur senyawa kompleks inti ganda 35 4.7 Kristal senyawa kompleks inti ganda 36 4.8 Kristal senyawa kompleks inti ganda dengan
perbesaran 600x
36
4.9 Spektra UV-Vis senyawa kompleks inti tunggal 37 4.10 Spektra UV-Vis senyawa kompleks inti ganda 38 4.11 Absortivitas molar pada Mn(II) 39 4.12 Spektra IR senyawa kompleks inti tunggal dan inti
ganda
DAFTAR LAMPIRAN
Lampiran Judul Lampiran
1.1 Spektra UV-Vis MnCl2.4H2O
1.2 Spektra UV-Vis garam MnCl2.4H2O secara kualitatif 1.3 Spektra UV-Vis 2,2’-bipiridin
1.4 Spektra UV-Vis amonium oksalat
1.5 Spektra UV-Vis senyawa kompleks inti tunggal 1.6 Spektra UV-Vis senyawa kompleks inti ganda 2.1 Spektra FT-IR senyawa kompleks inti tunggal 2.2 Spektra FT-IR senyawa kompleks inti ganda 2.3 Spektra FT-IR 2,2’-bipiridin
2.4 Spektra FT-IR amonium oksalat 2.5 Spektra FT-IR MnCl2.4H2O
3 Penentuan sifat kemagnetan senyawa kompleks hasil sintesis 4 Penentuan stoikiometri senyawa kompleks inti tunggal dan inti
BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Saat ini perkembangan material magnetik sudah mengarah pada senyawa magnetik berbasis senyawa kompleks, seperti senyawa kompleks inti ganda. Material magnetik ini berkembang dengan pesat karena kebutuhan teknologi yang semakin meningkat setiap tahunnya. Aplikasi material magnetik berbasis senyawa kompleks telah terbukti dapat diaplikasikan sebagai sumber energi, bahan penyimpan data dan pengeras suara radio (Setiawan, 2008).
Senyawa kompleks merupakan senyawa yang tersusun dari atom pusat dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebas kepada atom pusat (House, 2008). Senyawa kompleks juga dapat dikatakan sebagai kombinasi dari asam Lewis, yaitu atom pusat dengan sejumlah basa Lewis, yaitu ligan (Atkins, dkk., 2010).
kompleks. Khususnya logam Mn yang memiliki nilai momen magnet yang cukup besar yaitu 5,92 BM (Bohr Magneton) (Housecroft dan Sharpe, 2005).
Ligan 2,2’-bipiridin dapat bertindak sebagai donor pasangan elektron dan merupakan ligan bidentat, yaitu ligan yang dapat menyumbangkan dua pasang elektron. Ligan ini termasuk ligan yang memiliki kerapatan elektron yang tinggi sehingga dapat meningkatkan sifat kemagnetikkan senyawa kompleks. Ligan ini sangat menarik karena digunakan sebagai pengkelat yang mengelilingi atom pusat (Palanisami dan Murugavel, 2011). Sementara itu, ligan oksalat merupakan ligan jembatan yang dapat bertindak sebagai mediator interaksi magnetik antar ion logam yang dihubungkan (Reinoso, dkk., 2005). Selain itu, ligan ini murah dan mudah diperoleh, sehingga potensial dijadikan sebagai ligan jembatan dalam pembentukan senyawa kompleks inti ganda.
Berdasarkan uraian diatas, maka pada penelitian ini akan dilakukan sintesis dan karakterisasi senyawa kompleks inti ganda yang mempunyai potensial sebagai material magnetik dengan menggunakan logam Mn, ligan 2,2’-bipiridin serta ligan jembatan oksalat.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan diatas, maka dapat dirumuskan masalah sebagai berikut.
2. Bagaimana karakterisasi senyawa kompleks inti ganda Mn(II)-2,2’-bipiridin dengan ligan jembatan oksalat?
1.3 Tujuan Penelitian
1. Mempelajari cara mensintesis senyawa kompleks inti ganda Mn(II)-2,2’-bipiridin dengan ligan jembatan oksalat.
2. Karakterisasi senyawa kompleks inti ganda Mn(II)-2,2’-bipiridin dengan ligan jembatan oksalat.
1.4 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Material Magnetik
Perkembangan menarik dari molekul baru berdasarkan penelitian material magnetik terletak pada hubungan struktur magnetik dan material kompleks multidimensi (Nemec, dkk., 2011). Jenis material magnetik yang didasarkan pada respon terhadap medan magnet dan interaksi antar-atom meliputi diamagnetik, paramagnetik, dan feromagnetik. Saat ini, sudah banyak dikembangkan material magnetik berbasis senyawa kompleks. Senyawa kompleks sangat populer diantara kalangan kimiawan dan fisikawan, karena mempelajari fenomena fisika yang berhubungan dengan kemagnetan (Kocanova, dkk., 2010). Desain material multifungsi baru merupakan medan perubahan bagi penelitian yang berkembang pada kimia molekuler, material kimia dan fisika. Sebagai contohnya, kompleks bipiridin dan fenantrolin yang secara umum digunakan dengan variasi logam transisi (Lehleh, dkk., 2011).
2.2 Senyawa Kompleks
Dalam kimia koordinasi, dikenal istilah kompleks yang berarti atom pusat (logam) atau ion pusat yang dikelilingi oleh ligan (Atkins, dkk., 2010). Ligan adalah molekul netral atau ion yang memiliki sepasang elektron bebas yang digunakan untuk membentuk ikatan dengan logam. Ikatan antara logam dengan ligan dapat dikatakan sebagai interaksi antara basa Lewis (ligan) dan asam Lewis (logam), sehingga menghasilkan ikatan kovalen koordinasi (Zumdahl dan Zumdahl, 2007). Senyawa kompleks terbentuk karena adanya ikatan antara atom pusat (logam) yang berperan sebagai akseptor pasangan elektron dengan ligan sebagai donor pasangan elektron (Effendy, 2007).
Secara umum, logam transisi banyak digunakan sebagai atom pusat karena memiliki orbital d yang elektronnya tidak terisi penuh, sehingga logam transisi cenderung untuk membentuk ion kompleks. Sementara itu, ligan dalam berikatan dengan ion pusat (logam) tergantung pada jumlah pasangan elektron bebas yang didonorkan pada ion pusat (logam). Ligan yang hanya mendonorkan sepasang elektron bebas disebut ligan monodentat, seperti H2O dan NH3, sedangkan ligan yang mendonorkan dua pasang elektron bebas disebut ligan bidentat, seperti etilendiamin, NH2CH2CH2NH2(Chang, 2002).
penting dalam sistem oksidasi reduksi biologi pada fotosistem II (Kaizaki, dkk., 2009). Penelitian tentang senyawa kompleks cisplatin yang merupakan obat antikanker berperan penting dalam bidang kesehatan (Chang, dkk., 2011).
2.3 Mangan
Mangan pertama kali ditemukan oleh Johann Gahn pada tahun 1774 kebangsaan Swedia. Mangan merupakan salah satu unsur dari logam transisi yang mempunyai nomor atom 25 dengan konfigurasi elektronnya adalah (Ar) 3d5 4s2. Dalam keadaan murni, logam mangan berwarna putih seperti perak, sangat keras, tetapi mudah patah. Mangan dapat berada pada semua tingkat oksidasi, yaitu +2 sampai dengan +7 (Zumdahl dan Zumdahl, 2007).
Semua senyawa mangan(II) yang mempunyai spin tinggi menunjukkan sifat yang sangat stabil. Kestabilan mangan(II) dalam keadaan spin tinggi ditunjukkan oleh variasi kestabilan senyawa yang terbentuk. Sebagai contoh adalah [Mn(H2O)6]2+yang mempunyai warna merah muda (Mackay, dkk., 2002). Kation mangan(II) berasal dari mangan(II) oksida membentuk garam-garam yang kurang berwarna. Jika senyawa tersebut mengandung air pada pengkristalannya, maka larutannya berwarna agak merah muda. Hal ini disebabkan oleh adanya ion heksaakuomanganat(II) yaitu [Mn(H2O)6]2+(Svehla, 1996).
titik leleh 58oC, dan mempunyai toksisitas yang rendah sehingga aman digunakan dalam penelitian (Svehla, 1996).
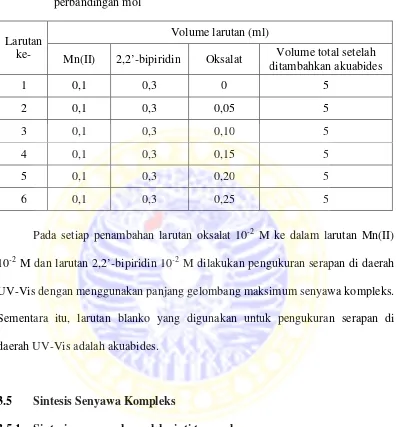
2.4 Ligan 2,2’-bipiridin
Ligan 2,2’-bipiridin merupakan ligan senyawa organik dengan rumus molekul (C10H8N2). Ligan 2,2’-bipiridin termasuk ligan bidentat, yaitu ligan yang dapat menyumbangkan dua pasang elektron bebas ke ion pusat. Umumnya, ligan ini sering disingkat dengan bipy. Ligan 2,2’-bipiridin berfungsi sebagai ligan pengkelat dalam mengikat logam (Chang, dkk., 2011). Adapun struktur molekul ligan 2,2’-bipiridin tertera pada Gambar 2.1.
N N
Gambar 2.1 Struktur 2,2’-bipiridin
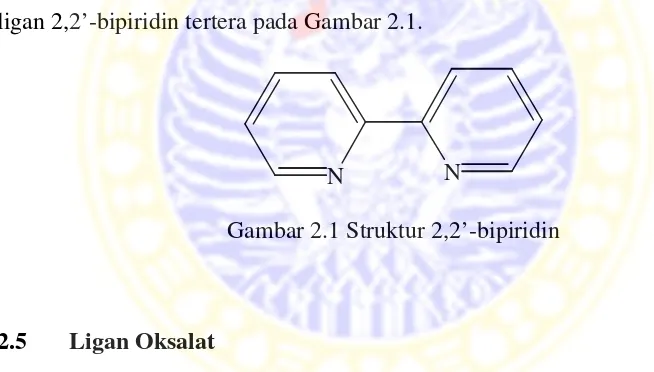
2.5 Ligan Oksalat
Ligan oksalat merupa material magnetik yan ganda [N(C4H9)4[Mn BM (Putri dan Mart magnet sebesar 7,51 B
2.6 Senyawa Kom Senyawa kom pusat lebih dari satu, dihubungkan oleh liga gugus jembatan dan m lain akan membentuk
upakan logam yang paling aktif digunakan untuk yang tinggi. Sebagai contohnya adalah senyaw MnIIFeIII(ox)3] yang mempunyai momen magn Martak, 2010) dan [N(C4H9)4[MnCr(ox)3] mem
BM (Elmila dan Martak, 2011).
ompleks Inti Ganda
kompleks inti ganda merupakan senyawa yang satu, antara ion pusat yang satu dengan ion
ligan jembatan. Senyawa kompleks inti ganda yawa kompleks tunggal. Senyawa kompleks cara menggabungkan logam (M) dengan li gunakan sebagai senyawa awal dalam pembua
.
M + nL→ M(L)n
rsebut, dengan mengganti satu atau lebih lig n menggabungkannya dengan senyawa komple uk senyawa kompleks inti ganda.
Gambar 2.2 Struktur ion oksalat
Pembentukan senyawa kompleks inti ganda lazim menggunakan ligan jembatan sebagai mediator interaksi magnetik diantara ion logam transisi pusat dengan ion logam transisi yang lainnya (Elmila dan Martak, 2011). Penelitian sebelumnya, telah mensintesis senyawa kompleks inti ganda [(bipy)2MnII (µ-C2H5CO2)2-MnII(bipy)2](ClO4)2. Dalam hal ini, dua Mn(II) dengan masing-masing dua ligan 2,2’-bipiridin dijembatani oleh dua ligan karboksilat (Zhang dan Janiak, 2001).
Cara mensintesis senyawa kompleks inti ganda adalah berdasarkan jenis atom atau ion logamnya, yaitu senyawa kompleks homologam dan senyawa kompleks heterologam. Senyawa kompleks homologam merupakan senyawa kompleks yang atom atau ion pusatnya sejenis, sebagai contohnya adalah [(bipy)2MnII(µ-C2H5CO2)2-MnII(bipy)2](ClO4)2 (Zhang dan Janiak, 2001). Sementara itu, senyawa kompleks heterologam merupakan senyawa kompleks yang atom atau ion pusatnya tidak sejenis, sebagai contohnya adalah [N(C4H9)4[MnCr(ox)3] (Elmila dan Martak, 2011) dan [N(C4H9)4[MnIIFeIII(ox)3] (Putri dan Martak, 2010). Sintesis senyawa kompleks inti ganda dapat dilakukan dengan menggunakan metode perbandingan mol atom pusat dengan ligan (Balzani, dkk., 1996).
2.7 Teori Pembentukan Senyawa Kompleks
2.7.1 Teori ikatan valensi
Teori ikatan valensi dikemukakan oleh Linus Pauling. Teori ini menyatakan jumlah orbital pada atom atau ion pusat sama dengan jumlah ligan sehingga menghasilkan ikatan kovalen kompleks antara ion pusat dan orbital ligan. Tumpang tindih antara orbital ion pusat dan orbital ligan yang menghasilkan ikatan kovalen yang kuat (Huheey, dkk., 1993) sehingga menghasilkan hibridisasi membentuk orbital baru yang disebut orbital hibrida. Orbital hibrida mempunyai sifat yang berbeda dengan orbital ion pusat dan orbital ligan yang lama. Pembentukan orbital hibrida menunjukkan struktur ruang senyawa kompleks.
Sebagai contoh pada ion kompleks [Mn(H2O)6]2+, pembentukan ikatan hibrida membentuk orbital hibrida baru dapat dijelaskan pada Gambar 2.3.
25Mn = [Ar] 3d54s2 Mn pada keadaan dasar
↿ ↿ ↿ ↿ ↿
↿⇂
Mn2+keadaan dasar
↿ ↿ ↿ ↿ ↿
[Mn(H2O)6]2+
↿ ↿ ↿ ↿ ↿
xx
xx xx xx
xx
xx
Gambar 2.3 Pembentukan senyawa kompleks [Mn(H2O)6]2+
sp3d2
3d 4s 4p 4d
3d 4s 4p
Pada saat keadaan tereksitasi, Mn2+berikatan dengan enam ligan H2O membentuk [Mn(H2O)6]2+ yang mempunyai lima elektron yang tidak berpasangan. Senyawa kompleks [Mn(H2O)6]2+ disebut sebagai senyawa kompleks orbital luar (outer orbital complex) karena orbital yang ditempati oleh semua pasangan elektron bebas ligan adalah orbital d yang luar. Selain itu, [Mn(H2O)6]2+disebut sebagai senyawa kompleks spin tinggi (high spin) karena tedapat elektron yang tidak berpasangan (Muryanti, 2001).
2.7.2 Teori medan kristal
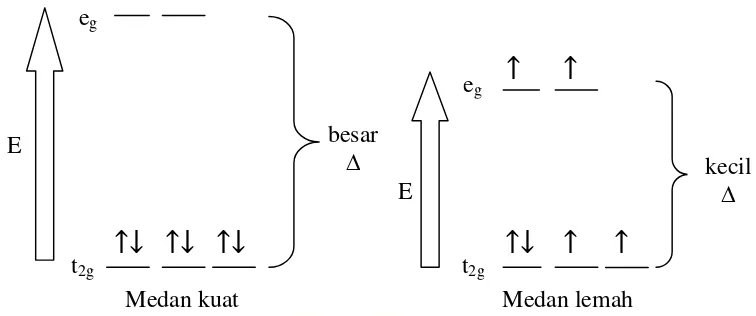
Teori medan kristal dikemukakan oleh Hans Bethe dan John Van Vleck pada tahun 1930. Teori ini mengasumsikan bahwa interaksi logam-ligan terjadi pada tingkat yang berbeda. Oleh sebab itu, sebuah kompleks akan relatif distabilkan dalam ion bebas karena tarik-menarik antara muatan negatif ligan dan muatan positif logam (Janes dan Moore, 2004). Hal ini merupakan model elektrostatik dan menggunakan elektron ligan untuk membuat sebuah medan listrik disekitar logam pusat (Housecroft dan Sharpe, 2005). Pengaruh medan listrik ligan, terutama pada elektron orbital d ion pusat menyebutkan tingkat energi orbital d bertambah dan akhirnya terpisah dengan energi yang tidak sama. Pemisahan kelima orbital d ion pusat disebut medan kristal (Huheey, dkk., 1993).
↑ ↑
↑↓ ↑↓ ↑↓
↑↓ ↑ ↑
Gambar 2.4 Pemisahan orbital 3d pada Co3+sebagai medan kuat dan medan lemah (Zumdahl dan Zumdahl, 2007)
Jika pemisahan dihasilkan oleh ligan yang sangat besar atau kuat (medan kuat), maka elektron akan berpasangan pada energi yang lebih rendah dalam orbital t2g (low spin), sehingga menghasilkan kompleks diamagnetik. Disamping itu, jika pemisahan dihasilkan oleh ligan yang kecil atau lemah (medan lemah), elektron akan mengisi kelima orbital sebelum berpasang-pasangan (high spin), sehingga menghasilkan kompleks yang memiliki elektron yang tidak berpasangan disebut sebagai paramagnetik (Zumdahl dan Zumdahl, 2007).
Pada pemisahan orbital 3d, orbital eg mengalami peningkatan energi sedangkan orbital t2g mengalami penurunan energi, sehingga antara kedua orbital tersebut terdapat perbedaan energi. Perbedaan energi dilambangkan dengan ∆ yang harganya 10 Dq yang disebut sebagai energi stabilisasi medan kristal atau CFSE (Crystal Field Stabilization Energy). Setiap elektron pada t2g mempunyai energi sebesar -4 Dq sedangkan pada eg mempunyai elektron sebesar +6 Dq. Pemisahan kelima orbital d disebabkan adanya pengaruh medan ligan (Muryanti, 2001).
Medan kuat Medan lemah
Ligan-ligan yang berbeda akan menghasilkan kekuatan medan kristal yang berbeda pula. Sebagai contoh adalah kekuatan medan kristal atau harga 10 Dq untuk ion-ion kompleks [CrCl6]3-, [Cr(NH3)6]3+ dan [Cr(CN)6]3-. Harga 10 Dq untuk ion-ion kompleks tersebut secara berturut-turut adalah adalah 163 kJ/mol, 259 kJ/mol, dan 314 kJ/mol. Hal ini disebabkan kekuatan ligan CN-> NH3> Cl-. Oleh sebab itu, Fajans dan Tsuchida berhasil membuat urutan relatif kekuatan beberapa ligan yang disebut dengan deret spektrokimia atau deret Fajans-Tsuchida (Effendy, 2007).
I- < Br- < S2- < SCN- < Cl- < NO
3- < F- < urea- OH- < ox2- - O2- < H2O < NCS- < CH
3CN < NH3-py < en < bipy– phen < NO2- < fosfina < C6H5- < CN- < CO
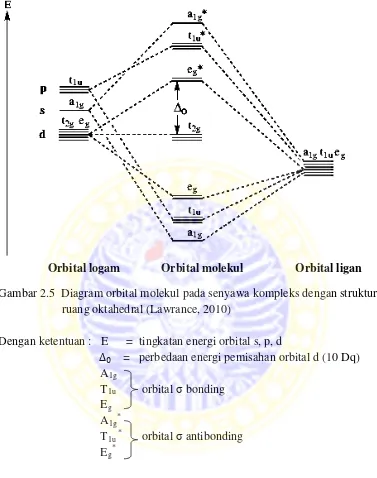
2.7.3 Teori orbital molekul
Gambar 2.5 Diagram orbital molekul pada senyawa kompleks dengan struktur ruang oktahedral (Lawrance, 2010)
Dengan ketentuan : E = tingkatan energi orbital s, p, d
∆ = perbedaan energi pemisahan orbital d (10 Dq) A1g
T1u orbitalσbonding Eg
A1g*
T1u* orbitalσantibonding Eg*
2.8 Karakterisasi Hasil Sintesis Senyawa Kompleks 2.8.1 Spektroskopi UV-Vis
Absorpsi atom atau molekul (M) di daerah ultraviolet dan sinar tampak dibedakan menjadi proses dua tahap. Tahap pertama melibatkan eksitasi elektronik yang ditunjukkan sebagai berikut.
M +ℎݒ →M⋆
Produk absorpsi oleh energi foton (hv) pada molekul (M) merupakan molekul tereksitasi yang disimbolkan oleh M⋆. Tahap kedua merupakaan proses relaksasi yang melibatkan konversi energi eksitasi menjadi panas (Skoog, dkk., 2007).
M⋆ →M + heat
Absorpsi sinar UV-Vis untuk kompleks logam-ligan anorganik adalah perpindahan muatan, dimana absorpsi oleh foton menghasilkan keadaan tereksitasi yaitu perpindahan elektron dari logam (M) ke ligan (L).
M−L + hv→Mା−Lି
Absorpsi perpindahan muatan menghasilkan absorbansi yang besar. Pada absorpsi perpindahan muatan kemungkinan elektron juga dapat bergerak dari ligan ke ion logam (Harvey, 2009). Selain transisi d-d, ada juga transisi yang disebabkan oleh adanya transfer muatan dari logam ke ligan yang disebut Metal Ligand Charge Transfer (MLCT), dan muatan dari ligan ke logam yang disebutLigand to Metal Charge Transfer(LMCT).
adanya puncak yang salah satu contoh spe Dalam hal ini : A = Spe dalam air, sehingga i rentang panjang gelom warna atau panjang ge bahwa zat tersebut me
ng spesifik (Kim, dkk., 1997). Pada Gambar spektra kompleks Mn-bipy dalam mesopor Spektra Al-MCM-41
Spektra Al-MCM-41-[MnL2]2+(5%) Spektra Al-MCM-41-[MnL2]2+(7%) Spektra MnL2(NO3)2
Spektra MnL2(NO3)2yang terimpregnasi silika ukkan spektra MnL2(NO3), dengan L adalah 2,2’
spektra dari logam Mn dengan ligan 2,2’ g.
ktra Mn-bipy dalam mesopori Al-MCM-41(Kim logam transisi seperti Cu(II) dan Co(II) pada la a ion logam tersebut dapat mengabsorpsi sina lombang sesuai pada Tabel 2.1. Ketika suatu za gelombang tertentu pada daerah sinar tampak, meneruskan warna komplementernya yang nam
sebagai warna. Adapun spektrum cahaya tampak dengan warna komplementernya pada berbagai rentang panjang gelombang tertera pada Tabel 2.1.
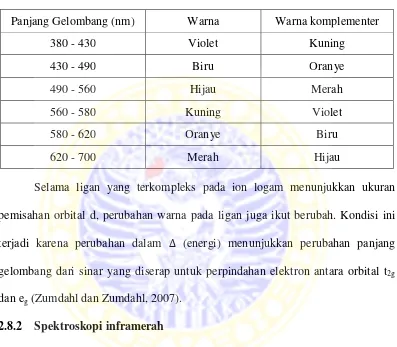
Tabel 2.1 Spektrum cahaya tampak dan warna-warna komplementer (Housecroft dan Sharpe, 2005).
Panjang Gelombang (nm) Warna Warna komplementer
380 - 430 Violet Kuning
430 - 490 Biru Oranye
490 - 560 Hijau Merah
560 - 580 Kuning Violet
580 - 620 Oranye Biru
620 - 700 Merah Hijau
Selama ligan yang terkompleks pada ion logam menunjukkan ukuran pemisahan orbital d, perubahan warna pada ligan juga ikut berubah. Kondisi ini terjadi karena perubahan dalam ∆ (energi) menunjukkan perubahan panjang gelombang dari sinar yang diserap untuk perpindahan elektron antara orbital t2g dan eg(Zumdahl dan Zumdahl, 2007).
2.8.2 Spektroskopi inframerah
Radiasi inframerah (IR) ditemukan oleh Sir William Herschel pada tahun 1800. Radiasi inframerah merupakan spektrum elektromagnetik yang terletak diantara daerah tampak dan gelombang mikro. Rentangan daerah inframerah adalah 4000-400 cm-1. Daerah yang rentangnya mulai 12.800-4000 cm-1 disebut daerah inframerah dekat, sedangkan daerah yang berkisar antara 700-200 cm-1 merupakan daerah inframerah jauh.
getaran atau vibrasi. Apabila molekul menyerap radiasi inframerah menyebabkan eksitasi molekul ke tingkat energi vibrasi yang lebih tinggi (Silverstein, dkk., 2005). Untuk mengabsorpsi radiasi inframerah, maka sebuah molekul harus mengalami perubahan momen dipol sebagai akibat adanya vibrasi dan rotasi (Skoog, dkk., 2007).
Pada umumnya, vibrasi molekul yang tereksitasi oleh radiasi inframerah merupakan vibrasi ulur (streching) dan vibrasi tekuk (bending). Vibrasi ulur menunjukkan perubahan sepanjang ikatan yang menghasilkan perubahan jarak antar atom, sedangkan vibrasi tekuk menunjukkan perubahan sudut ikatan antar atom. Sebuah molekul yang terdiri atas dua atom atau lebih bergabung karena ikatan kimia, seperti vibrasi atom yang satu dengan yang lainnya (Robinson dkk., 2005).
Hasilnya, menunjukkan bahwa terdapat hubungan yang menarik antara vibrasi M-N dan struktur elektronik ion logam yang dijelaskan sebagai berikut.
1. Pada Cr(III), Cr(II), Cr(I), Cr(0), V(II), V(0), Ti(0), Ti(I), Fe(II) dan Co(III) yang telah terisi atau sebagian terisi orbital t2g dan orbital eg yang kosong sehingga akan muncul vibrasi M-N dari logam pada daerah 300-390 cm-1. Logam tersebut dikelompokkan sebagai kelompok A.
2. Pada Co(II), Co(I), Co(0), Mn(II), Mn(0), Mn(I), Ni(II), Cu(II), dan Zn(II) telah terisi atau sebagian terisi orbital eg. Vibrasi M-N pada logam ini berada pada daerah 180-290 cm-1, sehingga disebut kelompok B.
3. Tidak terlihat perubahan frekuensi yang tajam pada Cr(III)-Cr(0) dan Co(II)-Co(0), meskipun penurunan tajam pada frekuensi telah diamati dari Co(III) ke Co(II) (Nakamoto, 2009).
2.8.3 Analisis kemagnetan senyawa kompleks
Sifat kemagnetan senyawa kompleks dapat diketahui dari jumlah elektron yang tidak berpasangan dalam suatu orbital molekul. Senyawa yang elektronnya berpasangan bersifat diamagnetik yaitu ditolak oleh medan magnet, sedangkan senyawa yang memiliki satu atau lebih elektron yang tidak berpasangan bersifat paramagnetik, yaitu ditarik oleh medan magnet (Atkins, dkk., 2010). Pengukuran sifat kemagnetan ini disebut magnetic susceptibility (Miessler dan Tarr, 2003). Untuk menghitung besarnya momen magnet suatu senyawa kompleks dapat menggunakan alat Magnetic Susceptibility Balance (MSB). Adapun rumus yang digunakan adalah sebagai berikut.
Xg =େౘౢౙ×୪× (ୖିୖబ)
Dalam hal ini : Cbalance = 1
l = panjang sampel (cm)
R = nilai tabung dan sampel yang terbaca R0 = nilai tabung kosong yang terbaca m = massa sampel (gram)
Xg = momen massa
Nilai yang diperoleh dari persamaan di atas dikonversi menjadi momen magnet menggunakan rumus sebagai berikut.
Xm = Xg × Mr (2.2)
μୣ = 2,82√Xm × T (2.3)
Dengan ketentuan : μୣ = momen magnet (BM = Bohr Magneton) Mr = massa molekul relatif sampel (g mol-1) T = suhu (K)
Xm = momen molar 2.8.4 Analisis secara konduktometri
oleh berkurangnya efek-efek antar ionik untuk elektrolit-elektrolit kuat dan oleh kenaikan derajat disosiasi untuk elektrolit-elektrolit lemah.
BAB III
METODOLOGI PENELITIAN
3.1 Pelaksanaan Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga Surabaya, mulai bulan Februari sampai dengan Juli 2012.
3.2 Bahan dan Peralatan Penelitian 3.2.1 Bahan penelitian
Bahan-bahan kimia yang digunakan dalam penelitian ini memiliki derajat kemurnian pro analysis (p.a) meliputi Mn(II) klorida tetrahidrat, 2,2’-bipiridin, amonium oksalat, metanol, dan akuabides.
3.2.2 Peralatan penelitian
Analisis menggunakan : Spektrofotometer UV-Vis Spektrofotometer FT-IR
Magnetic Susceptibility Balance(MSB) Konduktometer
3.3 Diagram Alir Penelitian
Sintesis senyawa 2,2’-bipiridin 10-2M Oksalat 10-2M
Penentuan panjang gelombang maksimum : Mn(II) 10-2M
2,2’-bipiridin 10-2M Oksalat 10-2M
Penentuan stoikiometri Mn(II) : bipy
(metode perbandingan mol)
Penentuan stoikiometri Mn(II) : bipy : oksalat (metode perbandingan mol)
3.4 Prosedur Penelitian
3.4.1 Pembuatan larutan Mn(II) 10-2M
Garam mangan klorida tetrahidrat (MnCl2.4H2O) ditimbang dengan tepat sebanyak 0,1979 gram, kemudian dilarutkan dengan akuabides dalam gelas beker 100 ml. Setelah semua larut, larutan dimasukkan ke dalam labu ukur 100 ml dan diencerkan dengan akuabides hingga tanda batas. Setelah itu, larutan dihomogenkan.
3.4.2 Pembuatan larutan 2,2’-bipiridin 10-2M
Senyawa 2,2’-bipiridin (C10H8N2) ditimbang dengan tepat sebanyak 0,1560 gram, kemudian dilarutkan dengan akuabides dalam gelas beker 100 ml. Setelah semua larut, larutan dimasukkan ke dalam labu ukur 100 ml dan diencerkan dengan akuabides hingga tanda batas. Setelah itu, larutan dihomogenkan.
3.4.3 Pembuatan larutan oksalat 10-2M
Amonium oksalat (NH4)2C2O4 ditimbang dengan tepat sebanyak 0,1240 gram, kemudian dilarutkan dengan akuabides dalam gelas beker 100 ml. Setelah semua larut, larutan dimasukkan ke dalam labu ukur 100 ml dan diencerkan dengan akuabides hingga tanda batas. Setelah itu, larutan dihomogenkan.
3.4.4 Penentuan panjang gelombang maksimum(λ maks) larutan Mn(II) 10-2M
3.4.5 Penentuan panjang gelombang maksimum(λ maks) larutan 2,2’-bipiridin 10-2M
Larutan 2,2’-bipiridin 10-2 M dimasukkan ke dalam kuvet, kemudian diukur panjang gelombang maksimumnya dengan rentang panjang gelombang 200-380 nm.
3.4.6 Penentuan panjang gelombang maksimum(λ maks) larutan oksalat 10-2M
Larutan oksalat 10-2 M dimasukkan ke dalam kuvet, kemudian diukur panjang gelombang maksimumnya dengan rentang panjang gelombang 200-380 nm.
3.4.7 Penentuan stoikiometri Mn(II) : bipy
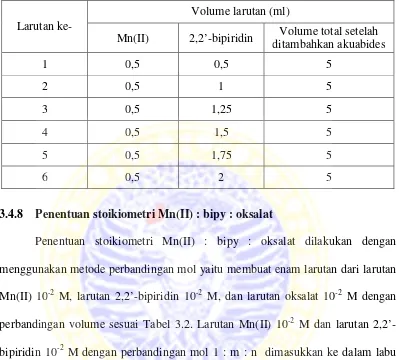
Penentuan stoikiometri Mn(II) : bipy dilakukan dengan menggunakan metode perbandingan mol yaitu membuat enam larutan dari larutan Mn(II) 10-2M dan larutan 2,2’-bipiridin 10-2 M dengan perbandingan volume sesuai Tabel 3.1. Larutan Mn(II) 10-2 M dengan volume tertentu dimasukkan ke dalam labu ukur 5 ml, kemudian ditambahkan secara bertahap larutan 2,2’-bipiridin 10-2 M. Selanjutnya, larutan tersebut diencerkan menggunakan akuabides hingga tanda batas. Adapun penambahan larutan 2,2’-bipiridin 10-2 M ke dalam larutan Mn(II) 10-2M dengan metode perbandingan mol tertera pada Tabel 3.1.
Tabel 3.1 Penambahan larutan 2,2’-bipiridin 10-2M ke dalam larutan Mn(II) 10-2 M dengan metode perbandingan mol
Larutan
ke-Volume larutan (ml)
Mn(II) 2,2’-bipiridin Volume total setelah ditambahkan akuabides
1 0,5 0,5 5
2 0,5 1 5
3 0,5 1,25 5
4 0,5 1,5 5
5 0,5 1,75 5
6 0,5 2 5
3.4.8 Penentuan stoikiometri Mn(II) : bipy : oksalat
Tabel 3.2 Penambahan larutan oksalat 10-2 M secara bertahap ke dalam larutan Mn(II) 10-2 M dan larutan 2,2’-bipiridin 10-2 M dengan metode perbandingan mol
Larutan
ke-Volume larutan (ml)
Mn(II) 2,2’-bipiridin Oksalat Volume total setelah ditambahkan akuabides
1 0,1 0,3 0 5
2 0,1 0,3 0,05 5
3 0,1 0,3 0,10 5
4 0,1 0,3 0,15 5
5 0,1 0,3 0,20 5
6 0,1 0,3 0,25 5
Pada setiap penambahan larutan oksalat 10-2 M ke dalam larutan Mn(II) 10-2 M dan larutan 2,2’-bipiridin 10-2M dilakukan pengukuran serapan di daerah UV-Vis dengan menggunakan panjang gelombang maksimum senyawa kompleks. Sementara itu, larutan blanko yang digunakan untuk pengukuran serapan di daerah UV-Vis adalah akuabides.
3.5 Sintesis Senyawa Kompleks
3.5.1 Sintesis senyawa kompleks inti tunggal
kompleks inti tunggal didiamkan selama beberapa hari pada suhu kamar dan ditutup menggunakan kertas saring agar terbentuk kristal senyawa kompleks tunggal.
3.5.2 Sintesis senyawa kompleks inti ganda
3.6 Prosedur Karakterisasi 3.6.1 Spektroskopi UV-Vis
Masing-masing kristal senyawa kompleks hasil sintesis yaitu kristal senyawa kompleks inti tunggal dan inti ganda dilarutkan dalam akuabides, kemudian dianalisis spektrumnya dengan panjang gelombang 200-700 nm menggunakan spektrofotometer Shimadzu UV-1800.
3.6.2 Spektroskopi FT-IR
Masing-masing padatan kristal senyawa kompleks hasil sintesis yaitu kristal senyawa kompleks inti tunggal dan inti ganda dicampur dengan KBr, kemudian dibuat pellet. Selanjutnya, diukur serapan inframerahnya pada bilangan gelombang 4000-300 cm-1 menggunakan spektrofotometer Inframerah Jasco FT-IR 5300.
3.6.3 Analisis kemagnetan
Masing-masing padatan kristal senyawa kompleks hasil sintesis yaitu kristal senyawa kompleks inti tunggal dan inti ganda ditumbuk sampai halus dalam mortar, kemudian dimasukkan ke dalam kuvet MSB sampai homogen. Masing-masing padatan halus dianalisis momen magnetnya menggunakan
Magnetic Susceptibility Balance(MSB). 3.6.4 Analisis daya hantar listrik
FeCl3.6H2O untuk muatan +3, yang masing-masing dibuat dengan konsentrasi 2x10-3 M dalam labu ukur 100 ml. Sebanyak 0,0149 gram KCl, 0,0406 gram MgCl2.6H2O, dan 0,0541 gram FeCl3.6H2O dilarutkan dalam akuabides pada labu ukur 100 ml. Sementara itu, pada konsentrasi yang sama dengan larutan pembanding yaitu 2x10-3 M, ditimbang sebanyak 0,0333 gram kristal senyawa kompleks inti tunggal dan 0,0589 gram kristal senyawa kompleks inti ganda yang dilarutkan dengan akuabides pada labu ukur 25 ml.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian dan pembahasan, dapat disimpulkan sebagai berikut.
1. Sintesis senyawa kompleks inti ganda Mn(II)-bipiridin menggunakan ligan jembatan oksalat dilakukan dengan cara mensintesis senyawa kompleks inti tunggal terlebih dahulu. Sintesis senyawa kompleks inti tunggal diperoleh berdasarkan perbandingan mol Mn(II) : bipy = 1 : 3, sedangkan senyawa kompleks inti ganda disintesis berdasarkan perbandingan mol Mn(II) : bipy : oksalat = 2 : 4 : 1.
2. Karakterisasi senyawa kompleks inti ganda Mn(II)-bipiridin menggunakan ligan jembatan oksalat meliputi analisis spektroskopi UV-Vis, spektroskopi FT-IR, analisis kemagnetan menggunakan Magnetic Susceptibility Balance
konduktometer menunjukkan bahwa muatan senyawa kompleks inti ganda adalah +3, sehingga kompleks yang terbentuk diduga mempunyai rumus [(OH)(bipy)2Mn(C2O4)Mn(bipy)2(OH)]3+.
5.2 Saran
Berdasarkan penelitian yang telah dilakukan, terdapat beberapa saran untuk perkembangan penelitian senyawa kompleks inti ganda selanjutnya.
1. Penelitian sintesis dan karakterisasi senyawa kompleks inti ganda perlu dikembangkan dan diteliti lebih lanjut, terutama menggunakan logam-logam transisi lain karena aplikasinya untuk material magnetik sangatlah banyak. 2. Untuk dapat memastikan sifat kemagnetan dari senyawa kompleks inti ganda
yang telah disintesis, perlu dilakukan analisis ESR untuk kemagnetan karena aplikasinya berhubungan dengan material magnetik.
DAFTAR PUSTAKA
Atkins, P.W., Overton, T.L., Rourke, J.P., Weller, M.T., dan Armstrong, F.A., 2010, Inorganic Chemistry, Fifth Edition, W.H. Freeman and Company, New York, hal. 199, 478
Balzani, V., Juris, A., dan Venturi, M., 1996, Luminescent and Redox-Active Polynuclear Transition Metal Complexes,Chem. Rev, Vol. 96, hal. 759-833
Basset, J., Denney, R.C., Jeffery, G.H., dan Mendham, J., 1994, Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik, Edisi Keempat, Cetakan Pertama, Terjemahan oleh L. Setiono dan A. Hadyana P., Penerbit Buku Kedokteran EGC, Jakarta, hal. 720-723
Chang, T., Shivaji, V.M., Norman, L., Jyun-Wei, J., Yi-Chuan, C., Shu-Chuan, J., dan Wen-Shan, L., 2011, Polyfluorinated Bipyridine Cisplatins Manipulate Cytotoxicity Through The Induction of S-G 2 /M Arrest and Partial Intercalation Mechanism, Bioorganic and Medicinal Chemistry, Vol. 19, hal. 4887–4894
Chang, R., 2002,Chemistry,Seventh edition, Mc-Graw Hill Companies, Inc., hal. 878-884
Effendy, 2007, Perspektif Baru Kimia Koordinasi, Jilid 1, Bayu Media Publishing, Malang, Jatim, hal. 14, 146
Elmila, I., dan Martak, F., 2011, Peningkatan Sifat Magnetik Kompleks Polimer Oksalat (N(C4H9)4)(MnCr(C2O4)3) dengan Menggunakan Kation Organik Tetrabutil Amonium, Prosiding Skripsi, SK-091304, Jurusan Kimia Fakultas MIPA, ITS
Harvey, D., 2009, Analytical Chemistry, Second edition, Mc-Graw Hill Companies, hal. 559
House, J.E., 2008,Inorganic Chemistry, Elsevier Inc., Canada, hal. 577
Housecroft, C.E., dan Sharpe, A.G., 2005, Inorganic Chemistry, Second edition, Pearson, Prentice Hall, hal. 539, 557, 581
Janes, R., dan Moore, E., 2004, Metal-Ligand Bonding, The Open University, London, hal. 5, 31, 44
Jianzhong, C., Wei, S., Peng, C., Xufang, C., Daizheng, L., Shipping, Y., Zonghui, J., dan Genglin, W., 2003, Synthesis and Magnetic Properties of One-dimensional Mn(II) Complexes Linked by Dithiooxalato,
Chinese Science Bulletin, Vol. 48, hal 859-861
Jitaru, I., Ungureanu, E., dan Alexandru, M., 2007, Synthesis and Characterization of new Mn(II,III) and Fe(III) Oxo polynuclear Complexes, U.P.B. Sci. Bull., Series B, Vol. 69, hal 11-20
Kocanova, I., Kuchar, J., Orendac, M., dan Cernak, J., 2010, Cu-Ni Heterobimetallic Compounds Part 2 : Study of The System Cu(II)-bpy-[Ni(CN)4]2-(bpy = 2,2’-bipyridine),Polyhedron, Vol. 29, hal. 3372-3379
Kaizaki, S., Nakahanada, M., Fuyuhiro, A., Ikedo-Urade, M., dan Abe, Y., 2009, Synthesis, Characterization and Redox Reactivity of L-Tartrato Bridged Dinuclear Manganese Complex with 2,2’-bipyridine,
Inorganica Chimica Acta, Vol. 362, hal. 5117-5121
Kim, S., Zhang, W., dan Pinnavaia, T., 1997, Catalitytic Oxidation of Styrene by Manganese(II) Bipyridine Complex Cations Immobilized in Mesoporous Al-MCM-41,Catalysis Letters, Vol. 43, hal. 149-154
Kurnia, K.A., Onggo, D., Patrick, D., dan Stevenson, K.L., 2006, Sintesis Senyawa Kompleks K[Cr(C2O4)2(H2O)2].2H2O dan [N(n-C4H9)4] [CrFe(C2O4)3].H2O,Jurnal Kimia Indonesia, Vol. 1, hal. 7-12
Lawrance, G.A., 2010, Introduction to Coordination Chemistry, John Wiley and Sons Ltd, hal 60, 225
Lehleh, A., Beghidja, A., Beghidja, C., Mentre, O., dan Welter, R., 2011, Synthesis, Crystal Structure and Thermal Decomposition of Cu(II), Co(II), Mn(II) Complexes with Hetero-ligands Containing Cysteic acid, 4,4-dimethyl-2,2’-bipyridine and Azide,C. R. Chimie, Vol. 14, hal. 462-470
Mackay, K.M., Mackay, R.A., dan Henderson W., 2002, Introduction to Modern Inorganic Chemistry, Sixth edition, Nelson Thomes Ltd, Delta Place, United Kingdom, hal. 323
Miessler, G.L., dan Tarr, D.A., 2003. Inorganic Chemistry, Third edition. Prentice-Hall, Inc., New Jersey, hal. 339-398
Muryanti, L., 2001, Sintesis Senyawa Koordinasi Mn(II)-2,2’Bipiridin dalam Ruang Interlamelar Monmorilonit,Skripsi, Departemen Kimia Fakultas MIPA Universitas Airlangga, Surabaya
Nakamoto, K., 2009, Infrared and Raman Spectra of Inorganic and Coordination Compounds,Sixth edition, John Wiley and Sons, Inc., New Jersey, hal. 29-31
Nemec, I., Herscel, R., Boca, R., Svoboda, I., Travnicek, Z., Dlhan, L., Matelkova, K., dan Fuess, H., 2011, Heterobimetallic Assemblies of Ni(II) Complexes with a Tetradentate Amine Ligand and Diamagnetic Cyanidometallates,Inorganica Chimica Acta, Vol. 366, hal. 366-372 Palanisami, N., dan Murugavel, R., 2011, Synthesis, Spectral characterization,
and Single Crystal X-ray Structures of a Series of Manganese-2,2’-bipyridine Complexes Derived from Substituted Aromatic Carboxylic Acids,Inorganica Chimica Acta, Vol. 365, hal. 430-438
Piramanayagam, S.N., dan Chong, T.C., 2012, Development in Data Storage, Materials Perspective, John Wiley and Sons, Inc., New Jersey, hal. 97 Putri, S. D., dan Martak, F., 2010, Pengaruh Kation Organik pada Kompleks
Binuklir [A][MnIIFeIII(ox)3], A = [N(n-C4H9)4]+ atau [N(n-C5H11)4]+,
Prosiding Skripsi, SK-091304, Jurusan Kimia Fakultas MIPA, ITS
Reinoso, S., Victoria, P., Zorilla, J.M., Lezama, L., Felices, L.S., dan Beitia, J.I., 2005, Inorganic-Metalorganic Hybrids Based on Monosubstituted Keggin Polyanions and Dinuclear Copper(II)-Oxalate Complexes. Synthesis, X-Ray Structural Characterization, and Magnetic Properties,Inorg. Chem, Vol. 44, hal. 9731-9742
Robinson, J.W., Skelly Frame, E.M., dan Frame II, G.M., 2005, Undergraduate Instrumental Analysis, Sixth edition, Marcel Dekker, New York, hal. 217, 325
Setiawan, Nur C.E., 2008. Sintesis dan Karakterisasi Senyawa Kompleks dari Ion Logam Cu2+ dengan Ligan Isokuinolin dan Ion Kompleks [Co(SCN)6]4-,Skripsi, Fakultas MIPA, Universitas Negeri Malang Silverstein, R.M., Webster, F.X., Morril, dan Kiemle, D.J., 2005, Spectrometric
Skoog, D.A., Holler, F.J., dan Crouch, S.R., 2007, Principles of Instrumental Analysis,Sixth edition, Thomson Brooks, Canada, hal. 367-375, 431, 461 Svehla, G., 1996, Vogel’s Qualitative Inorganic Analysis, Seventh edition,
Longman, London, hal. 135
Zhang, C., dan Janiak, C., 2001, Synthesis and Crystal Structure of Manganese(II) Bipyridine Carboxylato Complexes, Z. Anorg. Allg. Chem, Vol. 627, hal 1972-1975

![Gambar 2.3 Pembentukan senyawa kompleks [Mn(H2O)6]2+](https://thumb-ap.123doks.com/thumbv2/123dok/4014309.1957729/24.595.113.509.329.710/gambar-pembentukan-senyawa-kompleks-mn-h-o.webp)