i
P
TESIS – SK142501
SINTESIS DAN KARAKTERISASI SENYAWA
KOMPLEKS DARI ION LOGAM Cu(II) DENGAN
LIGAN 2,4,5-TRIFENILIMIDAZOL SEBAGAI
ANTIKANKER
TEGUH HARI SUCIPTO NRP. 01211350010011
DOSEN PEMBIMBING Dr. Fahimah Martak, M.Si.
PROGRAM MAGISTER
BIDANG KEAHLIAN KIMIA ANORGANIK DEPARTEMEN KIMIA
FAKULTAS ILMU ALAM
INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA
iii
THESIS – SK142501
SYNTHESIS AND CHARACTERIZATION OF
COMPLEXES METAL ION Cu(II) WITH
2,4,5-TRIPHENYLIMIDAZOLE FOR ANTICANCER
TEGUH HARI SUCIPTO NRP. 01211350010011
SUPERVISOR
Dr. Fahimah Martak, M.Si.
MAGISTER PROGRAM
EXPERTISE FIELD OF INORGANIC CHEMISTRY CHEMISTRY DEPARTMENT
FACULTY OF NATURAL SCIENCES
SEPULUH NOPEMBER INSTITUTE OF TECHNOLOGY SURABAYA
iv
vii
SINTESIS DAN KARAKTERISASI SENYAWA KOMPLEKS
DARI ION LOGAM Cu(II) DENGAN LIGAN
2,4,5-TRIFENILIMIDAZOL SEBAGAI ANTIKANKER
Nama Mahasiswa : Teguh Hari Sucipto
NRP : 01211350010011
Jurusan : Kimia
Pembimbing : Dr. Fahimah Martak, M.Si
ABSTRAK
Kompleks ion logam Cu(II) dengan ligan 2,4,5-trifenilimidazol berhasil disintesis dengan perbandingan mol logam dan ligan 1:2 dalam DMF. Hasil sintesis kompleks diperoleh padatan kristalin berwarna hijau muda. Kompleks menyerap sinar UV-Vis pada panjang gelombang 529 nm. Hasil karakterisasi FTIR menunjukkan terjadi ikatan logam dan ligan yaitu Cu-N pada daerah sekitar 422,38 cm-1. Hasil analisis elemental analyzer dan AAS menunjukkan kompleks yang terbentuk memiliki rumus molekul [Cu(L)2(H2O)2].Cl2. Rumus molekul juga didukung dengan data TGA. Hasil analisis TGA menunjukkan tidak terdapat air kristal dalam senyawa kompleks. Uji toksisitas senyawa kompleks
dilakukan dengan metode (3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolium
bromide) (MTT) dan didapatkan nilai IC50 senyawa kompleks sebesar 72,139 μg/ml.
viii
ix
SYNTHESIS AND CHARACTERIZATION OF COMPLEXES
METAL ION Cu(II) WITH 2,4,5-TRIPHENYLIMIDAZOLE
FOR ANTICANCER
Name : Teguh Hari Sucipto
NRP : 01211350010011
Department : Chemistry
Supervisor : Dr. Fahimah Martak, M.Si
ABSTRACT
The complex of metal ion Cu(II) with the ligand 2,4,5-trifenilimidazol has been successfully synthesized with mole ratio of metal and ligand 1:2 in DMF as a solvent. Complex synthesis results obtained green light crystalline solid. Complex absorbs UV-Vis light at 529 nm. FTIR characterization results indicate occurr bonding of metals and ligand that is Cu-N in region 422.38 cm-1. Results of elemental analyzer and AAS analysis shows the complex formed has the formula [Cu(L)2(H2O)2].Cl2. The molecular formula is also supported by the TGA data. TGA analysis results showed there was no water in the crystalline complex compounds. The cytotoxicity test complex compounds made by the method of (3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolium bromide) (MTT) and the IC50 value of complex obtained 72.139 μg/ml.
x
xi
KATA PENGANTAR
Alhamdulillah, Puji syukur kehadirat Allah SWT atas rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tesis yang berjudul “Sintesis dan Karakterisasi Senyawa Kompleks dari Ion Logam Cu(II) dengan Ligan 2,4,5-Trifenilimidazol sebagai Antikanker”.
Penulis menyadari bahwa tesis ini tidak akan selesai dengan baik tanpa bantuan dari berbagai pihak. Oleh karena itu penulis ingin menyampaikan banyak terima kasih atas segala bantuan yang telah diberikan, khususnya kepada : 1. Prof. Dr. Didik Prasetyoko, S.Si., M.Sc. selaku Ketua Departemen Kimia
FMIPA Institut Teknologi Sepuluh Nopember Surabaya dan selaku penguji seminar tesis atas saran dan bimbingannya.
2. Prof. Mardi Santoso, PhD. selaku Kaprodi S2 Kimia Institut Teknologi Sepuluh Nopember Surabaya.
3. Dr. Fahimah Martak, M.Si selaku dosen pembimbing tesis yang senantiasa memberikan bimbingan, masukan, saran, arahan dan selalu memberikan motivasi dalam penyelesaian naskah tesis ini.
4. Dr. rer. nat. Fredy Kurniawan, M.Si. sekalu pembimbing akademik yang telah memberikan arahan dan nasihat selama masa perkuliahan.
5. Prof. Dr. rer. nat. Irmina Kris Murwani, M.Si selaku ketua penguji sidang tesis atas saran dan bimbingannya.
6. Prof. Dr. Taslim Ersam, M.S. selaku dosen penguji sidang tesis dan ketua Laboratorium Kimia Bahan Alam dan Sintesis Departemen Kimia FMIPA Institut Teknologi Sepuluh Nopember Surabaya.
7. Seluruh dosen dan karyawan Jurusan Kimia FMIPA Institut Teknologi Sepuluh Nopember Surabaya.
8. Kementrian Pendidikan Tinggi Indonesia yang telah memberikan kesempatan kepada penulis untuk menjadi salah satu penerima beasiswa BPPDN dan melanjutkan studi S2.
9. Lembaga Penyakit Tropis Universitas Airlangga telah memberikan tempat untuk melakukan eksperimen.
xii
10. Pusat Penelitian dan Pengembangan Stem Cell Universitas Airlangga telah membantu dalam pengujian anti-kanker.
11. Universiti Kebangsaan Malaysia yang telah membantu dalam pengujian CHN micro analyzer.
12. Bapak, Ibu, Harsasi Setyawati, Siti Qamariyah Khairunisa, Kris Cahyo Mulyatno, Siti Churrotin, Prof. Soegeng Soegijanto, Dr. Tomohiro Kotaki, Dr. Masanori Kameoka, dan Prof. Maria Inge Lusida atas doa dan dukungannya.
13. Teman-teman Prodi Pascasarjana kimia angkatan 2013 yang telah banyak memberi masukan serta semua pihak yang telah berpartisispasi atas terselesainya tesis ini.
Penulis menyadari bahwa penyusunan tesis ini masih terdapat banyak kekurangan. Oleh karena itu, saran dan kritik yang membangun sangat penulis harapkan demi kesempurnaan di masa mendatang. Semoga tesis ini dapat memberikan manfaat bagi penulis dan semua pihak yang membutuhkan.
Surabaya, 5 Juli 2017
xiii
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN JUDUL ... iii
LEMBAR PENGESAHAN ... v
ABSTRAK ... vii
ABSTRACT ... ix
KATA PENGANTAR ... xi
DAFTAR ISI ... xiii
DAFTAR GAMBAR ... xv
DAFTAR TABEL ... xvii
DAFTAR LAMPIRAN ... xix
BAB 1 PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Rumusan Masalahan ... 3
1.3 Tujuan Penelitian ... 4
1.4 Manfaat Penelitian ... 4
BAB 2 KAJIAN PUSTAKA DAN DASAR TEORI 2.1 Tinjauan Umum tentang Kanker ... 5
2.2 Senyawa Kompleks untuk Antikanker ... 6
2.3 Kompleks Tembaga(II) Berbasis Imidazol ... 8
2.4 Senyawa Tusunan Imidazol (2,3,4-trifenilimidazol)……….. 10
2.5 Karakterisasi Senyawa Kompleks ……… . 11
2.5.1 Spektrofotometer UV-Vis ... 11
2.5.2 Spektrofotometri Fourier Transform Infrared (FTIR) … ... 14
2.5.3 Spektrofotometer Serapan Atom (SSA) ... 15
2.5.4 Analisa Mikrounsur CHN ……. ... 15
2.5.5 Thermo Gravimetric Analyzer (TGA) ... 16
2.6 Sitotoksisitas ... 16
BAB 3 METODE PENELITIAN 3.1 Bahan dan Alat Peneltian ... 19
xiv
3.1.1 Bahan ... 19
3.1.2 Alat... 19
3.2 Prosedur ... 19
3.2.1 Penentuan Panjang Gelombang Maksimum Senyawa Kompleks dengan Metode Variasi Kontinu... 19
3.2.2 Sintesis Senyawa Kompleks ... 20
3.3 Prosedur Karakterisasi ... 21
3.3.1 Spektrofotometri UV-Vis ... 21
3.3.2 Spektrofotometri Fourier Transform Infrared (FTIR)………. ... 21
3.3.3 Analisis Kadar Logam dengan Spektrofotometri Serapan Atom (SSA) ... 21
3.3.4 Penentuan Kandungan C, H, N dalam Senyawa ... 21
3.3.5 Thermo Gravimetric Analyzer (TGA) ... 22
3.3.6 Uji Toksisitas dengan Metode MTT ... 22
BAB 4 HASIL DAN PEMBAHASAN 4.1 Sintesis Kompleks Cu(II)-2,4,5-trifenilimidazol ... 25
4.1.1 Penentuan Perbadingan Logam dan Ligan ... 25
4.1.2 Sintesis Kompleks Cu(II)-2,4,5-trifenilimidazol ... 27
4.1.3 Karakterisasi FTIR Kompleks Cu(II)-2,4,5-trifenilimidazol ... 30
4.1.4 Penentuan Kadar Unsur C, H, N dalam Kompleks... 31
4.1.5 Analisis TGA (Thermo Gravimetric Analyzer) ... 32
4.1.6 Prediksi Struktur Senyawa Kompleks ... 34
4.2 Uji Bioaktivitas Senyawa Kompleks Cu(II)-2,4,5-trifenilimidazol ... 35
BAB 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 49
xv
DAFTAR GAMBAR
Gambar 2.1 Struktur senyawa a. cis-Pt(NH3)2Cl2 (cisplatin) dan b.
trans-Pt(NH3)2Cl2 (trasplatin) (Reedijk dan Lohman, 1985) ... 7
Gambar 2.2 Sintesis kompleks Cu(2-benzimidazolkarbamat)Br2.0,7H2O
dengan perbandingan ligan dan logam 1:1 (Guadarrama dkk., 2009) ... 8 Gambar 2.3 Senyawa kompleks [CuII(SrtaaiNR’)(SCN)2] (Sharker dkk.,
2010) ... 8 Gambar 2.4 Struktur Kompleks (a) Ligan; (b) [Cu(L1)Cl(H2O)]Cl.3H2O]
(Galal dkk., 2009) ... 10 Gambar 2.5 Sintesis senyawa 2,4,5-trifenilimidazole (Arora dkk., 2012) ... 10 Gambar 2.6 Diagram blok komponen spektrofotometer ... 12 Gambar 2.7 Spektra UV-Vis dari [CuII(SEtaaiNMe)(SCN)2] dan
[CuI(SEtaaiNMe)(SCN)n] (Sarker dkk., 2010) ... 13
Gambar 2.8 TGA Kompleks Cu(BIM)2Cl2 (Materazzi dkk., 2007) ... 16
Gambar 2.9 Reaksi Reduksi MTT (Mosmann, 1983) ... 17 Gambar 4.1 Larutan kompleks setelah 7 hari dengan perbandingan logam
dan ligan: (a) 1:9, (b) 3:7, (c) 5:5, (d) 7:3, dan (e) 9:1 ... 26 Gambar 4.2 Padatan kompleks dengan perbandingan logam dan ligan: (a)
1:9, (b) 3:7, (c) 5:5, (d) 7:3, dan (e) 9:1 ... 26 Gambar 4.3 Metode Variasi Kontinu Kompleks
Cu(II)-2,4,5-trifenilimidazol ... 27 Gambar 4.4 (a) Padatan Kompleks Cu(II)-2,4,5-trifenilimidazol; (b)
Kompleks Perbesar 10x ... 28 Gambar 4.5 Grafik Panjang Gelombang Maksimum Larutan Logam
CuCl2.2H2O, Kompleks Cu(II)-2,4,5-trifenilimidazol dan
ligan 2,4,5-trifenilimidazol ... 29 Gambar 4.6 Perbandingan spektrum IR kompleks (a) ligan
2,4,5-trifenilimidazol dan (b) Cu(II)-2,4,5-2,4,5-trifenilimidazol ... 30 Gambar 4.7 Kurva TGA kompleks Cu(II)-2,4,5-trifenilimidazol ... 33
xvi
Gambar 4.8 Ikatan yang Diusulkan pada Senyawa Kompleks Cu(II)-2,4,5-trifenilimidazol ... 34 Gambar 4.9 Bentuk Geometri Molekul yang Diusulkan pada Kompleks
[Cu(2,4,5- trifenilimidazol)2(H2O)2].Cl2 ... 35
xvii
DAFTAR TABEL
Tabel 2.1 Beberapa Hasil Penelitian Biokativitas Senyawa Kompleks ... 9 Tabel 3.1 Komposisi variasi kontinu CuCl2.2H2O dengan
2,4,5-trifenilimidazol dalam DMF ... 20 Tabel 4.1 Panjang Gelombang Maksimum ... 29 Tabel 4.2 Kadar unsur Cu, C, H, N dalam kompleks secara eksperimen
dan teoritis ... 32 Tabel 4.3 Data penurunan berat eksperimen dan teoritis TGA kompleks ... 34 Tabel 4.4 Data jumlah sel kanker yang hidup pada variasi konsentrasi
larutan senyawa kompleks Cu(II)-2,4,5-trifenilimidazol ... 36
xviii
xix
DAFTAR LAMPIRAN
Lampiran A PROSEDUR SINTESIS KOMPLEKS ... 49
Lampiran B VARIASI KONTINU DAN PENENTUAN MASSA CuCl2.H2O DAN LIGAN 2,4,5-TRIFENILIMIDAZOL ... 51
Lampiran C SPEKTRUM FTIR KOMPLEKS Cu(II)-2,4,5-TRIFENILIMIDAZOL ... 53
Lampiran D SPEKTRUM FTIR LIGAN 2,4,5TRIFENILIMIDAZOL ... 55
Lampiran E PERHITUNGAN ANALISIS PENENTUAN UNSUR C, H, N KOMPLEKS ... 57
Lampiran F ANALISIS SPEKTROSKOPI SERAPAN ATOM (SSA)... 59
Lampiran G ANALISIS TGA KOMPLEKS ... 62
xx
1
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Senyawa kompleks adalah senyawa yang tersusun dari suatu ion logam pusat dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebasnya kepada ion logam pusat. Senyawa kompleks terus dikembangkan menjadi senyawa yang bermanfaat dalam bidang pengobatan. Beberapa senyawa kompleks yang berhasil disintesis menunjukkan aktivitas yang baik dalam bidang kimia medisinal. Khususnya senyawa kompleks yang berikatan dengan senyawa organik.
Cis-platin merupakan senyawa kompleks yang digunakan sebagai obat antikanker pertama yang mengalami perkembangan yang pesat pada tahun 1960-an. Namun, senyawa kompleks berbasis platinum tersebut menimbulkan efek samping pada dosis tertentu dan memberikan resistensi obat selama proses terapi (Santini dkk., 2013). Hal ini memicu adanya pengembangan penemuan senyawa kompleks baru berbasis non-platinum, dengan harapan dapat meningkatkan sifat farmakologi, mengurangi efek samping, dan mendapatkan target spesifik obat yang berbeda (Qiao dkk., 2011). Beberapa logam transisi yang digunakan dalam sintesis senyawa kompleks antikanker antara lain Co(II), Ni(II), Cu(II), Pd(II), Ru(II) dan Pt(II) (Budzisz dkk., 2009, Ali dkk., 2011).
Logam Cu(II) merupakan unsur esensial dan berperan penting dalam sistem biologi tubuh manusia (Linder dan Azam, 1996). Logam Cu berperan dalam tubuh sebagai konstituen enzim redoks dan hemocyanin (Huheey dkk., 1993). Logam Cu memiliki nomor atom 29 dengan konfigurasi elektron [Ar] 4s2 3d9. Kation logam Cu(II) memiliki orbital kosong yang dapat berfungsi sebagai akseptor pasangan elektron dari ligan. Berdasarkan sifatnya tersebut, logam Cu(II) dapat dijadikan salah satu logam pengkompleks ligan dan diharapkan memiliki kemampuan aktivitas antikanker yang baik. Sebagaimana penelitian yang telah dilakukan oleh Devereux dkk. (2007), kompleks disintesis dari ion logam Cu(II) dengan ligan 2-(4′-thiazolyl)benzimidazole dan 2-(2-pyridyl)benzimidazol. Uji
2
sitoksisitas terhadap sel kanker hati (Hepatocellular carcinoma) terbaik ditunjukkan oleh kompleks dari ion logam Cu(II) dengan nilai IC50 sebesar 200
μM. Senyawa dengan nilai IC50 tersebut termasuk golongan senyawa antikanker
toksik rendah (low toxic) (Meyer dkk., 1982)
Ligan yang biasanya digunakan dan terus dikembangkan dalam penelitian senyawa obat antikanker adalah ligan yang memiliki atom nitrogen dan oksigen, diantaranya turunan-turunan dari ligan imidazol (Goncalves dkk., 2013), benzamida (El Boraey, 2012), piridin (Tiwari dkk., 2011), pirazol (Budzisz dkk., 2009) dan lain-lain. Ligan aromatis yang mengandung-N seperti piridin, imidazol, dan turunannya (dimana bersifat sebagai donor yang mirip dengan basa purin dan pirimidin) telah dilaporkan dan menunjukkan sifat antikanker in vitro dalam model seperti cisplatin (Deegan dkk., 2006).
Penelitian senyawa kompleks berbasis imidazol dan turunannya telah banyak dilaporkan memiliki aktivitas antikanker. Imidazol dan turunannya memiliki atom nitrogen yang berfungsi sebagai pendonor pasangan elektron ke logam. Senyawa kompleks berbasis imidazol telah disintesis oleh Devereux (2004) dan menunjukkan aktivitas antikanker terhadap sel kanker kulit SK-MEL-31 dan sel kanker lidah CAL-27. Senyawa berbasis imidazol juga menunjukkan efek sitotoksik terhadap sel kanker hati Hep-G2 dan kanker usus A-498 (Devereux dkk., 2007), kanker payudara MCF-7, kanker servik HeLa, dan kanker darah HL-60 (Bhat dkk., 2011).
Di sisi lain, senyawa berbasis imidazole dan turunannya seperti 2,4,5-trifenilimidazol pernah disintesis oleh Arora dkk. (2012), namun belum dilaporkan aktivitas antikankernya. Berdasarkan strukturnya, senyawa 2,4,5-trifeilimidazol memiliki cincin heterosiklik, 1 basa nitrogen N dan basa nitrogen NH pada bagian molekul imidazole. Gugus-gugus tersebut dapat berperan dalam aktivitas antikanker.
Atom nitrogen berfungsi sebagai donor pasangan elektron ke logam untuk membentuk kompleks. Peran senyawa kompleks sebagai antikanker juga dapat dihubungkan dengan interaksinya dengan DNA. Atom nitrogen yang lain yang terdapat pada kompleks dapat berinteraksi non-kovalen termasuk ikatan hidrogen dengan pasangan basa (di alur mayor dan minor DNA) (El-Boraey, 2012). Muatan
3
positif logam juga terlibat dalam interaksi elektrostatik dengan muatan negatif pada gugus gula-fosfat yang terdapat di backbone DNA (Chauhan dan Arjmund, 2006).
Salah satu turunan senyawa imidazol, 2-aril-4-benzoil-imidazol menunjukkan aktivitas antikanker yang baik terhadap sel kulit A375, B16-F1, WM164, LNCaP, PC-3, Du 145, dan PPC-1 dengan masing-masing nilai IC50
sebesar 0,16; 0,12; 0,10; 0,15; 0,29; 0,20 dan 0,13 μM (Chen dkk., 2010). Senyawa dengan nilai IC50 tersebut termasuk golongan senyawa antikanker toksik
tinggi (high toxic) (Meyer dkk., 1982).
Suatu senyawa dapat dikatakan toksik jika telah diuji terlebih dahulu pada sel uji. Pada penelitian ini uji antikanker senyawa kompleks dilakukan dengan metode MTT {3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazolium bromida} uji in vitro sel kanker payudara T74D. Adapun klasifikasi tingkat toksisitas suatu senyawa berdasarkan IC50 menurut Meyer dkk. (1982), yaitu kategori sangat
tinggi (highly toxic) apabila mampu membunuh 50% larva pada konsentrasi 1–10 µg/ml, kategori sedang (medium toxic) pada konsentrasi 10–100 µg/ml, dan kategori rendah (low toxic) pada konsentrasi 100–1000 µg/ml.
1.2 Perumusan Masalah
Senyawa kompleks Tembaga(II) pernah disintesis oleh Tabassun dkk. (2013) dengan yang membedakan yaitu ligan 1,10-fenantrolin dan 2-(trifluorometil)benziimidazol. Aktivitas antikanker yang paling baik ditunjukkan oleh senyawa kompleks dengan ligan 2-(trifluorometil)benziimidazol dengan IC50
sebesar 10,0 μg/ml. Namun senyawa kompleks tersebut termasuk kategori senyawa antikanker toksik sedang (medium toxic) (Meyer dkk., 1982). Senyawa 2,4,5-trifenilimidazol berhasil disintesis oleh Marzouk dkk. (2010), namun belum diketahui aktivitas antikankernya. Untuk itu, pada penelitian ini disintesis senyawa kompleks dari ion logam Cu(II) dengan ligan 2,4,5-trifenilimidazol dan dilakukan uji aktivitas antikanker dengan metode MTT {3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazolium bromida} uji in vitro terhadap sel kanker payudara T74D.
4
1.3 Tujuan Penelitian
Sesuai dengan perumusan yang disebutkan di atas, tujuan penelitian ini adalah:
1. Mendapatkan formula senyawa kompleks dari ion logam Cu(II) dengan ligan 2,4,5-trifenilimidazol.
2. Mendapatkan nilai IC50 senyawa kompleks melalui analisa metode MTT
{3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazolium bromida} uji invitro sel kanker payudara T74D.
1.4 Manfaat Penelitian
Hasil penelitian diharapkan memberikan kontribusi bagi ilmu pengetahuan di bidang sintesis dan karakterisasi senyawa kompleks serta perkembangan senyawa obat antikanker.
5
BAB 2
KAJIAN PUSTAKA DAN DASAR TEORI
2.1 Tinjauan Umum Tentang Kanker
Kanker adalah suatu penyakit sel dengan ciri gangguan atau kegagalan mekanisme pengatur multiplikasi dan fungsi homeostatis lainnya pada organisme multiseluler. Menurut Franks dan Teich (1998), sel kanker itu timbul dari sel normal tubuh kita sendiri yang mengalami transformasi menjadi ganas, karena adanya mutasi spontan atau induksi karsinogen (bahan/agen pencetus terjadinya kanker). Transformasi sel itu terjadi karena mutasi gen yang mengatur pertumbuhan dan diferensiasi sel, yaitu proto-onkogen dan atau suppressor gen (anti onkogen). Paparan karsinogen antara lain berbagai jenis virus, bahan kimia, radiasi dan ultraviolet. Sebagian besar karsinogen tersebut memiliki sifat biologis yang sama yaitu dapat mengakibatkan kerusakan pada DNA. Kesamaan sifat ini menimbulkan dugaan bahwa DNA sel merupakan sasaran utama semua bahan karsinogenik dan bahwa kanker disebabkan perubahan DNA sel. Apabila perbaikan DNA karena adanya perubahan DNA tersebut gagal, maka terjadi mutasi genom. Adanya mutasi mengakibatkan pengaktifan onkogen pendorong pertumbuhan, perubahan gen yang mengendalikan pertumbuhan, serta penonaktifan gen supresor kanker. Ketiga hal tersebut mengakibatkan timbulnya neoplasma ganas atau lebih dikenal dengan kanker (Kumar, et al., 2003).
Adapun ciri-ciri sel kanker secara khusus yang membedakan dengan sel normal (Kumar, et al., 2005), antara lain sebagai berikut: (1) sel kanker mampu mencukupi kebutuhan sinyal pertumbuhannya sendiri; (2) sel kanker tidak sensitif terhadap sinyal antiproliferatif; (3) sel kanker mampu menghindar dari mekanisme apoptosis; (4) kemampuan angiogenesis yang dimiliki oleh sel kanker; (5) sel kanker mampu menginvasi jaringan di sekitarnya dan membentuk anak sebar (metastasis); dan (6) sel kanker memiliki potensi yang tak terbatas untuk mengadakan replikasi.
6
Berdasarkan National Institute of Health (2006), kanker adalah penyakit yang disebabkan oleh pertumbuhan sel-sel jaringan tubuh yang tidak terkontrol, invasi sel ke jaringan lain yang berpotensi untuk melakukan metastasis, akibat dari akumulasi mutasi genetik yang terjadi dalam tubuh manusia yang menyebabkan perubahan sifat dari sel-sel normal. Kanker merupakan penyebab utama penyakit di seluruh dunia. Menurut IARC (International Agency for Research on Cancer) diperkirakan terdapat 14,1 juta kasus kanker baru terjadi pada tahun 2012 dan 8,2 juta kematian terjadi akibat kanker (Thomas, 2013).
2.2 Senyawa Kompleks untuk Antikanker
Senyawa kompleks merupakan senyawa yang tersusun dari suatu logam pusat dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebasnya kepada logam pusat. Donasi pasangan elektron ligan kepada logam pusat menghasilkan ikatan kovalen koordinasi sehingga senyawa kompleks juga disebut senyawa koordinasi (Cotton dan Wilkinson, 1984). Ikatan kovalen koordinasi menghasilkan molekul Dengan bentuk geometri yang spesifik., seperti planar, tetrahedral, dan oktahedral (Meissler, 2005).
Ligan adalah suatu ion atau molekul yang memiliki sepasang elektron atau lebih yang dapat disumbangkan. Ligan merupakan basa lewis yang dapat terkoordinasi pada logam atau sebagai asam lewis membentuk senyawa kompleks. Ligan dapat berupa anion atau molekul netral (Cotton dan Wilkinson, 2009). Jika suatu logam transisi berikatan secara kovalen koordinasi dengan satu atau lebih ligan maka akan membentuk suatu senyawa kompleks, dimana logam transisi tersebut berfungsi sebagai atom pusat. Logam transisi memiliki orbital d yang belum terisi penuh yang bersifat asam lewis yang dapat menerima pasangan elektron bebas yang bersifat basa lewis. Ligan pada senyawa kompleks dikelompokkan berdasarkan jumlah elektron yang dapat disumbangkan pada atom logam.
Di sisi lain, perkembangan penyakit kanker yang semakin banyak memicu adanya penelitian-penelitian penemuan obat antikanker. Perkembangan
7
kimia koordinasi terutama dalam bidang senyawa kompleks menyediakan prospek untuk mendesain senyawa terapi baru yang memiliki karakteristik sebagai senyawa yang memiliki aktivitas sebagai senyawa obat. Senyawa anorganik diusulkan lebih efektif digunakan sebagai alternatif senyawa obat. Salah satu senyawa anorganik yang telah terbukti memiliki aktifitas biologi adalah platinum(II). Kompleks Pt(II) yang digunakan sebagai obat antikanker adalah adalah cis-Pt(NH3)2Cl2 (cisplatin). Cisplatin telah terbukti sebagai agen
kemoterapi yang sangat efektif untuk mengobati berbagai jenis kanker, seperti kanker ovum dan testis (Meng dkk., 2009). Cisplatin bergerak ke dalam sel melalui difusi dan transport aktif, menyebabkan platinasi DNA sehingga terbentuk hasil adisi, yang menyebabkan distorsi dan inhibisi replikasi DNA. Struktur senyawa cisplatin ditunjukkan pada Gambar 2.1.
Pt Cl Cl H2N H2N a Pt Cl NH2 Cl H2N b
Gambar 2.1. Struktur senyawa a. cis-Pt(NH3)2Cl2 (cisplatin) dan b.
trans-Pt(NH3)2Cl2 (trasplatin) (Reedijk dan Lohman, 1985)
Ligan 2-benzimidazolkarbamat telah dikomplekskan dengan logam Cu(II) oleh Guadarrama dkk. (2009) dan dilakukan uji aktivitas sitotoksik pada 6 sel kanker yaitu kanker prostat (PC3), kanker payudara (MCF-7), kanker kolon (HCT-15), kanker serviks uterin (HeLa), kanker paru-paru (SKLU-1). Berdasarkan hasil uji tersebut, senyawa kompleks yang dihasilkan aktif pada sel kanker HeLa dan HCT-15 dengan nilai IC50 yang masing-masing sebesar 95,59
8
CuBr2
1:1
Gambar 2.2. Sintesis kompleks Cu(2-benzimidazolkarbamat)Br2.0,7H2O dengan
perbandingan ligan dan logam 1:1 (Guadarrama dkk., 2009)
2.3 Kompleks Tembaga(II) Berbasis Imidazol
Ion tembaga(I) cukup mudah teroksidasi menjadi ion tembaga(II), namun oksidasi menjadi tembaga(III) sangat sulit (Cotton and Wilkinson, 2009). Sehingga tembaga(II) menpunyai kemampuan untuk membentuk sejumlah senyawa kompleks diantaranya Cu(II)-EDTA (Nurvika dkk., 2013), Cu(II)-glisin (Hidayati dkk., 2010), Cu-Ditizhone (Shar dan Bhanger, 2001), dan [CuII(SraaiNR’)(SCN)2] (Sharker dkk., 2010).
Penelitian Sharker dkk., (2010) dilaporkan senyawa kompleks menggunakan logam Cu(II) sebagai atom pusat, fenilimidazol (SrtaaiNR’) dan NH4SCN sebagai ligan. Struktur kompleks [CuII(SraaiNR’)(SCN)2] ditunjukkan
pada Gambar 2.3.
9
Disamping itu, beberapa kompleks logam Cu dengan ligan imidazol terbukti aktif sebagai senyawa antikanker. Kompleks logam dengan ligan menunjukkan aktivitas antikanker yang lebih baik daripada ligan bebas (Devereux dkk., 2004). Nilai IC50 yang dihasilkan pada kompleks [Cu(BZA)2(phen)(H2O)]
untuk sel kanker Hep-G2 sebesar 9,5 ± 2,1 µM dan A-498 sebesar 21,3 ± 6,7 µM pada konsentrasi larutan 0,1 µM – 1000 µM. Toksisitas tersebut lebih baik daripada ligan bebas yang sebesar >1000 µM untuk Hep-G2 dan A-498 (Devereux dkk., 2007). Beberapa keunggulan kompleks logam Cu daripada logam lain dalam penggunaannya sebagai senyawa obat ditunjukkan pada Tabel 2.1.
Tabel 2.1 Beberapa Hasil Penelitian Bioaktivitas Senyawa Kompleks
Logam Ligan Aplikasi Hasil Referen
Ni(II), Cu(II), dan Co(II) Phenanthrenequi none thiosemicarbazo ne Antikanker Nilai IC50 Ni(II)= 1,92 µM Cu(II)= 0,31 µM Co(II)= 2,04 µM Afrasiabi dkk., 2003 Cu(II), Co(II), VO(II) 4-4-aminofenil morfolin Antimikroba Nilai IC50 Cu(II)= 14% Co(II)= 15% VO(II)= 15% Dhahagani dkk., 2014 Cu(II), Ni(II), Fe(II), dan Mn(II) Benzimidazol-5-asam karboksilat hidrasida Antitumor Nilai IC50 Cu(II)= >20 µM Ni(II)= >100 µM Fe(II)= >25 µM Mn(II)= >20 µM Galal dkk., 2009
Berdasarkan Tabel 2.1 diketahui bahwa Cu(II) merupakan logam yang baik dan dapat digunakan dalam sintesis senyawa kompleks. Tembaga(II) menunjukkan aktivitas antikanker dan antimikroba yang lebih baik daripada ion logam lain seperti Ni(II), Co(II), VO(II), Ni(II), dan Fe(II). Struktur kompleks [Cu(L1)Cl(H2O)]Cl.3H2O] dan ligan Benzimidazol-5-asam karboksilat hidrasida
10 (a) N H N H3C N H O NH2
(b) N H N H3C NH2 O Cu Cl OH2 Cl.3H 2O
Gambar 2.4 Struktur Kompleks (a) Ligan; (b) [Cu(L1)Cl(H2O)]Cl.3H2O]
(Galal dkk., 2009)
2.4 Senyawa Turunan Imidazol (2,3,4-trifenilimidazol)
Senyawa 2,4,5-trifenilimidazol secara struktur memiliki dan 1 atom donor N (nitrogen dari cincin azol) dimana dapat menyumbangkan pasangan elektron bebas ke logam Cu(II). Struktur senyawa 2,4,5-trifenilimidazol ditunjukkan pada Gambar 2.5. Senyawa 2,4,5-trifenilimidazol sebelumnya telah disintesis oleh Arora dkk., (2012) dari benzyl, ammonia dan benzaldehida.
O O Benzil + 2NH4 + O Benzaldehida N H N 2,4,5-trifenilimidazol
11
2.5 Karakterisasi Senyawa Kompleks 2.5.1 Spektrofotometer UV-Vis
Spektrofotometri UV-Vis adalah teknis analisis spektroskopik yang memakai sumber radiasi elektromagnetik ultra violet (190–380 nm) dan sinar tampak (380–780 nm) dengan memakai instrumen spektrofotometer. Pengukuran di atas panjang gelombang 780 nm harus dipakai detektor dengan kualitas sensitif terhadap radiasi infra merah (infrared sensitive). Spektofotometri UV–Vis melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV–Vis lebih banyak dipakai untuk analisis kuantitatif dibandingkan kualitatif. Sebuah spektrofotometer adalah suatu instrumen untuk mengukur transmitan atau absorban cuplikan sebagai fungsi panjang gelombang. Analisis kuantitatif dengan metode spektrofotometri UV–Vis dapat digolongkan tiga macam pelaksanaan pekerjaan yaitu analisis kuantitatif zat tunggal, campuran dua macam zat, dan campuran tiga macam zat atau lebih. Analisis secara kualitatif dipakai untuk data sekunder atau data pendukung dengan melakukan pemeriksaan kemurnian spektrum UV–Vis dan penentuan panjang gelombang maksimum (λmaks). Dilihat dari sistem optik spektrofotometer dapat digolongkan dalam tiga
macam yaitu sistem optik radiasi berkas tunggal, radiasi berkas ganda, dan radiasi berkas terpisah (Mulya dan Suharman, 1995).
Kebanyakan penerapan spektrofotometri ultraviolet dan cahaya tampak pada senyawaan organik didasarkan pada transisi n-π* ataupun π-π* dan oleh karena itu memerlukan gugus kromofor dalam molekul tersebut. Transisi ini terjadi dalam daerah spektrum sekitar 200–700 nm yang praktis untuk digunakan dalam eksperimen. Spektrofotometer UV–Vis yang komersial biasanya beroperasi dari sekitar 175 atau 200 hingga 1000 nm. Komponen yang penting sekali dari suatu spektrofotometer secara skema dapat ditunjukkan pada Gambar 2.6.
12
Gambar 2.6 Diagram blok komponen spektrofotometer
Sumber energi radiasi yang digunakan adalah sebuah lampu pijar dengan kawat rambut terbuat dari wolfram dirancang untuk beroperasi pada daerah panjang gelombang UV–Vis. Monokromator adalah suatu piranti optis untuk mendapatkan radiasi monokromatis dari sumber radiasi yang memancarkan radiasi polikromatis. Monokromator pada UV–Vis biasanya tersusun atas celah (slit) masuk – filter – prisma – kisi (grating) – celah keluar. Wadah sampel adalah tempat untuk menaruh cairan ke dalam berkas cahaya spektrofotometer. Detektor merupakan salah satu bagian spektrofotometer UV–Vis yang penting dalam mengubah sinyal radiasi yang diterima menjadi sinyal elektronik atau mengubah energi cahaya menjadi suatu isyarat listrik. Penguat atau pengganda (amplifire) dan rangkaian yang berikatan yang membuat isyarat listrik itu memadai untuk dibaca. Sistem baca yang mana memberi gagasan mengenai apa yang terlibat besarnya isyarat listrik (Underwood dan Day, 1998).
Analisis dengan spektrofotometri UV–Vis selalu melibatkan pembacaan absorban radiasi elektromagnetik oleh molekul atau radiasi elektromagnetik yang diteruskan. Keduanya dikenal sebagai absorban (A) tanpa satuan dan transmitan dengan satuan persen (% T). Apabila suatu radiasi elektromagnetik mengenai suatu larutan dengan intensitas radiasi semula (Io), maka sebagian radiasi tersebut
akan diteruskan (It), dipantulkan (Ir), dan diabsorpsi (Ia), sehingga :
Io = Ir + Ia + It (2.1)
Jika harga Ir (± 4%) maka dapat diabaikan karena pengerjaan dengan metode spektrofotometri UV-Vis dipakai larutan pembanding sehingga :
sumber monokromator
m
sampel detektor penguat
pembaca a
13
Io = Ia + It (2.2)
Bouguer, Lambert dan Beer membuat formula secara matematik hubungan antara transmitan atau absoban terhadap intensitas radiasi atau konsentrasi zat yang dianalisis dan tebal larutan yang mengabsorpsi sebagai :
T = = 10-ɛ c b (2.3)
A = log = ɛ c b (2.4)
dengan:
T = persen transmitan
Io = intensitas radiasi yang datang
It = intensitas radiasi yang diteruskan
ɛ = absorbansi molar (L. mol-1 cm-1) c = konsentrasi (mol. L-1)
Gambar 2.7 Spektra UV-Vis dari [CuII(SEtaaiNMe)(SCN)2] dan
14
Penelitian Sarker dkk, (2010) kompleks [CuII(SEtaaiNMe)(SCN)2] dan
[CuI(SEtaaiNMe)(SCN)n] dibedakan transisi elektroniknya dengan menggunakan
Spektrofotometer UV-Vis. Pada Gambar 2.7 terdapat 2 pita serapan, terdapat serapan pada panjang gelombang 450-250 nm dan serapan lemah pada 710-740 nm. Ligan fenilazoimidazol (SEtaaiNRI) muncul serapan pada 370-380 nm dan 250-260 nm. Hal ini dikarenakan transfer muatan intraligan n-π* dan π-π*. Serapan lemah pada 710-740 nm merupakan transisi d-d. Tembaga(II)-azoheterosiklik menunjukkan transisi MLCT yaitu d(Cu)π* (arilazoheterosiklik) pada panjang gelombang lebih dari 400 nm.
2.5.2 Spektrofotometer Fourier Transform Infra Red (FTIR)
Daerah radiasi spektoskopi infra merah atau infrared spectroscopy (IR) berkisar pada bilangan gelombang 400-4000 cm-1. Spektroskopi IR digunakan untuk penentuan struktur. Spektum infra merah memberikan puncak–puncak maksimal yang jelas sebaik puncak minimumnya. Bila dibandingkan dengan daerah sinar UV-Vis, di mana energi dalam daerah ini dibutuhkan untuk transisi elektronik, maka radiasi infra merah hanya terbatas pada perubahan energi setingkat molekul.
Instrumen spektrofotometer infra merah memiliki komponen dasar yang sama dengan UV-Vis, akan tetapi sedikit berbeda pada sumber, detektor dan komponen optiknya. Monokromator yang digunakan dalam alat infra merah terbuat dari berbagai macam bahan, seperti celah yang terbuat dari gelas, lelehan silika, LiF, CaF2, BaF2, dan AgCl. Untuk detektor dalam daerah IR, sel
fotokonduktif jarang digunakan, yang banyak digunakan adalah detektor termal. Alat infra merah umumnya dapat merekam sendiri absorbansinya secara tepat. Temperatur dan kelembapan ruang tidak boleh lebih dari 50% karena dapat menyebabkan permukaan prisma dan sel alkali halida akan menjadi suram.
Sampel umumnya dikerjakan dalam bentuk cair pada suhu kamar dan dalam keadaan murni. Ketebalan film untuk pengukuran berkisar antara 0,01–0,05 mm. Sampel dalam bentuk padat dilarutkan dengan CCl4 yang transmisi
15
dapat mentransmisikan sinar >75%. Semua pelarut bebas air, serbuk dan padatan partikelnya harus diperkecil agar dapat dianalisis dengan cara menggerus padatan tersebut dalam medium cairan kental yang memiliki indeks refraksi sama untuk mengurangi energi yang hilang karena terjadinya hamburan cahaya.
Di sisi lain, penelitian Maru dkk., (2012) dilaporkan senyawa polimer koordinasi Cu(II)-benzimidazol. Pada spektra IR muncul pita pada 1693- 1654 cm-1 yaitu vibrasi C=N dari cincin benzimidazol. Fenil muncul pada pita serapan 3090-2983 cm-1. Vibrasi N-H dan C=N pada kompleks logam muncul pada 3372-3150 cm-1 dan 1660-1612 cm-1. Muncul pita pada daerah 501-445 cm-1 merupakan vibrasi M-N.
2.5.3 Spektrofotometer Serapan Atom (SSA)
Spektroskopi serapan atom (SSA) digunakan untuk mengidentifikasi dan menentukan (kualitatif dan kuantitatif) logam dalam suatu jenis materi dan larutan. Pengukuran dalam spektroskopi serapan atom berdasarkan radiasi yang diserap oleh atom yang tidak tereksitasi. Sampel yang digunakan pada teknik serapan adalah aerosol dalam nyala. Penguapan pelarut dan penguapan garam terjadi terlebih dahulu untuk mendisosiasi garam dalam atom gas yang bebas. Pada suhu nyala udara-asetilena (± 2300°C atom dalam keadaan dasar). Apabila seberkas energi radiasi yang terdiri dari spektrum emisi untuk unsur tertentu akan ditentukan melalui nyala, atom dalam keadaan dasar akan menyerap energi dari panjang gelombang yang karakteristik dan mencapai keadaan energi yang tinggi. Jumah energi radiasi yang diserap sebagai suatu konsentrasi unsur dalam nyala merupakan dasar spektroskopi serapan atom.
2.5.4 Analisis Mikrounsur C, H, N
Analisis ini digunakan untuk menganalisis C, H, dan N dalam sampel. Pada analisis ini sampel akan dipanaskan 900 °C dalam oksigen dan campuran dari karbon dioksida, karbon monoksida, air, nitrogen, dan nitogen oksida sebagai hasilnya. Reduksi nitrogen oksida menjadi nitrogen dan oksigen hilang pada suhu furnace 750 °C. Hasil campuran dianalisis menggunakan 3 detektor yaitu, detektor pertama untuk hidrogen, detektor kedua untuk karbon, dan detektor ketiga untuk
16
nitrogen. Hasil yang diperoleh dari analisis mikrounsur ini adalah presentase massa C, H, dan N pada sampel (Atkins dkk., 2010).
2.5.5 Thermal Gravimetry Analyzer (TGA)
Teknik pengujian dengan menggunakan TGA merupakan salah satu teknik untuk analisa penentuan kestabilan termal pada material dan fraksi senyawa yang mudah menguap dengan menghitung perubahan berat yang dihubungkan dengan perubahan temperatur. Pengukuran dengan TGA dilakukan diudara atau atmosfer gas inert sepeti gas argon, helium dan nitrogen.
Gambar 2.8 TGA Kompleks Cu(BIM)2Cl2 (Materazzi dkk., 2007)
Kurva TGA pada Gambar 2.8 di atas merupakan kurva kompleks TGA dari Cu(BIM)2Cl2 dan BIM adalah 2-imidazilil sebagai ligan. Stabilitas kompleks
dikonfirmasi dengan menggunakan TGA. Kompleks ini stabil yang menujukkan tinggi pada temperatur sampai 265 °C, kemudian turun karena ada ion klorida terdekomposisi dan terakhir tersisa oksida logam.
Di sisi lain, penelitian yang dilaporkan oleh Maru dkk., (2012) yaitu senyawa kompleks Cu(II)-benzimidazol kehilangan molekul air pada 80-195 °C. Pada 220-445 °C dan 460-750 °C terdapat massa yang hilang dari molekul ligan. Pada akhir reaksi terbentuk CuO.
2.6 Sitotoksisitas
Sitotoksisitas adalah sejauh mana senyawa kompleks memiliki tindakan destruktif spesifik pada sel-sel tertentu. Dua metode umum yang digunakan untuk
17
uji sitotoksisitas adalah metode perhitungan langsung (direct counting) dengan menggunakan biru tripan (trypan blue) dan metode MTT assay. Dalam penelitian ini digunakan uji MTT assay yang memiliki kelebihan yaitu relatif cepat, sensitif, akurat, digunakan untuk mengukur sampel dalam jumlah besar dan hasilnya bisa untuk memprediksi sifat sitotoksik suatu bahan (Doyle dan Griffiths, 2000). Dasar uji enzimatik MTT adalah pengukuran kemampuan sel hidup berdasarkan aktivitas mitokondria dari kultur sel. Metode ini berdasarkan pada perubahan garam tetrazolium [3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolium bromide] (MTT) menjadi formazan dalam mitokondria yang aktif pada sel hidup. MTT diabsorbsi ke dalam sel hidup dan dipecah melalui reaksi reduksi oleh enzim reduktase dalam rantai respirasi mitokondria menjadi formazan yang terlarut dalam PBS (Phosphate Buffer saline) berwarna biru. Konsentrasi formazan yang berwarna biru dapat ditentukan secara spektrofotometri visibel dan berbanding lurus dengan jumlah sel hidup karena reduksi hanya terjadi ketika enzim reduktase yang terdapat dalam jalur respirasi sel pada mitokondria aktif (Mosmann, 1983). Semakin besar absorbansi menunjukkan semakin banyak jumlah sel yang hidup. Reaksi reduksi MTT dapat dilihat pada Gambar 2.9.
N N N N S Mitokondria Reduktase N N N N S NH Formazan
Gambar 2.9 Reaksi Reduksi MTT (Mosmann, 1983)
Uji sitotoksik ini digunakan untuk menentukan nilai IC50 (Inhibitory
Concentration). Nilai IC50 menunjukkan nilai konsentrasi yang menghasilkan
hambatan proliferasi sel 50% dan menunjukkan potensi ketoksikan suatu senyawa terhadap sel. Nilai ini merupakan patokan untuk melakukan uji pengamatan kinetika sel. Nilai IC50 menunjukkan potensi suatu senyawa sebagai sitostatik.
18
Semakin besar harga IC50 maka senyawa tersebut semakin tidak toksik (Meiyanto
19
BAB 3
METODE PENELITIAN
3.1 Bahan dan Alat Penelitian 3.1.1 Bahan
Bahan yang digunakan pada penelitian ini adalah tembaga(II) klorida dihidrat (CuCl2.2H2O) (Merck 99.0%), N,N-dimetilformamida (DMF) (Merck
99,8%), dimetil sulfoksida (DMSO) (Merck 99,8%), 2,4,5-trifenil imidazol (Sigma-Aldrich 90%), metanol (Sigma-Aldrich 98%), aquadem, sel vero (ATCC® CCL-81TM), sel kanker payudara T74D (CVCL_0553), Minimum Essential Medium Eagle (MEM) (Biowest), Gibco Adwanced RPMI (Roswell Park Memorial Institute) 1640 Medium, Phospate-buffered saline 1X (PBS 1X) (Gibco), dan Thiazoyl blue tetrazolium bromide (MTT) (Bio Basic). Bahan kimia yang digunakan mempunyai derajat kemurnian pro analysis (p.a).
3.1.2 Alat
Alat yang digunakan pada penelitian adalah seperangkat alat-alat gelas, pengaduk magnet, botol laboratorium, pipet tetes, labu ukur, gelas ukur, lumpang agate, corong Buchner, pompa vakum, neraca analitik, oven listrik untuk sintesis, Spektrofotometer UV-Vis (Shimadzu UV-1650 PC), Spektrofotometer FTIR (8400S Shimadzu), Spektrofotometer Serapan Atom (SSA) (Shimadzu AA8801S), Analisis Mikrounsur C, H, N (Thermo Finnigan), Thermogravimetr
Analyzer (TGA-METTLER TOLEDO), Microplate Reader (iMarkTM Bio Rad),
Inkubator CO2 (Esco), dan Micro stepper microscope (Olympus).
3.2 Prosedur
3.2.1 Penentuan panjang gelombang maksimum senyawa kompleks dengan metode variasi kontinu
Panjang gelombang senyawa kompleks Cu(II) dengan 2,4,5-trifenil imidazol ditentukan dengan metode variasi kontinu. Pada variasi kontinu diawali dengan sintesis kompleks CuCl2.2H2O 1 mol dan 2,4,5-trifenilimidazol 1 mol
Masing-20
masing larutan tersebut dalam pelarut DMF (Han dkk., 2012) sebanyak 5 mL. Larutan senyawa kompleks tersebut dimasukkan ke dalam botol duran, diaduk selama 30 menit dan dioven pada suhu 120 °C selama 3 jam. Selanjutnya campuran didinginkan pada suhu ruang dalam botol vial ditutup dengan aluminium foil yang telah diberi beberapa lubang kecil dan dibiarkan selama 7 hari sampai terbentuk padatan dan filtrat. Padatan dicuci dengan metanol untuk menghilangkan pengotor yang terdapat pada campuran. Padatan yang terbentuk didekantasi dan dikeringkan. Padatan dilarutkan dalam DMSO dan diukur panjang gelombang maksimum (λmaks) dengan spektrofotometer UV-Vis, kemudian dibuat
grafik antara absorbansi sebagai ordinat dan fraksi mol logam sebagai absis.
Tabel 3.1 Komposisi variasi kontinu CuCl2.2H2O dengan 2,4,5-trifenilimidazol
dalam DMF No. Perbandingan CuCl2.2H2O : 2,4,5-trifenilimidazol CuCl2.2H2O (ml) 2,4,5-trifenil imidazol (ml) 1. 0:10 0 10 2. 1:9 1 9 3. 3:7 3 7 4. 5:5 5 5 5. 7:3 7 3 6. 9:1 9 1 7. 10:0 10 0
3.2.2 Sintesis senyawa kompleks
Sintesis senyawa kompleks ini dilakukan dengan perbandingan mol hasil prosedur 3.2.1. Direaksikan garam tembaga(II) klorida dihidrat dan 2,4,5-trifenil imidazol dalam pelarut DMF (Han dkk., 2012) sebanyak 5 mL. Larutan kompleks tersebut dimasukkan ke dalam botol duran, distirer selama 30 menit dan dioven pada suhu 120 °C selama 3 jam. Selanjutnya campuran didinginkan pada suhu ruang dalam vial ditutup dengan aluminium foil yang telah diberi beberapa lubang kecil dan dibiarkan selama 7 hari sampai terbentuk padatan dan setiap harinya dicuci dengan metanol untuk menghilangkan pengotor yang terdapat pada campuran. Padatan yang terbentuk didekantasi dan dikeringkan. Selanjutnya dikarakterisasi dengan Spektrofotometer UV-Vis, Spektrosfotometer FTIR, SSA, Analisis Mikrounsur C, H, N, TGA, diuji aktivitas anti kanker (IC50).
21
3.3 Prosedur Karakterisasi 3.3.1 Spektrofotometri UV-Vis
Padatan dilarutkan dalam DMSO dan ditentukan spektrumnya di daerah tampak (200-700 nm).
3.3.2 Spektrofotometri Fourier Transform Infrared (FTIR)
Sampel padatan kompleks didispersikan dalam KBr dengan perbandingan 1:100. Sampel dan KBr dicampur dan digerus dengan mortar agate lalu dicetak menjadi pelet dengan dimampatkan menggunakan tekanan hidrolik hingga ketebalan 0,01 mm sampai dengan 0,05 mm. Pelet yang terbentuk selanjutnya ditempatkan pada holder dan spektranya direkam pada daerah bilangan gelombang 400-4000 cm-1 dengan pemisahan spektrum 2 cm-1.
3.3.3 Analisis kadar logam dengan Spektrofotometri Serapan Atom (SSA)
Analisis kadar logam dengan SSA menggunakan larutan standar CuCl2.2H2O pada konsentrasi 0,1; 0,2; 0,4; 0,8; dan 1,6 ppm. Larutan standar ini
dibuat dengan melarutkan 0.01 gram CuCl2.2H2O dan ditambah 2 mL HCl pekat
dalam aquadem pada labu ukur 100 mL. Penambahan aquadem sampai tanda batas, sehingga diperoleh larutan induk dengan konsentrasi 100 ppm. Selanjutnya dibuat dibuat larutan standar 0,1; 0.2; 0,4; 0,8; dan 1,6 ppm dengan cara mengambil masing-masing 0,05; 0,1; 0,2; 0,4; dan 0,8 mL dari larutan induk 100 ppm. Dimasukkan ke dalam labu ukur 50 mL ditambah aquadem yang mengandung HCl 1 mL sampai tanda batas.
Larutan induk sampel disiapkan dengan menimbang 0,057 gram sampel. Sampel selanjutnya ditambah 3 mL HNO3 pekat dan dilarutkan dalam aquadem
sampai tanda batas labu ukur 10 mL. Larutan induk sampel diambil 1,0 mL dan diencerkan dengan aquadem sampai tanda batas pada labu ukur 10 mL. Larutan standar dan sampel siap diuji dengan SSA.
3.3.4 Penentuan kandungan C, H, dan N dalam senyawa
Alat untuk analisis mikrounsur C, H, dan N distandarisasi dengan L-Cistina Standard (C6H12N2O4S2, C = 29,99%, H = 5,03%, N = 11,66%, O =
26,63%, dan S = 26,69%) sebelum digunakan. Sampel 2,83 mg ditempatkan dalam aluminium foil dan ditambahkan vanadium(V)oksida untuk menyempurnakan reaksi oksidasi. Sampel dimasukkan dalam pelat berlubang
22
untuk dilakukan pembakaran dengan gas oksigen. Selanjutnya alat mikrounsur dijalankan dan komposisi C, H, dan N yang terkandung pada senyawa terbaca pada monitor komputer.
3.3.5 Thermal gravimetry analyzer (TGA)
Analisis TGA digunakan untuk menentukan kestabilan termal material kompleks dengan menggunakan TGA-Mettler Toledo, prosedur yang dilakukan dengan ditimbang sampel seberat 10 mg sampel dan dimasukkan dalam holder. Kemuidan sampel dipanaskan dengan laju 10 oC/menit mulai dari suhu 0 oC sampai 800 oC dibawah atmosfer nitrogen.
3.3.6 Uji aktivitas anti kanker dengan metode MTT (Mosmann, 1983)
Sel kanker payudara T74D dengan kepadatan 5x103 sel/sumuran didistribusikan ke dalam plate 96 sumuran, diinkubasi selama 24 jam pada inkubator CO2 suhu 37 °C untuk beradaptasi dan menempel di dasar sumuran.
Dicuci PBS 3 kali kemudian ditambahkan 200 µL medium RPMI yang mengandung DMSO 0,1% (kontrol), senyawa kompleks dengan konsentrasi 50; 25; 12,5; 6,25; 3,13; dan 1,56 µg/mL dalam RPMI dengan DMSO 0,1%, dan diinkubasi 20 jam pada inkubator CO2 suhu 37 °C. Pada akhir inkubasi, media
kultur yang mengandung sampel dibuang dan dicuci dengan 100 µL PBS. Kemudian ke dalam masing-masing sumuran ditambahkan 100 µL RPMI yang mengandung 5 mg/ml MTT, inkubasi lagi selama 4 jam pada suhu 37 °C. Sel yang hidup akan bereaksi dengan MTT membentuk kristal formazan. Setelah 4 jam, media yang mengandung MTT dibuang, dicuci PBS kemudian ditambahkan larutan DMSO 50 µL untuk melarutkan Kristal formazan. Dihomogen di atas shaker selama 10 menit kemudian dibaca dengan Microplate reader pada panjang gelombang 595 nm.
Data yang diperoleh berupa absorbansi masing-masing sumuran dikonversi ke dalam persen sel hidup dan dihitung menggunakan rumus:
23
Berdasarkan data % sel hidup dan konsentrasi tersebut, kemudian ditarik regresi linier dari grafik konsentrasi versus % sel hidup :
y = Bx + A (3.2)
dimana:
x = konsentrasi y = % sel hidup
Persamaan regresi linear Y=Ax+B digunakan untuk menentukan IC50
dengan mensubtitusi angka 50 pada y, akan diperoleh nilai x (konsentrasi), sehingga dihasilkan nilai x yang merupakan konsentrasi sel hidup sebesar 50% atau IC50.
24
25
BAB 4
HASIL DAN PEMBAHASAN
Senyawa kompleks telah disintesis dengan mereaksikan ion logam Cu(II) dan ligan 2,4,5-trifenilimidazol. Senyawa kompleks yang dihasilkan ditentukan rumus molekulnya dengan Spektrofotometri UV-Vis, SSA (Spektrofotometer Serapan Atom), spektrofotometri FTIR, C, H, N analyzer, dan TGA (Thermal Gravimetric Analyzer). Kompleks yang dihasilkan diuji bioaktivitasnya dengan metode MTT (3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolium bromide) pada sel kanker payudara T74D.
4.1 Sintesis Kompleks Cu(II)-2,4,5-trifenilimidazol 4.1.1 Penentuan perbandingan logam dan ligan
Penentuan jumlah ligan yang dapat terikat oleh logam pada suatu kompleks dapat diperoleh dengan metode variasi kontinu (Renny dkk., 2013). Pada metode variasi kontinu diawali dengan sintesis kompleks dari CuCl2.2H2O 1 mol dan
2,4,5-trifenilimidazol 1 mol dengan perbandingan volume 0:10, 1:9, 3:7, 5:5, 7:3, 9:1, dan 10:0. Masing-masing larutan tersebut direaksikan menggunakan pelarut DMF dioven selama 3 jam pada suhu 120 °C. Selanjutnya campuran didinginkan pada suhu ruang dalam vial ditutup dengan alumumium foil yang telah diberi beberapa lubang kecil dan dibiarkan selama 7 hari sampai terbentuk padatan dan filtrat. Gambar ketiga larutan kompleks setelah 7 hari dapat dilihat pada Gambar 4.1. Pada gambar tersebut, terlihat bahwa filtrat yang terbentuk pada perbandingan 1:9, 3:7, 5:5, 7:3, dan 9:1 terdapat perbedaan warna, semakin banyak perbandingan ligan maka warna filtrat yang terbentuk semakin berwarna hijau keputihan. Hal ini berarti bahwa jumlah ligan mempengaruhi pembentukan warna larutan kompleks.
26
Gambar 4.1 Larutan kompleks setelah 7 hari dengan perbandingan logam dan ligan: (a) 1:9, (b) 3:7, (c) 5:5, (d) 7:3, dan (e) 9:1
Padatan kompleks yang terbentuk didekantasi dan dikeringkan. Gambar ketiga padatan kompleks dapat dilihat pada Gambar 4.2.
Gambar 4.2 Padatan kompleks dengan perbandingan logam dan ligan: (a) 1:9, (b)
3:7, (c) 5:5, (d) 7:3, dan (e) 9:1
Padatan yang diperoleh kemudian diuji panjang gelombang maksimumnya dengan Spektrofotometer UV-Vis. Masing-masing padatan dengan variasi kontinu dilarutkan dalam DMSO dan diuji panjang gelombangnya dengan Spektrofotometer UV-Vis pada rentang panjang gelombang maksimum 529 nm. Hasil penentuan perbandingan ion logam dan ligan dengan metode variasi kontinu ditunjukkan pada Gambar 4.3.
a
b
c
c
b
a
d
e
d
e
27
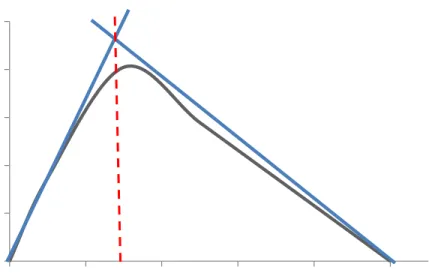
Gambar 4.3 Metode Variasi Kontinu Kompleks Cu(II)-2,4,5-trifenilimidazol
Gambar 4.3 merupakan grafik absorbansi sebagai fungsi fraksi mol kompleks 2,4,5-trifenilimidazol yang direaksikan dengan ion logam Cu. Grafik tersebut dapat ditarik garis singgung dari sebelah kiri dan kanan puncak. Kemudian, pertemuan kedua garis singgung ditarik titik potong ke sumbu X sehingga dihasilkan harga fraksi mol dari kompleks yaitu 0,2823. Hal ini menunjukkan bahwa perbandingan mol antara ion logam Cu2+ dan ligan 2,4,5-trifenilimidazol sebesar 1:2 dimana satu mol logam dapat berikatan dengan dua mol ion logam Cu. Jadi, kemungkinan rumus senyawa kompleks yang terbentuk adalah [Cu(2,4,5-trifenilimidazol)2(H2O)2].Cl2.
Data hasil penentuan kompleks dengan variasi kontinu ditunjukkan pada Lampiran B.
4.1.2 Sintesis Kompleks Cu(II)-2,4,5-trifenilimidazol
Sintesis senyawa kompleks Cu(II)-2,4,5-trifenilimdazol didasarkan pada hasil uji panjang gelombang maksimum sebelumnya. Padatan CuCl2.2H2O dan
2,4,5-trifenilimidazol dengan perbandingan mol 1:2 direaksikan dengan pelarut DMF dan dipanaskan selama 3 jam pada suhu 120 °C. Campuran yang diperoleh kemudian didiamkan selama 7 hari di dalam suhu ruang. Kompleks yang diperoleh kemudian
0 0.2 0.4 0.6 0.8 1 0 0.2 0.4 0.6 0.8 1
Fraksi Mol Logam
A
b
sorba
ns
28
disaring dan dikeringkan sehingga diperoleh padatan berwarna hijau muda (Malecki dkk., 2012). Padatan tersebut kemudian disaring dan dikeringkan dalam desikator.
Senyawa kompleks yang diperoleh kemudian dinalisis padatannya dengan foto mikroskop. Hasil foto mikroskop perbesaran 10x menunjukkan bahwa padatan yang diperoleh berbentuk jarum. Padatan kompleks yang diperoleh dan hasil foto mikroskop ditunjukkan pada Gambar 4.4. Rendemen kompleks Cu(II)-2,4,5-trifenilimidazol yang diperoleh adalah sebesar 72,127%. Perhitungan rendemen kompleks Cu(II)-2,4,5-trifenilimidazol ditunjukkan pada Lampiran A.
Gambar 4.4 (a) Padatan Kompleks Cu(II)-2,4,5-trifenilimidazol; (b) Kompleks
Perbesaran 10x
Penentuan panjang gelombang pada senyawa kompleks Cu(II)-2,4,5-trifenilimidazol dilakukan untuk mengetahui apakah kompleks tersebut telah terbentuk. Kompleks Cu(II)-2,4,5-trifenilimidazol dan ligan 2,4,5-trifenilimidazol dilarutkan dalam DMSO. Sedangkan, logam CuCl2.2H2O dilarutkan dalam metanol
pada suhu ruang. Spektra UV-Vis ketiga senyawa tersebut menunjukkan posisi pita absorbansi yang berbeda-beda. Hasil spektra senyawa kompleks Cu(II)-2,4,5-trifenilimidazol, ligan 2,4,5-Cu(II)-2,4,5-trifenilimidazol, dan logam CuCl2.2H2O ditunjukkan
pada Gambar 4.5.
29 0 0.2 0.4 0.6 0.8 1 1.2 180 280 380 480 A bs or ban si (a. u) Panjang gelombang (nm)
Gambar 4.5 Grafik Panjang Gelombang Maksimum Larutan Logam CuCl2.2H2O,
Kompleks Cu(II)-2,4,5-trifenilimidazol dan ligan 2,4,5-trifenilimidazol Berdasarkan grafik tersebut, diperoleh data perbedaan panjang gelombang maksimum seperti pada Tabel 4.1.
Tabel 4.1 Panjang gelombang maksimum
Sampel Larutan Panjang gelombang maksimum (nm)
CuCl2.2H2O 338
2,4,5-trifenilimidazol 243
Cu(II)-2,4,5-trifenilimidazol 529
Berdasarkan Tabel 4.1 dapat diamati bahwa terjadi pergeseran panjang gelombang maksimum dari ligan 2,4,5-trifenilimidazol ke kompleks Cu(II)-2,4,5-trifenilimidazol yaitu 243 nm menjadi 529 nm. Hal ini menunjukkan bahwa kompleks Cu(II)-2,4,5-trifenilimidazol telah terbentuk. Perubahan panjang gelombang maksimum ke arah yang lebih besar disebabkan adanya transisi elektron d-d logam yang diakibatkan transfer muatan dari ligan ke logam (Ligand Metal Charge Transfer) (LMCT). Data ini juga mendukung penelitian Pramanik dkk. (2010) bahwa panjang gelombang maksimum logam kompleks Cu(II)-aril azo imidazol bergeser ke
580 680 CuCl2.2H2O
Cu(II)-2,4,5-trifenilimidazol 2,4,5-trifenilimidazol
30
arah panjang gelombang yang lebih besar dibandingkan dengan ligan 2,4,5-trifenilimidazol.
4.1.3 Karakterisasi FTIR kompleks Cu(II)-2,4,5-trifenilimidazol
Karakterisasi menggunakan spektrofotometer FTIR digunakan untuk mengetahui adanya gugus fungsi dalam kompleks dan ikatan baru yang terbentuk antara logam dan ligan. Perbandingan spektrum FTIR ligan dan kompleks terdapat pada Gambar 4.6.
Gambar 4.6 Perbandingan spektrum IR kompleks (a) ligan 2,4,5-trifenilimidazol
dan (b) Cu(II)-2,4,5-trifenilimidazol
Berdasarkan hasil data tersebut, dapat dianalisis bahwa terdapat puncak baru yang muncul pada bilangan gelombang 422,38 cm-1. Puncak tersebut diamati sebagai vibrasi logam dan ligan. Hal ini sesuai dengan penelitian Gomathi dkk. (2014) bahwa puncak baru kompleks yang menunjukkan ikatan logam dan ligan (Cu-N) muncul pada bilangan gelombang 453 cm-1 sedangkan ikatan ion logam Cu dengan ligan H2O
muncul pada puncak serapan 534,25 cm-1 yang menunjukkan adanya vibrasi Cu-O.
(b) (a) Cu-N Cu-O T ra ns m it an (%) Bilangan Gelombang (cm-1)
31
Puncak lain sebagai indikasi terbentuknya kompleks yaitu puncak pada spektra 2,4,5-trifenilimidazol serapan diatas 3000 cm-1 tidak terdeteksi. Ini mengindikasikan bahwa ikatan N-H yang terdeteksi adalah N-H tersier. Sedangkan pada kompleks muncul puncak dengan intensitas lemah di daerah 3400,27 cm-1, puncak ini merupakan ciri khas amina sekunder yang terletak pada ligan 2,4,5-trifenilimidazol (Marouk dkk., 2013). Penyebab munculnya puncak amina sekunder karena struktur kompleks [Cu(II)-2,4,5-trifenilimidazol] yang disintesis memiliki dua mol ligan sehingga intensitas ikatan N-H sekunder lebih kuat sehingga dapat terdeteksi walaupun intensitasnya lemah. Pada spektra terlihat ikatan N-H imidazol pada kompleks serapan pada daerah diatas 3000 cm-1 sedikit lebih lebar bila dibandingkan dengan ligan. Pelebaran ini disebabkan adanya ikatan O-H pada air yang terkoordinasi didalam kompleks sebagai ligan (Ullah dkk., 2016). Pada spektra kompleks pelebaran tidak terlalu terlihat. Penyebabnya karena jumlah ikatan C-H sp2 lebih mendominasi didalam struktur sehingga puncak O-H dan C-H sp2 menyatu. Serapan yang muncul pada 1600-1700 cm-1 merupakan vibrasi C=N pada ligan 2,4,5-trifenilimidazol yang terkoordinasi pada ion logam Cu.
4.1.4 Penentuan kadar unsur Cu, C, H, dan N dalam kompleks
Penentuan rumus molekul dari kompleks dapat diperoleh melalui pendekatan perhitungan teoritis komposisi pembentukan kompleks tersebut. Dalam hal ini dimisalkan kompleks yang terbentuk dari satu logam dan dua ligan dengan rumus molekul [(H2O)x-Cu-(L)2(Cl)y]Cly. Penambahan Cl di luar kompleks berfungsi untuk
menetralkan muatan kompleks, sehingga jumlah Cl akan menyesuaikan dengan muatannya. Pendekatan teoritis dilakukan dengan menghitung presentase Cu, C, H, dan N pada kompleks. Secara teoritis, kompleks yang terbentuk memiliki rumus [Cu(L)2(H2O)2].Cl2 dimana dua ligan mengikat satu logam Cu sesuai dengan variasi
kontinu. Hasil pendekatan rumus molekul secara teoritis dan perhitungan ditampilkan pada Tabel 4.2.
32
Tabel 4.2 Kadar unsur C, H, N dan Cu secara eksperimen dan teoritis Rumus molekul % C %H %N %Cu Sampel (eksperimen) 66,2751 4,7284 7,3861 8.334
[Cu(L)2(Cl)2] 69,370 4,404 7,708 8,746
[Cu(L)2(H2O)2].Cl2 66,095 4,721 7,344 8,333
[Cu(L)2(Cl)2(H2O)].Cl 67,693 4,567 7,521 8,534
L = 2,4,5-trifenilimidazol
Selain itu, juga dilakukan pendekatan secara eksperimen yaitu penentuan kadar Cu dengan Spektroskopi Serapan Atom (SSA) sedangkan kadar C, H, dan N ditentukan dengan elemental analyzer.
Hasil analisis menunjukkan bahwa kompleks yang disintesis mengandung unsur Cu sebesar 8.334%, unsur C sebesar 66,2751%, unsur H sebesar 4,7284% dan unsur N sebesar 7,3861%. Berdasarkan data tersebut dihitung persentase kadar masing-masing unsur secara teori dari beberapa struktur kompleks yang mungkin terbentuk. Hasil perhitungan kadar unsur secara teoritis yang mendekati hasil pengukuran secara eksperimen merupakan hasil prediksi rumus molekul senyawa kompleks. Pencocokan menunjukkan hasil yang sesuai untuk rumus kompleks [Cu(L)2(H2O)2].Cl2 (blok kuning pada Tabel 4.2). Hasil tersebut menunjukkan bahwa
ligan 2,4,5-trifenilimidazol hanya mengikat satu Cu. Adanya halangan sterik menyebabkan ligan 2,4,5-trifenilimidazol sangat sulit mengikat logam dan hanya mampu mengikat satu logam. Hal ini menunjukkan bahwa H yang terikat pada N tidak semuanya digantikan oleh Cu. Perhitungan kadar Cu, C, H, N secara teoritis dan eksperimen terdapat pada Lampiran E dan Lampiran F.
4.1.5 Analisis TGA (Thermo Gravimetric Analyzer)
Analisis TGA pada penelitian ini dilakukan untuk mendukung formula kompleks yang telah diprediksi pada analisis CHN dan SSA. Pada penentuan rumus molekul kompleks, termogravimetri dapat memberikan informasi spesi dari kompleks yang terdekomposisi ketika terjadi pemanasan. Analisis termogravimetri kompleks
33
Cu(II)-2,4,5-trifenilimidazol dilakukan pada suhu 25-600°C dengan berat sampel kompleks sebesar 6,3670 mg.
Gambar 4.7 Kurva TGA kompleks Cu(II)-2,4,5-trifenilimidazol
Berdasarkan kurva TGA kompleks pada Gambar 4.7 dapat dilihat bahwa terjadi satu tahap dekomposisi pada kompleks. Penurunan berat sebesar 86.8791 % terjadi pada suhu 255.33 – 355.83 °C menunjukkan adanya dekomposisi kompleks yang terdiri atas 2 molekul ligan 2,4,5-trifenilimidazol, 2 molekul H2O dan 1 molekul
Cl2. Hasil ini sesuai dengan berat teoritis bahwa pada penurunan berat sebesar
86.8791 % merupakan dekomposisi (C21H16N2)2(H2O)2Cl2). Residu sebesar 13.1209
% (secara teori 8,333%) dapat diprediksi merupakan Cu, seperti pada penelitian Kukovec dkk., (2012) bahwa CuO merupakan residu akhir dari kompleks [Cu(6-hidroksipikolinat)2(3-pikolinat)2]. Perhitungan berat hilang teoritis terdapat pada
Lampiran G. Data berat eksperimen dan teoritis dapat dilihat pada Tabel 4.3. Penurunan berat tidak terjadi pada suhu 75-147°C (Tamaekong dkk., 2014). Hal ini berarti kompleks tidak mengandung air kristal. Hal ini mendukung data prediksi rumus molekul kompleks pada analisis C, H, N dan SSA sebelumnya, yaitu [Cu(L)2(H2O)2].Cl2. P enur una n b er at (m g )
34
Tabel 4.3 Data penurunan berat eksperimen dan teoritis TGA kompleks Suhu dekomposisi (°C) Berat eksperimen (%)
Rumus kompleks Berat teoritis (%)
0 100 [Cu(C21H16N2)2(H2O)2].Cl2 100
255,33 - 355,83 86,879 (C21H16N2)2(H2O)2Cl2 91,667 4.1.6 Prediksi Struktur Senyawa Kompleks
Berdasarkan hasil analisis UV-Vis, FTIR, SSA, CHN Analyzer, dan TGA maka ikatan yang diusulkan pada pembentukan kompleks Cu(II) dengan ligan 2,4,5-trifenilimidazol terjadi melalui atom nitrogen pada gugus amina tersier dari ligan 2,4,5-trifenilimidazol dan ion logam Cu(II). Ikatan yang terjadi antara ligan dan kompleks melalui atom N pada gugus amina tersier yang memiliki pasangan elektron bebas yang dapat didonorkan ke ion logam Cu(II). Hal ini semakin diperkuat dengan munculnya stretching lemah amina (N-H) tersier ligan pada bilangan gelombang 3400,27 cm-1 pada kompleks. Usulan posisi pengikatan yang terjadi pada kompleks disajikan pada Gambar 4.8.
HN N N NH Cu OH2 OH2
Gambar 4.8 Ikatan yang Diusulkan pada Senyawa Kompleks
Cu(II)-2,4,5-trifenilimidazol
Bentuk geometri yang paling mendekati berdasarkan rumus molekul senyawa kompleks dari data SSA, TGA, UV-Vis, CHN-analyzer, dan FTIR adalah [Cu(C21H16N2)2(H2O)2].Cl2 dengan geometri tetrahedral (Gambar 4.9). Hal ini
35
dikarenakan atom pusat yakni Cu(II) dikelilingi oleh 4 ligan yakni 2 ligan 2,4,5-trifenilimidazol dan 2 ligan H2O yang berasal dari prekusor CuCl2. Donor pasangan
elektron bebas dari ligan tersebut membentuk hibridisasi sp3 sehingga bentuk geometri molekul yang mendekati adalah tetrahedral. Usulan ini bersesuaian dengan penelitian sebelumnya yang berhasil mensintesis kompleks Cu(II) dengan ligan imidazol. Senyawa kompleks yang berhasil disintesis menunjukkan ikatan antara ion logam Cu(II) dengan N dari ligan. Rumus molekul yang dihasilkan pada kompleks tersebut adalah [Cu(L)4Cl].Cl, presursor yang digunakan ikut menjadi ligan dan
terikat dalam struktur molekul senyawa kompleks (Morzyk-Ociepa dkk., 2012).
HN N NH N OH2 OH2 Cu .Cl2
Gambar 4.9 Bentuk Geometri Molekul yang Diusulkan pada Kompleks
[Cu(2,4,5-trifenilimidazol)2(H2O)2].Cl2
4.2 Uji Bioaktivitas Senyawa Kompleks Cu(II)-2,4,5-trifenilimidazol
Pada penelitian ini uji bioaktivitas dilakukan dengan metode MTT (3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolium bromide) menggunakan sel kanker payudara T74D. Uji ini untuk menentukan sifat toksisitas suatu senyawa. Adapun klasifikasi tingkat toksisitas suatu ekstrak berdasarkan IC50 menurut Meyer dkk. (1982), yaitu
36
konsentrasi 1–10 µg/ml, kategori sedang (medium toxic) pada konsentrasi 10–100 µg/ml, dan kategori rendah (low toxic) pada konsentrasi 100–1000 µg/ml.
Sel yang hidup dihitung dengan micoplate reader setelah diinkubasi selama 20 jam. Persentase penghambatan perkembangan sel kanker payudara T74D oleh sampel uji dari kompleks Cu(II)-2,4,5-trifenilimidazol disajikan pada Tabel 4.4.
Tabel 4.4 Data jumlah sel kanker yang hidup pada variasi konsentrasi larutan
senyawa kompleks Cu(II)-2,4,5-trifenilimidazol
Konsentrasi Senyawa Kompleks Cu(II)-2,4,5-trifenilimidazol
% Jumlah Sel Hidup
1,56 µg/mL 82,573 3,13 µg/mL 79,197 6,25 µg/mL 76,460 12,5 µg/mL 73,631 25 µg/mL 66,880 50 µg/mL 60,949
Berdasarkan Tabel 4.4 dapat diamati bahwa semakin tinggi konsentrasi larutan uji, semakin tinggi pula kematian sel. Hal ini menunjukkan bahwa toksisitas suatu senyawa dipengaruhi oleh konsentrasi senyawa tersebut. Dari tabel tersebut dibuat kurva hubungan antara konsentrasi sampel uji dan persentase sel hidup seperti pada Gambar 4.10. Berdasarkan kurva tersebut diperoleh persamaan regresi linier, kemudian dihasilkan nilai IC50. Perhitungan nilai IC50 kompleks
37
Gambar 4.10 Kurva uji MTT kompleks Cu(II)-2,4,5-trifenilimidazol
Berdasarkan kurva uji MTT kompleks Cu(II)-2,4,5-trifenilimidazol seperti pada Gambar 4.10, diperoleh nilai IC50 seperti perhitungan di Lampiran G.
Berdasarkan perhitungan tersebut diperoleh nilai IC50 untuk kompleks
Cu(II)-2,4,5-trifenilimidazol sebesar 72,139 µg/mL. Berdasarkan nilai IC50 tersebut, kompleks
Cu(II)-2,4,5-trifenilimidazol sama-sama termasuk kategori senyawa toksisitas medium (medium toxic) (Meyer dkk., 1982). Hal ini sesuai dengan penelitian Ali dkk. (2013) dimana kompleks CuL (L= 3-(1,3-dioxoisoindolin-2-yl)-2,6-dioxopiperidine-1-carbodithioate) membunuh sel kanker lebih banyak daripada ligan bebasnya. Hasil IC50 kompleks Cu(II)-2,4,5-trifenilimidazol pada penelitian ini lebih besar
dibandingkan pada penelitian Deverux dkk. (2007), dimana uji MTT dilakukan pada kompleks [Cu(TBZH)2(BZA)]-(BZA).0.5TBZH.H2O dimana ligan TBZH adalah
2-(4’-tiazol)benzimidazol dan ligan BZA adalah asam benzoik, dihasilkan IC50 sebesar
32 µM. y = -0.4189x + 80.154 R² = 0.9284 0 10 20 30 40 50 60 70 80 90 0 20 40 60 % Jumlah Sel Hidup Linear (% Jumlah Sel Hidup) Konsentrasi µg/mL % Jumlah Sel Hidup
38
![Gambar 2.3 Senyawa kompleks [Cu II (SrtaaiNR’)(SCN) 2 ] (Sharker dkk., 2010)](https://thumb-ap.123doks.com/thumbv2/123dok/4429820.3219949/26.893.272.634.747.1069/gambar-senyawa-kompleks-cu-ii-srtaainr-scn-sharker.webp)

![Gambar 2.7 Spektra UV-Vis dari [Cu II (SEtaaiNMe)(SCN) 2 ] dan [Cu I (SEtaaiNMe)(SCN) n ] (Sarker dkk., 2010)](https://thumb-ap.123doks.com/thumbv2/123dok/4429820.3219949/31.893.253.679.732.1005/gambar-spektra-vis-dari-setaainme-scn-setaainme-sarker.webp)