SELEKSI MEDIA UNTUK REGENERASI KALUS DAN
PENINGKATAN PEMBENTUKAN PLANLET TANAMAN Tacca
leontopetaloides
Andri Fadillah Martin*, Evan Maulana dan Tri Muji Ermayanti
*) Research Center for Biotechnology LIPI. Jalan Raya Bogor Km 46 Cibinong, 16911.Telp. 021-8754627, Fax. 021-8754588, Email : andrifm@ymail.com
Abstract
Tissue culture is a technique to produce transplants having similar genotipe as the mother plants or to improve plant genetic by creating a new genotipe. Tacca leontopetaloides is a tuber plants potential for alternative food resource due to its carbohydrate content. This plant species also produces secondary metabolites used for medicinal purposes. This plant grows in limited areas in several coastal areas in Indonesia. In some areas, the flour of this plants have been utilized as materials for some food products. The aims of the study were to select the best medium and to incrase the plantlet formation of Tacca leontopetaloides. Seeds and leaf blades were surface-sterilized then they were cultured on MS medium containing BAP. In this medium, both explants formed compact dan white callus. Callus was then regenerated on the medium containing 2,4-D in combination with BAP to form shoots. Plantlet formation was increased by treatment of different light intensity and photoperiods. Plantlets were then acclimatized in a greenhouse. The results showed that the best medium for regeneration of callus to form shoots was MS containing 0.1 mg/L 2,4-D followed by trasferring callus to MS medium either with no addition of plant growth regulators or with 0.1 mg/L of BAP. Photoperiod and light intensity affected multiple shoot formation. In the greenhouse, plantlets were dormant, formed small tubers, then started to grow afterwards, then they are ready to be planted in the field.
Keywords : Tacca leontopetaloides, medium selection, planlets, regeneration
1. PENDAHULUAN
Indonesia saat ini memiliki penduduk lebih dari 240 juta orang dengan sebagian besar penduduknya mengkonsumsi beras sebagai makanan pokok. Oleh karena itu, dibutuhkan upaya untuk mengurangi ketergantungan pada beras sebagai komoditas pangan pokok antara lain dengan mengembangkan tanaman umbi minor yang sejak dulu telah dikenal sebagai bahan pangan namun kini mulai ditinggalkan oleh masyarakat. Salah satu tanaman umbi minor yang memiliki potensi untuk dikembangkan adalah Tacca
leontopetaloides.
Polynesian Arrowrot (Tacca leontopetaloides (L.)
Kuntze Syn T. pinnatifida. Forst, T. involucrata Schum dan Thonn.) adalah spesies tanaman dari keluarga Taccaceae. Tacca adalah genus yangdipisahkan dari keluarga Dioscoreaceae [1,2]. Tanaman ini secara alami terdistribusi dari Afrika Barat, Asia Tenggara, sampai Australia Utara [3]. Deskripsi tanaman T. leontopetaloises telah dilaporkan pada buku Original:Root Crops 15[4].
Pada masa lalu, umbi Tacca merupakan makanan pokok di Polinesia, dan sebagai sumber pati. Penduduk TahitiTacca digunakan untuk membuat "poi", sebagai makanan tradisional [4]. Umbi Tacca mengandung 20-30% pati yang dapat dengan mudah diekstraksi kemudian dipasarkan di Eropa. Di Filipina
tepungnya digunakan untuk pembuatan roti. Pati
Taccamengandung 22,5%amilosa serupa dengan
kentang, singkong dan beberapa pati umbi lainnya. Sifat fisikokimia pati Tacca yang mirip dengan tepung kentang dan jagung [5]. Karakteristik Taccajuga mirip dengan pati jagung meskipun pati Tacca relatif lebih tahan terhadap kompresi sehingga dapat digunakan sebagai bahan eksipien farmasi seperti pati jagung untuk formulasi tablet [5]. Di pulau-pulau Polinesia umbi Tacca juga berkhasiat obat untuk sakit perut terutama diare dan disentri [6]. Spesies lain yaituT.
chantrieri memiliki aktivitas sitotoksik terhadap
HL-60, sel leukemia manusia promyeocytic [7], sedangkan
T. PaxianadanT. Subflabellatamemiliki aktivitas
antikanker terhadap Sel HeLa [8,9,10].
Di Indonesia Tacca tumbuh terbatas di daerah pantai seperti Karimunjawa, Sukabumi, dan Yogyakarta. Biji Tacca sangat sulit berkecambah, perbanyakan vegetatif dengan umbinya adalah metode yang paling banyak digunakan untuk perkembangbiakannya.Kultur jaringan merupakan salah satu metode yang dapat digunakan untuk menghasilkan bibit unggul yang seragam dalam waktu yang relatif singkat. Kultur in vitro dari Tacca
chantrieri telah dilakukan di Thailand [11] dan inisiasi
kultur in vitro dari Tacca leontopetaloides telah dilakukan oleh Borokini (2011)[12]. Di Indonesia inisiasi kultur in vitro dari Tacca leontopetaloides telah dimulai sejak awal 2011 di Puslit Bioteknologi –
Vol.2 hal-2
LIPI. Tujuan dari penelitian ini adalah untuk melakukan seleksi media dan meningkatkan pembentukan planlet dalam penyediaan bibit
leontopetaloides.
2. METODOLOGI
Sterilisasi biji Tacca leontopetaloides.
Biji Tacca yang akan disterilisasi dicuci dengan air sabun (5%) selama 10 menit, kemudian di rendam pada larutan dithane (3%) selama 30 menit. Setelah dibersihkan dari larutan dithane, biji kemudian di rendam di air hangat selama 10 menit untuk memecah dormansi. Sterilisasi lanjutan dilakukan di laminar air flow cabinet. Biji Tacca direndam dalam larutan alkohol (70%) selama 1 menit, bilas dengan akuades steril, kemudian di rendam dalam larutan Na hipoklorit 0,7875% selama 15 menit, Selain larutan Na-hipoklorit, sterilan lain yang digunakan adalah larutan HgCl2 1% selama 5 menit. Setelah direndam
dalam larutan sterilan, biji Tacca
dengan akuades steril 3 kali dan ditanam pada media MS. Setelah berkecambah, eksplan kem disubkultur pada media MS [13
0,5 mg/L BAP (Benzyl Amino Purine
Sterilisasi eksplan daun Tacca leontopetaloides
Eksplan daun Tacca dari lapang dicuci di air sabun (5%) selama 10 menit, kemudian direndam dalam larutan dithane 3% selama 30 menit. Selanjutnya eksplan daun dicuci dengan air mengalir selama 30 menit. Proses sterilisasi selanjutnya dilakukan di
Laminar Air Flow Cabinet (LA
Eksplan daun direndam dengan alkohol 70% selama 1 menit, dibilas dengan akuades steril dan kemudian direndam dalam larutan Na-hipoklorit 0,525% selama 10 menit. Eksplan daun kemudian dibilas dengan akuades steril sebanyak 3 kali dan dip
ukuran 1x 1 cm dan ditanam pada media MS dengan penambahan 0,5 mg/L BAP. Selanjutnya kalus yang tumbuh dari eksplan daun maupun eksplan kecambah di subkultur pada media perlakuan
Penanaman kalus pada media perlakuan
Sebelum di subkultur pada
kalus terlebih dahulu di subkultur pada media MS selama 2 minggu. Penanaman kalus dilakukan secara aseptik di laminar. Eksplan kalus dari planlet hasil penanaman di media MS diambil dan diletakkan di petri. Kalus dipotong menjadi 4 bagian
Eksplan kalus ditanam di media kombinasi MS + BAP + 2,4-D (2,4 -Dichlorophenoxyacetic acid
terlihat pada Tabel 1. Pengamatan pertumbuhan kalus dilakukan selama 12 minggu.
Tabel 1. Kombinasi Media BAP
(mg/L)
2,4-D
0 0.1 0.5
0 MS0 0.1D 0.5D
Seminar Nasional Kimia Terapan Indonesia 2013
Andri Fadillah Martin et al/Prosiding SNKTI (2013) Vol.2 hal Tujuan dari penelitian ini adalah untuk
melakukan seleksi media dan meningkatkan pembentukan planlet dalam penyediaan bibit Tacca
leontopetaloides.
yang akan disterilisasi dicuci dengan air sabun (5%) selama 10 menit, kemudian di rendam pada larutan dithane (3%) selama 30 menit. Setelah dibersihkan dari larutan dithane, biji kemudian di rendam di air hangat selama 10 menit untuk memecah rilisasi lanjutan dilakukan di laminar air direndam dalam larutan alkohol (70%) selama 1 menit, bilas dengan akuades steril, kemudian di rendam dalam larutan Na-hipoklorit 0,7875% selama 15 menit, Selain larutan
ilan lain yang digunakan adalah 1% selama 5 menit. Setelah direndam
Tacca kemudian dibilas
dengan akuades steril 3 kali dan ditanam pada media cambah, eksplan kemudian 3] dengan penambahan
Benzyl Amino Purine).
Sterilisasi eksplan daun Tacca leontopetaloides
dari lapang dicuci di air sabun (5%) selama 10 menit, kemudian direndam dalam larutan dithane 3% selama 30 menit. Selanjutnya eksplan daun dicuci dengan air mengalir selama 30 menit. Proses sterilisasi selanjutnya dilakukan di (LAFC) secara aseptik. Eksplan daun direndam dengan alkohol 70% selama 1 menit, dibilas dengan akuades steril dan kemudian hipoklorit 0,525% selama 10 menit. Eksplan daun kemudian dibilas dengan akuades steril sebanyak 3 kali dan dipotong dengan ukuran 1x 1 cm dan ditanam pada media MS dengan BAP. Selanjutnya kalus yang tumbuh dari eksplan daun maupun eksplan kecambah di subkultur pada media perlakuan.
perlakuan
Sebelum di subkultur pada media perlakuan, terlebih dahulu di subkultur pada media MS selama 2 minggu. Penanaman kalus dilakukan secara aseptik di laminar. Eksplan kalus dari planlet hasil penanaman di media MS diambil dan diletakkan di petri. Kalus dipotong menjadi 4 bagian sebesar 1 cm. di media kombinasi MS + BAP
ichlorophenoxyacetic acid) seperti
abel 1. Pengamatan pertumbuhan kalus
Tabel 1. Kombinasi Media Perlakuan D (mg/L) 0.5 1.0 2.0 0.5D 1D 2D 0.1 0.1B 0.1D+0.1B 0.5D+ 0.5 0.5B 0.1D+0.5B 0.5D+ 1.0 1B 0.1D+1B 2.0 2B 0.1D+2B
Penanaman planlet pada intensitas cahaya dan fotoperiode berbeda
Kultur tunas Tacca pada media MS
pengatur tumbuh disimpan di dalam ruang inkubasi dengan kondisi cahaya yang berbeda selama minggu. Perlakuan pertama (A) dilakukan dengan fotoperiode (16 jam terang, 8 jam gelap) dengan intensitas cahaya 1000 – 1400 lux. Perlakuan kedua (B) dilakukan dengan pencahayaan secara terus menerus (continous light) dengan intensitas cahaya 1000 – 1400 lux. Perlakuan ketiga (C) dilakukan dengan cahaya yang lebih redup dengan intensitas cahaya 500 – 800 lux dan pencahayaan terus menerus (continous light). Pada akhir periode pengamatan, dicatat rata-rata jumlah tunas, rata
dan rata-rata tinggi tunas.
Perakaran dan aklimatisasi
Tunas Tacca yang sudah mempun
daun dipindahkan pada media MS yang mengandung 0.5 mg/L IBA untuk induksi perakaran. Setelah akar terbentuk, planlet siap diaklimatisasi dengan cara memindahkan planlet pada pot berisi media campuran tanah, pasir, kompos dan sekam bakar. Pot kemu disungkup dengan plastik dan ditempatkan di tempat yang teduh. Setelah terbentuk daun baru, sungkup dibuka dan pot dipindahkan di rumah kaca.
3. HASIL DAN PEMBAHASAN
Pertumbuhan biji dan helai daun yang mengandung 0,5 mg/L
Biji dengan testa lengkap
memerlukan waktu yang cukup lama untuk berkecambah yaitu mulai berkecambah setelah 2 bulan ditanam pada media MS padat tanpa penambahan zat pengatur tumbuh, sedangkan biji yang telah dikupas maupun dibelah dapat mulai berkecambah setelah 1 bulan ditanam pada media yang sama
semua biji berkecambah dengan baik (Gambar 1 tengah.). Biji yang telah berkecambah kemudian disubkultur pada media MS padat tanpa penambahan zat pengatur tumbuh. Pada saat pengamatan perkecambahan, diketahui bahwa biji
poliembrioni, sehingga dari satu biji memiliki 2 embrio. Hasil dari perkecambahan disubkultur langsung pada media MS yang mengandung 0,5 BAP sehingga membentuk kalus berwarna putih (Gambar 1 kanan).
Nasional Kimia Terapan Indonesia 2013
Solo, 23 Mei 2013
/Prosiding SNKTI (2013) Vol.2 hal-1-7 0.5D+0.1B 1D+0.1B 2D+0.1B 0.5D+0.5B 1D+0.5B 2D+0.5B 0.5D+1B 1D+1B 2D+1B 0.5D+2B 2D+2B 2D+2B
intensitas cahaya dan
pada media MS tanpa zat disimpan di dalam ruang inkubasi dengan kondisi cahaya yang berbeda selama 8 . Perlakuan pertama (A) dilakukan dengan fotoperiode (16 jam terang, 8 jam gelap) dengan 1400 lux. Perlakuan kedua (B) dilakukan dengan pencahayaan secara terus ) dengan intensitas cahaya 1400 lux. Perlakuan ketiga (C) dilakukan dengan cahaya yang lebih redup dengan intensitas 800 lux dan pencahayaan terus menerus ). Pada akhir periode pengamatan, rata jumlah tunas, rata-rata jumlah akar
yang sudah mempunyai 3-4 helai media MS yang mengandung IBA untuk induksi perakaran. Setelah akar iaklimatisasi dengan cara ahkan planlet pada pot berisi media campuran ompos dan sekam bakar. Pot kemudian astik dan ditempatkan di tempat yang teduh. Setelah terbentuk daun baru, sungkup dibuka dan pot dipindahkan di rumah kaca.
HASIL DAN PEMBAHASAN
Pertumbuhan biji dan helai daun pada media MS mg/L BAP.
Biji dengan testa lengkap (Gambar 1 kiri) memerlukan waktu yang cukup lama untuk mulai berkecambah setelah 2 bulan ditanam pada media MS padat tanpa penambahan zat pengatur tumbuh, sedangkan biji yang telah dikupas maupun dibelah dapat mulai berkecambah setelah 1 bulan ditanam pada media yang sama. Setelah 2 bulan semua biji berkecambah dengan baik (Gambar 1 .). Biji yang telah berkecambah kemudian disubkultur pada media MS padat tanpa penambahan zat pengatur tumbuh. Pada saat pengamatan ahui bahwa biji Tacca bersifat poliembrioni, sehingga dari satu biji memiliki 2–3 embrio. Hasil dari perkecambahan disubkultur langsung pada media MS yang mengandung 0,5 mg/L BAP sehingga membentuk kalus berwarna putih
Gambar 1. Biji Tacca setelah sterilisasi ditanam pada media MS mengandung 0.5 mg/L
kalus putih setelah 2 bulan
Eksplan daun yang berasal dari rumah kaca mempunyai tingkat kontaminasi yang rendah, sehingga daun dari tanaman yang tumbuh di rumah kaca sangat baik untuk dijadikan sumber eksplan. Media terbaik untuk induksi tunas dari eksplan helai daun yang berasal dari hasil eksplorasi di Sukabumi adalah media MS dengan penambahan 0,5 dan 1,0 mg/L BAP. Pengamatan selanjutnya menunjukkan bahwa media MS yang mengandung BAP sebanyak 0,5 mg/L lebih responsif, sehingga media ini dipergunakan untuk menginduksi tunas dari dau Gambar 2 merupakan contoh pertumbuhan eksplan potongan helai daun pada media MS dengan penambahan 0,5 mg/L BAP pada umur 5 minggu.
Kalus berwarna putih kemudian secara rutin ditanam pada media MS yang mengandung 0,5 BAP. Hasil pengamatan menunjukka
organogenesis langsung pada bulan ke
subkultur. Kalus terbentuk pada beberapa eksplan pada bulan ke-1 dan berdiferensiasi membentuk tunas pada bulan ke-2. Rata-rata jumlah pembentukan tunas pada bulan ke-2 adalah 3,13 ± 2,028. Art
eksplan rata-rata membentuk 3 tunas pada bulan ke Jumlah tunas terbentuk yang teramati pada bulan ke berkisar antara 1-9 tunas per eksplan. Setelah berumur 8 minggu tunas terus berkembang membentuk tunas adventif dengan jumlah yang meningk
percobaan ini, kalus yang terbentuk dipindahkan pada media perlakuan kombinasi BAP dan 2,4
konsentrasi yang berbeda untuk mengetahui pertumbuhan dan perkembangannya.
Gambar 2. Eksplan daun Tacca ditanam pada media MS mengandung 0.5 membentuk kalus putih setelah 6 minggu
Pertumbuhan kalus pada media perlakuan
Hasil percobaan menunjukkan bahwa perkembangan eksplan kalus yang dikulturkan pada media MS yang mengandung
menghasilkan jumlah tunas yang paling banyak tunas), jika dibandingkan dengan eksplan yang ditumbuhkan pada media kultur lainnya yang hanya menghasilkan 0-2 tunas sampai 12 m
subkultur (Gambar 3.). Hal ini dikarenakan dalam proses pembentukan tunas terdapat
pengatur tumbuh eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman
auksin atau sitokinin ke dalam media kultur dapat meningkatkan konsentrasi zat pengatur tumbuh setelah sterilisasi ditanam pada mg/L BAP membentuk
Eksplan daun yang berasal dari rumah kaca mempunyai tingkat kontaminasi yang rendah, sehingga daun dari tanaman yang tumbuh di rumah kaca sangat baik untuk dijadikan sumber eksplan. Media terbaik untuk induksi tunas dari eksplan helai i hasil eksplorasi di Sukabumi adalah media MS dengan penambahan 0,5 dan 1,0 BAP. Pengamatan selanjutnya menunjukkan bahwa media MS yang mengandung BAP sebanyak lebih responsif, sehingga media ini dipergunakan untuk menginduksi tunas dari daun. merupakan contoh pertumbuhan eksplan potongan helai daun pada media MS dengan
BAP pada umur 5 minggu. Kalus berwarna putih kemudian secara rutin ditanam pada media MS yang mengandung 0,5 mg/L BAP. Hasil pengamatan menunjukkan bahwa terjadi organogenesis langsung pada bulan ke-2 setelah subkultur. Kalus terbentuk pada beberapa eksplan 1 dan berdiferensiasi membentuk tunas rata jumlah pembentukan tunas 2 adalah 3,13 ± 2,028. Artinya setiap rata membentuk 3 tunas pada bulan ke-2. Jumlah tunas terbentuk yang teramati pada bulan ke-2 9 tunas per eksplan. Setelah berumur 8 minggu tunas terus berkembang membentuk tunas adventif dengan jumlah yang meningkat. Dari hasil percobaan ini, kalus yang terbentuk dipindahkan pada perlakuan kombinasi BAP dan 2,4-D dengan konsentrasi yang berbeda untuk mengetahui pertumbuhan dan perkembangannya.
Tacca setelah sterilisasi
ditanam pada media MS mengandung 0.5 mg/L BAP membentuk kalus putih setelah 6 minggu
perlakuan
menunjukkan bahwa perkembangan eksplan kalus yang dikulturkan pada ng mengandung 0,1mg/L 2,4-D menghasilkan jumlah tunas yang paling banyak (5
, jika dibandingkan dengan eksplan yang ditumbuhkan pada media kultur lainnya yang hanya 2 tunas sampai 12 minggu setelah .). Hal ini dikarenakan dalam terdapat interaksi antara zat pengatur tumbuh eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman [14]. Penambahan dalam media kultur dapat meningkatkan konsentrasi zat pengatur tumbuh
endogen di dalam sel, sehingga tertentu menjadi faktor pemicu dan perkembangan jaringan
pembentukan tunas dapat dilakukan deng memanipulasi dosis auksin dan sitokinin eksogen
Gambar 3.Jumlah tunas Tacca umur 1-12 minggu setelah subkultur
Pemberian BAP dan 2,4
konsentrasi telah memberikan respon yang berbeda terhadap pertumbuhan kalus
dapat terlihat bahwa pengaruh yang ditimbulkan oleh BAP dan 2,4-D yaitu eksplan
tunas dan plantlet. Respon sel, jaringan dan organyang dikulturkan secara in vitro
maupun kalus dipengaruhi oleh kondisi kultur, genotip tanaman dan tipe eksplan[16]
Eksplan kalus Tacca
penambahan zat pengatur tumbuh 2,4 minggu tidak membentuk tunas
dapat membentuk bakal tunas (nodus) berkembang menjadi tunas
tunas pada umur 8 minggu dan 12 minggu. Tunas yang terbentuk merupakan tunas adventif kecil Eksplan yang membentuk
pembesaran, pemanjangan dan pencoklatan pada 12 Minggu (Gambar 4). Pada media MS mengandung0,1mg/L 2,4-D, eksplan menghasilkan 1 tunaspada umur 8 minggu dan
tunas pada umur 12 minggu. Tunas kecil dan kalus berkembang
remah pada umur 12 minggu
alam sel, sehingga pada konsentrasi menjadi faktor pemicu dalam proses tumbuh dan perkembangan jaringan tanaman. Untuk memacu pembentukan tunas dapat dilakukan dengan memanipulasi dosis auksin dan sitokinin eksogen [15].
Tacca pada kultur kalus mulai
12 minggu setelah subkultur
Pemberian BAP dan 2,4-D pada beberapa taraf konsentrasi telah memberikan respon yang berbeda terhadap pertumbuhan kalus Tacca. Secara visual pengaruh yang ditimbulkan oleh D yaitu eksplan dapat membentuk kalus, antlet. Respon sel, jaringan dan organyang
in vitro membentuk tunas, akar
dipengaruhi oleh kondisi kultur, genotip [16].
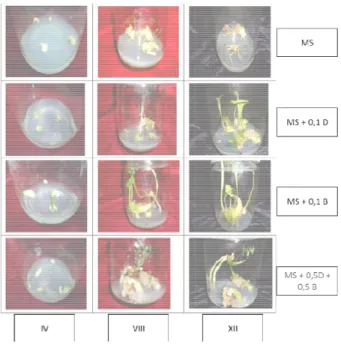
dalam media MS tanpa penambahan zat pengatur tumbuh 2,4-D pada umur 4 minggu tidak membentuk tunas atau kalus, akan tetapi dapat membentuk bakal tunas (nodus), kemudian berkembang menjadi tunas. Eksplan menghasilkan 2 tunas pada umur 8 minggu dan 12 minggu. Tunas yang terbentuk merupakan tunas adventif kecil. ksplan yang membentuk kalus mengalami pembesaran, pemanjangan dan pencoklatan pada 12 ). Pada media MS yang D, eksplan menghasilkan 1 tunaspada umur 8 minggu dan bertambah menjadi 5 tunas pada umur 12 minggu. Tunas masih berukuran berkembang menjadi 50% berstruktur remah pada umur 12 minggu (Gambar 4.).
Vol.2 hal-4
Gambar 4. Perkembangan eksplan kalus media MS (tanpa zat pengatur tumbuh) 0,1mg/L 2,4-D (0,1D), MS + 0,1
MS + 0,5mg/L 2,4-D + 0,5mg/L pada umur 4 (IV), 8 (VIII) dan 12
Eksplan kalus Taccapada mengandung 0,1mg/LBAPumur
tunas, kalus dan nodus. Eksplan menghasilkan rata 1,25 tunas pada umur 8 minggu
tunas pada umur 12 minggu. Eksplan kalus media MS yang mengandung kombinasi D dan 0,5mg/LBAPumur 4 menghasi kalus. Eksplan menghasilkan1 tunas pada minggu dan 1,25 tunas pada umur
4).
Pengaruh ZPT 2,4-D memberikan respon yang berbeda terhadap perkembangan kalus
Perkembangan tunas pada minggu ke MS yang mengandung 0,1mg/L
dibandingkan dalam media MS dengan penambahan konsentrasi 2,4-D yang lebih tinggi. Semakin tinggi konsentrasi 2,4-D maka semakin terhambat perkembangan tunas yang terbentuk
konsentrasi auksin 2,4-D semakin cepat perkembangan kalus atau akar yang
(Gambar 5.).
Seminar Nasional Kimia Terapan Indonesia 2013
Andri Fadillah Martin et al/Prosiding SNKTI (2013) Vol.2 hal . Perkembangan eksplan kalus Taccapada
(tanpa zat pengatur tumbuh), MS + , MS + 0,1mg/LBAP(0,1B) dan mg/LBAP (0,5D+0,5B) dan 12 (XII)minggu.
pada media MS yang 4 minggumembentuk . Eksplan menghasilkan
rata-minggu dan rata-rata 1,75 ksplan kalus Taccapada yang mengandung kombinasi 0,5mg/L
2,4-menghasilkan pembesaran . Eksplan menghasilkan1 tunas pada umur 8 umur 12 minggu(Gambar D memberikan respon yang berbeda terhadap perkembangan kalus Tacca.
Perkembangan tunas pada minggu ke-12 pada media mg/L 2,4-D lebih baik dibandingkan dalam media MS dengan penambahan tinggi. Semakin tinggi D maka semakin terhambat terbentuk. Semakin tinggi D semakin cepat perkembangan kalus atau akar yang terbentuk
Gambar 5. Perkembangan
media MS + 2,4-D dan MS + BAP pada umur 12 minggu.
Pengaruh BAP memberikan respon yang berbeda terhadap perkembangan kalus
jumlah tunas pada minggu ke mengandung 0,1mg/LBAP
dalam media MS dengan penambahan BAP konsentrasi lebih tinggi. Semakin tinggi konsentrasi sitokinin BAP semakin terhambat perkembangan jumlah tunas yang muncul. Hal ini
karena kalus Tacca mengandung sitokinin endogen yang cukup tinggi. Perbandingan s
lebih besar dapat memicu tunas, perbandingan sitokinin dan auksin berimbang dapat memicu kalus dan perbandingan sitokinin dan auksin lebih kecil dapat memicu perakaran. proses pembentukan organ seperti tunas atau akar ada interaksi anta pengatur tumbuh eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman
auksin ke dalam media kultur dapat meningkatkan konsentrasi zat pengatur tumbuh endogen
sel, sehingga menjadi faktor pemicu
tumbuh dan perkembangan jaringan. Untuk memacu pembentukan tunas dapat dilakukan dengan memanipulasi dosis auksin dan sitokinin eksogen
Pertumbuhan tunas pada perlakuan intensitas cahaya dan fotoperiode
Kondisi lingkungan yaitu lamanya penggunaan penerangan (fotoperiode) dan besarnya intensitas cahaya diaplikasikan pada kultur tunas
mengetahui pertumbuhan tunas pada kondisi
yang berbeda. Diharapkan dengan perlakuan ini diperoleh ketegaran tunas yang baik sehingga memudahkan aklimatisasi dan meningka
hidup setelah aklimatisasi. Kondisi yang dicobakan adalah fotoperiode selama 16 jam terang dan penyinaran secara kontinyu. Intensitas cahaya yang digunakan adalah terang (1000
(500-800 lux). Pada penyinaran fotoperiode 16 jam terang hanya digunakan intensitas cahaya tinggi yaitu 100-1400 lux. Tabel 2 merupakan pertumbuhan tunas setelah 8 minggu pada m
pencahayaan yang berbeda. Tabel 2 menunj bahwa dengan kondisi fotoperiod
sangat berpengaruh terhadap pertumbuhan tunas Tacca.R
lebih tinggi dibandingkan dengan
tunas pada perlakuan B (pencahayaan kontinyu dengan 1000-1400 lux) dan C (pencahayaan kontinyu dengan 500-800 lux). Dari hasil penelitian ini dapat diketahui bahwa untuk pembentukan tunas majemuk,
Tacca memerlukan fotoperiode 16 jam terang.
Gambar 6 merupakan contoh planlet yang membentuk tunas majemuk pada fotoperi
Nasional Kimia Terapan Indonesia 2013
Solo, 23 Mei 2013
/Prosiding SNKTI (2013) Vol.2 hal-1-7 . Perkembangan eksplan kalus Taccapada D dan MS + BAP pada umur 12
Pengaruh BAP memberikan respon yang berbeda terhadap perkembangan kalus tacca. Perkembangan jumlah tunas pada minggu ke-12 pada media MS yang lebih baik dibandingkan MS dengan penambahan BAP konsentrasi lebih tinggi. Semakin tinggi konsentrasi sitokinin BAP semakin terhambat perkembangan jumlah tunas yang muncul. Hal ini mungkin terjadi mengandung sitokinin endogen yang cukup tinggi. Perbandingan sitokinin dan auksin lebih besar dapat memicu tunas, perbandingan sitokinin dan auksin berimbang dapat memicu kalus dan perbandingan sitokinin dan auksin lebih kecil dapat memicu perakaran. proses pembentukan organ seperti tunas atau akar ada interaksi antara zat pengatur tumbuh eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman[14].Penambahan auksin ke dalam media kultur dapat meningkatkan konsentrasi zat pengatur tumbuh endogen di dalam ingga menjadi faktor pemicu dalam proses tumbuh dan perkembangan jaringan. Untuk memacu pembentukan tunas dapat dilakukan dengan memanipulasi dosis auksin dan sitokinin eksogen[15].
Pertumbuhan tunas pada perlakuan intensitas cahaya
Kondisi lingkungan yaitu lamanya penggunaan penerangan (fotoperiode) dan besarnya intensitas cahaya diaplikasikan pada kultur tunas Tacca untuk mengetahui pertumbuhan tunas pada kondisi in vitro yang berbeda. Diharapkan dengan perlakuan ini aran tunas yang baik sehingga memudahkan aklimatisasi dan meningkatkan daya hidup setelah aklimatisasi. Kondisi yang dicobakan adalah fotoperiode selama 16 jam terang dan penyinaran secara kontinyu. Intensitas cahaya yang digunakan adalah terang (1000-1400 lux) atau redup 800 lux). Pada penyinaran fotoperiode 16 jam terang hanya digunakan intensitas cahaya tinggi yaitu 1400 lux. Tabel 2 merupakan pertumbuhan tunas setelah 8 minggu pada media MS pada kondisi cahayaan yang berbeda. Tabel 2 menunjukkan bahwa dengan kondisi fotoperiode 16 jam terang sangat berpengaruh terhadap peningkatan Rata-rata jumlah tunas jauh lebih tinggi dibandingkan dengan rata-rata jumlah tunas pada perlakuan B (pencahayaan kontinyu lux) dan C (pencahayaan kontinyu . Dari hasil penelitian ini dapat diketahui bahwa untuk pembentukan tunas majemuk, memerlukan fotoperiode 16 jam terang. Gambar 6 merupakan contoh planlet yang membentuk tunas majemuk pada fotoperiode 16 jam terang.
Tabel 2. Pertumbuhan tunas setelah 8 minggu ditanam pada media MS pada kondisi pencahayaan berbeda Lingkungan tumbuh Jumlah tunas Tinggi (cm) Jumlah akar A (16 jam terang, 1000-1400 lux) 7,44 3,33 3,00 B (cahaya kontinyu, 1000-1400 lux) 3,00 3,70 2,92 C (cahaya kontinyu, 500-800 lux) 2,32 4,16 2,93
Hasil penelitian menunjukkan bahwa pertumbuhan dan perkembangan tunas Tacca dapat ditingkatkan dengan perlakuan intensitas cahaya dan fotoperiode. (Gambar 6 merupakan contoh pertumbuhan tunas
Tacca yang memperlihatkan ketegaran tunas pada
intensitas cahaya 1000-1400 lux dan 16 jam terang. Intensitas cahaya dan fotoperiode mempengaruhi perkembangan eksplan yang ditumbuhkan secara in
vitro.Faktor lingkungan in vitro berpengaruh terhadap
perkembangan tunas majemuk maupun peningkatan fase pertumbuhan lain pada tanaman baik yang ditumbuhkan secara in vitro maupun di lingkungan ex
vitro. Pengaturan intensitas cahaya dan fotoperiode
juga meningkatkan perkembangan dan pertumbuhan tanamanHippeastrum johnsonii[17]. Pada tanaman kentang, fotoperiode mempengaruhi terbentuknya umbi mikro[18].Fotoperiode selama 12 jam juga berperan meningkatkan daya tumbuh strawberi yang telah disimpan sampai dengan 12 dan 19 bulan[19]. Dikombinasikan dengan ukuran botol kultur dan suhu, pengaturan fotoperiode dapat meningkatkan produksi tunas majemuk pada tanaman Huernia hystrix [20].
Gambar 6. Planlet Tacca setelah 8 minggu tumbuh pada media MS dengan kondisi 16 jam terang, 1000-1400 lux.
Perakaran dan aklimatisasi
Perakaran pada Tacca secara in vitro dapat diinduksi pada media MS dengan penambahan auksin 0,5 mg/L IBA. Pada media ini, akar mulai terbentuk setelah 2-3 minggu kemudian akar memanjang dan lebih banyak akar mulai muncul. Setelah 5-6 minggu pada media perakaran, planlet diap diaklimatisasi. Pada media MS padat tanpa penambahan auksin, tunas dapat pula membentuk akar, namun diperlukan waktu
yang lebih lama. Penambahan auksin IBA biasa dilakukan untuk mempercepat perakaran. Pada Tacca dengan IBA sebanyak 0,5 mg/L telah berhasil menstimulasi pembentukan akar. Auksin IBA juga efektif untuk induksi perakaran pada Madhuca
latifolia[21]. Pada Gladiolus grandiflorus,
penambahan NAA atau IBA juga efektif untuk perakaran[22]. Beberapa upaya lain dapat dicoba untuk meningkatkan perakaran. Peningkatan perakaran juga dapat dilakukan menggunakan media MS dengan setengah konsentrasi hara makronya seperti pada tanaman Rosa damacena[23], bahkan konsentrasi hara makro dapat dikurangi menjadi hanya seperempat konsentrasi normalnya seperti pada tanaman Rosa hybrida[24].
Setelah terbentuk beberapa helai akar, planlet
Tacca siap diaklimatisasi. Persentase hidup tanaman
ini cukup tinggi yaitu lebih dari 80%. Planlet tumbuh segara pada saat awal aklimatisasi hingga membentuk beberapa helai daun baru. Setelah 2 bulan, satu per satu helai daun menguning kemudian bibit tanaman mulai memasuki masa dormansi. Pada saat ini umbi kecil sudah mulai terbentuk. Setelah dibiarkan beberapa lama, umbi berkecambah lagi membentuk tunas daun, dan siap dipindahkan di lapangan. Gambar 7 adalah contoh beberapa tanaman yang telah berhasil tumbuh di rumah kaca sebelum mengalami dormansi membentuk umbi kecil.
Gambar 7. Tanaman Tacca setelah 2 bulan aklimatisasi sebelum mengalami masa dormansi 4. KESIMPULAN
Dari eksplan biji Tacca leontopetaloides dapat dikecambahkan secara in vitro kemudian diperbanyak untuk membentuk tunas kemudian planlet. Eksplan helai daun dapat membentuk kalus berwarna putih yang selanjutnya dapat diregenerasikan membentuk tunas. Kalus yang terbentuk dapat berkembang menjadi tunas pada media yang mengandung 0,5 mg/L BAP. Fotoperiode dan intensitas cahaya yang tepat dapat meningkatkan produksi tunas adventif. Penambahan IBA dapat menstimulasi perakaran. Planlet berhasil diaklimatisasi di rumah kaca.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih kepada Lutvinda Ismanjani atas bantuannya dalam pemeliharaan kultur Tacca leontopetaloides.
Penelitian ini merupakan bagian dari program prioritas nasional LIPI dengan judul “Penyediaan bibit unggul tanaman Tacca leontopetaloides secara in vitro untuk pengembangan pangan alternatif “.
Vol.2 hal-6
Seminar Nasional Kimia Terapan Indonesia 2013
Solo, 23 Mei 2013
Andri Fadillah Martin et al/Prosiding SNKTI (2013) Vol.2 hal-1-7 DAFTAR REFERENSI
[1] RL. Caddick, P. Wilkin, PJ. Rudall, AJ. Hedderson, MW. Chase, “Yams reclassified: A recircumscription of Dioscoreaceae and
Dioscoreales”, Taxon, vol. 51, 2002, pp. 103-114.
[2] United States Department of Agriculture, National
Plant Database,2012.
http://plants.usda.gov/java/ClassificationServlet?sour ce=profile&symbol=TALE2&display=31,
[3] ST. Ubwa, BA. Anhwange, JT. Chia, “Chemical Analysis of Tacca leontopetaloides Peels”, American Journal of Food Technology, vol. 6, no. 10, 2011, pp. 932-938.
[4] Original : Root Crops 15,
http://www.appropedia.org/Original:Root_Crops_15,
2010 [accessed 6th August 2010].
[5] OO. Kunle, YE. Ibrahim, MO. Emeje, S. Shaba, Y. Kunle, “Extraction, Physicochemical and Compation Properties of Tacca Starch – a Potential Pharmaceutical Excipient”,Starch/Starke, vol. 55, 2003,pp. 319-325.
[6] UJ. Ukpabi, E. Ukenye, AO. Olojede, “Raw-Material Potentials of Nigerian Wild Polynesian Arrowroot (Tacca leontopetaloides) Tubers and Starch”,Journal of Food Technology, vol. 7, no. 4, 2009,pp. 135-138.
[7] A. Yokosuka, Y. Mimaki, Y. Sashida,“Spirostanol saponins from rhizomes of Tacca chantrieri and theri cytotoxic activity”,Phytochemistry, vol. 61, 2002, pp. 73-78.
[8] AL. Risinger, SL. Mooberry, “Taccalonolides: Novel microtubule stabilizers with clinical potential”,Cancer Letter, vol. 291, 2010, pp. 14-19. [9] A. Muhlbauer, S. Seip, “Five Novel Taccalonolides from the Roots of the Vietnamese Plant Tacca paxiana”,Helvetica Chimica Acta, vol. 86, 2003, pp. 2065-2072.
[10 ] Lei I, Wei Ni, Xing-Rao Li, Yan Hua, Ping-Lei Fang, Ling-Mei Kong, Li-Li Pan, Yan Li, Chan-Xiang Chen, Hai-Yang Liu, “Taccasubosides A-D, four new steroidal glycosides from Tacca subflabellata”,Steroids, 2011, (to be published)
[11] R. Charoensub, D. Thiantong, S. Phansiri,“Micropropagation of Bat Flower Plant”,Kasetsart J. (Nat. Sci.), vol. 42, 2008, pp. 7-12. [12] TI. Borokini, EF. Lawyer, AE. Ayodele, “In vitro propagation of Tacca leontopetaloides (L.) Kuntze in
Nigeria”,Egyptian Journal of Biology, vol. 13, 2011, pp. 51-56.
[13] T. Murashige, F. Skoog, “A revised medium for rapid growth and bioassays with tobacco tissue cultures”,Physiol. Plant., vol. 15, 1962, pp. 473-497. [14] L. Winata, “Teknik Kultur Jaringan”, PAU
Bogor, l987.
[15]P. Poonsapaya, MW. Nabors, W. Kersi, M.Vajrabhaya,“A comparison of methods for callus culture and plant regeneration of RD 25 rice (Oryza
sativa L.) in vitro laboratories”,Plant Cell, Tissue and Organ Culture,vol. 16, l989, pp.175-186.
[16]Gunawan. “Teknik Kultur Jaringan Tanaman”. Laboratorium Kultur Jaringan Tanaman, Pusat Antar Universitas Bioteknologi-IPB. Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan dan Kebudayaan. Bogor. 1992
[17]S. Zakizadeh, B. Kaviani and R. Onsinejad, “Role of photoperiod on some growth characters of Amaryllis (Hippeastrum johnsonii), a Bulbous plant”,
European Journal of Experimental Biology,vol. 3, no.
1, 2013, pp. 289-291.
[18]RA. Ghavidel, AR. Bolandi, H. Hamidi,S. Foroghian, “Effects of plant growth regulators and photoperiod on in vitro microtuberization of potato (Solanum tuberosum L.)”,African Journal of Biotechnology, vol.11, no. 53, 2012, pp. 11585-11590.
[19]BM. Reed, “Photoperiod improves longterm survival of in vitro-stored strawberry plantlets”,
HortScience, no. 37, 2002, pp. 811-814.
[20]SO. Omoo, JF. Finnie, J. van Staden, “Effects of temparatures, photoperiod and culture vessel size on adventitious sgoot production of in vitro propagated Huernia hystrix”, Plant Cell, Tissue and Organ
Culture, vol. 99, 2009, pp. 233-238.
[21] YK. Bansaland,T. Chibbar, “Micropropagation of
Madhuca latifolia Macb. trough nodal culture”, Plant Biotechnol, vol. 17, 2000, pp. 17-20.
[22] I. Priyakumari, VL.Sheela, “Micropropagation of gladiolus cv. ‘Peach Blossom’ through enhanced release of axillary buds”,J Trop Agric, vol. 43, 2005, pp. 47-50.
[23] A. Nikbakht, M. Kafi, M. Mirmasoumi, M. Babalar, “Micropropagation of Damask Rose (Rosa
damascena Mill.) cvs. Azaran and Ghamsar”, Intl J Agric Biol, vol. 7, 2005, pp. 535-538.
[24] N.Nak-Udom, K. Kanchanapoom, K. Kanchanapoom,“Micropropagation from cultured
nodal explants of rose (Rosa hybrida L. cv. ‘Perfume Delight’)”, Songklanakarin J. Sci. Technol, vol. 31,
2009, pp. 583-586.