Laporan PPDH
Koasistensi Diagnostik Laboratorik Gelombang IV Group N
STUDI KASUS
COLIBASILLOSIS PADA BABI LANDRACE (Nomor Protokol 304/N/10)
Oleh :
Johan Josias Manery 0409005033
PENDIDIKAN PROFESI DOKTER HEWAN FAKULTAS KEDOKTERAN HEWAN
UNIVERSITAS UDAYANA DENPASAR
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa atas berkat, rahmat dan karunia-Nya yang telah dilimpahkan sehingga penyususunan laporan koasistensi diagnostik laboratorik yang berjudul “COLIBASILLOSIS PADA BABI LANDRACE” dapat terselesaikan.
Laporan ini disusun sebagai salah satu prasyarat kelulusan bagi mahasiswa yang melaksanakan koasistensi diagnostik laboratorik di Fakultas Kedokteran Hewan Universitas Udayana. Pada kesempatan ini penyusun tidak lupa mengucapkan terima kasih kepada :
1. Drh. I.B. Oka Winaya, M. Kes sebagai Kepala Laboratorium Patologi Veteriner Fakultas Kedoteran Hewan Universitas Udayana.
2. Drh. Ketut Tono PG, M. Kes sebagai Kepala Laboratorium Mikrobiologi Veteriner Fakultas Kedoteran Hewan Universitas Udayana.
3. Drh. Ida Bagus Made Oka, M. Kes sebagai Kepala Laboratorium Parasitologi Veteriner Fakultas Kedoteran Hewan Universitas Udayana. 4. Dr. Drh. I.G. N. Kadek Mahardika sebagai Kepala UPT Laboratorium
Biomedik Fakultas Kedoteran Hewan Universitas Udayana.
5. Drh. I.B. Kadek Suardana, M. Kes sebagai Kepala Laboratorium Virologi Veteriner Fakultas Kedoteran Hewan Universitas Udayana.
6. Dr. Drh. I. B. K. Ardana, M. Kes sebagai Kepala Laboratorium Patologi Klinik Veteriner Fakultas Kedoteran Hewan Universitas Udayana.
Penyusun menyadari bahwa laporan ini masih jauh dari sempurna, untuk itu saran dan kritik sangat diharapkan guna menyempurnakan laporan ini.
Denpasar, September 2010
DAFTAR ISI KATA PENGANTAR ... i DAFTAR ISI ... ii BAB I PENDAHULUAN ... 1 1.1 Riwayat Kasus ... 1 1.2 Tujuan Penulisan ... 1 1.3 Manfaat Penulisan ... 2
BAB II MATERI DAN METODA ... 3
2.1 Materi ... 3
2.1.1 Laboratorium Patologi Veteriner ... 3
2.1.2 Laboratorium Mikrobilogi Veteriner ... 3
2.1.3 Laboratorium Parasitologi Veteriner ... 3
2.1 Metoda ... 3
2.1.1 Laboratorium Patologi Veteriner ... 3
2.1.2 Laboratorium Mikrobilogi Veteriner ... 4
2.1.3 Laboratorium Parasitologi Veteriner ... 7
2.1.4 Laboratorium Virologi Veteriner ... 8
BAB III HASIL ... 11
3.1 Hasil Pemeriksaan Laboratorium Patologi Veteriner ... 11
3.2 Hasil Pemeriksaan Histopatologi ... 11
3.3 Hasil Pemeriksaan Laboratorium Mikrobiologi Veteriner ... 12
3.4 Hasil Pemeriksaan Laboratorium Parasitologi Veteriner ... 12
3.5 Hasil Pemeriksaan Laboratorium Virologi Veteriner ... 13
BAB IV PEMBAHASAN ... 14
4.1 Epidemologi ... 14
4.2.Gejala Klinis dan Perubahan Patologi Anatomi ... 14
4.3 Diagnosa Sementara... 14
4.4 Diagnosa Banding ... 14
4.5 Pemeriksaan Laboratorium ... 15
4.5.2 Pemeriksaan Laboratorium Parasitologi Veteriner ... 15
4.5.3 Pemeriksaan Laboratorium Mikrobiologi Veteriner ... 15
4.6 Colibasillosis ... 17
4.7 Escherichia coli ... 17
BAB V SIMPULAN DAN SARAN ... 20
5.1 Simpulan ... 20
5.2 Saran ... 20
DAFTAR PUSTAKA LAMPIRAN
BAB I PENDAHULUAN
1.1. Riwayat Kasus
Pemeriksaan babi landrace dengan nomor protokol 304/N/10 yang berasal dari Jln. Tukad Kresek Kecamatan Denpasar Kabupaten Badung telah dilaksanakan pada tanggal 26 juli 2010. Peternakan ini milik Bapak Teji dengan jumlah ternak babi sebanyak 230 ekor yang terdiri dari 200 ekor babi dewasa dan 30 ekor anak babi. Dari 30 ekor anak babi terdapat 5 ekor anak babi yang sakit dan telah dikarantina. Anak babi yang sakit telah mendapatkan pengobatan dari petugas setempat.
Sistem pemeliharaan secara intensif, terlihat lantai kandang jarang dibersihkan dan lantai kandang berlubang-lubang sehingga banyak terdapat genangan air. Pakan yang diberikan adalah sisah makanan dan air minum berasal dari sumur didekat kandang. Ternak telah mendapatkan vaksin.
Berat badan babi yang dinekropsi adalah ± 10 kg, gejala yang terlihat adalah Diare, kaheksia dan anoreksia. Menurut pemilik, babi telah mengalami sakit selama 2 minggu dan telah mendapatkan pengobatan sebanyak satu kali.
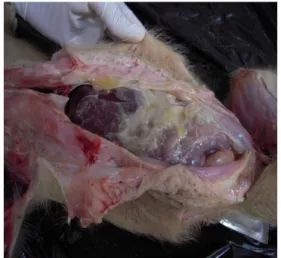
Perubahan patologi anatomi yang menciri adalah terlihat adanya fibrin yang melapisi hampir semua organ-organ abdomen dan thorak, adanya akumulasi cairan pada rongga abdomen, nekrosis pada organ paru-paru dan pendarahan pada organ otak.
Untuk mendukung hasil diagnosa kasus ini, telah dilakukan pemeriksaan darah, pemeriksaaan apusan darah, penanaman sample organ pada Media Blood Agar, MacConkey, dan dilanjutkan dengan uji biokimia dan uji gula-gula. Selain itu juga dilakukan pemeriksaan histopatologi pada organ yang mengalami perubahan.
1.2. Tujuan Penulisan
1. Pelaporan kasus penyakit pada hewan dan pemeriksaan sampel di laboratorium.
2. Menentukan diagnosa penyakit pada babi landrace dengan nomor protokol 304/N/10.
3. Mengetahui agen infeksius yang menyerang babi landrace dengan nomor protokol 304/N/10.
1.3. Manfaat Penulisan
1. Memberikan informasi mengenai kejadian kasus penyakit pada babi landrace dengan nomor protokol 304/N/10 sehingga dengan mengetahui penyebab penyakit diharapakan peternak dapat memberikan pengobatan yang tepat dan pencegahan terhadap penyakit colibasillosis.
2. Memberikan gambaran secara lengkap kepada mahasiswa PPDH mengenai metode diagnosa yang digunakan untuk menentukan kejadian suatu penyakit pada hewan.
BAB II
MATERI DAN METODE
2.1. Materi
2.1.1. Laboratorium Patologi Veteriner
Spesimen yang digunakan dalam pemeriksaan histopatologi diambil dari organ yang mengalami perubahan secara makroskopis maupun organ yang diduga mengalami perubahan berdasarkan gejala klinis. Organ yang diambil untuk pemeriksaan histopatologi adalah otak, paru-paru, jantung, hati, limpa, ginjal dan usus.
2.1.3. Laboratorium Mikrobiologi Veteriner
Spesimen yang digunakan dalam pemeriksaan bakteri adalah Paru-paru dan usus.
2.1.4. Laboratorium Parasitologi Veteriner
Spesimen yang digunakan dalam pemeriksaan parasit berupa feses. Selain itu untuk mengetahui kemungkinan adanya protozoa darah maka dilakukan pemeriksaan ulas darah tipis.
2.2. Metode
2.2.1. Laboratorium Patologi Veteriner
Materi : organ yang mengalami perubahan secara makroskopis. Metode : pembuatan dan pemeriksaan preparat histopatologi. Cara kerja :
1. Sampel organ yang akan diperiksa dipotong dengan ukuran 1x1x1 cm, kemudian direndam dalam larutan neutral buffer formalin (NBF).
2. Sampel organ selanjutnya diperkecil lagi dengan irisan tipis untuk disimpan dalam tissue cassette dan dilakukan fiksasi dalam larutan NBF.
3. Setelah fiksasi, dilakukan proses dehidrasi dan clearing dengan satu sesi larutan yang terdiri dari: alkohol 70 %, alkohol 80 %, alkohol 90 %, alkohol 96 %, alkohol absolut, toluene, dan parafin, secara bertahap dalam waktu satu hari.
4. Sampel organ di blocking dengan embedding set yang dituangi parafin cair kemudian didinginkan.
5. Blok yang sudah dingin di sectioning menggunakan microtome dengan ketebalan ± 4 – 5 mikron.
6. Proses yang terakhir adalah pewarnaan dengan metode Harris Hematoxylin – Eosin dan mounting media.
7. Preparat histopatologi diamati di bawah mikroskop dan dicatat perubahan mikroskopik yang ditemukan.
2.2.2 Laboratorium Mikrobiologi Veteriner
Materi : organ yang mengalami perubahan makroskopis berupa paru-paru dan usus.
Metode : isolasi bakteri pada media umum Sheeo Blood Agar (SBA) dan media selektif MacConkey Agar (MCA), serta identifikasi bakteri dengan pengamatan pertumbuhan koloni pada media, pewarnaan Gram, uji katalase, uji oksidase, uji biokimia dengan penanaman pada media Triple Sugar Iron Agar (TSIA), Sulfite Indol Motility (SIM), Simmon Citrate Agar, Methyl Red Voges Proskauer (MRVP) Medium, dan uji gula-gula dengan penanaman pada media yang mengandung laktosa dan glukosa.
Cara kerja :
1. Penanaman pada Media Sheep Blood Agar (SBA)
Media yang digunakan untuk penanaman adalah Sheep Blood Agar (SBA). Media dibagi menjadi dua bagian karena ada dua spesimen yang akan ditanam. Spesimen organ dilukai atau dikoyak dengan gunting steril, kemudian menggunakan ossa cairannya diambil dan diusapkan pada media biakan secara berturut-turut dengan menggunakan metode multiple line. Media biakan yang sudah dipupuk kemudian diinkubasikan dalam inkubator dengan suhu 37 °C selama 18-24 jam. Pertumbuhan koloni pada media diamati secara makroskopis untuk melihat bentuk, warna, elevasi, tepian dan diameter koloni.
2. Pewarnaan Gram
Koloni pada media biakan diambil dengan ossa steril dan dioleskan pada obyek glass kemudian difiksasi. Olesan tersebut ditetesi dengan larutan Crystal Violet dan didiamkan selama 2 menit kemudian dicuci dengan air mengalir. Tahap selanjutnya ditetesi dengan Iodine dan didiamkan selama 2 menit lalu dicuci dengan air mengalir. Setelah itu ditetesi alkohol 96% selama 30 detik dan dicuci dengan air mengalir. Tahap yang terakhir adalah pewarnaan menggunakan Safranin dengan cara diteteskan dan didiamkan selama 30 detik kemudian dicuci dengan air mengalir. Setelah kering teteskan minyak emersi secukupnya lalu diperiksa di bawah mikroskop dengan pembesaran 100X. Bakteri gram positif akan berwarna ungu karena menyerap zat warna Crystal Violet sedangkan bakteri gram negatif akan berwarna merah karena menyerap zat warna Safranin.
3. Penanaman Pada Media MacConkey Agar (MCA)
Cara penanaman sama dengan penanaman pada media Sheep Blood Agar. 4. Uji Katalase
Koloni pada media diambil dengan ossa steril dan dioleskan pada obyek glass dan ditetesi dengan larutan H2O2 10 % kemudian homogenkan. Tahap selanjutnya amati ada atau tidaknya gelembung gas yang terbentuk.
5. Uji Oksidase
Uji oksidase dilakukan dengan cara mencelupkan ujung stick oksidase pada aquades kemudian ujung stick tersebut disentuhkan pada koloni kuman dan diamati perubahan warna yang terjadi. Hasil positif ditandai dengan perubahan warna stick oksidase menjadi ungu.
6. Pengujian pada Media TSIA, SIM, Simmon Citrat dan MRVP
Penanaman kuman pada media Triple Sugar Iron Agar (TSIA) untuk mengetahui adanya tidaknya fermentasi karbohidrat, produksi H2S dan gelembung gas. Koloni kuman diambil dengan ossa steril kemudian ditusukkan pada bagian tegak dari medium lalu digoreskan pada bagian miring medium, selanjutnya medium tersebut diinkubasikan pada suhu 37ºC selama 24 jam. Fermentasi karbohidrat ditandai adanya perubahan warna pada media TSIA dari merah menjadi kuning. Produksi H2S ditandai dengan perubahan warna media menjadi hitam. Adanya gas dapat diamati dengan adanya gelembung gas dan keretakan pada media.
Penanaman pada media Sulfite indol Motility (SIM) untuk mengetahui sifat kuman dalam memproduksi H2S, indol dan pergerakan kuman. Koloni kuman diambil dengan menggunakan ossa steril kemudian ditusuk secara tegak lurus pada medium dan diinkubasikan pada suhu 37ºC selama 24 jam. Produksi H2S ditandai dengan media berwarna hitam, produksi indol dapat dilihat setalah ditetesi dengan reagen Erlich/Kovac’s sebanyak 3-5 tetes ke dalam media, bila indol positif akan terbentuk cincin merah pada permukaan medium dan kuman motil akan terlihat kekaburan media di tempat tusukan ossa.
Penanaman pada media Methyl Red Voges Proskauer (MRVP) untuk mengetahui sifat kuman dalam memproduksi asam tunggal atau campuran dan asam metal karinol. Koloni diambil dengan ossa steril kemudian dicelupkan ke dalam media tersebut selanjutnya media diinkubasikan pada suhu 37ºC selama 24 jam. Kemudian media tersebut di bagi ke dalam dua tabung yang steril. Tabung pertama ditetesi dengan reagen MR dan tabung kedua ditetesi dengan reagen VP. Hasil positif ditandai dengan adanya warna merah pada medium.
Penanaman pada media Simmon Citrat Agar (SCA) untuk mengetahui sifat kuman dalam menggunakan sitrat sebagai sumber karbon atau tidak. Koloni kuman diambil dengan ossa steril kemudian diusapkan pada permukaan medium mulai dari pangkal sampai ke ujung yang sama. Medium kemudian diinkubasikan pada suhu 37ºC selama 24 jam. Hasil positif ditandai dengan perubahan warna menjadi biru.
Setiap identifikasi pada media dicatat sifat pertumbuhan bakteri dan dicocokkan dengan tabel identifikasi yang ada.
7. Uji Gula-gula
Uji gula-gula meliputi uji glukosa dan uji laktosa. Uji ini dilakukan untuk mengetahui adanya fermentasi gula. Koloni pada media biakan diambil dengan ossa steril. Kemudian dicelupkan pada masing-masing media tersebut yang berbentuk cair dan di dasar tabung terdapat tabung durham. Media diinkubasikan dengan suhu 37 °C selama 24 jam. Selain itu dapat diamati adanya produksi gas dengan adanya gas di dalam tabung Durham.
2.2.3. Laboratorium Parasitologi Veteriner Materi : feses dan ulas darah tipis.
Metode : pemeriksaan feses dengan metode natif, pengapungan, dan sedimentasi, dan pemeriksaan ulas darah tipis dengan pewarnaan Giemza.
Cara kerja :
1. Pemeriksaan feses dengan metode natif dilakukan dengan cara: feses sebesar pentolan korek api diambil dan diletakkan di atas kaca obyek. Ditambahkan air dan diaduk sampai homogen. Serat kasar dibuang, kemudian kaca obyek ditutup dengan cover dan diperiksa di bawah mikroskop untuk menemukan telur cacing dan melakukan identifikasi.
2. Pemeriksaan feses dengan metode pengapungan dilakukan dengan cara: feses ± sebesar biji kemiri dicampur dengan air sampai konsentrasi 10 %, dan diaduk hingga homogen. Campuran disaring dan cairannya ditampung dengan tabung centrifuge sampai skala 10. Selanjutnya cairan tersebut dicentrifuge dengan kecepatan 1500 rpm selama 3 menit. Supernatan dibuang dan endapan ditambah larutan garam jenuh (NaCl jenuh) sampai skala 10. Kemudian campuran diaduk hingga homogen dan dicentrifuge kembali dengan kecepatan 1500 rpm selama 3 menit. Kemudian ditambahkan lagi larutan NaCl jenuh setetes demi setetes hingga permukaan cairan cembung. Setelah didiamkan selama 2 menit, cover disentuhkan pada permukaan cairan pengapung dan langsung ditempelkan pada kaca obyek. Diamati di bawah mikroskop untuk menemukan telur cacing dan melakukan identifikasi.
3. Pemeriksaan telur cacing dengan metode sedimentasi ; feses sebesar biji kemiri dimasukan kedalam gelas beker dan tambahkan aquades agar konsentrasinya kira-kira 10% kemudian aduk sampai homogen. Saring dengan menggunakna saringan the untuk menyingkirkan bagian yang besar, masukan kedalam tabung sentrifuge dengan kecepatan 1.500 rpm selam 2-3 menit. Tabung sentrifuge di keluakan dari centrifugator, supernatannya di buang sedangkan sediment yang tertinggal didasar tabung diaduk kemudian buat preparat seperti pada pemeriksaan langsung dan lakukan pemeriksaan di bawah mikroskop dengan pembesaran objektif 10 X. Adapun prinsip dari metode ini adalah dengan
menggunakan cairan dengan berat jenis (BJ) yang lebih rendah dari berat jenis telur cacing akan mengendap. Metode ini biasa digunakan untuk cacing kelas trematoda.
4. Pemeriksaan parasit cacing dengan metoda permanen dilakukan dengan cara : cacing diletakkan pada kaca obyek dan diamati di bawah mikroskop stereo untuk memperbaiki posisinya agar bagian yang menjadi cirri khas dapat terlihat. Setelah diperoleh posisi yang baik, cacing dijepit dengan kaca obyek yang lain lalu diikat dengan karet gelang. Proses berikutnya adalah perendaman dalam alkohol 70 % selama 24 jam. Untuk cacing nematoda dan trematoda dilakukan pewarnaan dengan ditetesi zat warna Eosin. Perendaman dilanjutkan dengan alkohol 70 %, 80 %, 90 %, dan 95 % masing-masing selama 30 menit. Setelah dikeringkan, preparat ditetesi minyak kayu putih dan dibiarkan selama 30 menit. Langkah terakhir adalah merekatkan cacing pada kaca obyek menggunakan Canada balsam. Preparat dapat diamati di bawah mikroskop untuk identifikasi cacing.
5. Pemeriksaan ulas darah tipis dilakukan dengan cara: ulas darah yang telah diwarnai dengan Giemza diamati di bawah mikroskop untuk identifikasi adanya protozoa darah.
2.2.5. Laboratorium Virologi Veteriner
Materi : otak, paru-paru, trakea, ginjal, usus, jantung dan hati
Metode : pembuatan inokulum dari spesimen organ, isolasi RNA, uji RT-PCR dan uji HA-HI.
Cara kerja :
a. Penyiapan inokulum
Spesimen berupa organ dipotong menjadi bagian lebih kecil dan digerus dengan mikropastel sambil ditambahkan larutan phospate buffered saline (PBS) sedikit demi sedikit hingga diperoleh konsentrasi 10 %. Kemudian suspensi disentrifuge dengan kecepatan 15000 rpm selama 10 menit. Supernatan diambil sebanyak 400 μl dan dimasukkan kedalam eppendorf baru, lalu ditambahkan
b. Isolasi RNA Trizol
RNA virus diisolasi dari membran korioalantois. Sampel digerus dalam eppendorf dengan tujuan menghancurkan sel sehingga virus yang merupakan mikroba obligat intraseluler dapat dikeluarkan. Hasil gerusan tersebut ditambah dengan 1000 μl PBS untuk mengencerkannya lalu disentrifuge dengan kecepatan 15000 rpm selama 10 menit. Supernatan dipisahkan kedalam tabung eppendorf, selanjutnya diproses untuk isolasi RNA.
Sebanyak 750 μl cairan spesimen diambil dengan menggunakan mikropipet dan ditampung dalam tabung eppendorf steril. Spesimen ditambahkan 250 μl Trizol Ls Reagent, lalu diaduk dengan vortex selama 1 menit dan diinkubasikan pada suhu kamar selama 5 menit. Kemudian ditambahkan 200 μl Chloroform, vortex selama 15 detik dan inkubasikan pada suhu kamar selama 15 menit. Sentrifugasi dengan kecepatan 12000 rcf selama 15 menit. Bagian aquaeus dipisahkan ketabung eppendorf steril dan ditambahkan Isopropil alkohol 500 μl dan homogenkan. Kemudian inkubasikan pada suhu kamar selama 10 menit. Supernatan dibuang dan ditambah alkohol 70 % sebanyak 1000 μl dan dihomogenkan. Kemudian sentrifugasi dengan kecepatan 7500 rcf selama 5 menit. Supernatan dibuang sedangkan peletnya dikeringkan (air dry) selama 5-10 menit. Kemudian disuspensi kembali dengan menambahkan treated water 20 μl dan disimpan pada lemari es selama 1 malam atau dalam freezer sampai digunakan.
c. Uji RT-PCR
Setelah RNA hasil isolasi RNA Trizol diperoleh, langkah selanjutnya adalah RT-PCR. Kedalam tabung PCR dengan volume 200 μl dimasukkan 1 μl RNA yang telah diisolasi, ditambahkan dengan 0,6 μl primer DDVP1 dan 0,6 μl primer DDVP2, ditambahkan enzim SuperScriptTM III One-Step RT-PCR System with Platinum® Taq DNA Polymerase (Invitrogen) 0,25 μl, ditambahkan Rmix (dNTP, MgSO4 dan buffer) 5 μl dan ditambahkan aquabides 1,55 μl. Kemudian tabung PCR dimasukkan kedalam thermo-cycler Eppendorf Mastercycler personal atau PTC-100TM Programable Thermal Controller MJ Research Inc. Mesin penyiklus panas diprogram dengan kondisi 94 °C selama 60 detik, 52 °C selama 30 detik, dan elongasi pada suhu 72 °C selama 1 menit 30 detik. Pada bagian akhir diinkubasikan pada suhu 72 °C untuk memperoleh fragmen yang sempurna selama 5 menit. Tabung
PCR dimasukkan setelah thermo-cycler mencapai suhu 50 °C. Setelah RT-PCR, 4 μl produk RT-PCR ditambahkan blue juice (Bromphenol-blue dan Cycline Cyanol), dan selanjutnya dielektroforesis pada gel agarose 1 % yang telah diisi etidium bromide dengan tegangan 100V selama 30 menit. Visualisasi DNA dilakukan dengan lampu ultraviolet dan didokumentasikan dengan kamera dan film Polaroid.
d. Uji Hemaglutinasi
Dilakukan dengan cara: setiap lubang plat mikro diisi dengan larutan PBS. Kemudian ditambahkan antigen pada lubang 1 dan diencerkan secara berseri hingga lubang 11, dan diaduk dengan pengocok mikro. Selanjutnya ditambahkan suspensi sel darah merah pada semua lubang dan diaduk kembali. Setelah didiamkan selama 30 menit, diamati ada tidaknya endapan sel darah merah.
e. Uji Hambatan Hemaglutinasi
Dilakukan dengan cara: setiap lubang plat mikro diisi dengan larutan PBS. Kemudian ditambahkan serum yang mengandung virus Avian Influenza (AI) atau virus New Castle Disease (ND) pada lubang 1 dan diencerkan secara berseri hingga lubang 11, dilanjutkan dengan penambahan antigen 4 unit HA pada lubang 1 – 11. Setelah itu, diaduk dengan pengocok mikro. Selanjutnya ditambahkan suspensi sel darah merah pada semua lubang dan diaduk kembali. Setelah didiamkan selama 30 menit, diamati ada tidaknya endapan sel darah merah.
BAB III HASIL
Sampel dari hewan yang telah dinekropsi dengan nomor protokol 304/N/10 dikirim ke beberapa laboratorium untuk mengetahui agen penyebab penyakit guna meneguhkan diagnosa penyakit yang menyebabkan kematian pada hewan. Untuk laboratorium patologi veteriner sampel berupa irisan organ otak, paru-paru, jantung, hati, limpa, ginjal dan usus. Irisan organ paru-paru dan usus yang mengalami perubahan dikirimkan ke laboratorium mikrobiologi veteriner. Pengiriman sampel berupa feses dan ulas darah tipis ke laboratorium parasitologi veteriner.
Hasil dari pemeriksaan di beberapa laboratorium yang telah dilakukan, disajikan dalam tabel-tabel berikut.
3.1 Hasil Pemeriksaan Patologi Anatomi Veteriner Gambar 1. Tabel Hasil Pemeriksaan Patologi Anatomi
Sisitem organ Perubahan Patologi Anatomi Sistem syaraf Organ otak mengalami perdarahan
Sistem kardiovaskuler Organ jatung mengalami perdarahan dan terbungkus oleh fibrin
Sistem respirasi Paru-paru mengalami nekrosis dan terbungkus oleh fibrin
Sistem gastrointestinal Seluruh organ abdomen terbungkus oleh fibrin. Sistem integumen Tidak ada perubahan
Sistem otot dan tendon Tidak ada perubahan Sistem tulang dan
persendian Tidak ada perubahan
Sistem urinaria Ginjal terbungkus oleh fibrin Sistem reproduksi Tidak ada perubahan
3.2 Hasil Pemeriksaan Histopatologi
Gambar 2. Tabel Hasil Pemeriksaan Histopatologi
Organ Perubahan Histopatologi
Otak Otak mengalami perdarahan ringan dan kongesti
Usus Halus Lamina profia usus membengkak disertai poliferasi sel radang makrofag.
Paru-paru Perdarahan, infiltrasi sel neutrophil dari lumen bronkhiolus sampai lumen alveoli. Septa alveoli banyak nekrosis.
Hati Ditemukanya sel radang neutrophil Limpa Mengalami perdarahan
Usus Besar Mengalami perdarahan, nekrosis, ditemukan infiltrasi sel radang makrofag dan sedikit neutrophil
Ginjal Mengalami perdarahan ringan pada medula nekrosis pada tubulus dan glomerulus.
3.3 Hasil Pemeriksaan Mikrobiologi Veteriner Gambar 3. Tabel Hasil Pemeriksaan Mikrobiologi
Pertumbuhan pada Blood Agar Pertumbuhan pada MCA
Kolon berwarna putih susu, bentuk bulat, tepi rata dan licin, diameter ± 2 mm.
Terdapat pertumbuhan dengan warna koloni pink, bentuk tidak beraturan, diameter ± 3 mm. Primary Test Katalase + Oksidase - Motilitas + Fermentasi glukosa + Secondary Test TSIA
Bagian tegak : Kuning +
Bagian miring: Kuning +
Produksi H2S - SIM Indol + Motil + Produksi H2S - MR : Merah + VP : Hijau -
Simmon Citrat Agar -
Gula-gula:
Glukosa + (Terbentuk Gas)
Laktosa + (Terbentuk Gas)
Escherichia coli
3.4 Hasil Pemeriksaan Parasitologi Veteriner Gambar 4. Tabel Hasil Pemeriksaan Parasitologi
Materi Metode Pemeriksaan Hasil Pemeriksaan
Feses Natif Sedimentasi Pengapungan Negatif Negatif Negatif Cacing Negatif
3.5. Hasil Pemeriksaan Virologi Veteriner Gambar 6. Tabel Hasil Pemeriksaan Virologi
Hasil Pemeriksaan : Tidak dilakukan pemeriksaan karena tidak ada indikasi ke arah penyakit virus dan babi sudah divaksinasi.
BAB IV PEMBAHASAN
4.1. Epidemiologi
Sistem pemeliharaan ternak dilakukan secara intensif. Akan tetapi lantai kandang jarang dibersihkan dan lantai kandang berlubang-lubang sehingga banyak terdapat genangan air. Hal ini akan mempercepat penyebaran penyakit antar babi dalam satu kandang. Ternak pernah divaksinasi sebelumnya.
4.2. Gejala Klinis dan Perubahan Patologi Anatomi
Gejala klinis yang teramati pada babi kasus dengan nomor protokol 304/N/10 yaitu gejala yang terlihat adalah Diare, kaheksia dan anoreksia. Menurut Dharma dan Putra (1997), gejala klinis colibasillosis pada anak babi setelah disapih adalah diare dan edema.
Perubahan patologi anatomi yang tampak pada babi kasus adalah terlihat adanya fibrin yang melapisi hampir semua organ-organ abdomen dan thorak, adanya akumulasi cairan pada rongga abdomen, nekrosis pada organ paru-paru dan pendarahan pada organ otak. Menurut Nielsen dkk (1975), patologi anatomi yang tampak pada colibasillosis adalah eksudat fibrin pada pleura, pericardial, dan rongga peritonium.
4.3. Diagnosa Sementara
Berdasarkan hasil anamnesa, gejala klinis yang tampak serta hasil dari pemeriksaan patologi anatomi setelah dilakukannya nekropsi dimana ditemukannya beberapa kelainan berupa adanya fibrin yang melapisi hampir semua organ-organ abdomen dan thorak maka dapat diambil diagnosa sementara bahwa babi dengan nomor protokol 304/N/10 menderita colibasillosis.
4.4. Diagnosa Banding
4.5. Pemeriksaan Laboratorium
4.5.1. Hasil Pemeriksaan Histopatologi
Perubahan histopatologi pada usus adalah Lamina profia usus membengkak disertai poliferasi sel radang makrofag pada usus halus dan pada usus besar mengalami perdarahan, nekrosis serta ditemukan infiltrasi sel radang makrofag dan sedikit neutrophil. Pada histopatologi paru-paru terlihat adanya perdarahan serta infiltrasi sel neutrophil dari lumen bronkhiolus sampai lumen alveoli dimana septa alveoli banyak mengalami nekrosis. Pada otak ditemukan perdarahan ringan dan kongesti. Pada hati ditemukanya sel radang neutrophil. Gambaran histopatologi pada ginjal adalah perdarahan ringan pada medula serta nekrosis pada tubulus dan glomerulus.
Dari hasil histopatologi diatas dapat dijelaskan bahwa babi kasus dengan nomor protokol 304/N/10 merupakan kasus septicemia dimana terlihat hampir seluruh organ mengalami kelainan jaringan dan disebabkan oleh infeksi bakteri dilihat dari jenis sel radang yang ditemukan.
4.5.2. Hasil Pemeriksaan Pada Laboratorium Parasitologi
Pemeriksaan di laboratorium parasitologi tidak ditemukan adanya endoparasit pada organ dan pada pemeriksaan feses juga tidak ditemukan adanya telur cacing. Ini menunjukkan bahwa babi kasus tersebut tidak terinfeksi parasit.
4.5.3. Hasil Pemeriksaan Laboratorium Mikrobiologi
Pada media Sheep Blood Agar koloni yang tumbuh berwarna putih kekuningan (keruh), bentuk bulat, tepi rata, elevasi cembung, diameter ± 2 mm dan tidak menghemolisa darah. Pada media Mac Conkey Agar kuman yang tumbuh berwarna merah muda (pink), bentuk tidak beraturan, dengan tepi rata dan elevasi cembung. Pada pewarnaan gram, kuman berwarna merah dan berbentuk batang pendek.
Setelah kuman diisolasi, dilanjutkan dengan identifikasi kuman, untuk uji oksidase hasilnya negatif, karena tidak ada perubahan warna ungu menjadi biru pada stick oksidase. Sedangkan untuk uji katalase hasilnya positif yang
ditandaidengan terbentuknya gelembung udara setelah kuman ditetesi dengan larutan H2O2 3%.
Pada media Triple Sugar Iron Agar (TSIA) terbentuk asam pada bagian media tegak dan miring, sehingga media berubah warna menjadi kuning baik pada bagian tegak maupun pada bagian miring. Hal ini menandakan kuman memfermentasi glukosa, laktosa, dan sukrosa, terdapat gelembung gas pada media bagian tegak, hal ini mengindikasikan kuman menghasilkan gas. Tidak ada perubahan warna media menjadi hitam. Kuman yang ditanam pada media Sulphide Indol Motility (SIM), kuman bersifat motil, media berubah menjadi kuning dan tidak menunjukkan adanya pembentukan H2S (media tidak menjadi hitam), sedangkan indolnya positif.
Uji penggunaan sitrat, dengan menggunakan media simon citrate agar menunjukkan hasil negatif dimana media tidak berubah dari hijau menjadi biru. Hal ini karena mikro organisme tidak mampu menggunakan sitrat sebagai sumber karbon dan energi. Pada uji MRVP menunjukkan hasil positif pada MR yaitu ditandai dengan warna merah /terbentuk cincin setelah ditetesi reagen MR dan VP negatif (warna tidak berubah setelah ditetesi reagen VP).
Pada uji fermentasi karbohidrat, dengan media kaldu karbohidrat (glukosa dan laktosa) didapatkan hasil positif memfermentasi karbohirat dan membentuk gas, dimana pada semua media berubah warnanya menjadi kuning (bersifat asam), dan adanya udara pada ujung tabung durham. Setelah diisolasi dan dicocokkan dengan table identifikasi Coween dan Steel, bakteri yang berhasil diidentifikasi pada pemeriksaan adalah Escherichia coli.
Berdasarkan hasil pemeriksaan histopatologi, pemeriksaan Laboratorium Mikrobilogi Veteriner dan Laboratorium Parasitologi Veteriner yang menunjang diagnosa sementara, maka diagnosa akhir dari kasus babi dengan nomor protokol 304/N/10 adalah Colibasilosis.
4.6. Kolibasillosis
Kolibasilosis disebabkan oleh bakteri Escherichia coli patogen yang biasanya terjadi pada babi muda. Penyakit ini muncul karena kondisi lingkungan terutama kandang dengan sanitasi yang buruk yaitu kotor dan lembab ditambah dengan manajemen pakan dan pengendalian penyakit yang jelek.
Kolibasilosis adalah penyakit umum yang dapat menyerang banyak hewan dan manusia yang disebabkan karena bakteri escherichia coli patogen. Penyakit ini banyak menimbulkan kerugian karena angka morbiditas dan mortalitasnya yang tinggi. Gejala klinis penyakit ini ditandai dengan diare bisa watery atau non watery. Kolibasillosis dengan diare yang encer sekali atau watery biasanya disebabkan oleh strain Enterotoxigenic E. coli (ETEC) karena produksi toksin yang bersifat heat stabile atau heat labile. Sedangkan diare dengan gambaran non watery dan bahkan dapat juga bercampur dengan darah dapat disebabkan oleh strain enteropatogenic, enteroinvasive dan enterohemorragi E.coli (Doyle and Dolores, 2006).
Kolibasilosis pada gastrointestinal dapat dibagi dalam 3 bentuk, yaitu neonetal diare, weaning diare, edema disease. Neonatal diare terjadi pada anak babi yang berumur kurang dari 4 hari, dengan gejala klinis yaitu diare yang berwarna putih. Weaning diare terjadi pada anak babi yang berumur 5 hari sampai dengan sesaat setelah disapih, dengan gejala yang tampak adalah diare yang berwarna putih. Edema disease, kejadian penyakit ini pada anak babi yang ditandai dengan adanya odem diseluruh tubuh (Tona dan Besung, 1994).
4.7. Escherichia coli
Escherichia coli merupakan famili dari Enterobacteriaceae yang bersifat fakultatif anaerob, gram negatif dan tinggal di usus hewan, tidak memproduksi gas H2S. Isolasi bakteri ini pada media agar darah, koloni dapat dilihat dengan bentuk bundar warna putih keruh dan dapat menghemolisa darah. Pada penelitian yang dilakukan oleh Nielsen dkk (1975) menunjukan bahwa mayoritas E. coli yang diisolasi dari babi dengan kasus septicemia merupakan E. coli yang non hemolitik. Isolasi pada agar MacConkay, koloni terlihat khas dengan warna merah muda yang menandakan bahwa bakteri ini dapat menggunakan laktosa untuk pertumbuhannya.
Secara umum bakteri Escherichia coli adalah flora normal dalam usus hewan babi, selama dilaksanakan manajemen pemeliharaan yang baik bakteri ini akan bersifat komensalisme dengan hostnya. Namun jika terjadi penurunan kondisi lingkungan dan kondisi hewan yang kurang baik maka peluang terinfeksi bakteri Escherichia coli patogen menjadi sangat besar. Infeksi dapat terjadi karena bakteri Escherichia coli patogen tertelan oleh hewan baik melalui makanan dan minuman yang terkontaminasi maupun puting susu yang tercemar (Moon et al, 1971).
Infeksi yang disebabkan oleh Escherichia coli dapat bersifat lokal atau sistemik. Infeksi lokal terbatas pada satu atau lebih dari organ sedangkan infeksi sistemik terjadi ketika bakteri menyebar keseluruh tubuh melalui aliran darah (Nielsen dkk, 1975).
Mekanisme terjadinya diare pada kasus Escherichia coli adalah karena usus halus tidak dapat mengeksresikan enzim pencernaan akibat rusaknya lapisan mukosa sehingga zat makanan tidak tercerna secara kimiawi menyebabkan zat makanan tidak dapat diserap oleh usus halus yang mengakibatkan tekanan osmotik di lumen meningkat sehingga cairan yang berada didalam sel tertarik keluar sehingga terjadi peningkatn jumlah cairan. Diare juga dapat terjadi karena dilepaskannya enterotoksin tahan panas yang akan menyebabkan akumulasi cAMP, dimana dapat mengakibatkan menurunnya absorbsi NaCl dan sekresi Clorida meningkat. Dengan menurunnya absorbsi Natrium, pada usus dan lumen usus merenggang yang diikuti oleh peningkatan peristaltik usus sehingga terjadi diare (Tono dan Besung, 1994).
Dari adanya diare ini menimbulkan dehidrasi, lemas, bulu kusam (kurangnya cairan untuk membasahi bulu). Anorexia dan diare menyebabkan kekurusan. Adanya peradangan pada paru-paru menyebabkan hewan sulit bernafas, sehingga tubuh kekurangan oksigen menyebabkan pucatnya mukosa. Adanya infeksi ulang pasca kesembuhan dikarenakan hewan yang sakit dengan hewan yang sehat dicampur dalam satu kandang sehingga belum sepenuhnya sembuh akan terinfeksi lagi oleh kuman tersebut
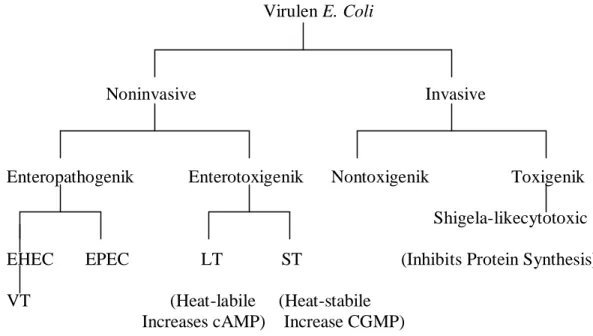
Diare yang terjadi dapat bersifat watery atau cair dan non watery biasanya feses bercampur darah. Pembagian grup Escherichia coli patogen dapat dilihat
Virulen E. Coli
Noninvasive Invasive
Enteropathogenik Enterotoxigenik Nontoxigenik Toxigenik
Shigela-likecytotoxic EHEC EPEC LT ST (Inhibits Protein Synthesis)
VT (Heat-labile (Heat-stabile Increases cAMP) Increase CGMP)
Tabel Pembagian Grup Escherichia coli pathogen (Doyle and Dolores, 2006). Escherichia coli patogen dapat dikelompokkan menjadi E.coli invasive dan noninvasive. E.coli invasive dapat menimbulkan infeksi dengan cara menginvasif sel sehingga disebut juga Enteroinvasive E.coli (EIEC). Escherichia coli non invasive dapat dibagi lagi menjadi Enteropathogenik dan Enterotoxigenik. Enteropatogenik dapat dikelompokkan menjadi dua grup patogen yaitu Enteropatogenic E. coli (EPEC) dan Enterohemorragi E. coli (EHEC). Enterotoxigenic adalah jenis grup E. coli patogen yang dapat memproduksi toksin baik yang tahan panas (Heat stabile toxin) atau yang tidak tahan panas (Heat labile toxin) (Doyle and Dolores, 2006).
Diagnosa yang tepat untuk kasus Escherichia coli dapat dilakukan melalui pemeriksaan labolatorium mikrobiologi dengan cara identifikasi melalui penanaman dan uji lanjutan. Pengujian dapat juga dilakukan dengan tes serologi untuk mengetahui strain Escherichia coli patogen dengan lebih spesifik. Pengobatan dapat dilakukan dengan pemberian antibiotika yang sebelumnya telah diuji kepekaannya untuk lebih memaksimalkan pengobatan.
BAB V
SIMPULAN DAN SARAN
5.1. Simpulan
Babi dengan nomor protokol 304/N/10 berdasarkan hasil dari pemeriksaan di empat laboratorium (patologi, bakteriologi, parasitologi dan virologi) didiagnosa menderita penyakit kolibasilosis.
5.2. Saran
Perlu perbaikan manajemen kandang, pakan dan pengendalian penyakit. Kandang harus dijaga kebersihan dan kelembabannya. Pengendalian penyakit dengan cara pemberian vaksin, obat cacing dan antibiotika harus lebih diperhatikan serta pemisahan hewan yang sakit dengan hewan yang sehat juga harus dilakukan untuk mencegah terjadinya penularan antar ternak dalam satu kandang.
DAFTAR PUSTAKA
Dharma, Dewa Made Ngurah dan Anak Agung Gde Putra. 1997. Penyidikan Penyakit Hewan. CV Bali Media. Denpasar.
Doyle, J. E and G. E. Dolares. 2006. Escherichia coli in Diarrheal Disease. Accessed at
Moon, H.G., Sorensen, D.K., and Satter, J.H. 1971. Experimental Enteric Colibacillosis in Piglets. College of veterinary Medicine University of Minnesota
Nielsen, N. C., N. Bile., H. –J. Riising and A. Dam. 1975. Polyserositis in Pigs Due to Generalized Escherichia coli Infection.
Tono, K.P.G and Besung, N.K. 1994. Ilmu Penyakit Bakterial. Program Studi Kedokteran Hewan Universitas Udayana. Denpasar.
LAMPIRAN
Gambar 1. Babi (304/N/10) Gambar 2. Fibrin pada abdomen
Gambar 7. Perdarahan pada otak Gambar 8. Koloni pada MCA
Gambar 9. Uji Oksidase Gambar 10. Koloni pada TSIA
Gambar 13. Uji MR (kiri) dan Uji VP Gambar 14. Uji SIM