ISSN 2302-6308
PERAN AMMONIUM KLORIDA (NH
4Cl) DAN SODIUM
NITRIT (NaNO
2) DALAM MENAMBAH BAKTERI
NITRIFIKASI
(The Role of Ammonium chloride and Sodium nitrite to enhance growth
of nitrifying bacteria)
Saifullah
1*1
Jurusan Perikanan Fakultas Pertanian Universitas Sultan Ageng Tirtayasa
Jl. Raya Jakarta Km. 4 Pakupatan Serang Banten
*Korespondensi: saifullah@untirta.ac.id
Diterima: 29 November 2013/ Disetujui: 22 Desember 2013
ABSTRACTThis research was conducted to evaluate the use of ammonium chloride and sodium nitrite to enhance growth of nitrifying bacteria in order avoiding the new tank syndrome effect. This experiment used ammonium chloride and sodium nitrite as a treatment factor. The experiment conducted using completely randomized design with three replications. Total bacteria were determined using Total Plate Count (TPC) and Most Probable Number (MPN) methods. The result showed that elevated dose of material could increase the number of Ammonia Oxidizing Bacteria (AOB) and Nitrie oxidizing bacteria (NOB), even though the increasing did not stand longer.
Keywords : ammonium chloride, sodium nitrite, AOB, NOB
ABSTRAK
Penelitian ini dilakukan dalam rangka menguji penggunaan ammonium klorida dan sodium nitrit sebagai sumber energi bagi pertumbuhan bakteri nitrifikasi sehingga diharapkan dapat mengatasi dampak new tank syndrome. Metode yang digunakan dalam penelitian ini adalah metode eksperimen menggunakan pola Rancangan Acak Lengkap dengan perlakuan kombinasi bahan dengan dosis berbeda. Parameter yang diamati adalah jumlah bakteri total dengan metode TPC dan MPN. Hasil penelitian menunjukkan peningkatan dosis bahan dapat meningkatkan jumlah bakteri AOB dan NOB nya, meskipun peningkatan jumlah bakteri ini tidak berlangsung lama.
Kata kunci : ammonium klorida, sodium nitrit, AOB, NOB PENDAHULUAN
Pemanfaatan akuarium untuk kegiatan budidaya perikanan telah banyak dilakukan, terutama untuk jenis-jenis ikan hias. Semakin terbatasnya lahan untuk budidaya dan kesulitan dalam memperoleh kualitas air yang sesuai, menjadi salah satu alasan dipilihnya akuarium ataupun bak untuk
kegiatan budidaya. Namun demikian, pemanfaatan akuarium sebagai tempat budidaya ikan, terutama dengan kepa-datan yang tinggi seringkali mengalami permasalahan berupa kematian ikan yang baru dimasukkan ke dalam akuarium secara mendadak. Kematian ikan ini biasanya terjadi walaupun kadar oksigen dalam perairan cukup
(diae-rasi), tanpa ada indikasi serangan penyakit, dan biasanya terjadi pada wadah budidaya yang baru dibersihkan (dicuci). Kondisi inilah yang dikenal sebagai new tank syndrome. New tank
syndrome terjadi pada akuarium atau
wadah budidaya yang baru digunakan, dimana kehadiran bakteri nitrifikasi masih dalam jumlah yang sedikit, sementara ammonia yang diekskresikan oleh ikan meningkat ke level toksik. Kondisi tersebut menyebabkan kema-tian pada ikan, karena ammonia dalam perairan lebih tinggi daripada dalam tubuh ikan. Hal ini terjadi karena bakteri tersebut tidak dalam jumlah yang cukup untuk berkembang biak ke titik yang mampu bersaing dengan output limbah dari ikan.
Ammonia merupakan limbah meta-bolisme yang diekskresikan oleh ikan yang bersifat toksik bagi kebanyakan ikan (Affandi dan Tang 2002), dapat menurunkan tingkat kelangsungan hidup, menghambat pertumbuhan dan menyebabkan beragam disfungsi fisiologis (Tomasso 1994). Menurut Weinstein dan Kimmel (1998), kadar ammonia dapat meningkat dengan cepat pada sistem budidaya intensif. Pemberian pakan pada budidaya intensif juga akan meningkatkan pengkayaan nitrogen di perairan (Durborow et al. 1997; Avnimelech 2009). Peningkatan kadar ammonia yang cepat pada sistem budidaya intensif, akan membuat ammonia mencapai tingkat toksik dalam jangka waktu yang tidak terlalu lama.
Tingkat toksisitas ammonia yang dilaporkan dari berbagai penelitian yang telah dilakukan, menunjukkan hasil yang beragam. Avnimelech (2009), melaporkan tingkat toksisitas ammonia berada pada kisaran 1-2 mg/l, tergantung dari jenis ikannya. El-Sherif dan El-Feky (2008), melaporkan bahwa pada benih ikan nila dengan berat rata-rata 19±1,0 g dapat dipelihara pada perairan dengan konsentrasi ammonia antara 0,004-0,01 mg/l untuk meng-hasilkan performa pertumbuhan yang
optimal dan tingkat kelangsungan hidup yang tinggi. Sementara itu, Durborow et
al. (1997) menyatakan tingkat toksisitas
menyebabkan kematian dimulai pada konsentrasi 0,6 mg/l. Biswas et al. (2006) menunjukkan paparan terus menerus ammonia pada konsentrasi 0,1 mg/l menyebabkan 100% kematian pada ikan mas (Cyprinus carpio) yang diuji.
Pada konsentrasi yang sama, ammonia yang bersifat toksik berasal dari bentuk yang tidak terionisasi (NH3).
Randall dan Tsui (2002) menyatakan ammonia yang masuk ke dalam tubuh organisme berasal dari bentuk yang tidak terionisasi (NH3). Toksisitas
ammonia ini terutama dipengaruhi oleh oksigen terlarut dan pH (Spotte 1970). Hal ini juga dinyatakan oleh Randall dan Tsui (2002) dimana pengaruh peruba-han tekanan dan suhu lebih kecil dibandingkan pengaruh pH terhadap proporsi NH3 dan toksisitasnya terhadap
organisme.
Ammonia dapat diubah menjadi nitrat (yang bersifat tidak toksik ter-hadap organisme akuatik) melalui pro-ses nitrifikasi. Nitrifikasi sendiri meru-pakan proses oksidasi ammonia men-jadi nitrit dan nitrat yang dilakukan oleh bakteri AOB (ammonia oxidizing bacteria) dan NOB (nitrite oxidizing bacteria). Jenis bakteri yang berperan
dalam nitrifikasi diantaranya adalah
Nitrosomonas dan Nitrobacter. Kedua
jenis bakteri tersebut merupakan bakteri kemotrofik, yaitu bakteri yang menda-patkan energi dari proses kimiawi (Effendi, 2003). New tank syndrome disebabkan karena belum tumbuhnya bakteri nitrifikasi pada wadah budidaya, sehingga keadaan tersebut membuat ikan mengalami kematian akibat level ammonia yang membuat stres yang tinggi pada ikan atau mencapai tingkat toksik.
Pendekatan masalah yang dilaku-kan dalam penelitian ini adalah dengan memberikan sumber energi bagi bakteri nitrifikasi, diharapkan bakteri nitrifikasi tersebut dapat tumbuh secara mapan
sehingga mampu mengubah ammonia menjadi nitrit dan nitrit menjadi nitrat. Menurut Dwidjoseputro (2010), kebutu-han bakteri nitrifikasi akan nitrogen diperoleh dari ion-ion NH4+ dan NO2-.
Selain itu, menurut Durborow et al. (1997) menjaga kelarutan oksigen tetap tinggi melalui aerasi dapat mengurangi toksisitas ammonia.
Berdasarkan uraian di atas, pene-litian ini dilakukan dengan tujuan untuk menguji pengaruh penambahan ammonium klorida dan sodium nitrit dalam menumbuhkan bakteri nitrifikasi sehingga diharapkan dapat mengatasi dampak new tank syndrome.
METODE PENELITIAN Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2011 – Mei 2012 di Laboratorium Lingkungan Departemen Akuakultur FPIK IPB Bogor. Analisa parameter perlakuan dilakukan di Lab. Lingkungan Departemen Akuakultur FPIK dan lab. Mikrobiologi Departemen Biologi FMIPA Institut Pertanian Bogor.
Bahan dan Alat
Bahan ammonium klorida dan sodium nitrit yang digunakan dalam penelitian ini diperoleh dari PT. Brataco Bogor. Bahan lain yang dibutuhkan adalah kalsium karbonat dan bioball. Wadah percobaan menggunakan akuarium dengan volume 4 liter sebanyak 24 buah.
Rancangan Penelitian
Metode yang digunakan dalam penelitian ini adalah metode eksperimen dengan menggunakan pola Rancangan Acak Lengkap (RAL) dengan perlakuan kombinasi bahan (NH4Cl dan NaNO2)
dengan dosis berbeda. Lama peng-amatan perlakuan adalah 21 hari. Kombinasi perlakuannya adalah:
A1 : Tanpa penambahan ammonium klorida dan sodium nitrit
B1 : Dosis ammonium klorida dan sodium nitrite (23 mg/l dan 37 mg/l)
C1 : Dosis ammonium klorida dan sodium nitrite (46 mg/l dan 74 mg/l)
D1 : Dosis ammonium klorida dan sodium nitrit (92 mg/l dan 148 mg/l)
Model linier dari rancangan ini adalah sebagai berikut :
Yij = μ + τi + εij i = 1, 2, 3, 4
j = 1, 2, 3
dimana :
Yij = variabel yang akan dianalisis μ = rataan umum
τi = pengaruh perlakuan ke-i
εij = pengaruh acak pada perlakuan ke-i ulangan ke-j
Prosedur Penelitian Persiapan penelitian
Akuarium yang akan digunakan dicuci bersih dan dikeringkan. Air dari bak tandon yang akan digunakan telah disiapkan beberapa hari sebelum penelitian dimulai. Selain itu, air dari bak tandon ini juga tidak dikaporit atau diberi tawas untuk mencegah ketiadaan bakteri. Bioball yang akan digunakan diaktifasi terlebih dahulu agar dapat menjadi substrat bagi pertumbuhan bakteri nitrifikasi menggunakan ammonium klorida dan sodium nitrit mengacu pada dosis yang disarankan oleh Forteath (1993). Sehari sebelum penelitian dimulai, air dimasukkan ke dalam akuarium penelitian diberi aerasi untuk meningkatkan kadar oksigen terlarut dalam air, ditambahkan CaCO3,
dan bioball yang telah diaktifasi.
Penelitian utama
Ammonium klorida dan sodium nitrit yang telah ditimbang sesuai perlakuan dimasukkan ke dalam akuarium pene-litian. Penelitian utama dilaksanakan selama 21 hari. Pengamatan parameter perlakuan dilakukan dengan interval waktu 3 hari.
Parameter yang diamati
Parameter yang diamati adalah jumlah bakteri total (TPC) dan jumlah bakteri nitrifikasi (MPN).
Analisis Data
Data yang diperoleh dianalisis dengan menggunakan uji F untuk mengetahui pengaruh dari setiap perlakuan. Perbedaan antar perlakuan diketahui dengan menggunakan uji jarak berganda Duncan pada taraf 5%.
HASIL DAN PEMBAHASAN Jumlah Bakteri Total
Penghitungan jumlah bakteri total yang dilakukan terhadap sampel air sebelum diberi perlakuan dan setelah diberi perlakuan ditunjukkan pada Tabel 1. Pada penelitian ini diupayakan untuk tidak menambahkan inokulasi bakteri dari luar ke dalam akuarium uji. Dalam rangka mendukung hal tersebut, dila-kukan pengujian jumlah bakteri total terhadap air tandon untuk mengetahui jumlah koloni bakterinya.
Tabel 1 Jumlah bakteri total di awal dan akhir penelitian
Sampel
Jumlah Bakteri Total (CFU/ml) Awal Akhir Air Tandon 5,2x101 A1 35,5x102 B1 22,2x102 C1 18,9x102 D1 5,55x102
Hasil pengujian menunjukkan jumlah koloni bakteri awal yang terdapat pada air tandon sebesar 5,2 x 101
CFU/ml (Tabel 1). Keberadaan bakteri ini, meskipun dalam jumlah yang kecil, menjadi modal untuk mengatasi dampak new tank syndrome melalui penambahan bahan kimia tertentu yang dapat dijadikan sebagai sumber energi bagi pertumbuhannya. Rendahnya kan-dungan bahan organik yang terdapat di air tandon membuat jumlah bakterinya
juga menjadi rendah. Keberadaan bakteri pada lingkungan perairan selain dipengaruhi oleh ketersediaan bahan organik, menurut Hogg (2005) juga dipengaruhi oleh keberadaan oksigen dan cahaya. Pengujian terhadap sampel air pada akhir penelitian menunjukkan terjadinya peningkatan jumlah koloni bakteri yang terdapat pada masing-masing perlakuan. Hal ini menunjukkan bahwa ammonium klorida dan sodium nitrit dapat digunakan untuk mening-katkan jumlah koloni bakteri pada air media pemeliharaan. Perbedaan jumlah bakteri total di akhir penelitian dapat dijelaskan berdasarkan kurva pertum-buhan bakteri (Gambar 1).
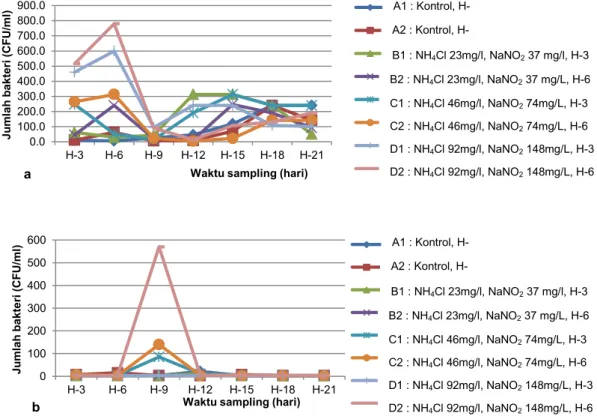
Gambar 1 Kurva pertumbuhan bakteri (Hogg 2005)
Pertumbuhan bakteri yang cepat di awal perlakuan (fase log) pada perlakuan D, C, dan B terjadi karena melimpahnya nutrien yang menjadi sumber energinya. Hogg (2005) menyatakan fase eksponensial bakteri dibatasi oleh faktor lingkungan. Faktor yang membatasi pertumbuhan bakteri pada penelitian ini adalah ketersediaan sumber energinya (ammonium klorida dan sodium nitrit). Namun demikian pertumbuhan bakteri ini mengalami penurunan sampai di akhir penelitian. Hal ini sesuai dengan hasil pertum-buhan bakteri AOB (Gambar 2) yang mengalami penurunan pada perlakuan D, C, dan B. Sementara pertumbuhan bakteri pada perlakuan A baru menga-lami peningkatan. Turunnya jumlah bakteri pada perlakuan D, C, dan B
diduga bakteri telah melewati fase eksponensialnya dan memasuki fase kematian. Selain itu, turunnya jumlah bakteri ini juga dapat terjadi karena pengaruh bahan yang digunakan (ammonium klorida dan sodium nitrit). Di satu sisi, bahan ini dibutuhkan sebagai sumber energi untuk menum-buhkan bakteri, namun di sisi lain bahan ini juga dapat bersifat toksik terhadap bakteri nitrifikasi. Ammonia yang tidak terionisasi ini dapat menyebabkan toksisitas terhadap bakteri nitrosomonas dan nitrobacter dan menghambat proses nitrifikasi (Anthonisen et al. 1976; Russo 1985). Bakteri nitrifikasi tidak mampu membentuk spora. Semua spesies bakteri ini juga memiliki rentang toleransi yang sempit terhadap para-meter pembatasnya. Di dalam air, bakteri ini dapat bertahan dengan memanfaatkan bahan yang disimpan dalam sel. Ketika bahan ini habis, bakterinya akan mengalami kematian.
Peran Ammonium Klorida (NH4Cl) dan Sodium Nitrit (NaNO2) Dalam
Menambah Bakteri Nitrifikasi
Pemberian ammonium klorida dan sodium nitrit sebagai sumber energi bagi bakteri nitrifikasi dalam penelitian ini dapat menambah jumlah bakteri AOB dari perlakuan B, C dan D. Tanpa penambahan bakteri, menurut Perfettini dan Bianchi (1990), dibutuhkan waktu sampai 40 hari untuk membuat komu-nitas bakteri nitrifikasi menjadi mapan. Penggunaan ammonium klorida dan sodium nitrit dengan dosis masing-masing 46 mg/l dan 73 mg/l mem-butuhkan waktu 20 hari untuk membuat bakteri tumbuh secara mapan pada biofilter (Forteath 1993). Waktu yang dibutuhkan untuk membuat bakteri nitrifikasi mapan menjadi lebih pendek ketika diberikan inokulan bakteri dan sumber energi bagi bakteri tersebut
untuk tumbuh. Grommen et al. (2002) menunjukkan hanya dibutuhkan waktu beberapa hari untuk membuat bakteri tumbuh secara mapan dan mampu mengoksidasi ammonia. Bakteri nitri-fikasi dikatakan telah tumbuh dengan mapan ketika proses nitrifikasi telah berlangsung dengan sempurna, yaitu saat amonia dirombak oleh bakteri nitrifikasi menjadi nitrit, kemudian nitrit ini diubah menjadi nitrat.
Hovanec dan DeLong (1996) menyatakan bakteri AOB dan NOB membutuhkan aerasi yang cukup dan sumber energi (ammonia/nitrit) untuk dapat tumbuh secara mapan (established). Sebagaimana terlihat dari Gambar 2, grafik pertumbuhan bakteri AOB tertinggi diperlihatkan oleh perlakuan D (dosis NH4Cl dan NaNO2
masing-masing 92 dan 148 mg/l), diikuti oleh perlakuan C (46 dan 74 mg/l), B (23 dan 37 mg/l) dan A (kontrol).
Berdasarkan Gambar 2 tersebut, terlihat bahwa peningkatan dosis bahan (NH4Cl dan NaNO2) meningkatkan
jumlah bakteri AOB-nya. Penelitian Princic et al. (1998) menunjukkan hal serupa, dimana biomassa tertinggi dari bakteri nitrifikasi didapatkan pada media yang berisi konsentrasi ammonium tertinggi. Hal ini paling tidak menun-jukkan bahwa konsentrasi bahan yang digunakan dapat mempengaruhi jumlah bakteri nitrifikasi yang didapatkan. Hasil analisis statistik menunjukkan terdapat pengaruh yang nyata dari dosis bahan yang digunakan terhadap jumlah bakteri AOB-nya. Sementara itu jumlah bakteri NOB-nya tidak mengalami peningkatan yang berarti. Hasil analisis statistik menunjukkan tidak adanya pengaruh yang nyata dari perlakuan terhadap jumlah bakteri NOB. Diduga pening-katan bakteri NOB tidak hanya terkait dengan keberadaan sumber nitrit di perairan.
Gambar 2 Pertumbuhan bakteri nitrifikasi a) AOB, b) NOB Peningkatan dosis bahan (NH4Cl
dan NaNO2) dengan harapan
mem-percepat proses peningkatan jumlah bakteri AOB ini tidak dapat berlangsung lama. Ternyata, selain bersifat toksik terhadap organisme akuatik, ammonia yang tidak terionisasi ini juga dapat menyebabkan toksisitas terhadap bakteri nitrosomonas dan nitrobacter dan menghambat proses nitrifikasi (Anthonisen et al. 1976; Russo, 1985). Selain hal itu, ketersediaan media substrat dalam jumlah yang cukup turut berperan dalam proses peningkatan jumlah bakteri yang diharapkan. Pertumbuhan bakteri nitrifikasi, menurut Mc Carty dan Haug (1971) dipengaruhi oleh keberadaan senyawa toksik, suhu, pH, kandungan oksigen terlarut, salinitas dan substrat untuk menem-pelnya bakteri.
Tingginya jumlah bakteri AOB di awal penelitian juga tidak dapat langsung menurunkan ammonia pada media pemeliharaan. Mota et al. (2005)
menyatakan bahwa efisiensi penurunan ammonia tidak hanya berasosiasi dengan tingginya jumlah bakteri AOB atau keragamanan bakterinya. Kondisi bakteri yang belum mapan inilah yang diduga menjadi penyebab tidak efek-tifnya penurunan ammonia pada media pemeliharaan. Padahal, kasus new tank
syndrome sendiri terjadi karena
am-monia yang mencapai level toksik sementara bakteri nitrifikasi belum tumbuh pada wadah budidayanya.
KESIMPULAN
Ammonium klorida dan sodium nitrit dapat digunakan untuk meningkatkan jumlah bakteri AOB dan NOB, meskipun peningkatan jumlah bakteri ini tidak dapat berlangsung lama.
0.0 100.0 200.0 300.0 400.0 500.0 600.0 700.0 800.0 900.0 H-3 H-6 H-9 H-12 H-15 H-18 H-21 Ju ml ah b akter i (C F U /ml )
Waktu sampling (hari)
a A1 A2 B1 B2 C1 C2 D1 D2 0 100 200 300 400 500 600 H-3 H-6 H-9 H-12 H-15 H-18 H-21 Ju ml ah b akter i (C F U /ml )
Waktu sampling (hari)
b A1 A2 B1 B2 C1 C2 D1 D2 A1 : Kontrol, H-3 A2 : Kontrol, H-6 B1 : NH4Cl 23mg/l, NaNO2 37 mg/l, H-3 B2 : NH4Cl 23mg/l, NaNO2 37 mg/L, H-6 C1 : NH4Cl 46mg/l, NaNO2 74mg/L, H-3 C2 : NH4Cl 46mg/l, NaNO2 74mg/L, H-6 D1 : NH4Cl 92mg/l, NaNO2 148mg/L, H-3 D2 : NH4Cl 92mg/l, NaNO2 148mg/L, H-6 A1 : Kontrol, H-3 A2 : Kontrol, H-6 B1 : NH4Cl 23mg/l, NaNO2 37 mg/l, H-3 B2 : NH4Cl 23mg/l, NaNO2 37 mg/L, H-6 C1 : NH4Cl 46mg/l, NaNO2 74mg/L, H-3 C2 : NH4Cl 46mg/l, NaNO2 74mg/L, H-6 D1 : NH4Cl 92mg/l, NaNO2 148mg/L, H-3 D2 : NH4Cl 92mg/l, NaNO2 148mg/L, H-6
DAFTAR PUSTAKA
Affandi R, Tang MU. 2002. Fisiologi
Hewan Air. Pekanbaru: Unri Pr.
Pekanbaru.
Anthonisen AC, Loehr RC, Prakasam TBS, Srinath EG. 1976. Inhibition of Nitrification by Ammonia and Nitrous Acid. J Water Pollut Control
Fed 48: 835-852.
Avnimelech Y. 2009. Biofloc Technology - A Practical Guide Book. The World Aquaculture Society. Lousiana.
Biswas JK, Sarkar D, Chakraborty P, Bhakta JN, Jana BB. 2006. Density Dependent Ambient Ammonium as The Key Faktor For Optimization Of Stocking Density Of Common Carp In Small Holding Tanks.
Aquaculture 261: 952-959.
Durborow RM, Crosby DM, Brunson MW. 1997. Ammonia in Fish Pond. Revised, June. Southern Regional Aquaculture Center. Publication no.463
Dwidjoseputro D. 2010. Dasar-dasar Mikrobiologi. Cetakan ketujuh belas. Jakarta: Djambatan.
Effendi H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Yogyakarta: Kanisius.
El- Sherif MS, El- Feky Amal M. 2008. Effect of Ammonia on Nile Tilapia (O. niloticus) Performance and Some Hematological and Histological Measures. 8th
International Symposium on Tilapia.
Aquaculture. 513 – 530.
Forteath N. 1993. The Biological Filter. Structure and Function. Di dalam : Hart P, O’Sullivan D, editor. Recirculation Systems. Design, Construction and Management. Aquaculture sourcebook. Australia. Hlm 55-63.
Grommen R, Van Hauteghem I, Van Wambeke M, Verstraete W. 2002. An Improved Nitrifying Enrichment to Remove Ammonium and Nitrite from Freshwater Aquaria Systems.
Aquaculture 211: 115-124.
Hogg S. 2005. Essential Microbiology. J Wiley. Chichester.
Hovanec TA, DeLong EF. 1996. Comparative analysis of nitrifying bacteria associated with freshwater and marine aquaria. Applied and Environmental Microbiology 62:2888-2896.
Mc Carty PL, Haug RT. 1971. Nitrogen Removal from Wastewater by Biological Nitrification and Denitrification. Di dalam : Sykes G, Skinner FA, editor. Society for applied bacteriological symposium series no.1. microbial aspect of pollution. Academic Pr. London. Mota C, Head MA, Ridenoure JA,
Cheng JJ, de los Reyes III FL. 2005. Effects of Aeration Cycles on Nitrifying Bacterial Populations and Nitrogen Removal In Intermittently Aerated Reactors. Appl Environ
Microbiol 71: 8565-8572.
Perfettini J, Bianchi M. 1990. The Comparison of Two Simple Protocols Designed to Initiate and Stimulate Ammonia Oxidation in Closed Aquaculture Systems.