1
Keragaman Virulensi dan Molekuler Virus Tungro
dari Beberapa Daerah Endemis
*)R. Heru Praptana1, YB. Sumardiyono2, Sedyo Hartono2, Y. Andi Trisyono2 dan I. Nyoman Widiarta3
1)Loka Penelitian Penyakit Tungro, 2) Fakultas Pertanian Universitas Gadjah Mada, Yogyakarta, 3)Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor.
Abstract
Tungro is one of the major diseases in rice which has become a constraint in increasing rice production in Indonesia. Tungro is caused by infection with two different viruses of Rice tungro bacilliform virus (RTBV) and Rice tungro spherical virus (RTSV), both of which can only be transmitted by green leafhoppers especially
Nephotettix virescens
(Distant) in a semipersistent manner. Since there is an indication of the existance of virulence variation of tungro viruses from different areas and the specific relationship between resistance of varieties and tungro viruses isolates, it is important to study of the virulence and the genetic diversity of tungro viruses from some endemic areas in Indonesia. This study aimed to identify the virulence and the molecular diversity of tungro viruses from several endemic areas in Indonesia. Susceptible variety i.e. TN1 was used in the study. Surveys and collection of infected plants and green leafhoppers were done in several tungro endemic areas, namely West Java, Central Java, Yogyakarta, Central Sulawesi, West Sulawesi, South Sulawesi, Bali and West Nusa Tenggara. Artificial transmission using the test tube method was used in the virulence test. Green leafhoppers caught from the field were used as transmitters. The virulence of tungro viruses was determined on the basis of diseases indexes (DI). The results showed that the virulence of tungro viruses varied among endemic areas in Indonesia. The Central Java isolate was the most virulent and not all isolates from endemic areas in the island of Java were more virulent than those from outside of Java. The presence of RTBV and RTSV was detected in the infected TN1 plants. The existence of molecular diversity of tungro viruses from several endemic areas was observed. The molecular diversity of tungro viruses was not correlated with geographic difference of endemic areas and the virulence.Key words: rice, tungro, RTBV, RTSV, resistant varieties, virulence, molecular diversity 1
Intisari
Tungro merupakan salah satu penyakit penting pada padi yang menjadi kendala dalam peningkatan produksi padi di Indonesia. Tungro disebabkan oleh infeksi dua virus yang berbeda yaitu
Rice tungro bacilliform virus
(RTBV) danRice tungro
spherical virus
(RTSV), yang keduanya hanya dapat ditularkan oleh vektor terutama
2
Nephotettix
virescens
(Distant) secara semipersisten. Adanya indikasi bahwa terjadi variasi virulensi virus tungro dari daerah yang berbeda dan hubungan spesifik antara ketahanan varietas dengan isolat virus tungro maka diperlukan suatu kajian tentang virulensi dan keragaman genetik virus tungro dari beberapa daerah endemis di Indonesia. Penelitian ini bertujuan untuk mendeterminasi keragaman virulensi dan molekuler virus tungro dari beberapa daerah endemis di Indonesia. Varietas rentan TN1 digunakan di dalam penelitian. Survei dan koleksi tanaman terinfeksi dilakukan di beberapa daerah endemis tungro yaitu Jabar, Jateng, DIY, Sulteng, Sulbar, Sulsel, Bali dan NTB. Penularan buatan dengan metode tabung digunakan dalam uji virulensi virus tungro. Vektor hasil tangkapan dari lapangan digunakan sebagai penular. Virulensi virus tungro ditentukan berdasarkan nilai indeks penyakit (DI). Hasil penelitian menunjukkan bahwa virulensi virus tungro bervariasi di antara daerah endemis. Isolat Jateng merupakan isolat paling virulen dan tidak semua isolat dari daerah endemis di pulau Jawa lebih virulen dibanding isolat dari luar Jawa. Keberadaan RTBV dan RTSV terdeteksi dalam setiap sampel tanaman TN1 bergejala hasil penularan. Virus tungro dari beberapa daerah endemis di Indonesia teridentifikasi beragam pada tingkat molekuler. Keragaman molekuler virus tungro tidak berkorelasi dengan perbedaan geografi daerah endemis dan virulensi.Kata kunci: padi, tungro, RTBV, RTSV, varietas tahan, virulensi, keragaman molecular
Pendahuluan
Tungro merupakan salah satu penyakit penting padi yang menjadi kendala dalam peningkatan produksi padi nasional. Tungro disebabkan oleh infeksi dua virus yang berbeda yaitu
Rice tungro bacilliform virus
(RTBV) danRice tungro spherical virus
(RTSV), yang keduanya hanya dapat ditularkan oleh wereng hijau (vektor) terutamaNephotettix
virescens
(Distant) secara semipersisten. Penyebaran tungro tidak hanya di Indonesia tetapi juga terjadi di India (Muralidharanet al
., 2003), Malaysia, Filipina, Thailand (Suranto, 2004), dan Vietnam (Duet al
., 2005). Di Indonesia, rerata luasan serangan tungro dalam kurun waktu tahun 2001 - 2006 mencapai 3650 ha per tahun (Raga, 2008). Pada musim tanam (MT) 2010/2011 terjadi serangan seluas 5828 ha dan meningkat menjadi 7177 ha pada MT 2011 yang tersebar di 33 provinsi (Kusprayogieet al
., 2011).Penggunaan varietas tahan virus tungro dan vektor merupakan komponen yang efektif dalam pengendalian tungro (Angeles
et al
., 2008), dan sesuai untuk berbagai ekosistem di Indonesia. Suatu varietas tahan tidak dianjurkan untuk ditanam secara terus-menerus karena dapat meningkatkan tekanan seleksi vektor dan memungkinkan3 terbentuknya biotipe vektor baru. Keseragaman varietas tahan yang ditanam di suatu wilayah juga akan mempermudah vektor untuk beradaptasi dan mempercepat terjadinya mutasi virus tungro, sehingga ketahanan varietas tidak dapat berlangsung lama. Ketahanan varietas juga bersifat spesifik lokasi, berarti bahwa suatu varietas menunjukkan reaksi tahan terhadap isolat virus tungro di daerah tertentu tetapi belum tentu tahan terhadap isolat virus tungro di daerah lain. Hal tersebut mengindikasikan adanya variasi virulensi virus tungro dari berbagai daerah yang berbeda.
Selama ini kejadian tungro sering ditemukan pada varietas yang sama di beberapa daerah, bahkan varietas tersebut tidak memiliki gen ketahanan terhadap virus tungro maupun vektor. Beberapa varietas tahan yang sudah dilepas tidak semuanya dapat dikembangkan di seluruh daerah endemis dan umumnya kurang disukai oleh petani. Pengendalian tungro menggunakan varietas tahan harus disesuaikan dengan variasi vierulensi virus tungro, sehingga diperlukan ketersediaan dan pemetaan dalam distribusi varietas tahan. Informasi variasi virulensi dan keragaman genetik virus tungro dari berbagai daerah endemis di Indonesia sangat diperlukan untuk mengetahui sebaran virus tungro berdasarkan virulensinya, sebagai pertimbangan dalam pengendalian tungro menggunakan varietas tahan yang sesuai serta menjadi dasar dalam perakitan varietas tahan tungro baik secara konvensional maupun melalui teknik rekayasa genetik. Oleh karena itu, diperlukan karakterisasi keragaman genetik virus tungro dan kesesuaian varietas tahan dengan variasi virulensi virus tungro dari berbagai daerah endemis di Indonesia. Tujuan penelitian ini adalah mendeterminasi variasi biologi dan molekuler virus tungro dari beberapa daerah endemis di Indonesia.
Bahan dan Metode 1. Persiapan Tanaman
Benih varietas rentan terhadap virus tungro dan vektor (TN1) disemai dalam pot kemudian dimasukkan ke dalam kurungan kasa dan dipelihara di rumah kaca. Setelah bibit berumur 21 hari, maka bibit siap dibawa ke daerah endemis untuk diinokulasi virus tungro menggunakan vektor hasil tangkapan di lapangan.
4 2. Isolat Virus Tungro dan Koloni Vektor
Isolat virus tungro dan koloni vektor berasal dari delapan daerah endemis di Indonesia yaitu Subang (Jawa Barat), Magelang (Jawa Tengah), Sleman (Daerah Istimewa Yogyakarta), Tabanan (Bali), Lombok Tengah (Nusa Tenggara Barat), Sidrap (Sulawesi Selatan), Polewali Mandar (Sulawesi Barat) dan Donggala (Sulawesi Tengah). Di setiap daerah endemis ditentukan empat lokasi pengambilan sampel untuk penularan dengan jarak antar lokasi kurang lebih 200 m. Di Subang, penularan dilakukan di rumah kaca BB Padi Sukamandi menggunakan isolat virus tungro dan vektor koloni Subang. Di Sidrap, pengamatan, koleksi sampel dan uji penularan dilakukan di pertanaman bulanan kebun percobaan (KP) Lokatungro.
3. Uji Virulensi Virus Tungro
Uji virulensi virus tungro dilakukan melalui penularan buatan terhadap bibit padi di dalam tabung gelas
(test tube method)
menggunakan vektor dan sumber inokulum dari pertanaman terserang di setiap daerah endemis. Isolat virus tungro dan vektor yang digunakan benar-benar telah berinteraksi di dalam kondisi lingkungan setempat sehingga kemurniannya dapat terjaga. Efisiensi penularan virus tungro dipengaruhi oleh spesies dan genotipe vektor (Choiet al
., 2009). Hasil uji penularan menunjukkan bahwa terdapat variasi efisiensi dalam menularkan virus tungro dari beberapa koloni vektor dari daerah endemis yang berbeda (Widiartaet al
., 2004).Vektor hasil tangkapan dari pertanaman terserang, satu per satu dimasukkan ke dalam kurungan yang sebelumnya telah diisi dengan rumpun tanaman terinfeksi (bergejala tungro) yang diperoleh dari pertanaman terserang. Setelah kurang lebih 5 jam, vektor diinfestasikan pada bibit TN1 di dalam tabung gelas yang telah diisi air setinggi 1 cm masing-masing 2 ekor imago. Penularan dilakukan terhadap 10 bibit TN1 di setiap petak pengamatan (10 tabung per petak pengamatan). Setelah 24 jam penularan di dalam tabung reaksi, bibit TN1 ditanam pada pot kemudian dimasukkan ke dalam kurungan kasa dan dipelihara di dalam rumah kaca. Sepuluh bibit TN1 ditanam dalam pot kemudian dimasukkan ke dalam kurungan kasa sebagai pembanding (tanpa diinokulasi virus tungro).
Pengamatan dilakukan terhadap insidensi tungro, tingkat keparahan gejala tungro dan tinggi tanaman ketika tanaman berumur 3 minggu setelah tanam (MST). Insidensi tungro ditentukan dengan menghitung jumlah tanaman terserang (tanaman
5 yang menunjukkan gejala tungro) dibagi dengan jumlah tanaman yang diamati kemudian dikalikan 100%. Tingkat keparahan gejala tungro dievaluasi berdasarkan sistem skor sesuai dengan
Standard Evaluation System for Rice
(SESR) (IRRI, 1996), yaitu sebagai berikut:Skor 1 = tidak ada gejala serangan
3 = tinggi tanaman lebih pendek 1-10%, perubahan warna daun dari kuning ke kuning oranye tidak nyata
5 = tinggi tanaman lebih pendek 11-30%, perubahan warna daun dari kuning ke kuning oranye tidak nyata
7 = tinggi tanaman lebih pendek 31-50%, perubahan warna daun dari kuning ke kuning oranye nyata
9 = tinggi tanaman lebih pendek >50%, perubahan warna daun dari kuning ke kuning oranye nyata
Berdasarkan skor tingkat keparahan gejala tersebut kemudian dihitung indeks penyakit dengan menggunakan rumus sebagai berikut:
DI
=tn
n
n
n
n
n
(
1
)
(
3
)
(
5
)
(
7
)
(
9
)
DI
:Disease Index
(indeks penyakit)n
: Jumlah tanaman yang menunjukkan nilai skor tertentutn
: Total tanaman yang diskorTingkat keparahan gejala tungro ditentukan berdasarkan nilai DI, yang berarti bahwa semakin tinggi nilai DI maka gejala yang ditimbulkan semakin parah dan sebaliknya. Virulensi virus tungro ditentukan berdasarkan tingkat keparahan gejala, yang berarti bahwa semakin tinggi nilai DI maka tingkat virulensi virus tersebut semakin tinggi dan sebaliknya.
4. Analisis Molekuler Virus Tungro
Analisis molekuler ditujukan untuk mendeteksi keberadaan virus tungro di dalam tanaman TN1 yang menunjukkan gejala pada uji virulensi virus tungro serta mengetahui keragaman molekuler virus tungro.
6 a. Ekstraksi DNA dan RNA
Ekstraksi DNA ditujukan untuk memperoleh DNA RTBV. Ekstraksi DNA dilakukan mengikuti metode CTAB (Deng
et al.,
1995) yang dimodifikasi. Modifikasi dilakukan pada volume buffer CTAB yang digunakan dan tanpa penggunaan RNAse untuk pemurnian.Ekstraksi RNA ditujukan untuk memperoleh ssRNA RTSV.
Ekstraksi RNA dilakukan menggunakan
Isogen RNA Extraction Kit (Amersham
Pharmacia) dengan sedikit modifikasi. Modifikasi yang dilakukan adalah tanpa
penggunakan nitrogen cair untuk ekstraksi sampel dan peningkatan kecepatan
dalam sentrifugasi.
b. Analisis RT-PCR dan PCR
Analisis RT-PCR dilakukan untuk membentuk
complementary
-DNA (cDNA) dari RTSV. Sebelum dilakukan analisis PCR untuk RTSV, RNA hasil ekstraksi harus diubah terlebih dahulu menjadi cDNA menggunakanFirst Strand cDNA Synthesis Kit
(Fermentas) di dalam mesin PCR. Primer yang digunakan untuk pembentukan cDNA adalah oligo d(T) karena genom RTSV mempunyai poly (A) pada ujung 3‟.Analisis PCR dilakukan untuk mendeteksi keberadaan virus tungro pada setiap sampel daun tanaman TN1 hasil penularan. Reagen yang digunakan dalam analisis PCR untuk deteksi RTBV adalah
Mega Mix Blue
(MMB) (Microzone Limited) sedangkanpureTaq
Ready to Go PCR Bead
(GE Healthcare) digunakan untuk deteksi RTSV. Primer GCAGAACAGAACTCTAAGGC (F) dan GTCTAAGGCTCATGCTGGAT (R) digunakan untuk mendeteksi RTBV dengan target amplifikasi sekuen ORF2 yang berukuran sekitar 430 bp. Primer AAACGGTCATTGTGGGGAGGT (F) dan CAGGCCCAGCAACGACATAA (R) digunakan untuk deteksi RTSV dengan target amplifikasi sekuen CP1 - CP2 yang berukuran sekitar 1115 bp. Optimasi volume reaksi dan program PCR yang sesuai untuk deteksi RTBV dan RTSV ditunjukkan pada Lampiran 1.c. Analisis PCR-RFLP
Analisis PCR-RFLP dilakukan untuk mengetahui keragaman molekuler virus tungro berdasarkan keberadaan dan posisi
restriction site
pada sekuen DNA hasil PCR. Enzim restriksiDra
I digunakan untuk analisis DNA RTBV sedang enzimBstY
I danHind
III digunakan untuk analisis DNA RTSV. Penentuan enzim restriksi didasarkan pada analisis restriksi terhadap sekuen RTBV dan RTSV yang ada di Gen BankNational
7
Center for Biotechnology Information
(NCBI) menggunakan program Genetyx 7.0. Hasil analisis PCR dan PCR-RFLP dielektroforesis pada PAGE bersama 1 kb DNA ladder di dalam buffer TBE 1x dan divisualisasi padaUV transilluminator
.Hasil dan Pembahasan 1. Keragaman Virulensi Virus Tungro
Hasil pengamatan menunjukkan bahwa tanaman TN1 memberikan respons gejala yang berbeda-beda setelah diinokulasi dengan isolat virus tungro dari beberapa daerah endemis. Gejala serangan yang ditimbulkan bervariasi dari daun yang berwarna hijau kekuningan hingga kuning serta tingkat kekerdilan yang berbeda dari agak kerdil hingga kerdil. Umumya, tanaman yang terinfeksi virus tungro menjadi kerdil dan daun berwarna oranye (Calleja, 2010). Gejala serangan pada tanaman terinfeksi terlihat jelas berbeda dengan tanaman kontrol terutama perbedaan tinggi tanaman (Gambar 1). Hal tersebut menunjukkan bahwa vektor hasil tangkapan di pertanaman telah memperoleh dan berhasil menularkan virus tungro. Keberhasilan penularan dan timbulnya gejala khas tungro menunjukkan bahwa vektor telah membawa kedua virus tungro dan menularkannya pada bibit TN1. Vektor dapat memperoleh dan menularkan kedua virus tungro secara bersama-sama atau RTSV saja dan tidak dapat memperoleh dan menularkan RTBV jika tidak memperoleh RTSV sebelumnya (Choi
et al
., 2009).Rerata insidensi tungro hasil penularan dari setiap isolat virus tungro berkisar antara 70 - 100% (Tabel 1). Seluruh tanaman TN1 yang diinokulasi dengan isolat Jateng, Sulteng, Sulsel dan Bali menunjukkan gejala terinfeksi virus tungro, namun terjadi variasi penurunan tinggi tanaman dan nilai DI. Jika dibandingkan dengan kontrol, penurunan tinggi tanaman akibat infeksi isolat virus tungro berkisar antara 35 - 57%. Isolat Jateng dan Sulteng menyebabkan penurunan tinggi lebih dari 50% sehingga tanaman terlihat lebih kerdil dibandingkan dengan tanaman yang diinokulasi dengan isolat yang lain. Indeks penyakit tungro berkisar antara 6 - 9 dan isolat Jateng menyebabkan DI yang paling tinggi. Isolat Jateng, Sulteng, Sulsel dan Bali menyebabkan insidensi tungro yang sama namun penurunan tinggi dan DI berbeda. Namun sebaliknya, isolat DIY dan Sulsel menyebabkan penurunan tinggi dan DI yang sama tetapi insidensi tungro berbeda. Hal tersebut mengindikasikan bahwa masing-masing isolat mempunyai kemampuan menginfeksi yang berbeda.
8
a b
c d
e f
g h
Gambar 1. Gejala tungro pada TN1 setelah diinokulasi dengan isolat virus tungro dari beberapa daerah endemis: a) Jabar; b) Jateng; c) DIY; d) Sulteng; e) Sulbar; f) Sulsel; g) Bali dan h) NTB; K = Kontrol; 1 dan 2 = tanaman TN1 terinfeksi virus tungro
K 1 2 K 1 2
K 1 2 K 1 2
K 1 2 K 1 2
9 Tabel 1. Respons tanaman TN1 setelah diinokulasi dengan isolat virus tungro dari
beberapa daerah endemis
Isolat Tungro (%) Insidensi Tanaman (cm) Tinggi Penyakit Indeks
(DI) Gejala Jabar 90,00 16,83 7,15 ak, kh Jateng 100,00 12,60 9,00 k, kn DIY 70,25 19,23 6,35 ak, kh Sulteng 100,00 14,23 7,85 k, kn Sulbar 70,00 15,60 7,35 ak, kh Sulsel 100,00 19,20 6,35 ak, kh Bali 100,00 16,03 7,00 ak, kh NTB 90,25 17,73 6,85 ak, kh Kontrol 0,00 29,35 1,00 h
Keterangan: k = kerdil; ak = agak kerdil; kh = hijau kekuningan; kn = kuning; h = hijau
Setiap isolat virus tungro menunjukkan virulensi yang berbeda walaupun berasal dari sumber inokulum (varietas padi yang terinfeksi di setiap daerah endemis) yang sama. Isolat Jateng dan Sulteng menyebabkan gejala paling parah hingga tanaman menjadi kerdil dan berwarna kuning. Isolat dari daerah endemis yang lain menyebabkan tanaman menjadi agak kerdil dan variasi perubahan warna daun. Perbedaan tingkat keparahan gejala tersebut mengindikasikan adanya variasi virulensi virus tungro dari daerah endemis yang berbeda. Berdasarkan nilai DI, isolat Jateng merupakan isolat yang paling virulen, sedangkan isolat DIY dan Sulsel lebih rendah virulensinya dibandingkan dengan isolat yang lain.
Membedakan kemampuan dalam menginfeksi dan tingkat keparahan gejala yang ditimbulkan merupakan tahap yang diperlukan di dalam identifikasi keragaman virus tungro (Azzam and Chancellor, 2002). Perbedaan strain virus tungro merupakan salah satu faktor yang menyebabkan adanya variasi keparahan gejala tungro (Choi
et
al
., 2009). Variasi gejala dan respons tanaman menjadi dasar untuk menentukan strain virus tungro dari berbagai isolat yang berbeda. Hasil penularan isolat virus tungro dari Manukwari, Medan dan Serang pada varietas TN1 dan FK 135 menggunakan vektor koloni Subang juga menunjukkan adanya variasi virulensi antar isolat (Suprihantoet
al
., 2007). Oleh karena itu, informasi ketahanan dan kesesuaian varietas tahan terhadap masing-masing isolat virus tungro dari berbagai daerah endemis diperlukan sebagai dasar pengendalian dan perakitan varietas tahan tungro spesifik isolat.10 Berdasarkan tingkat keparahan gejala, ada indikasi bahwa terjadi variasi virulensi virus tungro dari daerah yang berbeda terhadap varietas tahan (Widiarta dan Kusdiaman, 2002). Beberapa varietas tahan tungro yang sudah dilepas seperti Tukad Petanu dianjurkan ditanam di seluruh daerah endemis, Tukad Unda terbatas di Nusa Tenggara Barat dan Sulawesi Selatan serta Tukad Balian hanya sesuai dikembangkan di Bali dan Sulawesi Selatan (Widiarta
et al.
, 2003). Hasil uji multilokasi varietas Tukad Petanu di beberapa daerah endemis menunjukkan adanya perbedaan virulensi virus tungro dari Bali, Jawa Barat dan Nusa Tenggara Barat (Choi, 2004).Di antara daerah endemis tungro, ada kemungkinan terdapat variasi genetik virus tungro, sehingga diperlukan beberapa varietas tahan dengan latar belakang genetik yang berbeda untuk menjaga durabilitas ketahanannya (Azzam and Canchellor, 2002). Oleh karena itu, perakitan varietas berdasarkan sumber gen tahan dan isolat virus tungro harus terus-menerus dilakukan (Hasanuddin
et al.,
2001), maka pengembangan varietas saat ini lebih ditekankan pada perakitan varietas tahan virus tungro berdasarkan kesesuaian antara tetua tahan dan virulensi virus tungro (Widiartaet al.,
2004), dan mempertimbangkan preferensi pengguna.B. Keragaman Molekuler Virus Tungro
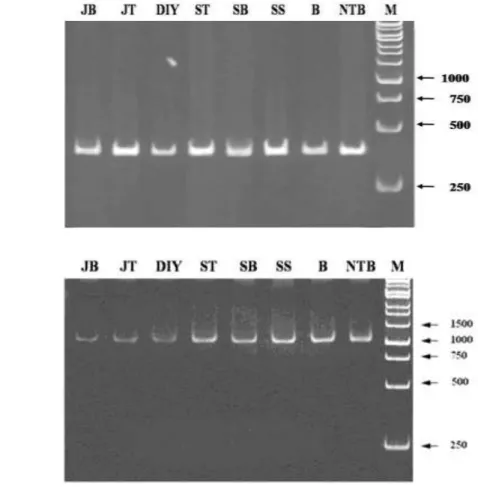
Hasil analisis PCR menunjukkan bahwa telah terdeteksi adanya RTBV dan RTSV pada setiap sampel tanaman TN1 hasil penularan yang bergejala tungro. Hasil analisis PCR ditunjukkan oleh adanya satu pita DNA dengan tingkat kejelasan dan ketebalan yang berbeda serta ukuran sesuai dengan target amplifikasi dari setiap primer. Keberadaan RTBV berdasarkan analisis PCR ditunjukkan oleh adanya satu pita DNA berukuran sekitar 430 bp yang konsisten teramplifikasi pada semua sampel (Gambar 2a). Berdasarkan sekuen lengkap RTBV di
DNA Data Bank of Japan
(DDBJ) nomor asesi M65026, target amplifikasi primer RTBV adalah sekuen basa nukleotida antara 576 – 1006 (bagian dari ORF 2). Demikian juga dengan analisis PCR untuk deteksi RTSV, telah dihasilkan satu pita DNA berukuran sekitar 1115 bp yang konsisten teramplifikasi pada semua sampel (Gambar 2b). Berdasarkan sekuen lengkap RTSV di DDBJ nomor asesi M95497, target amplifikasi primer RTSV adalah sekuen basa nukleotida antara 2494 – 3608 (bagian dari CP1-CP2). Kesesuaian antara posisi pita DNA pada PAGE dengan ukuran target amplifikasi menunjukkan bahwa analisis PCR menggunakan primer spesifik sangat sensitif dalam mendeteksi keberadaan RTBV dan RTSV di dalam tanaman terinfeksi. Deteksi virus tungro pada bibit tanaman dari11 persemaian dan vektor infektif dengan teknik PCR menggunakan primer spesifik terutama RTBV menunjukkan sensitifitas yang lebih tinggi dibandingkan dengan teknik ELISA (Takahashi
et al
., 1993). Keberhasilan dalam deteksi kedua virus tungro di dalam setiap sampel tanaman TN1 hasil penularan menunjukkan bahwa infeksi kedua virus tungro telah terjadi pada pertanaman di lapangan dan tanaman TN1 hasil penularan telah teinfeksi kedua virus tungro yang ditularkan oleh vektor hasil tangkapan dari lapangan.a
b
Gambar 2. Elektroforesis hasil analisis PCR beberapa isolat virus tungro pada PAGE: a) Pita DNA RTBV sebesar 430 bp hasil analisis PCR dengan primer RTBV; b) Pita DNA RTSV sebesar 1115 bp hasil analisis PCR dengan primer RTSV; JB = Jabar; JT = Jateng; DIY = DIY; ST = Sulteng; SS = Sulsel; SB = Sulbar; B = Bali; NTB = NTB dan M = Marker
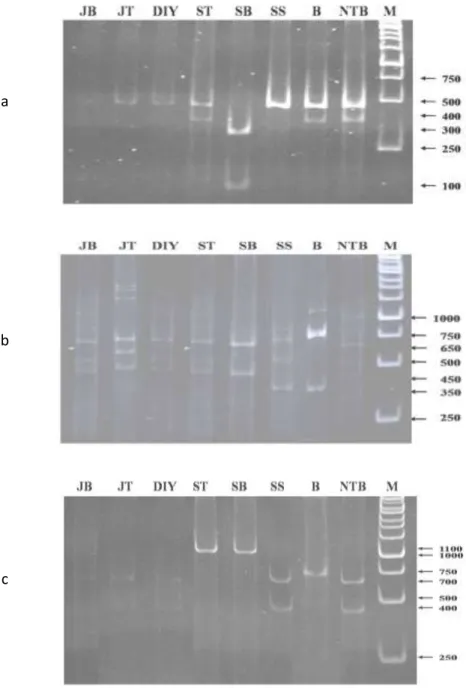
Hasil analisis RFLP dari DNA RTBV hasil PCR menunjukkan bahwa hanya empat isolat yang dapat dipotong oleh enzim
Dra
I yaitu Sulteng, Sulbar, Bali serta NTB dan masing-masing isolat tersebut terpotong menjadi 2 pita DNA (Gambar 3a). Berdasarkan sekuen target amplifikasi pada sekuen RTBV yang ada di DDBJ, enzim12
Dra
I dapat memotong sekuen tersebut menjadi dua bagian dengan ukuran masing-masing sekitar 130 bp dan 300 bp. Isolat Sulbar terpotong menjadi 2 pita DNA dengan ukuran sekitar 300 bp dan 100 bp, sedang isolat Sulteng, Bali dan NTB terpotong menjadi 2 pita dengan ukuran sekitar 400 bp dan satu pita sangat pendek sekitar 30 bp yang tidak terlihat pada PAGE.a
b
c
Gambar 3. Elektroforesis hasil analisis PCR-RFLP beberapa isolat virus tungro pada PAGE: a) DNA RTBV dengan enzim
Dra
I; b) DNA RTSV dengan enzimBstY
I; c) DNA RTSV dengan enzimHind
III; JB = Jabar; JT = Jateng; DIY = DIY; ST = Sulteng; SS = Sulsel; SB = Sulbar; B = Bali; NTB = NTB dan M = Marker13 Analisis RFLP menggunakan enzim
BstY
I terhadap DNA RTSV menghasilkan dua potongan pita DNA pada semua isolat (Gambar 3b). Ukuran dua potongan pita DNA isolat Sulsel dan Bali terlihat berbeda dengan isolat yang lain. Isolat Sulsel terpotong menjadi dua pita DNA berukuran sekitar 700 bp dan 400 bp serta isolat Bali sekitar 750 bp dan 350 bp. Sedangkan isolat yang lain terpotong menjadi dua pita DNA dengan ukuran sekitar 650 bp dan 450 bp. Berdasarkan sekuen target amplifikasi pada sekuen RTSV di DDBJ, enzimBstY
I dapat memotong menjadi dua atau tiga bagian dengan variasi ukuran, bahkan terdapat sekuen dari suatu isolat yang tidak terpotong. Demikian juga dengan hasil analisis RFLP menggunakan enzimHind
III yang menunjukkan bahwa terdapat dua isolat yang tidak terpotong yaitu Sulteng dan Sulbar (Gambar 3c). Isolat lainnya terpotong menjadi dua dengan ukuran sekitar 700 bp dan 400 bp kecuali dua potongan pita DNA isolat Bali berukuran sekitar 750 dan 350 bp. Hal tersebut sesuai dengan hasil analisis PCR-RFLP terhadap sekuen CP1 - CP2 pada beberapa kelompok isolat RTSV dari daerah endemis yang berbeda menggunakan kedua enzim yang sama. Hasil analisis menunjukkan bahwa enzimBstY
I dapat memotong sekuen tersebut menjadi dua atau tiga bagian dengan ukuran yang berbeda antar kelompok isolat dan terdapat kelompok isolat yang tidak dapat terpotong. Demikian juga dengan enzimHind
III, terdapat beberapa kelompok isolat yang tidak terpotong dan kelompok isolat yang terpotong menjadi dua bagian dengan ukuran yang sama antar kelompok isolat (Azzamet al
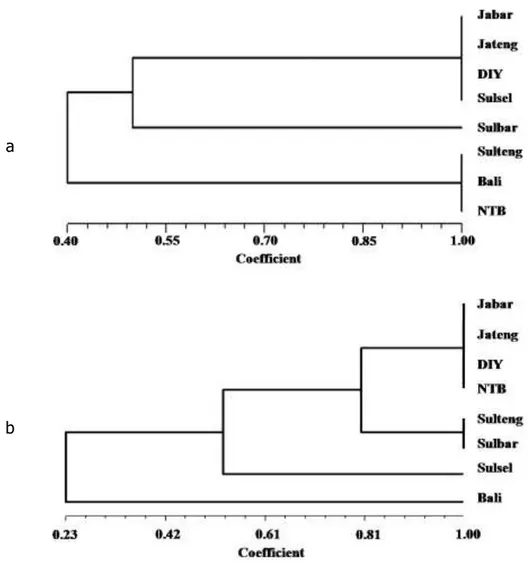
., 2000a). Keberadaan potongan pita DNA dengan ukuran yang berbeda antar isolat menunjukkan adanya keragaman baik RTBV maupun RTSV pada tingkat molekuler.Dendrogram kekerabatan isolat RTBV berdasarkan hasil analisis RFLP menunjukkan bahwa terdapat dua kelompok isolat RTBV sesuai dengan kedekatannya (Gambar 4a). Kelompok pertama terdiri dari isolat Jabar, Jateng, DIY, Sulsel dan Sulbar, sedangkan kelompok ke dua meliputi isolat Sulteng, Bali dan NTB. Dendrogram kekerabatan isolat RTSV berdasarkan hasil analisis RFLP menggunakan enzim
BstY
I danHind
III juga menunjukkan adanya dua kelompok isolat RTSV (Gambar 4b). Isolat Bali terpisah dari kelompok yang terdiri dari tujuh isolat yang lain dan ketujuh isolat tersebut terbagi menjadi tiga sub kelompok. Hal tersebut menunjukkan bahwa terdapat pola kekerabatan molekuler yang berbeda antara isolat RTBV dengan RTSV dari masing-masing daerah endemis.14 a
b
Gambar 4. Dendrogram kekerabatan molekuler beberapa isolat virus tungro berdasarkan analisis PCR-RFLP: a) RTBV; b) RTSV; JB = Jabar; JT = Jateng; DIY = DIY; ST = Sulteng; SS = Sulsel; SB = Sulbar; B = Bali dan NTB = NTB
Berdasarkan kelompok isolat pada dendrogram kekerabatan, keragaman molekuler isolat RTBV tidak secara tegas berkorelasi dengan perbedaan geografi. Terlihat bahwa isolat Sulsel berada di dalam satu kelompok dengan isolat Jabar, Jateng dan DIY. Demikian juga dengan isolat Sulteng, Bali dan NTB yang targabung di dalam satu kelompok. Sebaran isolat RTSV di dalam dendrogram kekerabatan menunjukkan adanya korelasi antara perbedaan geografi dengan keragaman molekuler secara lebih tegas kecuali isolat NTB. Terlihat bahwa hanya isolat NTB tergabung pada posisi yang sama dengan isolat Jabar, Jateng dan DIY. Hal tersebut mengindikasikan adanya kombinasi pada tingkat molekuler antara RTSV dan RTBV di beberapa daerah endemis dengan geografi yang berbeda. Keberadaan kelompok isolat RTBV yang secara tegas berbeda dari dua provinsi di Filipina dengan geografi yang berbeda yaitu Isabela dan
15 North Cotabato yang ditunjukkan oleh pola potongan pita DNA hasil analisis RFLP terhadap sekuen DNA utuh dari setiap isolat (Arboleda and Azzam, 2000). Analisis yang sama juga telah digunakan untuk menunjukkan adanya keragaman molekuler antar dan intra isolat RTBV dari empat provinsi di Filipina yaitu Polangui, Isabela, Davao dan Iloilo (Villegas
et al
., 1997).Analisis PCR-RFLP telah dilakukan terhadap sebagian sekuen ORF3 dan ORF4 pada enam isolat RTBV dari daerah endemis yang berbeda di India yaitu West Bengal, Tamil Nadu, Punjab, Andhra Pradesh, Orissa dan Assam menggunakan enzim
Mse
I (Joshiet al
., 2003), yang menunjukkan adanya keragaman molekuler antar isolat. Analisis PCR-RFLP juga dilakukan terhadap sekuen CP pada delapan isolat RTBV dari daerah yang berbeda di Indonesia yaitu Jabar-1, Jabar-2, Jateng, Jatim, Bali, NTB, Kalsel dan Sulsel menggunakan enzimEcoR
V danPst
I (Suprihanto, 2005), serta isolat dari tiga daerah endemis yang berbeda yaitu Medan, Serang dan Manukwari menggunakan enzimEcoR
V,Nsi
I danPst
I yang menunjukkan adanya keragaman pada tingkat molekuler antar isolat (Suprihantoet al
., 2007). Demikian juga dengan RTSV, analisis PCR-RFLP terhadap sekuen CP1 - CP2 pada kelompok isolat RTSV dari dua provinsi di Filipina yaitu North Cotabato dan Nueva Ecija serta kelompok isolat dari dua daerah endemis di Indonesia yaitu Bali dan Subang menggunakan enzimBstY
I danHind
III yang menunjukkan adanya keragaman molekuler antar kelompok isolat (Azzamet al
., 2000a).Keragaman molekuler RTBV dan RTSV berdasarkan analisis PCR-RFLP dapat menjadi dasar untuk deteksi dan pemantauan penyebaran virus tungro. Pola potongan pita DNA pada masing-masing isolat dapat digunakan sebagai penanda (
marker
) di dalam identifikasi keragaman isolat di daerah endemis yang sama ataupun di daerah baru yang tidak ada serangan sebelumnya, dari musim ke musim dan pada berbagai jenis varietas yang terserang. Perubahan komposisi dan keragaman genetik RTBV dan RTSV telah diamati pada musim kemarau dan musim hujan di suatu daerah terserang di Filipina (Azzamet al
., 2000b). Keragaman isolat RTBV di daerah yang sama telah terdeteksi melalui analisis PCR-RFLP dengan waktu pengambilan sampel dan dari jenis varietas yang berbeda (Joshiet al
., 2003). Analisis PCR-RFLP biasa digunakan untuk mendeteksi atau membuktikan adanya mutasi spesifik padarestriction site
yang ditambahkan atau dihilangkan setelah diketahui peta restriksi sekuen DNA hasil PCR yang akan dianalisis (McPherson and Moller, 2006).16 A. Keragaman Molekuler dan Virulensi Virus Tungro
Keragaman molekuler virus tungro berdasarkan analisis PCR-RFLP menunjukkan bahwa terdapat dua kelompok isolat RTBV dan RTSV. Pola kekerabatan yang terbentuk tidak memperlihatkan adanya hubungan antara keragaman molekuler dengan virulensi masing-masing isolat. Isolat Jateng merupakan isolat paling virulen, namun baik RTBV maupun RTSV isolat Jateng secara konsisten tergabung dalam satu kelompok dengan isolat Jabar dan DIY yang lebih rendah virulensinya. Demikian juga dengan isolat Sulteng dan NTB yang tergabung dalam satu kelompok walaupun virulensi kedua isolat tersebut berbeda.
Pola potongan pita DNA yang terbentuk juga tidak dapat membedakan antara isolat paling virulen dengan isolat yang lebih rendah virulensinya ataupun antara isolat dengan virulensi yang sama. Potongan pita DNA pada isolat Jateng sama dengan isolat Jabar dan DIY yang berlawanan tingkat virulensinya. Isolat DIY dan Sulsel mempunyai virulensi yang sama tetapi terdapat dua pita DNA yang berbeda pada masing-masing isolat (Tabel 2). Hal tersebut menunjukkan bahwa pola potongan pita DNA hasil analisis PCR-RFLP dari ORF2 pada RTBV serta CP1 - CP2 pada RTSV tidak berhubungan dengan virulensi masing-masing isolat. Diketahui bahwa ORF2 serta CP2 - CP2 hanya sebagian dari genom RTBV dan RTSV. Diduga bahwa, virulensi berhubungan dengan interaksi bagian tersebut dengan bagian-bagian fungsional yang lain dari genom RTBV dan RTSV. Oleh karena itu, diperlukan amplifikasi bagian genom yang lain dan dianalisis menggunakan enzim yang disesuaikan dengan peta restriksi dari sekuen isolat virus tungro yang telah teridentifikasi.
Tabel 2. Potongan pita DNA hasil analisis PCR-RFLP dan virulensi virus tungro dari beberapa daerah endemis
Isolat RTBV RTSV Virulensi
DraI
(bp)BstY
I (bp)Hind
III (bp) DIJabar Jateng DIY Sulteng Sulbar Sulsel Bali NTB 430 430 430 400; 30 330; 100 430 330; 100 330; 100 650; 450 650; 450 650; 450 650; 450 650; 450 700; 400 750; 350 650; 450 700; 400 700; 400 700; 400 1100 1100 700; 400 750; 350 700; 400 7,15 9,00 6,35 7,85 7,35 6,35 7,00 6,85 Keterangan:
Dra
I,BstY
I danHind
III = enzim restriksi; DI = indeks penyakit17 Namun demikian, korelasi antara keragaman molekuler dengan virulensi tidak bisa hanya dilihat dari salah satu virus tungro saja, karena keparahan gejala ditentukan oleh infeksi kedua virus tungro. Oleh karena itu, kekerabatan molekuler antar isolat virus tungro tidak berkorelasi dengan virulensi. Hasil analisis sekuen gen CP pada RTSV strain Vt6 dan A-Shen yang sangat berlawanan virulensinya menunjukkan bahwa CP pada kedua strain tersebut tidak berkorelasi dengan virulensi (Isogai
et al
., 2000). Persentase kesamaan basa nukleotida dan asam amino dari ORF2 antara RTBV isolat Filipina dan G2 adalah 100%, namun masing-masing dapat menimbulkan gejala yang berbeda. Lain halnya dengan RTBV strain G1 dan Ic, bahwa dalam genom keduanya hanya terdapat sedikit variasi basa nukleotida, namun penularan masing-masing strain tersebut dengan vektor dan RTSV yang sama pada varietas FK 135 menghasilkan gejala yang berbeda (Cabauatanet al
., 1999). Perbedaan tipe dan tingkat keparahan gejala dapat disebabkan oleh beberapa isolatCauliflower mosaic virus
(CaMV) dengan perbedaan sekuen basa nukleotida antar isolat sebesar 5% (Frischmuth, 2002).Diduga bahwa virulensi virus tungro melibatkan interaksi sejumlah gen dalam genom virus tungro serta interaksi yang sangat kompleks antara kedua partikel virus tungro. Virulensi virus dapat ditentukan oleh beberapa gen yang terekspresi secara bersama-sama (Valkonen, 2002). Perbedaan sejumlah asam amino antara isolat perlu dibuktikan apakah terdapat korelasi dengan virulensi melalui penelitian lebih lanjut. Diduga dapat ditemukan lagi sejumlah basa nukleotida yang berbeda di sepanjang bagian genom lainnya pada masing-masing isolat sehingga memungkinkan adanya perbedaan sejumlah asam amino. Oleh karena itu, analisis sekuen pada bagian genom yang lain dari setiap isolat diperlukan untuk memperoleh data keragaman molekuler virus tungro yang lebih lengkap.
Kesimpulan
Virulensi virus tungro bervariasi di antara daerah endemis di Indonesia. Isolat Jateng merupakan isolat paling virulen dan tidak semua isolat virus tungro dari daerah endemis di pulau Jawa mempunyai virulensi yang lebih tinggi dibanding isolat dari luar Jawa. Virus tungro dari beberapa daerah endemis di Indonesia teridentifikasi beragam pada tingkat molekular. Keragaman dan hubungan kekerabatan molekular virus tungro tidak berkorelasi dengan perbedaan geografi daerah endemis dan virulensi. Pola
18 potongan pita DNA hasil analisis PCR-RFLP dapat digunakan sebagai penanda di dalam deteksi keragaman isolat virus tungro di daerah endemis yang lain maupun di beberapa daerah dalam satu provinsi atau pulau tertentu untuk mengetahui komposisi populasi virus tungro.
Daftar Pustaka
Angeles ER, Cabunagan RC, Tabien RE and Khush GS. 2008. Resistance to tungro vectors and viruses. p. 117-141.
In
Tiongco, E.R., E.R. Angeles and L.S. Sebastian (ed.),Rice tungro virus disease: a paradigm in disease management
. Science City of Munoz, Nueva Ecija: Philippine Rice Research Institute and Honda Research Institute Japan Co. Ltd., 2008.Arboleda, M. and O. Azzam. 2000. Inter- and intra-site genetic diversity of natural field populations of rice tungro bacilliform virus in the Philippines.
Archives of
Virology
, 145: 275-289.Azzam, O., M.L.M. Yambao, M. Muhsin, K. L. McNally and K. M. L. Umadhay. 2000a. Genetic diversity of rice tungro spherical virus in tungro-endemic provinces of the Philippines and Indonesia.
Archives of Virology
, 145: 1183-1197.Azzam, O., M. Arboleda, K. M. L. Umadhay, J. B. de los Reyes, F. S. Cruz, A. Mackenzie, and K. L. McNally. 2000b. Genetic composition and complexity of virus populations at tungro-endemic and outbreak rice sites.
Archives of
Virology
, 145: 2643-2657.Azzam, O. and T.C.B. Chancellor. 2002. The biology, epidemiology and management of rice tungro disease in Asia.
Plant Disease
, 86: 88-100.Cabauatan, P.Q., U. Melcher, K. Ishikawa, T. Omura, H. Hibino, H. Koganezawa and O. Azzam. 1999. Sequence changes in six variants of rice tungro bacilliform virus and their phylogenetic relationships.
Journal of General Virology,
80: 2229-2237.Calleja, D.O. 2010. Water shortage due to El Niño breeds „tungro‟ in rice plantations.
http://balita.ph/2010/02/17/tungro-rice-disease-alert-up-in-bicol/. Diunduh pada 20 Januari 2012.
Choi, R.I. 2004. Current Status of Rice Tungro Disease Research and Future Program. p. 3-14.
In
A. Hasanuddin, I.N. Widiarta dan Sunihardi (eds.),Strategi
Pengendalian Penyakit Tungro: Status dan Program
.Prosiding Seminar Nasional
Status Program Penelitian Tungro Mendukung Keberlanjutan Produksi Padi
Nasional
. Makassar, 7–8 September 2004.Choi. I.R., P.Q. Cabauatan and R.C. Cabunagan. 2009. Rice Tungro Disease.
Rice Fact
Sheet
, IRRI, Sep. 2009: 1-4.19 Deng, Z.N., A. Gentile, E. Nicolosi, E. Domina, A. Vardi and E. Tribulato. 1995. Identification on in vivo and in vitro lemon mutans by RAPD markers.
Journal
Horticultural Science,
70(1): 117-125.Du, P.V., R.C. Cabunagan and I.R. Choi. 2005. Rice “yellowing syndrome” in Mekong river delta.
Omonrice
, 13: 135-138.Frischmuth, T. 2002. Recombination in Plant DNA Viruses. p. 339-363.
In
Khan, J.A. and J. Diikstra (ed.),Plant Viruses As Molecular Pathogens
. The Haworth Press. Inc. 2002.Hasanuddin, A., I.N. Widiarta dan M. Muhsin. 2001. Penelitian teknik eliminasi sumber inokulum RTSV: Suatu strategi pengendalian tungro.
Laporan
Riset Unggulan Terpadu IV. Kantor Menristek dan DRN.IRRI. 1996.
Standard Evaluasi System for Rice
. Los Banos, Philippines. 52 p.Isogai, M., P.Q. Cabauatan, C. Masuta, I. Uyeda and O. Azzam. 2000. Complete nucleotide sequence of rice tungro spherical virus genome of the highly virulent strain Vt6.
Virus Genes
, 20(1): 79-85.Joshi, R., V. Kumar and I. Dasgupta. 2003. Detection of molecular variability in rice tungro bacilliform viruses from India using polymerase chain reaction-restriction fragment length polymorphism.
Journal of Virological Methods
, 109: 89-93. Kusprayogie, Y., U. Nuzulullia dan D.R. Gabriel. 2011. Prakiraan Serangan OPT UtamaPadi pada MT 2011/2012.
Buletin Peramalan OPT
, Vol.11/No.2/ Edisi XIII /Okt./2011.McPherson, M.J. and S. G. Moller. 2006.
PCR
, Second Edition. Taylor & Francis Group. 305 p.Muralidharan, K., D. Krishnaveni, N.V.L. Rajarajeswari and A.S.R. Prasad. 2003. Tungro epidemics and yield losses in paddy fields in India.
Current Science
, 85(8):1143-1147.Raga, I.N. 2008. Perkembangan Dan Penyebaran Penyakit Tungro Di Indonesia.
Prosiding
Seminar Nasional Penyakit Tungro: Revitalisasi Strategi Pengendalian
Penyakit Tungro Mendukung Upaya Peningkatan Produksi Beras Nasional
, Makassar, 5-6 September 2007.Suprihanto. 2005. Diferensiasi beberapa isolat rice tungro virus dengan kultivar padi diferensial dan PCR-RFLP.
Tesis
. Fakultas Pertanian, Institut Pertanian Bogor. Suprihanto, I.N. Widiarta dan D. Kusdiaman. 2007. Virulensi Virus Tungro dari TigaDaerah Endemis di Indonesia.
Prosiding
Seminar Apresiasi Hasil Penelitian Padi Menunjang P2BN 2007.20 Suranto. 2004. Pengelolaan Virus Tungro Melalui Pendekatan Bioteknologi. Status dan Program Penelitian Pengendalian Terpadu Penyakit Tungro. p. 15-25.
In
A. Hasanuddin, I.N. Widiarta dan Sunihardi (eds.),Strategi Pengendalian Penyakit
Tungro: Status dan Program
,Prosiding Seminar Nasional Status Program
Penelitian Tungro Mendukung Keberlanjutan Produksi Padi Nasional
. Makassar, 7–8 September 2004Takahashi, Y., F.R.Tiongco, P.Q. Cabauatan, H. Koganezawa, H. Hibino and T. Omura. 1993. Detection of Rice Tungro Bacilliform Virus by Polymerase Chain Reaction for Assessing Mild Infection of Plants and Viruliferous Vector Leafhoppers.
Phytopathology,
83(6): 655-659.Valkonen, J.P.T. 2002. Natural Resistance to Viruses. p. 367-397.
In
Khan, J.A. and J. Diikstra (ed.),Plant Viruses As Molecular Pathogens
. The Haworth Press. Inc., 2002.Villegas, L.C., A. Druka, N.B. Bajet and R. Hull. 1997. Genetic Variation of Rice Tungro Bacilliform Virus in the Philippines.
Virus Genes
, 15(3): 195-201.Widiarta, I.N., Yulianto dan A. Hasanuddin. 2003. Pengendalian terpadu penyakit tungro dengan strategi eliminasi peranan virus bulat. Kebijakan Perberasan dan Inovasi Teknologi Padi. Puslitbangtan. Balitpa. Hal.: 513-527.
Widiarta, I.N., Burhanuddin, A.A. Daradjat, dan A. Hasanuddin. 2004. Status dan Program Penelitian Pengendalian Terpadu Penyakit Tungro. p. 61-89.