IKATAN KIMIA
MAKALAH KIMIA DASAR
dibuat sebagai salah satu syarat untuk memperoleh nilai mata kuliah kimia dasar
Oleh :
AZKA WAFI EL HAKIM ( NPM : 230210140008 ) HELGA RACHEL F ( NPM : 230210140014 ) MUHAMMAD KEMAL P. ( NPM : 230210140045 ) LISMA MAHESHA AMANDA ( NPM : 230210140047 )
Prodi Ilmu Kelautan
Fakultas Perikanan dan Ilmu Kelautan
UNIVERSITAS PADJAJARAN
2014
BAB I
PENDAHULUAN
1.1 Latar Belakang
Ilmu kimia dapat didefinisikan sebagai ilmu yang mempelajari segala sesuatu tentang materi, seperti hakekat, susunan, sifat-sifat, perubahan serta energi yang menyertai perubahannya.
Di alam sendiri banyak ditemukan zat, baik berupa unsur maupun senyawa. Keberadaan zat tersebut sangat ditentukan oleh kestabilan zat itu sendiri. Jika suatu zat stabil maka kita akan menemukannya dalam bentuk unsur bebas, namun jika zat itu tidak stabil maka kita akan menemukannya dalam bentuk senyawa. Suatu atom bergabung dengan atom lainnya melalui ikatan kimia sehingga dapat membentuk senyawa, baik senyawa kovalen maupun senyawa ion. Senyawa ion terbentuk melalui ikatan ion, yaitu ikatan yang terjadi antara ion positif, yaitu atom yang melepaskan elektron dan ion negatif, yaitu atom yang menangkap elektron. Akibatnya, senyawa ion yang terbentuk bersifat polar.
Ternyata unsur dan senyawa tersebut dapat bersatu karena gaya tarik-menarik antara atom dan dapat disebut Ikatan Kimia. Dari kekuatan gaya tarik-menarik inilah menentukan sifat-sifat kimia dari suatu zat. Cara ikatan kimia berubah jika suatu zat bereaksi digunakan untuk mengetahui jumlah energi yang diserap selama terjadinya reaksi.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah disampaikan, telah ditetapkan rumusan masalah sebagai berikut :
Apa yang dimaksud dengan ikatan kimia ?
Mengapa ikatan kimia begitu penting dalam kimia ? Bagaimana bentuk ikatan kimia ?
1.3 Tujuan
Sesuai dengan rumusan masalah diatas, tujuan dibuatnya makalah ini adalah : Mempelajari lebih dalam tentang ikatan kimia
BAB II
PEMBAHASAN
IKATAN KIMIA
1. Pengertian Ikatan Kimia
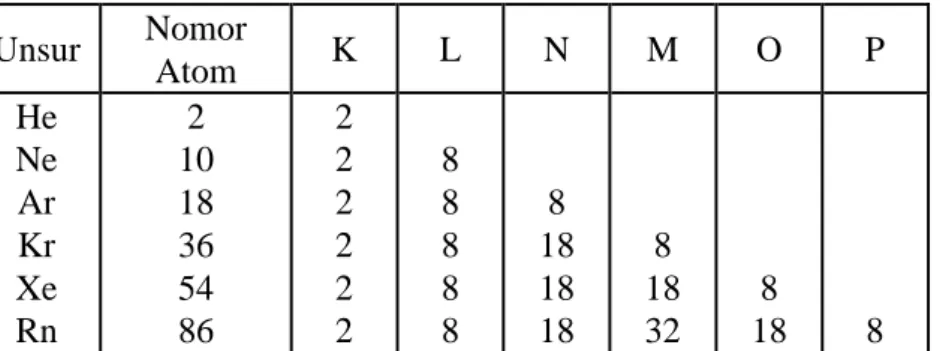
Antara dua atom atau lebih dapat saling berinteraksi dan membentuk molekul. Interaksi ini selalu disertai dengan pelepasan energi. Adapun gaya-gaya yang menahan atom-atom dalam molekul merupakan suatu ikatan yang dinamakan ikatan kimia. Ikatan kimia terbentuk karena unsur-unsur cenderung membentuk struktur elektron stabil. Struktur elektron stabil yaitu struktur elektron gas mulia ( Golongan VIII A ) Seperti dalam tabel 3.1 berikut.
Unsur Nomor Atom K L N M O P He Ne Ar Kr Xe Rn 2 10 18 36 54 86 2 2 2 2 2 2 8 8 8 8 8 8 18 18 18 8 18 32 8 18 8
Walter Kossel dan Gilbert Lewis pada tahun 1916 menyatakan bahwa terdapat hubungan antara stabilnya gas mulia dengan cara atom berikatan. Mereka mengemukakan bahwa jumlah elektron terluar dari dua atom yang berikatan, akan berubah sedemikian rupa sehingga susunan kedua elektron kedua atom tersebut sama dengan susunan gas mulia. Kecenderungan atom-atom untuk memiliki struktur atau konfigurasi elektron gas mulia atau 8 elektron pada kulit terluar disebut kaidah Oktet.
Contoh: Br + Br Br Br Atau Br - Br
Sementara itu, atom-atom yang mempunyai nomor atom kecil dari hidrogen sampai dengan boron cenderung memiliki konfigurasi elektron gas helium atau mengikuti kaidah Duplet.
Elektron yang berperan dalam reaksi kimia yaitu elektron pada kulit terluar atau elektron valensi. Elektron valensi menunjukan kemampuan suatu atom untuk berikan dengan atom lain. Contoh elektron valensi dari beberapa unsur dapat dilihat dalam tabel berikut. Tabel 3.2 Elektron Valensi Beberapa Unsur
Unsur Susunan elektron Elektron valensi 6C 8O 12Mg 13Al 15P 17Cl 2.4 2.6 2.8.2 2.8.3 2.8.5 2.8.7 4 6 2 3 5 7
Unsur – unsur dari golongan alkali dan alkali tanah, untuk menyamai kestabilan cenderung melepaskan elektron terluarnya sehingga membentuk ion positif. Unsur – unsur yang mempunyai kecenderungan membentuk ion positif termasuk unsur elektropositif. Unsur – unsur dari golongan halogen dan khalkhogen mempunyai kecenderungan menangkap elektron untuk mencapai kestabilan sehingga membentuk ion negatif. Unsur - unsur yang demikian termasuk unsur elektronegatif.
A. Jenis-Jenis Ikatan Kimia
Ikatan kimia merupakan sebuah proses fisika yang bertanggungung jawab dalam gaya interaksi tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Secara umum, ikatan kimia dapat digolongkan menjadi dua jenis, yaitu:
1. IKATAN ANTAR ATOM a. Ikatan ion = heteropolar
Ikatan ionik adalah sebuah gaya elektrostatik yang mempersatukan ion-ion dalam suatu senyawa ionik. Ion-ion yang diikat oleh ikatan kimia ini terdiri dari kation dan juga anion. Kation terbentuk dari unsur-unsur yang memiliki energi ionisasi rendah dan biasanya terdiri dari logam-logam alkali dan alkali tanah. Sementara itu, anion cenderung terbentuk dari unsur-unsur yang memiliki afinitas elektron tinggi, dalam hal ini unsur-unsur golongan halogen dan oksigen. Oleh karena itu, dapat dikatakan bahwa ikatan ion sangat dipengaruhi oleh besarnya beda keelektronegatifan dari atom-atom pembentuk senyawa tersebut. Semakin besar beda keelektronegatifannya, maka ikatan ionik yang dihasilkan akan semakin kuat. Ikatan ionik tergolong ikatan kuat, dalam hal ini memiliki energi ikatan yang kuat sebagai akibat dari perbedaan keelektronegatifan ion penyusunnya. Pembentukan ikatan ionik dilakukan dengan cara transfer elektron. Dalam hal ini, kation terionisasi dan melepaskan sejumlah elektron hingga mencapai jumlah oktet yang disyaratkan dalam aturan Lewis.
Sifat-Sifat ikatan ionik adalah:
a. Bersifat polar sehingga larut dalam pelarut polar b. Memiliki titik leleh yang tinggi
c. Baik larutan maupun lelehannya bersifat elektrolit Contoh : Pembentukan NaCl
b. Ikatan kovalen = homopolar
Ikatan kovalen merupakan ikatan kimia yang terbentuk dari pemakaian elektron bersama oleh atom-atom pembentuk ikatan. Ikatan kovalen biasanya terbentuk dari unsur-unsur non logam. Dalam ikatan kovalen, setiap elektron dalam pasangan tertarik ke dalam
nukleus kedua atom. Tarik menarik elektron inilah yang menyebabkan kedua atom terikat bersama.
Ikatan kovalen terjadi ketika masing-masing atom dalam ikatan tidak mampu memenuhi aturan oktet, dengan pemakaian elektron bersama dalam ikatan kovalen, masing-masing atom memenuhi jumlah oktetnya. Hal ini mendapat pengecualian untuk atom H yang menyesuaikan diri dengan konfigurasi atom dari yang tidak terlibat dalam ikatan kovalen disebut elektron bebas. Elektron bebas ini berpengaruh dalam menentukan bentuk dan geometri molekul.
Ada beberapa jenis ikatan kovalen yang semuanya bergantung pada jumlah pasangan elektron yang terlibat dalam ikatan kovalen.
Ikatan tunggal merupakan ikatan kovalen yang terbentuk 1 pasangan elektron. Contoh dari Ikatan Kovalen Tunggal, pembentukan molekul hidrogen :
(sumber: jejaringkimia.blogspot.com)
Ikatan rangkap 2 merupakan ikatan kovalen yang terbentuk dari dua pasangan elektron. Contohnya pembentukan molekul O2
Ikatan rangkap 3 yang terdiri dari 3 pasangan elektron. Contohnya pembentukan N2 (gas nitrogen).
Ikatan rangkap memiliki panjang ikatan yang lebih pendek daripada ikatan tunggal. Selain itu terdapat juga bermacam-macam jenis ikatan kovalen lain seperti ikatan sigma, pi, delta, dan lain-lain.
Senyawa kovalen dapat dibagi mejadi senyawa kovalen polar dan non polar. Pada senyawa kovalen polar, atom-atom pembentuknya mempunyai gaya tarik yang tidak sama terhadap elektron pasangan persekutuannya. Hal ini terjadi karena beda keelektronegatifan
antara atom-atom penyusunnya. Akibatnya terjadi pemisahan kutub positif dan negatif. Sementara itu pada senyawa kovalen non-polar titik muatan negatif elekton persekutuan berhimpit karena beda keelektronegatifan yang kecil atau tidak ada.
Contoh :
c. Ikatan kovalen koordinasi = semipolar
Ikatan kovalen koordinasi merupakan ikatan kimia yang terjadi apabila pasangan elektron bersama yang dipakai oleh kedua atom disumbangkan oleh salah satu atom saja. Sementara itu atom yang lain hanya berfungsi sebagai penerima elektron berpasangan saja. Syarat-syarat terbentuknya ikatan kovalen koordinasi :
Salah satu atom memiliki pasangan elektron bebas
Atom yang lainnya memiliki orbital kosong
Susunan ikatan kovalen koordinasi sepintas mirip dengan ikatan ion, namun kedua ikatan ini berbeda oleh karena beda keelektronegatifan yang kecil pada ikatan kovalen koordinasi sehingga menghasilkan ikatan yang cenderung mirip kovalen. Contohnya Pembentukan NH4+
d. Ikatan Logam
Ikatan logam merupakan salah satu ciri khusus dari logam, pada ikatan logam ini elektron tidak hanya menjadi miliki satu atau dua atom saja, melainkan menjadi milik dari semua atom yang ada dalam ikatan logam tersebut. Elektron-elektron dapat terdelokalisasi sehingga dapat bergerak bebas dalam awan Elektron-elektron yang mengelilingi atom-atom logam. Akibat dari elektron yang dapat bergerak bebas ini adalah sifat logam yang dapat menghantarkan listrik dengan mudah. Ikatan logam ini hanya ditemui pada ikatan yang seluruhnya terdiri dari atom unsur-unsur logam semata. Contohnya :
sumber : mulyadit.wordpress.com 2. IKATAN ANTAR MOLEKUL
a. Ikatan Hidrogen
Ikatan hidrogen merupakan gaya tarik menarik antara atom H dengan atom lain yang mempunyai keelektronegatifan besar pada satu molekul dari senyawa yang sama. Ikatan hidrogen merupakan ikatan yang paling kuat dibandingkan dengan ikatan antar molekul lain, namun ikatan ini masih lebih lemah dibandingkan dengan ikatan kovalen maupun ikatan ion. Ikatan hidrogen ini terjadi pada ikatan antara atom H dengan atom N, O, dan F yang memiliki pasangan elektron bebas. Hidrogen dari molekul lain akan bereaksi dengan pasangan elektron bebas ini membentuk suatu ikatan hidrogen dengan besar ikatan bervariasi. Kekuatan ikatan hidrogen ini dipengaruhi oleh beda keelektronegatifan dari atom-atom penyusunnya. Semakin besar perbedaannya semakin besar pula ikatan hidrogen yang dibentuknya.
Kekuatan ikatan hidrogen ini akan mempengaruhi titik didih dari senyawa tersebut. Semakin besar perbedaan keelektronegatifannya maka akan semakin besar titik didih dari senyawa tersebut. Namun, terdapat pengecualian untuk H2O yang memiliki dua ikatan
hidrogen tiap molekulnya. Akibatnya, titik didihnya paling besar dibanding senyawa dengan ikatan hidrogen lain, bahkan lebih tinggi dari HF yang memiliki beda keelektronegatifan terbesar. Contohnya :
b. Ikatan van der walls
Gaya Van Der Walls dahulu dipakai untuk menunjukan semua jenis gaya tarik menarik antar molekul. Namun kini merujuk pada gaya-gaya yang timbul dari polarisasi molekul menjadi dipol seketika. Ikatan ini merupakan jenis ikatan antar molekul yang terlemah, namun sering dijumpai diantara semua zat kimia terutama gas. Pada saat tertentu, molekul-molekul dapat berada dalam fase dipol seketika ketika salah satu muatan negatif berada di sisi tertentu. Dalam keadaan dipol ini, molekul dapat menarik atau menolak elektron lain dan menyebabkan atom lain menjadi dipol. Gaya tarik menarik yang muncul sesaat ini merupakan gaya Van der Walls.
3. TEORI ORBITAL MOLEKUL
Teori Ikatan Valensi mampu secara kualitatif menjelaskan kestabilan ikatan kovalen sebagai akibat tumpang-tindih orbital-orbital atom. Dengan konsep hibridisasi pun dapat .sayangnya dalam beberapa kasus, teori ikatan valensi tidak dapat menjelaskan sifat-sifat molekul yang tramati secara memuaskan. Contohnya adalah molekul oksigen, yang struktur Lewisnya sebagai berikut.
Menurut gambaran struktur Lewis Oksigen di atas, semua elektron pada O2
berpasangan dan molekulnya seharusnya bersifat diamagnetik, namun kenyataannya, menurut hasil percobaan diketahui bahwa Oksigen bersifat paramagnetik dengan dua elektron tidak berpasangan. Temuan ini membuktikan adanya kekurangan mendasar dalam teori ikatan valensi.
Sifat magnet dan sifat-sifat molekul yang lain dapat dijelaskan lebih baik dengan menggunakan pendekatan mekanika kuantum yang lain yang disebut sebagai teori orbital molekul (OM), yang menggambarkan ikatan kovalen melalui istilah orbital molekul yang dihasilkan dari interaksi orbital-orbital atom dari atom-atom yang berikatan dan yang terkait dengan molekul secara keseluruhan.
Menurut teori OM, tumpang tindih orbital 1s dua atom hidrogen mengarah pada pembentukan dua orbital molekul, satu orbital molekul ikatan dan satu orbital molekul antiikatan. Orbital molekul ikatan memiliki energi yang lebih rendah dan kestabilan yang lebih besar dibandingkan dengan orbital atom pembentuknya. Orbital molekul antiikatan memiliki energi yang lebih besar dan kestabilan yang lebih rendah dibandingkan dengan orbital atom pembentuknya. Penempatan elektron dalam orbital molekul ikatan menghasilkan ikatan kovalen yang stabil, sedangkan penempatan elektron dalam orbital molekul antiikatan menghasilkan ikatan kovalen yang tidak stabil.
Dalam orbital molekul ikatan kerapatan elektron lebih besar di antara inti atom yang berikatan. Sementara, dalam orbital molekul antiikatan, kerapatan elektron mendekati nol diantara inti. Perbedaa ini dapat dipahami bila kita mengingat sifat gelombang pada elektron. Gelombang dapat berinteraksi sedemikian rupa dengan gelombang lain membentuk interferensi konstruktif yang memperbesar amplitudo, dan juga interferensi destruktif yang meniadakan amplitudo.
Pembentukan orbital molekul ikatan berkaitan dengan interferensi konstruktif, sementara pembentukan orbital molekul antiikatan berkaitan dengan interferensi destruktif. Jadi, interaksi konstruktif dan interaksi destruktif antara dua orbital 1s dalam molekul H2 mengarah pada pembentukan ikatan sigma (σ1s) dan pembentukan antiikatan sigma (σ*1s).
4. HIBRIDISASI
Dalam kimia, hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul. Konsep ini adalah bagian tak terpisahkan dari teori ikatan valensi. Walaupun kadang-kadang diajarkan bersamaan dengan teori VSEPR, teori ikatan valensi dan hibridisasi sebenarnya tidak ada hubungannya sama sekali dengan teori VSEPR.
a. Sejarah perkembangan
Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling, dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.
Teori hibridisasi tidaklah sepraktis teori orbital molekul dalam hal perhitungan kuantitatif. Masalah-masalah pada hibridisasi terlihat jelas pada ikatan yang melibatkan orbital d, seperti yang terdapat pada kimia koordinasi dan kimia organologam. Walaupun skema hibridisasi pada logam transisi dapat digunakan, ia umumnya tidak akurat.
Sangatlah penting untuk dicatat bahwa orbital adalah sebuah model representasi dari tingkah laku elektron-elektron dalam molekul. Dalam kasus hibridisasi yang sederhana, pendekatan ini didasarkan pada orbital-orbital atom hidrogen. Orbital-orbital yang terhibridisasikan diasumsikan sebagai gabungan dari orbital-orbital atom yang bertumpang tindih satu sama lainnya dengan proporsi yang bervariasi. Orbital-orbital hidrogen digunakan sebagai dasar skema hibridisasi karena ia adalah salah satu dari sedikit orbital yang persamaan Schrödingernya memiliki penyelesaian analitis yang diketahui. Orbital-orbital ini kemudian diasumsikan terdistorsi sedikit untuk atom-atom yang lebih berat seperti karbon, nitrogen, dan oksigen. Dengan asumsi-asumsi ini, teori hibridisasi barulah dapat diaplikasikan. Perlu dicatat bahwa kita tidak memerlukan hibridisasi untuk menjelaskan molekul, namun untuk molekul-molekul yang terdiri dari karbon, nitrogen, dan oksigen, teori hibridisasi menjadikan penjelasan strukturnya lebih mudah.
Teori hibridisasi sering digunakan dalam kimia organik, biasanya digunakan untuk menjelaskan molekul yang terdiri dari atom C, N, dan O (kadang kala juga P dan S). Penjelasannya dimulai dari bagaimana sebuah ikatan terorganisasikan dalam metana.
Hibridisasi menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom. Untuk sebuah karbon yang berkoordinasi secara tetrahedal (seperti metana, CH4), maka karbon haruslah memiliki orbital-orbital yang memiliki simetri yang tepat dengan 4 atom hidrogen. Konfigurasi keadaan dasar karbon adalah 1s2 2s2 2px1 2py1.
b. Teori hibridisasi vs. Teori orbital molekul
Teori hibridisasi adalah bagian yang tak terpisahkan dari kimia organik dan secara umum didiskusikan bersama dengan teori orbital molekul dalam buku pelajaran kimia organik tingkat lanjut. Walaupun teori ini masih digunakan secara luas dalam kimia organik, teori hibridisasi secara luas telah ditinggalkan pada kebanyakan cabang kimia lainnya. Masalah dengan teori hibridisasi ini adalah kegagalan teori ini dalam memprediksikan spektra fotoelektron dari kebanyakan molekul, meliputi senyawa yang paling dasar seperti air dan metana. Dari sudut pandang pedagogi, pendekatan hibridisasi ini cenderung terlalu menekankan lokalisasi elektron-elektron ikatan dan tidak secara efektif mencakup simetri molekul seperti yang ada pada teori orbital molekul.
c. Contoh hibridisasi dan tabelnya
Sumber : safi-tri.blogspot.com
Daftar Pustaka
James E. Brady, Kimia Universitas, Binarupa Aksara, 2002 Data yang diberikan oleh ibu Yeni Mulyani, Dosen Kimia Dasar http://kimiaku.wordpress.com/materi-belajar/ikatan-kimia/ http://id.wikipedia.org/wiki/Ikatan_kimia
http://kimlemoet.wordpress.com/2013/11/10/ikatan-kimia-kelas-x/
http://www.chem-is-try.org/materi_kimia/kimia-kesehatan/ikatan-kimia/ikatan-kimia/ http://fitritanasy.student.unidar.ac.id/2013/06/makalah-ikatan-kimia.html