2 TINJAUAN PUSTAKA
2.1 Sistem karbonat laut
Karbon dioksida (CO2) termasuk gas yang reaktif dan banyak terdapat
dalam air laut. Keberadaan karbon dioksida di laut pada umumnya berasal dari udara melalui proses difusi, aktivitas metabolisme dari organisme laut terutama respirasi dan hasil penguraian zat organik oleh mikroorganisme. Total jumlah karbon di laut diperkirakan 50 kali lebih besar dibandingkan jumlah karbon yang ada di atmosfir, dan pertukaran karbon laut dan atmosfir terjadi dalam skala waktu beberapa ratus tahun (IPCC, 2001).
Karbon dioksida yang terlarut di dalam air laut ditemukan dalam tiga bentuk anorganik yang berbeda, yaitu CO2 bebas (≈0,5%) , bikarbonat (86,5%)
dan ion karbonat (13%), penjumlahan dari ketiganya disebut sebagai dissolved
inorganic carbon atau yang dikenal dengan DIC atau ƩCO 2 (Zeebe and
Wolf-Gladrow, 2001). Dalam berbagai literatur DIC juga disimbolkan dengan TCO2
dan CT (Dickson et al. 2007). Persamaannya adalah sebagai berikut:
DIC ≡ ƩCO2 ≡ CT = [CO2] + [HCO3-] + [CO32-]... (1)
Selanjutnya menurut Zeebe and Wolf-Gladrow (2001), di dalam air laut, CO2 berpartisipasi dalam reaksi kesetimbangan yang dikenal sebagai sistem
karbonat. Keseimbangan antara CO2
CO
terlarut, bikarbonat, ion karbonat, dan ion H+ memberikan suatu sistem pengaturan pH di laut. Reaksi keseimbangan ini dapat ditulis sebagai berikut:
2 + H2O H2CO3 HCO3- + H+ CO3= + 2H+... (2)
Arah reaksi keseimbangan ini sangat tergantung pada pH air laut sehingga nilai pH dapat mengendalikan konsentrasi dan proporsi relatif dari spesies karbonat di laut, namun sebaliknya sistem karbonat adalah buffer alami untuk pH air laut. Apabila pH air laut turun maka reaksi keseimbangan akan bergeser kearah kiri yang menyebabkan karbonat dan bikarbonat akan terurai menjadi CO2.
Sebaliknya bila pH air laut naik maka reaksi keseimbangan bergeser kekanan dan bikarbonat dan karbonat banyak terbentuk (Zeebe and Wolf-Gladrow, 2001).
Persamaan dalam sistem karbonat melibatkan enam variabel yaitu [CO2],
[HCO3-], [CO32-], [H+], DIC, dan Alkalinitas karbonat, ketika dua dari enam
variabel diketahui, maka semua komponen lainnya dapat dihitung (Zeebe and Wolf-Gladrow, 2001; Dickson et al. 2007). Variabel yang cukup penting dalam sistem karbonat adalah total alkalinitas (TA) yang berkaitan erat dengan keseimbangan muatan dalam air laut. Dickson (1981) dalam Dickson et al. (2007) mendefinisikan TA sebagai "jumlah mol ion hidrogen yang setara dengan kelebihan akseptor proton (basa yang terbentuk dari asam lemah dengan konstanta disosiasi (K) ≤ 10 - 4,5 pada suhu 25°C) atas donor proton (asam dengan K > 10 - 4,5) dalam 1 kilogram sampel. Persamaannya adalah sebagai berikut:
TA = [HCO3-] + 2[CO32-] + [B(OH)4-] + [OH-] + [HPO42-] + 2[PO43-] +
[SiO(OH)3-] + [NH3] + [HS-] – [H+] – [HSO4-] – [HF] – [H3PO4]... (3)
Sistem karbonat di laut di pengaruhi oleh proses-proses metabolisme organisme seperti fotosintesis, respirasi, kalsifikasi dan dekomposisi, dimana perubahan pada sistem karbonat tersebut paling baik digambarkan oleh perubahan konsentrasi DIC dan TA (Zeebe and Wolf-Gladrow, 2001). Proses fotosintesis akan mengurangi konsentrasi DIC. Selanjutnya pembentukan CaCO3 dalam
proses kalsifikasi menyebabkan turunnya konsentrasi DIC dan TA. Untuk setiap mol CaCO3 yang terbentuk atau diendapkan dari satu mol karbon dan satu mol
ion positif Ca2+
Disamping proses-proses metabolisme, sistem karbonat dalam air laut juga dipengaruhi oleh suhu, salinitas dan tekanan dimana suhu, salinitas dan tekanan akan mempengaruhi nilai konstanta kesetimbangan (pK) (Zeebe and Wolf-Gladrow, 2001). Perubahan dari nilai pK menyebabkan perubahan dalam proporsi relatif CO
akan mengarah kepada penurunan DIC dan TA dengan rasio 1:2. Hasil dari berbagai proses tersebut juga akan mempengaruhi spesies karbonat dan pH air laut.
2, HCO3-, dan CO32-. Sebagai contoh dari nilai referensi pK pada suhu
(T) = 25oC, Salinitas (S) = 35 psu, dan tekanan (p) = 1 atm, ketika diturunkan suhu dan salinitas pada T = 0 dan S = 0 akan menghasilkan peningkatan nilai-nilai
pK. Air laut pada S = 35 dan air tawar pada S = 0 pada pH dan temperatur yang
sama, mempunyai proporsi relatif dari ion [CO32-] dibandingkan dengan [CO2]
Contoh lain ketergantungan sistem karbonat terhadap suhu dan tekanan adalah air yang didinginkan dari suhu 25 sampai 0oC dan kemudian tenggelam dari permukaan (S = 35, dan p = 1 atm) ke laut dalam (S = 35 dan p = 300 atm pada kedalaman 3 km). Dalam contoh ini hanya ada hipotetis abiotik, karena proses biologis seperti produksi primer dan kalsifikasi yang merubah DIC dan TA di laut diabaikan. Penurunan suhu dari 25 sampai 0oC menyebabkan peningkatan besar dalam nilai-nilai pK, sedangkan perubahan tekanan dari 1 sampai 300 atm hanya menyebabkan peningkatan nilai pK yang kecil.
2.2 Siklus karbon dan pertukaran CO2 udara-laut 2.2.1 Laut global
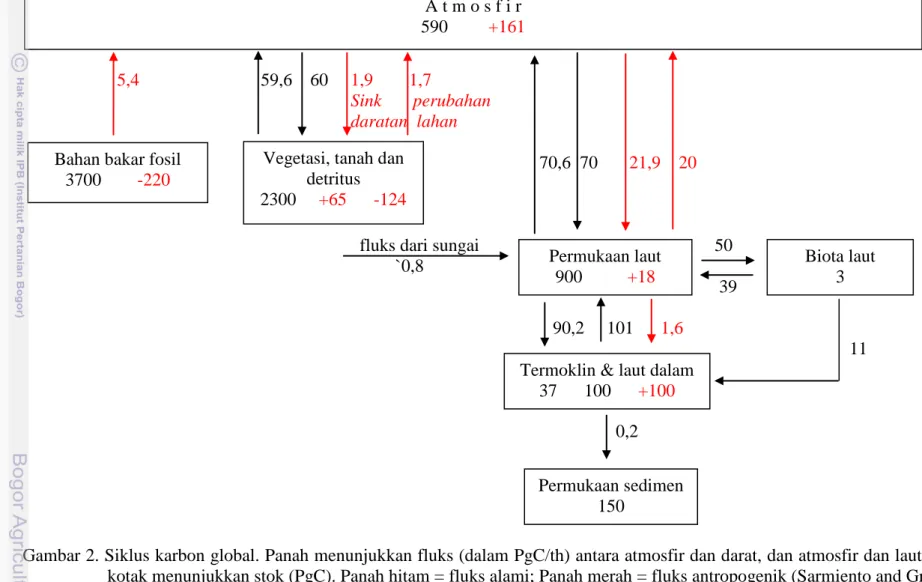
Siklus karbon global ditampilkan dalam Gambar 2. Konsentrasi CO2 di
atmosfer saat ini telah meningkat lebih dari 30% semenjak awal periode industri di akhir abad ke 18 yaitu 280 ppm menjadi 365 ppm yang disebabkan oleh pembakaran bahan bakar fosil dan perubahan penggunaan lahan (Sarmiento and Gruber, 2002). Pelepasan dan penyerapan CO2 diyakini telah berada dalam
kesetimbangan di masa praindustri. Sejak revolusi industri, penambahan emisi antropogenik secara dramatis telah mengakibatkan laut menjadi penyerap bersih (net sink) bagi CO2 atmosfir (Feely et al., 2001). Sarmiento dan Gruber (2002)
mengemukakan bahwa sekitar 5,4 PgC/th (petagram karbon per tahun) dilepaskan ke atmosfir sebagai hasil dari pembakaran bahan bakar fosil, sedangkan perubahan penggunaan lahan menyumbang 1,7 PgC/th. Sebagai akibat dari meningkatnya konsentrasi atmosfirik ini, gradien tekanan parsial antara atmosfir dan laut mengalami perubahan. Hal ini telah mengakibatkan penenggelaman alami (natural sinks) menjadi sedikit lebih kuat dan sumber (sources) menjadi sedikit lebih lemah. Akibatnya penyerapan CO2 bersih oleh laut telah meningkat
sekitar 1,9 PgC/th (Sarmiento and Gruber, 2002) yaitu sekitar sepertiga dari emisi total karbon antropogenik.
5,4 59,6 60 1,9 1,7
Sink perubahan
daratan lahan
70,6 70 21,9 20
fluks dari sungai 50
`0,8 39 90,2 101 1,6 11 0,2
Gambar 2. Siklus karbon global. Panah menunjukkan fluks (dalam PgC/th) antara atmosfir dan darat, dan atmosfir dan laut. Angka dalam kotak menunjukkan stok (PgC). Panah hitam = fluks alami; Panah merah = fluks antropogenik (Sarmiento and Gruber, 2002).
A t m o s f i r 590 +161
Vegetasi, tanah dan detritus 2300 +65 -124 Permukaan laut 900 +18 Biota laut 3 Bahan bakar fosil
3700 -220
Termoklin & laut dalam 37 100 +100
Permukaan sedimen 150
Fluks CO2 udara-laut global merupakan fungsi terintegrasi dari pompa
daya larut dan penyerapan biologis, proses-proses yang telah berjalan selama ribuan tahun (Hasell and Carlson, 2001). Kedua proses ini bertindak meningkatkan konsentrasi CO2 di dalam interior laut. Pompa fisis dibangkitkan
oleh sirkulasi balik laut yang lamban dan lebih mudah terlarutnya CO2 di air
dingin daripada di air hangat. Massa air yang dingin dan rapat (dense) di laut lintang tinggi, terutama di Atlantik Utara dan Laut Selatan (Southern Ocean), menyerap CO2 atmosfirik sebelum tenggelam (sink) ke interior laut. Air yang
tenggelam ini akan diimbangi oleh transpor vertikal (upwelling) di bagian laut lainnya. Air yang naik ke atas ini akan menjadi hangat ketika mencapai permukaan sehingga CO2 menjadi kurang dapat larut dan sebagian diantaranya
akan terlepas kembali ke atmosfir (melalui sebuah proses yang disebut pelepasgasan atau outgassing).
Gambar 3. Skema pompa fisis dan sirkulasi termohalin yang membawa CO2
Proses biologi yang ikut memandu distribusi regional dan musiman dari fluks CO
, yang menggambarkan interkoneksi perairan laut dunia (Hansell and Carlson, 2001).
2 adalah produksi primer kotor (GPP) oleh fitoplankton laut yang telah
diperkirakan oleh Sarmiento and Gruber (2002) sebesar 50 PgC/th. Sebagiannya (39 PgC/th) dikembalikan ke DIC melalui respirasi autotrofik, dan sisanya menjadi produksi primer bersih yang diperkirakan sekitar 11 PgC/th (Sarmiento
CO2 Pe m be nt uk an air d ala m CO2 Ve rt ik al Up w ellin g
CO
2and Gruber, 2002). Hasil karbon organik kemudian dikonsumsi oleh zooplankton atau menjadi detritus. Beberapa karbon organik dilepaskan dalam bentuk terlarut (DOC) dan oksidasi oleh bakteri dengan produksi DOC bersih yang masuk ke reservoir samudera. Penenggelaman partikel organik karbon (POC) yang terdiri dari organisme yang telah mati dan detritus bersama-sama dengan transfer vertikal DOC menciptakan suatu fluks karbon organik yang mengarah ke bawah dari permukaan samudera yang dikenal sebagai "produksi ekspor". Perkiraan untuk produksi ekspor global berkisar antara 10-20 PgC/th (Falkowski et al., 1998). Hanya sebagian kecil (±0,2 PgC/th) produksi ekspor yang mengendap pada sedimen (Sarmiento and Gruber, 2002).
2.2.2 Perairan Pesisir
Perairan pesisir didefinisikan sebagai wilayah yang membentang dari pantai ke landas kontinen, termasuk lereng benua dan inner estuari, sisa masa perairan laut disebut sebagai laut terbuka (Borges, 2005). Komponen perairan pesisir terdiri dari 6 ekosistem pesisir utama yaitu perairan estuari, mangrove, salt
marsh, terumbu karang, sistem upwelling, dan continental shelf. Perairan pesisir
merupakan daerah yang mempunyai siklus biogeokimia paling aktif di biosfer karena menerima masukan bahan organik dan nutrien yang besar dari daratan, dan adanya pertukaran materi dan energi dalam jumlah yang besar dengan laut terbuka (Gattuso et al 1998). Perairan pesisir menyumbang sekitar 20% dari total produksi bahan organik samudera, 90% dari total sedimen laut, dan menyumbang 30% dan 50% dari total produksi dan akumulasi partikel karbon anorganik (Gattuso et al., 1998; Wollast, 1998).
Penelitian mengenai siklus CO2 di perairan pesisir yang dilakukan oleh
Tsunogai et al. (1999) di Timur Laut Cina menunjukkan bahwa perairan pesisir adalah sink CO2 dari atmosfir yaitu sekitar 2,92 molC/m2/th, jika diekstrapolasi ke
luas pesisir dunia menghasilkan sink untuk CO2 atmosfir sebesar 0,95 PgC/th. Hal
ini didorong oleh pendinginan perairan lapisan permukaan yang menjadi lebih rapat (dense) sehingga menyebabkan peningkatan penyerapan CO2 bersama-sama
dengan produksi primer yang tinggi. Jika fluks CO2 perairan pesisir yang
dirumuskan oleh Tsunogai et al. (1999) dikonfirmasi di seluruh dunia, maka
penyerapan CO2 oleh samudera yang diperkirakan 1,6 Pg C/th (Takahashi et al.
2002).
Chen (2004) mengemukakan bahwa secara umum perairan pesisir cenderung untuk menyerap CO2 pada musim dingin, sebagai konsekuensi
dinginnya air permukaan dan dari proses biologi. Pada musim panas dan musim gugur, proses pemanasan menyebabkan proses respirasi dan dekomposisi organisme laut melepaskan kembali CO2 ke atmosfir, demikian juga dengan
bakteri yang terlibat dalam proses produksi CH4 (gas metan) serta dalam produksi
biologis dimetil sulfida (DMS) juga melepas gas rumah kaca ke atmosfir.
Penelitian lainnya menunjukkan bahwa perairan pesisir adalah source CO2
ke atmosfir (Ver et al. 1999). Hal ini didasarkan pada ketidakseimbangan antara angkutan sungai total sekitar 0,4 PgC/th dengan karbon organik yang terkubur di dasar perairan sekitar 0,14 PgC/th, jadi ada perbedaan 0,26 PgC/th yang mungkin dikembalikan ke atmosfir. Selanjutnya Fasham et al. (2001) melaporkan bahwa perairan pesisir adalah source CO2 ke atmosfir, dimana fluks CO2 udara laut
sekitar 0,5 PgC/th. Mackenzie et al. (2000) menyatakan bahwa sebelum kegiatan antropogenik, perairan pesisir global adalah sistem autotrofik bersih dengan ekspor bersih dari karbon organik ke sedimen laut terbuka adalah 20 TmolC/th. Namun, hasil penelitian mereka berikutnya menyimpulkan bahwa meskipun zona pesisir yang dekat dengan daratan adalah source CO2 (8,4 x 1012 molC/th), zona
pesisir yang jauh dari daratan adalah sink CO2 (28,4 x 1012 molC/th). Akibatnya
perairan pesisir ditemukan sebagai net sink CO2 sekitar 20 x 1012 molC/th (0,24
PgC/th).
Penelitian dari Global Ocean Flux Study (JGOFS) menunjukkan bahwa perairan pesisir adalah sink CO2 (Chen et al., 2003.). Sintesis Ini mencerminkan
beberapa perkembangan terakhir yang menunjukkan bahwa rata-rata global produksi baru fitoplankton di perairan pesisir adalah 0,78 PgC/th partikulat karbon organik (POC) dan 0,25 PgC/th partikulat karbon anorganik (PIC). Produksi baru ini hanya 13 persen dari tingkat rata-rata produksi primer pada daerah upwelling. Meskipun produktivitas bersih cukup tinggi di perairan pesisir global, hanya sekitar 0,2 PgC/th dari PIC dan jumlah yang sama dari POC dari total produksi (0,48 PgC/th PIC dan 6,2 PgC/th POC) yang terkubur dan
disimpan pada dasar perairan (Chen et al., 2003). Studi terbaru berdasarkan pengukuran C13, C14 dan N15 menunjukkan bahwa sebagian besar dari transportasi material organik ke perairan pesisir berasal dari daratan (Chen et al., 2003). Transportasi bersih DOC ke perairan pesisir adalah 0,60 PgC/th, dimana 0,32 PgC/th berasal dari darat, 0,28 PgC/th sisanya diproduksi di perairan pesisir dan mewakili 35 persen dari produksi karbon organik baru, atau 27 persen dari total produksi karbon baru (Cai et al., 2003).
2.2.2.1 Perairan Estuari
Cameron dan Pritchard (1963) mendefinisikan perairan estuari sebagai suatu badan perairan yang semi tertutup yang memiliki hubungan bebas dengan laut terbuka, dan di mana air laut diencerkan oleh air tawar yang berasal dari daratan. Batas hulu dari perairan estuari adalah batas pengaruh pasang surut (sungai pasang surut), di mana arus air dan proses sedimentasi menjadi sangat berbeda dibandingkan sungai, batas bawah dari perairan estuari adalah batas geografis pantai sesuai dengan mulut sungai. Perairan estuari mempunyai keragaman yang besar dalam hal geomorfologi, geokimia dan luas permukaan daerah aliran sungai, debit air tawar, dan pengaruh pasang surut, sehingga sangat mempengaruhi siklus biogeokimia karbon dan nutrien, stratifikasi vertikal, dan waktu tinggal air tawar (Borges 2005). Perairan estuari menerima bahan terlarut dan partikulat dalam jumlah besar, terutama karbon organik dan anorganik, dan nutrien yang dibawa oleh-sungai. Ini adalah sistem yang sangat dinamis yang dicirikan oleh gradien kuat dari senyawa biogeokimia, proses produksi dan degradasi bahan organik yang tinggi, dan adanya proses sedimentasi dan resuspensi yang intensif (Borges 2005).
Perairan estuari adalah sistem heterotrofik bersih (source CO2), dimana
jumlah respirasi oleh autotrof dan heterotrof di kedua kompartemen bentik dan pelagis melebihi produksi primer kotor (GPP), dan produksi ekosistem bersih (NEP) kecil dari nol (Borges 2005). Fluks CO2 udara laut di perairan estuari
dikontrol oleh pasokan DIC, tingkat metabolisme ekosistem, stratifikasi kolom air dan waktu tinggal massa air tawar (Borges, 2005). Disamping itu emisi CO2 ke
atmosfir juga sangat dipengaruhi oleh kecepatan transfer gas (Borges et al., 2004). Perairan estuari dicirikan oleh gradien spasial yang kuat dan variabilitas musiman
yang berkaitan dengan perbedaan dalam kontribusi relatif kecepatan transfer gas terhadap turbulensi antarmuka perairan, kecepatan angin, arus air, dan topografi (Borges et al., 2004)
Berdasarkan hasil review dari Borges (2005) menunjukkan bahwa hampir semua perairan estuari adalah sumber bersih CO2 ke atmosfir. Di antara perairan
estuari di Eropa, Scheldt dan Randers Fjord berada di batas tinggi dan rendah untuk fluks CO2 udara-laut. Estuari Randers Fjord adalah tipe estuari microtidal
yang dicirikan oleh stratifikasi permanen yang kuat, sedangkan estuari Scheldt adalah estuari macrotidal yang ditandai oleh kolom air tercampur permanen. Meskipun secara keseluruhan Randers Fjord adalah sistem heterotrofik bersih, lapisan tercampur adalah autotrofik bersih sedangkan lapisan bawah adalah sangat heterotrofik. Emisi CO2 dari estuari Scheldt hampir 15 kali lebih tinggi dibanding
Randers Fjord, meskipun NEP nya hanya 2 kali lebih rendah di Scheldt dibanding estuari Randers Fjord. Hal ini berhubungan dengan tingginya produksi bahan organik pada lapisan tercampur dan degradasi di lapisan bawah. Dengan cara ini CO2 hasil degradasi tidak langsung kembali ke atmosfir. Disamping itu lamanya
waktu tinggal air tawar di estuari Scheldt (30-90 hari) dibanding estuari Randers Fjord (5-10 hari) menyebabkan pengayaan DIC di perairan estuari Scheldt lebih intensif.
2.2.2.2 Perairan Sekitar Mangrove
Ekosistem mangrove, meskipun hampir keseluruhan ekosistem (di atas permukaan tanah) adalah autotrofik bersih dan sink untuk CO2 atmosfir karena
fiksasi karbon yang besar sebagai biomassa tanaman, perairan di sekitarnya merupakan sumber signifikan CO2 ke atmosfir (Borges, 2005; Kone and Borges,
2008). Sedimen dan kolom air dapat menerima masukan bahan organik yang tinggi, baik secara langsung sebagai serasah daun dan kayu maupun tidak langsung sebagai karbon organik terlarut yang mengakibatkan status metabolisme adalah heterotrofik dan secara signifikan melepas CO2 ke atmosfir (Borges et al.,
2003; Borges, 2005). Potensi signifikan dari mineralisasi dan dekomposisi material organik di perairan sekitar mangrove baru-baru ini mendapat perhatian karena perairan tersebut menunjukkan tingkat kejenuhan yang tinggi terhadap CO2 (Borges et al., 2003; Bouillon et al., 2003; 2007). Selanjutnya Borges
(2005) mengemukakan bahwa disamping proses dekomposisi material organik, dinamika DIC di perairan sekitar mangrove juga dipengaruhi oleh air poros dalam sedimen yang kaya dengan DIC, TA dan CO2 dan miskin oksigen yang
dipompa oleh arus pasang surut.
Fluks CO2 udara-laut pada ekosistem mangrove global telah diperkirakan
oleh Jennerjahn dan Ittekkot (2002). Jika ekspor bahan organik dari sistem perairan yang berdekatan dimasukkan maka fluks CO2 udara laut di perairan
sekitar mangrove adalah 18,7 molC/m2/th. Jika ekspor bahan organik dengan sistem perairan yang berdekatan tidak dimasukkan maka fluksnya akan berkurang sekitar 50% (9,8 molC/m2/th). Dalam perhitungan ini diasumsikan bahwa fluks CO2 udara-laut hanya berhubungan dengan degradasi bahan organik yang berasal
dari ekosistem mangrove, sedangkan pasokan karbon dari tempat lain seperti ekspor DIC dari sistem perairan yang berdekatan, emisi CO2 dari sedimen, dan
masukan allochthonous tidak diperhitungkan.
2.2.2.3 Perairan Sekitar Terumbu Karang
Terumbu karang merupakan ekosistem perairan tropis dan sub tropis yang terdiri dari struktur karbonat yang didominasi oleh karang Scleractinia dan mikroalga (Borges, 2005). Ekosistem terumbu karang mewakili sekitar 2% dari luas permukaan continental shelf dan menyumbang sekitar 83% dan 50% dari produksi dan akumulasi partikel karbon anorganik ekosistem pesisir (Milliman, 1993). Terumbu karang berkembang pada tingkat kekeruhan rendah, perairan yang oligotrofik dengan suhu tahunan minimum 18oC dan mempunyai tingkat metabolisme karbon organik dan kalsifikasi yang tinggi (Gattuso et al., 1998). Meskipun perairan terumbu karang mempunyai laju fotosintesis dan respirasi yang tinggi, produksi ekosistem bersih di perairan tersebut mendekati nol (Gattuso et al., 1998). Proses kalsifikasi dan fotosintesis merupakan proses utama yang mempengaruhi siklus karbon di perairan sekitar terumbu karang. Fiksasi CO2 oleh produksi ekosistem bersih (NEP) biasanya rendah tetapi tingkat
kalsifikasi tinggi sehingga menyebabkan proses kalsifikasi melepas CO2
Ca
ke perairan sekitarnya, sebagaimana dalam persamaan berikut:
2+
Konsentrasi CO2 meningkat sebesar 0,6 mol untuk setiap pengendapan 1 mol
kalsium karbonat (CaCO3) dalam standar air laut (salinitas=35, suhu=25,
TA=2370 µmol/kg, pCO2=365 ppm) (Gattuso et al., 1999). Rasio antara produksi
CO2 dengan presipitasi CaCO3 pada umumnya tergantung pada keseimbangan
termodinamika khususnya suhu dan salinitas (Ware et al., 1992; Frankignoulle et
al., 1994).
Berdasarkan perkiraan global dari kalsifikasi bersih dan NEP, Ware et al. (1992) menghitung potensi pelepasan CO2 ke perairan sekitarnya dari
kesetimbangan metabolisme organik dan kalsifikasi berkisar antara 3-11,3 mmolC/m2/th. Fluks CO2 udara laut di perairan sekitar terumbu karang sangat
tergantung pada waktu tinggal massa air, bentuk geomorfologi terumbu karang (karang tepi, penghalang, atau sistem terumbu karang atol) dan pola arus air laut di perairan sekitarnya. Di samping proses metabolisme yang terjadi dalam sistem terumbu karang dan waktu tinggal dari massa air, fluks CO2 udara-laut juga
dimodulasi oleh ΔpCO2 air laut yang masuk.
Pada skala tahunan, perairan laut tropis dan subtropis merupakan source CO2 (0,35 mol C/m2/th, ΔpCO2 = 11 ppm, Takahashi et al., 2002). Berdasarkan
perbedaan pCO2 antara perairan samudera dan terumbu yang disusun oleh Suzuki
dan Kawahata (2003) di 9 sistem terumbu dan menambahkan data dari Bates (2002) di Hog Reef dapat diperkirakan bahwa air laut yang masuk ke perairan terumbu karang diperkaya rata-rata sebesar 12 ppm selama transit melalui sistem terumbu karang. Borges (2005) memperkirakan emisi CO2 global dari sistem
3 METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
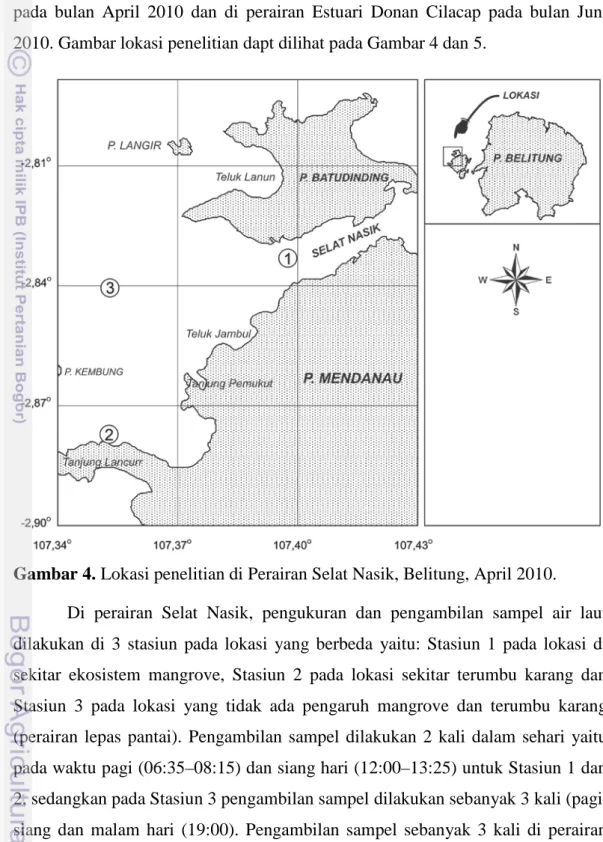
Penelitian telah dilakukan di perairan Selat Nasik Kabupaten Belitung pada bulan April 2010 dan di perairan Estuari Donan Cilacap pada bulan Juni 2010. Gambar lokasi penelitian dapt dilihat pada Gambar 4 dan 5.
Gambar 4. Lokasi penelitian di Perairan Selat Nasik, Belitung, April 2010.
Di perairan Selat Nasik, pengukuran dan pengambilan sampel air laut dilakukan di 3 stasiun pada lokasi yang berbeda yaitu: Stasiun 1 pada lokasi di sekitar ekosistem mangrove, Stasiun 2 pada lokasi sekitar terumbu karang dan Stasiun 3 pada lokasi yang tidak ada pengaruh mangrove dan terumbu karang (perairan lepas pantai). Pengambilan sampel dilakukan 2 kali dalam sehari yaitu pada waktu pagi (06:35–08:15) dan siang hari (12:00–13:25) untuk Stasiun 1 dan 2, sedangkan pada Stasiun 3 pengambilan sampel dilakukan sebanyak 3 kali (pagi, siang dan malam hari (19:00). Pengambilan sampel sebanyak 3 kali di perairan laut dimaksudkan untuk melihat sejauh mana peranan produktifitas primer
fitoplankton dalam menurunkan CO2 dalam air laut, karena di perairan laut
fitoplankton merupakan satu-satunya organisme yang menyerap CO2 sedangkan
di perairan sekitar mangrove dan terumbu karang ada organisme lain yang menyerap CO2 diantaranya lamun, makroalga, dan zooxanthella sehingga untuk
melihat peranan fitoplankton dalam penyerapan CO2
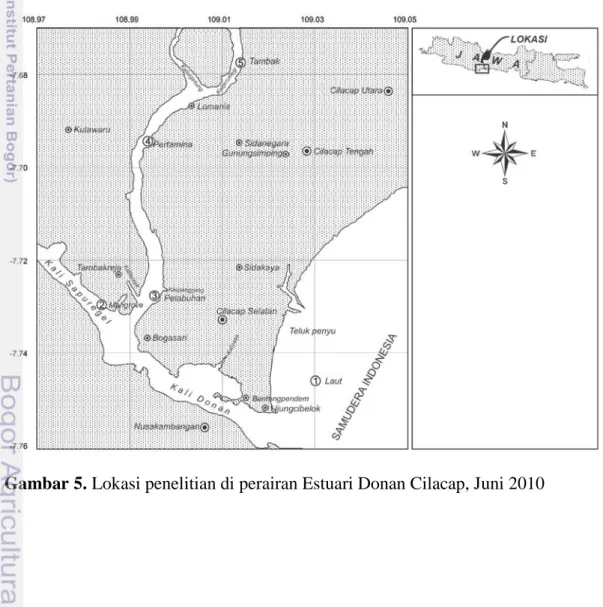
Gambar 5. Lokasi penelitian di perairan Estuari Donan Cilacap, Juni 2010
hanya dilakukan di perairan laut.
Di perairan Estuari Donan Cilacap, pengukuran dan pengambilan sampel air laut di lakukan pada 5 stasiun dari muara menuju sungai. Kelima stasiun mempunyai karakteristik yang berbeda yaitu Stasiun 1 berada di depan mulut sungai yang berhadapan langsung dengan samudera Hindia, Stasiun 2 dekat ekosistem mangrove, Stasiun 3 dekat pelabuhan, Stasiun 4 dekat pertamina dan Stasiun 5 dekat lokasi budidaya.
3.2 Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian meliputi : 1. Bahan kimia untuk analisis karbon, terdiri dari HgCl2
2. Bahan kimia untuk analisis Produktifitas Primer fitoplankton terdiri dari: MnSO
sebagai pengawet atau untuk menghentikan aktifitas biologi, HCl dan NaOH untuk analisis alkalinitas dan DIC.
4, NaI-Azida, H2SO4
3. Bahan kimia untuk analisis fosfat dan silikat: ammonium molibdate, asam sulfat, asam ascorbate, kalium antimonyl tartrat, methol sulfit dan asam oksalat.
dan Natrium Thiosulfat.
Tabel 1. Peralatan yang digunakan dalam penelitian.
No. Nama Alat Kegunaan
1 CTD Pengukuran suhu dan salinitas
2 Nansen water sampler Pengambilan sampel air
3 pH meter Pengukuran pH
4 CO2 meter Pengukuran CO2
5
atmosfir
Light meter Pengukuran intensitas cahaya
6 Cool Box Untuk penyimpanan sampel air
7 Alat saring dan Vacum pump Membantu proses penyaringan
sampel
8 Kertas saring CNM 0,45μm Untuk menyaring sampel air
9 Mikro titrator Untuk titrasi
10 Alat-alat gelas
11 Spectrophotometer Pengukuran fosfat dan silikat
3.3 Prosedur penelitian 3.3.1 Sistem CO2
Parameter sistem CO2 yang diukur adalah DIC, pH dan alkalinitas.
Pengambilan sampel dilakukan pada lapisan permukaan (0–1 meter) untuk semua stasiun dengan menggunakan Nansen water sampler. Untuk parameter sistem CO2
(DIC, alkalinitas dan pH), sesaat setelah pengambilan sampel ditambahkan HgCl2
pada sampel air untuk menghentikan aktivitas biologi dan sampel disimpan dalam
coolbox yang selalu ditambahkan es batu agar suhu tetap rendah untuk mencegah
3.3.2 Produktifitas primer
Pengambilan sampel air dilakukan dengan menggunakan VanDorn water sampler pada lapisan permukaan (0–1 meter). Pada waktu sampling, sampel air langsung dipindahkan ke plastic container (jerigen) 5–10 liter. Sampel kemudian dialirkan melalui ‘plankton gauze’ (mesh size 200 μm) ke dalam 2 botol terang dan 1 botol gelap. Untuk menentukan kandungan O2 pada permulaan inkubasi
dilakukan dengan metode titrasi Winkler. Pada saat yang bersamaan, 1 botol terang + 1 botol gelap diinkubasi di bawah sinar matahari selama ±4 jam. Proses inkubasi dilakukan dengan cara menggantungkan botol pada pelampung sehingga botol terendam pada lapisan permukaan. Setelah inkubasi, konsentrasi oksigen yang terdapat dalam botol gelap dan botol terang tersebut diukur kembali dengan metode titrasi Winkler.
3.4 Analisis data 3.4.1 Sistem CO
Sistem CO
2
2 di perairan dapat dikaji melalui empat parameter yang dapat
diukur, yaitu DIC, total alkalinitas (TA), pH dan pCO2 (tekanan parsial CO2)
(Lewis dan Wallace, 1997). Pada studi ini DIC diukur menggunakan metode
“Titrasi” (Giggenbach & Goguel, 1989), dengan prinsip mendasarkan pada
perubahan pH setelah ditambahkan HCl dan NaOH. DIC didapatkan dari penjumlahan HCO3- dan CO3
2-Keterangan:
A dan B = Volume HCl yang digunakan untuk menurunkan pH.
C dan D = Volume NaOH yang digunakan untuk menaikkan pH.
Vs = Volume sampel air laut yang dianalisa
Hasil pengukuran DIC dengan metode ini kemudian dikoreksi dengan hasil pengukuran certified sample/Certified Refference Material (RCM) dari Marine
Physical Laboratory, University of California, San Diego.
dalam satuan μmol/kg.
... (5)
Nilai RCM = 2021±0,65 µmol/kg, sedangkan hasil pengukuran RCM oleh BATAN = 1657,20 µmol/kg, jadi nilai koreksinya adalah 364,45 µmol/kg.
Total Alkalinitas diukur dengan menggunakan metode “Titrasi”
(Grasshoff, 1976). Prosedurnya meliputi: Kedalam 50 ml sampel air laut ditambahkan 5 ml HCl 0,025 M dan dididihkan selama ±5 menit, kemudian didinginkan dalam water bath. Setelah dingin kedalam sampel ditambahkan 3–5 tetes bromothymol blue sebagai indikator, kemudian sampel dititrasi dengan NaOH 0,02 M, selama titrasi kedalam sampel dialirkan gas bebas CO2 (Nitrogen atau Helium). Proses titrasi dihentikan setelah sampel bewarna biru, dan volume NaOH yang terpakai dicatat dan dimasukkan kedalam rumus berikut:
Keterangan:
V = Volume HCl dan NaOH
t = Molaritas HCl dan NaOH
Vb = Volume sampel
Tekanan parsial CO2 (pCO2) kolom air dihitung dengan menggunakan
Model OCMIP (Ocean Carbon Cycle Model Intercomparison Project) yang dikembangkan oleh Orr et al. (1999). Parameter yang digunakan dalam model ini adalah: suhu, salinitas, kisaran pH, pH insitu, DIC, alkalinitas, fosfat dan silikat.
pCO2 atmosfir diukur pada waktu pengambilan sampel dengan menggunakan
CO2
3.4.2 Pertukaran CO
meter.
2
Secara umum fluks atau pertukaran aliran gas CO
udara-laut
2 antara udara dan laut
dihitung dengan menggunakan rumus berikut:
Fluks CO2 = K. α. Δ pCO2 air–atm ... (8)
ΔpCO2 = pCO2 air-pCO2 atm ... (9) Keterangan:
K = kecepatan transfer gas (fungsi dari kecepatan angin)
α = koefisien daya larut (fungsi dari suhu dan salinitas)
ΔpCO2air–atm = perbedaan (selisih) antara tekanan parsial CO2 permukaan air
dengan atmosfir
Berdasarkan nilai pCO2 laut dan atmosfir dapat ditentukan apakah suatu
perairan penyerap (sink) atau pelepas (source) CO2. Suatu perairan berperan
sebagai ‘source’ atau pelepas CO2 ke udara/atmosfir jika nilai pCO2-nya lebih
tinggi dari nilai atmosfir (nilai positif) karena akan terjadi aliran CO2dari air ke
atmosfir. Sebaliknya berperan sebagai penyerap/‘sink’ CO2dari atmosfir jika nilai pCO2air-nya lebih rendah dari pCO2atm
3.4.3 Produktifitas Primer
(nilai negatif).
Pengukuran produktifitas primer dilakukan dengan menggunakan botol gelap dan botol terang dengan metode winkler modifikasi azida (Strickland & Parsons, 1968; APHA, 1980). Laju fotosintesis dan respirasi dalam satuan mgC/l/jam dihitung dengan menggunakan rumus:
LB (ppmO2) – DB (ppmO2 GPP (mgC/l/jam) = 0,375 ... (10) N x PQ LB (ppmO ) 2) – IB (ppmO2 NPP (mgC/l/jam) = 0,375 ... (11) N x PQ IB (ppmO ) 2) – DB (ppmO2 Respirasi (mgC/l/jam) = 0,375 RQ ... (12) N Keterangan:
GPP = Produksi Primer Kotor NPP = Produksi Primer Bersih
0,375 = faktor konversi dari oksigen ke karbon LB = Botol terang (Light bottle), Kandungan O
)
2 pada botol terang setelah
inkubasi
DB = Botol gelap (Dark bottle), Kandungan O2 pada botol gelap setelah
inkubasi
IB = Kandungan O2 awal sebelum inkubasi PQ = Photosynthesis Quotient (1,2)