1 BAB I PENDAHULUAN
A. Latar Belakang
Ribosome Inactivating Protein (RIP) merupakan kelompok enzim tanaman
yang mampu menyebabkan terjadinya kerusakan ribosom secara irreversibel melalui aktivitas pemotongan ikatan N-glikosidik adenin spesifik sehingga berpotensi menjadi agen antikanker. Daun tanaman Mirabilis jalapa L.(MJ) diketahui mengandung protein sejenis RIP yang terdiri dari fraksi protein MJ-30 (basa) dan MJ-C (asam), dimana efek sitotoksik yang lebih besar dimiliki oleh MJ-C (Sudjadi dkk., 2007).
Administrasi obat secara per-oral saat ini mulai dikembangkan pada terapi pengobatan kanker. Kenyamanan pasien serta fleksibilitas penggunaan obat menjadi faktor yang dianggap mampu meningkatkan kepatuhan serta kualitas hidup pasien pengidap kanker. Akan tetapi, penghantaran obat protein secara per-oral mengalami keterbatasan dalam dalam hal kestabilannya pada saluran pencernaan akibat pengaruh enzim, tingkat keasaman lambung, serta barier mukosa usus (Soltero dan Ekwuribe, 2001). Kondisi tersebut mempengaruhi bioavailabilitas obat pada jaringan target yang menjadi salah satu penentu efektivitas terapi. Oleh sebab itu, diperlukan sistem penghantaran khusus yang dapat menjamin stabilitas dan bioavailabilitas obat protein pada penghantaran secara per-oral.
Sistem penghantaran nanopartikel diketahui mampu melindungi senyawa dari kemungkinan degradasi, meningkatkan absorbsi, memodifikasi farmakokinetik
dan profil distribusi, serta memperbaiki penetrasi dan distribusi intraseluler obat (Elzoghby dkk., 2012). Saat ini terdapat berbagai senyawa protein yang diformulasikan dalam bentuk nanopartikel (Khampieng dkk., 2015; Cheng dan Lim, 2004). Kemampuan nanopartikel yang istimewa dalam menghantarkan obat tidak lepas dari peran polimer sebagai komponen pembentuk sistem nanopartikel. Kitosan merupakan polimer kationik yang bersifat mukoadesif dan diketahui mampu memperbaiki bioavailabilitas obat protein pada administrasi secara per-oral (Bowman dan Leong, 2006). Akan tetapi kitosan memiliki hidrofilisitas dan kelarutan yang tinggi pada pH asam (pH lambung) sehingga memungkinkan terjadinya kerusakan sistem nanopartikel sebelum mencapai target aksinya. Natrium alginat diketahui memiliki kemampuan untuk melepaskan senyawa bioaktif secara bertahap dan terkontrol tanpa menimbulkan risiko kerusakan mukosa (Kanjanabat dan Pongjanyakul, 2011; Rajesh dkk., 2012). Berdasarkan penelitian yang dilakukan oleh Bagre dkk. (2013) formula enkapsulasi ganda nanopartikel kitosan dan alginat mampu memperbaiki profil pelepasan dan meningkatkan bioavailabilitas obat secara per oral.
Formulasi polimeric nanoparticle umumnya dilakukan dengan metode ionic
gelation yang bekerja berdasarkan prinsip terjadinya interaksi elektrostatik antara
polimer polikationik/polianionik dengan counter ion-nya di dalam larutan yang berasal dari senyawa yang dienkapsulasi ataupun dari pengait silang yang ditambahkan. Tripolifosfat (TPP-) merupakan ion bermuatan negatif yang sering digunakan sebagai pengait silang pada formulasi nanopartikel dengan polimer kitosan. Kadar penggunaan penggunaan polimer menjadi faktor yang
mempengaruhi kecukupan pembentukan sistem dalam mengenkapsulasi protein secara efisien serta menentukan besarnya ukuran partikel yang terbentuk. Penelitian yang dilakukan oleh Sekarningtyas (2015) menunjukkan bahwa penggunaan kitosan kadar 0,5% b/v dan TPP 0,03% b/v mampu menghasilkan formula nanopartikel yang optimum dengan nilai efisiensi enkapsulasi yang tinggi. Pada metode ionic gelation, kondisi pH medium turut mempengaruhi reaksi taut silang karena berhubungan dengan proses protonasi dan deprotonasi yang menentukan muatan permukaan pada tiap komponen. Kitosan memiliki pKa 6,5 sehingga akan terprotonasi pada pH di bawah pKa-nya. Pengaturan pH medium dengan memperhatikan pKa senyawa akan memudahkan prediksi kondisi formulasi yang optimum untuk membentuk sistem nanopartikel yang baik. Pada formulasi nanopartikel dengan polimer alginat, umumnya digunakan ion kalsium (Ca2+) sebagai pengait silang. Kadar penggunaan pengait silang turut menjadi faktor yang mempengaruhi kekompakan serta kestabilan muatan permukaan nanopartikel yang dihasilkan. Penelitian yang dilakukan oleh Winarti, 2011 menunjukkan bahwa penggunaan crosslinker pada konsentrasi yang terlalu tinggi dapat menyebabkan agregasi pada partikel.
Oleh sebab itu, perlu dilakukan penelitian untuk menentukan kondisi formulasi yang optimum berdasarkan kadar penggunaan kitosan dan pH medium dalam menghasilkan nanopartikel RIP MJ-C inti (NPMJ-1) serta melihat kemampuan alginat dan kalsium klorida dalam mengenkapsulasi NPMJ-1 menjadi nanopartikel enkapsulasi ganda (NPMJ-2). Pada proses awal dilakukan penyiapan sampel RIP MJ-C dengan melakukan fraksinasi crude extract protein MJ dengan
kromatografi afinitas. Formulasi nanopartikel dilakukan dalam dua tahap enkapsulasi menggunakan metode ionic gelation. Enkapsulasi pertama RIP MJ-C dilakukan pada pH medium 3,5-5,5 dengan kitosan BMR 0,3-0,5% b/v, dan TPP 0,03% b/v. Pemilihan formula optimum nanopartikel pertama adalah berdasarkan stabilitas lama penyimpanan dan nilai Entrapment Efficiency (EE). Enkapsulasi kedua dilakukan terhadap formula optimum nanopartikel pertama menggunakan alginat 0,3% b/v dan kalsium klorida 0,1-0,3% b/v. Keberhasilan pembentukan nanopartikel enkapsulasi ganda diamati berdasarkan parameter stabilitas lama penyimpanan serta karakteristik nilai potensial zeta, ukuran partikel, dan indeks polidispersitas.
Dengan demikian, dapat diperoleh kondisi yang tepat dalam formulasi nanopartikel kitosan-natrium tripolifosfat RIP MJ-C terenkapsulasi alginat-kalsium klorida (NPMJ-2) yang mampu menjaga kestabilan RIP MJ-C pada penggunaan secara per-oral bagi terapi kanker.
B. Rumusan Masalah
1. Apakah penggunaan kitosan BMR 0,3-0,5% b/v dan TPP 0,03% b/v pada pH pembuatan 3,5-5,5 dapat membentuk NPMJ-1 dengan nilai nilai EE optimum (> 50 %) dan stabil dalam penyimpanan selama 7 hari?
2. Apakah penggunaan alginat 0,3% b/v dan kalsium klorida 0,1-0,3% b/v dapat mengenkapsulasi NPMJ-1 sehingga membentuk NPMJ-2 yang stabil dalam penyimpanan selama 7 hari?
3. Bagaimana karakteristik ukuran partikel, potensial zeta, dan polydispersity
C. Tujuan Penelitian
1. Membuat NPMJ-1 dengan kitosan BMR 0,3-0,5% b/v dan TPP 0,03% b/v pada pH pembuatan 3,5-5,5 dengan nilai EE optimum (> 50 %) dan stabil dalam penyimpanan selama 7 hari.
2. Mengenkapsulasi NPMJ-1 dengan alginat 0,3% b/v dan kalsium klorida 0,1-0,3% b/v untuk menghasilkan NPMJ-2 yang stabil dalam penyimpanan selama 7 hari.
3. Mengetahui karakteristik ukuran partikel, potensial zeta, dan polydispersity
index dari formula optimum NPMJ-2.
D. Manfaat Penelitian
Penelitian ini akan menghasilkan data ilmiah yang mampu mengungkapkan kondisi formulasi yang optimum dalam membentuk sistem nanopartikel inti NPMJ-1 serta melihat kemampuan alginat dan kalsium klorida dalam mengenkapsulasi NPMJ-1 menjadi nanopartikel enkapsulasi ganda (NPMJ-2). Data yang diperoleh dapat dijadikan salah satu acuan dalam pengembangan nanopartikel sebagai teknologi pilihan pada sistem penghantaran obat protein secara per-oral pada terapi kanker.
E. Tinjauan Pustaka
1. Ribosome Inactivating Protein from Mirabilis jalapa L.-C (RIP MJ-C) Ribosome-Inactivating Proteins (RIPs) merupakan kelompok enzim tanaman yang mampu memodifikasi 28S rRNA melalui aktivitas N-glycosidase
sehingga menyebabkan pemotongan ikatan N-glikosidik adenin spesifik dan berujung pada inaktivasi ribosom. Adenin spesifik tersebut terletak pada posisi 4324 dari hati tikus |28S rRNA dan adenin yang bersesuaian pada model eukariorik atau prokariotik lainnya (Stirpe dkk., 1992). Pemotongan ini mengakibatkan terhentinya sintesis protein karena mencegah pengikatan faktor perpanjangan pada ribosom (Chaddock dkk., 1996).
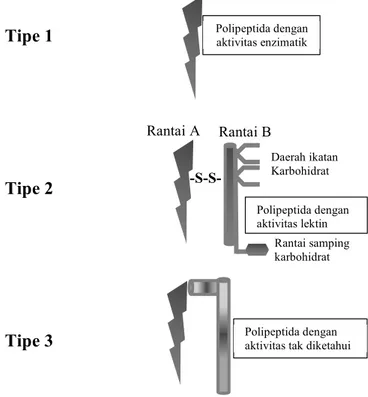
RIPs terbagi menjadi 3 kelompok utama, yakni RIPs tipe 1, tipe 2, dan tipe 3. RIPs tipe 1 mengandung rantai peptida ±30 kDa yang bersifat tidak sitotoksik. Salah satu contoh protein yang termasuk dalam RIPs tipe 1 adalah adalah maize b-32 RIP yang diaktivasi melalui proses proteolisis penghilangan 25 residu asam amino (2,8 kDa) pada bagian tengah rantai polipeptida sehingga menyisakan dua rantai aktif RIP dengan bobot molekul masing-masing 16,5 dan 8,5 kDa (Walsh dkk., 1991). Awalnya maize b-32 RIP tersebut termasuk dalam golongan RIPs tipe 3 karena secara struktur berbeda dengan RIPs tipe 1 dan tipe 2. Namun, penelitian Peumans dkk. (2001) mengungkapkan bahwa akan lebih baik jika penggolongan jenis RIPs dilakukan atas dasar keberadaan
lectin-like chain yang memberikan perbedaan fungsi secara signifikan pada
tiap golongan RIPs. RIPs tipe 2 merupakan polipeptida yang terikat secara kovalen melalui ikatan disulfida dengan polipeptida kedua yang dikenal sebagai galactose-binding lectin dengan bobot molekul yang juga ±30 kDa. RIP tipe 2 tersebut mengikat sel eukariotik melalui interaksi dengan galaktosida pada permukaan sel untuk selanjutnya memasuki sitosol dan menyebabkan kematian sel melalui penghambatan sintesis protein (Lord dkk.,
1994). Protein yang tergolong dalam RIPs tipe 3 adalah JIP60, yakni suatu RIP dari barley yang mampu memotong polisom asli hewan maupun tanaman menjadi subunit ribosomalnya (Reinbothe dkk., 1994).
Tipe 1
Tipe 2
Tipe 3
Gambar 1. Skema Ribosome Inactivating Protein (Stirpe, 2004)
Protein MJ yang diisolasi dari daun tanaman bunga pukul empat atau
Mirabilis Jalapa L. diketahui memiliki aktivitas antikanker dengan jalan
meningkatkan ekspresi dan aktivitas caspase-3 sebagai eksekutor terjadinya apoptosis pada sel kanker HeLa (Hussaana dkk., 2010). Berdasarkan penelitian yang dilakukan Sudjadi dkk. (2003) protein RIP MJ dengan ukuran 30 kDA mampu dipisahkan dari protein totalnya dengan menggunakan kolom
CM-Sepharose CL-6B yang dilanjutkan dengan Sephacryl S-300HR. Protein tak
terikat pada kolom tersebut yang kemudian diketahui sebagai RIP MJ-C memiliki aktivitas pemotongan DNA superkoil dan memperlihatkan efek
Polipeptida dengan aktivitas enzimatik
Polipeptida dengan aktivitas tak diketahui
Rantai A Rantai B -S-S- Rantai samping karbohidrat Daerah ikatan Karbohidrat Polipeptida dengan aktivitas lektin
sitotoksik pada sel HeLa, myeloma, dan T47D (Sudjadi dkk., 2007). RIP MJ-C termasuk dalam kelompok RIPs tipe 1.
2. Nanopartikel
Nanopartikel merupakan partikel koloidal dengan ukuran 10-1000 nm (Shaffer, 2005) yang telah secara luas digunakan sebagai sarana penghantaran obat dan/atau imaging agents (Thorek, 2009). Berdasarkan proses pembuatannya, nanopartikel polimerik dibagi menjadi 2 tipe, yakni
nanospheres dan nanocapsules. Nanosphere adalah berupa sistem matriks
dimana obat secara terdispersi secara merata. Sedangkan Nanocapsules lebih berupa struktur yang dapat mengurung obat di dalam suatu rongga yang terbuat dari membran polimer yang unik (Nagavarma dkk., 2012). Beberapa kelebihan nanopartikel diantaranya mampu dalam melepaskan obat secara terkontrol (sustain release), biokompatibel, biodegradabel, melindungi DNA dari degradasi oleh endolisosom (Panyam dan Labhasetwar, 2003), dan dapat berpenetrasi melintasi barrier melalui kapiler kecil ke dalam sel yang memungkinkan akumulasi obat pada tempat aksinya. (Parveen dkk., 2012). Penghantaran nanopartikel mampu menembus ruang-ruang antar sel (Buzea dkk., 2007) dan dinding sel yang lebih tinggi sehingga memungkinkan terjadinya peningkatan reuptake obat secara seluler.
Salah satu metode yang digunakan dalam pembuatan nanopartikel adalah melalui ionic gelation. Prinsip dari metode ini adalah pembentukan sistem nanopartikel akibat interaksi elektrostatik antara polimer polikationik/polianionik dengan counter ion-nya di dalam larutan yang berasal
dari senyawa yang dienkapsulasi ataupun dari pengait silang yang ditambahkan. Metode ionic gelation merupakan metode yang simpel dan murah serta mampu meningkatkan biokompatibilitas dari nanopartikel yang dihasilkan (Christenson dkk., 1993). Kelebihan lainnya dari metode ionic
gelation adalah dapat dilakukannya wash off dengan solven saat terjadi
kelebihan crosslinker serta derajat cross-linking dan aktivitas penyangga-an (buffering) yang dapat dimanipulasi(Kunjachan dan Jose, 2010). Derajat
cross-linking tersebut dapat diatur dengan teknik formulasi yang sederhana seperti
dengan melakukan variasi rasio formasi kompleks melalui perubahan jumlah
crosslinker dan polimer yang digunakan.
Jumlah penggunaan polimer menjadi faktor yang menentukan banyaknya interaksi yang mungkin terjadi serta mempengaruhi besarnya ukuran partikel yang terbentuk. Pengunaan kadar polimer yang terlalu rendah berisiko untuk menimbulkan ketidakcukupan komponen dalam membentuk sistem nanopartikel. Namun di sisi lainnya, hal tersebut dapat membentuk nanopartikel dengan ukuran yang lebih kecil akibat adanya penurunan resistensi fase cair dan fase dispers dalam viskositas medium gelasi yang rendah (Mohammadpour dkk., 2012).
Pembentukan muatan positif ataupun negatif dari protein ditentukan dari nilai pH medium yang berada di bawah ataupun di atas nilai isoelectric point (pI) (Ghosh dan Bandyopadhyay, 2012). Fenomena yang serupa juga terjadi pada pembentukan muatan permukaan dari komponen lainnya. Kondisi pH medium yang berada di bawah nilai pKa senyawa akan menyebabkan
terjadinya protonasi sehingga membentuk muatan permukaan yang bernilai positif. Teori ini dapat dijelaskan melalui rumus Handersen Hasselbach seperti yang tertera pada persamaan 1.
pH = pKa + log (1)
Interaksi protein-polisakarida dapat dikontrol dengan memvariasikan pH dan kekuatan ionik medium.
3. Kitosan
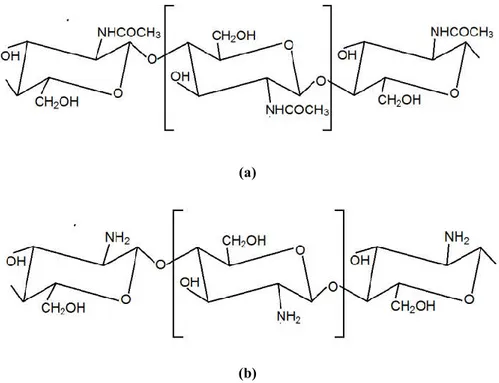
Kitosan merupakan polisakarida biodegradabel yang diturunkan dari deasetilasi parsial kitin, yang merupakan ko-polimer glukosamin dan
N-asetil-D-glukosamin yang terhubung bersama melalui ikatan beta(1,4)glikosidik.
Kitosan dapat terdegradasi menjadi N-asetil glukosamin melalui lysozyme umum dalam tubuh, yang sesudah itu diekskresikan sebagai karbon dioksida melalui jalur sintesis glikoprotein (Gan dan Wang, 2007).
Kitosan secara luas digunakan dalam sistem penghantaran obat, karena sifatnya yang tidak toksik, biodegradabel, biokompatibel, dan mukoadesif (Lertsutthiwong dan Rojsitthisak, 2011). Penelitain yag dilakukan oleh Bowman dan Leong, 2006 menunjukkan bahwa kitosan dapat digunakan untuk mengenkapsulasi senyawa protein serta plasmid DNA terkondensasi.
(a)
(b)
Gambar 2. Struktur kimia (a) kitin, (b) kitosan (Liu dkk., 2004)
Interaksi ionik antara gugus amina primer kitosan dengan substruktur anionik dari mukus menjadikan kitosan bersifat mukoadesif (Schnürch dan Dünnhaupt, 2012). Sifat mukoadesif tersebut memberikan keuntungan terhadap peningkatan permeabilitas seluler, uptake obat, dan ekspresi gen yang dipengaruhi. Proses enkapsulasi dan pelepasan senyawa dari nanopartikel kitosan dipengaruhi faktor lingkungan seperti pH dan kualitas medium (Liu dan Gao, 2009). Rantai utama unit kitosan yang terdeasetilasi mengandung gugus amin, yang bertanggung jawab terhadap interaksi elektrostatik yang kuat dengan protein dan gen yang bermuatan negatif pada pH netral (MacLaughlin dkk., 1998; Mao dkk., 2004). Gugus amina dan hidroksi yang dimiliki kitosan menyebabkan polimer ini dapat diaplikasikan di berbagai area dan dapat digunakan untuk berbagai reaksi kimia. Stabilitas kitosan sangat dipengaruhi oleh lingkungannya, seperti pH dan kekuatan ionik. Kitosan memiliki pKa 6,5
dan memiliki kelarutan yang rendah pada pH yang tinggi. Pembentukan interaksi elektrostatik dari gugus amina yang dimiliki oleh kitosan dengan polikation negatif akan membentuk kompleks yang baik dan berguna dalam sistem penghantaran obat. Penelitian yang dilakukan oleh Gan dan Wang (2007) menunjukkan bahwa penggunaan kitosan dengan TPP mampu menghasilkan nanopartikel pengenkapsulasi protein BSA dengan EE > 50%.
4. Alginat
Alginat merupakan biopolimer alami yang utamanya diekstraksi dari tiga spesies dalam divisi alga coklat (kelp), yakni Laminaria hyperborea,
Ascophyllum nodosum, dan Macrocystis pyrifera (Smidsrod dan Skjak-Braek,
1990). Polimer alginat memiliki beberapa kelebihan diantaranya : mampu melindungi protein dari lingkungan yang bervariasi, memiliki sifat mukoadesif, efek tokisistas yang rendah, dan juga imunogenisitas yang rendah.
(a) (b)
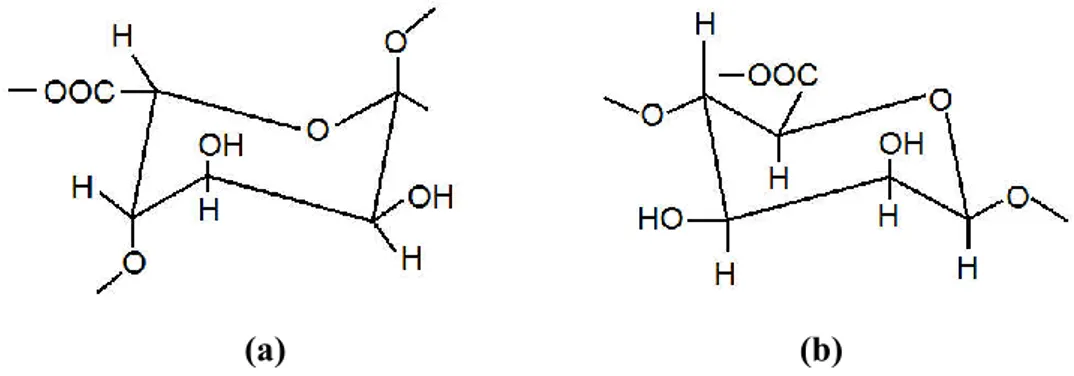
Gambar 3. Struktur kimia (a) - -guluronic acid (b) - -manuronic acid (Moura dkk., 2009)
Struktur alginat adalah berupa polisakarida linear tak bercabang yang - -manuronic acid - -guluronic acid (G) monomer
-(1-4)-glycoside bonding dalam jumlah yang bervariasi tergantung dari organisme dan jaringan penghasilnya (Gombotz dkk., 2012).
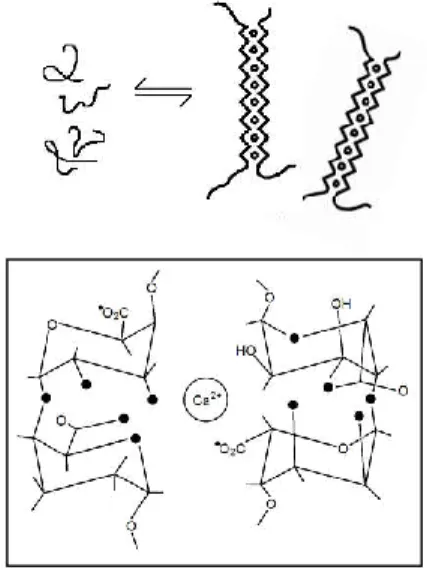
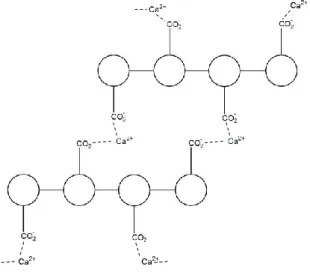
Butiran alginat dibuat dengan meng-ekstrusi larutan natrium alginat yang mengandung protein ke dalam larutan crosslinking divalen, seperti Ca2+. Proses
crosslinking dimulai dari penggantian ion natrium dari asam guluronat oleh
kation divalen, kemudian terbentuk susunan grup guluronat menjadi struktur krakteristik egg-box seperti yang ditunjukkan pada Gambar 4.
Gambar 4. Skema representasi crosslinking poly- -guluronic acid dengan ion kalsium (Rees, 1981)
Alginat secara luas digunakan pada bidang biomedis, terutama sebagai pembawa obat karena polimer ini memiliki biokompatibilitas, hidrofilisitas, porositas, dan biodegradabilitas yang baik dan (Wang dkk., 2008; Simpson dkk., 2005; Benyahia dan Polomarkaki, 2005). Konsentrasi kombinasi dari - -manuronic acid - -guluronic acid (G) mempengaruhi fleksibilitas alginat sebagai polimer dalam suatu larutan, yakni akan meningkat berdasarkan urutan kombinasi : MG>MM>GG (Smidsrod, 1973). Kelarutan alginat dapat bersifat terbatas, tergantung pada modifikasi kondisi
lingungannya. Diketahui gugus karboksil dari asam manuronat (pKa = 3,38) dan asam guluronat (pKa = 3,65) dapat mengalami protonasi melalui penambahan asam inorganik. Pengaruh pH larutan menjadi parameter kritis yang mengontrol kelarutan polisakarida (Rehm, 2009).
5. Enkapsulasi Ganda
Enkapsulasi (coating) merupakan proses penting yang mempengaruhi pola pelepasan obat, gen, dan senyawa bioaktif dari sediaan nanopartikel. Sistem pelepasan terkontrol sendiri mampu memberikan berbagai manfaat terhadap senyawa aktif dalam hal perlindungan dari proses degradasi yang cepat, penghantaran secara tertarget, serta perpanjangan durasi (Wang dkk., 2004).
Pembentukan sistem nanopartikel dengan tujuan administrasi secara per-oral biasa menggunakan kombinasi dua polimer untuk melengkapi kelebihan atau menutupi kelemahan satu sama lain. Pembentukan kompleks ionik nanopartikel enkapsulasi ganda dengan dua polimer dapat berasal dari interaksi antara gugus karboksil polimer anionik dan gugus amina polimer kationik (Ribeiro dkk., 2005).
Penelitian terhadap nanopartikel enkapsulasi ganda telah secara luas dilakukan. Lin dkk. (2008) membentuk sistem nanopartikel yang mampu memperbaiki penghantaran transmukosa dari insulin dengan memanfaatkan kombinasi kitosan dan poly- -glutamic acid -PGA). Penelitian yang dilakukan oleh Bagre dkk. (2013) menunjukkan bahwa nanopartikel enkapsulasi ganda dari kitosan dan alginat mampu memperbaiki profil pelepasan dan meningkatkan bioavailabilitas obat yang dihantarkan secara per
oral. Nanopartikel enkapsulasi ganda kitosan-alginat secara optimum dibuat pada pH 5,5 serta menghasilkan nilai EE > 60%. Keberhasilan enkpasulasi ganda dapat dilihat dari terjadinya perubahan karakteristik nanopartikel dalam hal ukuran partikel dan potensial zeta (Li dkk., 2008).
6. Tripolifosfat (TPP)
Tripolifosfat merupakan crosslinking agent yang secara luas digunakan pada formulasi nanopartikel khususnya nanopartikel kitosan. Salah satu tujuan penambahan crosslinking agent pada penggunaan polimer kitosan adalah untuk memperbaiki stabilitas membran kitosan yang mudah larut dalam suasana asam.
Gambar 5. Pentasodium Tripolyphosphate
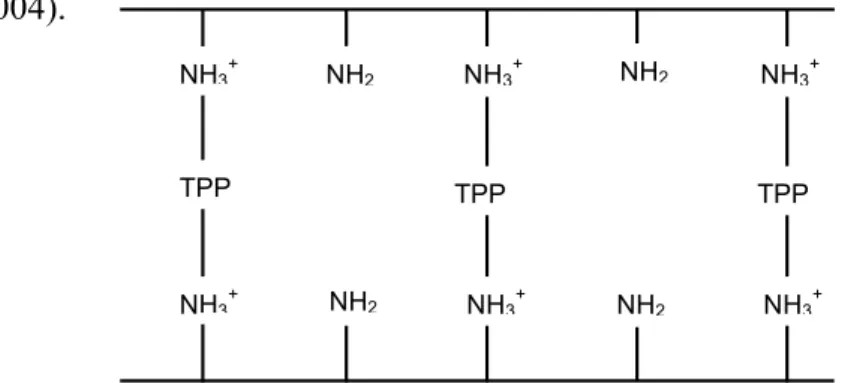
TPP bersifat membrane flexible dan pada waktu yang sama dapat memperbaiki stabilitas kimia membran kitosan. Di samping itu, TPP bersifat non-toksik dan dapat mengontrol crosslinking ratio melalui pengaturan pH larutan. Pada suasana asam TPP memiliki crosslinking ratio yang tinggi. (Liu dkk., 2004).
Gambar 6. Proses crosslinking TPP dan Kitosan (Liu dkk., 2004)
NH3+ NH3+ NH3+
TPP TPP TPP
NH3+ NH3+ NH3+
NH2 NH2
7. Kalsium Klorida(CaCl2)
Penggunaan ion kalsium sebagai pengait silang pembentukan nanopartikel alginat telah banyak diaplikasikan. Penambahan polikation seperti halnya ion Ca2+ mampu membentuk kompleks polielektrolit pada permukaan alginat (Patil dkk., 2010). Kompleks tersebut adalah berupa jaringan tiga dimesi yang stabil hasil reaksi taut silang (crosslinking) akibat interaksi ionik ion Ca2+ dengan gugus karboksil dari blok residu asam guluronat dari dua rantai alginat tetangga (Simpson dkk., 2004). Pada metode ionic gelation, variasi konsentrasi pengait silang dapat memodifikasi profil pelepasan obat dari sistem (Patil dkk., 2010). Penelitian yang dilakukan oleh Winarti (2011) dan menunjukkan bahwa penggunaan crosslinker pada konsentrasi yang terlalu tinggi, dapat menyebabkan agregasi pada partikel. Penggunaan kalsium klorida pada kadar di atas 0,1% b/v mampu menginduksi terjadinya pembentukan agregat gel pada nanopartikel (Saraei dkk., 2013).
F. Landasan Teori
Penelitian yang dilakukan oleh Bagre dkk. (2013) menunjukkan bahwa formula enkapsulasi ganda nanopartikel kitosan dan alginat mampu memperbaiki profil pelepasan dan meningkatkan bioavailabilitas obat secara per oral. Pembentukan sistem nanopartikel dengan desain yang serupa terhadap RIP MJ-C diprediksikan mampu melindungi protein dari kemungkinan degradasi dan inaktivasi protein dalam saluran cerna. Formulasi nanopartikel dengan menggunakan metode ionic gelation dipengaruhi oleh pH medium serta kadar penggunaan komponen pembentuk sistem nanopartikel.
Kitosan memiliki pKa 6,5 sehingga akan terprotonasi pada pH di bawah pKa-nya. Semakin besar perbedaan nilai pH formulasi di bawah pKa kitosan, maka semakin banyak pula persentase senyawa kitosan yang terprotonasi. Kondisi tersebut memungkinkan terjadinya interaksi ionik yang kuat antara gugus -COO- RIP MJ-C dengan gugus -NH3+ dari kitosan sehingga mampu meningkatkan efisiensi enkapsulasi nanopartikel. Kitosan cenderung sukar larut pada pH medium > dari pKa-nya, sehingga pH formulasi di atas nilai 6,5 dihindari dalam formulasi nanopartikel kitosan-natrium tripolifosfat RIP MJ-C (NPMJ-1). Kadar penggunaan penggunaan polimer menjadi faktor yang mempengaruhi kecukupan pembentukan sistem dalam mengenkapsulasi protein secara efisien serta menentukan besarnya ukuran partikel yang terbentuk. Penelitian yang dilakukan oleh Bagre dkk. (2013) menunjukkan bahwa penggunaan kitosan sebagai inti (core) dalam formulasi nanopartikel enkapsulasi ganda diketahui mampu menghasilkan nanopartikel dengan EE
70,6±4,2% pada pH formulasi 5,5. Kadar penggunaan kitosan 0,5% b/v dan TPP 0,03% b/v diketahui mampu mengenkapsulasi RIP MJ secara optimum dengan nilai efisiensi enkapsulasi sebesar 87,34 % dan stabil dalam penyimpanan selama 7 hari.
Pembentukan lapisan enkapsulasi ganda terhadap NPMJ-1 ditentukan berdasarkan kecukupan polimer alginat dan pengait silang kalsium klorida dalam membentuk ikatan pada permukaan NPMJ-1. Alginat memiliki gugus karboksil dari asam guluronat dengan pKa = 3,65 akan terdeprotonasi pada kondisi pH>pKa-nya. Saat proses enkapsulasi ganda, gugus (-COO-) dari alginat dapat berinteraksi membentuk kompleks dengan gugus amina (-NH3+) pada permukaan NPMJ-1. Kadar penggunaan pengait silang turut menjadi faktor yang mempengaruhi kekompakan serta kestabilan muatan permukaan nanopartikel yang dihasilkan. Penelitian yang dilakukan oleh Winarti (2011) menunjukkan bahwa penggunaan crosslinker pada konsentrasi yang terlalu tinggi dapat menyebabkan agregasi pada partikel. Formulasi nanopartikel alginat dengan menggunakan kadar kalsium klorida di atas 0,1% b/v akan menginduksi pembentukan agregat gel (Saraei dkk., 2013).
Keberhasilan proses enkapsulasi ganda nanopartikel dapat diamati berdasarkan kemampuan sistem untuk membentuk penampakan visual jernih serta perubahan ukuran dan muatan permukaan partikel. Bertambahnya ukuran partikel menjadi salah satu indikasi terbentuknya lapisan tambahan pada permukaan NPMJ-1. Distribusi ukuran yang merata pada sediaan dapat dilihat melalui nilai Polydispersity Index (PI) < 0,7. Perubahan potensial zeta yang
awalnya bernilai positif menjadi bernilai negatif menunjukkan bahwa gugus COO- dari alginat telah mampu melakukan interaksi ionik dengan gugus NH3+ pada permukaan NPMJ-1 sehingga menjadi indikasi kuat dari keberhasilan proses enkapsulasi ganda (Li dkk., 2008).
G. Hipotesis
Berdasarkan teori yang telah dipaparkan, dapat disusun beberapa hipotesis untuk menjawab rumusan masalah dalam penelitian ini, diantaranya :
1. Penggunaan kitosan BMR 0,3-0,5% b/v dan TPP 0,03% b/v pada pH pembuatan 3,5-5,5 dapat membentuk NPMJ-1 dengan nilai EE optimum (>50 %) dan stabil dalam penyimpanan selama 7 hari.
2. Penggunaan alginat 0,3% b/v dan kalsium klorida 0,1-0,3 % b/v dapat membentuk NPMJ-2 yang stabil dalam penyimpanan selama 7 hari.
3. Formula optimum NPMJ-2 memiliki karakteristik ukuran partikel <1000 nm, nilai potensial zeta negatif (-), dan polydispersity index < 0,7.