Permasalahan pada Tanah Ultisol
Jenis tanah yang berordo Ultisol merupakan salah satu jenis tanah yang cukup potensial digunakan sebagai lahan pertanian, namun karena tingkat kesuburan tanahnya rendah menyebabkan tanah tersebut masih termarjinalkan. Luas tanah ultisol mencapai 45.794 juta ha atau 24.3% dari total luas lahan kering di Indonesia (Hidayat & Mulyani 2002). Sebaran tanah Ultisol tersebut terdapat di Kalimantan (47.91%), Sumatra (20.68%), Papua (16.63%), Sulawesi (9.39%), Maluku (2.71%) dan Jawa+Bali+Nusa Tenggara (2.68%). Konsepsi pokok dari tanah Ultisol adalah tanah yang telah mengalami proses hancuran lanjut (ultimate) dan pencucian berat oleh curah hujan yang tinggi, berwarna merah kuning, berpenampang > 2m, dan terdapat lapisan argilik dari akumulasi liat (Subagyo et al. 2000). Basa-basa akan tercuci dari kompleks jerapan sehingga tinggal Al dan H sebagai kation dominan yang menyebabkan tanah bereaksi masam. Oleh karenanya tanah Ultisol banyak tersebar luas di wilayah tropis basah.
Pada tanah ultisol terdapat beberapa kendala kimia yang sering ditemukan secara serempak dan saling berinteraksi dalam menghambat pertumbuhan tanaman. Data analisis tanah Ultisol dari berbagai wilayah di Indonesia menunjukkan bahwa reaksi tanahnya sangat masam sampai masam (pH 4.1- 4.8), kandungan bahan organik sangat rendah sampai sedang dengan rasio C/N tergolong rendah. Kandungan P potensial maupun P tersedia sangat rendah, K potensial sangat rendah sampai rendah dan KTK termasuk rendah . Jumlah basa-basa dapat ditukarkan dan kejenuhan basa-basa tergolong sangat rendah (Hidayat & Mulyani 2002). Selanjutnya dikatakan bahwa pada reaksi tanah sangat masam (pH < 4.5) kelarutan Al dapat ditukarkan meningkat sehingga menaikkan kejenuhan Al. Tanah Ultisol dengan kejenuhan Al lebih dari 30% dan pH kurang dari 4.5 akan menimbulkan cekaman Al bagi tanaman (Subagyo et al. 2000). Bentuk-bentuk Al dalam larutan tanah tergantung tingkat kemasamannya. Pada keadaan reaksi tanah sangat masam (pH < 4.5), Al menjadi sangat larut terutama dalam bentuk Al3+ yang beracun bagi tanaman (Marschner 1995; Rout et al. 2001; Vitorello et al. 2005). Bentuk lain Al dapat ditemukan pada pH yang lebih tinggi
misalnya AlOH2+ pada pH 4.5-5.0, Al(OH)2+ pada pH 5.5-6.0, dan Al(OH)4- atau
Al(OH)3 pada pH di atas 6.0 (Marschner 1995).
Adanya kelarutan Al yang tinggi dapat menyebabkan keracunan pada akar sehingga pertumbuhan akar menjadi terhambat dan akhirnya menurunkan kemampuan akar dalam menyerap hara mineral dan air (Matsumoto et al. 1996; Samuel et al. 1997). Selain itu kelarutan Al yang tinggi pada tanah Ultisol dapat juga menyebabkan ketersediaan hara P menurun. Pada reaksi tanah yang masam, ion-ion Al bebas akan memfiksasi ion fosfat membentuk hidroksi fosfat yang tidak larut, akibatnya sering terjadi defisiensi hara tersebut (Ralalage et al. 1995; Rout et al. 2001).
Pengaruh Cekaman Aluminium pada Tanaman
Cekaman Al yang sering terjadi pada tanah Ultisol merupakan penghambat utama bagi pertumbuhan tanaman. Gejala umum yang paling nyata terlihat bila keracunan Al adalah terhambatnya pertumbuhan dan perpanjangan akar, baik akar primer, akar lateral, maupun bulu akar. Tanaman yang keracunan Al mempunyai akar yang pendek, percabangan sedikit, akar adventif lebih banyak tumbuh pada pangkal akar, serta akar primer berkembang melebar ke arah apikal meristem sehingga terlihat gemuk (Rout et al. 2001). Pertumbuhan akar yang demikian sulit melakukan penetrasi ke lapisan sub soil menyebabkan penyerapan hara dan air menjadi lebih rendah (Marschner 1995).
Kelarutan Al sebagai Al3+ merupakan bentuk yang sangat beracun dan dapat merusak akar serta menghambat penyerapan hara mineral (Delhaize & Ryan 1995; Samuel et al. 1997). Bentuk lain seperti Al(OH)2+ juga beracun bagi tanaman terutama kedelai, disamping itu bentuk monomer secara bersamaan dapat lebih menghambat pertumbuhan akar dibandingkan secara individual (Alva et al. 1986; Bushamuka & Zobel 1998). Kerusakan akar akibat keracunan Al juga dilaporkan pada beberapa tanaman, seperti padi (Sivaguru & Paliwal 1993; Bakhtiar et al. 2007), sorgum (Tan et al. 1993), barley (Matsumoto et al. 1996), gandum (Samuel et al. 1997) dan jagung (Bushamuka & Zobel 1998).
Penghambatan pertumbuhan akar oleh cekaman Al terjadi karena pembe-lahan dan pemanjangan sel pada meristem akar terhambat. Aluminium yang masuk ke dalam sel akan merusak membran plasma dan protein di dalam
membran plasma, selanjutnya Al akan berikatan dengan gugus P pada DNA sehingga menghambat pembelahan sel (Delhaize & Ryan 1995; Matsumoto 1988; Matsumoto et al. 1996). Selain itu, Al dapat juga menggantikan Ca pada ikatan Ca-pektat serta menstimulir sintesis lignin di dalam dinding sel, akibatnya terjadi kekakuan dinding sel dan pemanjangan sel-sel akar menjadi terhambat (Blamey et al. 1993; Watanabe & Okada. 2005). Kalsium sangat dibutuhkan untuk menjaga stabilitas membran dan perkembangan sel. Penggantian Ca oleh Al akan menye-babkan kerusakan pada membran plasma dan terjadi kebocoran sel (Matsumoto et al. 1996; Rengel 1997).
Akumulasi Al pada jaringan akar akan menentukan tingkat toleransi genotipe tanaman terhadap cekaman Al dan berkorelasi dengan tingkat kerusakan akar. Pada genotipe toleran, kandungan Al yang terakumulasi pada jaringan akar umumnya lebih rendah dibandingkan genotipe peka (Delhaize & Ryan 1995; Ma 2000). Hasil deteksi visual penetrasi Al dengan metode pewarnaan hematoksilin pada akar kedelai dari genotipe Yellow (toleran Al ) menunjukkan bahwa akumulasi Al terdapat pada permukaan ujung akar sehingga kerusakan yang terlihat hanya pada bagian tersebut. Sementara itu, pada genotipe Lumut (peka Al) terlihat adanya akumulasi Al sampai ke bagian akar yang lebih tua sehingga kerusakan akar tampak pada jaringan yang lebih dalam dan ke arah jaringan yang lebih tua (Sopandie et al. 2003). Sementara itu, pada tanaman yang sangat peka seperti barley, kerusakan dapat mencapai korteks maupun epidermis dan tidak terbatas pada jaringan meristematik saja (Matsumoto et al. 1996).
Gejala kerusakan akar dapat terlihat dalam waktu yang relatif singkat setelah Al diserap oleh akar. Aluminium dapat menyebabkan kerusakan akar saat masih berada di dinding sel tanpa menunggu masuk ke dalam sel (Delhaize & Ryan 1995). Pada tanaman ercis, perpanjangan akar mulai terhambat setelah 24 jam terkena cekaman Al (Matsumoto et al. 1996). Akar tanaman gandum yang mengalami cekaman Al selama 6 jam memperlihatkan gejala kerusakan akar yang tidak dapat balik (Sasaki et al. 1994).
Adanya cekaman Al dapat juga menurunkan efisiensi pemupukan pada tanah ultisol. Penambahan unsur-unsur hara melalui pemupukan sering tidak bermanfaat pada tanah Ultisol, bila kelebihan Al tidak diatasi (Idris 1995). Pada
reaksi tanah yang masam, ion-ion Al bebas akan mengfiksasi ion fosfat membentuk hidroksi fosfat yang tidak larut, akibatnya sering terjadi defisiensi hara tersebut (Naidu et al. 1990; Ralalage et al. 1995).
Adaptasi Tanaman terhadap Cekaman Aluminium
Adanya sifat toleransi terhadap kelebihan Al merupakan faktor utama untuk adaptasi tanaman pada tanah masam. Secara umum, kemampuan adaptasi tanaman terhadap cekaman Al dilakukan melalui 2 mekanisme, yaitu : (1) mekanisme eksternal, yaitu sistem adaptasi dengan cara mencegah Al agar tidak masuk ke dalam sel (Pineros et al. 2002), dan (2) mekanisme internal, yaitu sistem adaptasi dengan cara mengurangi toksisitas Al di dalam sel tanaman (Ma 2000; Watanabe et al. 2006). Pada mekanisme eksternal, detoksifikasi Al terjadi di apoplas, sedangkan mekanisme internal terjadi di simplas (Rout et al. 2001).
Tanaman dengan sistem mekanisme toleransi eksternal memiliki kemam-puan untuk melakukan penolakan terhadap Al (eksklusi Al) dari tempat peka di akar. Permeabilitas membran plasma yang selektif terhadap Al dan kapasitas tukar kation (KTK) apoplas yang rendah merupakan bentuk toleransi dengan cara mengeksklusi Al (Taylor 1988). KTK apoplas tinggi akan meningkatkan pertukaran kation-kation polivalen sehingga kemungkinan terjadinya akumu-lasi Al menjadi lebih besar (Matsumoto et al. 1996).
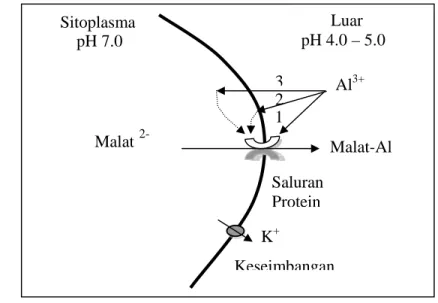
Gambar 2. Pengaruh Al terhadap effluks asam malat melalui saluran protein (Delhaize & Ryan 1995)
2 1 Luar pH 4.0 – 5.0 Sitoplasma Keseimbangan Malat-Al Malat 2-K+ Al3+ Saluran Protein pH 7.0 3
Selain itu, sistem toleransi eksternal dapat juga dilakukan tanaman melalui eksudasi asam-asam organik yang mampu mengkelat Al, sehingga terjadi immobilisasi Al di apoplas dan menurunkan kelarutan Al di daerah rizosfir (Ma 2000). Proses efluks asam organik dari dalam sel akar dapat dilakukan dengan tiga cara, yaitu efluks secara pasif melalui membran bilayer, efluks melalui saluran protein pada membran plasma, dan efluks secara aktif karena adanya gradien potensial elektro-kimia yang diatur oleh H+-ATPase (Jones & Brassington 1998). Pada beberapa tanaman, eksudasi asam-asam organik sebagai respon terhadap cekaman Al sebagian besar diefluks melalui saluran protein (Gambar 2). Menurut Delhaize & Ryan 1995, pengaruh Al terhadap efluks asam malat melalui saluran protein melibatkan tiga mekanisme, yaitu (1) Al berinteraksi langsung dengan saluran protein, sehingga meningkatkan masa waktu pembukaan saluran protein, (2) Al berinteraksi dengan reseptor spesifik pada permukaan membran atau dengan membran yang selanjutnya melalui serangkaian kurir sekunder di sitoplasma akan mengubah aktivitas saluran protein, dan (3) Al masuk ke sitoplasma, kemudian dapat secara langsung mengubah aktivitas saluran protein dengan cara menempel saluran dari dalam, atau secara tidak langsung melalui suatu transduksi sinyal. Di daerah rizosfir, asam-asam organik yang diketahui mempunyai afinitas yang tinggi terhadap logam bervalensi tiga seperti Al3+ dan Fe3+ akan membentuk kompleks Al-asam organik atau Fe-asam organik sehingga mengurangi kelarutan logam-logam tersebut (Jones & Brassington 1998).
Keterlibatan asam-asam organik dalam sistem toleransi eksternal telah banyak dilaporkan. Pada genotipe gandum yang toleran Al, asam malat banyak dieksudasi melalui ujung akar, yaitu 5 sampai 10 kali lebih banyak dibandingkan genotipe peka (Delhaize et al. 1993). Selain asam malat, toleransi tanaman gandum juga terjadi karena terikatnya Al pada mucillage akar dan melibatkan eksudasi fosfat (Archambaut et al. 1996; Pellet et al. 1997). Genotipe kedelai yang toleran Al banyak mengakumulasi dan mengeksudasi asam sitrat dan malat untuk merespon adanya cekaman Al (Kasim et al. 2001). Sementara itu, genotipe toleran pada tanaman wortel, buncis, dan jagung banyak mengeksudasi asam sitrat sebagai respon terhadap cekaman Al (Ojima & Ohira 1988; Miyasaka et al. 1991; Pellet et al. 1995).
Peningkatan pH rizosfir pada tanah masam juga merupakan salah satu bentuk mekanisme toleransi eksternal terhadap cekaman Al. Kemampuan tanaman untuk menaikkan pH dapat mengurangi pengaruh buruk Al melalui proses hidrolisis dan polimerasi Al menjadi bentuk yang kurang beracun (Taylor, 1988). Keseimbangan penyerapan kation-anion, terutama amonium (NH4+) dan
nitrat (NO3-), merupakan salah satu parameter yang penting dalam sistem
pengaturan pH rizosfir. Pada tanaman kedelai, naiknya pH berkaitan dengan kemampuan genotipe toleran untuk menyerap nitrat lebih banyak dibandingkan amonium. Hal ini juga disertai dengan tingginya aktivitas spesifik NR (nitrat reduktase) pada akar genotipe toleran (Sopandie 1999). Nitrat yang diserap tanaman akan direduksi menjadi asam-asam organik dan menyebabkan ekskresi OH- sehingga pH rizosfir meningkat (Haynes 1990).
Kemampuan tanaman untuk mendetoksifikasi Al dalam sitosol merupakan ciri spesies tanaman yang mempunyai sistem mekanisme toleransi internal. Tanaman mampu mempertahankan proses metabolismenya, walaupun Al telah masuk ke dalam sitosol. Mekanisme ini dapat berupa pengkelatan Al di sitosol, kompartementasi Al ke dalam vakuola, sintesis protein pengikat Al dan evolusi enzim yang toleran Al (Taylor 1988).
Peningkatan akumulasi asam-asam organik pada tanaman yang toleran Al mengindikasikan adanya peranan asam-asam organik dalam mendetoksifikasi Al dalam jaringan tanaman. Detoksifikasi Al oleh asam organik dapat dilakukan dengan cara mengkelat Al pada kelompok karboksilat dari molekul asam organik membentuk kompleks Al-asam organik yang stabil sehingga tidak menyebabkan keracunan bagi tanaman (Ma 2000). Pada akar tanaman jagung yang toleran terdapat akumulasi asam malat dan trans-akonitat yang diduga dapat mendetoksifikasi Al dalam sitosol (Suhayda & Haug 1986). Sementara itu, pada tanaman Hydrangea macrophylla detoksifikasi Al di sitosol dilakukan oleh asam sitrat (Ma et al. 1997).
Pada beberapa spesies tanaman, detoksifikasi Al dilakukan dengan cara mengkompartementasi Al ke dalam vakuola. Pengamatan membran mikrosomal pada akar barley menunjukkan bahwa Al banyak diakumulasi di dalam vakuola oleh genotipe yang toleran (Matsumoto 1991). Selain itu dijelaskan pula bahwa
aktivitas transport H+ tonoplas mempunyai peranan yang penting dalam pertukaran proton dengan Al yang dikompartementasi di vakuola.
Pada tanaman gandum, peningkatan aktivitas beberapa enzim merupakan salah satu bentuk toleransi terhadap Al. Slaski et al. (1996) melaporkan adanya peningkatan enzim-enzim glukosa-6-fosfat dehidrogenase dan 6-fosfoglukonat dehidrogenase pada genotipe gandum yang toleran Al. Kedua enzim tersebut terlibat dalam biosintesis lintasan pentosa fosfat yang diduga dapat berperan dalam sistem toleransi tanaman terhadap cekaman Al.
Struktur Umum Fungi Mikoriza Arbuskula
Mikoriza merupakan suatu struktur khas pada sistem perakaran yang terbentuk karena adanya simbiosis mutualistik antara fungi (myces) dan akar (rhiza) dari tumbuhan tingkat tinggi. Bentuk struktur khas mikoriza dapat dibedakan berdasarkan cara infeksinya pada perakaran tanaman inang, yaitu : (1) endomikoriza, merupakan struktur mikoriza yang terbentuk sampai ke dalam sel korteks akar, (2) ektomikoriza, merupakan struktur mikoriza pada lapisan luar akar yang bentuknya berupa jala hartig; dan (3) ektendomikoriza, merupakan struktur mikoriza yang tidak hanya dapat membentuk jala hartig di permukaan akar, tetapi dapat menembus sel korteks (Smith & Read, 1997). Salah satu simbion fungi yang banyak membentuk struktur endomikoriza pada tanaman pertanian adalah fungi mikoriza arbuskula (FMA). Secara taksonomi FMA termasuk ke dalam kelas Zygomycetes, ordo Glomales yang terbagi dalam tiga famili yaitu Gigasporaceae, Glomaceae, dan Acaulosporaceae. Masing-masing famili terbagi atas dua genus, secara berurutan adalah Gigaspora, Scutelospora, Glomus, Sclerocyctis, Aculospora, dan Entrophospora.
Akar yang terinfeksi FMA tidak mengalami pembesaran dan tetap mempunyai rambut-rambut akar sehingga penampilannya tidak berbeda dengan akar-akar yang tidak terinfeksi. Hal tersebut disebabkan hifa eksternal pada permukaan akar hanya berbentuk lapisan tipis, tidak setebal mantel seperti pada ektomikoriza. Karakteristik lain yang merupakan ciri khas dari FMA adalah adanya struktur berbentuk percabangan hifa yang disebut arbuskula (arbuscules) dan ada juga yang membentuk struktur berbentuk oval yang disebut vesikula (vesicules). Struktur arbuskula berfungsi sebagai alat tranfer hara antar kedua
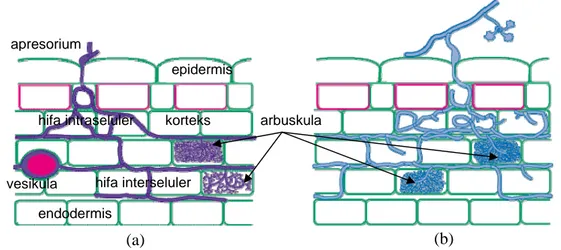
simbion, sedangkan vesikula berfungsi sebagai organ penyimpan cadangan makanan. Tidak semua jenis FMA membentuk kedua struktur tersebut, seperti jenis Glomus, Sclerocystis, Acaulospora, dan Entrophospora dapat membentuk struktur arbuskula maupun vesikula, sedangkan jenis lainnya seperti Gigaspora dan Scutellospora hanya membentuk struktur arbuskula (Brundrett et al. 1996). Struktur miselium intraradikal dari FMA pada akar tanaman dapat dilihat pada Gambar 3.
Gambar 3. Struktur miselium intraradikal pada FMA: (a) yang membentuk struktur arbuskula dan vesikula, dan (b) hanya arbuskula (Brundrett et al. 1996).
Secara umum proses koloni FMA pada akar tanaman melewati empat tahap, yaitu (1) induksi perkecambahan spora dan pertumbuhan hifa, (2) kontak antara hifa dan permukaan akar yang menyebabkan pengenalan dan pembentukan apresorium, (3) penetrasi hifa ke dalam akar, dan (4) perkembangan struktur hifa interseluler (Bonfante & Perotto 1995). Koloni FMA pada akar tanaman inang diawali dengan kontak hifa dan pelekatan pada akar, setelah 2-3 hari terjadi pembentukan apresorium yang membengkak. Perkembangan selanjutnya akan terjadi pengecilan diameter hifa membentuk ujung yang agak runcing, dan kemudian diikuti dengan ekspansi hifa memasuki lumen sel dan berkembang diantara rongga-rongga interselluler korteks. Hifa interselluler kemudian berkembang membentuk struktur percabangan (arbuskula) dan pada beberapa cendawan dapat juga membentuk struktur oval (vesikula). Meskipun
vesikula arbuskula epidermis korteks endodermis apresorium hifa intraseluler (a) (b) hifa interseluler
perkembangan arbuskula dan vesikula terlihat menembus dinding sel korteks, namun kenyataannya membran plasmanya tidak rusak, tetapi berkembang mengelilingi bentuk arbuskula atau vesikula membentuk kompartemen apoplastik baru yang disebut bidang kontak (Smith & Smith 1996).
Keragaman dan Manfaat FMA bagi Tanaman
Fungi mikoriza arbuskula merupakan tipe mikoriza yang paling banyak mendapat perhatian, karena diketahui dapat bersimbiosis dengan sekitar 80% spesies tanaman (Brundrett et al. 1996). Keragaman FMA dapat ditemukan pada berbagai ekosistem, baik yang masih utuh maupun yang telah mengalami perubahan. Eksplorasi FMA pada daerah perkebunan kelapa sawit telah berhasil diidentifikasi jenis-jenis FMA, antara lain Acaulospora tuberculata, A. foveata, A. mellea , A. scrobiculata, Glomus fluegianum, G. rubiforme, G. sinuosum, dan G. globisporum (Widiastuti & Kramadibrata, 1993). Sementara itu, eksplorasi pada bukit pasir di daerah pantai banyak ditemukan FMA dari jenis Glomus, Sclerocystis, Acaulospora, dan Gigaspora (Setiadi 2000). Pada tanah masam podsolik juga telah diidentifikasi jenis-jenis FMA indigen pada pertanaman padi gogo dan ubi kayu (Tabel 1).
Tabel 1. Identifikasi FMA indigen tanah podsolik pada lahan pertanaman padi gogo dan ubi kayu (Iriani 2003)
Jenis pertanaman
Jenis CMA indigen yang ditemukan
Kerapatan (spora/g tanah) Padi gogo Acaulospora laevis
Glomus agregatum Glomus etunicatum Gigaspora margarita Glomus fasciculatum 23 14 12 10 4 Ubi kayu Glomus agregatum
Gigaspora margarita Glomus manihotis Glomus etunicatum Acaulospora laevis Glaziella spp. Glomus macrocarpum 31 25 16 9 7 3 3
Dari berbagai kegiatan eksplorasi FMA di beberapa tempat di Indonesia telah diidentifikasi 54 jenis FMA dan telah dibuat isolatnya oleh laboratorium
Bioteknologi Kehutanan Pusat Studi Hayati dan Bioteknologi IPB (Setiadi 2000). Koleksi berbagai isolat FMA dapat dijadikan sumber plasma nutfah yang sangat potensial dan dapat digunakan untuk kegiatan penelitian maupun kepentingan lainnya. Beberapa isolat yang telah dibuat biakan murninya (monosenic) adalah : Glomus manihotis (INDO-1), Acaulospora tuberculata (INDO-2), Glomus mossea (INDO-3), Acaulospora delicata (INDO-4), Acaulospora scrobiculata (INCO-1), Acaulospora sp (INCO-2), Gigaspora rosea (FL.105), Gigaspora margarita (FL.1-5), Glomus etunicatum (FL.126), dan Glomus sp(BIO-4).
Secara alami terdapat asosiasi mikoriza antara fungi dan tanaman dalam bentuk simbiosis mutualisme. Berdasarkan aspek fungsional, simbiosis mutualisme dikatakan berhasil apabila kedua simbion dapat memanfaatkan fungsi simbiosis secara maksimal. Indikator keberhasilan tersebut dapat terlihat dari pertumbuhan dan perkembangan kedua simbion. Manfaat fungsional yang diperoleh FMA dapat dilihat dari adanya pembentukan struktur arbuskula dan atau vesikula di dalam sel-sel akar serta produksi spora yang tinggi. Perkembangan FMA dan produksi spora membutuhkan energi yang diperoleh melalui penyerapan C organik dari tanaman inang (Smith & Read 1997). Sementara itu, tanaman inang dapat memanfaatkan fungsi simbiosis berupa hara mineral dan air yang penyerapannya dibantu oleh FMA sehingga pertumbuhan dan hasil tanaman meningkat.
Transfer hara antara fungi dan tanaman terjadi dalam struktur arbuskula. Fungi menyerap carbon dalam bentuk karbohidrat terlarut kemudian dengan cepat mengkonversinya menjadi bentuk lipid dan glikogen, yang selanjutnya disimpan di dalam struktur hifa maupun vesikula (Brundrett et al. 1996). Sukrosa dan glukosa merupakan bentuk utama karbohidrat terlarut yang ditranslokasikan ke akar tanaman yang bermikoriza (Bago et al. 2000).
Terbentuknya simbiosis antara tanaman dan FMA sangat tergantung pada jenis FMA, genotipe tanaman, dan kondisi tanah serta interaksi ketiganya (Brundrett et al. 1996). Untuk mereklamasi lahan bekas pertambangan nikel, jenis isolat Gigaspora rosea (FL.105), Glomus etunicatum (FL.126), Acaulospora scrobiculata (INCO-1), dan Acaulospora sp (INCO-2) telah terbukti efektif pada bibit sengon dan acasia (Setiadi 2000). Jenis FMA yang telah diketahui dapat
bersimbiosis dengan cabai adalah Gigaspora margarita (Haryantini & Santoso 2001), dan Glomus agregatum (Rahayu et al. 2002).
Adanya simbiosis dengan FMA telah banyak diketahui mampu memper-baiki hara tanaman inang melalui penyerapan hara dan air yang pada akhirnya akan meningkatkan pertumbuhan dan hasil tanaman. Inokulasi FMA pada cabai dapat meningkatkan serapan P (Haryantini & Santoso 2001) dan meningkatkan adaptasi terhadap kekeringan (Rahayu et al. 2002). Pada tanah Ultisol, inokulasi FMA juga dapat meningkatkan serapan P pada jagung (Nurlaeni et al. 1996), meningkatkan adaptasi kedelai terhadap cekaman kekeringan (Hapsoh et al. 2005) maupun cekaman ganda Al dan kekeringan (Hanum 2004). Fungi mikoriza arbuskula yang menginfeksi sistem perakaran tanaman inang akan memproduksi jalinan hifa eksternal yang dapat tumbuh secara ekspansif dan menembus lapisan subsoil sehingga meningkatkan kapasitas akar dalam penyerapan hara dan air. Volume tanah yang dapat dijelajahi oleh 1 cm akar yang bermikoriza dapat mencapai 12-15 cm3 atau 6-15 kali lebih banyak dibandingkan akar tanaman tidak bermikoriza yang hanya dapat menjelajahi sekitar 1-2 cm3 (Cruz et al. 2004).
Fosfat merupakan unsur hara utama yang dapat diserap oleh tanaman yang bermikoriza (Bolan 1991). Secara fungsional, FMA dapat membantu penyerapan hara terutama P melalui tiga tahap, yaitu (1) P diserap oleh hifa dari larutan tanah, (2) translokasi P melalui hifa, dan (3) transfer P melewati interfase ruang fungi (Cruz et al. 2004). Pergerakan P anorganik secara difusi dari larutan tanah ke rizosfir sangat lambat sehingga terjadi daerah deplesi P di sekitar perakaran. Adanya hifa eksternal memungkinkan tanaman dapat mengeksploitasi P di luar daerah deplesi (Joner et al. 1995). Pada tanaman bermikoriza daerah deplesi P di sekitar perakaran akan semakin luas, karena eksploitasi P oleh hifa eksternal cukup tinggi (Bolan 1991).
Peningkatan serapan P tanaman yang bermikoriza terutama pada tanah-tanah yang mengandung kompleks P tetapi tidak tersedia disebabkan oleh adanya aktivitas fosfatase asam di rizosfir. Inokulasi FMA dapat menginduksi aktivitas fosfatase asam yang berperan dalam mineralisasi P organik sehingga Pi menjadi tersedia bagi tanaman (Joner & Johansen 2000).
Selain itu, FMA juga membantu penyerapan hara N, K dan Mg yang mobil, serta unsur mikro seperti Cu, Zn, Mn, B dan Mo (Smith & Read 1997). Inokulasi FMA pada tanaman kedelai mampu meningkatkan serapan hara N, P, dan K serta dapat memperbaiki toleransi tanaman terhadap cekaman ganda Al dan kekeringan (Hanum 2004).
Kondisi tanah yang terdegradasi umumnya tingkat kesuburan tanahnya rendah, dan ada yang mengandung unsur yang beracun bagi tanaman. Pemanfaatan FMA telah banyak dilaporkan mampu meningkatkan toleransi tanaman terhadap tanah masam (Clark 1997; Cuenca et al. 2001), dan mampu bertindak sebagai bio-remediator pada tanah yang tercemar logam berat seperti tembaga, nikel, seng dan timbal (Shetti et al. 1995; Setiadi 2000).
Fungsi FMA dalam meningkatkan toleransi tanaman terhadap Al belum dibahas secara mendalam, namun beberapa penelitian mengindikasikan bahwa FMA dapat memperbaiki kondisi rizosfir sehingga meningkatkan daya adaptasi tanaman terhadap cekaman Al pada tanah masam. Bentuk mekanisme tersebut diduga melibatkan induksi sintesis asam-asam organik dan aktivitas fosfatase asam, serta perubahan pH rizosfir. Hifa eksternal dari FMA sangat aktif menyerap nitrat sehingga menginduksi peningkatan pH rizosfir (Bago et al. 1996). Selain itu, banyak ditemukan Al dalam sel dari micelium FMA yang diinokulasikan pada Clusia multifloria (Cuenca 2001), namun bagaimana Al dikompartementasikan dalam sitoplasma belum diketahui. Beberapa jenis FMA yang diketahui dapat berperan pada kondisi tanah masam dan konsentrasi Al yang tinggi antara lain: Glomus manihotis, Gigaspora sp, dan Acaulospora sp (Clark 1997).
Syarat Tumbuh Tanaman Cabai
Tanaman cabai merah dapat tumbuh pada berbagai jenis tanah yang mempunyai struktur remah, kaya bahan organik serta drainase dan aerasi cukup baik. Tingkat kemasaman tanah antara pH 5.5 - 6.8 merupakan kondisi yang baik untuk tanaman cabai. Untuk dapat tumbuh optimal, tanaman cabai memerlukan kisaran suhu udara 16o – 270 C. Suhu udara yang optimum untuk pertumbuhan dan pembungaannya adalah 210 – 270 C dan untuk pembuahannya antara 160 – 230C. Suhu malam kurang dari 160 C dan suhu siang lebih dari 230C akan
menghambat pembungaan. Suhu optimum untuk pertumbuhan vegetatif adalah 160 - 200 C (Sumarni, 1996).
Sementara itu Rubatzky & Yamaguchi (1996), menyatakan bahwa intensitas curah hujan yang sesuai untuk pertumbuhan tanaman cabai adalah 600 – 1.200 mm/tahun. Tanaman cabai kurang tahan terhadap curah hujan yang tinggi, terutama pada saat berbunga, karena bunga akan gugur. Curah hujan yang merata sepanjang tahun berpengaruh baik, karena tidak terjadi kekurangan ataupun kelebihan air selama pertumbuhannya.
Penanaman cabai umumnya dilakukan dengan cara pindah tanaman (transplanting), namun ada juga yang dilakukan dengan cara sebar langsung tanpa penyemaian. Media persemaian yang baik adalah campuran antara pupuk kandang dan tanah dengan perbandingan 1: 1 (Rubatzky & Yamaguchi 1997 ). Pada sistem transplanting, bibit yang berumur 3-4 minggu setelah semai dapat dipindahkan ke lapang (Sumarni 1996). Jarak tanam yang biasa digunakan yaitu 60 – 80 cm untuk jarak antara baris, dan 40 – 50 cm untuk jarak dalam baris. Jarak tanam yang terlalu rapat mengakibatkan tanaman tumbuh terlalu tinggi, sehingga mudah patah oleh angin. Jumlah pupuk yang diberikan tergantung pada kebutuhan tanaman dan ketersediaan hara dalam media tumbuh. Cabai yang ditanam dalam rumah kaca menggunakan polibag membutuhkan jumlah pupuk yang lebih banyak dibandingkan bila ditanam di lapangan. Tanaman cabai di lapangan memerlukan pupuk kurang lebih 170 – 220 kg N/ha, dan 120 kg P2O5/ha
serta kalium ditambahkan apabila ketersediaannya kurang (Rubatzky & Yamaguchi 1997). Pada budidaya cabai di lapangan menggunakan mulsa polyethylene dan irigasi tetes membutuhkan pupuk untuk memperoleh hasil yang optimum sebanyak 200 kg N/ha, 100 kg P2O5/ha dan 150 kg K2O/ha (Alviana
2005). Penyakit utama yang perlu diwaspadai pada cabai adalah antraknosa, disebabkan oleh cendawan Colletotrichum yang menyerang buah pada saat belum panen maupun setelah panen hingga dalam penyimpanan (Sumarni 1996).