1
BAB I
PENDAHULUAN
1.1Latar Belakang
Kristalisasi dari larutan sangat penting dalam industri karena banyaknya ragam bahan yang diperlukan dalam bentuk kristal. Kristalisasi adalah proses separasi dimana suatu solute terkristalkan dari larutan multikomponennya sehingga bila dilakukan dengan benar akan dapat diperoleh kristal yang realtif murni. Oleh karena itu, kristalisasi merupakan salah satu metode yang praktis untuk mendapatkan bahan kimia murni dalam kondisi yang sangat memenuhi syarat untuk pemasaran. Dalam kristalisasi suatu larutan, solute akan terkristalkan sehingga terbentuk campuran dua fasa yang disebut magma, fasa cair yang disebut mother liquor atau larutan induk dan fasa padat kristalin.
1.2Perumusan Masalah
Dalam percobaan ini dilakukan operasi kristalisasi menggunakan kristaliser MSMPR dengan sistem kontinyu, respon dari percobaan ini adalah pengaruh flowrate dan waktu tinggal terhadap jumlah berat kristal yang terbentuk serta distribusi ukuran kristal yang dihasilkan (CSD).
1.3Tujuan Praktikum
1. Mampu menjelaskan jenis – jenis kristaliser
2. Mampu menjelaskan variabel – variabel operasi dalam kristalisasi, yaitu: derajat supersaturasi larutan, flowrate feed, kecepatan pendinginan, pembentukan inti kristal, kecepatan pertumbuhan kristal, seed kristal, dan produk CSD
3. Mampu merakit dan mengoperasikan alat percobaan MSMPR kristaliser dengan penginginan larutan
4. Mampu mengambil data – data percobaan secara benar dan mengolahnya serta menyajikan dalam bentuk grafik hubungan flowrate dengan massa kristal, diameter partikel dengan jumlah kristal yang dihasilkan (CSD)
2 1.4Manfaat Praktikum
1. Mahasiswa mampu menjelaskan jenis – jenis kristaliser
2. Mahasiswa mampu menjelaskan variabel – variabel operasi dalam kristalisasi 3. Mahasiswa mampu merakit dan mengoperasikan alat percobaan MSMPR kristaliser 4. Mahasiswa mampu mengambil data – data percobaan secara benar
3
BAB II
TINJAUAN PUSTAKA
2.1Pengertian
Kristalisasi dapat terjadi dari 3 macam fasa yaitu pembentukan partikel – partikel padat kristalin dari fasa uap, dari solute suatu larutan, ataupun dari lelehan atau melt. Kristalisasi dapat dilakukan dengan pendinginan, penguapan solven atau penambahan solven tertentu. Kristalisasi dari larutan bertujuan untuk memisahkan suatu solute dari larutan multikomponen sehingga didapat produk dalam bentuk kristal yang lebih murni, sehingga kristalisasi sering dipilih sebagai salah satu cara pemurnian karena lebih ekonomis.
2.2Pembagian Tahapan Operasi Kristalisasi Operasi kristalisasi terbagi menjadi: 1. Membuat larutan supersaturasi
Bila larutan telah mencapai derajat saturasi tertentu, maka di dalam larutan akan terbentuk zat padat kristalin. Oleh sebab itu derajat supersaturasi larutan merupakan factor terpenting dalam mengontrol operasi kristalisasi. Ada beberapa cara untuk mendapatkan larutan supersaturasi:
a. Pendinginan larutan
Kelarutan zat padat dalam cairan merupakan fungsi suhu sehingga dengan mendinginkan larutan yang akan dikristalkan akan dicapai kondisi supersaturasi dimana konsentrasi solute dalam larutan lebih besar dari konsentrasi larutan jenuh pada suhu tersebut
b. Penguapan solven
Larutan diuapkan solvennya sehingga konsentrasi solute akan meningkat dan mencapai kondisi supersaturasi. Cara ini digunakan untuk zat yang mempunyai kurva kelarutan relatif mendatar.
c. Evaporasi adiabatic
Larutan dalam keadaan panas bila dimasukkan dalam ruang vakum, maka terjadi penguapan dengan sendirinya karena tekanan totalnya menjadi lebih rendah dari tekanan uap solven pada suhu tersebut. Penguapan disertai dengan penurunan suhu akan membuat larutan mencapai kondisi supersaturasi
4 d. Reaksi kimia
Bila reaksi kimia dijalankan dalam fasa cair, konsentrasi solute produk reaksi semakin lama semakin meningkat sehingga mencapai konsdisi supersaturasi
e. Penambahan zat lain
Penambahan zat lain dapat menurunkan kelarutan zat yang akan dikristalisasi, missal larutan NaOH ditambah gliserol maka kelarutan NaOH akan turun dan mencapai kondisi supersaturasi
2. Pembentukan inti kristal
Pembentukan inti kristal secara sistematis dapat dijelaskan sebagai berikut.
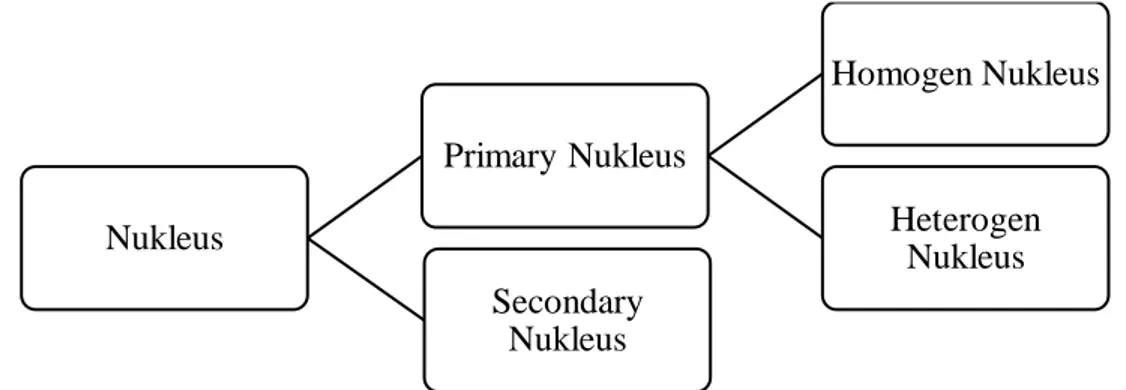
Gambar 2.1 Pembentukan inti kristal a. Primary Nukleus
Proses pembentukan inti kristal ini dapat terjadi pada saat larutan telah mencapai derajat saturasi yang cukup tinggi. Nukleasi primer dapat terjadi lewat 2 cara:
- Homogen Nukleus
Nukleus disini pembentukannya spontan pada larutan dengan supersaturasi tinggi, artinya nucleus terbentuk karena penggabungan molekul – molekul solute sendiri
- Heterogen Nukleus
Pembentukan inti kristalnya masih dalam supersaturasi tinggi, namun dapat dipercepat dengan adanya partikel – partikel asing seperti debu dan sebagainya
b. Secondary Nukleus (Contant Nucleation)
Pembentukan inti kristal dengan akibat tumbukan (contact) antar kristal induk atau antara kristal induk dengan impeller pengaduk, tumbukan Nukleus Primary Nukleus Homogen Nukleus Heterogen Nukleus Secondary Nukleus
5 dengan dinding kristaliser ataupun gesekan permukaan kristal induk dengan larutan.
Jumlah inti kristal yang terbentuk dapat dinyatakan dengan persamaan N=(a)(L)b(∆C)c(P)d
Dimana,
N = Jumlah nuclei (inti kristal) yang terbentuk (jumlah/jam) L = Ukuran kristal induk (mm)
C = derajat supersaturasi larutan (mole/L) atau (O∆C) P = Tenaga pengaduk (HP)
a,b,c,d = Konstanta – konstanta
Jika
a. L >>> maka jumlah kristal yang terbentuk juga semakin besar, kristal makin besar menyebabkan kemungkinan tumbukan semakin banyak. Pecahan bagian kecil dari kristal menyebabkan terbentuknya inti kristal. b. ∆C >>> maka jumah kristal yang terbentuk juga semakin banyak. Derajat
supersaturasi makin besar maka makin besar pula kemungkinan terbentuk inti kristal baru
c. P >>> maka gaya gesekan partikel larutan atau tumbukan juga semakin besar sehingga kemungkinan terjadinya pecahan partikel besar maka inti kristal yang terbentuk juga semakin besar jumlahnya
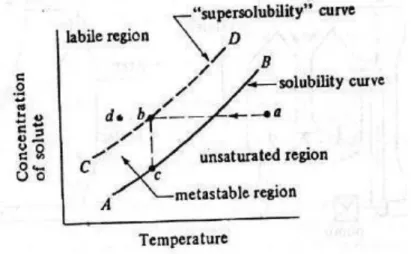
Teori Miers dalam percobaannya, Miers membuat larutan supersaturasi melalui pendinginan larutan belum jenuh (titik a), setelah melewati kurva saturasi A-B larutan menjadi supersaturasi dan dalam grafik dinamai daerah metastabil. Pada tingkat supersaturasi tertentu, kristalisasi mulai terjadi berupa terbentuknya inti kristal primer (titik b). Oleh Miers, titik – titik dimana mulai terbentuk inti kristal primer ini dinamai supersolubility curve. Inti – inti kristal yang selanjutnya tumbuh dengan menempelnya solute dipermukaannya sehingga konsentrasi solute dalam larutan akan menurun (dari b ke c). Oleh Miers, daerah supersaturasi tinggi dimana inti kristal primer dapat terbentuk disebut daerah labil
Dalam industri, pembentukan inti primer tidak diinginkan, karena cenderung membuat produk kristal berukuran kecil – kecil. Lebih umum digunakan metode inti senkunder dengan cara menambahkan bibit kristal (seed) ke dalam larutan
6 dengan tingkat supersaturasi yang rendah atau sedikit lewat jenuh. Seed ini berfungi sebagai induk kristal, sumber terbentuknya inti kristal sekunder.
Gambar 2.2 Teori Miers
Untuk sistem kontinyu seeding hanya sekali disaat startup sedang untuk sistem batch, seeding dilakukan tiap batch.
3. Pertumbuhan kristal
Umumnya kristal yang berukuran > 100 mikron kecepatan tumbuhnya tidak tergantung pada ukuran dan dapat dinyatakan dengan
r=a (∆C) b dimana:
r = kecepatan tumbuhnya kristal (mm/jam) ∆C = derajat saturasi (mole/L)
a, b = konstanta
Derajat saturasi (∆C) merupakan factor terpenting dalam proses pertumbuhan kristal. Larutan yang berderajat saturasi tinggi, perbedaan konsentrasi antara permukaan kristal dengan permukaan akan tinggi sehingga kecepatan tumbuh kristal juga semakin tinggi
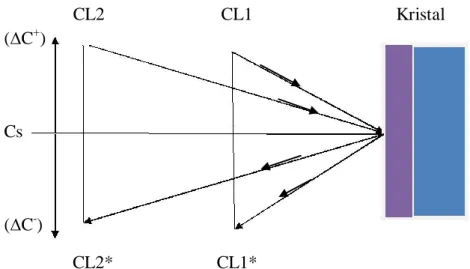
Teori difusi solute dari larutan ke permukaan kristal. Proses kristalisasi merupakan kebalikan dari proses kelarutan. Kristal di dalam larutan membentuk daerah boundary layer di permukaannya. Konsentrasi solute dalam daerah boundary layer ini sama dengan konsentrasi jenuhnya (saturasi), karena selalu dalam kondisi kesetimbangan cair – padat. Bila larutan konsentrasinya supersaturasi (∆C+) maka molekul solute akan mendifusi dari larutan ke permukaan kristal (arah panah dari kiri ke kanan), kemudian menempel menjadi
7 molekul kristal dipermukaannya. Tetapi bila larutannya belum jenih (∆C–) maka molekul kristal di permukaan akan larut menjadi solute (arah panaj dari kanan ke kiri).
CL2 CL1 Kristal
CL2* CL1*
Gambar 2. 3 Difusi solute dari larutan ke permukaan kristal Dengan
Cs = konsentrasi saturasi (jenuh) ∆C+
= konsentrasi supersaturasi (lewat jenuh) ∆C
-= konsentrasi unsaturasi (belum jenuh)
CL1, CL1* = menunjukkan adanya pengaruh pengadukan dalam larutan sehingga jarak difusi lebih pendek
CL2, CL2* = menunjukan tidak adanya pengadukan dalam larutan sehingga jarak difusi lebih jauh
2.3Grafik CSD dan Jenis –Jenis Kristaliser
Keseragaman ukuran produk suatu kristaliser dinyatakan dengan CSD (crystal size distribution) dan sangat bergantung pada tiper kristalisernya. Ada 2 tipe kristaliser yaitu MSCPR (Mixed Suspension Classified Product Removal) dan MSMPR (Mixed Suspension Mixed Product Removal). MSCPR kristaliser dapat menghasilkan produk yang relatif lebih seragam ukurannya dibandingkan tipe MSMPR karena ada mekanisme klarifikasinya.
1. Ukuran produk seragam MSCPR kristaliser (∆C+)
Cs
8 2. Ukuran produk tidak seragam MSMPR kristaliser
Gambar 2.4 Grafik CSD
Untuk jenis MSMPR, kristal yang diperoleh mempunyai ukuran yang tidak seragam sehingga diameter bervariasi mulai dari ukuran yang tidak terlihat sampai diameter besar.
Jenis – jenis kristaliser
1. Oslo Surface Cooled Crystallizer
Kristaliser ini menggunakan sistem pendinginan dengan pendinginan feed (G) di dalam cooler (H) untuk membuat larutan supersaturasinya. Kemudian larutan supersaturasi ini, dikontakkan dengan suspensi kristal dalam ruangan suspensi (E). Pada puncak ruangan suspensi, sebagian larutan induk (D) dikeluarkan untuk mengurangi jumlah inti kristal sekunder yang terlalu banyak terbentuk. Produk slurry dikeluarkan dari bawah.
Dengan N: jumlah kristal D: diameter Dengan N: jumlah kristal D: diameter
9 Gambar 2. 5 Oslo Surface Cooled Crystallizer
2. Oslo Evaporative Crystallizer
Kristaliser ini memakai metode penguapan solven untuk mendapatkan larutan supersaturasinya. Larutan yang meninggalkan ruang penguapan pada kondisi supersaturated, mendekati daerah metastabil sehingga nucleus primer tidak akan terbentuk. Kontak larutan supersaturasi dengan unggun kristal di E akan mendorong pertumbuhan kristal tetapi sekaligus membentuk inti kristal sekunder. Umpan larutan dimasukkan lewat G dan mengalami pemanasan di HE sebelum masuk ke ruang penguapan solven di A. Dengan membuat ruang peguapan bertekanan vakum maka sebagian solven akan menguap sekaligus diikuti penurunan suhu, larutan akan mencapai kondisi supersaturasi yang dibutuhkan untuk menumbuhkan kristal. Dalam kristaliser tipe ini, fungsi sirkulasi larutan adalah untuk pemanasan kembali sekaligus melarutkan kembali sebagian inti kristal sekunder. Hal ini untuk mencegah ukuran produk yang semakin lama semakin mengecil.
CW in
CW out Feed
10 Gambar 2.6 Oslo Evaportive Crystallizer
3. Draft Tube Baffle – DTB Crystallizer
Kristaliser ini bertipe MSCPR karena dilengkapi baffle dan propeller yang berfungsi mengatur sirkulasi kristal magma sedangkan diluar body crystallizer ditambah pompa untuk sistem sirkulasi dan klasifikasi ukuran produk. Untuk mencapai kondisi supersaturasi digunakan sistem penguapan solven dengan tekanan vakum.
Bagian bawah kristaliser ini dilengkapi dengan elutriation leg yang berfungsi untuk mengklasifikasi kristal hingga didapat produk kristal dengan ukuran tertentu yang relatif seragam. Klasifikasi ukuran kristal di sini didasarkan atas gaya gravitasi dengan jalan sebagai berikut.
Jika di dalam kristaliser telah terbentuk kristal – kristal dengan ukuran heterogen, maka kristal ini diklasifikasikan ukurannya dengan mengalirkan sebagian larutan dari bawah ke atas dalam ruang elutriationleg dengan menggunakan pompa sirkulasi. Dengan adanya aliran larutan ini, kristal dengan ukuran yang besar akan dapat melawan daya dorong aliran kea ta sehingga tetap dapat turun ke bawah karena gaya gravitasi dan keluar sebagai produk, dengan demikian didapatkan produk dengan ukuran homogen. Dengan demikian untuk mendapatkan kristal dengan ukuran tertentu dapat diatur dengan mengatur aliran ke atas di dalam elutriation leg. Jika larutan mempunyai kecepatan tinggi maka akan didapat kristal dengan ukuran yang besar atau sebaliknya. Kristal kecil yang tidak dapat
Feed Kondensat
11 melawan gaya dorong akan terbawa naik kembali ke ruang kristalisasi untuk ditumbuhkan hingga mencapai ukuran tertentu yang karena beratnya sendiri dapat melawan gaya dorong ke atas di dalam elutriation leg.
Kristaliser ini juga dilengkapi dengan sistem sirkulasi larutan dan inti kristal keluar kristaliser untuk mengurangi jumlah inti kristal di dalam kristaliser. Inti kristal yang berlebih ini akan larut kembali saat lewat HE karena pemanasan. Pengurangan inti kristalini dimaksudkan agar inti kristal berkurang karena jika dibiarkan makin lama makin banyak, akibatnya produk kristal cenderung semakin halus. Hal ini karena inti kristal membutuhkan solute untuk pertumbuhan selanjutnya, sedangkan jumlah solute yang masuk dalam feed tetap, maka inti kristal tidak cukup banyak mendapat solute untuk tumbuh menjadi kristal yang lebih besar.
Gambar 2.7 Draft Tube Baffle Crystallizer Cooling water
12
BAB III
METODE PRAKTIKUM
3.1 Rancangan Praktikum 3.1.1 Alur praktikum
Rancangan praktikum kristalisasi ini diawali dengan persiapan larutan jenuh di dalam saturator tank, selanjutnya persiapan alat yang meliputi pengaturan suhu dengan termoregulator dan pengadukan. Lalu dilanjutkan dengan proses feeding larutan jenuh dari saturator tank ke tangki kristaliser dan jalankan sistem recycle. Jalankan sistem kristalisasi ini hingga mencapai kondisi steady state atau hingga 3 kali waktu tinggal cairan dalam kristaliser. Setelah waktu tinggal tercapai lakukan penyaringan larutan dan kristal, selanjutnya dilakukan proses pengeringan. Hasil pengeringan ditimbang selanjutnya dilakuka proses sieving (pengayakan) Adapun rancangan percobaan praktikum secara garis besar ditampilkan pada Gambar 3.1 sebagai berikut
Gambar 3. 1 Rancangan praktikum 3.1.2 Penetapan Variabel
1. Variabel tetap: Suhu saturator tank 55 oC 2. Variabel bebas: flowrate
Proses Sieving Pengeringan
Penyaringan Kristal dan Pengambilan Produk Proses Recycle Larutan Jenuh
Proses Feeding Larutan Jenuh Persiapan Alat
13 3.2 Bahan dan Alat yang Digunakan
3.2.1 Bahan yang digunakan Kristal tawas
Air
3.2.2 Alat yang digunakan Saturator Tank Heater dan controller Pengaduk Thermoregulator Tangki Pendingin MSMPR Crystallizer Penampung kristal Motor pengaduk Pompa vakum
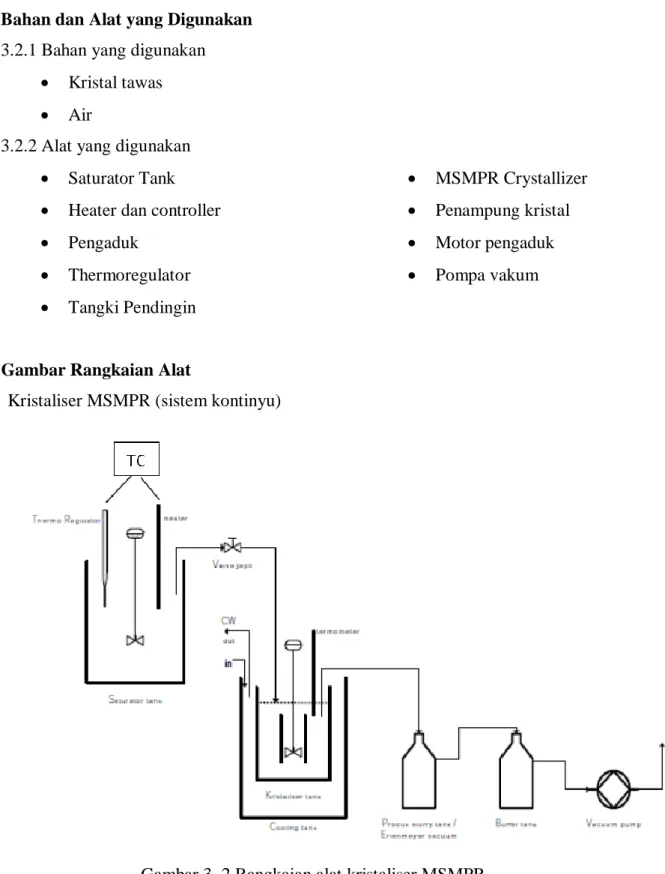
3.3 Gambar Rangkaian Alat
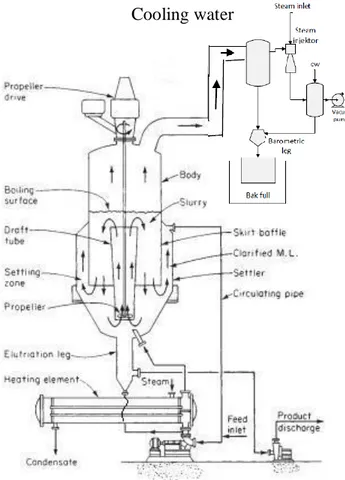
Kristaliser MSMPR (sistem kontinyu)
Gambar 3. 2 Rangkaian alat kristaliser MSMPR 3.4 Prosedur Praktikum
1. Membuat larutan jenuh tawas pada suatu suhu tertentu di dalam tangki saturator 2. Pengaturan suhu dilakukan dengan thermoregulator , setting suhu 55OC, cek ketelitian
14 3. Hidupkan heater dan pengaduk listrik, tambahkan tawas dengan air secukupnya ke
saturator tank, biarkan pemanasan berjalan beberapa lama
4. Cek kondisi apakah jenuh atau belum dengan mengukur densitas larutan dengan picnometer. Berat picnometer dan larutan sudah konstan berarti sudah jenuh (tawas tidak bisa larut lagi)
5. Jalankan sistem pendingin tangki kristaliser dengan air yang dialirkan kontinyu, atur jepitan selang air pendingin sedemikian rupa sehingga input – output yang ditandai dengan konstannya ketinggian permukaan air pendingin di dalam tangki pendingin kristaliser. Tangki kristaliser diberi tanda untuk volume tertentu, missal 2 L.
6. Jalankan pompa atur flowrate yang menuju tangki kristaliser sesuai dengan yang diinginkan dengan mengatur jepitan recycle. Cek (kalibrasi) flowrate dengan menggunakan gelas ukur dan stopwatch.
7. Siapkan sistem vakum pengeluaran produk slurry: pompa vakum, buffer tank dikosongkan. Cek apakah tidak bocor (lewat ujung selang penghisap apakah terasa bila menghisap.
8. Jalankan pengaduk tangki kristaliser dan usahakan tinggi permukaan larutan tawas di dalam kristaliser tetap pada tanda 2 L, karena tipe MSMPR pastikan kristal teraduk sempurna.
9. Jalankan sistem kristalisasi ini sampai dicapai kondisi tunak (steady state) dengan perkiraan dari start awal 3 kali waktu tinggal cairan di dalam kristaliser
10.Sebelum tercapai kondisi tunak, kristal dan cairan yang dikeluarkan tidak dipakai sebagi produk tetapi dikembalikan ke saturator tank lagi. Setelah tercapai kondisi tunak, kristal dan cairan dikeluarkan untuk jangka waktu tertentu misalnya 20 menit, tamping dan saring kristalnya, keringkan kristalnya dengan diangin – anginkan (penyaringan kristal diupayakan saat larutannya belum mendingin agar produk kristal tidak bertambah).
11.Ulangi langkah kerja di atas dari awal untuk masing – masing flowrate sehingga diperoleh minimal 2 titik agar bisa dibuat grafik yang baik
12.Timbang produk kristal, kemudian dilakukan analisa ayak untuk masing – masing variasi flowrate
13.Hitung berat 1 kristal untuk ukuran ayakan tertentu dengan mengasumsi kristalnya berbentuk bola, kemudian hitunglah jumlah butir kristal yang ada dalam 1 ayakan 14.Buat grafik kelarutan tawas dalam air sebagai fungsi suhu dari data di Perry
15 15.Hitung derajat supersaturasi yang terjadi untuk masing – masing flowrate dengan
melihat data kelarutan tawas dari suhu saturator dan suhu kristaliser
16.Buat grafik hubungan berat kristal versus derajat supersaturasi dan grafik CSD untuk masing – masing variasi flowrate.
16
DAFTAR PUSTAKA
Garside, J. and Daupus R.J.1980.Chemical Engineering Common.4:393 Mullin, J. W.1972. Crystallization 2nd.London: Butterworths
Rusli, I. I., Larisan, M. A., dan Garside, J.1980. Chemical Engineering Process. P Syn P Sher, 193 vol 176.
Tokyokura, K. and Aoyama, Y.1982. Jace Design Manual Series Crystallization vol I. Osaka: Jace I Research Center.
Tokyokura, K. and Aoyama, Y.1984. Jace Design Manual Series Crystallization vol III. Osaka: Jace I Research Center