BAB II
TINJAUAN PUSTAKA
Ulatgrayak Bawang Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae)
S. exigua merupakan hama polifag yang menyerang berbagai jenis tanaman
budidaya di Eropa, Asia, Afrika, Australia dan Amerika Utara terutama di wilayah yang beriklim hangat (CAB 2000; Jakubowska et al. 2005; Lasa et al. 2007a). Inang utama dari hama ini adalah bawang merah (Allium ascalonicum), jagung (Zea mays), jutes (Corchorus sp.), kapas (Gossypium sp.), kubis-kubisan (Brassica), bawang daun (Allium fistulosum), kacang (Pisum sativum), padi (Oryza sativa), kentang (Solanum
tuberosum), bit gula (Beta vulgaris var. saccharifera) dan tomat (Lycopersicon esculentum) (Amaldoss & Hsue 1989; CAB 2000; Jakubowska et al. 2005; Lasa et al.
2007a). Hama ini dikenal dengan beberapa sebutan, antara lain: beet armyworm,
lesser armyworm, asparagus fern caterpillar, lesser cottonworm, pigweed caterpillar, berseem armyworm, lucerne armyworm, onion armyworm, onion caterpillar, cottonworm, lesser sugarbeet armyworm, small mottled willow moth dan inchworm
(CAB 2000). Di Indonesia hama ini lebih dikenal sebagai ulat bawang (onion
caterpillar) (Kalshoven 1981) atau ulatgrayak bawang (UGB) (Rauf 1999), karena
memiliki inang utama terbatas pada jenis bawang-bawangan terutama bawang merah dan bawang daun.
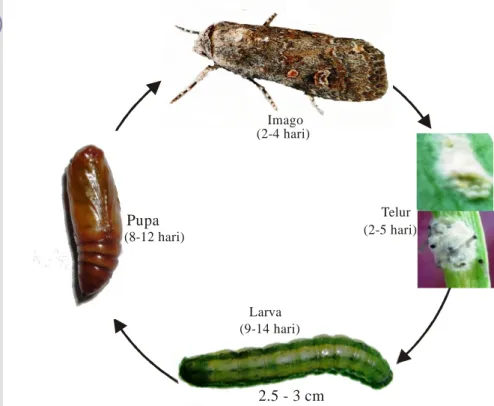
Imago S. exigua berupa ngengat berwarna putih gelap atau kelabu dengan titik kuning pada sayap depan. Telurnya berwarna hijau atau kuning terang diletakkan pada malam hari pada daun bawah dalam bentuk kluster yang masing-masing terdiri dari 50-150 butir telur yang ditutupi bulu-bulu halus berwarna putih atau putih kekuning-kuningan (Capinera 1999; Samsudin 1999; CAB 2000; Sparks et al. 2008). Telur menetas dalam waktu 2-5 hari. Instar pertama dan kedua biasanya makan secara berkelompok (gregariously) pada bagian dalam daun muda dengan membentuk gejala khas berupa membran putih transparan atau lubang masuk (windowing) (Kalshoven 1981; CAB 2000). Larva terdiri atas 5 instar, dengan stadium larva berlangsung
antara 9–14 hari, dengan rata-rata 12 hari (Rauf 1999; Capinera 1999). Larva berbentuk bulat panjang dengan ukuran instar akhir antara 2.5-3.0 cm, memiliki variasi warna yang sangat banyak (polymorfisme) dari berwarna hijau sampai hitam pekat, dengan ciri khas berupa garis memanjang (longitudinal stripes). Menurut Sparks et al. (2008) dalam kondisi alami, larva berwarna hijau sampai kuning pada instar 1 dan 2, kemudian cenderung hijau terang sampai hijau gelap. Terjadinya
polimorfisme menurut Rauf (1999) dipengaruhi oleh tingkat populasi di lapangan,
pada saat populasi rendah, larva umumnya berwarna hijau terang, sedangkan pada saat terjadi ledakan populasi kebanyakan larva berwarna gelap.
Pupa berwarna coklat terang atau coklat gelap berada di dalam tanah di bawah tanaman yang terserang (Sastrosiswojo et al. 1995; Capinera 1999), dengan lama stadium pupa rata-rata 8-12 hari (Amaldoss & Hsue 1989; Rauf 1999).
Satu ekor imago betina dalam kondisi laboratorium dengan pakan alami bawang daun di Bogor mampu meletakkan telur kurang lebih 1000 butir (Kalshoven 1981) dan pada pakan buatan rata-rata 1062 butir (Samsudin 1999). Sedangkan di Lembang dengan pakan daun bawang daun rata-rata 500-600 butir (Sastrosiswojo et
al. 1995). Waktu yang dibutuhkan untuk siklus hidup satu generasi dari telur sampai
imago bertelur lagi di laboratorium rata-rata 23 hari (Gambar 2.1) (Kalshoven 1981; Amaldoss & Hsue 1989; Sparks et al. 2008).
Biologi Nucleopolyhedrovirus (NPV)
Morfotipe NPV
NPV merupakan salah satu anggota genus Baculovirus, famili Baculoviridae. Berdasarkan tipe morfologi luar baculoviridae terdiri atas 3 subgroup yaitu: nuclear polyhedrosis virus atau nucleopolyhedrovirus (NPV), granulosis virus atau granulo-virus (GV) dan non-occluded baculogranulo-virus (NOB) yang tidak memiliki kristal protein (Matthew 1982; Adam & McClintock dalam Adam & Bonami 1991; Tanada & Kaya 1993; Shepard 1994; Murphy et al. 1995; Federici dalam Hall & Julius 1999; Koul & Dhaliwal 2002; Narayanan 2004). Kristal protein dari NPV berbentuk segi banyak
Telur Larva Pupa Imago (2-5 hari) (9-14 hari) (8-12 hari) (2-4 hari) 2.5 - 3 cm
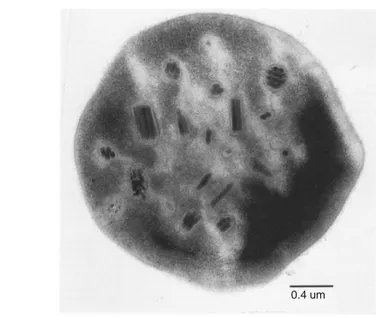
(polyhedral) dengan diameter 0.2 – 20.0 μm yang biasanya dapat dilihat di bawah mikroskop cahaya biasa, dan umumnya mengandung lebih dari satu virion (Pionar & Thomas 1984).
Gambar 2.1. Siklus hidup UGB Spodoptera exigua (Gambar: koleksi pribadi)
Menurut Tinsley & Kelly (1985) ciri khas NPV adalah adanya nukleokapsid berbentuk batang yang mengandung untaian ganda asam deoksiribonukleat (DNA) yang panjangnya 250 – 400 nm dan lebar 40 – 70 nm. Berdasarkan jumlah nukleokapsid, NPV dibedakan menjadi dua kelompok, yaitu single nukleokapsid (SNPV) dan multi nucleokapsid (MNPV) (Washburn et al. 2003; Inceoglu et al. 2006). Pada SNPV tiap envelope berisi satu nuckleokapsid, sedangkan pada MNPV berisi lebih dari satu sampai 39 nukleokapsid (Tanada & Kaya 1993; Kalmakoff & Ward 2003). Pada umumnya SNPV mempunyai inang yang lebih spesifik dibandingkan dengan MNPV (Ignoffo & Couch 1981). Beberapa ciri khas lainnya dari NPV partikel virus atau virionnya terbungkus dalam protein kristalin berupa
0.4 um
badan oklusi (occlusion bodies) yang disebut dengan polihedra dan replikasi virus terjadi hanya pada inti sel (nucleus) sel serangga inang yang terinfeksi (Tanada & Kaya 1993). Gambar 2.2 menunjukkan bentuk badan oklusi dari NPV.
Gambar 2.2. Badan oklusi Spodoptera litura NPV (Sumber: Adams & McClintock
dalam Adam & Bonami 1991)
Siklus Hidup NPV
NPV dilaporkan telah ditemukan pada lebih dari 600 spesies serangga (Beard
et al. 1989; Woo et al. 2007), terutama pada ordo Lepidoptera sebanyak 150 spesies
(Tanada & Hess dalam Adam & Bonami 1991). Umumnya NPV menginfeksi stadia larva Lepidoptera, sedikit sekali laporan yang menyebutkan bahwa NPV dapat menginfeksi pupa dan imago (Barrett et al. dalam Koul & Dhaliwal 2002). Sebagian besar NPV bersifat spesifik inang, oleh sebab itu maka penamaan NPV disesuaikan dengan nama inang dimana pertama kali diisolasi dan diidentifikasi (CAB 2000).
NPV memperbanyak diri di dalam inti sel (nucleus) serangga inangnya. Agar NPV dapat menginfeksi sel serangga inang, maka polihedra harus tertelan bersama dengan pakan yang dikonsumsinya melalui alat mulut, kemudian pada saluran pencernaan bagian tengah (mesenteron) NPV mulai menginfeksi inti sel inang (Adams & McClintock dalam Adam & Bonami 1991). Proses infeksi NPV pada sel
inang melalui dua tahap. Pada tahap pertama (primer) NPV menyerang saluran pencernaan tengah (mesenteron), kemudian pada tahap selanjutnya (sekunder) akan menyerang sel-sel dari organ tubuh yang lain (Ignoffo & Couch 1981; Deacon 1983). Proses infeksi primer terjadi karena pada kondisi alkalin pada mesenteron badan oklusi akan terdegradasi dan virion lepas dari selubung protein (Koul & Dhaliwal (2002); Etebari et al. 2007). Virion-virion tersebut kemudian akan menembus matrik peritrofik dan akan menginfeksi sel-sel kolumnar dan goblet. Kemudian pada infeksi sekunder, virion-virion yang baru terbentuk akan menginfeksi seluruh sel jaringan serangga. Larva akan mati setelah sebagian besar jaringan tubuhnya terinfeksi NPV (Smits 1987; Bonning & Hammock 1996). Pembentukan badan oklusi (polihedra) terjadi sebagai hasil infeksi sekunder pada jaringan sel hemolimf, trakea, hypodermis, dan badan lemak. Sangat jarang terjadi pembentukan badan oklusi pada sel saluran pencernaan (Kalmakoff & Ward 2003).
Menurut Li & Blissard (2009) gen gp64 yang terdapat pada badan oklusi NPV memegang peranan penting sebagai reseptor pengikat sel serangga inang yang kinerjanya dimediasi oleh kondisi pH rendah dan masuk ke dalam sel inang melalui proses endositosis. Kalmakoff & Ward (2003) menyatakan bahwa, NPV umumnya menginfeksi semua tipe jaringan utama dari serangga inangnya, mulai dari sel saluran pencernaan (midgut) kemudian keluar menginfeksi hemolimfa, badan lemak, epidermis dan matrik trakea.
Pada Gambar 2.3 diilustrasikan mekanisme infeksi NPV pada sel-sel serangga inang dan proses penyebaran di alam.
Infeksi primer ODV BV Infeksi sekunder Infeksi sekunder BV POB
Gambar 2.3. Siklus hidup NPV; A) polyhedra occlusion bodies (POB) termakan inang, occluded derived virion (ODV) menginfeksi sel epitelium, B)
buded virion (BV) keluar sel dan menginfeksi sel baru, C) awal infeksi
menghasilkan BV, D) akhir infeksi membentuk POB yang dilepas ke lingkungan. (Sumber: Rohrmann 2011).
Tanda dan Gejala Infeksi NPV
Larva serangga inang yang terinfeksi NPV akan mengalami abnormalitas secara morfologi, fisiologi dan perilakunya (Pionar & Thomas 1984). Hoffmann & Frodsham (1993) menyatakan bahwa virus yang berbeda akan menimbulkan tanda dan gejala yang berbeda pula. Menurut Adam & McClintock dalam Adam & Bonami (1991) di lapang kematian larva akibat terinfeksi NPV sering ditemukan dengan tanda tubuh larva menggantung dengan kedua tungkai semu bagian abdomen menempel pada daun atau ranting tanaman membentuk huruf “V” terbalik. Akan tetapi ada juga
larva mati yang posisinya tidak seperti huruf “V” terbalik melainkan terkulai pada helaian daun. Oleh karena itu Hoffmann & Frodsham (1993) menyatakan bahwa penyakit yang diakibatkan oleh infeksi NPV sering disebut dengan penyakit layu ulat (caterpillar wilt) atau penyakit ulat ujung pohon (tree top) (Gambar 2.4).
A B
Gambar 2.4. Tanda larva terinfeksi NPV pada (A) S. litura dan (B) S. exigua (Gambar: koleksi pribadi)
Kematian larva terjadi pada 3 – 7 hari setelah terinfeksi NPV (Hoffman & Frodsham 1993). Masa infeksi NPV sampai larva yang terserang mati dipengaruhi oleh banyak faktor diantaranya umur larva, suhu, dan banyaknya polihedra yang tertelan. Isolat-isolat virus yang lebih virulen dapat mematikan larva dalam waktu 2 – 5 hari, tetapi isolat yang kurang virulen membutuhkan 2 – 3 minggu untuk mematikan inangnya (Granados & William 1986). Menurut Narayanan (2004) infeksi juga dapat terjadi pada larva instar awal akibat kontaminasi pada telur. Hal ini karena larva yang keluar dari telur akan memakan korion untuk membuat lubang. Apabila korion yang mengandung NPV masuk ke dalam tubuh larva dan menginfeksi organ-organ tubuhnya maka kematian akan terjadi 1 – 2 hari kemudian.
Pemanfaatan Nucleopolyhedrovirus (NPV) Sebagai Bioinsektisida
Pemanfaatan virus patogen serangga untuk mengendalikan hama tanaman pertama kali diketahui pada awal tahun 1900-an. Pada saat itu beberapa jenis baculovirus telah mulai digunakan untuk mengendalikan beberapa hama kelompok hymenoptera, lepidoptera dan coleoptera pada tanaman kelapa, kapas dan kubis (Bonning & Hammock 1996). Pada tahun 1943 populasi sawfly (Gilpinia hercyniae) hama tumbuhan hutan berkurang sampai 90% dikendalikan dengan NPV (Cunning-ham & Entwistle 1981). Pada pertengahan tahun 1960an ditemukan nonoccluded baculovirus yang merupakan patogen kumbang badak Oryctes rhinoceros dari Malaysia (Huger 1966). Virus tersebut telah digunakan untuk mengendalikan kumbang kelapa di Kepulauan Fiji, dan berhasil mengurangi populasi antara 40 -90%, sehingga 4 - 6 tahun kemudian kerusakan tanaman kelapa di seluruh kepulauan tersebut selalu dibawah 20% (Bedford 1981).
Beberapa keunggulan penggunaan virus patogen serangga NPV untuk mengendalikan hama tanaman dibandingkan dengan insektisida kimia, antara lain: efektif mengendalikan hama sasaran, spesifik inang sehingga tidak berdampak negatif terhadap kelangsungan hidup musuh alami dan serangga berguna lainnya dan dihasilkan inokulum yang dapat mengendalikan populasi hama selanjutnya (Young 1989; Lacey et al. 2001). Sebaliknya pengendalian hama dengan insektisida kimia yang memiliki spektrum inang luas (broad spectrum) dapat mengakibatkan terjadinya gejala resurjensi hama (Armes et al. 1995), terbunuhnya musuh alami (Tengkano et
al. 1992), meningkatnya residu pada hasil, mencemari lingkungan dan gangguan
kesehatan bagi pengguna (Schumutterer 1995; Oka 2005).
NPV di beberapa negara telah berhasil diproduksi secara massal dengan menggunakan teknologi tinggi, akan tetapi harga produk biopestisida NPV sangat mahal karena tingginya biaya produksi dan registrasinya (Stair & Fraser 1981; Bull et
al. 1979; Federici dalam Hall & Julius 1999). Bukti-bukti kesuksesan NPV sebagai
agens hayati untuk mengendalikan hama tanaman ini belum diikuti dengan upaya komersialisasi besar-besaran. Young (1989) dan Federici dalam Hall & Julius (1999) mengemukakan beberapa masalah yang berkaitan dengan produksi dan pemanfaatan
biopestisida berbahan virus, antara lain: permintaan pasar yang masih kecil, regulasi dari pemerintah belum ada, biaya produksi mahal, belum ada standarisasi produk dan teknologi aplikasinya yang masih terbatas.
Dalam upaya kemersialisasi NPV menjadi bioinsektisida dalam skala industri, William et al. (1999) menyarankan untuk mengurangi biaya produksinya dengan cara mencari bahan mentah pakan serangga yang murah dan melakukan efesiensi dalam biaya tenaga kerja. Oleh karena itu Federici dalam Hall & Julius (1999) dan Barrett et
al. dalam Koul & Dhaliwal (2002) menyatakan bahwa bioinsektisida NPV ini sangat
ideal untuk dikembangkan dalam skala kecil di negara-negara berkembang, mengingat banyak dan murahnya tenaga kerja.
Upaya untuk Meningkatkan Kinerja NPV Sebagai Bioinsektisida
Kelemahan NPV untuk dikembangkan menjadi bioinsektisida adalah 1) membutuhkan waktu relatif lama untuk membunuh inangnya, sehingga serangga yang terinfeksi masih makan dan menimbulkan kerugian (Bonning & Hammock 1996; Dushoff & Dwyer 2001), 2) memiliki inang yang spesifik, sehingga terlalu mahal untuk dikembangkan dalam skala industri (McCutchen et. al. 1991) dan kurang efektif jika tanaman terserang oleh beberapa jenis hama (CAB, 2000) dan 3) cepat menjadi tidak aktif di lapangan akibat sinar ultra violet (UV) matahari (Ignoffo
et al. 1991; Koul & Dhaliwal 2002; Monobrullah 2003; McIntosh et al. 2004;
Mondragon et al. 2007; Mehrvar et al. 2008).
Beberapa upaya yang dapat dilakukan untuk meningkatkan kinerja NPV sebagai bioinsektisida antara lain dengan menambahkan bahan perekat (sticker), perangsang makan (phagostimulant), pemicu kinerja (enhancer), pelindung dari sinar ultraviolet dan perata (Federici dalam Hall & Julius 1999; CAB 2000). Sejalan dengan perkembangan ilmu dan pengetahuan tentang biologi molekuler NPV, maka upaya peningkatan kinerja NPV saat ini sudah ditekankan pada upaya rekayasa genetik.
Upaya untuk Meningkatkan Virulensi NPV
Perkembangan bioteknologi pada NPV dengan memanfaatkan pengetahuan dan teknologi biologi molekuler telah berkembang pesat. Treacy (1999) menyatakan bahwa untuk mengatasi kelemahan kinerja NPV secara bioteknologi telah dilakukan melalui dua pendekatan, yaitu dengan menghilangkan gen (gene deletion) tertentu dari genom virus dan menyisipkan gen (gene insertion) yang mengekspresikan protein yang bersifat racun pada genom virus.
Rekayasa genetik pada Autographa californica nucleopolyhedrovirus (AcNPV) dengan membuang gen EGT ternyata dapat mengurangi aktifitas makan dari S.
frugiperda yang terinfeksi virus rekombinan tersebut dan mematikan 30% lebih cepat
dari larva yang terinfeksi wild-type AcNPV (O’Reilly & Miller 1991), sedangkan
Lymantria dispar NPV (LdNPV) yang dibuang gen EGT dilaporkan mematikan larva L. dispar rata-rata 20% lebih cepat dibandingkan yang terinfeksi LdNPV asalnya
(Treacy 1999). Carbonell et. al. (1988) melaporkan keberhasilan mereka menyisipkan gen A 112-bp (BeIt) yang mengkode toksin serangga (insectotoxin-1) kalajengking
Buthus eupeus pada genom AcNPV. Virus rekombinan (rAcNPV) tersebut mampu
mengekspresikan toksin kalajengking di dalam sel inang yang terinfeksi, akan tetapi kecepatan membunuhnya masih sama dengan AcNPV asalnya. Rekombinan AcNPV yang mengandung gen pengkode racun syaraf (neurotoxin) kalajengking Androctonus
australis (AaIT) (rAcNPV-AaIT) dapat membunuh serangga lepidoptera kurang dari
setengah waktu yang dibutuhkan oleh AcNPV asalnya (McCutchen et. al. 1991; Treacy & All 1996) dan mampu menghentikan makan 8-10 jam sebelum mati (McCutchen et. al. 1991). Virus rekombinan Bombyx mori NPV (rBmNPV) yang mengekspresikan hormon diuretik Manduca sexta dapat mematikan ulat sutera rata-rata 20% lebih cepat daripada yang terinfeksi BmNPV asalnya (Maeda 1989). Gen yang mengkodekan enzim juvenil hormone esterase (JHE) telah berhasil disisipkan pada genom AcNPV dan rekombinan AcNPV-JHE ini mampu menurunkan makan sampai 66% dan mematikan larva T. ni 20% - 30% lebih cepat dibandingkan dengan
Beberapa gen yang menentukan kisaran inang saat ini telah berhasil diidentifikasi dan diisolasi. Salah satunya adalah gen host range factor 1 (hrf-1) yang bertanggung jawab dalam menentukan kisaran inang diisolasi dari LdNPV. Rekombinan AcNPV-hrf-1 mampu menormalkan sintesis protein dan meningkatkan keberhasilan replikasi virus pada kultur sel line Ld652Y dan pada larva L. dispar. Hasil ini menunjukan bahwa hrf-1 berperan dalam keberhasilan replikasi dalam kultur sel dan dapat memperluas kisaran inang AcNPV (Ishikawa et al. 2004). Spenger et. al. (2002) melaporkan bahwa protein pembungkus GP64 pada AcNPV menentukan aktifitas permukaan partikel virus terikat pada sel inang dan sangat penting dalam proses masuknya virus pada sel inang. Upaya rekayasa genetik pada gen gp64 pada AcNPV ini ternyata dapat meningkatkan kemampuan aktifitas permukaan partikel AcNPV terhadap sel inangnya. Penyisipan gen gp64 rekombinan ini pada beberapa baculovirus diharapkan akan memperluas kisaran inangnya dan meningkatkan daya tahan partikel baculovirus terhadap sinar ultra violet di lapang.
Upaya Mempertahankan Persistensi NPV
Salah satu kelemahan NPV sebagai biopestisida adalah mudah terdegradasi oleh sinar ultra violet (UV) matahari (Ignoffo et al. 1991; Koul & Dhaliwal 2002; McIntosh et al. 2004; Mondragon et al. 2007; Mehrvar et al. 2008), sehingga upaya untuk menambahkan pelindung terhadap UV ke dalam formulasi biopestisida NPV menjadi objek penelitian yang menarik (Shapiro et al. 2008).
Beberapa bahan telah diuji untuk mempertahankan persistensi NPV terhadap paparan sinar ultraviolet (UV), antara lain: penambahan pencerah fluorescen
(fluorescent brightener) pada Spodoptera frugiperda nucleopolyhedrovirus (SfNPV)
(Hamm et al. 1994; Martinez et al. 2003; Mondragon et al. 2007), Lymantria dispar NPV (LdNPV) (Dougherty et al. 2006), S. exigua NPV (SeNPV) (Kao et al. 1991; Murillo et al. 2003; Lasa et al. 2007b), penambahan Titanium dioksida (TiO2) pada Helicoverpa zea nucleopolyhedrovirus (HzNPV) (Farrar et al. 2004), penambahan
oksida besi pada Homona magnanima granulovirus (HomaGV) (Asano 2005), penambahan Congo red dan Tinopal LPW pada L. dispar NPV (LdMNPV) (Shapiro
& Shepard 2008), penambahan adjuvan pada H. armigera NPV (HaNPV) (Mehrvar
et al. 2008), penambahan ekstrak teh hijau pada S. exigua NPV (SeNPV) (Shapiro et al. 2008) dan penambahan ekstrak teh hitam dan lignin pada SeNPV (El Salamouny et al. 2009).
Martinez et al. (2003) melaporkan bahwa dari 10 pencerah optik (optical
brightener) yang diuji diperoleh 5 jenis yaitu: Blankophor BBH, Calcoflour M2R,
Leucophor AP, Leucophor SAC dan Leucophor UO yang dapat meningkatkan kematian larva antara 87.7 – 100%. Sedangkan Lasa et al. (2007b) melaporkan bahwa penambahan 0.1% Leucophor AP pada formulasi SeNPV yang diaplikasikan di dalam rumah kaca, secara nyata meningkatkan mortalitas larva S. exigua pada 2 hari setelah aplikasi. Hasil penelitian Asano (2005) menunjukkan bahwa penambahan oksida besi (iron oxide) 1-4 mg/ml pada produk granulovirus (GV) dapat mengurangi inaktivasi GV akibat penyinaran UV dengan perbandingan 1/6 sampai 1/18 dibandingkan dengan tanpa perlakuan. Farrar et al. (2004) menyatakan bahwa Titanium dioksida (TiO2) dapat memantulkan cahaya UV dan dapat meningkatkan persistensi polihedra Helicoverpa zea nucleopolyhedrovirus (HzNPV) di lapangan. Shapiro & Shepard
(2008) melaporkan bahwa penambahan Congo red dan Tinopal LPW dapat mengurangi nilai LC50dari Lymantria dispar NPV (LdMNPV) masing-masing 26 dan
360 kali lipat daripada kontrol.
Penambahan bahan-bahan pelindung UV kimia seperti pencerah optik pada konsentrasi rendah (< 0,1%) umumnya tidak berpengaruh terhadap pertumbuhan tanaman, akan tetapi pada konsentrasi tinggi (> 0,1%) diketahui dapat menurunkan rata-rata tinggi tanaman, jumlah daun per pohon dan bobot keringnya (Goulson et al. 2003). Sehingga upaya pemanfaatan bahan pencerah ini dalam konsentrasi rendah (< 0,1%) untuk meningkatkan kinerja bioinsektisida NPV sangat menguntungkan jika dikembangkan (Martinez et al. 2000).