SINTESIS ASAM 4-HIDROKSI-3-METOKSISINAMAT
DARI 4-HIDROKSI-3-METOKSIBENZALDEHIDA DAN ASAM MALONAT DENGAN KATALIS AMONIA
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh: Yusak Gunawan NIM : 048114076
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
SINTESIS ASAM 4-HIDROKSI-3-METOKSISINAMAT
DARI 4-HIDROKSI-3-METOKSIBENZALDEHIDA DAN ASAM MALONAT DENGAN KATALIS AMONIA
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh : Yusak Gunawan NIM : 048114076
v
HALAMAN PERSEMBAHAN
Menjadi mandiri, kreatif dan berjiwa seni
(Titik Qudarsih)
karya ini :
Saya persembahkan dengan hati yang bersyukur kepada
Papah, Mamah, Yoseph, Reni serta keluarga di rumah,
Guru dan pembimbing ku
And my lovely gamelan
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus atas semua
rahmat dan karuniaNya sehingga penulis dapat menyelesaikan penelitian dan
penulisan skripsi yang berjudul “Sintesis Asam 4-Hidroksi-3-metoksisinamat dari
4-Hidroksi-3-metoksibenzaldehid dan Asam Malonat dengan Katalis Amonia.”
Skripsi ini disusun dalam rangka memenuhi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi (S.Farm).
Selama penelitian dan penyusunan skripsi ini, penulis tidak terlepas dari
bantuan dan dukungan berbagai pihak. Oleh karena itu, penulis mengucapkan
terimakasih kepada :
1. Ipang Djunarko, M.Sc.,Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Lucia Wiwid Wijayanti, M.Si., selaku dosen pembimbing atas kesediaannya
dalam memberikan perhatian dan dukungan dalam penelitian dan penulisan
skripsi ini.
3. Dra. M. M. Yetty Tjandrawati M.Si., selaku dosen penguji yang telah
memberikan saran dan masukan kepada penulis.
4. Jeffry Julianus, M.Si., selaku dosen penguji yang telah banyak memberikan saran
dan masukan kepada penulis..
ix
INTISARI
Sintesis asam 4-hidroksi-3-metoksisinamat yang memiliki aktivitas sebagai
tirosinase inhibitor telah banyak dilakukan. Adanya substituen metoksi meningkatkan aktivitastirosinase inhibitorturunan asam sinamat.
Senyawa asam malonat merupakan asam diprotik yang memiliki dua proton yang bersifat asam, yang memiliki hidrogen yang berposisi alfa pada kedua gugus karbonil. Senyawa ini diharapkan dapat mengalami reaksi kondensasi Knoevenagle
dengan 4-hidroksi-3-metoksi benzaldehid menggunakan katalis amonia. Tujuan penelitian ini adalah mengetahui apakah asam 4-hidroksi-3-metoksisinamat dapat di sintesis dari material awal asam malonat dan 4-hidroksi-3-metoksibenzaldehid menggunakan katalis amonia berdasarkan reaksi kondensasi Knoevenagel.
Penelitian ini merupakan penelitian non-eksperimental deskriptif non-analitik. Analisis hasil dilakukan dengan uji pendahuluan yang meliputi uji organoleptis, uji kelarutan, uji titik lebur, dan elusidasi struktur menggunakan kromatogarfi gas-spektroskopi massa (GC-MS).
Hasil penelitian yaitu: serbuk kasar berwarna coklat muda, rasa pahit, harum vanilla, larut dalam etil asetat, metanol, aquades panas; sukar larut dalam aquades panas dan tidak larut dalam kloroform. Titik lebur 81-820C. Senyawa hasil reaksi masih terdapat dalam bentuk 4-hidroksi-3-metoksibenzaldehid, dapat di simpulkan bahwa reaksi tidak berjalan menurut reaksi kondensasiKnoevenagel.
Kata kunci: 4-hidroksi-3-metoksibenzaldehid, asam malonat, kondensasi
ABSTRACT
4-hidroksi-3-metoksicinnamic acid synthesis which has activity astirosinase inhibitor has been done for many times. The existence of methoksi substituent increase thetirosinase inhibitorcinnamic acid derivative activity.
Malonic acid compound is diprolitic acid which has two acid characteristic protons, which has alpha position hydrogen on the both of carbonyl functional groups. This compound is expected to experience Knoevenagle condensation reaction with 4-hidroksi-3-metoksibenzaldehid by using ammoniac and natrium hydroxide catalysts. The purpose of this research is to figure out whether 4-hidroksi-3-methoksicinnamic acid could be synthesized from the raw materials mallonic acid and 4-hidroksi-3-metoksi benzaldehid using catalysts, ammoniac catalysts on
Knoevenagelcondensation reaction.
This research is non-analytic descriptive non-experimental research. Result analysis was done by introduction test which include organoleptic test, solubility test, melting-point test, and structure elucidation using gas chromatography-mass spectrometry (GC-MS).
The product of this research is a compound with soft-powder form, bitter, vanilla scent, soluble in ethyl acetate, methanol and aquadest, hot aquadest, unsoluble in chloroform, melting point 81-820C. The compound result is still 4-hydroxy-3-methoxybenzaldehid. The reaction is not following Knoevenagel
condensation reaction.
Key words: 4-hydroxy-3-methoxybenzaldehid, mallonic acid, Knoevenagel
DAFTAR ISI
HALAMAN JUDUL………ii
PERSETUJUAN PEMBIMBING...iii
PENGESAHAN SKRIPSI………...iv
HALAMAN PERSEMBAHAN...v
PRAKATA...vi
PERNYATAAN KEASLIAN KARYA...viii
INTISARI...ix
ABSTRACT...x
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI……….xi
DAFTAR ISI...xi
DAFTAR TABEL...xvi
DAFTAR GAMBAR...xvii
DAFTAR LAMPIRAN...xix
BAB I PENGANTAR...1
A. Latar belakang...1
1. Permasalahan...3
2. Keaslian penelitian...3
3. Manfaat Penelitian...4
xiii BAB II
PENELAAHAN PUSTAKA...5
A. Asam Sinamat...5
B. Asam 4-hidroksi-3metoksisinamat...6
C. Asam malonat...7
D.Vanilin...8
E. Amina... 9
F. Aldehid ...10
G. Kondensasi Knoevenagel...11
I. Ekstraksi Pelarut...13
H. Rekristalisasi...14
J. Katalis... ..15
K.Uji Pendahuluan ...15
1. Pemeriksaan organoleptis...16
2. Pemeriksaan Kelarutan...16
3.Pemeriksaan Titik Lebur...17
4. Kromatografi gas...17
K. Spektoskopi Massa untuk Elusidasi Struktur Senyawa Hasil Sintesis...18
1. Pengertian ...18
2. Pola fragmentasi molekul……….………...18
L. Kromatografi Gas-Spektrometri Massa (GC-MS)... 22
M. Landasan Teori……….……23
BAB III
METODE PENELITIAN...27
A. Jenis dan Rancangan Penelitian...27
B. Variabel Penelitian...27
C. Bahan / Materi Penelitian...28
D. Alat...28
E. Tata Cara Penelitian...28
1. Sintesis asam 4-hidroksi-3-metoksisinamat...28
2. Ekstraksi Senyawa Hasil Sintesis...29
3. Rekristalisasi Senyawa Hasil Sintesis...29
4. Uji Pendahuluan...30
a. Uji organoleptis...30
b. Uji kelarutan...30
c. Titik Lebur...30
d. Kromatografi gas...30
4. Elusidasi struktur senyawa hasil sintesis...30
a. Spektrometri massa...30
BAB IV HASIL DAN PEMBAHASAN...32
A. Reaksi KondensasiKnoevenagel………....………...32
xv
3.Uji kelarutan ...34
C. Pengujian hasil reaksi dengan metode GC-MS...34
BAB V KESIMPULAN DAN SARAN...40
A. Kesimpulan...40
B. Saran...40
DAFTAR PUSTAKA...41
LAMPIRAN...43
DAFTAR TABEL
Tabel I. Urutan kebasaan senyawa amina... ..9
Tabel II. Istilah kelarutan menurut Farmakope Indonesia IV ... 17
Tabel III. Perbandingan senyawa hasil reaksi dengan reaktan ... 33
xvii
DAFTAR GAMBAR
Gambar1. Struktur asam sinamat...5
Gambar 2. Bentuk isomertransdancispada asam sinamat...6
Gambar 3. Bentuk isomertransdancisAsam 4-hidroksi-3-metoksisinamat...7
Gambar 4. Struktur asam malonat ...7
Gambar 5. Deaktivasi gugus karboksilat ...7
Gambar 6. Vanilin………...………...8
Gambar 7. Struktur umum aldehid ...10
Gambar 8. Reaksi penyerangan gugus karbonil oleh nukleofil dan elektrofil ...10
Gambar 9. Efek induktif dari penarikan elektron ...…………...11
Gambar 10. Stabilisasi resonansi ion enolat………...………...11
Gambar 11. Reaksi kondensasiKnoevenagelantara benzaldehid dan asam malonat...12
Gambar 12. Dekarboksilasi pada asam malonat dan tautomerasi keto-enol…...13
Gambar 13. spektra massa etanol ...19
Gambar 14. Pemutusan homolitik pada etanol ...20
Gambar 15. Pemutusan heterolitik pada etanol ...20
Gambar 16. Beberapa contoh pemutusan homolitik...20
Gambar 17. Pemutusan dengan transfer proton melalui dua tahap ...21
Gambar 18. Pemutusan ikatan sikloheksanol dengan penataulangan struktur ..…....21
Gambar 19. Pemutusan ikatan sikloheksanol dengan kehilangan air…………...22
Gambar 21. Reaksi umum pembentukan asam 4-hidroksi-3-metoksisinamat ...24
Gambar 22. Reaksi pembentukan garam malonat dan ion enolat dari asam malonat...24
Gambar 23. Reaksi antara 4-hidroksi-3-metoksibenzaldehid dengan ion enolat...25
Gambar 24. Reaksi dehidrasi dan dekarboksilasi pada asam 4-hidroksi-3-metoksisinamat...25
Gambar 25. Foto hasil reaksi dan reaktan...33
Gambar 26. Kromatogram GC...36
Gambar 27. Spektra Massa B ...37
Gambar 28 . Pemutusan ikatan secara homolitik menghasilkan (C8H7O3.+) dan radikal H. ...38
Gambar 29. Pemutusan ikatan secara heterolitik menghasilkan (C7H8O2+) dan C=O ...38
Gambar 30 . Penataulanggan H pelepasan secara heterolitik COH2 ...38
xix
DAFTAR LAMPIRAN
Lampiran 1. Data kromatogram GC ... ...43
Lampiran 2. Data spesifikasi alat dan penggunaannya...44
BAB I
PENGANTAR
A.Latar belakang
Asam sinamat biasa diisolasi dari kulit kayu manis (Cinnamomum burmani). Pada penelitian yang dilakukan oleh Tuzen dan Ozdemir (2003) terhadap tanaman Galanthus elwesii, proses isolasi memerlukan tahapan yang panjang dan sulit dilakukan serta jumlah rendemen asam sinamat yang dihasilkan
hanya sedikit, yaitu sekitar 8,3%. Oleh karena itu, asam sinamat lebih umum
dilakukan dengan cara sintesis.
Hasil penelitian menunjukan adanya subtituen metoksi pada sistem
aromatis memiliki aktifitas sebagi tirosinase inhibitor, material awal untuk sintesis senyawa tabir surya, analgetika & anti inflamasi NSAID. Sebagai
tirosinase inhibitor, adanya substituen metoksi meningkatkan aktivitas turunan sinamat tersebut (LD50 asam sinamat=0,65mM;LD50 asam p-metoksisinamat =0,34 mM) (Haet al., 2001; Kubo et al., 1994; Kubo & Hori, 1999; Leeet al., 2000; Lee HS, 2002; Budiati dkk.,2003).Mengingat pentingnya senyawa tersebut,
maka penelitian tentang senyawa golongan sinamat perlu dikembangkan.
Sintesis turunan asam sinamat telah banyak dilakukan dengan beberapa
macam reaksi dan penggunaan katalis. Seperti sintesis asam p-metoksi sinamat
dari asam malonat dan p-metoksi benzaldehid dengan katalis piridin yang
2 Sintesis asam sinamat dapat dilakukan melalui reaksi Knoevenagel dan reaksiPerkin. ReaksiKnoevenagellebih sering digunakan karena jumlah senyawa yang diperoleh lebih banyak dibandingkan dengan reaksi Perkin. Reaksi
Knoevenagel merupakan reaksi kondensasi antara suatu aldehid dan senyawa yang mempunyai hidrogen α dengan dua gugus karbonil dengan menggunakan amonia atau suatu amina sebagai katalis. (Fessenden and Fessenden, 1986).
Senyawa asam malonat merupakan asam diprolitik yang memiliki dua
proton yang bersifat asam yang memiliki hidrogen yang berposisi alfa pada kedua
gugus karbonil (Fessenden and Fessenden, 1986). Untuk mengetahui reaksi yang
terjadi dari asam malonat bila direaksikan dengan katalis yaitu amonia dalam
membentuk ion enolat. Maka perlu dilakukan penelitian dengan mereaksikannya
dengan dengan suatu senyawaan yang memiliki gugus aldehid dalam hal ini
4-hidroksi-3-metoksi benzaldehid.
Suatu senyawa organik dapat diketahui strukturnya dengan beberapa
teknik analisis, salah satunya dengan spektroskopi massa. Dalam
perkembangannya dapat juga digabungkan dengan kromatografi gas dan
spektroskopi massa (GC-MS). Kombinasi dari kromatografi gas dan spektroskopi
massa memberikan beberapa keuntungan dalam analisis suatu senyawa organik.
Proses elusi dapat dilakukan oleh kromatografi gas berdasarkan polaritasnnya
sedangkan proses indentifikasi dan kuantitatif dapat ditelusuri lewat
fragmen-fragmen yang terbentuk.
Dalam spektroskopi massa, terjadi proses ionisasi senyawa organik dan
Ion-ion molekul ini akan terfragmentasi menjadi fragmen yang paling stabil. Oleh
sebab itu struktur dan massa fargmen dapat memberikan informasi mengenai
senyawa induk dari suatu molekul. Spektra massa yang didapatkan dapat
dipergunakan untuk menentukan bobot molekul namun masih perlu digabungkan
dengan spektra infrared (IR), spektra Proton Nuklear Magnetic Resonance (H-NMR), spekraCarbon-13 Nuclear Magnetic Resonance(C-NMR).
1. Permasalahan
Dari latar belakang diatas, maka dapat dirumuskan permasalahannya
yaitu apakah asam 4-hidroksi-3-metoksi sinamat dapat di sintesis dari material
awal asam malonat dan 4-hidroksi-3-metoksi benzaldehid menggunakan katalis
yaitu amonia berdasarkan reaksi Knoevenagel?
2. Keaslian penelitian
Sejauh pengetahuan penulis belum ada laporan produk yang dihasilkan dari
reaksi antara asam malonat dan 4-hidroksi-3-metoksi benzaldehid menggunakan
katalis amonia. Beberapa senyawa yang dihasilkan berdasarkan reaksi
Knoevenagel yaitu asam malonat dengan para-metoksi benzaldehid menggunakan katalis piridin (Ekawati 2005a) dan asam malonat dengan
meta-metoksi benzaldehid menggunakan katalis piridin (Ekawati, 2005b),
asam malonat dengan para-hidroksi benzaldehid menggunakan katalis amonia (Disastra, 2008), asam malonat dengan benzaldehid asam malonat dengan
4 3. Manfaat penelitian
Mendapatkan informasi mengenai apakah asam 4-hidroksi-3-metoksi
sinamat dapat disintesis dari material awal asam malonat dan
4-hidroksi-3-metoksi benzaldehid menggunakan katalis yaitu amonia berdasarkan reaksi
Knoevenagel?
B.Tujuan Penelitian
Tujuan penelitian ini adalah mengetahui apakah asam 4-hidroksi
-3-metoksi sinamat dapat di sintesis dari material awal asam malonat dan
4-hidroksi-3-metoksi benzaldehid menggunakan katalis yaitu amonia berdasarkan
BAB II
PENELAAHAN PUSTAKA
A. Asam Sinamat
Asam sinamat merupakan senyawa yang berasal dari isolasi kulit kayu
manis (Cinnamomum burmanni) dan termasuk dalam famili Lauraceae. Kulit kayu manis berguna sebagai pewangi atau menimbulkan cita rasa dalam makanan,
kosmetik, sabun, dan produk-produk industri farmasi lainnya. Minyak kayu manis
memiliki efek antiseptik terhadap mikroorganisme. Kandungan utama minyak
kayu manis adalah sinamaldehid yang jika teroksidasi akan menghasilkan asam
sinamat. (Anwaret al., 1994).
Asam sinamat dikenal pula dengan nama asam 3-fenil-2-propenoat, asamβ
-fenilakrilat. Asam sinamat memiliki bobot molekul 148,16 g/mol dengan rumus
molekul C9H8O2; memiliki titik lebur 133°C dan titik didih 300°C; memiliki
panjang gelombang serapan maksimum pada daerah ultraviolet (dalam pelarut
etanol) sebesar 273 nm; sangat sukar larut dalam air dingin; larut dalam air panas;
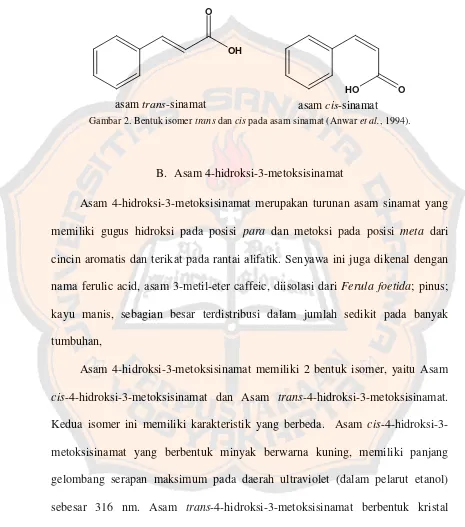
mudah larut dalam alkohol, etanol, dan kloroform.
OH O
6
trans-sinamat memiliki titik lebur 133°C, sedangkan asam cis-sinamat memiliki titik lebur 68°C.
O HO
O
OH
asamcis-sinamat asamtrans-sinamat
Gambar 2. Bentuk isomertransdancispada asam sinamat (Anwaret al., 1994).
B. Asam 4-hidroksi-3-metoksisinamat
Asam 4-hidroksi-3-metoksisinamat merupakan turunan asam sinamat yang
memiliki gugus hidroksi pada posisi para dan metoksi pada posisi meta dari cincin aromatis dan terikat pada rantai alifatik. Senyawa ini juga dikenal dengan
nama ferulic acid, asam 3-metil-eter caffeic, diisolasi dari Ferula foetida; pinus; kayu manis, sebagian besar terdistribusi dalam jumlah sedikit pada banyak
tumbuhan,
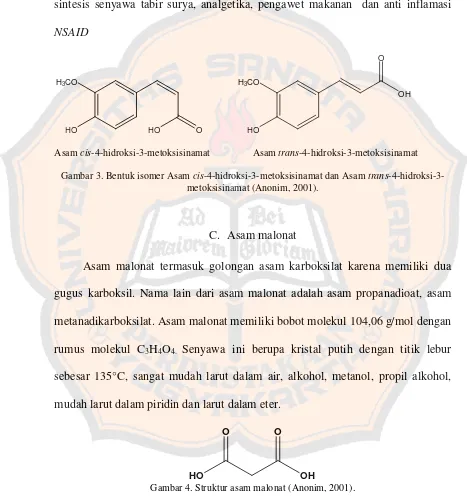
Asam 4-hidroksi-3-metoksisinamat memiliki 2 bentuk isomer, yaitu Asam
cis-4-hidroksi-3-metoksisinamat dan Asam trans-4-hidroksi-3-metoksisinamat. Kedua isomer ini memiliki karakteristik yang berbeda. Asam cis -4-hidroksi-3-metoksisinamat yang berbentuk minyak berwarna kuning, memiliki panjang
gelombang serapan maksimum pada daerah ultraviolet (dalam pelarut etanol)
sebesar 316 nm. Asam trans-4-hidroksi-3-metoksisinamat berbentuk kristal
panas, etil asetat, alkohol. Agak sukar larut dalam eter, sedikit larut dalam
petroleum eter, benzene, Berat molekul 194.18 g/mol, titik lebur 1740C rumus
molekul C10H10O4. Aktifitas sebagai tirosinase inhibitor, material awal untuk sintesis senyawa tabir surya, analgetika, pengawet makanan dan anti inflamasi
NSAID
Asamcis-4-hidroksi-3-metoksisinamat Asamtrans-4-hidroksi-3-metoksisinamat Gambar 3. Bentuk isomer Asamcis-4-hidroksi-3-metoksisinamat dan Asamtrans
-4-hidroksi-3-metoksisinamat (Anonim, 2001).
C. Asam malonat
Asam malonat termasuk golongan asam karboksilat karena memiliki dua
gugus karboksil. Nama lain dari asam malonat adalah asam propanadioat, asam
metanadikarboksilat. Asam malonat memiliki bobot molekul 104,06 g/mol dengan
rumus molekul C3H4O4. Senyawa ini berupa kristal putih dengan titik lebur
sebesar 135°C, sangat mudah larut dalam air, alkohol, metanol, propil alkohol,
mudah larut dalam piridin dan larut dalam eter.
O
OH O
HO
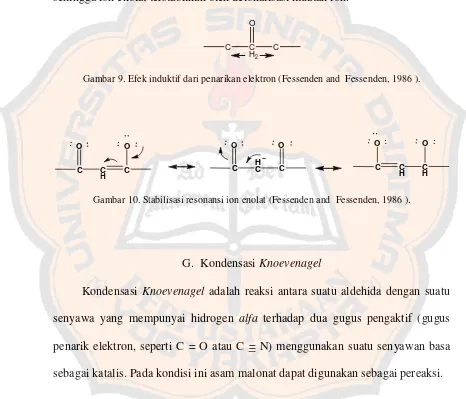
8 tersubtitusi atau sebagai kompleks amina asam (Fessenden and Fessenden,
1986b). Reaksi asam karboksilat dengan suatu amina tidak akan membentuk
amida karena amina merupakan suatu basa yang mengubah keasaman gugus
karboksilat menjadi bentuk anion karboksilat yang tidak reaktif
R
Gambar 5. Deaktivasi gugus karboksilat (McMurry, 2004).
D. Vanilin
Vanilin merupakan senyawa organik yang berasal dari alam yang diperoleh
dari tanamanVanilla planifolia,tetapi juga telah diproduksi secara sintesis. Nama lain dari vanilin adalah 4-hidroksi-3-metoksibenzaldehid. Secara struktural terdiri
atas cincin benzene dengan gugus aldehid, gugus hidroksi dan gugus metoksi.
Rumus molekulnya adalah C8H8O3.
O
OH
H OCH3
Gambar 6. Vanilin (Anonim, 2001).
Vanilin murni berbentuk kristal jarum berwarna putih atau putih kekuningan
(mengkilat), berbau khas (harum) dan memiliki rasa yang khas. Senyawa ini
memiliki kelarutan 1 gram dalam 100 ml air, 1 gram dalam 16 ml air pada suhu
160 C dan 1 gram larut dalam 20 ml gliserol. Mudah larut dalam alkohol dan
piridin, ether, larutan basa hidroksi. Vanilin dapat teroksidasi dalam kondisi
udara yang lembab dan terpapar sinar matahari secara langsung, berat molekul
adalah 152.14 sedangkan berat jenis vanilin adalah 1.056 dengan titik leleh 80-81 0
C dan titik didih 2850C.
E. Amina
Amina memiliki atom nitrogen dengan suatu pasangan elektron bebas, hal
ini menjadikan amonia bersifat basa dan dapat berperan sebagai nukleofil. Jika
amina bebas terstabilkan relatif terhadap kationnya, maka amina itu merupakan
basa lemah dan jika kation itu terstabilkan relatif terhadap amina bebasnya, maka
amina itu adalah basa yang lebih kuat. Berikut urutan kebasaan senyawa amina
berdasarkan pKa:
Tabel I. Urutan kebasaan senyawa amina (Brown and Poon, 2005)
Nama Nilai pKb
10 Selain itu, resonansi juga mempengaruhi sifat basa suatu amina. Suatu
molekul dengan kemampuan beresonansi akan menurunkan kebasaannya karena
elekteron-elektron menyendiri pada senyawa nitrogen bebas lebih mudah
terstabilkan dengan adanya resonansi tersebut (Fessenden dan Fessenden, 1986 b).
F. Aldehid
Aldehid merupakan satu dari sekian banyak senyawa organik yang memiliki
gugus karbonil. Aldehid memiliki sekurang-kurangnya satu hidrogen yang terikat
pada gugus karbonil. Gugus lain pada aldehid dapat berupa alkil, aril, H
O
H R
Gambar 7. Struktur umum aldehid (Fessenden and Fessenden, 1994).
Gugus karbonil dalam aldehid bersifat polar dengan elektron dalam ikatan
sigma dan ikatan pi. Elektron dalam ikatan pi akan mudah tertarik pada atom
oksigen yang bersifat elektronegatif. Selain elektronegatifitas faktor lain yang
menentukan kepolaran adalah momen dipol.
Oksigen pada gugus karbonil memiliki dua pasang elekron bebas yang
mudah di serang oleh elektrofil maupun nukleofil.
O
Ikatan antara karbon dan hidrogen biasanya stabil, non polar dan tidak
bersifat asam. Tetapi dengan adanya gugus karbonil terjadilah hidrogen yang
bersifat asam terutama posisi alfa pada gugus karbonil. Hal itu disebabkan oleh
efek induktif dan adanya stabilisasi ion enolat bila kehilangan atom hidrogen
sehingga ion enolat terstabilkan oleh delokalisasi muatan ion.
C C
H2 O
C
Gambar 9. Efek induktif dari penarikan elektron (Fessenden and Fessenden, 1986 ).
O
Gambar 10. Stabilisasi resonansi ion enolat (Fessenden and Fessenden, 1986 ).
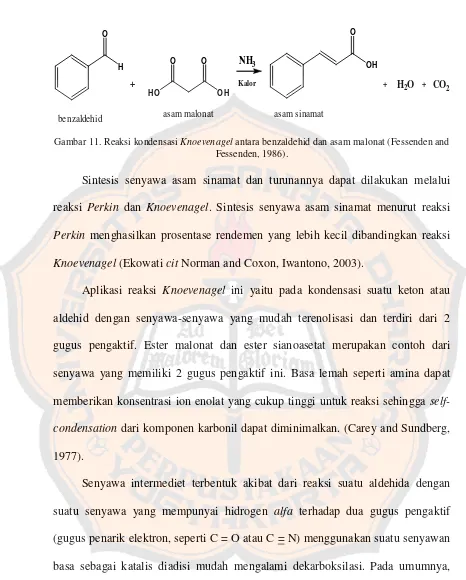
G. KondensasiKnoevenagel
Kondensasi Knoevenagel adalah reaksi antara suatu aldehida dengan suatu senyawa yang mempunyai hidrogen alfa terhadap dua gugus pengaktif (gugus penarik elektron, seperti C = O atau C = N) menggunakan suatu senyawan basa
12
benzaldehid asam malonat asam sinamat
Gambar 11. Reaksi kondensasiKnoevenagelantara benzaldehid dan asam malonat (Fessenden and Fessenden, 1986).
Sintesis senyawa asam sinamat dan turunannya dapat dilakukan melalui
reaksi Perkin dan Knoevenagel. Sintesis senyawa asam sinamat menurut reaksi
Perkin menghasilkan prosentase rendemen yang lebih kecil dibandingkan reaksi
Knoevenagel(EkowaticitNorman and Coxon, Iwantono, 2003).
Aplikasi reaksi Knoevenagel ini yaitu pada kondensasi suatu keton atau aldehid dengan senyawa-senyawa yang mudah terenolisasi dan terdiri dari 2
gugus pengaktif. Ester malonat dan ester sianoasetat merupakan contoh dari
senyawa yang memiliki 2 gugus pengaktif ini. Basa lemah seperti amina dapat
memberikan konsentrasi ion enolat yang cukup tinggi untuk reaksi sehingga self-condensationdari komponen karbonil dapat diminimalkan. (Carey and Sundberg, 1977).
Senyawa intermediet terbentuk akibat dari reaksi suatu aldehida dengan
suatu senyawa yang mempunyai hidrogen alfa terhadap dua gugus pengaktif (gugus penarik elektron, seperti C = O atau C = N) menggunakan suatu senyawan
basa sebagai katalis diadisi mudah mengalami dekarboksilasi. Pada umumnya,
dekarboksilasi dan eliminasi terjadi secara bersamaan (Carey and Sundberg,
asam karboksilat membutuhkan pemanasan yang tinggi untuk mengalami
dekarboksilasi ini.
Dekarboksilasi terjadi karena adanya penataulangan enam elektron dari
bentuk transisi cincin siklik sehingga menghasilkan karbondioksida dan suatu
enol. Bentuk enol sebagai hasil dekarboksilasi ini selanjutnya akan mengalami
tautomerisasi keto-enol.
Gambar 12. Dekarboksilasi pada asam malonat dan tautomerasi keto-enol (Brown and Poon, 2005).
H. Ekstraksi Pelarut
Ekstraksi pelarut atau disebut juga ekstraksi cair merupakan metode
pemisahan yang paling baik dan popular. Penyebab utamanya adalah bahwa
pemisahan ini dapat dilakukan baik dalam tingkat makro dan mikro. Prinsip
metode ini berdasarkan pada ditribusi zat terlarut dengan perbandingan tertentu
antara dua pelarut yang tidak saling bercampur seperti benzene,
karbontetraklorida, kloroform. Batasannya adalah zat terlarut dapat ditransfer
pada jumlah yang berbeda dalam kedua fase terlarut. Teknik ini dapat
14 terlarut dalam fase 2, maka perbandingan X1, X2didapat; KD = , dimana KD
adalah koefisien partisi. Partisi atau koefisen ditribusi ini tidak tergantung pada
konsentrasi total zat terlarut pada kedua fase tersebut.
Perbandingan distribusi (D) dapat dilakukan dengan memperhitungkan
konsentrasi total sat di dalam kedua fase. Perbandingan ditribusi terssebut
dinyatakan sebagai berikut:
D =
Jika tidak terjadi asosiasi, disosiasi dan polemirisasi pada fase tersebut maka
disebut keadaan ideal dimana KD sama dengan D. Mekanisme ekstaksi
memungkinkan interaksinya dengan fase organik. (Khopkar.1990.)
Katalis merupakan suatu bahan yang dapat meningkatkan laju reaksi kimia
tanpa diubah dalam keseluruhan reaksi kimia. Namun tidak berarti tidak terlibat
dalam reaksi, katalis berada dalam bentuk yang sama sebelum dan sesudah reaksi
berlangsung.
Reaksi kondensasi knoevenagle melibatkan suatu katalis basa. Katalis basa tersebut akan bereaksi dengan hidrogen alfa untuk membentuk ion enolat. Ion
enolat ini kemudian akan bereaksi dengan karbonil dari aldehid. (Bruice,1998).
I. Rekristalisasi
Rekristalisasi merupakan metode pemurnian suatu zat padat dengan cara
melarutkan zat padat tersebut dengan pemanasan pada pelarut yang sesuai dan
kemudian mendinginkan larutan tersebut. Dengan memanaskan larutan, kelarutan
dan senyawa mulai mengendap (Bresnick, 1996). Dengan demikian rekristalisasi
adalah suatu cara memurnikan zat padat dengan jalan mengkristalkan kembali dari
cairan pelarut atau campuran cairan pelarut yang sesuai (Reksohadiprojo, 1975).
Agar rekristalisasi dapat berjalan dengan baik, pengotor harus dapat larut
dalam pelarut untuk rekristalisasi atau mempunyai kelarutan lebih besar daripada
senyawa yang diinginkan. Jika hal ini tidak terpenuhi, kotoran akan ikut
mengkristal bersama senyawa yang diinginkan (Bresnick, 1996).
J. Uji Pendahuluan
Uji pendahuluan dilakukan untuk mengetahui karakteristik dari senyawa
hasil reaksi, biasanya meliputi pemeriksaan organoleptis, pemeriksaan kelarutan,
pemeriksaan titik lebur, dan kromatografi gas.
1. Pemeriksaan organoleptis
Pemeriksaan organoleptis memuat paparan mengenai sifat zat yang
meliputi wujud, rupa, warna, rasa, bau. Dengan pemeriksaan organoleptis
dapat diketahui ciri fisik dari senyawa baru. Sehingga pemeriksaan
organoleptis dapat dijadikan sebagai pentunjuk awal dalam pemeriksaan
senyawa hasil sintesis dengan membandingkanya dengan standar dan
diharapkan sesuai dengan yang tercantum dalam standar.
Pernyataan dalam pemeriksaan organoleptis tidak cukup kuat dijadikan
16 Pemeriksaan kelarutan senyawa dilakukan untuk mengetahui sifat fisik
suatu zat. Selain itu, uji kelarutan dapat digunakan untuk identifikasi atau
determinasi kemurnian dari senyawa tersebut dengan membandingkannya
dengan standar dan diharapkan sesuai dengan yang tercantum dalam standar.
(Jenkinset al, 1965).
Istilah kelarutan tidak saja merupakan standar atau uji kemurnian dari
suatu zat, tetapi lebih dimaksudkan sebagai informasi dalam penggunaan,
pengolahan, dan peracikan bahan, kecuali apabila disebutkan khusus dalam
judul tersendiri dan disertai cara ujinya secara kuantitatif. Pernyataan bagian
dalam kelarutan berarti 1 gram zat padat atau 1 ml zat cair dalam sejumlah ml
pelarut (Anonim,2001).
Tabel II. Istilah kelarutan zat menurut Farmakope Indonesia IV (Anonim, 1995)
Istilah kelarutan
Jumlah bagian pelarut yang diperlukan untuk melarutkan 1 bagian zat Sangat mudah larut
Mudah larut Larut Agak sukar larut
Sukar larut Sangat sukar larut Praktis tidak larut
Kurang dari 1 1 sampai 10 10 sampai 30 30 sampai 100 100 sampai 1.000 1.000 sampai 10.000
Lebih dari 10.000
3. Pemeriksaan titik lebur
Titik lebur adalah proses perubahan fisika pada suhu tertentu yang
mengakibatkan padatan mulai berubah menjadi cair pada tekanan 1 atmosfer.
Jika suhu dinaikkan, terjadi penyerapan energi oleh molekul senyawa
rotasi dari molekul tersebut. Bila suhu tetap dinaikkan terus maka molekul
akan rusak dan berubah menjadi cairan (Brandstatter, 1971).
Pemeriksaan titik lebur merupakan aspek yang sangat penting, yang
seringkali dilakukan dalam penelitian sintesis suatu senyawa. Pemeriksaan
titik lebur dapat memberikan informasi mengenai kemurnian dari suatu
produk hasil sintesis. Pada umumnya suatu senyawa mempunyai kemurnian
yang baik bila jarak leburnya tidak lebih dari 2°C. Rentangan lebih besar dari
harga ini dapat dikatakan senyawa kurang murni (MacKenzie, 1967).
K. Spektroskopi Massa Untuk Penentuan Struktur Kimia
1. Pengertian
Molekul-molekul organik dalam spektrometri massa, ditembak dengan
elektron berenergi tinggi. Penembakan elektron pada suatu molekul
menyebabkan pelepasan elektronnya dan terbentuknya ion molekuler.
e + M 70 eV M + 2e
Energi yang dibutuhkan untuk penembakan tersebut bervariasi, namun
sering digunakan adalah sebesar 70 eV. Pemecahan molekul dengan elektron
berkekuatan 7-15 eV tidak menghasilkan pecahan-pecahan molekul yang
dapat diidentifikasi, sedangkan dengan elektron diatas 70 eV akan
menghasilkan fragmen yang sulit diidentifikasi, karena massa relatif
18 Ion-ion molekuler ini tidak stabil dan pecah menjadi fragmen kecil, baik
berbentuk radikal bebas maupun ion-ion lain. Fragmen yang bermuatan positif
ini akan terdeteksi. Sedangkan fragmen-fragmen netral yang dihasilkan
(molekul tak bermuatan atau radikal) tidak dapat dideteksi dalam spektrometer
massa (Sastrohamidjojo, 2001).
Spektrum massa adalah alur kelimpahan (abundance, jumlah relative
fragmen bermuatan positif yang berlainan) versus nisbah muatan/massa (m/e
atau m/z) dari fragmen-fragmen tersebut. Muatan ion yang diditeksi spectra
massa adalah M+1; nilai dari massa partikel versus kelimpahan relative
partikel itu. (Fessenden dan Fessenden 1986 ).
2. Pola fragmentasi molekul
a. Pemutusan ikatan secara homolitik dan heterolitik
Suatu analait di analisis menggunakan Elektron Impact akan bermuatan
positif dengan kehilangan satu elektron. Jika terdapat atom elektronegatif
seperti oksigen, sulfur, nitrogen maka muatan positif ini akan berada
dalam atom-atom elektronegatif. Jiaka tidak terdapat dalam atom-atom
elektronegatif maka sulit ditentukan secara pasti letaknya. Dua tipe
fragmentasi dapat dilihat pada spektra massa etanol, seperti gambar di
Gambar 13. spektra massa etanol Proses fragmentasi adalah sebagai berikut :
a.1 Pemutusan ikatan homolitik diawali dengan adanya heteroatom
seperti oksigen, sulfur, nitrogen, base peak atau peak dasar
bisanya diberikan oleh molekul yang mengandung heteroatom.
a.2 Suatu elektron akan terpisah, suatu radikal akan terbentuk. Elekron
satunya lagi akan bergabung dengan electron tanpa berpasangan
dari heteroatom, maka akan terbentuk ikatan rangkap; heteroatom
ini akan bermuatan positif
a.3 Kehilangan molekul radikal terbesar adalah yang paling disukai
dalam fragmentasi, untuk etanol peak dasar m/z = 31 dengan
kehilangan molekul radikal CH3.
H3C C H H
OH H
3C C H
OH + H
20 Untuk beberapa molekul spektra didominasi oleh pemutusan
homolitik dibandingkan heterolitik
H3C
Gambar 15. Pemutusan heterolitik pada etanol
Mekanisme pemutusan homolitik diperjelas lewat mekanisme berikut:
H3C
Gambar 16. Beberapa contoh pemutusan homolitik (Watson,2003) b. Pemutusan ikatan dengan transfer proton
Pemutusan ikatan dengan transfer proton sering juga terjadi dalam
spektra massa suatu senyawa. Pada senyawa organik dengan hidrokarbon
rantai panjang, pemutusa ikatan secara homolitik terjadi terlebih dahulu
dilanjutkan dengan transfer muatan, yang dapat di lihat pada gambar 17
O
Gambar 17. Pemutusan dengan transfer proton melalui dua tahap (Watson,2003) c. Fragmentasi dari struktur cincin
Tipe fragmentasi yang lebih komplek dalam spectra massa adalah
penataulangan dari struktur suatu molekul dan ini lebih mungkin terjadi
bila memiliki struktur cincin.sikloheksanol adalah salah satu senyawa
yang memiliki stuktur cincin, pemutusan dapat terjadi lewat beberapa
cara yaitu; penataulangan struktur molekul dengan kehilangan air atau
fragmentasi yang mengikuti reaksi retro-Diels –Alder. Pola fragmentasi dapat di lihat pada gambar 18 sampai 20.
OH O
Gambar 18. Pemutusan ikatan sikloheksanol dengan penataulangan struktur (Watson,2003).
OH
H
H
22 CH
CH3
Gambar 20. fragmentasi yang mengikuti reaksiretro-Diels –Aldel(Watson,2003).
L. Kromatografi Gas-Spektrometri Massa (GC-MS)
Metode kromatografi gas dan spektrometri massa memberikan keuntungan
saat keduanya digunakan secara bersamaan. Proses pemisahan dilakukan oleh
kromatografi gas, sedangkan proses fragmentasi dilakukan oleh spektrometri
massa. Keuntungan dari kromatografi gas-spektrometri massa antara lain metode
ini dapat digunakan untuk hampir semua jenis analit, memiliki batas deteksi yang
rendah, dan memberi informasi penting tentang spektra massa dari suatu senyawa
organik (Dean, 1995).
Perkembangan metode GC-MS pada mulanya dihadapkan pada suatu
masalah besar yaitu penggabungan kolom kromatografi gas ke spektrometri massa.
Packed Coloums dipergunakan dan besarnya volume sample dan gas pembawa akan memenuhi sistem spektrometer massa, sehingga harus dioperasikan dengan
tekanan rendah dan penggabungan keluaran kolom dan spectrometer massa harus
dibuat khusus. Dengan ditemukannya kolom berlapis sillika maka masalah ini
dapat diatasi, dan eluat dari kromatografi gas dapa langsung dihubungkan dengan
ion source. (Christian,2004).
Terdapat beberapa teknik untuk menghasilkan ion molekul yaitu: ionisasi
atom bombardment (FAB), Elektrospray ionization (ESI) dan Matrix Assisted
Loaser Desorption Ionization (MALDI). Dari beberapa macam teknik tersebut
yang paling umuin dipergunakan adalah Elekton Impact, yaitu dengan penembakan
berkas electron pada suatu molekul organik menghasilkan ion molekul bermuatan
positif yang dapat pecah menjadi ion yang lebih kecil (Silverstain and
Webster,1998).
M. Landasan Teori
Reaksi Knoevenagel adalah reaksi antara suatu aldehida yang berperan sebagi elektrofil dengan suatu senyawa yang mempunyai hidrogen alfa terhadap dua gugus karbonil dengan menggunakan suatu basa amina sebagai katalis. Oleh
karena itu, pada sintesis asam hidroksi-3-metoksisinamat ini digunakan
4-hidroksi-3-metoksibenzaldehid yang berperan sebagai elektrofil dan asam malonat
yang mempunyai hidrogen alfa terhadap dua gugus karbonil menggunakan amonia sebagai katalis melalui reaksi kondensasiKnoevenagel.
24 N. Hipotesis
Asam malonat akan bereaksi dengan 4-hidroksi-3-metoksibenzaldehid
menggunakan katalis yaitu amonia menghasilkan asam
4-hidroksi-3-metoksisinamat. Dengan reaksi sebagai berikut :
O
Gambar 22. Reaksi pembentukan garam malonat dan ion enolat dari asam malonat
C
26
OH OH
O
OH O
OH O
O H
- CO2
OCH3
OCH3
OH OH
O
OCH3 H
Gambar 24.Reaksi dehidrasi dan dekarboksilasi pada asamtrans-4-hidroksi-3-metoksi
BAB III
METODE PENELITIAN
A. Jenis dan rancangan penelitian
Penelitian ini merupakan suatu penelitian eksperimental deskriptif
non-analitik karena tidak ada manipulasi terhadap subjek uji.
B. Parameter penelitian dan Definisi Operasional
1. Starting material (SM) adalah bahan awal yang digunakan untuk menghasilkan produk. Bahan awal yang digunakan pada penelitian ini adalah
asam malonat dan 4-hidroksi-3-metoksibenzaldehid
2. Molekul target (MT) adalah senyawa yang diharapkan dapat terbentuk dari
bahan awal. Senyawa yang diharapkan terbentuk dalam penelitian ini adalah
asam 4-hidroksi-3-metoksisinamat
3. Katalis adalah suatu senyawa yang digunakan dalam reaksi untuk
meningkatkan laju reaksi kimia. Katalis yang digunakan dalam penelitian ini
adalah amonia 25%.
4. Rendemen adalah jumlah molekul target yang terjadi dan dapat
diperhitungkan dari jumlah starting material yang digunakan. Rendemen senyawa hasil sintesis yang diharapkan dalam penelitian ini adalah rendemen
28 C. Bahan / materi penelitian
Asam malonat (p.a, E. Merck), Amonia 25 % (p.a, E. Merck), NaOH (p.a, E. Merck) Vanilin (p.a, E. Merck), pelarut : aquadest (laboratorium Farmasi Universitas Sanata Dharma), asam klorida (p.a, E. Merck), metanol (p.a, E. Merck), n-heksan (teknis, Brataco Chemika), etil asetat (p.a, E. Merck), kloroform (p.a, E. Merck), asam asetat glasial (teknis, Asia Lab), aseton (teknis, Asia Lab), petroleum eter (p.a, E. Merck), eter (teknis, Brataco Chemika), kertas saring, es batu.
D. Alat
Pendinginalihn(Vuline), kompor listrik (Herdolph MR 2002),beaker glass
(Duran schott mainz), klem, erlenmeyer bertutup (Duran schott mainz), stirrer
magnetik, selang air, baskom, termometer, corong buchner, tabung buchner, pompa vakum (Robinair High Vacuum Pump model no. 15100), corong kaca,
cawan petri, oven (Memmert oven model 400), flakon, gelas pengaduk,
timbangan elektrik (Mextler PM 100), lampu UV254 nm, kaca arloji, gelas ukur
(Iwaki pyrex), labu ukur (Iwaki pyrex), pipet ukur (Brand), alat uji titik lebur
(Thermophan), kromatografi gas-spektrometer massa (Shimadzu QP 2010S).
E. Tata cara penelitian
1. Sintesis 4-hidroksi-3-metoksisinamat
Asam malonat 15 mmol (1,55 g) ditambahkan dalam amonia 45 mmol (4 ml)
dimasukkan Vanilin 15 mmol (2,2 g) yang sudah dilarutkan NaOH 0,2N (15 ml)
dan dipanaskan pada suhu 800C dilanjutkan dengan pengadukan selama 5 jam.
Tambahkan larutan HCl 2N 50 ml ke dalam larutan diatas. Larutan hasil sintesis
ditambahkan dengan etil asetat dalam corong pisah dan di gojog hingga diperoleh
dua fase yaitu fase air dan fase etil asetat. Fraksi etil asetat kemudian di ambil dan
diuapkan dalan vakum evaporator dengan suhu 800C. Hasil penguapan berupa
endapan merah.
Endapan disaring dengan corongBuchnerdan dicuci dengan larutan HCl 2N, air. Endapan yang diperoleh selanjutnya dimurnikan dengan rekristalisasi
menggunakan akuades panas.
2. Ekstraksi Senyawa Hasil Sintesis
Larutan hasil sintesis ditambahkan dengan etil asetat dalam corong pisah dan
di gojog hingga diperoleh dua fase yaitu fase air dan fase etil asetat. Fraksi etil
asetat kemudian di ambil dan di uapkan dalan vakum evaporator dengan suhu
800C. Hasil penguapan berupa endapan merah.
3. Rekristalisasi Senyawa Hasil Sintesis
Serbuk hasil sintesis dilarutkan dalam aquadest panas, disaring dan filtrat
ditampung. Filtrat yang diperoleh didinginkan dalam ice bath hingga terbentuk kristal. Kristal disaring dengan corong Buchner yang telah dilapisi kertas saring dan dikeringkan dalam oven pengering pada suhu 100°C. Setelah kering, kristal
30 4. Uji Pendahuluan
a. Uji organoleptis. Dilakukan dengan cara mengamati warna, bentuk, bau
dan rasa senyawa hasil sintesis. Kemudian hasil pengamatan dibandingkan dengan
starting material yang digunakan dalam penelitian yaitu asam malonat dan 4-hidroksi-3-metoksibenzaldehid.
b. Uji kelarutan. Senyawa hasil sintesis 50 mg dimasukkan ke dalam beaker glass 1000 ml, kemudian tambahkan akuades sebanyak 1 ml hingga tepat larut. Prosedur yang sama dilakukan dengan pelarut lain yaitu akuades panas, akuades
dingin, metanol, kloroform, dan etil asetat.
c. Titik Lebur. Kristal senyawa hasil sintesis diisikan kedalamelectrothermal capillary tubes, kemudian dimasukkan ke dalam alat pengukur titik lebur (Thermophan). Amati peleburan kristalnya dan catat suhu waktu pertama kali melebur hingga semua kristal melebur dengan kenaikan suhu 0,2° C per menitnya.
5. Elusidasi Struktur Senyawa Hasil Sintesis Dengan Kromatografi Gas
Spektroskopi Massa (GC-MS)
Pemisahan dan pemeriksaan kemurnian senyawa hasil sintesis dilakukan
menggunakan instrumen kromatografi gas dengan kondisi alat: suhu injektor
320°C, jenis kolom Rtx-5MS, panjang kolom 30 meter, suhu kolom diprogram
100°C, gas pembawa helium, tekanan 22 kPa, kecepatan alir fase gerak 0,5
ml/menit, dan detektor ionisasi nyala. Cuplikan senyawa hasil sintesis dilarutkan
dalam aseton, kemudian diinjeksikan ke dalam injektor pada alat kromatografi
diuapkan masuk kedalam kolom Rtx-5MS yang dilapisi fase cair
dimethylpolysiloxane. Selanjutnya cuplikan diukur oleh detektor hingga diperoleh suatu kromatogram
Uap cuplikan senyawa hasil sintesis yang keluar dari kolom kromatografi
gas dialirkan ke dalam kamar pengion pada spektrometer massa untuk ditembak
dengan seberkas elektron sehingga terfragmentasi. Jenis pengionan yang
digunakan adalah EI (Electron Impact) 70 eV. Fragmen-fragmen akan melewati lempeng pemercepat ion dan didorong menuju tabung analisator, dimana
partikel-partikel akan dibelokkan dalam medan magnet dan menimbulkan arus pada
kolektor yang sebanding dengan kelimpahan relatif setiap fragmennya.
Kelimpahan relatif setiap fragmen akan dicatat dan menghasilkan data spektra
32 BAB IV
HASIL DAN PEMBAHASAN
A. Reaksi KondensasiKnoevenagel
Reaksi KondensasiKnoevenageldilakukan dengan cara mereaksikan asam malonat 15 mmol (1,55 g) ditambahkan amonia 45 mmol (4 ml) kemudian ke
dalam campuran tadi dimasukkan 4-hidroksi-3-metoksibenzaldehid 15 mmol
(2,2 g) yang sudah dilarutkan NaOH 0,2 N (15 ml) dan dipanaskan pada suhu
800C dilanjutkan dengan pengadukan selama 5 jam. Sebanyak 50 ml larutan HCl
2N ditambahkan larutan ke dalam larutan diatas. Larutan hasil sintesis
ditambahkan dengan etil asetat dalam corong pisah dan di gojog hingga diperoleh
dua fase yaitu fase air dan fase etil asetat. Fraksi etil asetat kemudian di ambil dan
diuapkan dalan vakum evaporator dengan suhu 800C. Hasil penguapan berupa
endapan merah.
Endapan tersebut kemudian di periksa titik leburnya dengan termophan, langkah selanjutnya adalah menguji kelarutan menggunakan etanol, metanol, air
dingin, air panas, etil asetat. Langkah akhir dilakukan dengan elusidasi struktur
menggunakan spektrometri massa, menggunakan alat Kromatografi gas
-Spektrometer massa (GC-MS).
B. Uji Pendahuluan
1. Uji organoleptis
Dilakukan dengan cara mengamati warna, bentuk, bau dan rasa senyawa hasil
sintesis. Kemudian hasil pengamatan dibandingkan denganstarting material yang digunakan dalam penelitian yaitu asam malonat dan 4-hidroksi-3-metoksi
benzaldehid. Ditujukan dengan tabel III dan gambar 23
Pemeriksaan Senyawa hasil reaksi Vanilin Asam malonat
bentuk serbuk halus serbuk kristal serbuk kristal
warna coklat muda putih kekuninggan putih
bau harum vanila harum vanila tidak berbau
Tabel III. Perbandingan organoleptis senyawa hasil reaksi dan reaktan
Senyawa hasil reaksi Vanilin Asam malonat
Gambar 25. Foto hasil reaksi dan reaktan 2. Uji titik lebur
Uji titik lebur digunakan untuk mengetahui informasi mengenai identifikasi
dan kemurnian dari suatu senyawa hasil sintesis. Senyawa diakatakan murni bila
memiliki rentang titik lebur20C. (MacKenzei,1967)
Berdasarkan pemeriksaan diketahui bahwa senyawa hasil sintesis
34 metoksibenzaldehid 81-820C. Perbedaan titik lebur produk dengan reaktan
menunjukan produk yang berbeda dengan reaktan.
3. Uji kelarutan
Uji kelarutan senyawa hasil sintesis dilakukan untuk mengetahui kelarutan
senyawa hasil sintesis dalam berbagai pelarut, baik yang polar maupun non polar.
Hasil kelarutan juga dapat digunakan sebagai acuan dalam pemilihan pelarut
untuk GC-MS. Data uji kelarutan senyawa hasil sintesis adalah sebagai berikut :
Kelarutan
Pelarut Senyawa hasil sintesis
4-hidroksi-3-metoksibenzaldehid
Asam malonat
Aquadest Sangat sukar larut Larut Larut
Aquadest
panas Larut Larut Larut
Metanol Larut Larut Larut
Kloroform Tidak larut Tidak larut
Tidak larut
Etil asetat Larut Larut
Tidak larut Tabel IV. Perbandingan kelarutan senyawa hasil reaksi dan reaktan
Dari data di atas terdapat beberapa perbedaan antara produk dengan reaktan, dapat
di simpulkan bahwa produk masih merupakan suatu campuran yang larut dam
pelarut polar seperti metanol
C. Pengujian Senyawa Hasil Reaksi Dengan Metode GC-MS
Pengujian senyawa hasil reaksi dengan kombinasi kromatografi gas dan
spektrometri massa memilki keuntungan, yaitu dapat melakukan pemisahan
campuran. Pemisahan pada GC akan dideteksi oleh spektrometri massa dan
Spekta massa yang diperoleh akan dipergunakan untuk menentukan bobot
molekul senyawa hasil reaksi. Spektra massa juga dapat dipergunakan untuk
meramalkan kerangka molekul hasil reaksi melalui interpretasi
fragmen-fragmennya.
Dari hasil pengujuian dengan alat GC-MS didapatkan data kromarogram
GC dan spektra massa. Senyawa hasil reaksi menunjukan tiga peak dengan waktu
retensi yang berbeda, ini menunjukan bahwa terdapat minimal tiga senyawa hasil
reaksi, dalam campuran.
Terdapat tiga waktu retensi yang berbeda yaitu A=10.076; B=11.625; dan
Waktu retensi 2 = 11.625 setelah di analisis dengan spektrometer massa
menujukan AUC terbesar yaitu 97.89%. spektra massanya ternyata menunjukan
senyawa vanillin dengan base peak 151, sedangkan bobot molekul vanillin adalah
152 yang artinya bahwa vanilin melepas radikal H. Gambar spektra massa dan
interpretasi spekra vanillin selengkapnya akan ditunjukan pada gambar 27 hingga
30.
Keterangan:
Abundance : kelimpahan yaitu jumlah relatife fragmen bermuatan positif m/z = massa/muatan
Gambar 27. Spektra massa B
38
Peak A pada m/z = 151 menujukan base peak dari vanilin (C8H8O3) dengan melepaskan radikal H secara homolitik menjadi (C8H7O3.+)
H3CO
Gambar 29 . Pemutusan ikatan secara heterolitik menghasilkan (C7H8O2+) dan C=O
Peak B pada m/z = 123 menunjukan fragmen dari ion (C7H8O2+) dari lepasnya fragmen C=O dari ikatanya dengan cincin secara heterolitik.
H2CO
Gambar 30 . Penataulanggan H pelepasan secara heterolitik COH2
Peak C pada m/z = 93 menunjukan fragmen dari ion (C6H6O+) dari lepasnya
Gambar 31 . Pelepasan C=C.secararetro-Diels –Aldel
Berdasarkan serangkaian uji yang telah dilakukan dapat disimpulkan
bahwa tidak terjadi reaksi kondensasi Knoevenagel. Dibuktikan oleh kromatogarm GC dimana konsentrasi dari vanilin masih dalam jumlah yang
Reaksi kondensasi Knoevenagel tidak berjalan dikarenakan basa amonia yang dapat memberikan sepasangan elektron bebas dan berperan sebagai nukleofil
terlalu lemah untuk dapat menarik H pada posisi α untuk dapat membentuk ion
enolat. Ion enolat yang tidak terbentuk mengakibatkan reaksi adisi antara asam
malonat dan 4-hidroksi-3-metoksi benzaldehid.
Penggunaan NaOH berfungsi sebagi pelarut dari 4-hidroksi-3-metoksi
benzaldehid dalam reaksi kondensasiKnoevenagel. Asam malonat tidak terdeteksi pada analisis kromatografi gas dikarenakan larut saat pencucian dengan HCl dan
40 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Reaksi kondensasi Knoevenagel tidak berjalan dikarenakan basa amonia yang dapat memberikan sepasangan elektron bebas dan berperan sebagai nukleofil
terlalu lemah untuk dapat menarik H pada posisi α untuk dapat membentuk ion
enolat.
B. Saran
Perlu dilakukan penelitian lebih lanjut mengenai pengaruh suhu dan waktu
reaksi dalam Reaksi kondensasiKnoevenagel.
DAFTAR PUSTAKA
Anonim, 1995, Farmakope Indonesia, Edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2001, Merck Index 13th ed: An Encyclopedia of Chemicals, drugs and biological. Merck & Co.,Inc., USA
Anwar, C., Purwono, B., Pranowo, H.D., Wayuningsih, T.D., 1994, Pengantar Praktikum Kimia Organik, 335, 341-342. Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Gajah Mada., Yogyakarta.
Bob Andreas D.P., 2008, Sintesis Asam 4-Hidroksisinamat dengan Variasi Perbandingan Mol Starting Material 4-Hidroksibenzaldehida dan Asam Malonat dengan Katalis Amonia, Fakultas Farmasi Universitas Sanata Dharma., Yogyakarta.
Brandstatter, M.K., 1971,Thermomicroscopy’s Analysis of Pharmaceutical, 1-10, Pergamon Press., London.
Bresnick, S.M.D, 1996, Intisari Kimia Organik, 96-97, 101-107 Penerbit Hipokrates., Jakarta
Brown, W. and Poon, T., 2005. Introduction to Organic Chemistry 3thedition. 419-421 Willey and Sons, Inc., USA.
Bruice. P.Y., 1998. Organic Chemistry, Second Edition, 953, Prentice-Hall, Inc.,USA
Budiati, T.; Ekowati J; Suzana; GN. Astika; Siswono H;Wibowo H; Syahrani A; Purwono H; Rudyanto M., 2003. Sintesis Turunan Sinamat sebagai Tirosinase Inhibitor, Project Grant Th. ke III, FFUA.,Surabaya.
Carey, F.A and Sunberg, R.J., 1977,Advanced Organic Chemistry:Reaction and Synthesis, 42, 44, Plenum Publishing Corporation., New York
Christian, G.D., 2004, Analytical Chemistry,168-185, Jhon Wiley and Sons, Inc., N.J., USA
42 Ekowati, J. dan Suzana, B.T., 2005, Pengaruh Posisi Gugus Metoksi para dan meta Terhadap Hasil Sintesis Asam para-metoksisinamat dan Asam meta-metoksisinamat, Majalah Farmasi AirlanggaVol.5 No.3
Fessenden, R.J. and Fessenden, J., 1986,Kimia Organik, terj. Pudjaatmaka, A.H., Edisi III, Jilid 2, 184, Penerbit Erlangga., Jakarta
Gritter, R.J., Bobbit, J.M., Schwarting, A.E., 1991, Pengantar Kromatografi, terj. Padmawinata, K., Edisi II, Penerbit Institut Teknologi Bandung., Bandung.
Ha TJ, Yang MS, Jang DS, Choi SU, Park KH., 2001. Inhibitory Activities of Flavanone Derivatives Isolated from Sophora flavescens for melanogenesis, Bull. Korean Chem. Soc. 1: 97-99.
Jenkins, G.L., Knevel, A.M., Digangi, F.E., 1965, Quantitative Pharmaceutical Chemistry, Sixth Edition, McGraw-Hill Book Company, New York. Khophar.S.M., 1990, Konsep Dasar Kimia Analitik, terj. Saptorahardjo, A,
Penerbit Universitas Indonesia, Jakarta.
Kubo I, Kinst-Hori, Yokohama Y., 1994.Tyrosinase Inhibitor form Anacardium Occidentale Fruits, J. Nat.Prod., 57: 545-551.
Lee HS, 2002. TyrosinaseInhibitors of Pulsatilla cernua root-derived mater,
J.Agric. Food Chem50: 1400-3.
Lee SE; Kim MK; Lee SG; Ahn YJ; Lee HS, 2000.Inhibitory effects of
Cinnamomum Casia Barkderivedmaterials on Mushroom Tyrosinase, Food Sci. Biotechnol5:330-303.
Lukyvano, E. 2009. Sintesis Asam Sinamat dari Benzaldehid dan Asam Malonat Menggunakan Katalis Dietilamin, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
MacKenzie, 1967, Experimental Organic Chemistry, 3rd ed., Prentice-hall Inc., Engelwood Cliffs, New Jersey.
McMurry, J., 2004, Fundamentals of Organic Chemistry, 6th ed., 317-318, 325-326, Thomson Learning, Inc., USA.
48