III. METODE PENELITIAN
A. Lokasi, Waktu, dan Materi Penelitian 1. Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler, Balai Besar Penelitian Bioteknologi dan Pemuliaan Tanaman Hutan (BBPBPTH), Purwobinangun, Pakem, Sleman, Yogyakarta. Penelitian dilaksanakan selama 3 bulan dari bulan April hingga Juni 2013.
Sampel berupa daun Jabon Putih N. cadamba berasal dari kebun koleksi yang di tanam di Magelang, sedangkan Jabon Merah N.
macrophyllus berasal dari kebun koleksi di persemaian (BBPBPTH). Aksesi
jabon yang digunakan dalam penelitian ini adalah 9 sampel Jabon Putih dan 20 sampel Jabon Merah. Koleksi materi Jabon Putih berasal dari Sumatera Selatan sementara sampel Jabon Merah berasal dari Sulawesi Utara.
2. Materi 2.1. Alat
Alat yang digunakan adalah sebagai berikut : timbangan analitik, mikrotube 1,5 dan 2 ml, bedbeader, small rotator, sentrifugator 1500 rpm (rotasi per menit), mikropipet 0,5 µl, 2 µl, 10 µl , 20 µl, 100 µl, 1000 µl, dan 5 ml, pipet tip sekali pakai, aspirator, microwave, desikator, lemari pendingin, vortex, sendok kimia, gunting, gel tray, bak elektroforesis, well plate 96 thermocycler, BIO-RAD Gel DocTM EQ), jas lab serta sarung tangan dan masker.
2.2. Bahan
Bahan yang digunakan adalah sampel daun Jabon Putih dan Jabon Merah, buffer (1M Tris pH 9,0 ; 05M NaCl), Agarose, 0,5M EDTA (Ethidium Tetraasetat), 10% CTAB (Cationic Hexadecyl Trimethyl
Ammonium Bromide), β-mercaptoetanol, Aquades, Chlorofrm, NaOAc (Natrium Acetat), Isopropanol, Etanol 70% dan 100% New Wash, larutan NaI (Natrium iodide), silica, ddH2O, 10x Stoffel Buffer, dNTP
dan primer yang diproduksi oleh Operon Technologies (Vivantis).
B. Bagan Alir Penelitian
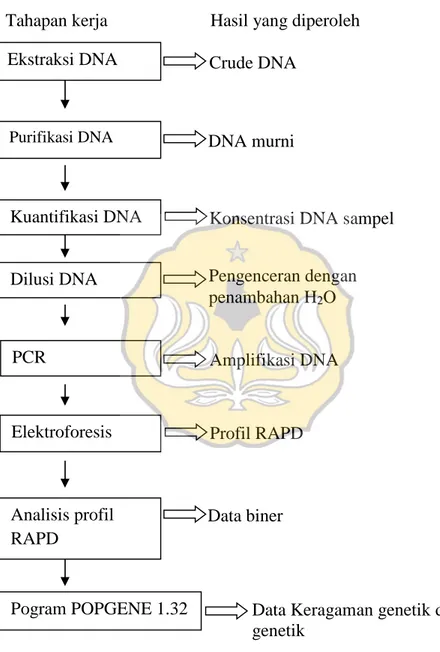
Tahapan kerja yang dilakukan dalam penelitian ini meliputi ekstraksi DNA, purifikasi DNA, kuantifikasi DNA, amplifikasi DNA melalui PCR-RAPD, elektrophoresis, dan analisis hasil PCR. Ekstraksi DNA dilakukan berdasarkan metode CTAB menurut Doyle and Doyle (1990) yang kemudian dimodifikasi oleh Shiraishi and Watanabe (1995). Ekstraksi menhasilkan DNA Crude yang kemudian dipurifikasi untuk mendapatkan DNA yang murni. Selanjutnya dilakukan kuantifikasi untuk menghitung konsentrasi DNA sehingga dapat disiapkan DNA template sebanyak 10 ng/µl. Amplifikasi DNA dilakukan menggunakan primer RAPD, dan hasilnya kemudian dianalisis. Diagram tahapan kerja dapat dilihat pada Gambar 3.1.
Tahapan kerja Hasil yang diperoleh
Gambar 3.1. Diagram tahapan kerja
C. Cara Kerja 1. Ekstraksi DNA
Metode ekstraksi yang dilakukan adalah metode CTAB. Ekstraksi ini bertujuan untuk mendapatkan total DNA dari sampel daun yang diuji. DNA yang diperoleh disebut crude DNA, yaitu DNA yang masih tercampur dengan RNA dan senyawa kontaminan seperti metabolit sekunder. Adanya metabolit sekunder dalam tanaman ditandai dengan kekentalan pada hasil isolasi DNA. Hal ini menyebabkan kesulitan dalam Ekstraksi DNA Crude DNA
Purifikasi DNA DNA murni
Kuantifikasi DNA Konsentrasi DNA sampel
Dilusi DNA Pengenceran dengan penambahan H2O
PCR
Elektroforesis Profil RAPD
Analisis profil RAPD
Data biner
Amplifikasi DNA
Pogram POPGENE 1.32 Data Keragaman genetik dan jarak genetik
metabolit sekunder yang banyak ditemukan pada tanaman adalah senyawa fenol. Pemberian β-mercaptoetanol dalam proses ekstraksi DNA dapat mencegah proses oksidasi senyawa fenolik yang menghambat aktifitas radikal bebas yang dihasilkan oleh oksidasi fenol terhadap asam nukleat. Prosedur ekstraksi menggunakan metode CTAB :
a. Sampel daun jabon ditimbang seberat 100 mg, kemudian dipotong kecil-kecil, setelah itu dimasukkan ke dalam mikrotube 2 ml, kemudian tambahkan larutan buffer CTAB sebanyak 1,5 ml (Tabel 3.1.). Sampel dihaluskan dengan menggunakan mini beadbeater selama 5 menit atau kira-kira sampel halus dan homogen dengan larutan buffer.
Tabel 3.1. Buffer metode CTAB (1,5 ml untuk 1 sampel)
No. Bahan kimia 1 x reaksi (µl)
1. Dd H2O 570 2. 1 M Tris, pH 9.0 150 3. 5 M NaCl 420 4. 0,5 M EDTA 60 5. 10% CTAB 300 6. Β-mercaptoetanol 7,5
b. Sampel diinkubasi pada suhu 650C selama 60 menit, kemudian larutan dipisahkan sebanyak 1 ml dari ampas daun dipindahkan ke mikrotube baru, setelah itu ditambahkan chloroform sebanyak 800 µl dan diputar menggunakan rotator selama 20 menit. Kemudian larutan disentrifugasi pada 12,000 rpm (rotasi per menit) selama 10 menit. Cairan terbagi menjadi 2 bagian, yaitu larutan bagian bawah berupa chloroform dan bagian atas berupa supernatan yang mengandung DNA tanaman, bagian atas diambil sebanyak 700 µl dan dipindahkan ke mikrotube baru. Setelah itu, ditambahkan 700 µl chloroform kedalam larutan, kemudian supernatan diputar kembali selama 20 menit sampai homogen dan disentrifugasi pada 15,000 rpm selama 10 menit.
c. Supernatan diambil sebanyak 600 µl dan dipindahkan ke mikrotube baru, ditambahkan 25 µl NaOAc (Natrium Asetat) dan 650 µl isopropanol. Selanjutnya larutan dibolak-balik untuk mendapatkan DNA.
d. Larutan diinkubasi pada suhu ruang selama 10 menit. Lalu disentrifugasi pada 15,000 rpm selama 30 detik. Setelah itu supernatan dibuang dengan aspirator, lalu ditambahkan etanol 70 % (dingin) sebanyak 1 ml untuk mencuci pellet dan dinding tabung. Larutan disentrifugasi kembali pada 15,000 rpm selama 5 menit, kemudian supernatan kembali dibuang dengan aspirator, langkah diatas diulang dengan menggunakan etanol 100 % (dingin) sebanyak 1 ml.
e. Supernatan dibuang dengan aspirator, kemudian pellet DNA dikeringkan dengan vacum centrifuge MILLI-DRY selama 10 menit, setelah itu pellet DNA dilarutkan dengan 200 µl dd H2O. sampel DNA disimpan dalam refrigerator pada suhu 40C. pada tahap ini diperoleh sampel DNA (crude DNA) yang belum bersih, sehingga perlu dilakukan proses purifikasi (pemurnian) untuk mendapatan DNA murni.
2. Purifikasi DNA
DNA hasil ekstraksi dipurifikasi untuk meminimalkan senyawa-senyawa kontaminan yang dapat mengganggu reaksi PCR. Adanya kandungan metabolit sekunder seperti fenol dapat menurunkan kemurnian DNA dan menghambat menempelnya primer pada saat PCR.
Tahapan purifikasi menggunakan Gene Clean III Kit (Q-bio) :
1. Crude DNA (DNA kasar) sebanyak 50 µl dimasukkan ke dalam mikrotube 1,5 ml, kemudian ditambahkan NaI sebanyak 50 µl (3 x volume larutan DNA), setelah itu ditambahkan 5 µl silica ( silica di vortex sebelum digunakan), kemudian mikrotube diletakkan pada suhu ruangan selama 5 menit dan dihomogenkan setiap 1 menit (diusahakan tidak terbentuk endapan), setelah itu disentrifugasi pada 10,000 rpm selama 30 detik, dan supernatan dibuang menggunakan aspirator, sehingga menyisakan pellet DNA, kemudian pellet dicuci dengan 375 µl New Wash, disentrifugasi pada 13,000 rpm selama 30 detik, lalu supernatan dibuang.
2. Langkah diatas diulang sebanyak 3 kali; disentrifugasi pada 14,000 rpm dan supernatan dibuang ; disentrifugasi pada 15,000 rpm supernatan dibuang. Selanjutnya, pellet DNA dikeringkan dengan vacum MILLY-DRY selama 10 menit, kemudian ditambahkan 65 µl H2O dan divortex, setelah itu
sebenyak 57 µl dan dipindahkan ke mikrotube yang baru, setelah itu konsentrasi DNA dihitung menggun Nano Vuo.
3. Kuantifikasi DNA
Kuantifikasi DNA merupakan prosedur untuk mengetahui konsentrasi dan kualitas DNA setelah proses ekstraksi. Kuantifikasi menggunakan alat
Nano Vuo (Heathcare Bio Science AB). Prinsip kerja Nano Vuo ini adalah
menghitung rasio dan konsentrasi DNA pada penyerapan/absorbansi beberapa macam gelombang cahaya (230 nm, 260nm, 280 nm, dan 320 nm). DNA dinyatakan murni jika memiliki nilai rasio À260/À280 berkisar antara 1,8–2,0 (Muladno, 2002). Menurut Devereux dan Wilkinson (2004) rasio À260/À280 < 1,8 menunjukkan adanya kontaminasi fenol atau protein pada hasil ekstraksi. Khosravinia et al. (2007) juga menjelaskan bahwa DNA dikatakan terkontaminasi RNA jika memiliki rasio À260/À280 > 2,0.
4. Dilusi DNA
Dilusi merupakan pengenceran DNA untuk memudahkan penggunaan konsentrasi larutan DNA sesuai dengan kebutuhan. Penghitungan dilusi menggunakan rumus :
V1xM1= V2xM2... (3.1) Keterangan:
V1: Volume akhir hasil purifikasi (µl)
M1: Konsentrasi DNA hasil kuantifikasi (ng/µl)
V2: Volume akhir pengenceran (µl)
M2: Konsentrasi DNA yang dibutuhkan (ng/µl).
5. Amplifikasi PCR-RAPD 5.1. Pembuatan PCR mix
a. Disiapkan 96 well reaction plate.
b. Dimasukkan larutan DNA sebanyak 4 µl, kemudian disiapkan PCR mix dengan mencampurkan ddH2O, 10x Stoffel Buffer, MgCl2, dNTP (dATP, dGTP, dCTP, dan dTTP), dan Ampli Taq polymerase kedalam mikrotube sesuai dengan kebutuhan. Kebutuhan senyawa kimia untuk reaksi PCR dihitung dan disesuaikan dengan jumlah sampel. Galat
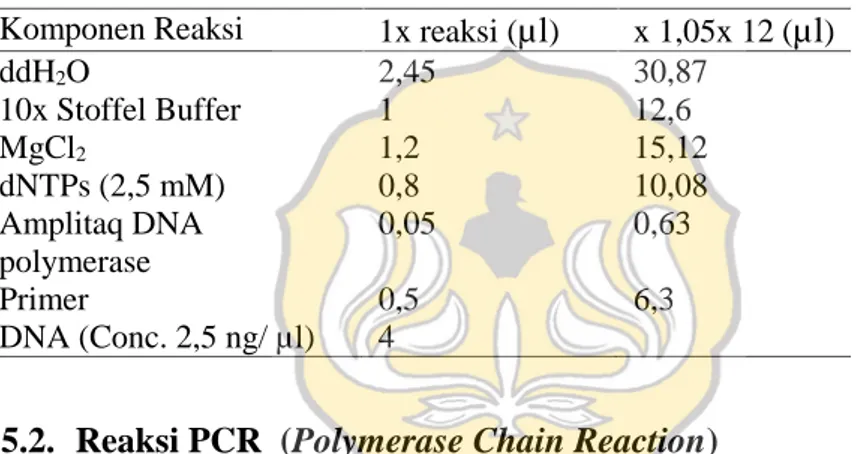
untuk kesalahan pipet ditera sebesar 1,05. Volume standar yang digunakan untuk satu reaksi adalah 10 µl, sehingga untuk 12 reaksi misalnya, kebutuhan PCR mix dapat dilihat pada Tabel 3.1.
c. Sebanyak 6 µl dimasukkan kedalam plate PCR mix. reaksi plate ditutup, selanjutnya divortex.
d. Langkah terakhir plate dimasukkan ke dalam mesin PCR. Tabel 3.2. Volume senyawa untuk running PCR.
Komponen Reaksi 1x reaksi (µl) x 1,05x 12 (µl)
ddH2O 2,45 30,87 10x Stoffel Buffer 1 12,6 MgCl2 1,2 15,12 dNTPs (2,5 mM) 0,8 10,08 Amplitaq DNA polymerase 0,05 0,63 Primer 0,5 6,3 DNA (Conc. 2,5 ng/ µl) 4
5.2. Reaksi PCR (Polymerase Chain Reaction)
Amplifikasi PCR dilakukan menggunakan Applied Gene Amp PCR
system 9700 dengan tahapan pre-heating selama 3 detik pada suhu 940C, lalu inkubasi selama 60 detik pada suhu 950C, kemudian diikuti dengan 45 siklus denaturasi selama 30 detik pada suhu 940C, annealing selama 30 detik pada suhu370C, dan extension selama 90 detik pada suhu 720C.
Final extension dilakukan selama 5 menit pada suhu 720C, dan storage pada suhu 40C. Primer yang digunakan pada tahap seleksi berjumlah 16 buah (Tabel 3.2.). Keenambelas primer yang digunakan dalam penelitian ini ditentukan berdasarkan informasi dari penelitian pada Kopi Robusta yang termasuk family Rubiaceae (Lashermes et al. 1993 dan Tshilenge et al. 2009).
Tabel 3.3. Daftar primer yang digunakan dalam skrining primer untuk analisis RAPD
No Primer Sekuens No Primer Sekuens
(5’-3’) (5’-3’)
1. OPA 1 CAGGCCCTTC 9. OPA 14 TCTGTGCTGG
2. OPA 3 AGTCAGCCAC 10 OPA 16 AGCCAGCGAA
3. OPA 4 AATCGGGCTG 11. OPA 17 GACCGCTTGT
4. OPA 5 AGGGGTCTTG 12. OPA 19 CAAACGTCGG
5. OPA 7 GAAACGGGTG 13. OPA 20 GTTGCGATCC
6. OPA 11 CAATCGCCGT 14. OPQ 14 GGACGCTTCA
(5’-3’) (5’-3’)
7. OPA 12 TCGGCGATAG 15. OPQ 15 GGGTAACGTG
8. OPA 13 CAGCACCCAC 16. OPQ16 AGTGCAGCCA
4.3.Elektrophoresis
Elektroforesis bertujuan memisahkan fragmen-fragmen DNA hasil amplifikasi PCR. Keberadaan fragmen DNA atau lokus gen terlihat berupa pita setelah pewarnaan gel dan dilihat dibawah pendaran sinar UV (BIO-RADGel DocTMEQ). Tahapan proses elektroforesis adalah sebagai berikut :
4.3.1. Pembuatan Gel Agarose
Gel agarose digunakan sebagai media elektroforesis. Pembuatan
gel agarosa 1,2% adalah sebagai berikut :
a. Agarose sebanyak 0,96 gram dilarutkan ke dalam 4 ml 20x TBE (Tris-Borac EDTA) dan ditambahkan 76 ml dd H2O, kemudian campuran dipanaskan dalam microwave.
b. Larutan diletakkan pada suhu ruang dan dibiarkan menjadi hangat, lalu ditambahkan 5 µl Ethidium Bromide (Et Br) sebagai pewarna, kemudian larutan dituangkan ke dalam cetakan dengan ketebalan 3-5 mm, agarose siap digunakan setelah 1 jam.
4.3.2. Proses elektroforesis
Tahapan proses elektroforesis adalah sebagai berikut :
a. Sampel DNA hasil PCR dicampur dengan 2 µl Gel loading (GL3) yang berfungsi sebagai pewarna atau penanda laju DNA dan pemberat saat elektroforesis berlangsung.
b. DNA dimasukkan ke dalam sumuran yang terdapat dalam gel. c. Pada ujung kiri dan kanan sampel dimasukkan 2,5 µl DNA ladder. d. Gel dielektroforesis pada tegangan 120 volt selama ± 3 jam. 4.3.3. Visualisasi
Visualisasi pita hasil amplifikasi pada gel dilakukan menggun BIO-RAD Gel DocTM EQ dengan menggunakan sinar UV. Gambar dapat dilihat pada layar computer untuk kemudian disimpan dan dicetak.
D. Analisis Data
Pita-pita hasil amplifikasi DNA diubah menjadi data biner berupa nilai, yaitu 1 apabila muncul pita dan 0 apabila tidak muncul pita. Ukuran molekul fragmen DNA ditentukan dengan DNA ladder 100 bp. Data dianalisis menggunakan program POPGENE 1. 32 (Yeh et al. 1999) dan program Gen AlEx
v6. POPGENE 1. 32 menghitung nilai keragaman genetik (genetic diversity) dan
jarak genetik (genetic distances) berdasarkan Nei’s Gene Diversity (1972) dan
Nei’s Original Measures of Genetic Distance (1992) dengan memanfaatkan
perbedaan frekuensi alel (frekuensi pita amplifikasi). Gen AlEx v6 untuk menghitung Alel spesifik menggunakan frekuensi alel (AFP dan APT).