BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian telah dilakukan mulai bulan Juni 2008 sampai Januari 2009. Pengambilan sampel DOC dilakukan di gudang keberangkatan domestik dan kedatangan international Bandara Soekarno Hatta dan di Instalasi DOC Balai Besar Karantina Pertanian Soekarno Hatta (BBKPSH). Preparasi sampel dilakukan di Laboratorium BBKPSH dan Balai Besar Uji Standar Karantina Pertanian (BBUSKP). Pengujian laboratorium dilakukan di Laboratorium Virologi dan Biologimolekuler Karantina Hewan BBUSKP dan Unit Pelayanan Terpadu Bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB).
Rancangan Percobaan
Pengambilan sampel mengunakan rumus Detect Diseases dengan prevalensi dugaan 0.9% lebih besar dari prevalensi sampel DOC positif PCR AI yang diuji di BBUSKP pada tahun 2007 sebesar 0.27%. Diasumsikan dengan prevalensi dugaan lebih tinggi dan dengan metode sampling terencana akan mendapatkan jumlah sampel positif lebih banyak dari sampel-sampel yang dikirim ke laboratorium BBUSKP.
Thrusfield (2005) menyebutkan rumus untuk mendetekai penyakit: n = [1-(1-p)1/d] [N-d/2]+1]
N = jumlah populasi DOC n = jumlah DOC
d = jumlah DOC yang sakit dalam populasi (didapat dari prevalensi x jumlah populasi DOC)
p = tingkat konfidensi.
Populasi DOC yang di lalulintaskan melalui Bandara Soekarno Hatta pada tahun 2007 berjumlah 13.538.555 ekor, prevalensi 0.9%, dengan menggunakan rumus di atas, besaran sampel berjumlah 332 ekor. Sampling yang digunakan adalah sampling acak (conveniance) setiap produsen (shipment) DOC pada hari sampling diambil masing-masing 6 ekor. Jika sampel yang dibutuhkan minimal
332 ekor DOC maka sampling yang dilakukan sebanyak 56 shipment dalam 4 bulan pertama penelitian. Sampel DOC yang masih hidup diambil darahnya intrakardial untuk mendapatkan serum dan selanjutnya DOC dimatikan. Kadaver DOC dilakukan bedah bangkai dan diambil organ trakhea dan paru-paru (pooling) mengikuti standar WHO (2002). Pooling organ masing-masing sebanyak 6 sampel organ DOC tiap-tiap shipment. Organ kuning telur dikumpulkan secara individu.
Pengujian RT-PCR dilakukan setelah kegiatan pengambilan sampel selesai. Pengujian tersebut dilakukan pada campuran organ paru-paru dan trakhea untuk setiap pooling sampel menggunakan primer matrik: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001). Sampel positif matrik dilanjutkan pengujian dengan primer H5: F-H5-AI; R-H5-AI (Lee et al. 2001). Beberapa data pendukung antara lain: asal daerah/negara, tujuan dan tanggal menetas. Uji statistik yang digunakan adalah korelasi titer antibodi dengan keberadaan virus AI, proporsi sampel positif virus AI dan deskriptif statistik.
Percobaan lanjutan untuk menelusuri virus AI dilakukan pada kuning telur DOC. Pada sampel dengan hasil negatif AI pada paru-paru dan trakhea dengan primer matrik: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001), dilakukan menggunakan 3 macam primer matrik: F-Matrik AI; R-Matrik-AI (Lee et al. 2001), M-Flu 1; M-Flu 2 (Trani et al. 2006), FAI; RAI (Lee & Suarez 2004) dan 2 macam primer H5: HA1144; H5-1735 (WHO 2002) dan FH5; RH5 (Lee & Suarez 2004) untuk meyakinkan bahwa sampel yang diuji benar-benar negatif. Penelusuran keberadaan virus AI pada sampel positif AI pada paru-paru dan trakhea dengan primer matrik: F-Matrik-AI; R-Matrik-AI (Lee et al. 2001), menggunakan pasangan primer matrik: FAI; RAI dan primer H5: FH5; RH5 (Lee & Suarez 2004). Sampel-sampel yang menunjukkan hasil dubius, positif lemah dan positif dilakukan isolasi virus pada TAB-SPF.
Uji Serologi Antibodi terhadap Antigen H5 Pembuatan RBC 1%
Darah ayam diambil dari ayam sehat specific pathogen free (SPF) atau specific antibodi negative (SAN) dan dicampurkan dengan antikoagulan alsevers
dengan perbandingan 1:1. Suspensi darah dicuci dengan PBS 0.01 M pH 7.0-7.2 dengan cara menambahkan PBS ke dalam suspensi RBC tersebut secukupnya sampai tabung sentrifus hampir terisi penuh, kemudian dihomogenkan. Selanjutnya disentrifugasi selama 5-10 menit dengan kecepatan 1500 g. Supernatan PBS dibuang dan juga lapisan leukositnya (lapisan berwarna kelabu yang terletak di atas permukaan RBC) dengan jalan menghisapnya dengan Pipet Pasteur. Pencucian RBC dengan PBS dilakukan sebanyak 4 kali sampai RBC benar-benar bersih, leukositnya habis terbuang dan PBS pencuci tidak berwarna merah (bening). Endapan RBC tersebut dibuat suspensi RBC 10%, yaitu dengan menambah PBS 9 kali banyaknya endapan RBC. Suspensi RBC 10% dibuat RBC 1 % dengan mengambil 1 bagian RBC 10% dan ditambahkan 9 bagian PBS. Haemaglutination (HA) Test
Uji yang digunakan adalah Haemaglutination Test (HA) atau uji haemaglutinasi, menggunakan Ag AI 4 haemaglutination unit (HAU) Isolat Balitvet tahun 2005 mengikuti metode standar Office International des Epizooties (OIE 2005). Uji HA berdasarkan kemampuan virus AI untuk mengaglutinasi sel darah merah ayam. Uji HA direkomendasikan menggunakan microplate dasar V dengan volume akhir 100 μl. Reagen yang diperlukan antara lain larutan PBS isotonik 0.01 M, pH 7.0-7.2, Antigen AI (H5N1), red blood cell (RBC) 1 % dengan antikoagulan alsevers.
Larutan PBS dimasukkan ke dalam sumur-seumur microplate sebanyak 25
μl, ditambahkan 25 μl suspensi antigen ke dalam sumur pertama microplate dan dilakukan pengenceran seri sampai sumur ke-11. Larutan PBS di tambahkan 25
μl pada setiap sumur, kemudian ditambahkan 25 μl RBC 1% ke dalam setiap sumur. Komponen-komponen tersebut dicampur pada microplate dan inkubasi selama 30 menit pada suhu kamar. Hasil penilaian jika pada kontrol (sumur 12) sudah terjadi endapan sel darah merah. Jika terjadi haemaglutinasi menunjukkan ada antigen virus. Titer antigen dapat ditentukan pada pengenceran tertinggi dari antigen yang masih mampu mengaglutinasi sel darah merah ayam (RBC 1 %).
Pembuatan Suspensi Virus Standar
Cara membuat suspensi virus standar 4 HAU dalam 25 μl: misal aglutinasi terakhir hasil uji HA terjadi pada sumur ke 5 atau pada pengenceran 25 = 32 berarti terdapat 32 HA Unit / 25 μl. Jika akan mendapatkan virus dengan jumlah 4 HAU / 25 μl, maka perhitungannya adalah 25-22 = 23= 8. Jadi virus stok diencerkan 1 bagian virus ditambah 7 bagian larutan PBS.
Haemaglutination Inhibition (HI) Test
Uji HI atau penghambatan haemaglutinasi, merupakan salah satu uji serologis berdasarkan atas hambatan serum terhadap haemaglutinasi antigen virus AI, titer serum ditentukan berdasarkan atas hambatan serum pada pengenceran tertinggi masih mampu menghambat antigen (4 HAU) mengaglutinasi sel darah merah. Kontrol positif antigen dan antisera harus disertakan dalam setiap pengujian.
Larutan PBS dimasukkan ke dalam sumur-seumur microplate sebanyak 25
μl, ditambahkan 25 μl serum sampel ke dalam sumur pertama microplate dan dilakukan pengenceran seri sampai sumur ke-11. Antigen AI 4 HAU ditambahkan pada setiap sumur, kecuali pada sumur ke 12, kemudian dicampur. Plate diinkubasikan pada suhu kamar selama 30 menit atau 40 menit pada suhu 20oC, kemudian ditambahkan 25 μl RBC 1% ke dalam setiap sumur. Komponen-komponen tersebut dicampur pada cawan mikro (microplate) dan inkubasi selama 30 menit pada suhu kamar.Hasil penilaian jika telah terjadi endapan pada sumur kontrol maka dimulai pembacaan serum. Serum yang positif mengandung antibodi AI (H5N1) ditandai endapan seperti sumur kontrol (bentuk air mata jauh/tear shaped streaming). Titer serum ditentukan dari pengenceran serum tertinggi yang masih mampu penghambat antigen 4 HAU untuk mengaglutinasi sel darah merah ayam.
Identifikasi Virus Avian Influenza
Identifikasi virus AI menggunakan metode Reverse Transcriptase Polymerase Chain Reaction (RT-PCR), dengan beberapa tahapan sebagai berikut:
Preparasi Sampel
Pada penelitian dilakukan pengumpulan (pooling) organ paru-paru dan trakhea (terdiri dari 6 sampel) di homogenisasi dengan Homogenizer (Silent Cruizer) 10.000 g selama 2 menit, disentrifugasi 3000 g selama 5 menit dan diambil supernatannya. Kuning telur dilarutkan dalam PBS pH 7.2-7.4 (1:1), dihomogenisasi dengan kloroform (1:2), diinkubasi 30 menit, disentrifugasi 3000 g selama 15 menit dan diambil supernatannya.
Supernatan tersebut dilakukan ekstraksi dengan TRIzol-LS (Invitrogen Cat No. 10296-010).
Isolasi RNA Virus
Isolasi RNA virus menggunakan TRIzol-LS (Invitrogen). Larutan ekstrak organ/supernatan, usapan kloaka sebanyak 250 µl dimasukkan dalam tabung microtube 1,5 ml, kemudian ditambahkan TRIzol-LS sebanyak 750 µl, divortex selama 15 detik, diinkubasi selama 5 menit pada temperatur dingin (ice pack). Sebanyak 200 µl kloroform ditambahkan, divortex selama 15 detik. Inkubasi selama 10-15 menit dalam ice pack. Sampel dilakukan sentrifugasi dengan microcentrifuge 2-8oC selama 15 menit dengan kecepatan 12.000 g. Cairan bening di atas dipindahkan ke tabung microtube baru sebanyak 400-500 µl dengan hati-hati sehingga cairan pada batas ataupun bawah (berwarna merah) tidak ikut terambil. Larutan isopropanol / isoprophil alkohol ditambahkan sebanyak 500 µl, divortex selama 15 detik dan diinkubasi selama 10-15 menit. Sampel disentrifugasi kembali dengan microcentrifuge dengan kecepatan 12.000 g pada temperatur 2-8oC selama 20 menit. Seluruh cairan dibuang (pada sisi bawah tabung mungkin akan tampak pelet putih RNA), diusahakan sampai pelet tersebut tidak ikut terbuang. Larutan ethanol-DEPCdH2O 75% dingin ditambahkan sebanyak 1000 µl, kemudian disentrifugasi dengan microcentrifuge dengan kecepatan 12.000 g pada temperatur 2-8oC selama 20 menit. Semua ethanol-DEPCdH2O 75% diaspirasi dengan hati-hati. Pellet yang terbentuk dikeringkan dengan membiarkan di temperatur ruang selama 10-15 menit. Setelah semua sisa cairan dalam tabung kering, pelet RNA yang terbentuk disuspensikan kembali
dengan 20 µl RNAse free water. Suspensi RNA dapat langsung digunakan atau dapat disimpan pada temperatur -20oC.
Runing pada Thermal Cycle
Reverse transcription (RT) adalah pembuatan cDNA yang bersifat komplementer dengan RNA virus, menggunakan enzim reverse transcriptase-polymerase chains reaction (RT-PCR) merupakan metode alternatif untuk mengidentifikasi virus AI, meskipun material genetik virus hanya terdapat dalam jumlah sedikit (WHO 2002). Reverse transcriptase-polymerase chains reaction (RT- PCR) menggunakan Superscript TM One-Step RT-PCR with Platinum ® Taq (Invitrogen Cat. No. 10928-034) dengan total reaksi 25 µl yang mengandung 12.5 µl 2x Reaction Mix, 3 µl RNA, 0.5 µl RT/Platinum® Taq Mix, 0.5 µl (0.2 µM) primer forward, 0.5 µl (0.2 µM) primer reverse dan 8 ddH2O. Formulasi reaksi RT-PCR ini berlaku untuk semua jenis primer.
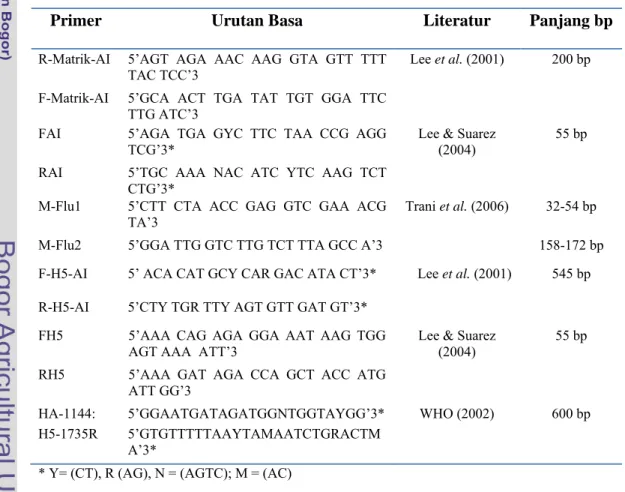
Tabel 1. Primer yang digunakan dalam pengujian RT-PCR
Primer Urutan Basa Literatur Panjang bp
R-Matrik-AI 5’AGT AGA AAC AAG GTA GTT TTT
TAC TCC’3 Lee et al. (2001) 200 bp F-Matrik-AI 5’GCA ACT TGA TAT TGT GGA TTC
TTG ATC’3
FAI 5’AGA TGA GYC TTC TAA CCG AGG
TCG’3* Lee & Suarez (2004) 55 bp RAI 5’TGC AAA NAC ATC YTC AAG TCT
CTG’3*
M-Flu1 5’CTT CTA ACC GAG GTC GAA ACG
TA’3 Trani et al. (2006) 32-54 bp M-Flu2 5’GGA TTG GTC TTG TCT TTA GCC A’3 158-172 bp F-H5-AI 5’ ACA CAT GCY CAR GAC ATA CT’3* Lee et al. (2001)
545 bp
R-H5-AI 5’CTY TGR TTY AGT GTT GAT GT’3* FH5 5’AAA CAG AGA GGA AAT AAG TGG
AGT AAA ATT’3 Lee & Suarez (2004) 55 bp RH5 5’AAA GAT AGA CCA GCT ACC ATG
ATT GG’3
HA-1144: 5’GGAATGATAGATGGNTGGTAYGG’3* WHO (2002) 600 bp H5-1735R 5’GTGTTTTTAAYTAMAATCTGRACTM
A’3*
Program RT-PCR untuk setiap primer sebagai berikut:
1. Primer Lee et al. (2001): 60oC --- 30 menit dan 95oC ---- 2 menit (pre-denaturasi) sebanyak satu siklus; PCR amplifikasi pada suhu 95oC selama 40 detik (denaturasi), suhu 50oC selama 40 detik (annealing) dan suhu 72oC selama 1 menit (extension) diulang sampai 35 siklus dan 72oC selama 4 menit (final extension) dan 15oC untuk rest, 1 siklus.
2. Primer Lee and Suarez (2004): 48oC --- 30 menit dan 95 derajat---10 menit (pre-denaturasi) masing masing 1 satu siklus; 95 derajat---15 detik (denaturasi); 60 derajat---1 menit (annealing) dan 72 derajat---1 menit (extension) diulang sampai 40 siklus; 72 derajat --- 4 menit (final extension) dan 15 derajat untuk rest, 1 siklus.
3. Primer Trani et al. (2006): 60oC---2 menit; 50oC --- 30 menit dan 94 derajat---4 menit (pre-denaturasi) masing-masing 1 siklus; 95 derajat---derajat---45 detik (denaturasi); 60 derajat---30 detik (annealing) dan 72 derajat---2 menit (extension) diulang sampai 35 siklus; 72 derajat --- 2 menit (final extension) dan 15 derajat untuk rest, 1 siklus.
4. Primer WHO (2002): 60oC---2 menit dan 50oC --- 30 menit (pre-denaturasi) masing masing 1 satu siklus; 94 45 detik (denaturasi); 56 derajat---45 detik (annealing) dan 72 derajat---2 menit (extension) diulang sampai 35 siklus; 72 derajat --- 10 menit (final extension) dan 15 derajat untuk rest, 1 siklus.
Proses amplifikasi menggunakan mesin Thermal Cycle Sprint Hybaid dan Gene Amp® PCR System 9700 Aplied Biosystem.
Elektroforesis Hasil RT-PCR pada Gel Agarose 1.5%
Produk PCR (DNA) hasil PCR yang diperoleh dianalisa dengan teknik elektroforesis menggunakan ultrapureTM
agarose (Invitrogen) 1.5%. Sebanyak 0.75 g agarose dilarutkan dengan 50 ml Tris Buffer EDTA (TBE) 1x, kemudian dipanaskan dengan microwave sampai larutan menjadi jernih. Larutan didinginkan pada suhu kamar sampai dingin (hangat-hangat kuku) kemudian dimasukkan 3 µl ethidium bromide (10 mg/ml; Promega) dicampur sampai homogen. Agarose kemudian dituang pada cetakan gel yang telah dipasang sisir dan dibiarkan sampai
membeku. Setelah membeku gel dimasukkan ke elektroforesis (Mupid-x Japan) atau elektroforesis (Owl Model OSP-300) yang telah diisi dengan larutan buffer TBE 1x sampai semua gel terendam. Sebanyak 6 µl produk PCR dicampur dengan 1 µl loading dye (Invitrogen) kemudian dimasukkan ke dalam sumur-sumur pada gel. Marker DNA digunakan 100 bp (Invitrogen, Fermentas) dan 50 bp (Invitrogen) disesuaikan dengan letak produk PCR dari masing-masing primer. Marker DNA dicampur dengan loading dye dan aquades dengan perbandingan marker DNA: loading dye : aquades (1:1:8). Setiap satu kali elektroforesis digunakan 1 sumur marker DNA sebanyak 5 µl. Running dilakukan pada 135 volt selama 35 menit (Mupid-x Japan) dan 100 volt, 400 mA selama 60 menit (Owl Model OSP-300). Keberadaan pita-pita DNA produk PCR diamati di atas UV transillumination (Vilber Lourmat, France). Hasil positif ditunjukkan adanya pita berwarna jingga pada gel agarose (dimodifikasi dari Payungporn et al. 2004). Isolasi Virus Avian Influenza
Sampel positif pada pengujian RT-PCR dengan primer matrik akan diinokulasikan pada ruang alantois Telur Ayam Berembrio (TAB) umur 10 hari dari ayam Specifik Pathogen Free (SPF) atau Specific Antibody Negative (SAN) selama 1-7 hari. Suspensi sampel ditambah antibiotik penisilin 4000 IU/ml dan streptomisin 4000 µl/ml, kemudian diinokulasikan ke ruang alantois TAB-SPF sebanyak 0.1 ml (OIE 2005). Setiap hari dilakukan pengecekan dengan candle light untuk mengetahui apakah embrio masih hidup atau sudah mati. Telur yang embrionya mati disimpan dalam refrigerator 4oC selama 4-24 jam dan selanjutnya dilakukan panen cairan alantois.