PROFIL MATURITAS RETIKULOSIT PADA ORANG
DEWASA NORMAL SERTA PEMBAWA SIFAT
THALASSEMIA-β ATAU HEMOGLOBIN E
TESIS
CUSSI LESTARI SILADJAJA 0906565955
FAKULTAS KEDOKTERAN
PROGRAM PENDIDIKAN DOKTER SPESIALIS PATOLOGI KLINIK JAKARTA
PROFIL MATURITAS RETIKULOSIT PADA ORANG
DEWASA NORMAL SERTA PEMBAWA SIFAT
THALASSEMIA-β ATAU HEMOGLOBIN E
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Dokter Spesialias Patologi Klinik
CUSSI LESTARI SILADJAJA 0906565955
FAKULTAS KEDOKTERAN
PROGRAM STUDI PENDIDIKAN DOKTER SPESIALIS PATOLOGI KLINIK JAKARTA
Puji Syukur saya panjatkan kepada Tuhan YME atas berkat dan karuniaNya, saya dapat menyelesaikan pendidikan di Departemen Patologi Klinik, Fakultas Kedokteran Universitas Indonesia. Penulisan tesis ini untuk memenuhi salah satu syarat mencapai gelar Spesialis Patologi Klinik.
Selama masa pendidikan dan selama masa penyusunan tesis ini saya didukung oleh berbagai pihak. Oleh karena itu, saya mengucapkan terima kasih setulus hati kepada:
a. dr. Alida R. Harahap, SpPK(K), PhD selaku guru dan pembimbing tesis saya, yang telah banyak mendorong dan membantu saya sehingga saya dapat menyelesaikan tugas akhir saya dengan baik.
b. Prof. dr. Riadi Wirawan, SpPK(K) selaku guru dan pembimbing tesis saya, yang telah banyak membantu saya sehingga saya dapat menyelesaikan tugas akhir saya dengan baik.
c. Dr. dr. Pustika Amalia Wahidiyat, SpA(K) selaku pembimbing tesis saya, yang telah banyak memberikan masukan untuk tugas akhir saya.
d. Prof. dra. Arini Setiawati, PhD, selaku pembimbing tesis saya, yang telah banyak memberikan masukan mengenai statistic untuk tugas akhir saya.
e. dr. Farida Oesman, SpPK(K), selaku guru dan penguji tesis saya, yang telah banyak memberikan saran dari segi akademis maupun non-akademis dalam penyelesaian tesis saya.
f. Dr. dr. Diana Aulia, SpPK(K), selaku guru dan penguji tesis saya, arahan dan saran Beliau membantu saya dalam menyelesaikan tesis saya.
g. dr. Ninik Sukartini, DMM, SpPK(K), selaku guru dan penguji tesis saya, yang telah memberikan masukan yang sangat berharga untuk tesis saya.
h. Prof. dr. Suzanna Immanuel, SpPK(K), selaku guru dan ketua program studi, dr. Yusra, SpPK, PhD selaku sekretaris program studi, yang banyak membantu saya selama belajar di Departemen Patologi Klinik FKUI/RSCM
i. Semua guru-guru saya: Prof. Dr. dr. Rustadi Sosrosumihardjo, DMM, MS, SpPK(K); Prof. dr. Marzuki Suryaatmadja, SpPK(K); Prof. dr. Rahajuningsih Dharma Setiabudy, SpPK(K), DSc, FACT; Dr. dr. Ina S. Timan, SpPK(K); dr. Dalima AW Astrawinata, SpPK(K), MEpid; dr. Tonny
Sri S. Adiyanti, SpPK.
j. Kedua orang tua saya, dr. Julianto Siladjaja dan Surjani Idris, kedua mertua saya Ng A Liem dan Tjhai Kin Fun yang telah mencintai saya dengan tulus dan selalu mendukung saya baik secara moril dan materil.
k. Suami saya tercinta Felixius Pranata, SE yang telah mendukung dan membantu saya dalam setiap keputusan dan tindakan saya.
l. Anak saya Hans Davis Pranata yang telah bersabar selama saya bersekolah.
m. Adik saya, Suwita Siladjaja, yang telah menyemangati saya.
n. dr. Lidya Utami, SpPK, yang telah membantu dan mendukung saya dalam mengumpulkan subjek penelitian hingga menyelesaikan tesis saya.
o. Teman-teman saya dr. Diana, dr. Tandry, dr. Wilya, dr. Irrine, dr. Glady, dr. Fina, dan semua teman-teman seperjuangan yang telah membantu saya secara langsung maupun tidak langsung saat pengerjaan tesis maupun saat belajar di Departement Patologi Klinik FKUI/RSCM.
p. Analis dan karyawan Departemen Patologi Klinik FKUI/RSCM.
q. Pasien dan hasil laboratorium yang menjadi bahan belajar saya selama ini. r. PT Sysmex Indonesia atas bantuan dan kerja samanya.
Akhir kata, saya berharap Tuhan YME membalas kebaikan semua pihak yang tulus membantu saya dalam mengerjakan tesis ini. Semoga tesis saya bermanfaat bagi pengembangan ilmu pengetahuan.
Jakarta, 24 Desember 2014 Penulis
sifat thalassemia-β atau hemoglobin E
Latar belakang: Retikulosit dapat dibedakan menjadi beberapa fraksi berdasarkan tingkat maturitasnya yaitu high fluorescence ratio (HFR), medium fluorescence ratio (MFR), low fluorescence ratio (LFR) yang diukur berdasarkan banyaknya kandungan RNA. Immature reticulocyte fraction (IRF) merupakan gabungan fraksi MFR dan HFR. Tingkat maturitas retikulosit dapat menjadi indikator klinis aktivitas eritropoiesis dan eritropoiesis inefektif. Eritropoiesis inefektif merupakan salah satu patofisiologi pada thalassemia dan HbE. Pada defisiensi besi, eritropoiesis menurun karena besi sebagai salah satu bahan baku pembentukan hemoglobin jumlahnya kurang sehingga jumlah retikulosit menurun
Tujuan: Mendapatkan gambaran retikulosit dan fraksinya pada orang Indonesia dewasa normal yang dapat digunakan sebagai nilai rujukan, serta pada pembawa sifat thalassemia-β atau hemoglobin E dengan dan tanpa defisiensi besi untuk menilai aktivitas eritropoiesis dan eritropoiesis inefektif
Metode: Desain penelitian adalah potong lintang, dengan menggunakan 249 subjek sehat dan 98 subjek keluarga pasien thalassemia yang berobat ke poliklinik thalassemia
Hasil:Nilai rujukan retikulosit dan fraksinya pada orang dewasa adalah hitung retikulosit relatif (HRR) lelaki dan perempuan 0,7 – 2,2%, hitung retikulosit absolut (HRA) lelaki
35.988 – 101.198 /μL dan HRA perempuan 26.400 – 105.000 /μL, IRF relatif lelaki dan perempuan 2,4 – 13,4%, IRF absolut lelaki 1.343 – 10.049 /μL dan perempuan 764 – 11.223 /μL, LFE relatif lelaki dan perempuan 86,6 – 97,4%, LFR absolut lelaki 32.444 – 97.573 /μL dan perempuan 25.634 – 92.063 /μL. HRR dan HRA subjek pembawa sifat thalassemia-β atau HbE dalam rentang nilai rujukan tetapi IRF lebih tinggi dari orang sehat. Pada pembawa sifat thalassemia-β atau HbE dengan defisiensi besi didapatkan HRR, HRA, dan IRF lebih rendahdaripada subjek tanpa defisiensi besi, tetapi lebih tinggi daripada orang sehat.
Kesimpulan: HRR dan HRA pembawa sifat thalassemia-β atau HbE dalam rentang nilai rujukan tetapi IRF lebih tinggi, menunjukkan terjadi eritropoiesis inefektif. HRR, HRA, dan IRF pembawa sifat thalassemia-β atau HbE dengan defisiensi besi lebih rendah daripada subjek tanpa defisiensi besi tetapi lebih tinggi daripada orang sehat, menunjukkan eritropoiesis inefektif juga terjadi pada subjek defisiensi besi walaupun aktivitas eritropoiesis lebih rendah daripada subjek tanpa defisiensi besi.
Study program : Clinical pathology
Title : Reticulocyte maturity in normal adults and β-thalassemiaor hemoglobin E carriers
Background: Based on the measurement of RNA content, flowcytometry provides reticulocyte maturation indices, which are low fluorescence ratio (LFR), medium fluorescence ratio (MFR), and high fluorescence ratio (HFR). Immature reticulocyte fraction (IRF) consists of MFR and HFR. Reticulocyte maturity can be used as a clinical indicator of erythropoietic activity. Ineffective erythropoiesis and chronic hemolytic in thalassemia-β and hemoglobin E carriers results in anemia. Human body responds byincreasing erythropoiesis. In iron deficiency, erythropoiesis will decrease as iron which is essential for hemoglobin formation is deficient.
Objective: to obtain profile of reticulocyte and its fractions in normal adults that can be used as reference interval, and in β-thalassemia or hemoglobin E carriers with and without iron deficiency to assess erythropoiesis activity and ineffective erythropoiesis.
Methods: a cross sectional study. There were 249 healthy subjects and 98 family members of thalassemia patients in thalassemia policlinic.
Results: MFR and HFR had poor precision thus results of both parameters were unreliable. Reference interval for reticulocyte and its fractions in normal adults are relative reticulocyte count (RRC) male and female 0.7 – 2.2%, absolute reticulocyte count (ARC) male 35,988 – 101,198 /μL and female 26,400 – 105,000/μL, relative IRF maleand female 2.4 – 13.4%, absolute IRF male 1,343 – 10,049/μL and female 764 – 11.223/μL, relative LFR male and female 86.6 – 97,4%, absolute LFR male 32,444 – 97,573/μL and female 25.634 – 92.063/μL. RRC and ARC ofthalassemia-β or HbE carriers were within reference interval, but IRF were higher than in normal adults. RRC, ARC, and IRF inthalassemia-β or HbE carriers with iron deficiency were lower than those without iron deficiency, but higher than in normal adults
Conclusions: RRC and ARC of β-thalassemia or HbE carriers were within reference interval, but IRF were higher, showed ineffective erythropoiesis. RRC, ARC, and IRF β-thalassemia or HbE carriers with iron deficiency were lower than those without iron deficiency, but higher than in normal adults. It showed that ineffective erythropoiesis also occurred in those with iron deficiency despite lower erythropoiesis activity.
HALAMAN PENGESAHAN……… iii
KATA PENGANTAR……… iv
LEMBAR PERSETUJUAN PUBLIKASI KARYA ILMIAH………... vi
ABSTRAK……….. vii
ABSTRAK……….. viii
DAFTAR ISI………... ix
DAFTAR TABEL……….. xi
DAFTAR GAMBAR……….. xii
DARTAR LAMPIRAN……….. xiii
DAFTAR ISTILAH DAN SINGKATAN……….. xiv
1. PENDAHULUAN………1 1.1.Latar belakang……….. 1 1.2. Permasalahan……… 3 1.3. Tujuan penelitian……….. 4 1.3.1. Tujuan umum………... 4 1.3.2. Tujuan khusus……….. 4 1.4. Manfaat penelitian……… 4 1.4.1. manfaat klinis……….. 4 1.4.2. manfaat akademis……… 4 2. TINJAUAN PUSTAKA……….. 5 2.1. Thalassemia……….. 5 2.1.1. Sintesis hemoglobin………. 5
2.1.2. Definisi dan tipe thalassemia………... 9
2.1.3. Thalassemia-β………. 10 2.1.3.1. Patologi molekular……….. 10 2.1.3.2. Patofisiologi……… 11 2.1.3.3. Manifestasi klinis……… 13 2.1.3.4. Temuan laboratoris………. 14 2.1.4. Hemoglobin E……….. 15
2.1.4.1. Pembawa sifat hemoglobin E………. 16
2.1.5. Defisiensi besi dan thalassemia intermedia/minor……….. 16
2.2. Immature reticulocyte fraction……….. 17
2.2.1. Fisiologi retikulosit……….. 17
2.2.2. Hubungan efektivitas eritropoiesis dan retikulosit……….. 19
2.2.3. Pemeriksaan retikulosit otomatik……… 20
2.3. Kerangka teori……….. 22
2.4.Kerangka konsep……….. 23
3. METODOLOGI PENELITIAN……… 24
3.1.Desain penelitian……….. 24
3.2.Tempat dan waktu penelitian……… 24
3.3.Subjek penelitian……….. 24
3.3.1. Subjek penelitian profil maturitas retikulosit pada orang dewasa normal... 24
3.3.2. Subjek penelitian profil maturitas retikulosit pada pembawa sifat thalassemia-β atau hemoglobin E……… 25
3.7.Alur penelitian……….. 28 3.8.Pemeriksaan……….. 29 3.8.1. Pemeriksaan pendahuluan………... 29 3.8.2. Pemeriksaan retikulosit……… 30 3.9.Pengolahan data……… 33 4. HASIL PENELITIAN……….. 37
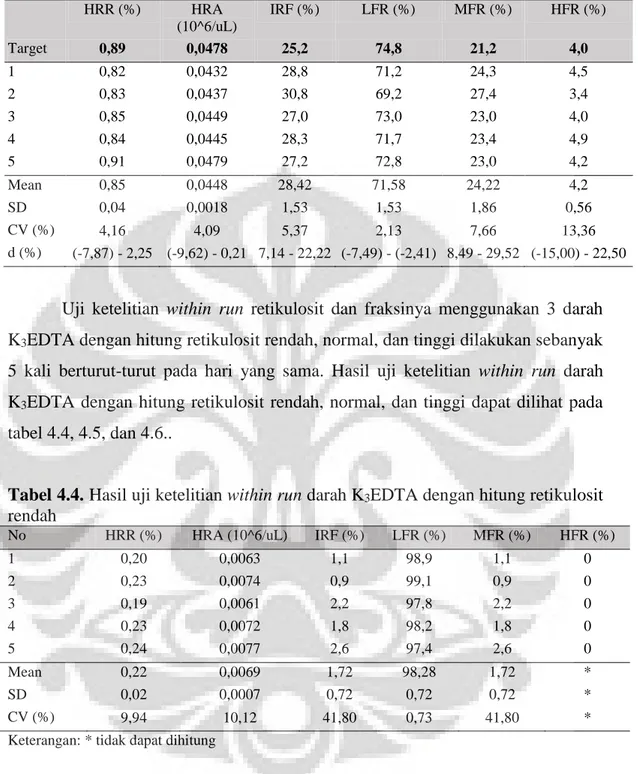
4.1.Uji ketelitian dan ketepatan……….. 37
4.2.Nilai rujukan retikulosit dan fraksinya………... 41
4.2.1. Subjek penelitian………. 41
4.2.2. Karakteristik subjek………. 41
4.2.3. Perhitungan statistik………. 42
4.3.Profil maturitas retikulosit pada pembawa sifat thalassemia-β atau hemoglobin E. 44 4.3.1. Subjek penelitian………. 44
4.3.2. Karakteristik subjek………. 44
4.3.3. Profil maturitas retikulosit………... 45
5. PEMBAHASAN……….. 48
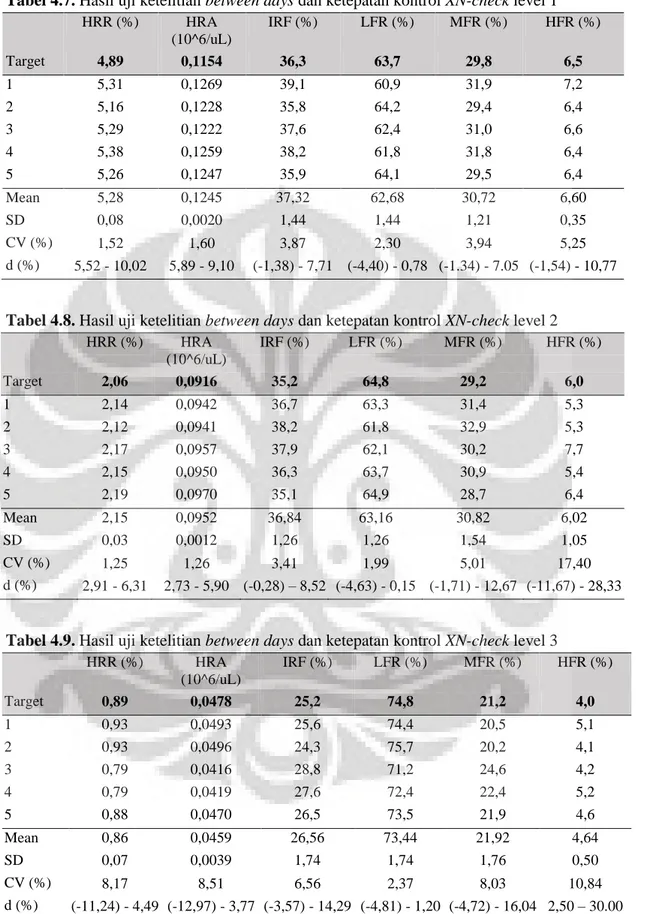
5.1.Uji ketelitian dan ketepatan……….. 48
5.2.Nilai rujukan retikulosit dan fraksinya………. 52
5.3.Profil maturitas retikulosit pada pembawa sifat thalassemia-β atau hemoglobin E. 55 5.4.Keterbatasan penelitian………. 57
6. KESIMPULAN DAN SARAN………... 58
6.1.Kesimpulan………... 58
6.2.Saran………... 59
DAFTAR PUSTAKA……… 61
Tabel 2.1. Berbagai tipe thalassemia ………9
Tabel 4.1. Hasil uji ketelitian within run dan ketepatan kontrol XN-check level 1 ..37
Tabel 4.2. Hasil uji ketelitian within run dan ketepatan kontrol XN-check level 2 ..37
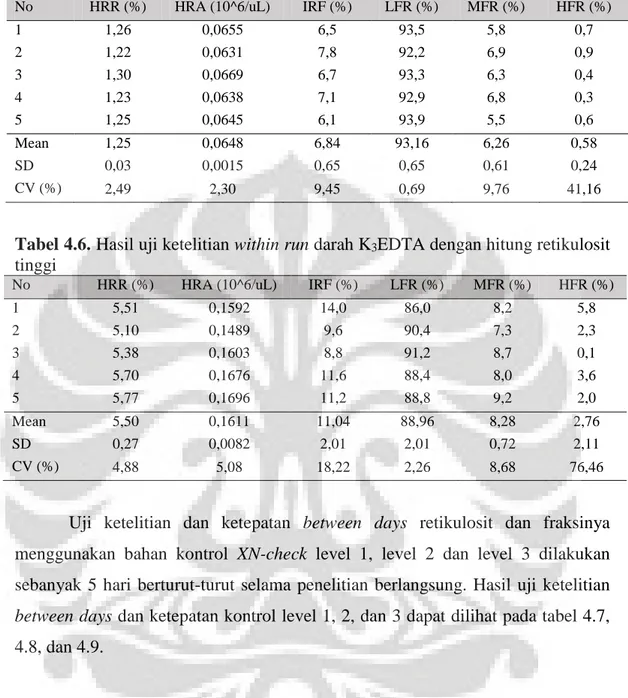
Tabel 4.3. Hasil uji ketelitian within run dan ketepatan kontrol XN-check level 3 ..38
Tabel 4.4. Hasil uji ketelitian within run darah K3EDTA dengan hitung retikulosit rendah ………..38
Tabel 4.5. Hasil uji ketelitian within run darah K3EDTA dengan hitung retikulosit normal ………...39
Tabel 4.6. Hasil uji ketelitian within run darah K3EDTA dengan hitung retikulosit tinggi………...39
Tabel 4.7. Hasil uji ketelitian between days dan ketepatan kontrol XN-check level 1. ……… …….40
Tabel 4.8. Hasil uji ketelitian between days dan ketepatan kontrol XN-check level 2. ……… …….40
Tabel 4.9. Hasil uji ketelitian between days dan ketepatan kontrol XN-check level 3. ……… …….40
Tabel 4.10. Alasan bahan pemeriksaan yang tidak memenuhi kriteria masukan atau tolakan………... …….41
Tabel 4.11. Nilai rujukan retikulosit dan fraksinya……… 43
Tabel 4.12. Karakteristik subjek pembawa sifat thalassemia-β atau hemoglobin E ..44
Tabel 4.13. Karakteristik subjek pembawa sifat thalassemia-β atau hemoglobin E tanpadefisiensi besi dan dengan defisiensi besi……… 45
Tabel 4.14. Gambaran parameter hematologi, retikulosit dan fraksinya pada orang Sehat dan pembawa sifat thalassemia-β atau HbE lelaki……….46
Tabel 4.15 Gambaran parameter hematologi, retikulosit dan fraksinya pada orang Sehat dan pembawa sifat thalassemia-β atau HbE perempuan…………46
Tabel 5.1. Perbandingan hasil uji ketelitian within run kontrol XN-Check dengan rekomendasipabrik ……….………48
Tabel 5.2. Perbandingan hasil uji ketepatanwithin run kontrol XN-Check dengan rekomendasi pabrik………..49
Tabel 5.3. Perbandingan hasil uji ketelitian within run darah K3EDTA dengan rekomendasipabrik ………..………...50
Tabel 5.4. Perbandinganhasil uji ketelitian between days kontrol XN-Check dengan rekomendasi pabrik………..50
Tabel 5.5. Perbandingan hasil uji ketepatan between dayskontrol XN-Check dengan rekomendasi pabrik……….………51
Tabel 5.6. Nilai rujukan HRR berbagai penelitian ………..52
Tabel 5.7. Nilai rujukan HRA berbagai penelitian ………..53
Tabel 5.8. Nilai rujukan IRF berbagai penelitian ………54
Tabel 5.9. Nilai rujukan LFR berbagai penelitian ……….. ……54
Tabel 5.12. Perbandingan data hemoglobin, VER, HER antara subjekpembawa sifat thalassemia-β atau HbE dengan dan tanpa defisiensi besi…...55
Gambar 2.1 Struktur molekular hemoglobin ………. 6
Gambar 2.2. Kontrol genetik sintesis hemoglobin ………. 6
Gambar 2.3. Sintesis rantai globin pada usia pranatal dan postnatal ………. 7
Gambar 2.4. Proses sintesis rantai globin ………... 8
Gambar 2.5. Patofisiologi thalassemia-β mayor ………. 12
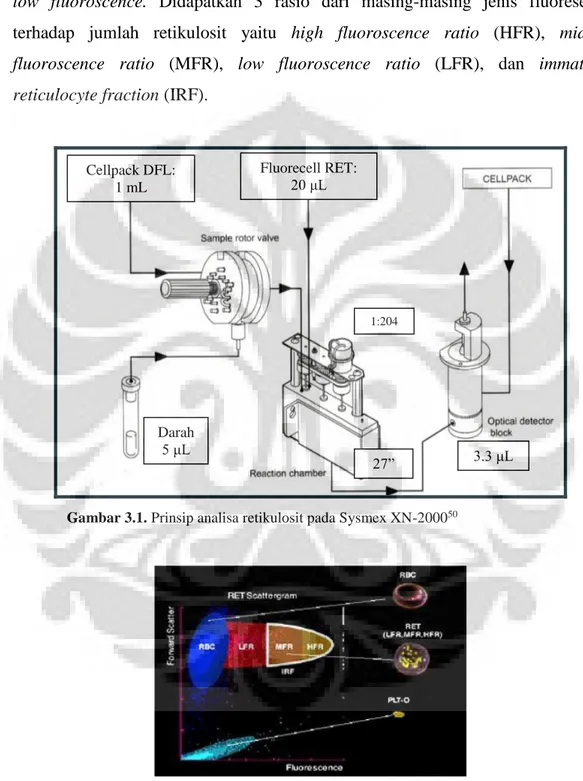
Gambar 3.1. Prinsip analisa retikulosit pada Sysmex XN-2000 ……… 32
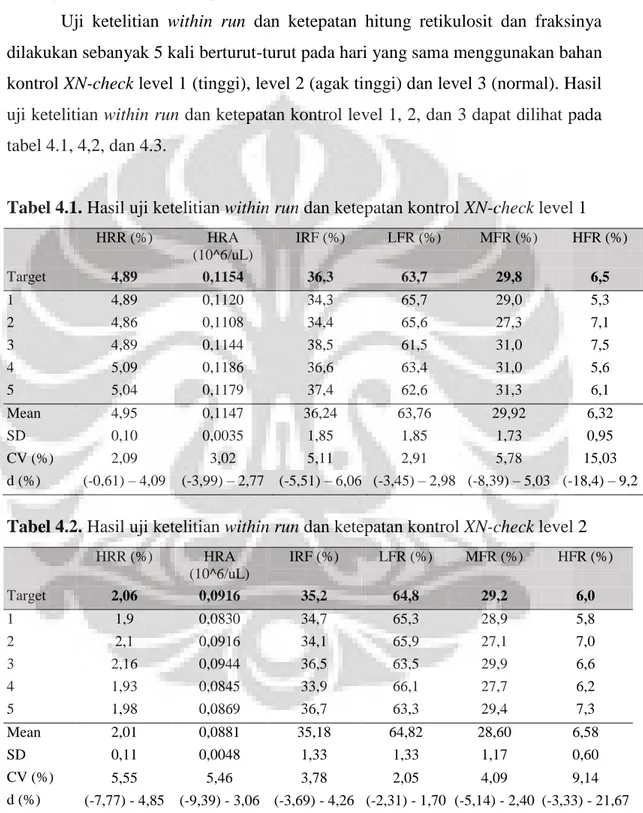
Gambar 3.2. Scattergram retikulosit ……… 32 Gambar 4.1. Distribusi usiasubjek penelitian nilai rujukan retikulosit dan fraksinya.42
Lampiran 3. Data subjek pembawa sifat thalassemia-β dan hemoglobin E ………... 75
Lampiran 4. Perhitungan kriteria Chauvenet untuk menentukan nilai pencilan yang dieksklusi pada perhitungan nilai rujukan retikulosit dan fraksinya….. 82
Lampiran 5. Uji deviasi normal baku untuk niali rujukan retikulosit dn fraksinya… 84 Lampiran 6. Keterangan lolos kaji etik………... 85
Lampiran 7. Surat keterangan ijin penelitian……….. 86
Lampiran 8. Informasi penelitian……… 87
ALT Alanine aminotransferase ARC Absolute reticulocyte Count BFU-E Burst forming units-erythroid CFU-E Colony forming units-erythroid
CLSI Clinical and Laboratory Standards Institute CRP C-reactive protein CV Coefficient of variants D Deviation Def Defisiensi EPO Eritropoietin Hb Hemoglobin HbE Hemoglobin E
HRA Hitung retikulosit absolut HER hemoglobin eritrosit rerata HFR High fluorescence ratio HRR Hitung retikulosit relatif IFN interferon
IL interleukin
IRF Immature reticulocyte fraction
K3EDTA Tripotassium ethylene diamine tetra acetate KHER Konsentrasi hemoglobin eritrosit rerata KTP Kartu tanda penduduk
LFR Low fluorescence ratio MFR Medium fluorescence ratio MMC Metropolitan Medical Center mRNA Messenger ribonucleic acid ROS Reactive oxygen species RRC Relative reticulocyte count RSCM RS Dr Cipto Mangunkusumo
SPSS Statistical product and service solution TNF Tumor necrosis factor
tRNA Transfer ribonucleic acid VER Volume eritrosit rerata
PENDAHULUAN
1.1. Latar belakang
Hemoglobinopati merupakan kelainan genetik yang ditandai adanya abnormalitas struktur atau sintesis rantai globin dari hemoglobin. Pada hemoglobin varian terdapat mutasi genetik yang menyebabkan delesi atau substitusi asam amino pada rantai globin yang menyebabkan kelainan struktur, sedangkan pada thalassemia terdapat kelainan genetik yang menyebabkan berkurangnya atau tidak adanya sintesis satu atau lebih rantai globin.1 Di Pusat Thalassemia Departemen Ilmu Kesehatan Anak RS Dr Cipto Mangunkusumo (RSCM), jumlah pasien yang terdaftar di Pusat Thalassemia sampai dengan bulan Oktober 2014 sebanyak 1.723 pasien, terdiri atas thalassemia-β 50,9%, thalassemia-β/Hemomglobin E (HbE) 46,6%, thalassemia-α 2%, dan 0,5% hemoglobinopati lain.2
Eritropoiesis inefektif merupakan salah satu patofisiologi pada thalassemia. Pada thalassemia beta, eritropoiesis inefektif terjadi akibat adanya rantai alfa berlebih. Rantai alfa yang berlebih akan dioksidasi sebagian (partially oxidized), berpresipitasi serta melekat pada rangka membran eritrosit. Hal ini menyebabkan stabilitas membran eritrosit berkurang sehingga mudah terjadi hemolisis di sirkulasi. Pada sumsum tulang, sel eritroid dengan presipitasi rantai alfa yang teroksidasi akan dihancurkan oleh makrofag sumsum tulang sebelum eritrosit dilepaskan ke sirkulasi, menyebabkan eritropoiesis inefektif. Semakin matur prekursor eritrosit, sintesis rantai globin meningkat sehingga akumulasi rantai alfa juga meningkat. Dengan demikian penghancuran prekursor eritrosit di sumsum tulang semakin meningkat progresif seiring dengan tingkat maturitas prekursor eritrosit tersebut.3,4 Akibat hemolisis dan eritropoiesis inefektif, akitivitas eritropoiesis meningkat sebagai upaya untuk mengatasi anemia yang terjadi. Peningkatan aktivitas eritropoiesis ini dapat dilihat dengan peningkatan jumlah retikulosit.5
Kejadian defisiensi besi pada thalassemia intermedia/minor cukup tinggi. Penelitian oleh Dolai dkk pada pasien thalassemia minor di India menunjukkan prevalensi defisiensi besi adalah 29,67% pada perempuan dan 3,38% pada lelaki.
Adanya defisiensi besi ini mengganggu sintesis hemoglobin karena besi merupakan salah satu komponen hemoglobin. Penurunan sintesis hemoglobin menyebabkan penurunan eritropoiesis yang dapat dilihat dengan penurunan retikulosit.6
Teknik pemeriksaan retikulosit berdasarkan adanya ribonucleic acid
(RNA) pada sitoplasma retikulosit. Flowsitometri merupakan salah satu teknik pemeriksaan retikulosit yang banyak digunakan saat ini dan dapat memberikan informasi berguna yang tidak didapatkan melalui mikroskop cahaya. Teknik flowsitometri ini telah menyatu pada alat hematologi otomatis sehingga hasil pemeriksaan hitung retikulosit dapat rutin dilakukan saat pemeriksaan hematologi.7 Flowsitometri dapat membedakan retikulosit menjadi beberapa fraksi maturitas berdasarkan banyaknya kandungan RNA yaitu high fluorescence ratio (HFR), medium fluorescence ratio (MFR), low fluorescence ratio (LFR).
Immature reticulocyte fraction (IRF) merupakan gabungan fraksi MFR dan HFR.5,7 Alat hitung hematologi automatik Sysmex XN-2000 merupakan seri Sysmex terbaru yang memiliki beberapa kelebihan dibandingkan dengan seri Sysmex sebelumnya, yaitu mampu memberikan hasil yang lebih cepat dengan
turnaround time sebanyak 10% serta memiliki beberapa modul yang dapat dipasang sesuai dengan kebutuhan. Penelitian Wirawan tahun 2006 menggunakan Sysmex XT 2000i mendapatkan nilai rujukan jumlah retikulosit untuk orang Indonesia dewasa di Jakarta adalah 0,5–2,0% untuk hitung retikulosit relatif, hitung retikulosit absolut lelaki 24.000-110.000/μL, perempuan 24.000– 95.000/μL, dan nilai rujukan IRF perempuan dan lelaki 1,4–14,6%, LFR 85,4-98,6%, MFR 1,3-12.0%, dan HFR 0-3,1%.5 Hingga saat ini belum ada nilai rujukan retikulosit orang dewasa normal menggunakan Sysmex XN-2000.
Tingkat maturitas retikulosit dapat menjadi indikator klinis aktivitas eritropoietik serta informasi tambahan yang berguna di samping nilai hitung retikulosit. Peningkatan retikulosit imatur umumnya terjadi pada regenerasi sumsum tulang pasca-kemoterapi atau transplantasi sumsum tulang, stimulasi eritropoietik iatrogenik, regenerasi eritrosit yang cepat pada hemolisis, perdarahan akut, dan pasca terapi anemia sehingga dapat digunakan untuk mengikuti hasil pengobatan anemia.5
dan adanya proses hemolitik kronik menyebabkan timbulnya anemia. Tubuh berusaha mengatasi anemia dengan meningkatkan eritropoiesis yang menyebabkan peningkatan retikulosit. Pada pasien dengan defisiensi besi, eritropoiesis akan menurun karena sintesis hemoglobin terganggu. Namun hingga saat ini belum terdapat data tingkat maturitas retikulosit yang dapat menunjukkan aktivitas eritropoiesis pembawa sifat thalassemia dengan atau tanpa defisiensi besi.
1.2. Permasalahan penelitian
Aktivitas eritropoiesis pada thalassemia atau HbE bergantung dari upaya kompensasi tubuh dalam mengatasi berat ringannya anemia yang terjadi. Peningkatan aktivitas eritropoiesis ini menyebabkan peningkatan jumlah retikulosit. Adanya eritropoiesis inefektif menyebabkan prekursor eritroid dihancurkan di sumsum tulang sehingga jumlah retikulosit yang terbentuk menjadi tidak setinggi daripada pada keadaan eritropoiesis efektif. Eritropoiesis inefektif juga menyebabkan retikulosit imatur dihancurkan sebelum menjadi retikulosit matur sehingga jumlah fraksi retikulosit imatur di sirkulasi meningkat.
Pada sisi lain, pembawa sifat thalassemia atau HbE dapat ditemukan defisiensi besi. Pada anemia defisiensi besi, aktivitas eritropoiesis menurun akibat kurangnya besi sebagai salah satu bahan baku eritropoiesis. Retikulosit imatur pada defisiensi besi dapat meningkat karena adanya pemendekan proses maturitas retikulosit di sumsum tulang sehingga menyebabkan penglepasan retikulosit lebih dini ke sirkulasi. Akibatnya proses pematangan retikulosit di sirkulasi berlangsung lebih lama. Dengan demikian Dengan demikian gambaran maturitas retikulosit di darah tepi pada pembawa sifat thalassemia-β atau HbE dapat dipengaruhi oleh eritropoiesis inefektif dan ada tidaknya defisiensi besi. Namun hingga saat ini belum ada data gambaran maturitas retikulosit pada pembawa sifat thalassemia-β atau HbE dengan dan tanpa defisiensi besi..
1.3.Tujuan penelitian 1.3.1. Tujuan umum
Mendapatkan nilai rujukan retikulosit dan fraksinya pada orang Indonesia dewasa di Jakarta serta membuktikan eritropoiesis inefektif pada pembawa sifat thalassemia-β atau HbE dengan alat Sysmex XN-2000
1.3.2. Tujuan khusus
1. Mendapatkan gambaran retikulosit dan fraksi maturitasnya secara relatif dan absolut pada orang Indonesia dewasa normal di Jakarta yang dapat digunakan sebagai nilai rujukan.
2. Mendapatkan gambaran hitung retikulosit dan fraksi maturitasnya relatif dan absolut pada pembawa sifat thalassemia-β atau HbE tanpa defisiensi besi. 3. Mendapatkan gambaran hitung retikulosit dan fraksi maturitasnya relatif dan
absolut pada pembawa sifat thalassemia-β atau HbE dengan defisiensi besi.
1.4. Manfaat penelitian 1.4.1. Manfaat klinis
Nilai retikulosit dan fraksi maturitas retikulosit pada orang Indonesia dewasa normal di Jakarta dapat dijadikan sebagai nilai rujukan. Diketahuinya profil maturitas retikulosit pada pembawa sifat thalassemia-β atau HbE dapat membantu menilai akitvitas eritropoiesis dengan dan tanpa defisiensi besi, serta dapat mendukung adanya defisiensi besi pada pembawa sifat thalassemia-β atau HbE.
1.4.2. Manfaat akademis
Nilai rujukan retikulosit dan fraksi maturitasnya untuk alat hematologi Sysmex XN-2000 pada orang dewasa normal dapat digunakan dalam menginterpretasi hasil pemeriksaan retikulosit dan fraksi maturitas pasien. Diketahuinya profil maturitas retikulosit pada pembawa sifat thalassemia-β atau HbE dapat mendukung adanya eritropoiesis inefektif sebagai bagian dari patofisiologi thalassemia-β atau HbE.
BAB II
TINJAUAN PUSTAKA
2.1. Thalassemia
Thalassemia pertama kali ditemukan oleh Thomas B Cooley pada tahun 1925 di Detroit. Dr. Cooley mendeskripsikan beberapa bayi yang menderita anemia berat dengan splenomegali dan kelainan tulang. Pada tahun 1932, Whipple dan Bradford mempublikasikan temuan patologik serta memberi nama ‘Thalassemia’ yang berasal dari bahasa Yunani θαλασσα yang berarti laut karena banyak pasien ditemukan berasal dari daerah Mediterania. Setelah tahun 1940 baru diketahui karakteristik genetik thalassemia. Saat ini thalassemia dapat ditemukan di berbagai belahan dunia, dari daerah Mediterania, Timur Tengah, hingga Asia Tenggara.1,8,9
Manifestasi klinis thalassemia bervariasi. Pada thalassemia homosigot / heterosigot ganda pasien mengalami anemia berat dan dapat meninggal pada saat anak bila tidak ditatalaksana dengan baik. Pada pembawa sifat thalassemia manifestasi klinis bervariasi dari tanpa gejala hingga bergejala seperti individu yang homosigot / heterosigot ganda.1,8,10
2.1.1. Sintesis hemoglobin
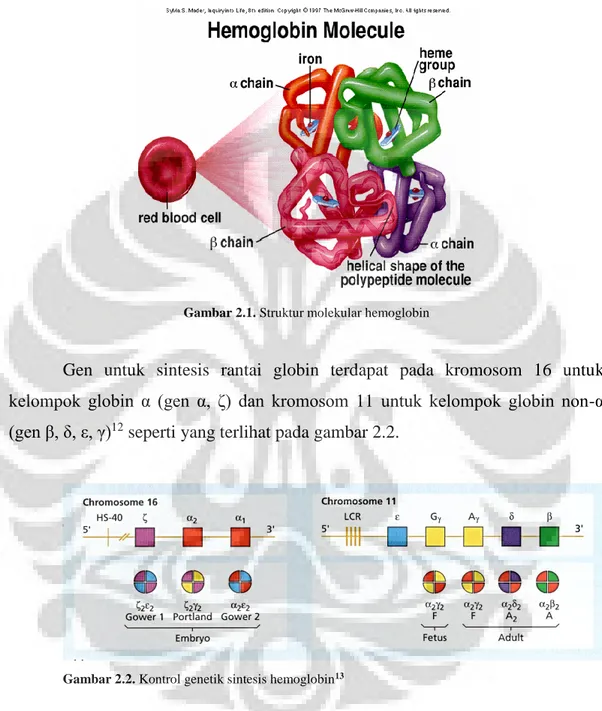
Hemoglobin merupakan struktur tetramer yang memiliki berat molekul 66.700 Dalton, terdiri dari 4 subunit protein globular. Masing-masing subunit terdiri dari sebuah rantai globin dan sebuah gugus heme seperti yang terlihat pada gambar 2.1. Heme merupakan senyawa kompleks yang terdiri dari sebuah atom Fe yang terletak di tengah-tengah struktur porfirin. Setiap heme dapat mengangkut sebuah molekul oksigen yang terikat pada atom Fe, dengan demikian setiap molekul hemoglobin dapat mengangkut empat molekul oksigen.9,11
Setiap molekul hemoglobin memiliki dua pasang rantai globin yaitu sepasang rantai globin kelompok α (α atau ζ) dan sepasang rantai globin kelompok non-α (β, δ, ε, atau γ). Pada orang dewasa normal terdapat tiga macam hemoglobin yaitu hemoglobin A (α2β2) yang merupakan komponen terbanyak
serta hemoglobin A2 (α2δ2) dan hemoglobin F (α2γ2). Pada masa embrio dan fetus terdapat Hb Portland (ζ2γ2), Hb Gower 1 (ζ2ε2), Hb Gower 2 (α2ε2), dan Hb F (α2γ2).8,9
Gambar 2.1. Struktur molekular hemoglobin
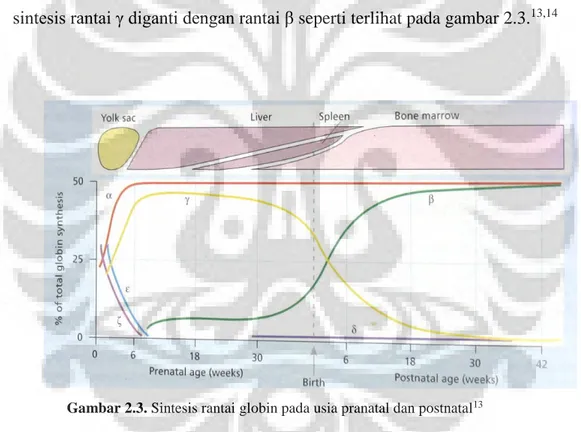
Gen untuk sintesis rantai globin terdapat pada kromosom 16 untuk kelompok globin α (gen α, ζ) dan kromosom 11 untuk kelompok globin non-α (gen β, δ, ε, γ)12 seperti yang terlihat pada gambar 2.2.
Gambar 2.2. Kontrol genetik sintesis hemoglobin13
Pada masa embrio (trimester pertama kehamilan) terdapat Hb Portland, Hb Gower 1 dan Hb Gower 2. Hemoglobin primitif ini dapat dideteksi pada saat hematopoiesis terjadi di kantung kuning telur (yolk sac) dan hati. Pada masa fetus dan neonatal eritropoiesis terjadi di hati, limpa dan sumsum tulang dengan hemogloin didominasi oleh HbF. Pada saat lahir neonatus memiliki 50-85% HbF.13,14
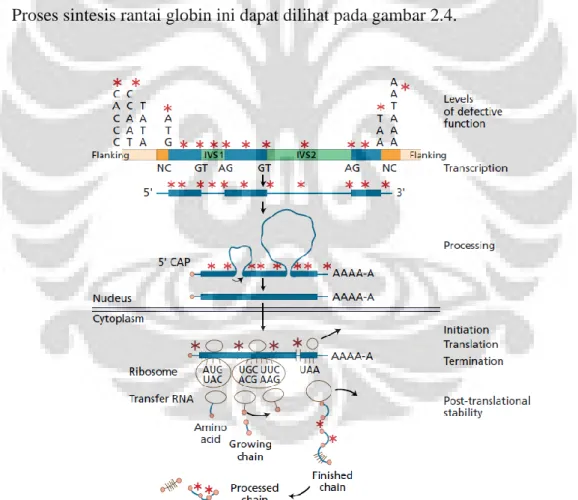
dan HbF. Hb A merupakan komponen mayor hemoglobin. Meskipun HbA dapat ditemukan sejak usia minggu kesembilan gestasi, sintesis rantai β tidak melebihi sintesis rantai γ sampai setelah lahir. Pada minggu ke-36 gestasi, sintesis rantai β meningkat secara nyata sedangkan sintesis rantai γ menurun sehingga saat lahir jumlah rantai β dan γ seimbang. Setelah lahir HbA terus meningkat hingga mencapai kadar seperti dewasa normal pada akhir tahun pertama kehidupan (>95%). Produksi HbF <1% dari hemoglobin dewasa normal. Produksi HbA2 terjadi pada masa fetus akhir dan pada saat lahir kadarnya <1%, kemudian kadarnya mencapai sama seperti dewasa normal setelah usia 1 tahun yaitu 1,5-3%, Pertukaran (switch) dari HbF ke HbA terjadi pada 3-6 bulan setelah lahir saat sintesis rantai γ diganti dengan rantai β seperti terlihat pada gambar 2.3.13,14
Gambar 2.3. Sintesis rantai globin pada usia pranatal dan postnatal13
Gen yang mengatur sintesis rantai globin terdiri dari 3 ekson dan 2 intron. Pada proses transkripsi terbentuk messenger RNA (mRNA) yang mengandung ekson dan intron dengan bantuan RNA polimerase II. Intron dari mRNA yang terbentuk akan hilang melalui proses splicing. Intron selalui diawali dengan dinukleotida GT pada ujung 5’ dan diakhiri dinukleotida AG pada ujung 3’. Ujung 5’ mRNA ditambahkan struktur CAP yang terdiri dari 7 metil-guanosin. Struktur CAP penting untuk perlekatan pada ribosom. Ujung 3’ mRNA
ditambahkan residu asam adenilat (poly-A) yang berguna untuk stabilisasi. Thalasemia dapat terjadi akibat mutasi atau delesi berbagai sekuens nukleotida. mRNA kemudian pindah ke sitoplasma dan melekat pada ribosom untuk mengalami translasi.13,14
Asam amino dibawa oleh transfer RNA (tRNA) sesuai dengan cetakan mRNA. Susunan asam amino pada rantai globin ditentukan oleh susunan kodon (3 basa). tRNA mengandung 3 basa, antikodon (komplementer terhadap kodon mRNA), dan membawa asam amino sesuai dengan pasangan kodon-antikodon pada posisi yang sesuai di cetakan mRNA.8,13
Kodon inisiasi adalah AUG dan kodon terminasi adalah UAA, UAG, dan UGA. Apabila ribosom mencapai kodon terminasi, translasi berhenti, rantai globin yang telah terbentuk dilepas, serta subunit ribosom akan didaur ulang.8,13 Proses sintesis rantai globin ini dapat dilihat pada gambar 2.4.
2.1.2. Definisi dan tipe thalassemia
Thalassemia adalah sekelompok kelainan genetik yang diakibatkan penurunan sintesis satu atau lebih rantai globin hemoglobin. Thalassemia diklasifikasikan berdasarkan jenis rantai globin yang berkurang sintesisnya. Thalassemia α bila sintesis rantai α berkurang, sedangkan thalassemia β bila sintesis rantai β berkurang. Di samping itu dapat juga ditemukan individu yang menerima gen thalassemia dari salah satu orang tua dan gen hemoglobin varian dari orang tua lainnya, atau gen thalassemia α dari satu orang tua dan gen thalassemia β dari orang tua lainnya.1,8,10,12 Pada tabel 2.1 dapat dilihat berbagai variasi thalassemia.
Tabel 2.1. Berbagai tipe thalassemia8,10
Thalassemia α α0 α+ delesi (-α) non-delesi (αT) Thalassemia β β0 β+ HbA2 normal Dominan
Tidak terkait dengan gen rantai β Thalassemia δβ (δβ)0 (δβ)+ (Aγ δβ)0 Thalassemia γ Thalassemia δ δ0 δ+ Thalassemia εγδβ Hereditary persistence of fetal haemoglobin Delesi (δβ)0 , (Aγ δβ)0 Non-delesi
Terkait dengan gen rantai β Gγβ+, Aγβ+ Tidak terkait dengan gen rantai β
Secara klinis, thalassemia dapat dibagi menjadi thalassemia mayor, intermedia dan minor. Thalassemia mayor (anemia Cooley) memberikan gambaran klinis anemia berat dengan ketergantungan terhadap transfusi. Thalassemia intermedia terdapat anemia dan splenomegali, tetapi tidak membutuhkan transfusi rutin. Sedangkan thalassemia minor dapat tanpa gejala atau anemia ringan.8
2.1.3. Thalassemia-β
Thalassemia-β tersebar luas di Mediterania, Timur Tengah, India-Pakistan, dan Asia Tenggara. Penyakit ini juga banyak ditemukan di bagian selatan dari bekas Uni Soviet dan Cina. Namun thalassemia-β tidak terbatas pada daerah tersebut, tetapi tersebar secara sporadis di berbagai ras.8,10
Pada thalasemia-β0 tidak terdapat sintesis rantai β, sedangkan pada thalasemia-β+ terjadi defisiensi parsial rantai β. Lebih dari 200 mutasi di dalam atau sekitar gen globin β diketahui menyebabkan penurunan atau tiadanya produksi globin-β.10
2.1.3.1. Patologi molekular
Terdapat sekitar 200 mutasi pada thalasemia-β. Mutasi dapat mengganggu proses transkripsi, translasi, dan stabilitas pasca translasi gen globin sehingga tidak disintesisnya rantai globin-β (thalasemia-β0), atau berkurangnya sinstesis rantai globin-β (thalasemia-β+). mutasi pada thalasemia-β berupa mutasi titik, delesi atau substitusi nukleotida pada regio tertentu.8,12,15,16
Mutasi pada regio promoter gen globin dapat menurunkan transkripsi gen globin-β. Proses splicing mRNA dapat terganggu bila terdapat mutasi di dalam intron, ekson atau pada tempat perbatasan intron dan ekson. Mutasi yang melibatkan proses translasi terdiri dari dua kelompok yaitu mutasi nonsense dan
frameshift. Mutasi nonsense yaitu perubahan satu basa yang menghasilkan kodon stop sehingga terjadi terminasi prematur sintesis rantai globin. Frameshift yaitu hilangnya atau insersi satu atau lebih basa.8,16
Selain itu mutasi pada ekson 3 juga dapat menyebabkan instabilitas produk globin-β. Rantai globin-β yang tidak stabil ini bersama dengan rantai globin-α yang berlebih akan berpresipitasi dan menimbulkan badan inklusi pada preskursor eritroid. Badan inklusi ini menyebabkan destruksi eritroid intramedular dan menyebabkan eritropoiesis inefektif. Hal ini merupakan dasar thalasemia-β diturunkan secara dominan. Di samping itu dapat juga dihasilkan eritrosit dengan rantai-β yang tidak stabil ke sirkulasi. Ertrosit tersebut akan dihancurkan di limpa dan menyebabkan hemolitik kronik.8,16
2.1.3.2. Patofisiologi
Pada individu normal, rantai α dan β diproduksi dalam jumlah seimbang. Pada thalassemia-β terjadi penurunan atau tidak adanya sintesis rantai-β sehingga terjadi kelebihan rantai-α.1,8,10,17 Hampir seluruh patofisiologi thalassemia-β berkaitan dengan ketidakseimbangan sintesis rantai globin ini.
Rantai-α yang berlebih tidak dapat membentuk struktur tetramer hemoglobin yang stabil sehingga berpresipitasi di dalam prekursor eritroid. Presipitasi tersebut menghasilkan badan inklusi yang dapat mengganggu pematangan eritroid. Pada sumsum tulang, presipitasi dapat terlihat paling dini pada prekursor ertroid yang membentuk hemoglobin dan sepanjang jalur pematangan eritroid. Badan inklusi menyebabkan destruksi prekursor eritroid intramedular sehingga terjadi eritropoiesis inefektif yang merupakan salah satu ciri thalassemia. Eritrosit yang masuk ke sirkulasi mengandung badan inklusi dari rantai-α yang dapat mengganggu perjalanan eritrosit melalui mikrosirkulasi terutama di limpa.8,10,15,16
Kerusakan membran eritrosit oleh presipitasi rantai-α terjadi selain akibat rantai-α yang berlebih juga akibat produk degradasi dari rantai-α bebas yaitu globin, heme, hemin (heme yang teroksidasi), dan besi bebas. Rantai globin yang berlebih dapat berikatan dengan protein membran eritrosit sehingga merusak struktur dan fungsi membran. Besi berlebih bersifat radikal bebas sehingga merusak protein dan lipid membran serta organel intraselular eritrosit. Heme dan hemin mengkatalisis pembentuk berbagai reative oxygen species (ROS) yang merusak membran eritrosit. Membran eritrosit menjadi kaku, eritrosit menjadi dehidrasi, kurang kalium, serta memiliki kadar kalsium tinggi dan kadar ATP yang rendah.8,10,15,18
Anemia pada thalassemia terjadi akibat 3 komponen. Pertama akibat eritropoiesis inefektif yaitu terjadi destruksi intramedular dari prekursor eritrosit. Kedua akibat hemolisis yaitu destruksi eritrosit matur yang mengandung inklusi rantai-α. Ketiga adalah eritrosit mikrositik hipokrom akibat penurunan sintesis hemoglobin secara keseluruhan.7,10 Anemia merangsang produksi eritropoietin sehingga terjadi ekspansi sumsum tulang yang dapat menyebabkan deformitas
tulang tengkorak dan tulang panjang. Limpa menjadi hipertrofi akibat peningkatan destruksi eritrosit abnormal. Splenomegali selanjutnya menyebabkan peningkatan sekuestrasi eritrosit dan berperan menyebabkan anemia.8,16 Pada orang dewasa normal, sekitar 2-3 juta sel darah merah baru diproduksi setiap detik, tetapi pada thalassemia berat terjadi peningkatan eritropoiesis sebanyak 20-30 kali untuk mengatasi anemia yang terjadi.12 Pemberian transfusi darah yang rutin pada thalassemia mayor dapat membantu mengatasi anemia namun dapat terjadi akumulasi besi di hati, kelenjar endorin dan miokardium.8
Pada thalassemia-β sintesis HbF dan HbA2 tidak menurun. Produksi hemoglobin fetal dalam uterus berlangsung normal. Manifestasi klinis thalassemia mulai timbul saat terjadi pertukaran (switch) dari rantai γ ke rantai β. Namun
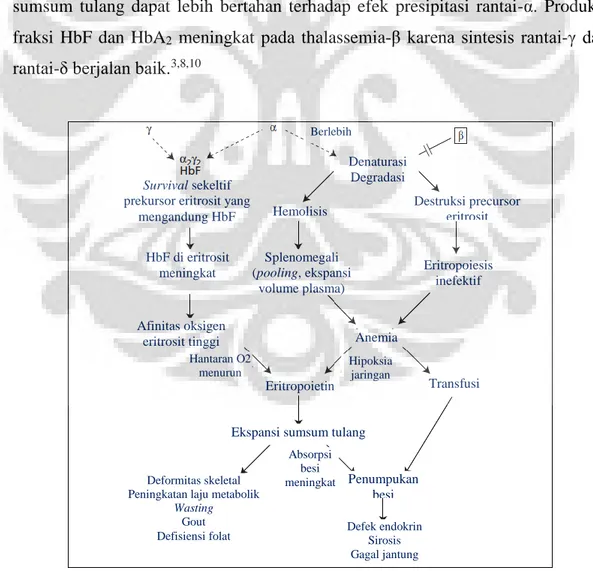
beberapa prekursor eritroid dewasa mampu memproduksi rantai-γ dalam jumlah yang bervariasi. Eritrosit yang mampu memproduksi rantai-γ lebih banyak di sumsum tulang dapat lebih bertahan terhadap efek presipitasi rantai-α. Produksi fraksi HbF dan HbA2 meningkat pada thalassemia-β karena sintesis rantai-γ dan rantai-δ berjalan baik.3,8,10
Gambar 2.5. Patofisiologi thalassemia-β mayor8 Denaturasi Degradasi Destruksi precursor eritrosit Eritropoiesis inefektif Transfusi Penumpukan besi Defek endokrin Sirosis Gagal jantung Anemia Berlebih Hemolisis Splenomegali (pooling, ekspansi volume plasma) Eritropoietin Hipoksia jaringan
Ekspansi sumsum tulang
Deformitas skeletal Peningkatan laju metabolik
Wasting Gout Defisiensi folat Absorpsi besi meningkat Hantaran O2 menurun Afinitas oksigen eritrosit tinggi HbF di eritrosit meningkat Survival sekeltif prekursor eritrosit yang
2.1.3.3. Manifestasi klinis
Pada thalassemia mayor, manifestasi klinis nampak sejak tahun pertama kehidupan. Saat lahir, bayi tampak normal, namun dalam beberapa bulan mulai timbul anemia dan semakin memberat secara progresif. Bayi mengalami gagal tumbuh, asupan makan tidak adekuat, beberapa episode demam, diare dan gangguan gastrointestinal, serta malaise umum. Pada kebanyakan kasus splenomegali sudah nyata. Bila anak kemudian mendapatkan transfusi rutin yang adekuat, pertumbuhan dan perkembangan dapat berjalan baik dan splenomegali minimal, hingga memasuki masa pubertas yaitu saat mulai timbul efek kelebihan besi akibat eritropoiesis inefektif dan transfusi darah berulang. Berbagai komplikasi seperti diabetes, hipoparatiroidisme, insufisiensi adrenal, kegagalan hati progresif, keterlambatan perkembangan seksual sekunder, dan kerusakan jantung dapat terjadi akibat efek kelebihan besi. Pemberian terapi kelasi besi secara rutin dapat mengurangi efek kelebihan besi ini meskipun masih terdapat kemungkinan gangguan pertumbuhan, perkembangan seksual dan osteoporosis karena organ endokrin sensitif terhadap kelebihan besi yang ringan sekalipun. Di samping itu anak juga memiliki risiko tertular penyakit yang ditularkan melalui darah seperti HIV, hepatitis B, dan hepatitis C.8,10
Anak yang tidak mendapatkan transfusi darah adekuat memiliki karakteristik anemia Cooley’s yaitu gangguan pertumbuhan, deformitas tulang dengan bossing of the skull, overgrowth of maxillary region, wajah ‘mongoloid’, dan pada gambaran radiologis ditemukan pola trabekular berambut pada tulang panjang dan jari, serta gambaran hair on end di tulang tengkorak. Hati dan limpa membesar, dan terdapat pigmentasi pada kulit. Deformitas tulang menyebabkan peningkatan risiko fraktur. Terjadi peningkatan kebutuhan asam folat dan bila terjadi defisiensi asam folat dapat memperberat anemia. Peningkatan turnover
prekursor eritrosit dapat menyebabkan hiperurisemia dan gout sekunder. Hipersplenisme dapat menyebabkan trombositopenia yang meningkatkan risiko perdarahan. Saat masuk ke masa pubertas, anak mengalami gangguan akibat kelebihan besi. Gangguan akibat kelebihan besi ini terjadi peningkatan absorpsi di gastrointestinal dan transfusi yang ireguler.8,10
Pasien thalasemia intermedia tidak memerlukan transfusi rutin seperti pada thalasemia mayor. Manifestasi klinis bervariasi mulai dari tidak bergejala dengan kadar hemoglobin 10-12 g/dL hingga adanya gejala seperti gangguan pertumbuhan, deformitas skeletal, artritis, nyeri tulang splenomegali progresif, dengan kadar hemoglobin 6 g/dL. Kelebihan besi dapat terjadi walaupun tidak mendapatkan transfusi yang sering dan dapat menimbulkan diabetes dan gangguan endokrin pada dekade keempat kehidupan.10
Thalasemia minor biasanya asimtomatik dengan tidak adanya kelainan klinis. Pasien baru diketahui memiliki thalasemia saat melakukan pemeriksaan darah rutin, hamil, infeksi berat, atau saat penyelidikan riwayat keluarga dari kerabat yang thalasemia. Beberapa pasien dapat mengalami peningkatan simpanan besi namun hal ini biasanya terkait pemberian terapi besi karena kesalahan diagnosis anemia defisiensi besi.10
2.1.3.4. Temuan laboratoris
Pada thalasemia mayor kadar hemoglobin berkisar 2-3 g/dL. Eritrosit mikrositik hipokrom dengan ukuran dan bentuk yang bervariasi, terdapat fragmentosit, sel target, serta basophilic stippling. Eritrosit berinti dalam darah tepi ditemukan dalam jumlah bervariasi, dan setelah splenektomi jumlahnya meningkat. Retikulosit meningkat ringan. Jumlah leukosit dan trombosit kecuali bila terjadi hipersplenisme. Pada hipersplenisme, leukosit dan trombosit dapat menurun. Sumsum tulang menunjukkan hiperplasia eritroid dengan rasio mieloid:eritroid seimbang (1:1) atau kurang.8,10,19
Kadar besi serum meningkat progresif seiring dengan transfusi yang diberikan serta saturasi transferin sangat tinggi. Kadar feritin tinggi dan pada biopsi hati tampak peningkatan besi pada sel retikuloendotelial dan sel parenkimal.8,10
Kadar HbF di atas 90% pada thalasemia-β homosigot. Pada thalasemia-β0 tidak terbentuk HbA. Kadar HbA2 meningkat bervariasi (menurun, normal, atau meningkat) dan tidak bisa dijadikan dasar diagnosis.8,10
Pada thalassemia-β heterosigot biasanya tidak mempunyai gejala kecuali pada beberapa keadaan seperti kehamilan. Kadar hemoglobin berkisar 9-11 g/dL.
Sumsum tulang menunjukkan hiperplasia eritroid ringan. Splenomegali jarang terjadi. Kadar HbA2 berkisar 3,5-7% serta kadar HbF 1-3% pada sekitar 50% kasus.8,10
Hitung retikulosit dapat digunakan untuk menilai aktivitas eritropoiesis. Anemia pada thalassemia terjadi akibat adanya eritropoiesis inefektif, hemolisis kronik dan penurunan sintesis rantai globin. Tubuh berusaha mengatasi anemia dengan meningkatkan eritropoiesis. Peningkatan eritropoiesis ini dapat dinilai dari peningkatan retikulosit, tetapi adanya eritropoiesis inefektif menyebabkan peningkatan retikulosit yang terjadi ringan. Pada thalassemia-β heterosigot, anemia yang terjadi tidak seberat thalassemia-β homosigot/heterosigot ganda sehingga peningkatan aktivitas eritropoiesis juga tidak setinggi thalassemia-β homosigot/heterosigot ganda. Adanya eritropoiesis inefektif pada thalassemia-β heterosigot dapat menyebabkan retikulosit normal. Eritropoiesis inefektif ini juga menyebabkan retikulosit imatur dihancurkan sebelum menjadi retikulosti matur sehingga pada pemeriksaan maturitas retikulosit didapatkan peningkatan fraksi retikulosit imatur.
2.1.4. Hemoglobin E
Hemoglobin E (HbE) meurpakan varian rantai globin β yaitu adanya substitusi asam glutamat menjadi lisin pada kodon ke-26 dari gen globin β. Prevalensi hemoglobinopati ini tinggi di regio Asia Tenggara, yaitu 60% pasien HbE terdapat di Thailand, Laos, dan Kamboja. Hemoglobin E juga ditemukan di Sri Lanka, India bagian Timur Laut, Bangladesh, Pakistan, Nepal, Vietnam, Malaysia, Filipina, Indonesia, dan Turki.20,21
Mutasi pada HbE menyebabkan aktivasi situs sambungan (splicing) mRNA kriptik, yaitu terjadi situs sambungan palsu dekat ujung 3’ ekson 1 sehingga terdapat penambahan daerah mRNA yang tersambung abnormal. Akibatnya terjadi penurunan sintesis rantai βE dan selanjutnya menyebabkan terdapatnya rantai α bebas yang sifatnya tidak stabil. Hemoglobin E dikatakan sebagai hemoglobinopati talasemik karena fenotipenya dapat menyerupai thalassemia. Hemoglobin E juga memiliki kontak rantai α1β1 yang lemah
sehingga menjadi tidak stabil saat terdapat peningkatan stres oksidatif. Hemoglobin E homosigot dan heterosigot memberikan gambaran klinis yang ringan hingga tidak memiliki gejala klinis. Manifestasi klinis yang paling berat timbul bila HbE diturunkan bersama dengan Thalassemia-β trait sehingga menyebabkan timbulnya thalassemia mayor atau intermedia.20,22
Eritropoiesis inefektif juga terjadi pada pasien HbE tetapi lebih ringan daripada thalassemia-β. Pada sumsum tulang terjadi presipitasi rantai globin-α yang berlebih di membran sel eritroid yang memicu eritropoiesis inefektif.
2.1.4.1. Pembawa sifat hemoglobin E
Pasien HbE trait umumnya tidak bergejala walaupun terdapat kemungkinan mudah hemolisis akibat stres oksidatif. Pemeriksaan hematologi dapat memberikan hasil normal, anemia ringan, penurunan volume eritrosit rerata (VER), penurunan hemoglobin eritrosit rerata (HER), dengan konsentrasi hemoglobin eritrosit rerata (KHER) normal. Retikulosit dapat normal. Pada HbE juga terdapat peningkatan aktivitas eritropoiesis sebagai usaha mengatasi anemia. Tetapi karena adanya eritropoiesis inefektif jumlah retikulosit dapat menjadi normal. Eritropoiesis inefektif juga menyebabkan retikulosit imatur dihancurkan sebelum menjadi retikulosit matur sehingga pada pemeriksaan maturitas retikulosit didapatkan fraksi retikulosit imatur meningkat. Pada gambaran darah tepi, eritrosit dapat terlihat normal atau mikrositik hipokrom, dapat ditemukan sel target, dan basophilic stippling. Pada analisis hemoglobin, didapatkan HbE sekitar 30%. Bila HbE >39% kemungkinan Thalassemia-β/HbE, bukan HbE trait. Bila HbE trait didapatkan bersama dengan pembawa sifat Thalassemia α, persentase HbE <25%. Bila pembawa sifat HbE didapatkan bersama dengan HbH, persentase HbE <10%. Adanya defisiensi besi juga menurunkan persentase HbE.20,22
2.1.5. Defisiensi besi dan thalassemia intermedia/minor
Pasien thalassemia minor sering disertai juga dengan defisiensi besi. Penelitian oleh Dolai dkk pada pasien thalassemia minor di India menunjukkan prevalensi defisiensi besi adalah 29,67% pada perempuan dan 3,38% pada lelaki.6 Defisiensi besi dan peningkatan aktivitas eritropoiesis akan menekan hepsidin.
ferroportin yang terdapat pada enterosit, hepatosit dan makrofag. Hepsidin menghambat keluarnya besi dari enterosit, hepatosit dan makrofag ke plasma sehingga kadar besi darah rendah. Penurunan hepsidin seperti yang terjadi pada defisiensi besi dan peningkatan aktivitas eritropoiesis menyebabkan peningkatan absorpsi besi di enterosit dan pelepasan simpanan besi dari makrofag dan hepatosit ke darah sehingga jumlah besi di darah meningkat dan sintesis hemoglobin tubuh juga meningkat.24
Pada thalassemia intermedia/minor dengan defisiensi besi, penurunan hepsidin selain akibat defisiensi besi, juga terjadi akibat peningkatan aktivitas eritropoiesis dan anemia pada thalassemia. Peningkatan penglepasan besi dari makrofag dan absorpsi besi intestinal menyebabkan feritin rendah dan kadar besi serum tinggi. Peningkatan kadar besi serum yang tinggi ini menyebabkan iron overload dan penumpukan besi terutama di hati yang merupakan tempat utama penyimpanan besi tubuh dalam bentuk feritin.25,26 Sehingga pada thalassemia intermedia/minor juga dapat terjadi kelebihan besi walaupun tidak mendapatkan transfusi rutin.
2.2. Immature reticulocyte fraction 2.2.1. Fisiologi retikulosit
Retikulosit merupakan eritrosit muda yang masih mengandung sisa ribosom di sitoplasmanya. Retikulosit termasuk salah satu tahapan dalam eritropoiesis. Tahapan eritropoiesis dimulai dengan rubriblas (proerythroblast) kemudian diikuti prorubrisit (basophilic erythroblast), rubrisit (polychromatophilic erythroblast), metarubrisit (orthochromatic erythroblast), retikulosit (polychromatophilic erythrocyte), dan eritrosit.27
Eritropoiesis merupakan proses pembentukan sel darah merah di sumsum tulang. Proses ini meliputi serangkaian tahapan pematangan, berawal dari sel punca progenitor eritroid dan berakhir dengan sel darah merah matang yang beredar di sirkulasi.28 Pada keadaan normal jumlah sel darah merah di sirkulasi serta prekursornya berada pada keadaan yang relatif konstan akibat adanya
keseimbangan antara pembentukan sel darah merah baru di sumsum tulang dan destruksi sel darah merah tua.28,29
Satu siklus eitropoesis berlangsung sekitar 5-7 hari mulai dari rubriblas sampai menjadi eritrosit matang. Perubahan pada setiap stadium maturasi ditandai dengan peningkatan kondensasi kromatin inti, anak inti akan hilang, dan perubahan warna sitoplasma dari biru tua dengan kandungan RNA yang tinggi menjadi kemerah-merahan yang menandakan terdapatnya hemoglobin.29,30
Oksigenasi jaringan dapat mempengaruhi eritropoiesis melalui berbagai faktor transkripsi dan sitokin, salah satunya adalah eritropoietin (EPO). Eritropoietin merupakan hormon yang dihasilkan di ginjal (utama) dan hati sebagai respons terhadap hipoksia dan berperan sebagai pengatur humoral utama dari eritropoiesis. Eritropoietin akan menginduksi diferensiasi prekursor ertroid menjadi rubriblas dan selanjutnya menjadi eritrosit matang, sehingga menyebabkan peningkatan produksi eritrosit. Eritropoietin juga menjaga viabilitas sel eritroid.28,29
Adanya inflamasi dapat mengganggu eritropoiesis. Sitokin proinflamasi yang dihasilkan makrofag saat inflamasi seperti interleukin-1 (IL-1), tumor necrosis factor (TNF)-α, interferon (IFN)-γ berperan dalam menekan eritropoiesis.
Tumor necrosis factor-α menghambat pembentukan burst forming units-erytrhoid
(BFU-E) dan menyebabkan penurunan produksi eritropoietin oleh ginjal.31 Interlukin-1 dan TNF-α juga menyebabkan penurunan respons sumsum tulang terhadap eritropoietin.32 Interferon-γ menghambat pembentuk colony forming units-erytrhoid (CFU-E).33
Pematangan retikulosit terjadi selama 2-3 hari, dengan separuh pertama terjadi di sumsum tulang dan separuh selanjutnya di sirkulasi. Saat masuk di sirkulasi, retikulosit masih mengandung mitokondria, sejumlah kecil ribosom, sentriol, dan sisa aparatus Golgi. Retikulosit tidak mengandung retikulum endoplasmik. Akibat kandungan ribosomnya, retikulosit berwarna kebiruan dengan pewarnaan Romanowsky sehingga disebut sebagai eritrosit polikrom. Ukuran retikulosit lebih besar daripada eritrosit, yaitu 7-10 μm. Pewarnaan supravital menggunakan brilliant cresyl blue atau new methylene blue
retikulosit.27,34 Sekitar 20% hemoglobin terbentuk pada tahap retikulosit. Sintesis hemoglobin secara berangsur-angsur menurun bersamaan dengan hilangnya organel seluler di retikulosit yang kemudian menjadi eritrosit. Pada proses pematangannya retikulosit akan kehilangan mitokondria yang menghasilkan energi melalui fosforilasi oksidatif dan kehilangan ribosom yang merupakan tempat sintesis protein, sehingga membentuk eritrosit matang.
2.2.2. Hubungan efektivitas eritropoiesis dan retikulosit
Efektivitas eritropoiesis dapat diperkirakan dengan melihat hitung retikulosit. Persentase retikulosit terhadap eritrosit merupakan hitung retikulosit relatif. Jumlah retikulosit per unit darah merupakan hitung retikulosit absolut.29
Eritropoiesis inefektif dicurigai bila hitung retikulosit normal atau hanya meningkat sedikit tetapi terdapat hiperplasia eritroid pada sumsum tulang. Eritropoiesis inefektif terjadi pada beberapa penyakit seperti anemia pernisiosa, thalassemia, dan anemia sideroblastik.29
Pembagian tingkat maturitas retikulosit pertama kali dilakukan oleh Heilmeyer tahun 1932, yang membagi maturitas retikulosit menjadi 4 kategori. Pembagian ini berdasarkan hasil pemeriksaan mikroskopik dengan pewarnaan supravital menggunakan brilliant cresyl blue.30,35 Retikulosit stadium 1 memiliki presipitat besar dan padat, stadium 2 memiliki presipitat agak padat, stadium 3 presipitat lebih renggang sedangkan retikulosit matur atau stadium 4 hanya memiliki sedikit presipitat berupa titik atau terlihat seperti benang pendek.36 Tingkat maturitas ini berguna untuk menilai aktivitas eritropoiesis, namun pembagian berdasarkan pemeriksaan mikroskopik ini tidak teliti (not reproducible) dan memiliki variasi besar antar pengamat sehingga tidak digunakan dalam aplikasi klinis. Penggunaan alat hitung automatik dengan flowsitometri untuk melihat tingkat maturitas retikulosit memberikan hasil yang lebih teliti.30,35
2.2.3. Pemeriksaan retikulosit automatik
Pemeriksaan retikulosit menggunakan zat warna fluoresens pertama kali dilaporkan oleh Kozenow dan Mai pada awal tahun 1950-an dengan menggunakan acridine orange yang mewarnai RNA/DNA. Pemeriksaan retikulosit automatik dengan flowsitometri memberikah hasil yang lebih cepat, objektif, teliti dan mudah dibandingkan dengan pemeriksaan manual. Di samping itu pemeriksaan automatik dapat memberikan gambaran distribusi maturitas retikulosit.7
Alat hitung sel darah automatik yang berbeda menggunakan reagen dan teknik yang berbeda dalam menghitung retikulosit. Penggunaan zat warna new methylene blue yang mewarnai RNA retikulosit dipakai pada alat hitung sel darah automatik dari Beckman Coulter (STKS, MAXM, dan GEN-S) dan Abbott (Cell-Dyn 3500 dan 3700). Sedangkan penggunaan fluorokrom seperti polymethine, dipakai oleh alat Sysmex, auramin-O dipakai alat sysmex seri R, oxazine 750 dipakai alat Bayer Advia 120 Technicon, CD4K530 dipakai Abbott (Cell-Dyn 4000), dan thiazole orange dipakai alat ABX.5,37
Analisis retikulosit dengan flowsitometri dilakukan dengan mencampur darah EDTA dengan zat warna fluoresens, diinkubasi pada ruang gelap dalam suhu ruang selama beberapa detik. Zat warna fluoresens masuk melalui membran sel, mewarnai RNA retikulosit dan DNA/RNA sel berinti sehingga menimbulkan fluoresensi setelah penyinaran oleh sinar laser.5,7
Hitung retikulosit dilakukan melalui dua tahap. Tahap pertama adalah tahap isolasi retikulosit yaitu pemisahan retikulosit dari eritrosit, leukosit dan trombosit. Hasil tahap ini dapat dilihat pada sitogram 2 dimensi dengan sumbu Y merupakan forward scatter yang menunjukkan fungsi ukuran sel dan sumbu x merupakan side scatter yang menunjukkan serapan dari fluoresensi. Tahap kedua adalah gated electronic yaitu sinyal fluoresens dipresentasikan menjadi histogram1 dimensi yang menunjukkan banyaknya fluoresens atau light scattered terhadap jumlah sel.5,7,37-39
Berdasarkan derajat fluoresensi, retikulosit dibagi menjadi 3 subpopulasi yaitu retikulosit imatur memiliki kandungan RNA paling banyak sehingga memancarkan intensitas fluoresensi paling kuat (high fulorescent ratio, HFR),
sehingga memancarkan intensitas fluoresensi medium (medium fluorescent ratio, MFR), dan retikulosit matur hanya mengandung sedikit RNA sehingga intensitas fluoresensinya rendah (low flourescent ratio, LFR). Immature reticulocyte
fraction (IRF) merupakan gabungan nilai MFR dan HFR.5,7,37 Immature
reticulocyte fraction merupakan penanda dini dan sensitif terhadap aktivitas eritropoiesis.38,39
Berdasarkan penelitian Wirawan tahun 2006 menggunakan Sysmex XT 2000i didapatkan nilai rujukan retikulosit untuk orang dewasa di Indonesia adalah 0,5–2,0% untuk hitung retikulosit relatif, hitung retikulosit absolut lelaki 24.000-110.000/μL, perempuan 24.000–95.000/μL, dan nilai rujukan IRF perempuan dan lelaki 1,4–14,6%, LFR 85,4-98,6%, MFR 1,3-12.0%, dan HFR 0-3,1%.5
2.3. Kerangka teori
Pembawa sifat thalassemia-β atau HbE
Destruksi prekursor eritrosit intramedular Eritropoiesis inefektif Absorpsi besi enterosit ↑ Anemia Hipoksia Eritropoietin Hemolisis ekstravaskular Globin ↓ Defisiensi besi Aktivitas eritropoiesis ↑ Feritin seurm ↓ Saturasi transferin ↓ Hepsidin ↓ Rubriblas Prorubrisit Rubrisit Metarubrisit HFR MFR LFR Eritrosit IRF Pelepasan simpanan besi dari makrofag dan
hati ↑ Besi di darah ↑ Feritin ↓ Heme ↓ Sintesis hemoglobin ↓ Aktivitas eritropoiesis ↓ + Rubriblas Prorubrisit Rubrisit Metarubrisit HFR MFR LFR Eritrosit IRF
Pembawa sifat thalassemia-β atau HbE Eritropoiesis inefektif Anemia Hemolisis ekstravaskular Defisiensi besi Aktivitas eritropoiesis ↑ Feritin serum ↓ Saturasi transferin ↓ Rubriblas Prorubrisit Rubrisit Metarubrisit HFR MFR LFR Eritrosit IRF Sintesis hemoglobin ↓ Aktivitas eritropoiesis ↓ + Rubriblas Prorubrisit Rubrisit Metarubrisit HFR MFR LFR Eritrosit IRF Keterangan:
BAB III
METODOLOGI PENELITIAN
3.1. Desain penelitian
Penelitian ini menggunakan desain potong lintang. Data dilaporkan dalam bentuk deskriptif analitik.
3.2. Tempat dan waktu penelitan
Subjek penelitian beserta data pendukung untuk mendapatkan profil maturitas retikulosit pada orang dewasa normal diperoleh dari populasi umum dan pasien uji kesehatan di RS Metropolitan Medical Center (MMC). Subjek penelitian beserta data pendukung untuk mengetahui profil maturitas retikulosit pada pembawa sifat thalassemia-β atau HbE diperoleh dari keluarga pasien thalassemia di Poliklinik Thalassemia RSCM. Penelitian dilaksanakan pada bulan Februari-November 2014.
3.3. Subjek penelitian
3.3.1. Subjek penelitian profil maturitas retikulosit pada orang dewasa normal
Subjek penelitian adalah lelaki dan perempuan yang melakukan pemeriksaan kesehatan (medical check up) di RS MMC dan populasi umum yang memenuhi kriteria masukan.
Kriteria masukan: 1. Usia 18-60 tahun
2. Dinyatakan sehat berdasarkan hasil anamnesis dan pemeriksaan fisik oleh dokter, hasil pemeriksaan penyaring hematologi, aktivitas alanine aminotransferase (ALT), kadar albumin, kadar kreatinin serum, c-reactive protein (CRP) dan feritin serum dalam batas rentang rujukan
thalassemia-β atau hemoboglin E
Subjek penelitian adalah keluarga pasien thalassemia mayor (thalassemia-β atau thalassemia-(thalassemia-β/HbE) di Poliklinik Thalassemia RSCM serta memenuhi kriteria masukan dan tolakan
Kriteria masukan 1. Usia 18-60 tahun
2. Bersedia mengikuti penelitian ini dan menandatangani informed consent
Kriteria tolakan
1. Menerima transfusi dalam 3 bulan terakhir 2. Hamil
3. Perdarahan
3.4. Besar sampel
Sampel diambil secara consecutive sampling sampai jumlah subjek terpenuhi. Besar sampel untuk profil maturitas retikulosit pada orang dewasa normal yang dapat digunakan sebagai nilai rujukan retikulosit ditetapkan berdasarkan kriteria dari Clinical and Laboratory Standards Institute (CLSI) yaitu minimal 120 subjek lelaki dan 120 subjek perempuan.
Tidak ada perhitungan besar sampel untuk subjek profil maturitas retikulosit pada pembawa sifat thalassemia-β atau HbE. Besar sampel ditentukan sebesar 100 subjek dan pengolahan data dilakukan secara deskriptif.
3.5. Batasan operasional
a. Usia dihitung berdasarkan tanggal lahir yang tercantum pada kartu identitas yaitu kartu tanda penduduk (KTP), dinyatakan dalam tahun b. Lelaki dan perempuan dilihat dari KTP
c. Pemeriksaan untuk nilai rujukan terdiri dari pemeriksaan penyaring yaitu hemoglobin, VER, HER, KHER, leukosit, serta pemeriksaan aktivitas ALT, kadar albumin, kreatinin serum, feritin dan CRP. Kadar hemoglobin >12 g/dL. Kadar VER 82-92 fL. Kadar HER 27-31 pg. Kadar KHER 32-36 g/dL. Jumlah leukosit 5.000-10.000/μL. Kreatinin serum dalam batas
nilai rujukan bila pada lelaki 0,67-1,17 mg/dL dan perempuan 0,51-0,95 mg/dL.40 Aktivitas ALT dalam batas rentang rujukan bila pada lelaki <41 U/L dan perempuan <33 U/L.41 Kadar albumin dalam batas rentang rujukan bila 3,5-5,2 g/dL.42 Kadar CRP dalam batas rentang rujukan bila <5 mg/L.43 Kadar feritin serum dalam batas rentang rujukan bila 15-300 µg/L.44
d. Defisiensi besi ditentukan berdasarkan: - Saturasi transferin <20%45, dan - Feritin serum ≤15 ng/mL46
e. Diagnosis pembawa sifat thalassemia-β atau HbE ditentukan berdasarkan hasil pemeriksaan elektroforesis hemoglobin sebagai berikut:47-49
- Pembawa sifat Thalassemia-β: HbA2 3,5-7% - Pembawa sifat HbE: HbE 25-40%
f. Fraksi retikulosit terdiri dari: LFR, MFR, HFR, dan IRF
3.6. Bahan penelitian dan cara kerja
Bahan penelitian berupa 3 mL darah tripotassium ethylene diamine tetra acetate (K3EDTA) dan 3 mL darah yang ditampung dalam tabung vakum clot activator yang diambil dari vena cubiti.
Cara kerja untuk profil maturitas retikulosit pada orang dewasa normal, popilasi umum dan peserta uji kesehatan (medical checkup) diberi penjelasan mengenai penelitian, kemudian diminta kesediaannya untuk mengisi dan menandatangani lembar informed consent kemudian dilakukan pengambilan darah dari vena cubiti, sebanyak 6 mL. Tiga milliliter darah dimasukkan ke dalam tabung vakum K3EDTA untuk pemeriksaan darah perifer lengkap, hitung retikulosit dan fraksinya, dan 3 mL dimasukkan ke tabung vakum yang mengandung clot activator untuk pemeriksaan kreatinin, ALT, albumin, CRP, dan feritin.
Cara kerja untuk penelitian profil maturitas retikulosit pada pembawa sifat thalassemia-β atau HbE, keluarga dari pasien thalassemia mayor diberi penjelasan mengenai penelitian kemudian diminta kesediaannya untuk mengisi dan menandatangani lembar informed consent. Selanjutnya ditanyakan hubungan
hanya orang tua dan saudara kandung pasien thalassemia mayor. Kemudian dilakukan pengambilan darah dari vena cubiti sebanyak 6 ml, yang terdiri dari 3 mL ke dalam tabung K3EDTA dan 3 mL ke tabung clot activator. Darah K3EDTA digunakan untuk pemeriksaan darah perifer lengkap, hitung retikulosit dan fraksinya, serta elektroforesis hemoglobin. Serum dari darah dalam tabung
clot activator digunakan untuk pemeriksaan saturasi transferin, feritin serum, dan CRP.
3.7. Alur penelitian
1. Pemeriksaan profil maturitas retikulosit pada orang dewasa normal
Peserta uji kesehatan atau populasi umum
Informed consent
6 mL darah
Hb, VER, HER, KHER, leukosit, ALT, albumin, kreatinin serum
dalam rentang rujukan Hb, VER, HER, KHER, leukosit,
ALT, albumin, kreatinin serum di luar rentang rujukan
Sampel ditolak
Dalam rentang rujukan Di luar rentang rujukan
Analisis data retikulosit dan fraksinya
3 mL darah K3EDTA 3 mL darah beku
Pemeriksaan Hb, VER, HER, KHER, leukosit, retikulosit
dan fraksinya
Pemeriksaan CRP, feritin serum Sisa serum disimpan pada -200C
Sampel ditolak Pemeriksaan ALT, albumin,
kreatinin serum serum Dinyatakan sehat berdasarkan
anamnesis dan pemeriksaan fisik
Dinyatakan tidak sehat berdasarkan anamnesis dan pemeriksaan fisik
2. Pemeriksaan parameter retikulosit pada pembawa sifat thalassemia-β atau hemogobin E
3.8. Pemeriksaan
3.8.1. Pemeriksaan pendahuluan
Sebelum penelitian, dilakukan kalibrasi dan kontrol pada alat hitung sel darah automatik Sysmex XN-2000. Selanjutnya dilakukan uji ketelitian within run
dan between day serta uji ketepatan menggunakan bahan kontrol XN-check
dengan nilai normal, agak tinggi, dan tinggi. Uji ketelitian within run
menggunakan bahan kontrol dilakukan sebanyak 5 kali berturut-turut pada hari yang sama. Uji ketelitian between days dilakukan selama 5 hari berturut-turut selama penelitian berlangsung. Uji ketepatan dilakukan setiap hari selama penelitian berlangsung. Selain itu juga dilakukan uji ketelitian within run menggunakan darah K3EDTA segar dengan nilai rendah, normal dan tinggi
Keluarga pasien thalassemia mayor (thalassemia-β atau thalassemia-β/HbE)
Informed consent
Pemeriksaan hemoglobin, VER, HER, KHER, retikulosit dan fraksinya, elektroforesis hemoglobin
Disimpan pada -200C 6 mL darah
3 mL darah K3EDTA 3 mL darah beku
Pemeriksaan saturasi transferrin, feritin serum, CRP Memenuhi kriteria masukan dan tolakan
Pembawa sifat thalassemia-β atau HbE
Ya Tidak
sebanyak 5 kali. Parameter yang dinilai adalah CV dan d dari HRR, HRA, IRF, HFR, MFR, dan LFR. relatif dan absolut.
3.8.2. Pemeriksaan retikulosit
Pemeriksaan hemoglobin, retikulosit, LFR, MFR, HFR dan IRF50
Alat
1. Alat hitung sel darah automatik Sysmex XN-2000 2. Tabung K3EDTA
Bahan : Darah K3EDTA
Reagen
1. Cellpack DCL: berisi sodium chloride 0,7%, Tris buffer 0,2%, EDTA-2K 0,02%. Reagen ini merupakan diluen dan digunakan untuk menghitung jumLah dan ukuran eritrosit dan trombosit dengan hydrodynamic focusing
(DC detection).
2. Cellpack DST: berisi sodium chloride 15,7%, Tris buffer 4,3%, EDTA-2K 0,4%. Reagen ini merupakan diluen terkonsentrasi dan digunakan untuk menghitung jumlah dan ukuran eritrosit dan trombosit dengan hydrodynamic focusing (DC detection).
3. Cellpack DFL: berisi Tricine buffer 0,17%. Reagen ini merupakan diluen dan digunakan bersama dengan Fluorecell RET untuk menganalisis retikulosit, atau bersama dengan Fluorecell PLT untuk menganalisis trombosit, dengan metode flowsitometri.
4. Sulfolyser: berisi sodium lauryl sulfate 1,8%. Reagen ini digunakan untuk menghitung konsentrasi hemoglobin
5. Lysercell WNR: berisi organic quatermary ammonium salts 0,2%, nonionic surfactant 0,1%. Reagen ini digunakan bersama dengan Fluorocell WNR untuk menganalisis hitung leukosit, basofil, dan eritrosit berinti. Lysercell digunakan untuk menghemolisis eritrosit.
ini digunakan untuk mewarnai sel berinti sehingga menghitung leukosit, basofil dan eritrosit berinti.
7. Fluorocell RET: berisi polymethine dye 0,03%, metanol 7,9%, etilen glikol 92%. Reagen ini digunakan untuk mewarnai retikulosit sehingga dapat menghitung retikulosit.
8. Fluorocell PLT: berisi oxazine dye 0,003%, etilen glikol 99,9%. Reagen ini digunakan untuk mewarnai trombosit sehingga dapat menghitung trombosit 9. Cellclean: berisi sodium hypochlorite (konsentrasi chlorine 5%). Reagen ini
merupakan detergen dan digunakan untuk membersihkan residu selular dan protein darah dari sistem hidrolik, detektor, dan tabung aspirasi darah utuh.
Bahan Kontrol
Bahan kontrol XN check 3 level
1. XN-check level 1 (no lot. 41951101), ED 05-10-2014 2. XN-check level 2 (no lot. 41951102), ED 05-10-2014 3. XN-check level 3 (no lot. 41951103), ED 05-10-2014
Prinsip pemeriksaan retikulosit
Retikulosit dianalisis menggunakan metode flowsitometri dengan laser semikonduktor. Bahan pemeriksaan darah EDTA sebanyak 5 μL dihisap ke dalam alat, kemudian diencerkan dengan Cellpack DFL sebanyak 1 mL, dan dikirim ke reaction chamber. Pada saat bersamaan 20 μL Fluorecell RET ditambahkan ke dalam darah yang telah diencerkan sebelumnya, sehingga terbentuk pengenceran 1:204. Setelah diinkubasi 27 detik darah yang telah diencerkan terwarnai. Untuk pewarnaan retikulosit dipakai zat warna fluorokrom yaitu polymethine yang mewarnai RNA retikulosit. Sebanyak 3.3 μL darah yang telah terwarnai dikirimkan ke optical detector block untuk dianalisis secara
flowcytometry by semi-conductor laser. Menghasilkan diagram 2 dimensi foward scatte dan side fluorescence. Retikulosit yang telah diwarnai berjalan pada
aperture yang disinari laser dan menghasilkan fluoresensi. Forward scatter light