commit to user
27 BAB IV
HASIL DAN PEMBAHASAN
A. Isolasi Bakteri Rizosfer dari Tanaman Jagung (Zea mays) Matrik tanah merupakan tempat perkembangan akar tanaman, produksi eksudat akar tumbuhan yang umumnya banyak mengandung senyawa karbon, dan tempat pertumbuhan makro dan mikro biota tanah. Isolasi bakteri dilakukan di rizosfer tanaman jagung yang terdapat dalam matriks tanah. Dengan mengambil bahan tanah di sekitar perakaran, diharapkan diperoleh bakteri tanah dengan keragaman yang cukup tinggi. Penentuan isolat bakteri berdasarkan warna koloni, bentuk tepian, bentuk koloni, dan elevasi (Tabel 3.).
Tabel 3. Morfologi koloni bakteri rizosfer dari tanaman jagung (Zea mays).
No. Kode Isolat Bakteri Ciri-Ciri Koloni Warna
koloni Bentuk Tepian Elevasi
Kecamatan Selogiri
1 S1 Putih Bundar Licin Datar
S2 Putih keruh
Bundar dengan tepian timbul
Tak
beraturan Datar
S3 Putih Bundar Licin Datar
S4 Putih bening Bundar Licin Timbul
S5 Putih Bundar Licin Timbul
S6 Putih Konsentris
Tak
beraturan Datar S7 Putih keruh
Tak beraturan
dan menyebar Berombak Berbukit
S8 Kuning Bundar Licin Datar
S9 Merah muda Bundar Licin Timbul
S10 Putih
Tak beraturan
dan menyebar Licin Berbukit S11 Putih keruh
commit to user Tabel 3. Lanjutan. No. Kode Isolat Bakteri Ciri-Ciri Koloni Warna
koloni Bentuk Tepian Elevasi
Kecamatan Selogiri
S12 Transparan Rizoid
Seperti ikal
rambut Berbukit S13 Putih susu Keriput Berombak Berbukit
S14 Putih Bundar Licin Berbukit
Kecamatan Wuryantoro
2 W1 Putih bening Bundar Licin Datar
W2 Putih bening Bundar Licin Cembung
W3 Putih Tak beraturan Berombak Datar W4 Putih susu
Tak beraturan
dan menyebar Berlekuk Datar
W5 Putih Bulat Berlekuk Datar
W6 Putih bening Bundar Licin Timbul
W7 Transparan Bundar Berombak Licin
W8 Putih keruh Bundar Licin Datar
W9 Transparan Bundar Licin Timbul
W10 Putih susu Bundar Licin Timbul
W11 Transparan Bundar Licin Datar
W12 Putih susu
Tak beraturan
dan menyebar Berombak Berbukit W13 Putih keruh Bundar
Tak
beraturan Timbul
W14 Kuning
Tak beraturan
dan menyebar Berlekuk Datar W15 Putih keruh Tak beraturan Licin Timbul W16 Putih susu Konsentris Berlekuk Timbul
W17
Putih transparan
Bundar dengan
tepian timbul Licin Datar W18 Putih bening Konsentris Licin Datar
W19 Kuning
Tak beraturan
dan menyebar Berombak Timbul W20 Putih pudar Tak beraturan Licin Timbul
commit to user Tabel 3. Lanjutan. No. Kode Isolat Bakteri Ciri-Ciri Koloni Warna
koloni Bentuk Tepian Elevasi
Kecamatan Eromoko 3 E1 Putih bening
Bundar dengan
tepian timbul Licin Timbul E2 Putih bening
Bundar dengan
tepian timbul Berombak Timbul E3 Putih susu Bundar Berombak Datar E4 Putih susu Konsentris Licin Timbul E5 Putih bening
Bundar dengan
tepian timbul Berombak
Seperti tombol
E6 Putih Bundar Licin Cembung
E7 Putih Konsentris Berombak
Seperti tombol
E8
Putih
transparan Konsentris Berombak
Seperti tombol
E9
Kuning
transparan Bundar Licin Cembung E10 Transparan Konsentris Berombak Timbul E11 Putih kuning Bundar Licin Cembung
E12 Putih Bundar Licin Datar
E13 Putih Bundar Berombak Timbul
E14
Putih
kekuningan Bundar Licin Datar
E15 Putih
Bundar dengan
tepian timbul Licin Cembung
E16 Putih Bundar Licin Cembung
E17 Putih
Tak beraturan
dan menyabar Berlekuk
Seperti tombol
E18
Putih
kekuningan Keriput Berombak Berbukit
E19
Putih transparan
Bundar dengan
tepian karang Berlekuk Berbukit
E20 Kuning
Tak beraturan
dan menyabar Berombak Berbukit
E21 Putih
Berbenang-benang Bercabang Berbukit
E22
Putih
kekuningan Rizoid
Seperti
commit to user
Sebanyak 56 isolat bakteri berhasil diisolasi. Ke-lima puluh enam isolat bakteri diberi notasi nama sesuai tempat pengambilan sampel. Sampel dari Kecamatan Selogiri terdapat 14 isolat dengan bentuk terbanyak yaitu bundar dan tepian licin. Kecamatan Wuryantoro terdapat 20 isolat dengan bentuk terbanyak bundar dan tepian licin dan dari Kecamatan Eromoko terdapat 22 isolat dengan bentuk terbanyak bundar dan tepian berombak. Berdasarkan data isolasi bakteri rizosfer bahwa jumlah isolat bakteri paling banyak di Kecamatan Eromoko.
Pengambilan sampel dilakukan di Kabupaten Wonogiri yaitu Kecamatan Selogiri, Wuryantoro, dan Eromoko. Sampel tanah diambil saat musim kemarau karena dimungkinkan akan diperoleh bakteri yang mampu hidup dalam kondisi kekurangan air. Kondisi tanah di ketiga kecamatan memiliki struktur yang keras dan pecah-pecah karena tanah mengalami kekurangan air. Suhu tanah ketiga kecamatan tersebut 38ºC dengan kelembaban 0%. Sumber air seperti sungai di sekitar tempat pengambilan sampel di Kecamatan Wuryantoro dan Eromoko mengalami kekeringan, sehingga mengalami kesulitan dalam pengairan. Selain itu, sistem penyiraman di Kecamatan Eromoko dilakukan selama satu bulan awal penanaman selanjutnya melalui sarana hujan. Oleh karena itu, dapat disimpulkan bahwa tanah ketiga kecamatan termasuk tanah kering.
Berdasarkan data di atas keanekaragaman bakteri di lahan kering cukup tinggi. Hal ini seperti ditunjukkan pada penelitian Kavamura et al. (2013) terdapatnya 74 isolat bakteri dari rizosfer Cereus jamaca, Melocactus
commit to user
sp., Pilosocereus gounellei di Brazil pada musim kering. Sebagian besar bakteri akan melakukan adaptasi dalam kondisi kurang menguntungkan yaitu dengan membentuk endospora atau kapsula.
commit to user
B. Seleksi Bakteri Toleran Kekeringan
Tahap seleksi bakteri toleran kekeringan dilakukan untuk menyeleksi bakteri-bakteri yang dapat bertahan dan tumbuh baik dalam kondisi cekaman kekeringan. Penentuan jumlah bakteri yang digunakan sebagai inokulum menggunakan larutan MacFarland 0,5. Larutan MacFarland 0,5 adalah standar kekeruhan yang diseragamkan untuk menghasilkan kepadatan bakteri 1,5 x 108 CFU/ml. Menurut Alikhani dan Mohamadi (2010) bahwa bakteri yang memiliki nilai Optical Density (OD) lebih besar dari 0,5 pada tekanan osmotik tertentu dikategorikan sebagai bakteri yang benar-benar toleran. Hasil seleksi bakteri toleran kekeringan dalam Tabel 4.
Tabel 4. Tingkat toleransi bakteri rizosfer dari tanaman jagung (Zea mays) pada media NB yang ditambahkan PEG 6000.
Kode Isolat Bakteri
Nilai Optical Density (OD) pada Tekanan Osmotik (MPa)
-1,0 -1,5 -2,0 Kecamatan Selogiri S 1 1,067 0,875 0,659 Sangat Toleran S 2 0,960 0,573 0,403 Toleran S 3 0,962 0,736 0,615 Sangat Toleran S 4 0,698 0,250 0,144 Sangat Sensitif S 5 1,090 0,983 0,942 Sangat Toleran S 6 0,765 0,759 0,491 Toleran S 7 0,475 0,283 0,112 Sangat Sensitif S 8 0,704 0,443 0,396 Sensitif S 9 0,606 0,550 0,309 Sensitif S 10 1,047 0,926 0,794 Sangat Toleran S 11 0,664 0,615 0,424 Toleran S12 0,738 0,729 0,491 Toleran S 13 0,575 0,566 0,336 Sensitif S 14 0,423 0,406 0,307 Sensitif Golongan
commit to user Tabel 4. Lanjutan.
Kode Isolat Bakteri
Nilai Optical Density (OD) pada
Tekanan Osmotik (MPa)
-1,0 -1,5 -2,0 Kecamatan Wuryantoro W 1 1,889 1,308 1,125 Sangat Toleran W 2 0,714 0,307 0,288 Sangat Sensitif W 3 1,280 0,972 0,584 Sangat Toleran W 4 1,065 0,860 0,788 Sangat Toleran W 5 0,656 0,559 0,545 Sangat Toleran W 6 0,545 0,501 0,207 Sangat Sensitif W 7 1,046 0,556 0,475 Toleran W 8 0,929 0,721 0,521 Sangat Toleran W 9 0,629 0,389 0,342 Sensitif W 10 0,905 0,668 0,249 Sangat Sensitif W 11 0,662 0,530 0,363 Sensitif W 12 1,355 0,994 0,940 Sangat Toleran W 13 0,749 0,663 0,102 Sangat Sensitif W 14 1,046 0,556 0,475 Toleran W 15 0,929 0,721 0,521 Sangat Toleran W 16 0,892 0,846 0,823 Sangat Toleran W 17 1,128 0,901 0,801 Sangat Toleran W 18 0,752 0,520 0,465 Toleran W 19 0,570 0,407 0,302 Sensitif W 20 1,000 0,876 0,817 Sangat Toleran Kecamatan Eromoko E 1 0,501 0,264 0,179 Sangat Sensitif E 2 0,539 0,387 0,221 Sangat Sensitif E 3 0,548 0,289 0,187 Sangat Sensitif E 4 0,741 0,312 0,179 Sangat Sensitif E 5 0,670 0,311 0,228 Sangat Sensitif E 6 0,714 0,528 0,204 Sangat Sensitif E 7 0,659 0,117 0,114 Sangat Sensitif E 8 0,549 0,386 0,114 Sangat Sensitif Golongan
commit to user Tabel 4. Lanjutan.
Kode Isolat Bakteri
Nilai Optical Density (OD) pada Tekanan Osmotik (MPa) -1,0 -1,5 -2,0 Kecamatan Eromoko E 9 0,627 0,495 0,123 Sangat Sensitif E 10 0,484 0,436 0,365 Sensitif E 11 0,673 0,265 0,212 Sangat Sensitif E 12 0,724 0,543 0,483 Toleran E 13 0,590 0,481 0,461 Toleran E 14 1,148 1,104 0,947 Sangat Toleran E 15 0,810 0,703 0,525 Sangat Toleran E 16 0,757 0,657 0,620 Sangat Toleran E 17 1,084 1,042 0,832 Sangat Toleran E 18 0,744 0,704 0,714 Sangat Toleran E 19 0,483 0,459 0,442 Toleran E 20 0,441 0,366 0,346 Sensitif E 21 0,563 0,439 0,331 Sensitif E 22 1,037 1,026 0,801 Sangat Toleran
Berdasarkan data tersebut dipilih 8 isolat bakteri terbaik dengan nilai OD tertinggi dari Kecamatan Selogiri isolat S yaitu S1, S2, S3, S5, S6, S10, S11, dan S12. Untuk isolat W dari Kecamatan Wuryantoro dipilih 10 isolat terbaik yaitu W4, W5, W7, W8, W14, W15, W16, W17, W18, dan W20, sedangkan untuk isolat E dari Kecamatan Eromoko dipilih 9 isolat terbaik yaitu E12, E13, E14, E15, E16, E17, E18, E19, dan E22 (Tabel 5.).
Di Kecamatan Wuryantoro diperoleh lebih banyak isolat yang bersifat toleran kekeringan pada uji toleransi kekeringan. Kondisi cekaman kekeringan diwujudkan dengan menambahkan poli etilen glikol (PEG) 6000 ke dalam media kultur.
commit to user
Tabel 5. Bakteri toleran dan sangat toleran yang diisolasi dari rizosfer tanaman jagung (Zea mays).
Kode Isolat Bakteri
Nilai Optical Density (OD) pada Tekanan Osmotik (MPa)
Strain -1,0 -1,5 -2,0 Kecamatan Selogiri S 1 1,067 0,875 0,659 Sangat Toleran S 2 0,960 0,573 0,403 Toleran S 3 0,962 0,736 0,615 Sangat Toleran S 5 1,090 0,983 0,942 Sangat Toleran S 6 0,765 0,759 0,491 Toleran S 10 1,047 0,926 0,794 Sangat Toleran S 11 0,664 0,615 0,424 Toleran S 12 0,738 0,729 0,491 Toleran Kecamatan Wuryantoro W 4 1,065 0,860 0,788 Sangat Toleran W 5 0.656 0,559 0,545 Sangat Toleran W 7 1,046 0,556 0,475 Toleran W 8 0,929 0,721 0,521 Sangat Toleran W 14 1,046 0,556 0,475 Toleran W 15 0,929 0,721 0,521 Sangat Toleran W 16 0,892 0,846 0,823 Sangat Toleran W 17 1,128 0,901 0,801 Sangat Toleran W 18 0,752 0,520 0,465 Toleran W 20 1,000 0,876 0,817 Sangat Toleran Kecamatan Eromoko E 12 0,724 0,543 0,483 Toleran E 13 0,590 0,481 0,461 Sangat Toleran E 14 1,148 1,104 0,947 Sangat Toleran E 15 0,810 0,703 0,525 Sangat Toleran E 16 0,757 0,657 0,620 Sangat Toleran E 17 1,084 1,042 0,832 Sangat Toleran E 18 0,744 0,704 0,714 Sangat Toleran E 19 0,483 0,459 0,442 Toleran E 22 1,037 1,026 0,801 Sangat Toleran
commit to user
Menurut Michel dan Kaufmann (1973) bahwa senyawa PEG bersifat larut dalam air dan menyebabkan penurunan potensial air. Media kultur dengan penambahan PEG 6000 menyebabkan media kultur menjadi lebih kental karena terjadinya penurunan tekanan potensial air. Potensial air dalam media yang mengandung PEG 6000 dapat digunakan untuk meniru besarnya potensial air tanah. Berdasarkan data di atas bahwa bakteri toleran diperoleh 9 isolat dan bakteri sangat toleran diperoleh 18 isolat. Toleran adalah suatu kondisi bakteri masih mampu bertahan hidup dan bertahan pada lingkungan kurang menguntungkan yaitu kekeringan. Selain itu, sensitif adalah keadaan bakteri tidak mampu bertahan hidup karena lingkungan tidak mendukung kehidupannya. Berdasarkan hasil seleksi bakteri toleran kekeringan bahwa rizobakteri mampu bertahan hidup hingga tekanan osmotik -2 MPa dengan OD ≤ 0,5.
Isolat E 14 memiliki nilai OD tertinggi setiap tekanan osmotik 1,0; -1,5; dan -2 MPa yaitu 1,148; 1,104; dan 0,947. Jadi semakin rendahnya tekanan osmotik, maka penambahan PEG 6000 semakin banyak. Oleh karena itu, nilai OD yang dihasilkan isolat E14 akan semakin menurun dengan menurunnya tekanan osmotik. Pada tekanan osmotik -2,0 MPa memiliki konsentrasi air yang lebih sedikit dibandingkan -1,0 MPa dan -1,5 MPa.
Beberapa isolat bakteri telah terbukti mampu bertahan dalam kondisi cekaman kekeringan. Hal ini dimungkinkan karena bakteri meminimalkan proses metabolisme, sehingga dapat menyimpan energi. Menurut Sandhya et
commit to user
dapat melindungi bakteri ketika kondisi tidak menguntungkan. Kapsula yang dihasilkan bakteri mampu melindungi dari cekaman kekeringan, dengan mengurangi penguapan atau keluarnya air dari membran luar bakteri.
commit to user
C. Seleksi Bakteri Potensial Penghasil Eksopolisakarida
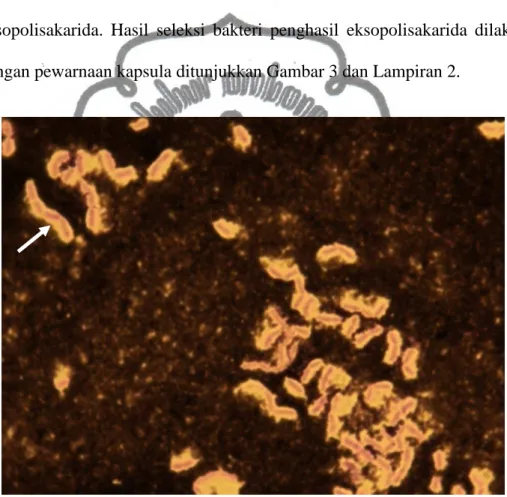
Tahap seleksi ini bertujuan untuk menyeleksi bakteri-bakteri yang dapat menghasilkan eksopolisakarida. Media ATCC no.14 digunakan untuk menyeleksi bakteri-bakteri penghasil eksopolisakarida. Media ini mengandung sumber sukrosa yang dapat digunakan bakteri untuk membentuk eksopolisakarida. Hasil seleksi bakteri penghasil eksopolisakarida dilakukan dengan pewarnaan kapsula ditunjukkan Gambar 3 dan Lampiran 2.
Gambar 3. Kapsula (tanda panah) pada bakteri isolat W14.
Berdasarkan gambar di atas bahwa eksopolisakarida yang dihasilkan bakteri memiliki bentuk kapsula. Kapsula akan mengelilingi seluruh membran luar bakteri (tanda panah). Menurut Wingender et al. (1999) bahwa eksopolisakarida sering ditemukan di sekeliling struktur membran sel luar,
commit to user
baik pada prokariota. Struktur fisik eksopolisakarida berupa kapsula sampai dengan dinding sel slime masif yang terbentuk di luar membran sel bakteri (Steinmetz et al., 1995). Selain itu, kapsula bakteri tidak dapat diwarnai dengan tinta cina seperti dilaporkan pada penelitian Vandevivere dan Baveye (1992). Pada gambar di atas bahwa kapsula bakteri tidak dapat terwarnai dan bakteri berwarna ungu karena terwarnai oleh kristal violet (Sulistyaningsih, 2008). Kapsula yang terbentuk memungkinkan bakteri dapat bertahan pada kondisi tidak menguntungkan yaitu kekeringan.
Berdasarkan pengujian pewarnaan kapsula didapatkan 11 isolat bakteri yang memiliki kemampuan menghasilkan eksopolisakarida berupa kapsula. Ke-sebelas isolat bakteri tersebut yaitu S1, S5, S10, W3, W4, W12, W14, W15, W16, W20, dan E15. Kemampuan bakteri bertahan terhadap cekaman kekeringan salah satunya dengan menghasilkan eksopolisakarida. Berdasarkan penelitian Ali et al. (2013) Psedomonas sp. yang diisolasi dari tanah kering dapat menghasilkan eksopolisakarida sebagai respon terhadap kekeringan.
Eksopolisakarida merupakan polimer dengan bobot molekul tinggi yang tersusun dari monosakarida dan beberapa bahan non karbohidrat seperti asetat, piruvat, suksinat, dan fosfat. Pembentukkan eksopolisakarida di daerah rizosfer dapat memberikan kelembaban, sehingga meningkatkan kapasitas menahan air (Sayyed et al., 2011). Selain itu, eksopolisakarida dapat meningkatkan perlekatan akar pada tanah (Chenu dan Guerif, 1991), sedangkan bagi bakteri dapat melindungi dari cekaman kekeringan dan
commit to user
cadangan energi potensial karena dapat dikatabolisme dibawah kondisi lingkungan kurang menguntungkan.
Pembentukan eksopolisakarida suatu proses pemanfaatan sumber karbon. Media ATCC no. 14 merupakan media selektif bakteri penghasil eksopolisakarida dengan memanfaatkan sukrosa sebagai sumber karbon (Santi
et al., 2008). Hal ini seperti penelitian Sayyed et al. (2011) bahwa sukrosa
menghasilkan biomassa eksopolisakarida maksimum sebesar 2,47 mg/ml dibandingkan dektrosa sebesar 1,50 mg/ml. Selain itu, sumber karbon glukosa menghasilkan eksopolisakarida lebih rendah dibandingkan sukrosa (Staudt, 2009).
Kapsula adalah lapisan terluar dari dinding sel dengan konsistensi yang berlendir. Selain itu, sifat dinding selnya sangat susah ditembus. Pada pewarnaan kapsula bakteri bahwa kapsula tidak dapat terwarnai sehingga berwarna putih. Oleh karena itu, kapsula bakteri dapat melindungi bakteri dari cekaman kekeringan dengan memberikan kondisi yang lembab. Menurut Roberson dan Fireston (1992) bahwa pembentukan eksopolisakarida akan semakin meningkat selama cekaman kekeringan sebagai mekanisme perlindungan bakteri Pseudomonas sp. terhadap berbagai tekanan. Selain itu, rizobakteri di perakaran gandum mampu mengatur kondisi stres terhadap kekeringan dengan memproduksi eksopoliskarida (Amellal et al., 1998). Pembentukkan matriks eksopolisakarida disekitar koloni akan memperlambat proses pengeringan sehingga menyediakan waktu untuk penyesuaian metabolisme bakteri.
commit to user
Eksopolisakarida yang dihasilkan bakteri mampu membentuk struktur yang disebut biofilm. Biofilm merupakan komunitas bakteri dimana sel-sel yang hidup dalam matriks senyawa ekstraseluler polimer yang melekat pada permukaan (Branda et al., 2005). Pembentukan biofilm di sekitar perakaran tomat mampu melindungi akar tanaman tomat dari serangan patogen (Haggag, 2012). Selain itu, biofilm mampu melindungi bakteri terhadap cekaman kekeringan. Dengan mempertahankan air di dalam lingkungan mikrosel karena sifat biofilm yang higroskopis atau kemampuannya mempengaruhi arsitektur biofilm yang membantu mengurangi kehilangan air yang berlebihan selama penguapan (Mager, 2010).
Menurut Timmusk dan Wagner (1999) bahwa inokulasi Paenibacillus
polymyxa dapat menginduksi gen responsif kekeringan sehingga dapat
melindungi Arabidopsis thaliana dari kekeringan. Selain itu, Paenibacillus
polymyxa mampu mengkolonisasi perakaran Arabidopsis thaliana dengan
membentuk biofilm. Biofilm ini berfungsi sebagai lapisan pelindung untuk mencegah patogen dan terlibat dalam toleransi cekaman kekeringan (Timusk
commit to user
D. Uji Produksi Indol Acetic Acid (IAA)
Uji kemampuan bakteri dalam memproduksi IAA dilakukan dengan dua perlakuan tanpa dan ditambahkan prekursor L-triptofan pada media kultur. Reagen Salkowski yang digunakan dapat mendeteksi keberadaan senyawa-senyawa antara dalam sintesis IAA seperti triptofan, triptamin, indol etanol, asam indol piruvat, dan indol asetamida (Glickman dan Dessaux, 1995). Produksi IAA ditunjukkan oleh adanya perubahan warna supernatan yang ditambahkan reagen Salkowski (Tabel 6.).
Tabel 6. Reaksi perubahan warna bakteri rizosfer yang termasuk penghasil IAA. No. Kode Isolat Bakteri
Reaksi Perubahan Warna
Hasil
Sebelum Sesudah
Kecamatan Selogiri
1 S1 Kuning Bening Kuning Bening -
S5 Kuning Bening Kuning Bening - S10 Kuning Bening Kuning Bening - Kecamatan Wuryantoro
2 W3 Kuning Bening Kuning Bening -
W4 Kuning Bening Kuning Bening - W12 Kuning Bening Kuning Bening -
W14 Kuning Bening Merah muda +
W15 Kuning Bening Kuning Bening - W16 Kuning Bening Kuning Bening - W20 Kuning Bening Kuning Bening - Kecamatan Eromoko
3 E15 Kuning Bening Kuning Bening -
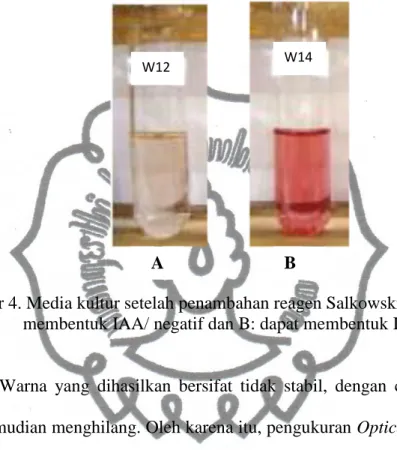
Dari sebelas isolat bakteri yang diuji hanya terdapat satu isolat bakteri yang memiliki kemampuan mensintesis IAA. Isolat bakteri kode W14 mampu mensintesis IAA ditunjukkan dengan terbentuknya warna merah muda
commit to user
(Gambar 4.). Nilai negatif menunjukkan bahwa bakteri tidak mampu memproduksi IAA, sedangkan nilai + menunjukkan bakteri mampu memproduksi IAA ditandai dengan perubahan warna.
Berdasarkan data diatas (Tabel 6.) bahwa bakteri penghasil IAA di tanah kering umumnya lebih rendah. Hal ini seperti ditunjukkan pada penelitian Kavamura et al. (2013) bahwa hanya 7 dari 74 isolat bakteri rizosfer yang mampu menghasilkan hormon IAA. Selain itu, produksi hormon IAA mengalami penurunan dalam kondisi cekaman kekeringan (Sandhya et al., 2010).
Tabel 7. Produksi IAA isolat bakteri W14. No.
Kode
Isolat Konsentrasi IAA (ppm)
L-Triptofan Tanpa L-Triptofan
1 W14 0,934 0,445
Konsentrasi IAA yang dihasilkan media inkubasi dengan penambahan L-triptofan 0,934 ppm dan tanpa L-triptofan 0,445 ppm (Tabel 7.). Oleh karena itu, isolat bakteri yang ditumbuhkan dalam kultur yang ditambahkan L-triptofan umumnya lebih mampu memproduksi IAA. Hal ini diperlihatkan dengan terbentuknya warna merah yang lebih pekat karena dimungkinkan L-triptofan terdapat dalam jumlah banyak di dalam medium dan terakumulasi menjadi asam indol piruvat.
Selain itu, isolat bakteri yang tidak diinduksi L-triptofan mampu mensintesis IAA. Hal ini terjadi karena L-triptofan merupakan prekursor biosintesis IAA. Isolat W14 mampu memproduksi IAA tanpa penambahan
L-commit to user
triptofan dikarenakan isolat bakteri tersebut memiliki kemampuan mensintesis L-triptofan di dalam selnya.
Gambar 4. Media kultur setelah penambahan reagen Salkowski, A: tidak dapat membentuk IAA/ negatif dan B: dapat membentuk IAA/ positif.
Warna yang dihasilkan bersifat tidak stabil, dengan cepat terbentuk, dan kemudian menghilang. Oleh karena itu, pengukuran Optical Density (OD) dilakukan dengan cepat karena produksi IAA akan berhenti jika terkena cahaya. Menurut Gordon dan Weber (1950) bahwa memudarnya warna pada dasarnya dapat dideteksi dengan mengadopsi standar waktu antara penambahan pereaksi dan pembacaan absorbansi.
Pada bakteri penghasilnya, IAA yang dihasilkan tidak digunakan sebagai hormon pertumbuhan bagi selnya, tetapi IAA tersebut umumnya sebagai interaksi antara bakteri dan tanaman. IAA terdapat di akar dan bagian tumbuhan lainnya dalam konsentrasi yang hampir sama. Tumbuhan mungkin tidak mensintesis IAA dalam jumlah cukup untuk pertumbuhan optimalnya,
W14 W12
B A
commit to user
sehingga pemberian IAA dapat memacu pemanjangan akar. Konsentrasi yang diproduksi sangat rendah (10-7 - 10-9, bergantung pada spesies dan umur akar) (Salisbury dan Ross, 1992).
commit to user E. Uji Kelarutan Fosfat
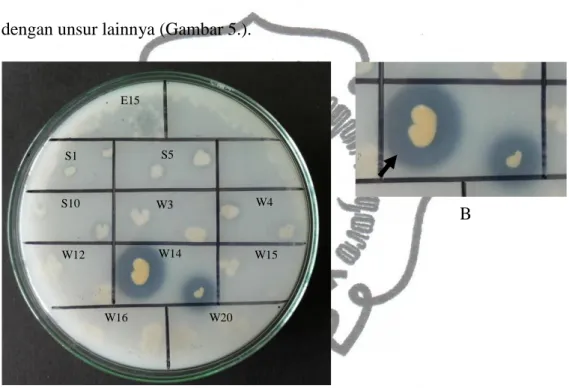
Pada pengujian kelarutan fosfat digunakan media Pikovskaya yang merupakan salah satu media selektif bakteri pelarut fosfat. Fosfat di dalam media Pikovskaya berikatan dengan kalsium, adanya zona bening yang terbentuk mencirikan adanya aktivitas melarutkan dan memecah ikatan fosfat dengan unsur lainnya (Gambar 5.).
Gambar 5. A: Zona bening pelrutan fosfat isolat bakteri W14,
B: Zona bening pelarutan fosfat isolat bakteri W14 (diperbesar).
Dari sebelas isolat bakteri yang diuji, hanya satu isolat bakteri yang memiliki kemampuan dalam melarutkan fosfat yaitu isolat bakteri W14 (Gambar 5.). Pada isolat bakteri lain tidak terlihat adanya zona bening. Hal ini dimungkinkan karena perbedaan asam organik yang diproduksi setiap isolat bakteri atau isolat bakteri tersebut tidak menghasilkan asam organik yang dapat melarutkan fosfat. Setiap jenis asam organik dimungkinkan memiliki
S1 S5 S10 W3 W4 W12 W14 W15 W20 E15 W16 A B
commit to user
kecocokan dan efektivitas dalam melepaskan ikatan fosfat. Fosfat dalam media Pikovskaya terikat dalam kalsium, dimungkinkan isolat bakteri lain tidak memiliki respon positif dalam melarutkan fosfat. Hasil penelitian Rachmiati (1995) bahwa setiap jenis bakteri pelarut fosfat mempunyai kemampuan berbeda secara genetik dalam menghasilkan jumlah jenis asam-asam organik yang berperan dalam menentukan tinggi rendahnya pelarutan fosfat.
Fosfat di dalam tanah sebagian besar terdapat dalam bentuk terikat dengan kation logam, sehingga tidak dapat dimanfaatkan oleh tanaman. Mikroba pelarut fosfat mempunyai kemampuan untuk melarutkan senyawa fosfat anorganik yang tidak larut seperti trikalsium fosfat, dikalsium fosfat, hidroksiapatit, dan batuan fosfat. Menurut Rodriguez dan Fraga (1999) bahwa
Pseudomonas spp., Bacillus spp., dan Rhizobium spp. adalah kelompok
bakteri pelarut fosfat yang potensial dalam meningkatkan ketersediaan fosfat bagi tanaman, terutama tanah yang mengandung banyak endapan fosfat.
Menurut Illmer dan Schinner (1995) bahwa proses pelarutan fosfat terjadi karena efektivitas bakteri pelarut fosfat mereduksi pH substrat dengan mensekresi sejumlah asam-asam organik (asam sitrat, asam glutamat, asam suksinat, asam laktat, asam oksalat, asam glikooksalat, asam malat, asam fumarat, asam tartarat, dan asam alfa ketobutirat) yang dihasilkan oleh mikroba tersebut dan berakibat pada terjadinya pelarutan P terikat. Asam-asam tersebut akan mengikat kation dalam bentuk kompleks yang stabil dengan Ca2+, Mg2+, Fe3+, dan Al3+ (Rao, 1994).