KAJIAN
Ulva
sp. SEBAGAI SUPLEMEN PAKAN
TERHADAP PERFORMA PERTUMBUHAN DAN RESPON IMUN
NON-SPESIFIK IKAN NILA (
Oreochromis niloticus
)
STUDY OF Ulva sp. AS FEED SUPPLEMENT TOWARDS GROWTH
PERFORMANCES AND NON-SPECIFIC IMMUNE
RESPONSE OF TILAPIA (Oreochromis niloticus)
Esti Harpeni, Limin Santoso, Winda Rohaila Sari,dan Duma Oktorina Purba
Program Studi Budidaya Perairan, Fakultas Pertanian, Universitas Lampung, Indonesia Email: edypeni@yahoo.com
Registrasi: 17 Maret 2015; Diterima setelah perbaikan: 18 April 2015; Disetujui terbit: 11 Juni 2015
ABSTRAK
Peningkatan produksi melalui intensifikasi sistem budidaya menyebabkan peningkatan penggunaan pakan buatan. Pakan buatan yang baik harus memiliki kecukupan nutrisi bagi pertumbuhan optimum ikan selain juga meningkatkan resistensi terhadap penyakit. Penggunaan suplemen pakan menjadi penting dilakukan untuk memperoleh panen yang maksimal. Penggunaan algae sebagai suplemen pakan telah diketahui cukup potensial sebagai sumber protein dan metabolit sekunder melawan patogen. Namun, pengaruh pakan dengan penambahan algae terhadap pertumbuhan dan ketahanan tubuh ikan mungkin bervariasi tergantung pada jenis algae dan ikannya. Oleh karena itu, penelitian ini dilakukan untuk mengkaji pengaruh pemberian suplemen pakan Ulva sp. terhadap performa pertumbuhan dan respon imun non-spesifik ikan nila. Penelitian dilakukan dengan perlakuan 5 perlakuan dan 3 ulangan, A: Suplementasi Ulva sp. 0% pakan; B: 4% pakan; C: 8% pakan; D: 12 % pakan; dan E: 16% pakan. Hasil penelitian ini menunjukkan adanya peningkatan performa pertumbuhan dan respon imun non spesifik. Perubahan level jaringan ke level berat terjadi seiring dengan peningkatan dosis suplementasi Ulva sp. pada pakan. Suplementasi dengan dosis 4% pakan merupakan perlakuan terbaik. KATA KUNCI: Nila, pertumbuhan, respon imun non-spesifik,suplementasi, Ulva sp.
ABSTRACT
Increasing of production through intensification of aquaculture system has caused increase in the utilization of artificial feed. The good quality of artificial feed should have enough nutrition for optimal growth of fish, besides increasing its resistance against pathogens. Use of feed supplement being important to do for maximazing products. Use of algae as feed supplement has been known as a source of protein dan secondary metabollites against pathogens. However, the effect of feed by adding algae towards growth and immunity of fish could be varies depend on species of the algae and fish. Therefore, this research was conducted to study the effect of feed supplementation of Ulva sp. towards growth performance and non-specific immune response of tilapia. This study was using 5 treatments in triplicate, i.e. A: Ulva sp. Supplementation 0% of feed; B: 4% of feed; C: 8% of feed, D: 12% of feed; and E: 16% of feed. The result showed that there were increase of growth performance and non-specific immune response of tilapia. The changes of histology to heavy
66
level was happened as increaseing doses of Ulva sp. supplementation into the feed. The best supplementation doses was 4% of feed.
KEYWORDS: growth, non-specific immune respons, supplementation, tilapi , Ulva sp.
1.PENDAHULUAN
Budidaya ikan secara intensif yang banyak dilakukan di Indonesia, sangat tergantung pada pakan untuk
meningkatkan produksi ikan.
Kebutuhan nutrisi ikan sebagai faktor
penentu pertumbuhan sangat
tergantung pada pakan. Pada sistem budidaya intensif, pakan buatan sangat berperan penting daripada pakan alami karena ketersediaannya yang memadai. Pakan buatan dengan nilai nutrisi yang baik didapatkan dari suplemen pakan. Suplemen pakan pada pakan buatan diketahui mampu meningkatkan daya
dukung sistem budidaya (Devaraj et al.,
1976) sekaligus mempersingkat waktu
budidaya (Sahzadi et al., 2006).
Beberapa suplemen pakan (faktor nutrisi) juga diketahui memiliki fungsi
sebagai imunostimulan (Cook et al.,
2003). Imunostimulan dalam budidaya ikan memungkinkan upaya pencegahan penyakit infeksi yang lebih hemat waktu, biaya dan tenaga dibandingkan vaksinasi. Upaya pencegahan dengan
imunostimulan juga lebih efektif
daripada pengobatan, seperti
pengobatan dengan antibiotik, yang
beresiko tingginya kematian dan
akumulasi residu dalam jaringan ikan. Berbagai jenis algae diketahui mampu dijadikan sebagai alternatif sumber
protein selain sebagai sumber
komponen bioaktif yang memproduksi metabolit sekunder melawan patogen
pada ikan (Mahasneh et al., 1995; De
Val et al., 2001; Liao et al., 2003). Penggunaan algae sebagai suplemen pakan ditujukan untuk meningkatkan pertumbuhan dan efisiensi pencernaan
pakan, selain itu juga untuk
meningkatkan resistensi terhadap
penyakit.
Ulva sp. merupakan algae merah
yang cukup potensial digunakan
sebagai suplemen pakan karena Ulva
sp. dilaporkan mengandung protein kasar 10-26% dari berat kering (Fleurence, 1999). Penelitian Wong and Cheung (2000) menunjukkan bahwa
Ulva lactuca juga mengandung semua
asam amino esensial kecuali
tryptophan. Asam amino esensial
diketahui sangat penting bagi
pertumbuhan ikan, peningkatan respon imun dan resistensi ikan terhadap sejumlah patogen secara simultan
(Burrells et al., 2001). Namun,
pengaruh pakan dengan penambahan
algae terhadap pertumbuhan dan
ketahanan tubuh ikan pada jenis algae dan ikan mungkin bervariasi. Oleh karena itu, penelitian ini dilakukan untuk mengkaji pengaruh pemberian
suplemen pakan Ulva sp. terhadap
performa pertumbuhan dan respon imun non-spesifik ikan nila.
2.BAHAN DAN METODE
Sebanyak 15 unit akuarium (5 perlakuan dan 3 ulangan) berukuran 50 x 40 x 40 cm digunakan dalam penelitian ini. Air sebanyak 60 liter diisi ke dalam akuarium tersebut dengan aerasi terus menerus. Ikan nila GIFT ukuran sekitar 10 cm yang digunakan dalam penelitian ini berasal dari BBI Probolinggo, Lampung Timur. Ikan diaklimatisasi terlebih dahulu selama satu minggu. Masing- masing akuarium berisi 5 ekor ikan. Selama masa aklimatisasi, ikan uji diberi pakan
67 berupa pellet yang diberikan pada pagi
dan sore hari.
Ulva sp. yang banyak ditemukan
menempel di bebatuan di sekitar Pantai Tebaka, Pesisir Barat, Lampung Barat, dikumpulkan untuk kemudian dibilas
dengan air tawar mengalir. Ulva sp.
kemudian dibungkus dengan plastik bening lalu dijemur di bawah sinar
matahari hingga kering. Ulva sp. juga
dioven pada suhu 60-700 C untuk
memastikan bahwa Ulva sp. kering
sempurna. Jika Ulva sp. sudah kering
sempurna, Ulva sp. digiling dan diayak
sampai halus (diameter ayakan 0,6 mm) untuk kemudian disimpan sampai waktu akan digunakan.
Berbagai sumber bahan pakan komersial (Tabel 1) digunakan dalam penelitian ini yaitu tepung ikan, tepung kedelai, tepung jagung, tepung gandum, minyak ikan, minyak jagung dan
premix. Lima tingkat perlakuan Ulva sp.
yang digunakan yaitu 0% (kontrol), 4, 8, 12 dan 16% dari formulasi pakan.
Bubuk Ulva sp. yang telah dipersiapkan
sebelumnya, dicampurkan ke dalam pakan hingga merata. Air dimasukkan ke dalam campuran pakan sebanyak 20% dari jumlah pakan lalu diaduk untuk membentuk pakan menjadi pelet.
Tabel 1. Komposisi pakan pada
berbagai tingkatan perlakuan
Ulva sp. yang digunakan
dalam Penelitian Bahan Perlakuan 0% 4% 8% 12% 16% Tepung ikan 35 34 31 28 25 Tepung kedelai 27 28 29 30 31 Ulva sp. 0 4 8 12 16 Tepung jagung 22 18 16 14 12 Tepung gandum 10 10 10 10 10 Minyak ikan 3 3 3 3 3 Minyak jagung 2 2 2 2 2 Premix 1 1 1 1 1 Total 100 100 100 100 100
Isolat Streptococcus iniae
diperoleh dari Balai Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas II Semarang. Sebelum proses infeksi dilakukan, isolat dikultur kembali selama 48 jam untuk mendapatkan isolat dengan kepadatan
108 CFU/ml.
Ikan diberi pakan dua kali sehari pukul 09.00 dan 16.00 WIB disesuaikan
dengan feeding rate (FR) 5% dari bobot
ikan. Pakan yang diberikan serta kotoran dan sisa pakan ditimbang setiap hari, sedangkan bobot ikan ditimbang setiap dua minggu sekali. Pemeliharaan ikan dilakukan selama 8 minggu.
Sampel darah diambil melalui
vena caudalis sebanyak 1,5 ml lalu
ditampung dalam microtube yang telah
dibilas dengan larutan EDTA 10%.
Pengambilan sampel darah ikan
dilakukan pada hari ke-0 (sebelum suplementasi Ulva sp.), hari ke-7, hari ke-14, dan hari ke-43. Pada hari ke-37
pemberian suplemen pakan Ulva sp.,
hewan uji diuji tantang dengan
menyuntikkan S. iniae secara
intramuscular dengan dosis 0,1 ml/ikan.
Perhitungan Specific Growth Rate
(SGR) sesuai Schram et al. (2009) yang
mengukur bobot hari ke-1 (awal pemeliharaan) dan bobot hari ke-t (akhir pemeliharaan).
õ =: : ;« : Ú;;
ÚÙÙ
SGR = % bobot per hari; Wt = rerata bobot pada hari ke-t; W1 = rerata bobot pada hari ke-1; t = jumlah hari.
Penghitungan Feeding Conversion
Ratio (FCR) pada penelitian ini
mengacu pada Sahzadi et al. (2006).
ôñ = ô
68
F = berat persediaan pakan yang disiapkan selama waktu pemeliharaan; Wo = bobot ikan pada awal masa pemeliharaan; Wt = bobot ikan pada akhir masa pemeliharaan.
Survival Rate (SR) dihitung berdasarkan rumus Effendi (2002) sebagai berikut :
:%;=lø
ø pž
ÚÙÙ%
Pengukuran kadar hematokrit
darah dilakukan dengan memasukkan
darah ke dalam capillary tube
berheparin kemudian disentrifuse pada
7000 rpm selama 5 menit (Hosseini et
al., 2011). Pengukuran dilakukan
dengan membandingkan volume sel darah merah terhadap seluruh volume darah.
Total leukosit dihitung
menggunakan Standard Neubauer
Haemocytometer. Semua peralatan
dibersihkan terlebih dahulu dengan sodium citrate lalu dikeringkan. Sampel darah diambil menggunakan pipet sampai skala 0,5 kemudian diencerkan dengan larutan Turk sampai skala 11,0. Darah kemudian dihomogenisasi dan dibuang beberapa tetes pertama. Darah
lalu diteteskan ke dalam
haemocytometer. Setelah darah
mengendap, darah pada 4 kotak besar haemocytometer dihitung di bawah mikroskop (Afaq and Rana, 2009). Jenis-jenis leukosit meliputi limfosit, monosit dan neutrofil dihitung dengan
cara membuat ulas darah yang
diwarnai dengan larutan Giemsa dan dihitung di bawah mikroskop (Tierney
et al., 2004).
Aktivitas fagosit (AF) dalam
persen ditentukan dengan menghitung 100 sel fagosit per preparat ulas darah yang telah diwarnai dengan safranin di
bawah mikroskop (Ispir et al., 2009):
ïô:%;=lø
ø pžÚÙÙ%
Sampel jaringan (hati, ginjal dan otak) dari ikan nila semua perlakuan
diambil kemudian difiksasi
menggunakan larutan ƒ˜‹†•‘•ï•
fixative. Pewarnaan dilakukan menggunakan larutan hematoxylin dan
eosin (H&E) (Filho et al., 2009).
Pengujian histopatologi sampel
dilakukan di Laboratorium Penguji, Balai Veteriner Lampung.
Parameter kualitas air yang
diamati adalah suhu, pH, DO dan
amoniak (NH3) yang diukur pagi dan
sore hari. Selama masa pemeliharaan, penyiponan dan pergantian air sampai mendekati 50% dilakukan setiap pagi sebelum pemberian pakan.
Data hasil pengamatan meliputi
•ƒ†ƒ” Š‡•ƒ–‘•”‹–á –‘–ƒŽ Ž‡—•‘•‹–ö differensial leukosit, dan aktivitas fagositosis dianalisis ragam melalui ANOVA pada selang kepercayaan 95% menggunakan software SPSS. Apabila hasil uji perlakuan berbeda nyata maka akan dilakukan uji BNT pada selang kepercayaan 95%. Jika data tidak
homogen maka dianalisa statistik
dengan uji Kruskal-Wallis, apabila hasil uji perlakuan berbeda nyata maka akan dilakukan uji Mann-Whitney pada selang kepercayaan 95%. Data SGR, FCR, SR, histopatologi dan kualitas air dianalisa secara deskriptif.
3.HASIL DAN PEMBAHASAN
Secara umum, suplementasi Ulva
sp. mampu meningkatkan bobot ikan nila (Tabel 2). Penambahan bobot dan SGR antar perlakuan (Tabel 2)
menunjukkan bahwa suplementasi Ulva
sp. tidak mempengaruhi pertumbuhan ikan nila. Namun demikian, FCR pada
perlakuan suplementasi Ulva sp.
(perlakuan B, C, D, dan E) lebih tinggi dari perlakuan A, tanpa suplementasi
69
Ulva sp. (Tabel 2). Artinya suplementasi
Ulva sp. belum mampu meningkatkan
akseptabilitas (acceptability) pakan
dibandingkan perlakuan tanpa
suplementasi Ulva sp. Walaupun
demikian, semua perlakuan masih lebih efisien memanfaatkan pakan sehingga mempengaruhi beban limbah yang dikeluarkan dan masuk ke perairan jika dibandingkan nilai FCR sebesar 1,70
oleh Rakocy et al., (2006). Performa
pertumbuhan terbaik dari semua
perlakuan suplementasi Ulva sp.
ditunjukkan oleh perlakuan B,
suplementasi Ulva sp. 4% pakan.
Perlakuan ini menunjukkan rerata penambahan bobot dan SGR tertinggi serta FCR yang cukup baik, tanpa kematian ikan selama pemeliharaan.
Tabel 2. Rerata Bobot Awal dan Akhir Ikan Nila, Rerata Penambahan Bobot,
Specific Growth Rate (SGR), Feed Conversion Ratio (FCR) dan Survival
Rate (SR) tiap perlakuan (A : Suplementasi Ulva sp. 0% pakan; B:
Suplementasi Ulva sp. 4% pakan; C : Suplementasi Ulva sp. 8% pakan; D :
Suplementasi Ulva sp. 12% pakan; E : Suplementasi Ulva sp. 16% pakan)
Perlakuan Rerata Bobot Awal (g) Rerata Bobot Akhir (g) Rerata Penambahan Bobot (g) SGR (%Body Weight (BW)/hari) FCR SR (%) A 2,87±0,15 15,40±0,10 12,53 4,20 1,36±0,04 100 B 2,83±0,21 15,77±0,71 12,94 4,29 1,39±0,09 100 C 2,80±0,26 14,53±0,38 11,73 4,12 1,52±0,13 100 D 2,67±0,15 14,27±0,23 11,60 4,19 1,72±0,08 100 E 2,60±0,10 15,37±0,21 12,77 4,44 1,55±0,02 100
Kisaran kadar hematokrit pada semua perlakuan hari ke-0 sebelum ikan diberi perlakuan yakni 28,17 hingga 30,81% (Tabel 3). Kisaran ini masih tergolong normal menurut Hardi (2011) yang menyatakan bahwa nilai hematokrit pada ikan teleostei berkisar 27,3-37,8%. Pada pengamatan hari ke-7
semua perlakuan mengalami
penurunan, penurunan terbesar terjadi pada perlakuan A yang berada dibawah kisaran normal yaitu 18,05% (Tabel 3). Apabila dibandingkan dengan hari ke-7, kadar hematokrit pada hari ke-14 juga menurun pada perlakuan A, C dan D, nilai yang tetap pada perlakuan B dan terjadi peningkatan pada perlakuan E. Berdasarkan hasil uji BNT pada hari ke-14 menunjukkan bahwa perlakuan B dan E berbeda nyata terhadap A. Kadar hematokrit yang mengalami penurunan yang disebabkan ikan stres akibat
perubahan lingkungan, sehingga
menyebabkan selama 2 minggu setelah
perlakuan nilai hematokrit cenderung mengalami penurunan.
Kadar hematokrit setelah
perlakuan pada awalnya mengalami penurunan, namun setelah uji tantang
(hari ke-43) kadar hematokrit
mengalami peningkatan pada sebagian besar perlakuan. Berdasarkan hasil uji BNT menunjukkan bahwa perlakuan E berbeda nyata terhadap A. Penurunan nilai hematokrit perlakuan B (Tabel 3) setelah uji tantang mengindikasikan bahwa tingkat infeksi pada perlakuan ini lebih tinggi dibandingkan dengan perlakuan lainnya yang diuji tantang
dengan bakteri S. iniae. Sesuai pendapat
Woo (1979) menurunnya kadar
hematokrit dapat dijadikan petunjuk ikan mendapatkan infeksi. Penurunan nilai hematokrit tersebut diimbangi dengan peningkatan total leukosit yang berfungsi untuk memfagosit bakteri
dan mensintesis antibodi (Abbas et al.,
70
Nilai hematokrit dapat digunakan untuk mendeteksi terjadinya anemia dan ikan terkena penyakit yang ditunjukkan dengan rendahnya nilai hematokrit. Pada hari ke-43 perlakuan B memiliki nilai kadar hematokrit terendah, diduga disebabkan oleh
bakteri S. iniae yang masuk ke dalam
tubuh ikan sehingga terjadi perubahan pola nafsu makan. Hal ini sesuai dengan pernyataan Anderson (1992) bahwa berkurangnya nilai hematokrit pada ikan dapat mengindasikan ikan tidak makan dan infeksi penyakit.
Tabel 3. Kadar Hematokrit Ikan Nila (%) Tiap Perlakuan (A : Suplementasi Ulva
sp. 0% pakan; B: Suplementasi Ulva sp. 4% pakan; C : Suplementasi Ulva
sp. 8% pakan; D : Suplementasi Ulva sp. 12% pakan; E : Suplementasi
Ulva sp. 16% pakan) Kadar Hematokrit (%) Perlakuan H-0 H-7 H-14 H-43 A 30,24 ± 7,24a 18,05 ± 5,66a 1545 ± 1,66c 23,74 ± 1,70b B 29,18 ± 6,09a 21,7 ± 5,25a 21,74 ± 1,78b 20,66 ± 1,70b C 28,17 ± 4,10a 25,02 ± 1,47a 18,82 ± 2,52bc 27,70 ± 1,26ab D 30,82 ± 8,21a 23,44 ± 2,80a 21,53 ± 3,53bc 27,75 ± 2,64ab E 30,68 ± 0,55a 25,83 ± 6,78a 26,99 ± 3,64a 29,03 ± 1,04a Keterangan: huruf yang sama pada kolom yang sama menunjukkan antar perlakuan tidak berbeda nyata (P>0,05)
Jumlah total leukosit pada
sebagian perlakuan rendah namun berada dalam kisaran normal. Hal ini sesuai dengan Rukyani dkk., (1997) yang menyatakan bahwa jumlah sel darah putih (leukosit) pada ikan normal
berkisar antara 20.000 sel/mm3 hingga
150.000 sel/mm3. Pada perlakuan E
jumlah total leukosit sedikit berada di bawah kisaran normal (Tabel 4). Hal ini diduga ketika diambil darahnya ikan mengalami stress akibat perubahan
lingkungan. Jumlah total leukosit
berhubungan dengan kadar hematokrit, apabila kadar hematokrit meningkat maka total leukosit menurun dan sebaliknya. Kadar hematokrit pada hari
ke-0 cenderung tinggi sehingga
mengakibatkan total leukosit
cenderung rendah.
Pada pengamatan hari ke-7
jumlah leukosit sebagian besar
perlakuan mengalami peningkatan
(Tabel 4). Uji Kruskal-Wallis (Non Parametrik) dengan taraf kepercayaan 95% menunjukkan perbedaan yang
nyata pada hari ke-7, selanjutnya dilakukan uji Mann-Whitney yang menunjukkan bahwa perlakuan C, E dan D berbeda nyata terhadap A. Pada pengamatan hari ke-14 jumlah total leukosit juga mengalami peningkatan pada semua perlakuan berdasarkan hasil uji BNT menunjukkan bahwa perlakuan E berbeda nyata terhadap A. Pasca uji tantang (hari ke-43) sebagian besar perlakuan mengalami penurunan
sedangkan pada perlakuan B
mengalami peningkatan jumlah total leukosit yang sangat signifikan yaitu
144.000 sel/mm3 (Tabel 4), hasil uji
BNT menunjukkan bahwa perlakuan B,
D dan E berbeda nyata terhadap A.
Kresno (2001) menyatakan bahwa indikasi terpacunya respon imunitas seluler (non spesifik) ikan ditandai
dengan adanya peningkatan sel
leukosit. Hal ini didukung oleh
pernyataan Griffin (1984) dan Sharp et
al. (1992) bahwa karakteristik respon
71 migrasi leukosit dari dalam sel menuju
jaringan yang mengalami infeksi.
Jumlah total leukosit disetiap pengamatan perlakuan B mengalami peningkatan hal ini diduga perlakuan B mudah direspon oleh ikan sehingga lebih efektif dibandingkan perlakuan
lainnya. Hal yang sama juga
ditunjukkan oleh perlakuan
menggunakan rumput laut Ulva sp.
yang dapat meningkatkan jumlah total
hemosit udang (Selvine et al., 2004).
Selain itu, terlihat bahwa dosis
suplementasi Ulva sp. yang semakin
meningkat mengakibatkan jumlah total leukosit yang semakin menurun, dosis suplementasi yang tinggi memberikan efek negative terhadap ikan nila, salah
satunya adalah mengganggu
kesetimbangan media pemeliharaan ikan nila sehingga ikan mengalami stress, kondisi ini membuat ikan menjadi lemah dan mudah terserang
penyakit. Hal ini didukung oleh
pernyataan Couso et al., (2003) bahwa
dosis pemberian imunostimulan yang tinggi dalam jangka waktu lama, dapat menekan mekanisme pertahanan.
Tabel 4. Jumlah Total Leukosit Ikan Nila (sel/mm3) Tiap Perlakuan (A :
Suplementasi Ulva sp. 0% pakan; B: Suplementasi Ulva sp. 4% pakan; C:
Suplementasi Ulva sp. 8% pakan; D : Suplementasi Ulva sp. 12% pakan; E
: Suplementasi Ulva sp. 16% pakan)
Total Leukosit (sel/mm3)
Perlakuan H-0 H-7 H-14 H-43 A 26000 ± 2645,75a 35000 ± 6244,99b 75000 ± 1000,00ab 72000 ± 2598,08b B 24000 ± 2645,75a 39000 ± 2645,75b 81300 ± 3411,74a 144000 ± 5766,28a C 23000 ± 1000,00a 20000 ± 4358,90a 73000 ± 3000,00b 45000 ± 5650,66bc D 22000 ± 2645,75a 27000 ± 1000,00d 72000 ± 1732,05b 42000 ± 7073,90c E 19000 ± 2645,75a 21000 ± 1732,05c 22000 ± 6873,86c 24000 ± 4044,75d Keterangan : huruf yang sama pada kolom yang sama menunjukkan antar perlakuan tidak berbeda nyata (P>0,05)
Pada hari ke-0 sebelum diberi perlakuan kisaran persentase neutrofil ikan nila berkisar antara 14,67 hingga 21,33% (Tabel 5). Nilai ini tergolong normal karena ikan nila memiliki rerata persentase neutrofil 22,73% (Utami dkk, 2013). Pada hari ke-7 setelah diberi perlakuan, persentase neutrofil
pada sebagian besar perlakuan
mengalami peningkatan kecuali pada perlakuan A dan B. Hasil uji BNT pada
hari ke-7 menunjukkan bahwa
perlakuan B berbeda nyata terhadap A.
Pada pengamatan hari ke-14
persentase neutrofil mengalami
penurunan disemua perlakuan, sama halnya dengan pengamatan hari ke-43
meskipun begitu nilai persentase
neutrofil masih berada dalam kisaran normal.
Neutrofil mempunyai fungsi
utama yaitu menghancurkan antigen asing melalu proses fagositosis. Pada penelitian ini penurunan persentase
neutrofil diimbangi dengan
peningkatan persentase limfosit
(Gambar 4 dan 5), sehingga sistem imun non spesifik terbentuk oleh limfosit. Penurunan jumlah sel neutrofil yang selalu terjadi disetiap pengamatan diperkirakan ketika bakteri disuntikkan kedalam tubuh ikan sel neutrofil diproduksi dalam jumlah banyak, namun saat dilakukan pengamatan persentase neutrofil pasca uji tantang (hari ke-43) sel sel neutrofil tadi jumlahnya menurun akibat akitivitas serangan antigen yang dilakukan pada hari sebelumnya. Hal ini didukung oleh pernyataan Suzuki and Iida, (1992)
72
yang menyatakan bahwa neutrofil akan bekerja secara aktif ketika ada bakteri yang masuk ke dalam tubuh, namun
keaktifan neutrofil tersebut tidak
bertahan lama. Selain itu, Abbas et al.
(2007) menyatakan bahwa setelah
proses infeksi jumlah sel neutrofil dapat ditekan, sel sel mati dan jaringan
nekrotik yang salah satunya
mengandung neutrofil yang telah mati
secara bertahap dan mengalami
autolisis dalam beberapa hari.
Tabel 5. Persentase Neutrofil Ikan Nila Tiap Perlakuan (A : Suplementasi Ulva sp.
0% pakan; B: Suplementasi Ulva sp. 4% pakan; C : Suplementasi Ulva sp.
8% pakan; D : Suplementasi Ulva sp. 12% pakan; E : Suplementasi Ulva
sp. 16% pakan) Persentase Neutrofil (%) Perlakuan H-0 H-7 H-14 H-43 A 21,33 ± 6,02a 20 ± 3,46 ab 14 ± 3,00a 4,33 ± 0,58a B 24 ± 4,36a 11,33 ± 0,58c 8 ± 2,00a 4 ± 1,00a C 14,67 ± 1,53a 19 ± 2,00b 14,67 ± 4,51a 5,67 ± 1,53a D 15,67 ± 3,21a 24,33 ± 3,51a 14 ± 1,72a 6 ± 3,61a E 17,33 ± 4,04a 19 ± 2,65b 12 ± 2,00a 5,33 ±2,08a
Keterangan: huruf yang sama pada kolom yang sama menunjukkan antar perlakuan tidak berbeda nyata (P>0,05)
Pada hari ke-0 sebelum
pemberian perlakuan persentase
limfosit berada dikisaran normal yaitu berkisar antara 73-82% (Tabel 6). Hal ini sesuai dengan penelitian Hardi
(2011) yang menyatakan bahwa
persentase limfosit ikan nila normal
yaitu 68-86%. Hasil uji ANOVA
menunjukkan tidak ada perbedaan nyata pada masing masing perlakuan (Tabel 6). Pada pengamatan hari ke-7 sampai hari ke-43 jumlah limfosit terus mengalami peningkatan, setelah 2
minggu (hari ke-14) pemberian
perlakuan pakan jumlah persentase limfosit melebihi kisaran normal pada perlakuan A dan B. Hasil uji BNT menunjukkan bahwa pada hari ke-7 perlakuan B dan D berbeda nyata
terhadap A. Pada hari ke-14
menunjukkan bahwa perlakuan B berbeda nyata terhadap A, C, D dan E. Pada hari ke-43 menunjukkan bahwa perlakuan E dan D berbeda nyata terhadap A.
Limfosit sebagai salah satu
indikator pertahanan alami tubuh dan merupakan sistem kekebalan non spesifik yang dapat melindungi tubuh dari serangan mikroba, seperti bakteri
S. iniae (Utami dkk, 2013). Perlakuan A
yang tidak diberi suplementasi Ulva sp.
persentase limfositnya cenderung sama besar dengan persentase limfosit pada perlakuan B, C, D dan E yang diberi
suplementasi Ulva sp. Hal ini
dikarenakan pada perlakuan A tetap terjadi mekanisme pertahanan tubuh bawaan apabila terjadi infeksi bakteri, seperti diketahui bahwa ikan memiliki kekebalan tubuh alami yang sudah ada sejak lahir. Roberts (2012), menyatakan bahwa limfosit memegang peranan penting dalam pembentukan antibodi.
Persentase limfosit yang
cenderung meningkat diimbangi
dengan penurunan jumlah neutrofil.
Peningkatan persentase limfosit
mengindikasikan bahwa respon
imunitas non spesifik ikan terpicu
73
Mekanisme kerja limfosit dalam
peranannya untuk sistem kekebalan tubuh berfungsi menyediakan zat kebal untuk pertahanan tubuh dengan cara mengenali antigen melalui reseptor spesifik pada membran sel. Pada limfosit T, ketika tubuh atau jaringan terpapar oleh antigen, maka limfosit T
tidak mampu mengenal antigen
tersebut sendirian tanpa melalui
reseptor spesifik. Adanya sel reseptor spesifik ini memungkinkan sel T lebih cepat mengenali antigen yang ada sehingga langsung memberikan reaksi kekebalan dan menstimulasi sel B
untuk mengeluarkan antibodi (Abbas et
al., 2007).
Persentase monosit pada hari
ke-0 sebelum pemberian Ulva sp. pada
perlakuan A 3,67%, perlakuan B 3%, perlakuan C 3,33%, perlakuan D 3,33% dan perlakuan E 3,67% (Tabel 7). Hasil uji ANOVA menunjukkan tidak ada perbedaan nyata pada masing masing perlakuan (Tabel 7). Jumlah persentase
monosit masing masing perlakuan
berada sedikit di bawah kisaran normal, karena menurut Hardi (2011) jumlah normal monosit ikan nila 3,9-5,9%. Jumlah monosit yang rendah diimbangi dengan jumlah limfosit yang rendah dan jumlah neutrofil yang tinggi.
Pada pengamatan hari ke-7
persentase monosit mengalami
peningkatan di semua perlakuan,
berdasarkan uji Mann-Whitney
menunjukkan bahwa perlakuan E
berbeda nyata terhadap A. Pada pengamatan hari ke-14 dan hari ke-43 di mana persentase monosit juga mengalami peningkatan. Berdasrkan uji BNT pada hari ke-14 menunjukkan bahwa perlakuan D dan E berbeda nyata terhadap A, pada hari ke-43
dengan menggunakan uji
Mann-Whitney menunjukkan bahwa
perlakuan D dan E berbeda nyata. Nilai
persentase monosit yang selalu
meningkat pada setiap pengamtan diduga bahwa monosit berperan aktif memfagosit agen penyebab penyakit.
Selain itu, peningkatan monosit
merupakan indikator peningkatan
sistem imun non spesifik dengan
fungsinya yang setelah matang
berperan sebagai sel fagosit
(makrofag), dapat membantu
melindungi ikan dari serangan bakteri (Anderson, 1992).
Monosit berperan sebagai
makrofag dan banyak dijumpai pada daerah peradangan atau infeksi. Jumlah monosit yang meningkat pasca uji tantang diduga sel monosit berperan
aktif dalam menghancurkan bakteri S.
iniae. Roberts (2012) menyatakan bahwa monosit atau makrofag pada
ikan teleostei berperan dalam
pertahanan seluler. Peningkatan nilai
monosit menggambarkan bahwa
monosit teraktivasi oleh bakteri dan memperbanyak diri secara tepat dan dalam kuantitas yang lebih banyak
(Abbas et al., 2007). Roberts (2012)
mengatakan bahwa pada proses
inflamasi saat terjadi kerusakan
jaringan oleh infeksi maupun reaksi antigen-antibodi, akan meningkatkan produksi monosit. Sebagai sel fagosit
utama, monosit berperan untuk
menghancurkan berbagai patogen
penyerang dan berperan pula sebagai
antigen presenting cells (APC) yang fungsinya untuk menyajikan antigen
kepada sel limfosit (Madigan et al.,
2012).
Persentase monosit pada hari
ke-0 sebelum pemberian Ulva sp. pada
perlakuan A 3,67%, perlakuan B 3%, perlakuan C 3,33%, perlakuan D 3,33% dan perlakuan E 3,67% (Tabel 7). Hasil uji ANOVA menunjukkan tidak ada perbedaan nyata pada masing masing
74
perlakuan (Tabel 7). Jumlah persentase
monosit masing masing perlakuan
berada sedikit di bawah kisaran normal, karena menurut Hardi (2011) jumlah normal monosit ikan nila 3,9-5,9%. Jumlah monosit yang rendah diimbangi dengan jumlah limfosit yang rendah dan jumlah neutrofil yang tinggi.
Pada pengamatan hari ke-7
persentase monosit mengalami
peningkatan di semua perlakuan,
berdasarkan uji Mann-Whitney
menunjukkan bahwa perlakuan E
berbeda nyata terhadap A. Pada pengamatan hari ke-14 dan hari ke-43
dimana persentase monosit juga
mengalami peningkatan. Berdasrkan uji BNT pada hari ke-14 menunjukkan bahwa perlakuan D dan E berbeda nyata terhadap A, pada hari ke-43
dengan menggunakan uji
Mann-Whitney menunjukkan bahwa
perlakuan D dan E berbeda nyata. Nilai
persentase monosit yang selalu
meningkat pada setiap pengamtan diduga bahwa monosit berperan aktif memfagosit agen penyebab penyakit.
Selain itu, peningkatan monosit
merupakan indikator peningkatan
sistem imun non spesifik dengan
fungsinya yang setelah matang
berperan sebagai sel fagosit
(makrofag), dapat membantu
melindungi ikan dari serangan bakteri (Anderson, 1992).
Monosit berperan sebagai
makrofag dan banyak dijumpai pada daerah peradangan atau infeksi. Jumlah monosit yang meningkat pasca uji tantang diduga sel monosit berperan
aktif dalam menghancurkan bakteri S.
iniae. Roberts (2012) menyatakan bahwa monosit atau makrofag pada
ikan teleostei berperan dalam
pertahanan seluler. Peningkatan nilai
monosit menggambarkan bahwa
monosit teraktivasi oleh bakteri dan memperbanyak diri secara tepat dan dalam kuantitas yang lebih banyak
(Abbas et al., 2007). Roberts (2012)
mengatakan bahwa pada proses
inflamasi saat terjadi kerusakan
jaringan oleh infeksi maupun reaksi antigen-antibodi, akan meningkatkan produksi monosit. Sebagai sel fagosit
utama, monosit berperan untuk
menghancurkan berbagai patogen
penyerang dan berperan pula sebagai
antigen presenting cells (APC) yang fungsinya untuk menyajikan antigen
kepada sel limfosit (Madigan et al.,
2012).
Tabel 7. Persentase Monosit Ikan Nila Tiap Perlakuan (A : Suplementasi Ulva sp.
0% pakan; B: Suplementasi Ulva sp. 4% pakan; C : Suplementasi Ulva sp.
8% pakan; D : Suplementasi Ulva sp. 12% pakan; E : Suplementasi Ulva
sp. 16% pakan) Persentase Monosit (%) Perlakuan H-0 H-7 H-14 H-43 A 3,67 ± 0,58a 4 ± 0,00b 4,33 ± 0,58c 5,67 ± 0,58cd B 3 ± 0,00a 3,67 ± 0,58b 4 ± 0,00c 5 ± 0,00d C 3,33 ± 0,58a 4 ± 0,00b 5 ± 0,00bc 6,33 ± 0,58bc D 3,33 ± 0,58a 4,67 ± 0,58ab 7 ± 1,00a 8,33 ± 1,15ab E 3,67 ± 0,58a 5 ± 0,00a 6 ± 1,00ab 8,67 ± 0,58a
Keterangan: huruf yang sama pada kolom yang sama menunjukkan antar perlakuan tidak berbeda nyata (P>0,05)
75 Bakteri melalui fagositosis terjadi
dalam beberapa tingkat yaitu
kemotaksis di mana sel sel fagositosis mendekati mikroorganisme, kemudian
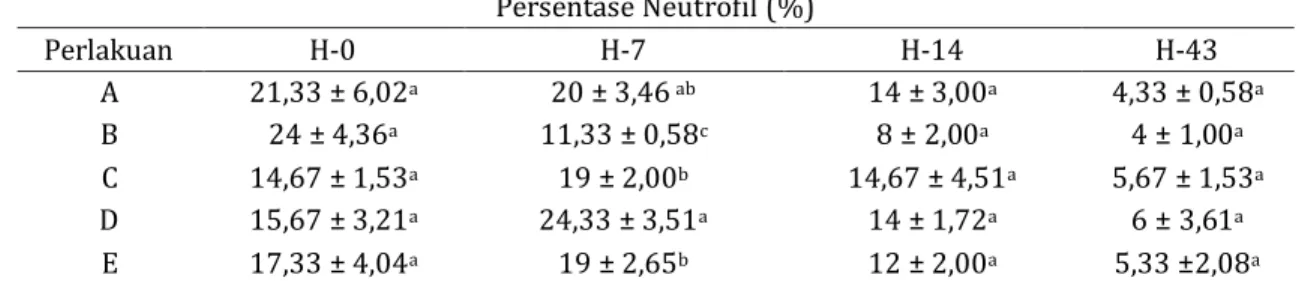
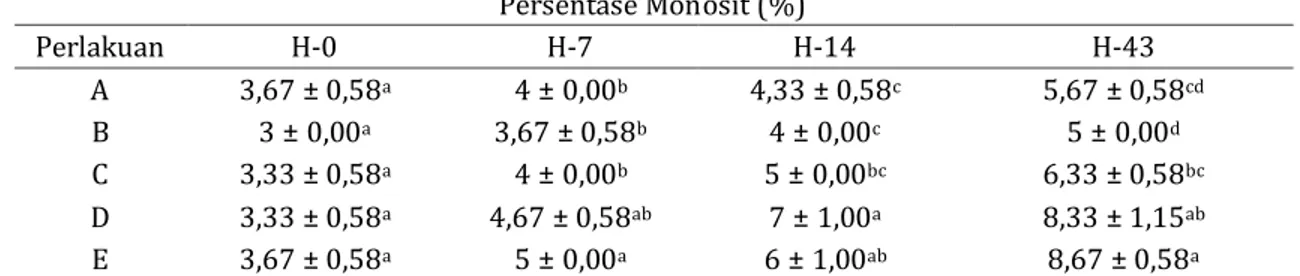
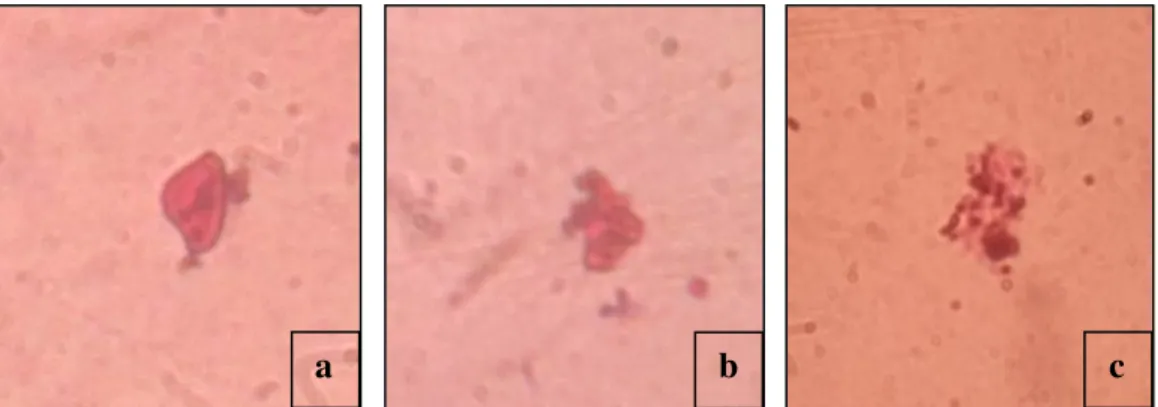
menangkap, memakan (fagositosis), membunuh dan mencerna (Gambar 1) (Hardi et al., 2013).
Gambar 1. Proses Fagositosis Bakteri S. iniae. a. Pelekatan; b. Penghancuran; c.
Pelepasan hasil fagositosis
Hasil persentase aktifitas
fagositosis ikan nila setelah diuji
tantang dengan bakteri S. iniae yaitu
pada perlakuan A 71%, perlakuan B 75,67%, perlakuan C 61%, perlakuan D 57,67% dan perlakuan E 53.33% (Gambar 2). Fagositosis merupakan langkah awal untuk mekanisme respon imunitas, selanjutnya akan terbentuk respon spesifik yang berupa antibodi
(Madigan et al., 2012). Tingginya
aktivitas fagositosis menunjukkan
adanya peningkatan kekebalan tubuh, Hal ini sesuai dengan Hardi dkk (2013), yang menyatakan peningkatan aktifitas sel fagosit mempercepat tubuh ikan
menghancurkan bakteri penyebab
infeksi. Fagosit adalah bagian paling kuat dan paling penting dari sistem
pertahanan tubuh yang dapat
beroperasi segera (tanpa penundaan) dalam melawan invasi mikroorganisme setelah melintasi permukaan tubuh dan
masuk ke dalam tubuh (Madigan et al.,
2012).
Pemberian suplementasi Ulva sp.
dalam pakan dengan dosis yang
terendah yaitu 4% pada perlakuan B berpengaruh nyata terhadap aktivitas fagositosis darah ikan uji karena memiliki persentase tertinggi (Gambar
2). Hal ini diduga suplementasi Ulva sp.
dalam pakan sebanyak 4%
berpengaruh positif terhadap aktifitas fagositosis ikan nila, dugaan tersebut
diperkuat dengan pernyataan Selvine et
al. (2004) bahwa rumput laut Ulva
secara signifikan meningkatkan faktor - faktor pertahanan tubuh diantaranya adalah aktivitas fagositosis.
Aktfitas fagositosis pada
perlakuan B diduga didominasi oleh sel limfosit, dimana pada pengamatan limfosit pasca uji tantang persentase limfosit perlakuan B memiliki nilai
tertinggi, sedangkan persentase
neutrofil memiliki nilai terendah. Oleh
karenanya dapat dikatakan pada
penelitian ini, sel yang berperan aktif
dalam memfagosit bakteri S. iniae
bukanlah sel neutrofil yang befungsi untuk menghancurkan antigen asing melalu proses fagositosis, melainkan sel limfosit.
76 71 75.67 61 57.67 53.33 A B C D E
Aktifitas Fagositosis
(%)
Gambar 2. Persentase Aktifitas Fagositosis Ikan Nila pada Berbagai
Perlakuan (A : Suplementasi Ulva sp.
0% pakan; B: Suplementasi Ulva sp. 4%
pakan; C : Suplementasi Ulva sp. 8%
pakan; D : Suplementasi Ulva sp. 12%
pakan; E : Suplementasi Ulva sp. 16%
pakan)
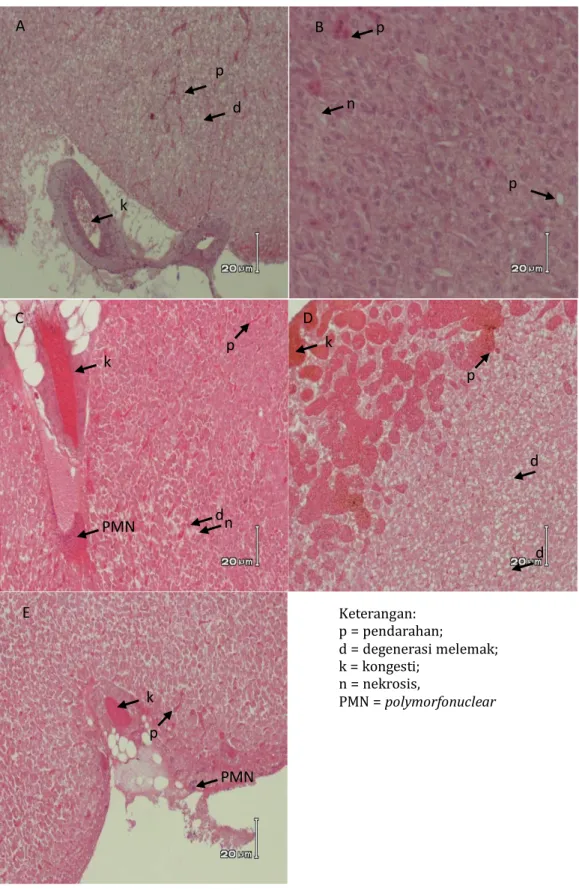
Hasil pengujian histopatologi
menunjukkan bahwa semakin tinggi
dosis suplementasi Ulva sp. pada pakan,
semakin berat level perubahan jaringan
yang terjadi (Tabel 8). Namun
demikian, munculnya sel radang berupa sel polymorfonuclear (PMN) (Gambar 3 dan 5) menandakan adanya aktifitas sel neutrofil sebagai sel fagosit PMN yang berfungsi mengidentifikasi, menelan dan menghancurkan mikroorganisme
yang menginfeksi (Abbas et al., 2007).
Kondisi yang paling banyak
ditemukan pada semua organ uji adalah pendarahan, dengan kecenderungan
level semakin berat dengan
suplementasi suplementasi Ulva sp.
(Tabel 8). Pendarahan ini ditengarai
sebagai upaya tubuh merespon
masuknya benda asing.
Kondisi ini tidak terlalu
menghawatirkan karena nekrosis
(Gambar 3, 4 dan 5), sebagai tahap lanjut infeksi, hanya sedikit terjadi.
Nekrosis ini juga sebagai tanda
munculnya infeksi bakteri. Kongesti atau melambatnya (berhentinya) aliran
darah terlihat meningkat dengan
semakin tingginya level pendarahan yang terjadi (Tabel 8).
Walaupun tidak ada kematian ikan nila yang terjadi, penggunaan
suplementasi Ulva sp. pada pakan nila
tetap mengacu pada dosis dengan level perubahan jaringan paling ringan.
Perlakuan B menunjukkan level
perubahan jaringan yang paling ringan
diantara perlakuan suplementasi Ulva
sp. lainnya. Sehingga perlakuan ini direkomendasikan untuk digunakan.
Tabel 8. Hasil Pengujian Histopatologi Ikan Nila pada Berbagai Perlakuan A : Suplementasi Ulva sp. 0% pakan; B: Suplementasi
Ulva sp. 4% pakan; C : Suplementasi Ulva sp. 8% pakan; D : Suplementasi Ulva sp. 12% pakan; E : Suplementasi Ulva sp.
16% pakan)
Kelompok
Level Perubahan yang terjadi pada
Hati Ginjal Otak
Perdarahan Kongesti Degenerasi Nekrosa Sel
Radang Fibrin Perdarahan Kongesti Nekrosa Sel
Radang Perdarahan Kongesti Nekrosa Sel Radang
A
A 1 + + - - - + + + - + - - -
A 2 + + - + + - - - Tidak ada slide + - - -
A 3 + + + - - - - + + - - + - - -
B
B 1 + + - - - PMN - + - - - + + - -
B 2 + + - + + + PMN + Tidak ada slide + + - -
B 3 + + - + ++ + PMN + + + + - - + - - -
C
C 1 + + + + + + - PMN - + + + - - + + + + - -
C 2 + + + + + + + PMN + Tidak ada slide + + - + PMN
C 3 + + + + + + + - + Tidak ada slide + + + + - PMN
D
D 1 + + + + - - - Tidak ada slide + - + PMN
D 2 + + + + + + + + + PMN + + + + + + PMN + + + + + + - D 3 + + + - + + + - - - + + + + + - + - + - E E 1 + + + + + - PMN - + + - + + - + + + + - E 2 + + + + + + + - PMN - + + + + - + + + + - E 3 + + + + + + + + - + + + - + + - + + - + PMN Keterangan : - Negatif + Ringan ++ Sedang +++ Berat
PMN Sel radang Polymorfonuclear
E st i H ar p en i e t a l. K aj ian U lv a s p . se b agai S u p le m en P ak an t er h ad ap P er for m a P er tu m b u h an d an R es p on I m u n N on -S p es if ik I k an N il a ( O r e oc h r om is n il ot ic u s ) 7 7
78
Gambar 3. Histopatologi Hati Ikan Nila pada Berbagai Perlakuan (A :
Suplementasi Ulva sp. 0% pakan; B: Suplementasi Ulva sp. 4% pakan; C :
Suplementasi Ulva sp. 8% pakan; D : Suplementasi Ulva sp. 12% pakan; E :
Suplementasi Ulva sp. 16% pakan)
Keterangan: p = pendarahan; d = degenerasi melemak; k = kongesti; n = nekrosis, PMN = polymorfonuclear d p k PMN d n k PMN p p p p n B A k d C E k D d d p
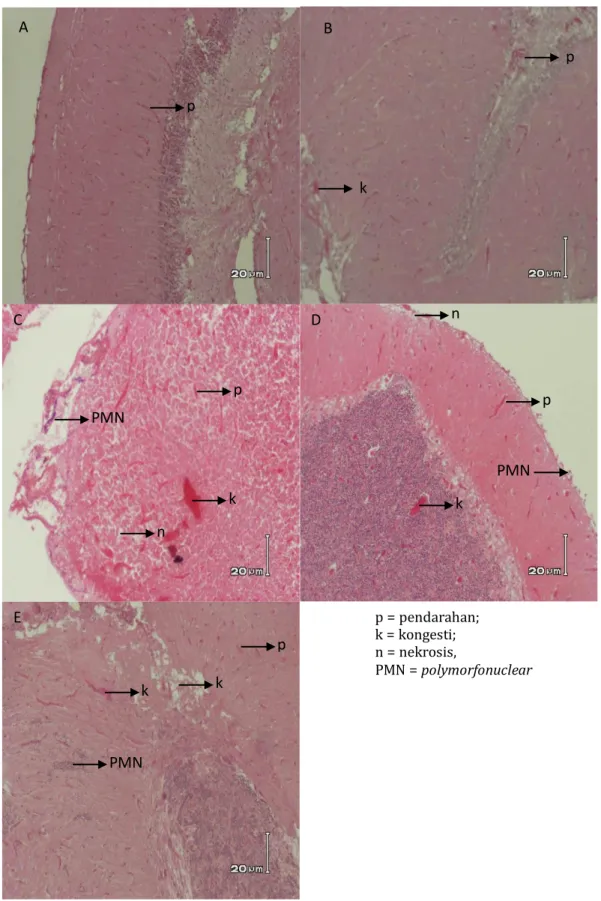
79 Gambar 4. Histopatologi Ginjal Ikan Nila pada Berbagai Perlakuan (A :
Suplementasi Ulva sp. 0% pakan; B: Suplementasi Ulva sp. 4% pakan; C :
Suplementasi Ulva sp. 8% pakan; D : Suplementasi Ulva sp. 12% pakan; E :
Suplementasi Ulva sp. 16% pakan)
A B p k n p k C D E p k n n p k k p k h Keterangan: p = pendarahan; k = kongesti; n = nekrosis,
80 A B C D E p p k PMN k p n p n k PMN k p k PMN
Gambar 5. Histopatologi Otak Ikan Nila pada Berbagai Perlakuan (A : Suplementasi
Ulva sp. 0% pakan; B: Suplementasi Ulva sp. 4% pakan; C : Suplementasi Ulva sp.
8% pakan; D : Suplementasi Ulva sp. 12% pakan; E : Suplementasi Ulva sp. 16%
pakan)
p = pendarahan; k = kongesti; n = nekrosis,
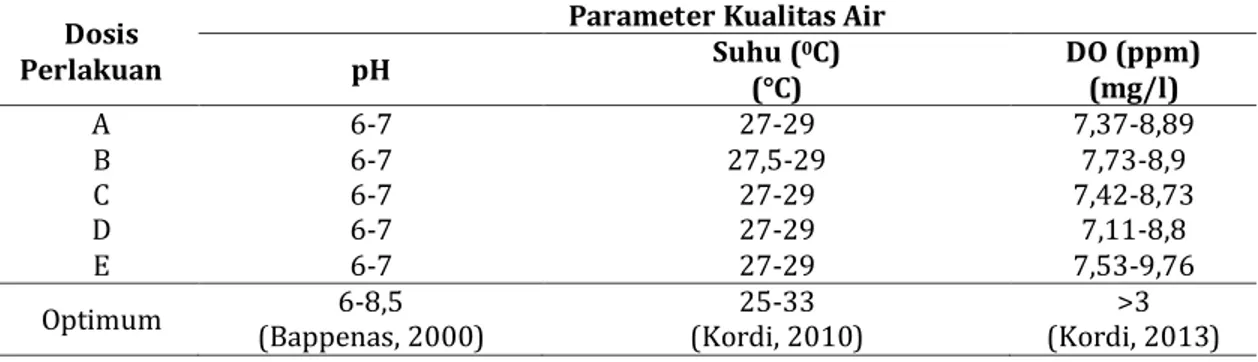
81 Kualitas air di perairan memegang
peranan penting terhadap kehidupan ikan dan organisme lainnya. Kualitas air
yang buruk dapat menghambat
pertumbuhan ikan, bahkan dapat
mengakibatkan kematian pada ikan.
Kualitas air dinyatakan dengan
beberapa parameter dalam penelitian adalah suhu, pH, dan DO. Berdasarkan pengamatan yang telah dilakukan, semua parameter kualitas air berada dalam kisaran optimum (Tabel 9) untuk pemeliharaan ikan nila.
Tabel 9. Kisaran Kualitas Air pada Berbagai Perlakuan (A : Suplementasi Ulva sp.
0% pakan; B: Suplementasi Ulva sp. 4% pakan; C : Suplementasi Ulva sp.
8% pakan; D : Suplementasi Ulva sp. 12% pakan; E : Suplementasi Ulva
sp. 16% pakan) selama Penelitian
Dosis Perlakuan
Parameter Kualitas Air
pH Suhu (0C) (°C) DO (ppm) (mg/l) A 6-7 27-29 7,37-8,89 B 6-7 27,5-29 7,73-8,9 C 6-7 27-29 7,42-8,73 D 6-7 27-29 7,11-8,8 E 6-7 27-29 7,53-9,76 Optimum 6-8,5 (Bappenas, 2000) 25-33 (Kordi, 2010) >3 (Kordi, 2013) 4.KESIMPULAN
Suplementasi Ulva sp. mampu
meningkatkan performa pertumbuhan dan respon imun non spesifik ikan
niladibandingkan perlakuan tanpa
suplementai Ulva sp. Peningkatan dosis
suplementasi Ulva sp. pada pakan
meningkatkan level perubahan jaringan
ke level berat pada uji histopatologi.
Suplementasi Ulva sp. dengan dosis 4%
pakan mampu meningkatkan SGR, FCR, dan respon imun non spesifik (total
leukosit, persentase limfosit dan
aktifitas fagositosis tertinggi) ikan nila
yang diuji tantang S. iniae serta
memiliki level perubahan jaringan paling rendah.
UCAPAN TERIMA KASIH
Terima kasih kepada Ditjen Dikti melalui Universitas Lampung atas pendanaan DIPA BLU tahun 2014
sehingga penelitian ini dapat
dilaksanakan dengan baik.
DAFTAR PUSTAKA
Abbas AK, Lichtman AH, Pillai S. 2007.
Cellular and Molecular Immunology 6th edition. Saunders:
Philadelphia.
Afaq S, Rana KS. 2009. Toxicological effects of leather dyes on total leucocyte count of fresh water
teleost, Cirrhinus mrigala (Ham).
Biology and Medicine. 1(2):134-138.
Anderson DP. 1992. Immunostimulants, adjuvants and vaccine carriers in fish: applications to aquaculture.
Annual Rev. of Fish Diseases. 2: 281-307.
Bappenas. 2000. Budidaya Ikan Nila.
Proyek Pengembangan Ekonomi Masyarakat Pedesaan. Jakarta: Bappenas.
Burrells C, Williams PD, Forno PF. 2001.
Dietary nucleotides: a novel
supplement in fish feeds: 1. Effects on resistance to disease in
82
salmonids. Aquaculture.
199:159-169
Cook MT, Hayball PJ, Hutchinson W, Nowak BF, Hayball JD. 2003. Administration of a commercial
immunestimulan preparation,
EcoActiva as a feed supplement enhances macrophage respiratory burst and the growth rate of
snaper (Pagurus auratus,
Sparidae (Bloch and Schneider) in winter. Fish and Shellfish Immunology. 14:333 345.
Couso N, Castro R, Magarinos B, Obach A, Lamas J. 2003. Effect of oral administration of glucans on the resistance of gilthead seabream to
pasteurellosis. Aquaculture. 219:
99 109.
De Val AG, Platas G, Basilio A, Cabello A, Gorrochategui J, Suay I, Vicente F, Portilllo E, deRio MJ, Reina GG, Pelaez F. 2001. Screening of antimicrobial activities in red, green and brown macroalgae from Gran Canaria (Canary
Islands, Spain). Int. Microbiol.
4:35-40.
Devaraj KV, Keshavappa GY, Manissery JK. 1976. Growth of grass carp,
Ctenopharyngodon idella fed on two terrestrial fodder plants.
Aquaculture and Fisheries Management. 17:123-128.
Effendi MI. 2002. Biologi Perikanan.
Jakarta: Yayasan Pustaka
Nusantara.
Filho CI, Muller EE, Pretto-Giordano LG,
Bracarense APFRL. 2009.
Histological findings of
experimental Streptococcus
agalactiae infection in nile tilapias (Oreochromis niloticus). Braz J Vet Pathol. 2(1):12-15.
Fleurence J. 1999. Seaweed proteins: biochemical, nutritional aspects and potential uses. Trends in
Food Science and Technology. 10:25-28.
Griffin BR. 1984. Random and directed
migration of trout (Salmo
sairdneri) leukocytes: activation by antibody, complement, and
normal serum components.
Developmental and Comparative Immunology. 8:589-597.
Hardi EH. 2011. Kandidat vaksin
potensial Streptococcus agalactiae
untuk pencegahan penyakit
Streptococcosis pada ikan nila (Oreochromis niloticus) [Disertasi]. Bogor: IPB.
Hardi EH, Sukenda, Harris E, Lusiastuti
AM. 2013. Kandidat Vaksin
Potensial Streptococcus agalactiae
untuk Pencegahan Penyakit
Streptococcosis pada Ikan Nila (Oreochromis niloticus). Jurnal Veteriner. 14(4):408-416.
Hosseini P, Vahabzade H, Bourani MS, Kazemi R. 2011. The effects of salinity stress on hematocrit and hemoglobin in fingerling rainbow
trout (Oncorhynchus mykiss).
International Conference on Medical, Biological and Pharmaceutical Sciences
ïxvww . 487-489.
Ispir U, Gokhan B, Ozcan M, Dorucu M, Saglam N. 2009. Immune response
of rainbow trout (Oncorhynchus
mykiss) to selected antigens of
Yersinia ruckeri. Acta Vet. BRNO. 78:145-150.
Kordi K. 2010. Budi Daya Ikan Nila di
Kolam Terpal. Yogyakarta: Andi.
Kordi K. 2013. Budi Daya Nila Unggul.
Jakarta: PT AgroMedia Pustaka.
Kresno BS. 2001. Imunologi: Diagnosis
dan Prosedur Laboratorium. Edisi
ke-4. Jakarta: Universitas
Indonesia.
Liao WR, Lin JY, Shieh WY, Jeng WL. 2003. Antibiotic activity of
83 lectins from marine algae
against marine vibrios. J. Ind.
Microbiol. Biotech. 30:433-439. Madigan MT, Martinko JM, Stahl DA,
Clark DP. 2012. Brock Biology of
Microorganisms. Thirteenth Edition. San Francisco: Benjamin Cummings.
Mahasneh I, Jamal M, Kashashneh M. Zibdeh M. 1995. Antibiotic activity of marine algae against multiantibiotic resistant bacteria.
Microbios. 83:23-26.
Rakocy JE, Masser MP, Losordo TM. 2006. Recirculating aquaculture
tank production systems:
aquaponics integrating fish and
plant culture. SRAC Publication No.
454.
Roberts RJ. 2012. Fish Pathology. Fourth
Edition. West Sussex: Blackwell Publishing Ltd.
Rukyani A, Silvia E, Sunarto A, Taukhid. 1997. Peningkatan respon kebal non-spesifik pada ikan lele dumbo (Clarias sp.) dengan pemberian
‹••—•‘•–‹•—Žƒ• >-glucan). JPPI.
II(1):1-10.
Sahzadi T, Salim M, Um-E-Kalsoom,
Shahzad K. 2006. Growth
performance and feed conversion ratio (FCR) of hybrid fingerlings (Catla catla X Labeo rohita) fed on cottonseed meal, sunflower meal
and bone meal. Pakistan Vet J.
26(4):163-166.
Schram E, Verdegem MCJ, Widjaja RTOBH, Kloet CJ, Foss A, Schelvis-Smit R, Roth B, Imsland AK. 2009. Impact of increased flow rate on specific growth rate of juvenile
turbot (Scophthalmus maximus,
Rafinesque 1810). Aquaculture.
292:46-52.
Selvine J, Huxleya AJ, Lipton AP. 2004. Immunomodulatory potential of marine secondary metabolites
against bacterial diseases of
shrimp. Aquaculture. 230:241
248.
Sharp GJE, Pettitt TR, Rowley AF,
Secombes CJ. 1992.
Lipoxin-induced migration of fish
leukocytes. Journal of Leukocyte
Biology. 51:140-145.
Suzuki Y, Iida T. 1992. Fish granulocytes in the process of inflammation.
Annual Rev. of Fish Disease. 149-160.
Tierney KB, Farrell AP, Kennedy CJ. 2004. The differential leucocyte
landscape of four teleosts:
juvenile Oncorhynchus kisutch,
Clupea pallasi, Culaea inconstans and Pimephales promelas. Journal of Fish Biology. 65:906-919.
Utami DT, Prayitno SB, Hastuti S, Santika A. 2013. Gambaran parameter hematologis pada
ikan nila (Oreochromis niloticus)
yang diberi Vaksin DNA
Streptococcus iniae dengan
dosis yang berbeda. Journal of
Aquaculture Management and Technology. 2(4):7-20.
Wong KH, Cheung PC. 2000. Nutritional evaluation of some subtropical red and green seaweeds I. proximate composition, amino acid profiles and some
physico-chemical properties. Food Chem.
71:475-482.
Woo PTK. 1979. Trypanoplusma
salmositica: experimental infections in rainbow trout,
Salmo guirdneri. Experimental Parasitology. 47:36-48.