BAB 2
TINJAUAN PUSTAKA
2.1 Pasir Kuarsa
Pasir kuarsa dikenal dengan nama pasir putih merupakan hasil pelapukan batuan
yang mengandung mineral utama seperti kuarsa dan feldsfar. Pasir kuarsa
mempunyai komposisi gabungan dari SiO2, Al2O3, CaO, Fe2O3, TiO2, MgO, Na2O
dan K2O yang berwarna putih bening atau warna yang lain bergantung pada
senyawa pengotornya (Siswanto,2012). Sifat fisik pasir kuarsa
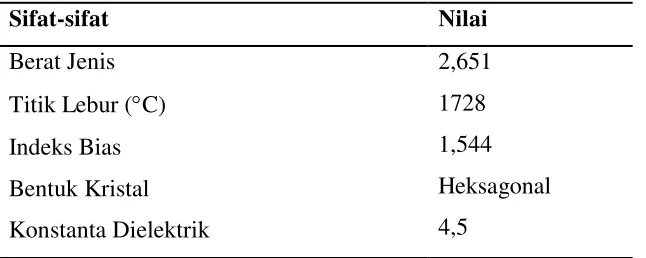
Tabel 2.1 Sifat-sifat kuarsa (Norton, 1974)
Sifat-sifat Nilai
Berat Jenis
Titik Lebur (C)
Indeks Bias
Bentuk Kristal
Konstanta Dielektrik
2,651
1728
1,544
Heksagonal
4,5
Pasir kuarsa biasanya dimanfaatkan untuk berbagai keperluan dengan
berbagai ukuran tergantung aplikasi yang dibutuhkan seperti dalam industri ban,
karet, gelas, semen, beton, keramik, tekstil, kertas, kosmetik, elektronik, cat, film,
pasta gigi, dan lain-lain. Saat ini dengan perkembangan teknologi mulai banyak
aplikasi penggunaan silika pada industri semakin meningkat terutama dalam
penggunaan silika pada ukuran partikel yang kecil sampai ukuran mikron atau
bahkan nanosilika. Kondisi ukuran partikel bahan baku yang diperkecil membuat
produk memiliki sifat yang berbeda yang dapat meningkatkan kualitas (Siswanto,
2012). Pasir kuarsa juga digunakan secara luas dalam industri keramik, metalurgi,
dalam pembuatan batu tahan api dan digunakan dalam skala besar sebagai
pembentuk jaringan dalam industri kaca (McColm, 1983). Adapun pasir kuarsa
Gambar 2.1. Pasir Kuarsa
2.2 Silika (SiO2)
Silika terdiri dari satu atom Si dan dua atom O, dimana Si memiliki nomor atom
14 dengan konfigurasi elektron [Ne]3s23p2 sedangkan atom O memiliki nomor atom 8 dengan konfigurasi elektron 1s22s22p4. Silika (SiO2) memiliki ikatan ion
dan ikatan kovalen yang hampir berimbang (Sudirham dan Utari, 2010).
Pada suhu 573C, kuarsa yang biasa atau α-kuarsa dapat berubah struktur secara reversibel menjadi β-kuarsa yang memiliki densitas yang lebih rendah dan pada suhu 867C, β-kuarsa berubah menjadi suatu modifikasi kristal yang berbeda
yaitu β-tridimit yang masih lebih tinggi, pada suhu 1470C, β-tridimit menjadi suatu modifikasi ketiga yang disebut β-kristobalit (Iller,2007).
Ada tiga bentuk polimorf dari silika berdasarkan kestabilannya terhadap
kenaikan suhu tinggi (McColm, 1983), yaitu:
a. Kuarsa, sampai pada suhu 870C
b. Tridimit, pada suhu 870 sampai 1470C
c. Kristobalit, pada suhu 1470C sampai 1730C
Tridimit merupakan bentuk silika yang jarang ditemui di alam tetapi
sangat penting sebagai bahan tahan api. Sedangkan kristobalit merupakan bentuk
lain dari silika dan dianggap merupakan komponen pengotor dari kuarsa karena
dapat mencegah pembentukan kristal kuarsa. Kristobalit tidak berlimpah di alam
tetapi memiliki kegunaan sebagai bahan yang ditambahkan pada keramik tahan
api (Norton, 1974)
Masing-masing dari ketiga bentuk diatas memiliki perubahan pada suhu
tinggi dan rendah dimana strukturnya hanya sedikit berubah oleh perubahan yang
sederhana pada orientasi dari SiO4 yang relatif tetrahedral satu sama lain.
Perubahan bentuk
Gambar 2.2. Perubahan polimorf dari silika (Borsoum, 1997)
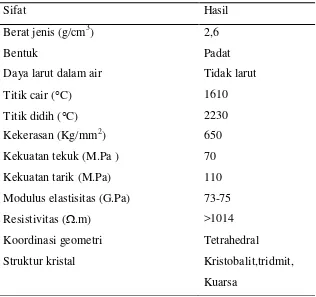
Adapun sifat-sifat silika dapat dilihat pada Tabel 2.2 dibawah ini
Tabel 2.2. sifat-sifat silika (Iler, 1979)
Sifat Hasil
Berat jenis (g/cm3) 2,6
Bentuk Padat
Daya larut dalam air Tidak larut
SiO2(s) + 4HF(aq) SiF4(aq) + 2H2O(l)
SiO2(s) + 6HF(aq) H
2[SiF6](aq) + 2H2O(l)
SiO2(s) + 2NaOH (aq) Na2SiO3 + H2O Adapun sifat kimia dari silika (SiO2) yaitu:
Mineral silika mempunyai berbagai sifat kimia antara lain sebagai berikut:
a. Reaksi Asam
Silika relatif tidak reaktif terhadap asam kecuali terhadap asam
hidrofluorida dan asam phospat.
(Vogel, 1985)
Dalam asam berlebih reaksinya adalah:
(Vogel, 1985)
b. Reaksi Basa
Silika dapat bereaksi dengan basa, terutama dengan basa kuat, seperti
dengan hidroksi alkali
(Vogel, 1985)
2.3 Silikon
Silikon pada kerak bumi sebesar 27,69% dan merupakan unsur kedua terbanyak di
kerak bumi sedangkan didalam tanah berkisar 23-35% (Makarim, 2007). Silikon
tidak tersedia di alam bebas, biasanya bentuk silikon yang tersedia di alam bebas
berikatan dengan oksigen (sebagai oksida) contohnya silikon oksida yang terdapat
pada pasir kuarsa, batuan kuarsit, dll (Gustiono, 2012). Sumber utama silikon
dalam tanah adalah mineral primer, sekunder, dan kuarsa (SiO2). Kuarsa
merupakan mineral utama di dalam lapisan tanah yang mengandung hingga
90-95% silikon dalam fraksi debu dan pasir (Makarim, 2007)
Silikon biasanya diklasifikasikan kedalam tiga level kemurnian (Gustiono,
2012), yaitu :
1. Metallurgical Grade Silicon (MG-Si)
Tingkat kemurnian dari Metallurgical Grade Silicon adalah 98%. Metallurgical
Grade Silicon biasanya digunakan pada paduan alumunium maupun baju tahan
api dan sebagai bahan baku untuk industri silikon yang sesuai untuk aplikasi P V
penggunaan energi matahari dengan cara mengubah energi cahaya matahari
menjadi energi listrik.
2. Solar Grade Silicon (SG-Si)
Tingkat kemurnian dari Solar Grade Silicon adalah 99,9999% (biasanya disebut
dengan 6 N ataupun six nines pure). Solar Grade Silicon biasanya digunakan pada
aplikasi P V (Photo Voltalic).
3. Electronic Grade Silicon (EG-Si)
Tingkat kemurnian dari Electronic Grade Silicon adalah 99,999999% (biasanya
disebut dengan 9 N ataupun nine nines pure). Electronic Grade Silicon digunakan
untuk membuat semi conductor wafers.
2.3.1 Sifat Fisis dan Sifat Kimia dari Unsur Silikon
Silikon tidak terdapat bebas di alam, tetapi ditemukan dalam sebagian besar
batu, pasir, dan tanah liat. Silikon bersifat elektropositif sehingga bertindak
seperti metaloid atau semikonduktor. Dalam beberapa bentuk silikon dapat
bersifat menyerupai logam dan non logam. Pada beberapa senyawa yang disebut
polimer, silikon akan berkonjugasi dengan oksigen, dalam kasus ini silikon
bersifat sebagai non logam.
Terdapat dua jenis alotrop dari silikon, diantaranya adalah pasir (silikon
dioksida), dan kristal dengan sebuah logam kelabu yang dikenal sebagai
semikonduktor dalam industri elektronik. Kristal Silikon ditumbuh kembangkan
dengan sendirinya melalui metode yang dikenal dengan Proses Czochralski
Berikut ini adalah sifat fisis dari unsur silikon (Greenwood, 1997) :
Silikon yang berukuran besar relative tidak reaktif kecuali pada suhu
tinggi. Silikon juga tidak reaktif terhadap air asam, namun mudah larut dalam
cairan alkali panas, adapun reaksi yang terjadi
Si+ 4OH- SiO44- + 4H+
Silikon tidak dapat membentuk senyawa biner dengan unsur dari kelompok (Ge,
Sn, Pb) tetapi dapat terjalin dengan karbon, SiC. Mayoritas senyawa silikon
membentuk struktur tetrahedral, tetapi struktur dengan koordinasi enam juga
dapat terjadi. Contoh terbaru dari persenyawaan Si yang berkoordinasi-3 dengan
struktur piramida adalah anion Si44- (isoelektronik dengan molekul tetrahedral
P4), yang seringkali ditemukan dalam ‘Silicide’ (CsSi). Terdapat banyak diskusi
terkait kebolehjadian Si dalam ester ortosilikat dari pyrocatechol yang
membentuk bilangan koordinasi 4 dengan struktur planar. Si dapat memiliki
bilangan koordiansi 5 dengan struktur trigonal bipiramid atau square pyramid.
Banyak contoh dari Si yang berbilangan koordinasi 6 dengan struktur
oktahendral. Sebuah contoh dari Si yang memiliki bilangan koordinasi 7 telah
teridentifikasi. Dan kadang – kadang terdapat contoh dari Si yang memiliki
2.4. Metode Reduksi Silika
Ada beberapa metode reduksi silika, antara lain
1. Reduksi Aluminotermik
Proses reduksi ini menggunakan alumunium sebagai bahan pereduksi yang secara
umum dikenal sebagai reduksi aluminotermik. Dikarenakan alumunium
merupakan sebuah logam yang lebih aktif dari silikon, maka almunium dapat
mereduksi silikon dioksida sehingga dihasilkan silikon. Reaksi ini sangat
eksotermik dan kalor yang dilepaskan tersebut cukup untuk mempertahankan
reaksi dengan perambatan yang cepat terhadap pembakaran tanpa penambahan
energi lagi. Penggunaan reduksi aluminotermik disarankan dalam memproduksi
mateial-material komposit (Das, 2002).
Sintesis material-material komposit dari alumina-alumunium silikon juga
disarankan menggunakan reduksi aluminotermik dengan campuran dari Al dan
SiO2 sesuai reaksi berikut:
3 SiO2 + 4 Al 2 Al2O3 + 3 Si
Reaksi ini dapat diterapkan untuk memproduksi silikon. Namun setelah alumina
terbentuk melalui reaksi diatas dengan adanya silika, akan memungkinkan dua
reaksi lain yang terjadi, yaitu pembentukan mullite dan reduksi silikon dari
mullite.
3 Al2O3 + 2 SiO2 Al6Si2O13
8 Al + 3 Al6Si2O13 13 Al2O3 + 6 Si
Pembentukan mullite dan alumina sebagai hasil reduksi dari reduksi
aluminotermik tidak cocok dalam suasana asam (Wang and Shi, 2002).
2. Reduksi Karbotermik
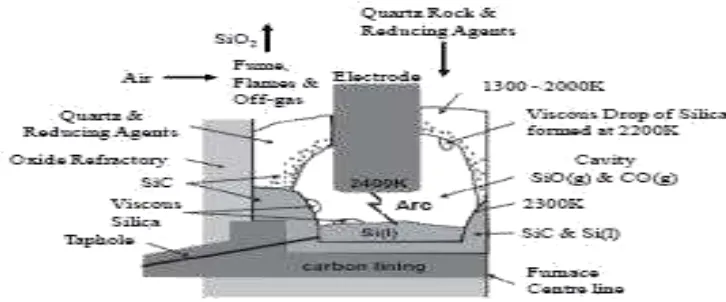
Silikon didapatkan dengan cara reduksi karbotermik, dimana kuarsa dicampurkan
dengan material karbon. Reaksi yang terjadi selama proses reduksi ini adalah :
SiO2(s) + C(s) Si(s) + CO2(g)
Reaksi yang terjadi pada tanur dibedakan menjadi dua, yaitu reaksi pada
inner hot zone dan outer cooler zone. Silikon cair dihasilkan pada inner zone yang
mana temperaturnya berkisar antara 1900-2100C, Reaksi kimia yang terjadi
SiO(g) + SiC(s) 2 Si(l) + CO(g)
Pada outer zone dimana temperaturnya dibawah 1900C, SiO(g) dan CO(g),
yang keluar dari inner zone akan bereaksi dengan karbon bebas (Gustiono, 2012).
Reaksinya adalah:
SiO(g) + 2C(s) SiC(s) + CO(g)
2 SiO(g) Si(l) + SiO2(s)
Adapun skema prosesnya dapat dilihat pada gambar berikut :
Gambar 2.3. Proses reduksi silika dengan karbon (Sadique,2010)
3. Reduksi Kalsiometrik
Reduksi kalsiotermik sama dengan reduksi aluminotermik. Sebuah proyek
penelitian pada reduksi dari silika amorf (yang diperoleh dari sekam padi)
menjadi silikon dengan kemurnian yang wajar melalui proses reduksi kalsiometrik
menggunakan kalsium telah dilakukan oleh Mishra (1985). Reaksi yang terjadi
sebagai berikut
SiO2 + 2 Ca 2 CaO + Si
Reduksi dari silika amorf menjadi silikon menggunakan kalsium yang
Mg2Si(s) + SiO2(s) 2 MgO(s) + 2 Si(s)
Si(s) + 2 Mg(s) Mg2Si(s)
pencucian asam dengan menggunakan HNO3 dan HF pekat adalah sebesar 99,9
persen (Mishra, 1985).
4. Reduksi magnesiotermik
Silika (SiO2) dapat direduksi oleh magnesium untuk menghasilkan silikon dengan
reaksi :
SiO2 + 2 Mg 2 MgO + Si
Reaksi dapat melibatkan pembentukan Mg2Si terlebih dahulu, diikuti
dengan reduksi silika oleh Mg2Si melalui reaksi kimia berikut :
ΔG(900C) = -308,5 kJ/mol ΔG(900C) = -181,8 kJ/mol
dengan adanya kelebihan Mg pada reaktan, Mg2Si akan lebih banyak terbentuk
melalui reaksi:
terkait dengan produksi silikon yang menghambat proses pelengketan hasil
silikon.
Namun, belum ditemukan aplikasi industri yang luas untuk reduksi
magnesiotermik dikarenakan reaksinya yang eksotermis yang menyebabkan
peningkatan suhu secara berlebihan dan menghasilkan produk magnesium Silisit
(Mg2Si) dengan produk Si (Zulumyan, 2006).
Pembentukan Mg2Si dipengaruhi oleh Mg yang berlebih dan suhu reduksi.
Pengurangan jumlah magnesium mengakibatkan pengurangan Mg2Si dan dengan
menaikkan suhu pada perbandingan campuran Mg dan SiO2 akan meningkatkan
pembentukan Mg2Si. Namun dalam studi yang dilakukan oleh Kalem (2004),
Mg2SiO4 dalam kondisi tertentu tidak diperhitungkan. Selain itu, studi kuantitatif
pada tahap reduksi hasil tidak dilakukan dan semata-mata didasarkan pada
intensitas puncak dari Mg2Si, MgO dan Si.
2.5. Nanosilikon
Nanosilikon dikenal juga sebagai mikrokristalin silikon. Nanosilikon adalah
bentuk silikon berpori yang merupakan fase alotropik dari silikon yang kecil pada
fase amorf. Hal ini berbeda dengan silikon polikristal yang terdiri dari biji-bijian
silikon kristal .
Nanosilikon memiliki banyak kelebihan dibandingakan dengan silikon
biasa, salah satunya adalah memiliki mobilitas elektron yang lebih tinggi, karena
adanya bentuk kristal pada fase amorfnya. Selain itu nanosilikon juga
menunjukkan adanya peningkatan penyerapan dalam panjang gelombang
inframerah yang membuat nanosilikon menjadi bahan penting dalam pembuatan
sel surya. Salah satu kelebihan yang paling penting dari silikon nanokristalin,
adalah nanosilikon memiliki stabilitas yang lebih baik dibanding dengan silikon
biasa, hal ini disebabkan nanosilikon memiliki ukuran partikel yang lebih kecil.
Selain itu nanosilikon memilliki daya simpan yang lebih baik dibanding dengan
silikon biasa maupun polikristalin silikon lainnya (Luo, 2013)..
Nanosilikon sendiri memiliki titik didih 2355C dan titik lebur 1410C
serta densitas 2,33 g/ml (Sigma Aldrich, 2014) dan memiliki distribusi warna
kuning hingga coklat (Luo, 2013).
Gambar 2.4. Serbuk Nanosilikon (Sigma Aldrich, 2014)
Perbedaan warna pada serbuk silikon yang dihasilkan disebabkan oleh
emisi gelombang pantulan cahaya pada serbuk yang ukurannya berbeda (Delley,
2.6. Sintesis Nanosilikon
Favorz (2014) telah membuat nanosilikon dari pasir pantai secara magnesiotermik
dengan penambahan NaCl. Reaksi dilakukan pada suhu 700C di dalam tanur
listrik selama 6 jam dan menghasilkan nanosilikon yang memiliki kemurnian 53,3
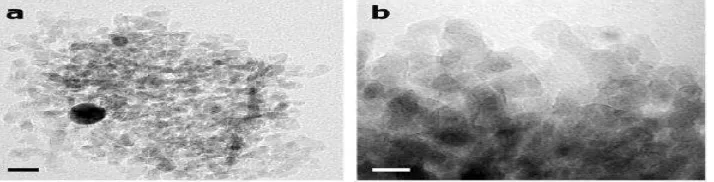
% dengan ukuran partikel pada range 8−10 nm dan dari hasil karakterisasi TEM
hasil karakterisasi menunjukkan bahwa nanosilikon memiliki ukuran partikel
yang sangat kecil dan cenderung membentuk aglomerasi antara satu dengan yang
lainnya dan memiliki ukuran partikel yang terdistribusi sekitar 9 nm.
Adapun gambar analisa TEM nya dapat dilihat pada gambar 2.5 di bawah ini :
Gambar 2.5. Hasil analisis TEM nanosilikon. a. perbesaran 20 nm
b.perbesaran 10 nm ( Favorz, 2014 )
Kemudian Liang (2014) juga telah membuat nanosilikon dengan mereduksi
cairan alkali silika menggunakan magnesium, yang dilakukan di dalam
autoclave selama 10 jam pada suhu 180°C, dan menghasilkan nanosilikon
yang memiliki kemurnian yang rendah yakni 25% dengan ukuran partikel
sebesar 80 nm.
Kumar (2012) telah membuat nanosilikon dengan menggunakan microwave
plasma. Nanosilikon disintesis dengan menggunakan nukleasi uap homogen dari
silikon yang dihasilkan oleh injeksi radial uap silikon tetraklorida dan
menghasilkan nanosilikon yang memliki kemurnian 40% serta ukuran
partikelnya memiliki jarak distribusi telalu besar yakni 20 nm – 50 nm.
Selanjutnya Suwandy (2015) juga telah membuat nanosilikon secara
magnesiotermik dengan penambahan NaCl pada suhu 800C selama 6 jam dan
nanosilikon yang dihasilkan memiliki kemurnian 49,4 % dengan ukuran partikel
2.7.Kalium Klorida
Kalium Klorida (KCl) adalah senyawa garam alkali tanah dengan halida yang
terbentuk dari unsur kalium dan klorida. Garam tersebut tidak berbau dan
memiliki bentuk kristal putih atau tak berwarna dan mudah larut dalam air yang
memiliki rasa seperti garam pada umumnya. (Penn State Agronomy Guide, 2010).
2.7.1. Sifat Fisika Kalium Klorida
Sifat Hasil
Rumus Molekul KCl
Berat Molekul 74,56 gr/mol
Suhu Leleh 790C
Suhu Didih 1.500C
Indeks Bias 1,4904 (589 nm)
Densitas 1.984 g/cm3
Kelarutan Larut dalam golongan alkohol dan alkali
(Kirk, 1967)
Entalpi Pembentukan Standard -436 kJ/mol
Entropi Molar Standard 83 J/mol K (Steven, 2009)
2.7.2. Sifat Kimia
Kalium Klorida larut dalam pelarut polar, dan biasanya digunakan untuk kalibrasi
konduktivitas listrik, karena larutan KCl stabil, memungkinkan untuk pengukuran
direproduksi. Dalam air terionisasi menjadi ion K+ dan Cl-. Meskipun kalium lebih elektropositif dari natrium, KCl dapat dikurangi dengan logam melalui
reaksi dengan logam natrium pada suhu 850C karena kalium lebih tidak stabil
dapat dihilangkan dengan destilasi.
(lihat prinsip Le Chateleir)
KCl(l) + Na(l)↔ NaCl(l) + K(g)
Metode ini merupakan metode utama untuk memproduksi logam kalium.
Elektrolisis (digunakan untuk garam) gagal karena kelarutan kalium yang tinggi
Reaksi- Reaksi garam KCl (Kalium Klorida) dapat
1. Bereaksi dengan asam kuat seperti H2SO4 menghasilkan asam klorida
2KCl + H2SO4 K2SO4 + 2HCl
2. Bereaksi dengan Asam Lemah seperti CH3COOH
KCl + CH3COOH CH3COOK + HCl
3. Bereaksi dengan H2O, CO2, dan Trimethylamine membentuk kalium
bikarbonat
KCl + N(CH3)3 + H2O + CO2 KHCO3 + N(CH3)3HCl
4. Bereaksi dengan Kalsium Hodroksida
2KCl + Ca(OH)2 2 KOH+ CaCl2
(Kirk, 1967)
2.7.3 Pembuatan KCl (Kalium Klorida)
Kalium Klorida diekstrak dari mineral silvit, karnali, dan kalium. Hal ini juga
diambil dari air garam dan dapat diproduksi dengan kristalisasi dari larutan, flotasi
atau pemisahan elektrostatik dari mineral yang sesuai. Ini adalah produk
sampingan dari produksi asam nitrat dari kalium nitrat dan asam klorida.kalium
klorida didalam laboratorium dapat di buat dengan mereaksikan kalium
hidroksida (atau basa kalium lainnya) dengan asam klorida. KOH + HCl → KCl + H2O
Reaksi ini adalah reaksi netralisasi asam-basa. Garam yang dihasilkan kemudian
dapat dimurnikan dengan rekristalisasi. Metode lain akan memungkinkan kalium
untuk membakar di hadapan gas klorin, juga reaksi yang sangat eksoterm;
K + Cl2→ 2 KCl (Elizabeth, 2006).
2.6.Difraksi Sinar –X (XRD)
Sinar X ditemukan pertama kali oleh Wilhelm Conrad Rontgen pada tahun 1895.
Karena asalnya tidak diketahui waktu itu, maka disebut sinar-X. Sinar X
digunakan untuk tujuan pemeriksaan yang sifatnya tidak merusak pada material
maupun manusia. Disamping itu, sinar X dapat juga digunakan untuk
menghasilkan pola difraksi tertentu yang dapat digunakan dalam analisis kualitatif
Pada saat suatu material dikenai sinar X, maka intensitas sinar yang
ditransmisikan lebih rendah dari intensitas sinar datang. Hal ini disebabkan
adanya penyerapan energi oleh material dan juga penghamburan sinar oleh
atom-atom dalam material tersebut.Berkas sinar X yang dihamburkan tersebut ada yang
saling menghilangkan karena fasanya berbeda dan ada juga yang saling
menguatkan karena fasanya sama. Berkas sinar X yang saling menguatkan itulah
yang disebut sebagai berkas difraksi ( Warren,1969).
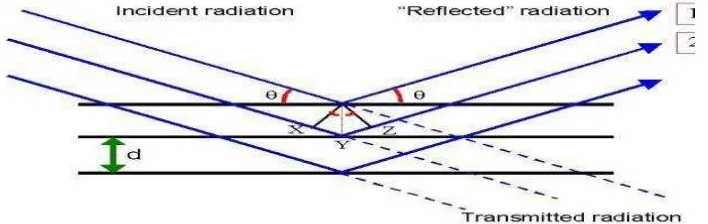
Peristiwa terjadinya sinar X dapat dilihat pada gambar 2.6 di bawah ini:
Gambar 2.6. Difraksi sinar X (Cullity, 1967 )
Hukum Bragg merupakan perumusan matematika tentang persyaratan
yang harus dipenuhi agar berkas sinar X yang dihamburkan tersebut merupakan
berkas difraksi. Sinar X dihasilkan dari tumbukan antara elektron kecepatan tinggi
dengan logam target. Dari prinsip dasar ini, maka dibuatlah berbagai jenis alat
yang memanfaatkan prinsip dari Hukum Bragg ini.
Difraksi Sinar-X (XRD) merupakan salah satu alat yang
memanfaatkanprinsip tersebut dengan menggunakan metode karakterisasi
material yang paling tua dan paling sering digunakan hingga sekarang. Teknik ini
digunakan untuk mengidentifikasi fasa kristalin dalam material dengan cara
menentukan parameter struktur kisi serta untuk mendapatkan ukuran partikel.
Dasar dari prinsip pendifraksian sinar X yaitu difraksi sinar-X terjadi karena
adanya hamburan elastis foton-foton sinar-X oleh atom dalam sebuah kisi
interferensi yang konstruktif. Dasar dari penggunaan difraksi sinar-X untuk
mempelajari kisi kristal adalah berdasarkan persamaan Bragg: n.λ = 2.d.sin θ ; n = 1,2,...
Berdasarkan persamaan Bragg, jika seberkas sinar-X dijatuhkan pada
sampel kristal,maka bidang kristal itu akan membiaskan sinar-X yang memiliki
panjang gelombang sama dengan jarak antar kisi dalam kristal tersebut. Sinar
yang dibiaskan akan ditangkap oleh detektor kemudian diterjemahkan sebagai
sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat dalam sampel,
makin kuat intensitas pembiasan yang dihasilkannya. Tiap puncak yang muncul
pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu
dalam sumbu tiga dimensi. Puncak-puncak yang didapatkan dari data pengukuran
ini kemudian dicocokkan dengan standar difraksi sinar-X untuk hampir semua
jenis material. Standar ini disebut JCPDS (Joint Committe On Powder Diffraction
Standars) (Cullity,1967).
Prinsip kerja XRD secara umum adalah sebagai berikut : XRD terdiri dari
tiga bagian utama, yaitu tabung sinar-X, tempat objek yang diteliti, dan detektor
sinar X. Sinar X yang dihasilkan dari tabung sinar X yang terdiri dari katoda
digunakan untuk memanaskan filamen, sehingga menghasilkan elektron.
Perbedaan tegangan menyebabkan percepatan elektron akan menembaki objek.
Ketika elektron mempunyai tingkat energi yang tinggi dan menabrak elektron
dalam objek maka dihasilkan pancaran sinar X. Objek dan detektor berputar
untuk menangkap dan merekam intensitas refleksi sinar X. Detektor merekam dan
memproses sinyal sinar X dan mengolahnya dalam bentuk grafik (Chung,1973).
2.7.Ultrasonik
Ultrasonik merupakan bunyi yang mempunyai frekuensi tinggi. Bunyi pada
dasarnya mempunyai frekuensi dari yang kecil hingga tinggi. Berdasarkan
kegunaannya, bunyi dapat dibedakan menjadi: ( Wardiyati,2004)
1. Bunyi yang bisa didengar oleh manusia ( 16 Hz – 18 Hz )
2. Tenaga ultrasonik konvensional ( 20 kHz – 100 kHz )
3. Sonochemistry (20 kHz–2MHz )
Pemanfaatan ultrasonik pada bidang kimia disebut dengan istilah
sonochemistry. Pemanfaatannya sangat luas, seperti proses ekstraksi,
kristalisasi,sintesis bahan, dan pembuatan katalis.
Tenaga ultrasonik pada proses – proses kimia tidak secara langsung
kontak dengan media yang bersangkutan, akan tetapi melalui media perantara
yang berupa cairan. Gelombang bunyi yang dihasilkan oleh tenaga listrik,
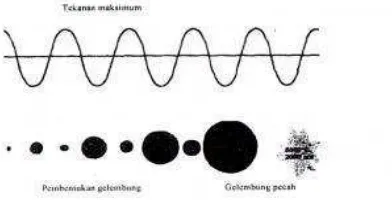
diteruskan oleh media cair ke media yang dituju melalui fenomena kavitasi.
Fenomena kavitasi yaitu terbentuknya gelembung kecil pada media perantara,
yang lama kelamaan gelembung akan bertambah besar dan akhirnya akan pecah
dan mengeluarkan tenaga besar. Tenaga inilah yang digunakan dalam proses
kimia. Fenomena kavitasi dapat dilhat pada gambar 2.7 di bawah ini:
Gambar 2.7. Fenomena kavitasi ( Wardiyati, 2004)
2.11.Cleaning Bath Ultrasonic
Ultrasonik jenis bath secara umum mempunyai spesifikasi sebagai berikut:
a. Daya tranduser : 1 sampai 5 Wcm-2 b. Frekuensi : 40 kHz
c. Kapasitas: 1,5 L ( satu tranduser) sampai dengan 50.000 L ( lebih dari satu
tranduser )
d. Medium : air ditambah sedikit surfaktan atau detergen untuk menurunkan
tegangan permukaan
Beberapa jenis cleaning bath, yaitu:
a. Indirect cleaning bath
b. Direct cleaning bath
Direct cleaning bath lebih cocok digunakan pada proses kimia dengan bahan
indirect cleaning bath ultrasonic digunakan untuk bahan yang mudah menguap ,
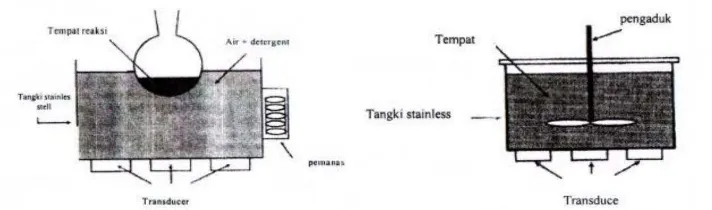
maka wadahperlu dilengkapi penutup (Wardiyati, 2004). Skema perbedaan antara
indirect cleaning bath dan direct cleaning bath dapat dilihat pada gambar 2.8.
Gambar 2.8. Gambar Indirect dan direct bath ultrasonic ( Wardiyati, 2004).
Kelebihan dan kekurangan pemakaian ultrasonik jenis Cleaning bath pada
sono chemistry menurut ( Wardiyati,2004) adalah sebagai berikut;
Kelebihan:
- Mudah didapat secara umum atau luas
- Tidak mahal
- Daerah akustik terdistribusi secara merata
- Dapat menggunakan gelas reaksi biasa
- Bath dapat digunakan sebagai tempat reaksi
Kekurangan:
- Daya kurang besar (maksimum 5 W/cm2)
- Energi masuk harus dikaji pada sistem, karena tenaga yang diperlukan
bergantung pada ukuran bath, jenis bath, jenis wadah, posisi wadah dalam
bath
- Frekuensi ultrasonik tidak sama secara universal
- Sulit mengontrol suhu