POTENSI LAMUN JENIS Enhalus acoroides DAN Thalassia hemprichii DARI PULAU PRAMUKA, DKI JAKARTA SEBAGAI BIOANTIFOULING
CITRA SATRYA UTAMA DEWI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
3
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa tesis “Potensi Lamun Jenis Enhalus acoroides dan Thalassia hemprichii dari Pulau Pramuka, DKI Jakarta Sebagai Bioantifouling” adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2012
Citra Satrya Utama Dewi NIM C551090041
5 ABSTRACT
CITRA SATRYA UTAMA DEWI. Potential Bioactive of Enhalus acoroides and Thalassia hemprichii for BIOANTIFOULING in Pramuka Island, DKI Jakarta. Under direction of DEDI SOEDHARMA and MUJIZAT KAWAROE.
Biochemically, seagrass has natural antifouling compounds potential to substitute harmful compund of TBT (tributhyl tin) in the antifouling paint. The aim of this study was to explore potential seagrass as bioantifouling materials. Particulary of Thalassia hemprichii and Enhalus acoroides extraction was performed using two solvents: methanol (polar) and n-hexane (non-polar). The results showed that extracts of Thalassia hemprichii and Enhalus acoroides contains flavonoids, a chemical compound potential as bioantifouling. Based on toxicity tests using Brain Shrimp Lethal Toxic (BSLT) method, methanol extract of Enhalus acoroides was more toxic (5.74 ppm) than n-hexane extract (1309.42 ppm). Biofilm inhibitory activity assay showed that inhibition performance seagrass extract (200 mg/ml) were weak (1.00 mm) to moderate (5.33mm).
7
RINGKASAN
CITRA SATRYA UTAMA DEWI. Potensi Lamun Jenis Enhalus acoroides dan Thalassia hemprichii Dari Pulau Pramuka, DKI Jakarta Sebagai Bioantifouling. Dibimbing oleh DEDI SOEDHARMA dan MUJIZAT KAWAROE.
Lamun (seagrass) merupakan satu-satunya tumbuhan berbunga (Angiospermae) yang memiliki kemampuan beradaptasi untuk hidup di laut. Keragaman jenis lamun di Kepulauan Seribu dilaporkan ada delapan jenis, yaitu Enhalus acoroides, Thalassia hemprichii, Cymodocea serrulata, Cymodocea rotundata, Halophila ovalis, Halophila minor, Syringodium isoetifolium, dan Halodule uninervis (Mardesyawati dan Anggraeni 2009). Sejak dekade terakhir beragam penelitian bioteknologi telah mulai dilakukan untuk mengeksplorasi lamun, guna mengetahui potensi bahan bioaktif yang terkandung di dalamnya. Qi et al. (2008) melakukan pengujian terhadap lamun jenis Enhalus acoroides yang hasilnya menunjukkan bahwa jenis tersebut mengandung bahan aktif potensial untuk menghambat proses penempelan larva (antilarva) Bugula neritina pada bagian daunnya, serta menghambat proses predasi daun (antifeedant) oleh Spodoptera litura.
Potensi lamun sebagai antifeedant dan anti-larva menimbulkan dugaan bahwa lamun dapat digunakan sebagai bahan baku subtitusi senyawa kimia tributyl tin (TBT), yang umum digunakan sebagai campuran cat antifouling. Cat antifouling tersebut umum digunakan untuk mengatasi masalah organisme penempel (biofouling), namun tidak ramah lingkungan, sehingga mengakibatkan dampak negatif pada ekosistem (Darmayanti 1994). Salah satu contoh dampak negatif pada ekosistem, adalah indikasi terganggunya organ reproduksi (imposex) pada Thais sp. yang ditemukan di Perairan Pelabuhan Ratu (Soedharma dan Fauzan 1996) dan di Pantai Barat Semenanjung Malaysia (Yusuf et al. 2011). Sejak 17 September 2008, Organisasi Maritim Internasional (IMO) melarang pemakaian cat dengan campuran TBT untuk cat kapal, oleh karena itu pencarian bahan antifouling yang ramah lingkungan (bioantifouling), khususnya yang berasal dari lamun dibutuhkan.
Tujuan dari penelitian ini adalah (1) menganalisis kandungan golongan senyawa bioaktif lamun; (2) menganalisis toksisitas bahan bioaktif lamun; dan (3) menganalisis potensi lamun sebagai penghambat biofouling (bioantifouling).
Berdasarkan penelitian yang telah dilakukan, diketahui bahwa rendemen yang dihasilkan oleh lamun jenis Enhalus acoroides dan Thalassia hemprichii meningkat seiring dengan kepolaran pelarut. Nilai rendemen kedua jenis lamun yang diekstraksi dengan pelarut polar (methanol) lebih tinggi jika dibandingkan dengan yang diekstraksi dengan pelarut non polar (n–heksana), artinya Enhalus acoroides dan Thalassia hemprichii mengandung senyawa polar lebih banyak dari pada senyawa non polar.
Hasil uji fitokimia, menunjukkan bahwa ekstrak metanol dari Enhalus acoroides mengandung senyawa alkaloid, flavonoid, benedict, dan ninhidrin. Ekstrak metanol lamun jenis Thalassia hemprichii diketahui mengandung senyawa golongan alkaloid, steroid, flavonoid, benedict dan ninhidrin. Uji
fitokimia yang dilakukan terhadap ekstrak n–heksana dari Enhalus acoroides menunjukkan bahwa ekstrak tersebut mengandung senyawa pada golongan flavonoid dan gula pereduksi, sementara uji yang dilakukan terhadap ekstrak Thalassia hemprichii menunjukkan ketersediaan senyawa bioaktif pada golongan alkaloid, steroid, flavonoid, dan gula pereduksi.
Berdasarkan uji toksisitas terhadap organisme uji Artemia, diketahui bahwa Enhalus acoroides yang diekstrak dengan menggunakan metanol mengandung bahan bioaktif sangat toksik, yaitu 5,74 ppm, sementara ekstrak n-heksana dari jenis yang sama tingkat toksisitasnya sangat rendah (tidak toksik), yaitu 1309,42 ppm.
Hasil uji aktivitas hambat ekstrak lamun terhadap bakteri biofilm terpilih jenis Vibrio spp. dengan konsentrsai 200 mg/ml menunjukkan ekstrak Thalassia hemprichii yang diujikan terhadap bakteri Vibrio 4-3 MA membentuk zona hambat terbesar, yaitu 5.33 mm. Nilai zona hambat tersebut termasuk dalam golongan aktivitas sedang.
9
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar
IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
11
POTENSI LAMUN JENIS Enhalus acoroides DAN Thalassia hemprichii DARI PULAU PRAMUKA, DKI JAKARTA SEBAGAI BIOANTIFOULING
CITRA SATRYA UTAMA DEWI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Kelautan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2012
13
Judul Tesis :Potensi Lamun Jenis Enhalus acoroides dan Thalassia hemprichii Dari Pulau Pramuka, DKI Jakarta Sebagai Bioantifouling
Nama : Citra Satrya Utama Dewi
NIM : C551090041
Disetujui Komisi Pembimbing
Diketahui Ketua Program Studi Ilmu Kelautan
Dr. Ir. Neviaty P. Zamani, M.Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrulsyah, M.Sc. Agr
Tanggal Ujian : 19 Oktober 2012 Tanggal Lulus : Prof. Dr. Ir. Dedi Soedharma, DEA
Ketua
Dr. Ir. Mujizat Kawaroe, M.Si Anggota
15 PRAKATA
Puji dan syukur penulis panjatkan kepada ALLAH SWT atas semua nikmat iman dan islam yang dikaruniakan sehingga tesis ini berhasil diselesaikan. Tema yang penulis pilih dalam penelitian yang dilakukan sejak Maret 2011 ini adalah bioaktivitas lamun, dengan judul Potensi Lamun Jenis Enhalus acoroides dan Thalassia hemprichii dari Pulau Pramuka, DKI Jakarta Sebagai Bioantifouling. Lamun merupakan sumber daya hayati laut yang tersebar hampir diseluruh pantai Indonesia, namun masih sangat kurang informasi pemanfaatannya selain mafaat ekologis. Sejak akhir Tahun 1990-an, penelitian pemanfaatan lamun mulai banyak dilakukan, dan beberapa menunjukkan lamun potensial sebagai antibakteri, antijamur, dan antilarva. Potensi lamun tersebut menimbulkan dugaan bahwa lamun dapat dimanfaatkan sebagai bioantifuling. Oleh karena itu penelitian awal ini dilakukan untuk mengkaji potensi lamun sebagai bioantifuling. Semoga sedikit pemaparan ilmiah hasil penelitian ini dapat bermanfaat bagi pengembangan dunia kelautan.
Bogor, Desember 2012
17
UCAPAN TERIMAKASIH
Penelitian ini tidak akan dapat terlaksana dengan baik tanpa bantuan dari berbagai pihak, oleh karena itu penulis sangat berterimakasih kepada :
1. Papa, Mama, dan Amelia Satrya Assyifa, anakku atas doa, restu, dan kesabarannya, sehingga penulis dapat terus bertahan dan berjuang untuk menuntut ilmu serta menuntaskannya.
2. Prof. Dr. Ir. Dedi Soedharma, DEA dan Dr. Ir. Mujizat Kawaroe selaku komisi pembimbing tesis yang tidak sekedar memberikan masukan dan saran dalam pelaksanaan penelitian, namun juga bimbingan dan diskusi dengan kehangatan seorang Bapak dan Ibu sekaligus pendidik, sehingga penulis mampu menyelesaikan penelitian dan menulis tesis.
3. Dr. Ir. Neviaty P. Zamani, M.Sc selaku Ketua Program Studi Ilmu Kelautan yang memberikan masukan serta dorongan, sehingga semangat menyelesaikan tesis terus menyala tanpa henti.
4. Dr. Hawis Madduppa, M.Si selaku penguji luar pembimbing, atas saran dan masukan agar tesis ini menjadi lebih baik.
5. Laboratorium Mikrobiologi Pusat Penelitian Oseanografi (P2O) LIPI yang telah memberikan izin untuk menggunakan koleksi isolat bakteri biofilm dan fasilitas penelitian yang lainnya.
6. Keluarga Bagian Hidrobiologi Laut, Departemen ITK, FPIK – IPB atas kerjasama berbasis kekeluargaan dan beasiswa yang telah diberikan selama penulis menempuh studi.
7. Abang, mbak, adinda, sahabat kelu*warga besar ITK untuk pelajaran “bertahan hidup” yang baik sebagai anak rantau, sehingga penulis dapat menikmati masa-masa menjadi mahasiswa seutuhnya.
8. Kanda, ayunda, dan adinda keluarga HMI untuk pelajaran Nilai Dasar Perjuangan Islam (NDPI), terutama Kanda OP untuk praktikum NDPI yang sangat aplikatif.
9. Keluarga Siaga (Siap Antar Jaga): Beginer Subhan, M.Si, Dondy Arafat, M.Si, Fadhilah Rahmawati, S.Pi, Safrina Dyah Hardiningtyas, M.Si, Yuliana F. Syamsuni, M.Si, Lumban Nauli Lumban Toruan, M.Si, Heidi Retnoningtyas, S.Pi, M. Fahmi Fauzi, S.Pi, M. Ince A. Akbar, S.Pi, Febrina Desrianti, M.Si, Auhadillah Azizi, M.Si, dan Rahmi Purnomowati, M.Si atas limpahan kasih sayang, serta segenap bantuan jiwa dan raga yang tak tergantikan, sehingga penulis dapat melewati masa kritis, lalu bangkit dan menyelesaikan tesis.
10. Semua pihak yang turut membantu penelitian dan penulisan tesis yang tidak memungkinkan untuk dituliskan satu per satu.
19
RIWAYAT HIDUP
Penulis dilahirkan di Jember pada 27 Januari 1984, anak tunggal dari bapak Rahmat Utomo dan ibu Ratna Satrya Indra Dewi. Penulis menyelesaikan pendidikan Sekolah Menengah Umum di SMU Negeri 2 Bondowoso pada Tahun 2002, kemudian melanjutkan pendidikan sarjana di IPB, melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis menyelesaikan program sarjana di Jurusan Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan (FPIK) pada Tahun 2007. Pada Tahun 2009, penulis melanjutkan pendidikan pascasarjana di Mayor Ilmu Kelautan, Sekolah Pascasarjana IPB.
Sejak Tahun 2007 hingga sekarang penulis tercatat sebagai asisten dosen di Bagian Hidrobiologi Laut, Departemen Ilmu dan Teknologi Kelautan, FPIK – IPB. Dalam kurun waktu tersebut, penulis bertanggung jawab untuk membantu kegiatan praktikum mata kuliah Ekologi Laut Tropis, Keanekaragaman Hayati Laut, dan Biologi Laut. Penulis tercatat aktif pada forum taksonomi kelautan Indonesia, dan terlibat dalam pelatihan yang diadakan Tahun 2009 di Jakarta dan 2010 di Sanur, Bali. Pada Tahun 2010 penulis terpilih sebagai delegasi IPB bergabung dalam Pelayaran Kebangsaan Indonesia Muda, kegiatan tersebut diadakan oleh Kementerian Pendidikan Nasional, dengan menggunakan Kapal Penelitian LIPI, Baruna Jaya VIII.
21 DAFTAR ISI
Halaman
DAFTAR ISI ... xiii
DAFTAR TABEL ... 23
DAFTAR GAMBAR ... 25i
DAFTAR LAMPIRAN ... xviii
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 1
1.3. Tujuan dan sasaran ... 3
2. TINJAUAN PUSTAKA ... 5
2.1. Lamun ... 5
2.2. Potensi Bioaktif Lamun ... 7
2.3. Senyawa Antifouling ... 9
2.4. Biofouling ... 10
2.4.1. Makrofouling ... 11
2.4.2. Mikrofouling ... 12
2.5. Ekstraksi Senyawa Bioaktif ... 14
2.6. Uji Fitokimia ... 15
2.7. Uji Toksisitas ... 18
2.8. Uji Bioantifuling ... 19
3. METODOLOGI ... 21
3.1. Lokasi dan Waktu Penelitian ... 21
3.2. Alat dan Bahan ... 22
3.3. Metode Penelitian ... 23
3.3.1. Koleksi contoh lamun ... 23
3.3.2. Ekstraksi komponen bioaktif contoh lamun ... 25
3.3.3. Uji fitokimia ekstrak contoh lamun ... 25
3.3.4. Uji toksisitas ... 27
3.3.5. Uji bioantifuling ... 28
3.4. Analisis Data ... 30
4.1. Koleksi Contoh Lamun ... 31 4.2. Senyawa Bioaktif Enhalus acoroides dan Thalassia hemprichii ... 33 4.3. Golongan Senyawa Fitokimia ... 35 4.4. Toksisitas Senyawa Bioaktif Lamun ... 37 4.5. Uji bioantifuling ... 41 V. KESIMPULAN DAN SARAN ... 47 5.1. Kesimpulan ... 47 5.2. Saran ... 47 DAFTAR PUSTAKA ... 49 LAMPIRAN ... 55
23
DAFTAR TABEL
Halaman
1. Kategori toksisitas bahan ……… 19
2. Alat dan bahan yang digunakan selama penelitian ……….. 22 3. Hasil analisis kualitas perairan Pulau Pramuka, DKI Jakarta (Maret
2011) ………. 32
4. Berat ekstrak kasar Enhalus acoroides dan Thalassia hemprichii …….. 34 5. Hasil identifikasi kandungan golongan senyawa lamun jenis Enhalus
acoroides dan Thalassia hemprichii ………... 37
6. Nilai toksisitas ekstrak lamun terhadap hewan uji Artemia salina ……... 39 7. Hasil pengujian aktivitas hambat biofilm Enhalus acoroides dan
Thalassia hemprichii pada konsentrasi 20mg/ml ……… 43 8. Hasil pengujian aktivitas hambat biofilm Enhalus acoroides dan
25
DAFTAR GAMBAR
Halaman 1. Empat habitat unik bagi lamun tropis ... 5 2. Senyawa murni hasil purifikasi dan ilusidasi lamun jenis Thalassia
testudinum, flavones glycoside liteolin 7-O-β-glucopyransyl-2-sulfate . 8 3. Proses penempelan biofouling pada substrat padat di laut. ... 11 4. Tahapan penempelan bakteri biofilm pada substrat di laut... 12 5. Lokasi koleksi contoh lamun ... 21 6. Diagram alir penelitian... 24 7. Proses koleksi dan persiapan contoh lamun ... 24 8. Proses ekstraksi dan pasta rendemen lamun ... 25 9. Proses kegiatan uji fitokimia ... 27 10. Proses kegiatan uji toksisitas ... 28 11. Bagan alir seleksi bakteri uji ... 29 12. Proses mendapatkan bakteri terpilih ... 30 13. Proses uji aktivitas hambat biofilm ... 30 14. Foto lamun (A) Enhalus acoroides dan (B) Thalassia hemprichii ... 31 15. Rendemen ekstrak Enhalus acoroides dan Thalassia hemprichii ... 35 16. Grafik regresi hubungan log konsentrasi dan mortalitas A. salina
dalam nilai probit dari A) Ekstrak n-heksana Thalassia hemprichii; B) Ekstrak n-heksana Enhalus acoroides; C) Ekstrak methanol Thalassia
hemprichii; D) Ekstrak methanol Enhalus acoroides ... 40 17. (a) Koloni bakteri Vibrio spp. hasil seleksi dengan menggunakan
media TCBS; (b) Hasil identifikasi dengan metode pewarnaan gram
18. Hasil uji aktivitas hambat biofilm Enhalus acoroides dan Thalassia hemprichii pada konsentrasi 20mg/ml; Kertas cakram ditetesi Hex) pelarut n-heksana; Met) pelarut methanol; 1) Ekstrak Enhalus acoroides dengan pelarut methanol; 2) Ekstrak Thalassia hemprichii dengan pelarut methanol; 3) Ekstrak Enhalus acoroides dengan pelarut
n-heksana; 4) Ekstrak Thalassia hemprichii dengan pelarut n-heksana .. 43 19. Hasil uji aktivitas hambat biofilm Enhalus acoroides dan Thalassia
hemprichii pada konsentrasi 200mg/ml; Kertas cakram ditetesi 1) Ekstrak Enhalus acoroides dengan pelarut methanol; 2) Ekstrak Thalassia hemprichii dengan pelarut methanol; 3) Ekstrak Enhalus acoroides dengan pelarut n-heksana; 4) Ekstrak Thalassia hemprichii
27
DAFTAR LAMPIRAN
Halaman 1. Hasil uji anova dua arah data rendemen ekstrak lamun ... 56 2. Data jumlah artemia yang mati, setelah uji toksisitas dengan empat
konsentrasi ... 57 3. Tabel Probit ... 58 4. Contoh Perhitungan LC50 ... 59 5. Hasil pengukukuran diameter zona hambat ekstrak Enhalus acoroides
dan Thalassia hemprichii konsentrasi 20mg/ml terhadap biofilm ... 60 6. Hasil pengukukuran diameter zona hambat ekstrak Enhalus acoroides
29
1. PENDAHULUAN
1.1. Latar Belakang
Lamun (seagrass) merupakan satu-satunya tumbuhan berbunga (Angiospermae) yang memiliki kemampuan beradaptasi untuk hidup di laut. Keragaman jenis lamun di Kepulauan Seribu dilaporkan ada delapan jenis, yaitu Enhalus acoroides, Thalassia hemprichii, Cymodocea serrulata, Cymodocea rotundata, Halophila ovalis, Halophila minor, Syringodium isoetifolium, dan Halodule uninervis (Mardesyawati dan Anggraeni 2009). Sejak dekade terakhir beragam penelitian bioteknologi telah mulai dilakukan untuk mengeksplorasi lamun, guna mengetahui potensi bahan bioaktif yang terkandung di dalamnya. Qi et al. (2008) melakukan pengujian terhadap lamun jenis Enhalus acoroides yang hasilnya menunjukkan mengandung bahan aktif potensial untuk menghambat proses penempelan larva (antilarva) gastropoda jenis Bugula neritina pada bagian daunnya, serta menghambat proses predasi daun (antifeedant) oleh Spodoptera litura.
Potensi lamun sebagai antifeedant dan antilarva menimbulkan dugaan bahwa lamun dapat digunakan sebagai bahan baku subtitusi senyawa kimia tributyl tin (TBT), yang umum digunakan sebagai campuran cat antifouling. Cat antifouling tersebut umum digunakan untuk mengatasi masalah organisme penempel (biofouling), namun tidak ramah lingkungan, sehingga mengakibatkan dampak negatif pada ekosistem (Darmayanti 1994). Salah satu contoh dampak negatif pada ekosistem, adalah indikasi terganggunya organ reproduksi (imposex) pada Thais sp. yang ditemukan di Perairan Pelabuhan Ratu (Soedharma dan Fauzan 1996), dan di Pantai Barat Semenanjung Malaysia (Yusuf et al. 2011). Sejak 17 September 2008, Organisasi Maritim Internasional (IMO) melarang pemakaian cat dengan campuran TBT untuk cat kapal, oleh karena itu pencarian bahan antifouling yang ramah lingkungan (bioantifouling), khususnya yang berasal dari lamun dibutuhkan.
1.2. Rumusan Masalah
Biofouling merupakan suatu istilah bagi organisme yang hidup menempel pada setiap substrat padat yang diletakkan di laut. Proses penempelan organisme
diawali dengan keberadaan material organik yang memicu adanya penempelan mikrofouling, kemudian diikuti dengan penempelan larva organisme makrofouling. Organisme mikrofouling umumnya terdiri dari bakteri dan jamur (biofilm) serta diatom (peryphyton), sementara makrofouling umumnya berasal dari golongan alga dan larva avertebrata.
Perlahan namun pasti, biofouling akan menimbulkan masalah pada material substrat padat tersebut, sehingga mengakibatkan kerugian bagi industri maritim. Laju penempelan biofouling pada substrat kayu lebih cepat jika dibandingkan dengan substrat fiber, karena permukaan kayu lebih kasar jika dibandingkan dengan fiber, sehingga materi organik lebih mudah menempel pada permukaan kayu. Pada umumnya, biofouling yang menempel pada substrat fiber hanya jenis mikrofouling saja, sehingga dapat diatasi dengan pencucian sarana dan prasarana sementara biofouling yang menempel pada substrat kayu lebih beragam, yaitu mikrofouling dan makrofouling, sehingga harus diatasi dengan pencucian dan pengerokan.
Masalah yang ditimbulkan akibat biofouling ini pada awalnya diatasi dengan penggunaan cat yang dicampur dengan senyawa TBT (tributhyl tin) dan unsur logam berat lain, seperti Selenium (Sn), Timbal (Pb). Cat dengan tambahan TBT dan logam berat ini pada awalnya banyak digunakan untuk mengatasi masalah biofouling pada industri maritim, dan semakin berkembang penggunaannya pada Tahun 1970. Aplikasi cat dengan tambahan senyawa TBT ternyata berdampak negatif pada lingkungan perairan, sehingga mendorong Oganisasi Maritim Internasional (IMO) melarang pemakaian bahan tersebut untuk cat kapal yang secara efektif dimulai 17 September 2008. Oleh karena itu pencarian bahan antifouling non-toksik yang ramah lingkungan (bioantifouling) sangat dibutuhkan saat ini.
Lamun (seagrass) merupakan salah satu organisme laut yang diduga potensial sebagai bahan bioantifouling, bahkan Zoostera marina dan Thalassia testudinum diketahui mengandung senyawa murni golongan flavonoid, yang potensial menghambat pertumbuhan jamur pembentuk biofilm. Potensi penghambat pertumbuhan biofilm diduga juga dapat diisolasi dari lamun jenis Thalassia hemprichii dan Enhalus accoroides yang tumbuh di Indonesia, terutama
31
di Kepulauan Seribu, DKI – Jakarta, sehingga pada penelitian ini perlu dikaji lebih lanjut mengenai golongan senyawa yang terkandung di dalam ekstrak kasar contoh lamun serta potensi senyawa bioaktif lamun sebagai bioantifouling.
1.3. Tujuan dan sasaran
Tujuan dari penelitian ini adalah :
1) Menganalisis kandungan golongan senyawa bioaktif yang diekstrak dari Enhalus acoroides dan Thalassia hemprichii;
2) Menganalisis toksisitas bahan bioaktif yang diekstrak dari Enhalus acoroides dan Thalassia hemprichii; dan
3) Menganalisis potensi bioantifouling dari ekstrak Enhalus acoroides dan Thalassia hemprichii.
Sasaran dari penelitian ini adalah diperolehnya informasi jenis lamun yang potensial dan jenis pelarut yang efektif digunakan sebagai bioantifouling dari Pulau Pramuka, DKI Jakarta.
33
2. TINJAUAN PUSTAKA 2.1. Lamun
Lamun yang umum disebut sebagai “samo-samo” oleh masyarakat lokal Kepulauan Seribu diketahui memiliki akar, batang, daun, bunga dan buah sejati seperti tumbuhan monokotil lain di darat. Lamun dapat hidup membentuk hamparan luas yang biasa disebut dengan padang lamun. Padang lamun berdasarkan komposisi jenis penyusunnya dapat dibagi menjadi dua macam, yaitu: padang lamun homogen, yang terdiri dari satu spesies, dan padang lamun heterogen yang tersusun lebih dari satu spesies.
Lamun dapat hidup, tumbuh dan berkembang biak dengan baik di habitat perairan laut dangkal, estuaria dengan kadar garam tinggi, serta di daerah yang selalu mendapat genangan air ketika surut. Waycott et al. (2004) memaparkan pada dasarnya cahaya matahari dan masukan nutrien merupakan faktor utama yang membatasi sebaran dan habitat hidup lamun. Waycott et al. (2004) membagi habitat hidup lamun di wilayah tropis menjadi empat bagian, yaitu: river estuary, coastal, deep water, dan reef. Empat habitat unik lamun tropis tersebut dapat dilustrasikan seperti pada Gambar 1:
Gambar 1 Empat habitat unik bagi lamun tropis
Jumlah jenis lamun yang telah ditemukan di dunia hingga saat ini adalah 58 jenis, yang termasuk ke dalam 12 marga. Sembilan marga lamun yang ditemukan, tergolong dalam Famili Potamogetonaceae, dan tiga marga lamun yang lainnya masuk dalam Famili Hydrocharitaceae. Sebaran geografik lamun di
dunia dapat dibagi menjadi dua bagian besar, yaitu di daerah tropis dan sub tropis. Den Hartog dan Kuo (2006) memaparkan bahwa di daerah tropis terdapat tujuh marga lamun yang umum ditemukan, yaitu Halodule, Cymodocea, Syringodium, Thalassodendron, Enhalus, Thalassia, dan Halophila, sedangkan di daerah sub tropis ditemukan dua marga yang umum yaitu, Zostera dan Posidonia. Tiga marga yang lain, Heterozostera dan Amphibolis hanya ditemukan di perairan sub tropis belahan bumi selatan, sedangkan Phyllospadix hanya ditemukan di perairan Pasifik utara.
Keragaman jenis lamun di Indonesia cukup banyak, lamun yang telah ditemukan hingga saat ini ada 12 jenis yang termasuk ke dalam tujuh marga yaitu: Enhalus, Halophila, Thalassia, Cymodocea, Halodule, Syringodium, dan Thalassodendron (Tomascik et al. 1997). Kiswara et al. (1997) memaparkan bahwa jenis lamun yang ditemukan di perairan Indonesia bagian timur lebih banyak jika dibandingkan dengan di Indonesia bagian barat. Di Indonesia bagian timur dapat ditemukan 12 jenis lamun, sedangkan di Indonesia bagian barat hanya sembilan jenis lamun, bahkan lamun jenis Thalassodendron ciliatum penyebarannya terbatas hanya di Indonesia bagian timur.
Kepulauan Seribu merupakan gugusan pulau pulau kecil yang tersebar di bagian utara DKI Jakarta. Mardesyawati dan Anggraeni (2009) melaporkan bahwa jenis lamun di Kepulauan Seribu terdiri dari Enhalus acoroides, Thalassia hemprichii, Cymodocea serrulata, Cymodocea rotundata, Halophila ovalis, Halophila minor, Syringodium isoetifolium, dan Halodule uninervis. Pada penelitian lain di Kepulauan Seribu, diketahui bahwa jenis lamun yang memiliki penyebaran luas di Kepulauan Seribu adalah Thalassia hemprichii (Kawaroe dan Jaya 2004).
Penelitian penelitian yang dilakukan di ekosistem lamun selama ini menunjukkan bahwa lamun memiliki peranan sebagai (1) produsen primer di laut dangkal; (2) habitat hidup biota; (3) perangkap sedimen; dan (4) pendaur zat hara (Azkab 1999). Ekosistem lamun telah lama diketahui memiliki peranan penting dalam memberikan tempat perlindungan bagi organisme penempel yang hidup di batang dan daun lamun, selain itu ekosistem lamun juga menyediakan makanan
35
serta menjadi daerah asuhan bagi ikan ikan herbivora dan organisme herbivora lainnya (Kikuchi dan Peres 1977 in Azkab 1999).
2.2. Potensi Bioaktif Lamun
Seiring dengan berkembangnya ilmu pengetahuan, kajian dan penelitian dengan menggunakan lamun sebagai objek penelitian mulai merambah pada bidang bioteknologi dan bioprospecting. Eksplorasi senyawa bioaktif dan potensi lamun mulai dilakukan pada beberapa dekade terakhir, tidak hanya di negara maju, eksplorasi ini juga dilakukan di Indonesia.
Enhalus acoroides merupakan salah satu jenis lamun tropis dengan morfologi yang besar, Elfahmi (1997) melakukan penelitian dengan menggunakan jenis lamun tersebut, hasilnya menunjukkan bahwa Enhalus acoroides mengandung senyawa golongan triterpenoid, steroid, tannin, dan flavonoid. Selain itu, penelitian ini juga menunjukkan bahwa ekstrak n-heksan dari Enhalus acoroides mengandung senyawa stigmasta-3,5-diena-7-on atau sakarostenon yang bercampur dengan asam palminat, ekstrak etil asetat dari Enhalus acoroides mengandung senyawa stigmat,5-22-dien-3-ol, dan ekstrak methanol dari Enhalus acoroides mengandung senyawa 5,7,3,4-tetrahidroksi glikosida flavon dan 5,7,3-trihidroksiglikosida flavon.
Qi et al. (2008) memaparkan bahwa Enhalus acoroides yang dikoleksi dari Cina, dan diekstrak dengan etanol diketahui mengandung 11 senyawa murni yang tergolong dalam golongan flavonoid dan steroid. Beberapa senyawa murni yang tergolong kedalam golongan flavonoid tersebut diduga memiliki potensi sebagai antifouling karena terbukti toksik bagi larva-larva biota penempel, Bugula neritina (Qi et al., 2008). Enhalus acoroides juga dilaporkan mengandung senyawa bioaktif golongan fenolik yang cenderung potensial sebagai antioksidan (Raja-Kannan et al. 2010).
Thalassia testudinum yang dikoleksi dari Kepulauan Bahama, dilaporkan memiliki senyawa bioaktif dengan potensi sebagai bahan baku antibiotik alami (Jensen et al. 1998). Jensen et al. (1998) melaporkan bahwa senyawa bioaktif terus diisolasi dan diilusidasi dengan metode HPLC menghasilkan senyawa murni flavones glycoside liteolin 7-O-β-Dglucopyransyl-2-sulfate (Gambar 2), senyawa ini diketahui termasuk kedalam golongan flavonoid. Senyawa tersebut menurut
Jensen et al. (1998) juga mampu menghambat pertumbuhan mikroorganisme penempel, jamur jenis Schizichytrium aggregatum.
Gambar 2 Senyawa murni hasil purifikasi dan ilusidasi lamun jenis Thalassia testudinum, flavones glycoside liteolin 7-O-β-glucopyransyl-2-sulfate
Thalassia hemprichii yang dikoleksi dari Pamban, Tamil Madu, India diketahui mengandung senyawa bioaktif potensial sebagai antibakteri, antifungi, antiprotozoa, antiviral, antifertility, dan yang bahan obat-obatan yang berpengaruh pada sistim cardiovascular (Laksmi et al. 2006). Raja-Kannan et al. (2010) memaparkan Thalassia hemprichii juga memiliki potensi bioaktif sebagai antioksidan dan mengandung senyawa golongan fenolik.
Syringodium isoetifolium merupakan salah satu jenis lamun yang dianalisis komponen bioaktifnya oleh Raja-Kannan (2010), dan hasil analisisnya menunjukkan lamun tersebut mengandung senyawa fenolik, serta potensial sebagai bahan antioksidan. Lakshmi et al. (2006) melaporkan Syringodium isoetifolium dari wilayah India, potensial sebagai antibaktetri, karena mampu menghambat bakteri Stapilococcus aureus, Escheria coli, Streptococcus fecalis, Pseudomonas aeruginosa. Lamun dengan bentuk seperti lidi ini juga memliki potensi sebagai antijamur dan antivirus (Lakshmi et al. 2006).
Zostera marina, Cymodocea nodosa, dan Ruppia cirrhosa merupakan jenis lamun yang tidak lazim ditemui di daerah tropis, namun ketiga lamun tersebut juga telah dikaji potensi bioaktifnya. Zostera marina dilaporkan mengandung senyawa aromatik zosteric acid, yaitu senyawa murni yang
37
dipurifikasi dari ekstrak methanol Zostera marina (Zimmerman et al. 1997 dalam Arlyza 2007). Cymodocea nodosa dan Ruppia cirrhosa, kedua jenis lamun tersebut dilaporkan oleh El-Hady et al. (2007) memiliki ekstrak metanol yang potensial sebagai antibakteri dan antifungi.
2.3. Senyawa Antifouling
Cat yang mengandung TBT terbukti mampu mengatasi masalah biofouling di laut, namun ternyata solusi praktis ini berdampak negatif pada lingkungan di sekitarnya (Darmayanti 1994). Salah satu contoh dampak negatif pada ekosistem, adalah indikasi terjadinya imposex pada organisme uji, Thais sp. (Soedharma dan Fauzan 1996; Yusuf et al. 2011), sehingga muncul larangan untuk menggunakan cat tersebut sejak Tahun 2008 (Delauney et al. 2009).
Penelitian bioprospeksi kelautan untuk mendeteksi bahan aktif alami antifouling di Australia, sudah dikembangkan sejak tahun 1995. Senyawa bioaktif yang digunakan berasal dari organisme laut jenis alga dan spons. Jenis alga Delisea pulchra diketahui mengandung senyawa furanones, yaitu senyawa non polar halogen yang mampu mengurangi jumlah populasi teritip (Wetherbee 2004 dalam Arlyza 2007). Anonimus (1995) dalam Arlyza (2007) mengemukakan lactone dan furanon merupakan komponen yang berperan sebagai antifouling, yaitu berupa gugusan oksigen kecil yang mengandung cincin hidroksil.
Bahaya dan larangan penggunaan cat antifouling dengan campuran TBT dan logam berat di Indonesia menjadi pemicu bagi para peneliti untuk melakukan kajian dan penelitian awal guna menemukan senyawa bioaktif antifouling namun ramah lingkungan (bioantifouling). Sabdono dan Radjasa (2006) mengisolasi dan mengkultur bakteri yang berasosiasi dengan Sarcophyton sp. kemudian melakukan uji bioaktif senyawa yang dihasilkan, hasilnya bakteri asosiasi tersebut memiliki potensi untuk menghambat aktivitas bakteri biofilm. Pada penelitian yang lain, Sabdono (2007) memaparkan bahwa bakteri Pelagiobacter variabilis mengandung senyawa bioaktif yang potensial menghambat aktivitas bakteri biofilm dan juga terbukti mampu menghambat penempelan bernakel pada kayu uji yang direndam di laut selama satu bulan.
Spons jenis Callyspongia pulvinata diketahui mengandung senyawa bioaktif yang mampu menghambat pertumbuhan Nitzchia paleaceae dan cacing
tabung (Hydroides elegans), potensi antifouling ini juga dimiliki oleh spons jenis yang lain, yaitu Dendrila nigra, Axinella donai, dan Clathria gorgonoides (Selvin dan Lipton 2002).
Bakteri yang hidup di laut ataupun yang hidup bersimbiosis (simbion) dengan organisme makro, juga memiliki potensi sebagai penghasil senyawa bioaktif antifouling. Pseudmonas sp. merupakan salah satu bakteri yang diisolasi dari air laut permukaan, potensial sebagai antifouling karena mampu menghambat pertumbuhan spora Ulfa lactuca (Burgess et al. 2003). Pseudoalteromonas tunicata adalah bakteri yang diisolasi dari tunicate Ciona intestinalis, bakteri ini mengandung senyawa aktif sebagai antifouling yang mampu menghambat pertumbuhan spora alga, bakteri, jamur dan diatom.
2.4. Biofouling
Biofouling merupakan istilah umum yang digunakan untuk semua jenis organisme laut yang hidup menempel pada permukaan substrat, organisme penempel pada umumnya menempel hanya pada substrat yang disukainya (Wahl 1989). Organisme penempel atau yang biasa disebut biofouling ini akan menempel pada semua benda padat yang terendam di laut, terutama yang tidak dilapisi oleh lapisan antifouling. Benda–benda padat tersebut dapat berupa bahan kayu, besi atau logam, fiber, dan beton.
Proses penempelan organisme laut pada substrat keras ini dapat dibagi menjadi lima tahapan (Delauney et al. 2009), yaitu: (1) Terjadinya proses turbulensi massa air yang mengakibatkan adanya adsorbsi bahan organik dan inorganik pada permukaan substrat; (2) Bahan organik dan inorganik yang teradsorbsi di permukaan substrat tersebut mengandung sel mikroba, baik itu bakteri ataupun jamur, serta mampu menjadi media yang baik untuk pertumbuhan mikrobakteri tersebut; (3) Pertumbuhan mikroba yang terus berkembang akan membentuk koloni sehingga terbentuklah lapisan biofilm; (4) Lapisan biofilm yang terbentuk akan memicu adanya penempelan spora alga dan larva organisme bentik; (5) Pada fase inilah larva dan spora akan berkembang dengan pesat sehingga permukaan substrat akan penuh ditempeli oleh biofouling. Ilustrasi proses penempelan biofouling pada substrat padat di laut dapat dilihat pada Gambar 3.
39
Gambar 3 Proses penempelan biofouling pada substrat padat di laut
Biofouling dapat dibagi menjadi dua bagian besar, yaitu mikrofouling dan makrofouling. Boesono (2008) menjelaskan bahwa organisme penempel pada substrat kayu jati dan kayu bangkirai yang direndam di laut selama 2 bulan didominasi oleh makrofouling, yaitu organisme filum crustacea dan moluska, seperti Balanus, Bankia, dan Ligia. Mikrofouling pada umumnya merupakan susunan koloni bakteri, jamur, diatom, cyanobacter, dan jenis uniseluler alga yang lainnya. Koloni diatom, cyanobacter, dan uniseluler alga biasa disebut sebagai peryphyton, sementara koloni jamur dan bakteri umum disebut sebagai biofilm.
2.4.1. Makrofouling
Makrofouling oleh Callow dan Callow (2002) dibedakan menjadi dua macam, yaitu makrofouling lunak dan keras. Makrofouling lunak contohnya soft coral, spons, anemon, tunikata, dan hydroid, sementara contoh yang keras adalah bernakel, kerang, dan cacing tabung.
Kerang hijau menempel pada substrat dengan bantuan senyawa yang disekresikan oleh tubuhnya. Senyawa tersebut lengket seperti lem, disebut sebagai protein dyhidroxypenylalanine yang masuk pada golongan polipeptida (Callow dan Callow 2002). Bernakel, juga mampu mensekresikan senyawa dengan sifat yang sama, namun diketahui sebagai senyawa hydrophobic protein (Callow dan Callow 2002). Larva bernakel (cyprid) memiliki cambuk dan berenang bebas, kemudian akan memilih lokasi yang baik untuk melekat dengan
menggunakan antennules. Salah satu bagian organ larva, yang umum disebut antennules tersebut menghasilkan cairan untuk menandai lokasi lalu kemudian menempel. Callow dan Callow (2002) memaparkan Enthemorpha, merupakan salah satu jenis golongan makroalga yang menempel pada substrat dilaut sejak fase spora. Spora makroalga tersebut memiliki cambuk yang dapat dimanfaatkan sebagai alat untuk menempel pada substrat, karena mengeluarkan glycoprotein, yaitu senyawa yang disekresikan dari bagian apparatus golgi spora alga.
2.4.2. Mikrofouling
Mikrofouling merupakan susunan koloni bakteri, jamur, diatom, cyanobacter, dan jenis uniseluler alga yang lainnya. Koloni diatom, cyanobacter, dan uniseluler alga biasa disebut sebagai peryphyton, sementara koloni jamur dan bakteri umum disebut sebagai biofilm. Biofilm pada umumnya didominasi oleh bakteri yang memiliki kemampuan untuk menempel pada substrat keras di laut. Penempelan biofilm pada permukaan substrat di laut juga melewati beberapa fase, yaitu (1) pelekatan bakteri yang bersifat planktonik di permukaan substrat, dengan menggunakan bulu atau cambuknya (flagel); (2) pembentukan koloni sederhana antara bakteri bakteri sejenis; (3) pembentukan koloni bakteri biofilm yang semakin besar dan kondisi individu bakteri lebih matang (Armitage 2005). Tahapan penempelan bakteri biofilm tersebut ditampilkan pada Gambar 4.
Gambar 4 Tahapan penempelan bakteri biofilm pada substrat di laut
Proses awal pelekatan biofilm pada substrat keras dipengaruhi oleh dua hal, yaitu (1) sifat fisika bahan sehingga terjadi reaksi kohesi dan adhesi morfologi bakteri dengan struktur substrat; (2) respon fisiologis bekteri terhadap
41
nutrisi yang tersedia (Czaczyk dan Myszka 2007). Respon fisiologis tersebut berupa sekresi Ekstracelluler Polysakaruda Substance (EPS) oleh bakteri melalui satu atau dua katub memanjang yang terdapat di bagian ujung tubuhnya. EPS telah diketahui sebagai penyusun utama koloni bakteri biofilm, yang mengandung protein, nukleid acid, lipid, dan hampir 97% polysakarida (Vu et al. 2009). Vu et al. (2009) memaparkan setiap bakteri penyusun biofilm memiliki kemampuan untuk mensekresikan EPS yang berbeda berdasarkan komposisi dan sifat kimianya. Asam kolanat merupakan salah satu jenis EPS fleksibel yang diproduksi oleh bakteri biofilm Pseudomonas aeruginosa, sementara Vibrio cholera diketahui mensekresikan EPS berupa senyawa galaktoglukan (Vu et al. 2009).
Salah satu faktor yang berpengaruh dalam proses koloni bakteri biofilm, selain EPS adalah adanya quorum sensing. Quorum sensing merupakan mekanisme komunikasi antar sel yang dimiliki bakteri untuk memastikan kecukupan jumlah sel sebelum melakukan respon biologi tertentu (Hentzer et al. 2002). Hentzer et al. (2002) memaparkan quorum sensing setiap sel bakteri dapat bersamaan menghasilkan molekul sinyal, sehingga bakteri dengan molekul sinyal yang sama dapat saling mendekat, kemudian membentuk koloni dan membentuk biofilm.
Vibrio spp. adalah jenis bakteri yang bersifat halofil, sehingga umum ditemukan di laut dan merupakan salah satu jenis bakteri biofilm yang mampu menghasilkan EPS. Bakteri ini dapat hidup optimal pada salinitas 20-40 ppm, pH 4-9, serta bersifat anaerobik fakultatif (Hikmah 2011). Toleransi terhadap selang salinitas yang lebar tersebut, membuat Vibrio spp. menjadi jenis bakteri kosmopolitan di laut.
Vibrio spp. diketahui sebagai bakteri gram negatif, dengan bentuk sel batang, dan ukuran sekitar 2-3 µm, serta bergerak dengan menggunakan cambuk di salah satu ujung selnya (Feliatra 1999). Vibrio diketahui memiliki kemampuan menghasilkan biofilm, dan kemampuan tersebut dipengaruhi oleh struktur morfologi sel dan komponen regulator sel (Yildiz and Visick 2009). Morfologi sel yang mempengaruhi, adalah keberadaan dan fungsi flagel, pili serta kemampuan sintetis EPS, sedangkan komponen regulator sel, meliputi quorum
sensing dan sinyal C-di-GMP (Yildiz and Visick 2009). Yildiz and Visick (2009) mengungkapkan, keberadaan flagel dan pili membantu pergerakan bakteri untuk membentuk koloni antar bakteri, flagel dan pili kemudian membantu koloni untuk menemukan substrat yang cocok untuk menempel. Pada saat koloni bakteri tersebut menempel di permukaan, flagel dan pili lepas, kemudian bakteri mulai membentuk biofilm.
Komunikasi antar bakteri terjadi dengan mekanisme quorum sensing, sehingga terjadi sekresi enzim yang mendeteksi autoinduncer sesama jenis Vibrio (Waters et al. 2008). Vibrio cholera mengandung enzim yang dihasilkan ketika mekanisme quorum sensing terjadi adalah CAI-1, (5)-3-hydroxytridecan-1-one dan AL-2, (25,45)-metyl 2,3,4 –tetrahydroxy tetrahydrofuranborate (Waters et al. 2008). Waters et al. (2008) juga menjelaskan, protein 3’ 5’ cyclic diguanylic acid (c-di-GMP) merupakan salah satu komponen yang membantu komunikasi intraseluler, yang membawa pesan mengenai kondisi lingkungan disekitar sel. C-di-GMP pada Vibrio diketahui mampu memicu peningkatan densitas sel dalam koloni, serta mengontrol pembentukan biofilm.
2.5. Ekstraksi Senyawa Bioaktif
Ekstraksi merupakan salah satu proses pemisahan satu atau lebih komponen senyawa dari sumbernya, agar diperoleh komponen dari suatu bahan yang diinginkan. Khopkar (2003) menyebutkan bahwa ada beberapa faktor yang mempengaruhi ekstraksi, yaitu: lama ekstraksi, suhu, dan jenis pelarut yang digunakan. Jenis pelarut yang digunakan juga harus diperhatikan titik didih, sifat korosif, sifat toksik dan daya melarutkannya.
Berdasarkan jenis pelarutnya, ekstraksi dapat dibagi menjadi dua macam, yaitu: aqueos phase, dengan menggunakan air dan organic phase dengan menggunakan pelarut organik. Berdasarkan metode kerjanya, ekstraksi dapat dibagi menjadi tiga macam, yaitu: (1) Penekanan mekanik; (2) Menggunakan pelarut; (3) Pemanasan. Selama proses maserasi, pelarut akan menembus dinding sel sehingga senyawa bioaktif akan larut, proses osmoregulasi kemudian akan terjadi. Larutan pekat di dalam sel akan didesak keluar terus menerus sampai keseimbangan konsentrasi larutan di dalam dan di luar sel terjadi.
43
Tahapan yang dilakukan pada saat proses ekstraksi, adalah penghancuran bahan, perendaman dengan pelarut, penyaringan dan pemisahan. Penghancuran bertujuan agar dapat mempermudah pengadukan, dan kontak bahan dengan pelarutnya pada saat proses perendaman. Bahan kemudian direndam dalam pelarut, seperti n-heksana (non polar), etil asetat (semi polar), dan metanol (polar), proses perendaman ini disebut dengan maserasi. Prinsip pelarutan yang dipakai pada metode ini adalah like dissolve like artinya pelarut polar akan melarutkan senyawa polar dan pelarut non polar akan melarutkan senyawa non polar.
Tahap pemisahan yang terdiri dari penyaringan dan evaporasi. Untuk memisahkan pelarut dengan senyawa bioaktif yang terikat dilakukan evaporasi, sehingga pelarutnya akan menguap dan diperoleh senyawa hasil ekstraksi yang dihasilkan (Khopkar 2003).
Harbone (1987) menjelaskan bahwa hasil ekstrak yang diperoleh bergantung pada beberapa faktor, yaitu kondisi alamiah senyawa, metode ekstraksi yang digunakan, ukuran partikel sampel, lama waktu ekstrak, kondisi dan waktu penyimpanan dan perbandingan jumlah pelarut terhadap jumlah sampel. Komponen aktif dari senyawa yang diekstrak sangat bergantung pada kepolaran pelarutnya, misalnya senyawa yang terikat pada pelarut polar antara lain alkaloid, asam amino, polihidrosisteroid, dan saponin (Riguera 1997)
2.6. Uji Fitokimia
Uji fitokimia merupakan uji yang dilakukan untuk mengetahui aneka golongan senyawa organik yang dihasilkan oleh organime sebagai bentuk metabolit sekunder. Tujuan dan manfaat dari melakukan uji fitokimia adalah untuk menentukan ciri senyawa aktif penyebab efek racun atau efek yang bermanfaat, yang ditujukan oleh ekstrak kasar bila diuji dengan sistem biologi (Harborne 1987).
a) Alkaloid
Alkaloid pada umumnya mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai bagian dari sitem siklik. Alkaloid biasanya tanpa warna, seringkali bersifat tropis aktif, kebanyakan berbentuk kristal tetapi hanya sedikit yang berupa cairan (missal nikotina pada suhu kamar). Alkaloid merupakan turunan yang paling
umum dari asam amino. Secara kimia, alkaloid merupakan suatu golongan heterogen (Harborne 1987).
b) Steroid
Steroid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa alkohol, aldehid atau asam karboksilat. Steroid dapat dipilah menjadi sekurang-kurangnya empat senyawa, yaitu triterpenoid, steroid, saponin, dan glikosida jantung. Senyawa triterpenoid yang terdapat pada tumbuhan tingkat tinggi adalah fitosterol yang terdiri dari sitosterol, stigmasterol, dan kaempsterol (Harborne 1987). Steroid dapat diklasifikasikan menjadi steroid dengan atom karbon tidak lebih dari 21, seperti sterol, sapogenin, glikosida jantung, dan vitamin D. Steroid alami berasal dari berbagai transformasi kimia dua triterpena, yaitu lanosterol dan sikloartenol. Senyawa steroid dapat digunakan sebagai bahan dasar pembuatan obat (Harborne 1987).
c) Flavonoid
Menurut strukturnya, semua flavonoid merupakan turunan senyawa induk flavon yang terdapat pada tumbuhan Primula. Flavonoid dapat diekstraksi dengan etanol 70% dan tetap ada dalam lapisan air setelah ekstrak ini dikocok dengan eter minyak bumi. Flavonoid ini berupa senyawa fenol, oleh karena itu warnanya berubah bila ditambah basa atau amoniak (Harborne 1987). Flavonoid mengandung sistem aromatik yang terkonjugasi, oleh karena itu menunjukkan pita serapan pada daerah spektrum UV dan spektrum tampak. Flavonoid terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan aglikon flavonoid. Harbone (1987) menyatakan golongan senyawa flavonoid terdiri dari sepuluh kelas, yaitu antosianin, proantosianidin, flavonol, flavon, glikoflavon, biflavanol, khalkon, auron, flavonon dan isoflavon.
d) Saponin
Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun dan dapat dideteksi berdasarkan kemampuannya membentuk busa. Pembentukan busa yang baik sewaktu mengekstraksi tumbuhan atau sewaktu memekatkan
45
ekstrak tumbuhan merupakan bukti terpercaya akan adanya saponin. Saponin jauh lebih polar dari pada sapogenin karena ikatan glikosidanya (Harborne 1987).
e) Karbohidrat
Karbohidrat berguna untuk mencegah timbulnya ketosis, pemecahan protein tubuh yang berlebihan, kehilangan mineral dan berguna untuk membantu metabolisme lemak dan protein dalam tubuh. Karbohidrat dibentuk dari reaksi CO2 dan H2O dengan bantuan sinar matahari melalui proses fotosintesis dalam sel tanaman yang berklorofil. Karbohidrat dalat dikelompokkan menjadi monosakarida, oligosakarida dan polisakarida. Monosakarida merupakan molekul yang terdiri dari lima atau enam atom C, sedangkan oligosakarida merupakan polimer dari 2-10 monosakarida dan pula umumnya polisakarida merupakan polimer yang terdiri lebih dari 10 monomer polisakarida (Winarno 1997). Karbohidrat dengan zat tertentu akan menghasilkan warna tertentu yang dapat digunakan untuk analisa kualitatif. Bila karbohidrat direaksikan dengan larutan naftol dalam alkohol, kemudian ditambahkan H2SO4 pekat secara hati-hati, pada batas akan terbentuk furfural yang berwarna ungu. Reaksi ini disebut Molisch dan merupakan reaksi umum bagi karbohidrat (Winarno 1997).
f) Gula pereduksi
Sifat pereduksi dari suatu molekul gula ditentukan oleh ada tidaknya gugus hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif pada glukosa (aldosa) biasanya terletak pada karbon nomor satu (anomerik), sedangkan pada fruktosa (ketosa) terletak pada karbon nomor dua. Sukrosa tidak mempunyai gugus OH bebas yang reaktif karena keduanya sudah saling terikat, sedangkan laktosa mempunyai OH bebas pada atom C nomor 1 pada gugus glukosanya (Winarno 1997). Gula pereduksi teroksidasi oleh zat pengoksidasi lemah, seperti larutan Benedict dan Fehling (reduksi Cu2+ menjadi Cu+) dan pereaksi Tollens (reduksi Ag+ menjadi Ag). Beberapa dari reaksi ini digunakan sebagai uji klinis untuk mendeteksi gula dalam air seni yang menunjukkan penyakit diabetes.
g) Peptida
Dua asam amino berikatan melalui suatu ikatan peptida (-CONH-) dengan melepas sebuah molekul air. Reaksi keseimbangan ini cenderung untuk berjalan ke arah hidrolisis daripada sintesis. Pembentukan ikatan tersebut memerlukan
banyak energi, sedangkan untuk hidrolisis tidak memerlukan energi. Gugus karboksil suatu asam amino berkaitan dengan gugus amino dari molekul asam amino lain menghasilkan suatu dipeptida dengan melepaskan molekul air. Dipeptida masih mempunyai gugus amino dan karboksil bebas sehingga dapat bereaksi dengan dipeptida-dipeptida lainnya membentuk peptida dan akhirnya membentuk molekul protein (Winarno 1997).
h) Asam amino
Bila suatu protein dihidrolisis dengan asam, alkali, atau enzim maka akan dihasilkan campuran asam-asam amino. Sebuah asam amino terdiri dari sebuah gugus amino, sebuah gugus karboksil, sebuah atom hidrogen dan gugus R yang terikat pada atom C, yang dikenal sebagai karbon alfa, serta rantai cabang gugus R. Semua asam amino berkonfigurasi alfa dan hanya konfigurasi l, kecuali glisin yang tidak mempunyai atom C asimetrik. Hanya asam amino L yang merupakan komponen protein (Winarno 1997). Ninhidrin adalah peraksi yang digunakan secara luas untuk mengukur asam amino secara kuantitatif.
2.7. Uji Toksisitas
BSLT (Brain Shrimp Lethal Toxic) merupakan salah satu uji yang banyak dilakukan untuk menguji bahan-bahan yang bersifat sitotoksik (uji toksisitas), dengan menggunakan larva udang (Artemia salina Leach). Metode ini pada umumnya digunakan untuk penapisan awal senyawa aktif yang terkandung dalam ekstrak tanaman karena murah, cepat dan mudah, dan dapat dipercaya. Artemia yang digunakan sebagai bahan uji dapat dibagi menjadi dua macam, yaitu stadia larva dan stadia dewasa. Stadia larva yang paling umum digunakan adalah larva 24-48 jam setelah menetas. Konsentrasi letal untuk kematian 50% setelah 6 jam perlakuan (akut LC50) atau konsentrasi letal untuk kematian 50% setelah 24 jam perlakuan (kronik LC50) dapat diartikan sebagai ukuran toksisitas kandungan racun suatu bahan (Meyer et al. 1982). Tingkat toksisitas suatu bahan aktif dapat dilihat pada Tabel 1.
Artemia salina merupakan jenis udang planktonik dengan toleransi kadar garam yang luas, antara 15 – 300 per mil, suhu antara 26 – 31 0C, dan pH perairan antara 7,3 – 8,4 (Djarijah 2006). Selang toleransi Artemia salina yang luas terhadap salinitas menyebabkan udang ini umum disebut sebagai brine shrimp.
47
Artemia merkembang biak dengan cara bertelur, dan setiap individu bersifat biseksual. Usia Artemia dapat mencapai enam bulan (180 hari), dan dikatakan dewasa ketika mencapai usia 141 hari. Artemia betina yang sudah dewasa dapat bertelur sebanyak 50 hingga 300 telur setiap kali bertelur, dan mereka bertelur setiap 4 – 5 hari sekali. Telur-telur Artemia dapat disimpan dalam suhu ruang, dan ditetaskan jika dibutuhkan, telur tersebut akan menetas menjadi naupli pada kurun waktu 24 – 36 jam.
Artemia salina dipilih sebagai obyek uji toksisitas yang efektif dan sederhana dalam ilmu biologi dan toksikologi (Meyer et al. 1982), karena kemudahan dalam menetaskan telur menjadi larva, pertumbuhan yang cepat dari larva serta mudah dalam mempertahankan populasi dalam kondisi laboratorium.
Tabel 1 Kategori toksisitas bahan
Kategori LC50 (µg/ml)
Sangat toksik < 30
Toksik 30 – 1000
Tidak toksik >1000
Sumber: Meyer et al. (1982)
2.8. Uji Bioantifouling
Uji bioantifouling dilakukan secara invitro, dengan mengamati aktivitas hambat ekstrak lamun terhadap bakteri pembentuk biofilm. Uji aktifitas hambat dilakukan untuk mengetahui kemampuan dari suatu senyawa bioaktif guna menghambat pertumbuhan mikroorganisme yang diuji (Schlegel dan Schmidt 1994). Pengujian ini dapat dilakukan dengan 2 metode, yaitu teknik tabung pengenceran (tube dilution technique) dan metode difusi agar (agar diffusion method). Aktivitas antimikroba dilakukan dengan mengukur diameter hambatannya, yaitu daerah bening yang terbentuk di sekitar kertas cakram. Bell (1984) menjelaskan bahwa suatu senyawa dikatakan memiliki aktivitas antibakteri apabila diameter hambatan yang terbentuk lebih besar atau sama dengan 6mm. Aktivitas antibakteri dari suatu senyawa dikatakan tinggi jika memiliki konsentrasi penghambat kecil, namun diameter hambatnya besar.
David dan Strout (1971) memaparkan ketentuan kekuatan antibiotik-antibakteri sebagai berikut: daerah hambatan 20 mm atau lebih berarti sangat kuat, daerah hambatan 10-20 mm (kuat), daerah hambatan 5-10 mm (sedang), dan daerah hambatan kurang 5 mm (lemah). Faktor yang mempengaruhi ukuran daerah penghambatan, yaitu sensitivitas organisme, medium kultur, kondisi inkubasi, dan kecepatan difusi agar. Faktor-faktor yang mempengaruhi kecepatan difusi agar, yaitu konsentrasi mikroorganisme, komposisi media, suhu inkubasi, dan waktu inkubasi (Schlegel dan Schmidt 1994).
49
3. METODOLOGI
3.1. Lokasi dan Waktu Penelitian
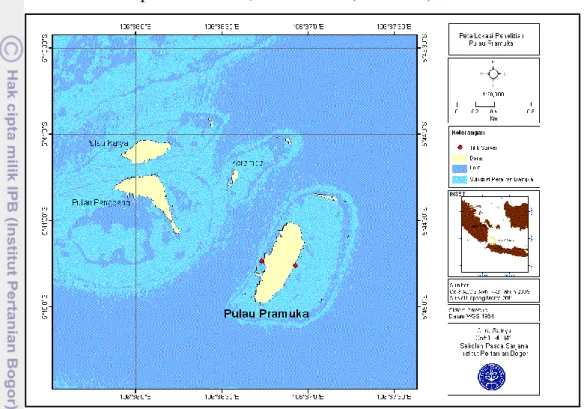
Penelitian ini diawali dengan melakukan koleksi contoh lamun segar di Pulau Pramuka Kepulauan Seribu, DKI Jakarta (Gambar 5).
Gambar 5 Lokasi koleksi contoh lamun di Pulau Pramuka, DKI Jakarta Contoh lamun segar yang diperoleh kemudian dikeringkan alami, dijemur dibawah sinar matahari kemudian diekstraksi di Laboratorium Kering, Bagian Hidrobiologi Laut, Departemen Ilmu dan Teknologi Kelautan, FPIK – IPB. Ekstrak lamun kemudian diuji, meliputi uji fitokimia, uji toksisitas dengan menggunakan metode Brain Shrimp Lethal Toxic (BSLT), dan uji bioantifouling dengan mekanisme aktivitas hambat bakteri. Uji fitokimia dilakukan di Laboratorium Mikrobiologi, Departemen Teknologi Hasil Perairan FPIK – IPB, dan uji bioantifouling dilakukan di Laboratorium mikrobiologi Pusat Penelitian Oseanografi (P2O – LIPI), sementara uji toksisitas dengan metode BSLT dilakukan di Laboratorium Kimia Analitik Departemen Kimia FMIPA – IPB.
Proses pengambilan contoh lamun segar, ekstraksi dan evaporasi, serta pelaksanaan uji fitokimia dilakukan sejak Maret – April 2011, sementara pelaksanaan uji toksisitas serta uji bioantifouling dilakukan pada April – Mei
2012. Selama selang waktu tersebut, ekstrak kasar contoh lamun disimpan didalam botol vial dan diletakkan didalam freezer.
3.2. Alat dan Bahan
Alat dan bahan yang dibutuhkan dalam penelitian ini dibagi menjadi tiga bagian besar (Tabel 2), yaitu alat dan bahan untuk pengambilan contoh lamun, untuk ekstraksi, dan perlakuan uji. Perlakuan uji yang dilakukan meliputi uji fitokimia, uji toksisitas, dan uji bioantifouling.
Tabel 2 Alat dan bahan yang digunakan selama penelitian
Tahapan Alat Bahan
1. Pengambilan contoh lamun
Masker Snorkel Plastik Pisau selam
2. Ekstraksi bahan bioaktif
Alat gelas Contoh lamun
Evaporator Methanol
shaker bath n - heksana Kertas saring (Whatman)
Timbangan
3. Uji Fitokimia
a. alkaloid Tabung reaksi, Pipet, Gelas piala
asam sulfat 2N pereaksi meyer pereaksi dragendorf pereaksi wagner b. Steroid Tabung reaksi, Pipet, Gelas
piala
klorofom anhidrida asetat asam sulfat pekat c. Flavonoid Tabung reaksi, Pipet, Gelas
piala
magnesium amil alkohol alkohol d. Saponin Tabung reaksi, Pipet, Gelas
piala HCL 2N
e. Molish Tabung reaksi, Pipet, Gelas piala
Asam sulfat pekat Pereaksi molisch f. Benedict Tabung reaksi, Pipet, Gelas
piala Pereaksi benedict
g. Biuret Tabung reaksi, Pipet, Gelas
piala Pereaksi biuret
51
Tabel 2 (Lanjutan) Alat dan bahan yang digunakan selama penelitian
Tahapan Alat Bahan
4. Uji toksisitas BSLT
Aerator Ekstrak sampel
Lampu
Telur Artemia salina
Pipet volumetric Air laut steril Wheel/Tabung reaksi
5. Uji aktivitas hambat biofilm (antimikrofouling)
Hotplate
Biakan bakteri biofilm Tabung reaksi Marine Agar
Kapas Aquades
Alumunium foil TCBS Agar
Autoklaf Gelas ukur Sudip Jarum ose Inkubator Bunsen Cawan petri Referigrator Vortex Paper disc 3.3. Metode Penelitian
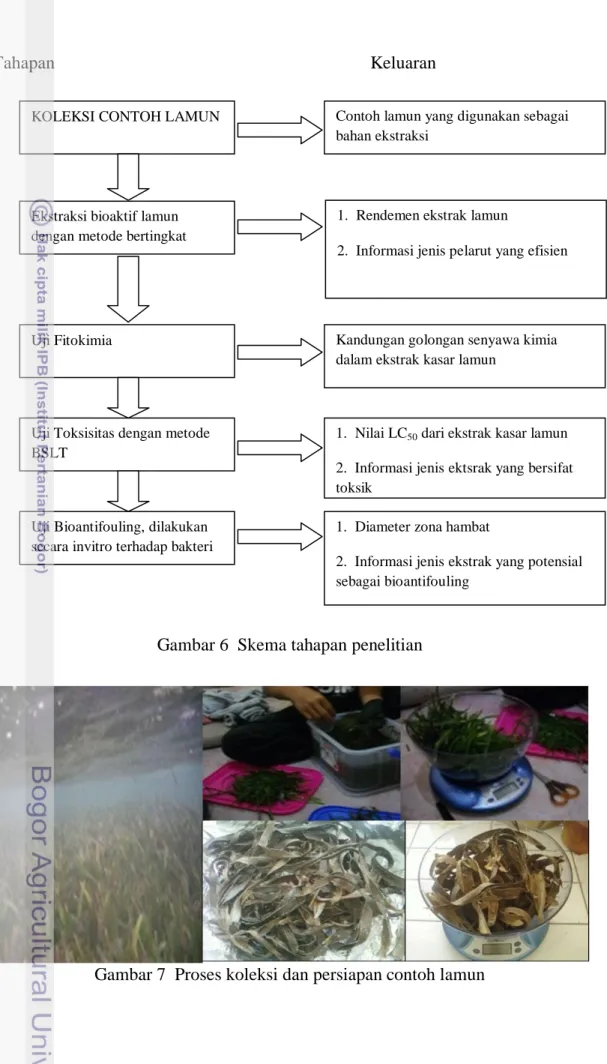
Penelitian ini dilakukan dalam beberapa tahap, yaitu koleksi contoh lamun, ekstraksi contoh lamun, uji fitokimia, uji toksisitas dengan metode BSLT, dan uji bioantifouling. Tahapan penelitian yang dilakukan dapat dilihat pada Gambar 6.
3.3.1. Koleksi Contoh Lamun
Proses koleksi dan preparasi contoh lamun ditampilkan dalam bentuk foto pada Gambar 7. Metode koleksi contoh lamun pada penelitian ini diadopsi dari El-Hady et al. (2007) dan Jensen et al. (1998). El-Hady et al. (2007) memaparkan teknik penanganan contoh daun lamun segar diambil langsung dari habitatnya, kemudian dibersihkan dari organisme penempel (epifit), setelah bersih dari epifit daun lamun dikeringkan alami sampai berat daun lamun menjadi konstan dan ditimbang dengan berat 50 gram. Contoh daun lamun ini diambil sebanyak tiga kali ulangan pada setiap spesiesnya.
Tahapan Keluaran
Gambar 6 Skema tahapan penelitian
Gambar 7 Proses koleksi dan persiapan contoh lamun KOLEKSI CONTOH LAMUN
Ekstraksi bioaktif lamun dengan metode bertingkat
Uji Fitokimia
Uji Toksisitas dengan metode BSLT
Uji Bioantifouling, dilakukan secara invitro terhadap bakteri pembentuk biofilm
Contoh lamun yang digunakan sebagai bahan ekstraksi
1. Rendemen ekstrak lamun
2. Informasi jenis pelarut yang efisien
Kandungan golongan senyawa kimia dalam ekstrak kasar lamun
1. Nilai LC50 dari ekstrak kasar lamun 2. Informasi jenis ektsrak yang bersifat toksik
1. Diameter zona hambat
2. Informasi jenis ekstrak yang potensial sebagai bioantifouling
53
3.3.2. Ekstraksi komponen bioaktif contoh lamun
Proses ekstraksi contoh lamun yang dilakukan selama penelitian dapat dilihat pada Gambar 8. Contoh lamun yang telah siap diekstraksi, ditimbang masing masing seberat 50gram, kemudian direndam pelarut non polar, n-hexana (75 ml) dengan perbandingan 1:1,5 (b/v) di dalam botol kaca, lalu dimaserasi selama 24 jam (El-Hady et al. 2007; Jensen et al. 1998). Larutan contoh lamun kemudian difiltrasi dengan menggunakan kertas saring. Filtrat contoh lamun yang terisisa kemudian direndam kembali dengan pelarut polar, methanol (75 ml) dengan perbandingan 1:1,5 (b/v) di dalam botol kaca, lalu dimaserasi selama 24 jam. Setelah 24 jam, larutan contoh lamun difiltrasi dengan menggunakan kertas saring.
Larutan contoh lamun hasil filtrasi kemudian dievaporasi dengan menggunakan Rotary evaporator yang diaplikasikan pada suhu 500C, sehingga diperoleh ekstrak kasar lamun dalam bentuk pasta. Pasta ekstrak kasar lamun kemudian ditimbang agar dapat diketahui prosentase rendemen yang diperoleh.
Gambar 8 Proses ekstraksi dan hasil ekstraksi lamun
3.3.3. Uji Fitokimia ekstrak contoh lamun
Uji fitokimia merupakan salah satu uji kualitatif untuk mengetahui golongan senyawa yang tekandung dalam suatu organisme. Rangkaian proses uji fitokimia selama penelitian ditampilkan pada Gambar 9. Ada delapan golongan senyawa yang akan diuji pada tahap ini, yaitu:
a) Alkaloid. Sejumlah ekstrak dilarutkan ke dalam beberapa tetes asam sulfat 2N, kemudian diuji dengan tiga pereaksi alkaloid, yaitu meyer, dragendorf, dan wagner. Uji ini positif jika terbentuk endapan warna putih pada larutan yang ditambahkan pereaksi meyer, endapan coklat pada yang
ditambahkan pereaksi dragendorf, dan endapan merah hingga jingga pada yang ditambahkan pereaksi wagner.
b) Steroid. Sejumlah ekstrak dilarutkan ke dalam 2 ml kloroform, kemudian ditambahkan 10 tetes anhidrida asetat dan 3 tetes asam sulfat pekat. Uji ini positif jika larutan yang dihasilkan membentuk warna merah di awal kemudian berubah menjadi biru atau hijau di akhir pengujian.
c) Flavonoid. Sejumlah ekstrak ditambahkan bubuk magnesium (Mg) sebanyak 0,1 mg, kemudian ditambahkan larutan amil alcohol sebanyak 0,4 ml, selanjutnya ditambahkan kembali alkohol sebanyak 4 ml dan dikocok. Uji flavonoid positif jika larutan membentuk lapisan amil alkohol dengan warna merah, kuning, atau jingga.
d) Saponin. Sejumlah ekstrak dilarutkan dengan akuades kemudian dipanaskan, jika muncul busa dan bertahan hingga 30 menit maka uji dilanjutkan dengan menambahkan 1 tetes HCl 2N. Uji saponin positif jika larutan mampu mempertahankan busa.
e) Molisch. Sejumlah ekstrak lamun dilarutkan dengan akuades, lalu diambil 1 ml dan ditambahkan 2 tetes pereaksi molisch serta 1 ml larutan asam sulfat (H2SO4) pekat. Uji ini positif jika ditandai dengan terbentuknya kompleks warna ungu diantara dua lapisan.
f) Benedict. Sejumlah ekstrak lamun dilarutkan dengan akuades, kemudian diambil delapan tetes dan dimasukkan ke dalam 5 ml pereaksi benedict, lalu dididihkan selama lima menit. Uji benedict positif jika larutan membentuk warna hijau, kuning, atau membentuk endapan warna merah bata.
g) Biuret. Uji ini dilakukan untuk mengetahui keberadaan senyawa peptida. Sejumlah ekstrak lamun yang dilarutkan dengan akuades diambil sebanyak 1 ml, kemudian ditambahkan 4 ml pereaksi biuret, lalu dikocok. Uji ini positif jika larutan membentuk warna ungu.
h) Ninhidrin. Uji ninhidrin dilakukan untuk mengetahui keberadaan golongan senyawa asam amino. Sejumlah ekstrak lamun yang dilarutkan dengan akuades diambil 2 ml, kemudian ditambahkan beberapa tetes
55
pereaksi ninhidrin 0,1% dan dipanaskan selama 10 menit. Uji ini positif jika terbentuk larutan dengan warna biru.
Gambar 9 Proses kegiatan uji fitokimia
3.3.4. Uji toksisitas
Uji toksisitas ini dilakukan dengan mengadopsi dan memodifikasi metode uji toksisitas dengan menggunakan larva Artemia salina (Meyer et al. 1982). Larva Artemia salina ini dipelihara pada air laut yang telah difilter selama 24 jam pada suhu 28 0C, kemudian setiap 10 larva dipindahkan ke dalam masing-masing wheel yang telah diisi air laut hasil filtrasi sebanyak 2 ml. Untuk menguji toksisitas ekstrak kasar lamun, ekstrak diencerkan menggunakan air steril (aquades) hingga konsentrasi 10 ppm, 100 ppm, 500 ppm, dan 1000 ppm, kemudian diteteskan kedalam masing masing wheel yang telah diisi Artemia. Sebagai kontrol digunakan satu wheel tambahan tanpa penambahan ekstrak kasar lamun, setelah 24 jam, masing masing wheel kembali diamati, dihitung, dan dicatat jumlah larva yang hidup. Data yang digunakan dalam perhitungan BSLT adalah data Artemia yang mati, kemudian data tersebut dikonversi kedalam bilangan logaritma dari Tabel Probit (Lampiran 2). Perolehan nilai dari Tabel Probit dan nilai konsentrasi ekstrak yang digunakan kemudian dimasukan ke dalam persamaan regresi, sehingga diperoleh nilai konsentrasi LC50. Ilustrasi proses uji toksisitas pada penelitian ini dapat dilihat pada Gambar 10.
Gambar 10 Proses kegiatan uji toksisitas
3.3.5. Uji bioantifouling
Uji bioantifouling dilakukan secara invitro, dengan mengamati aktivitas hambat ekstrak lamun terhadap bakteri pembentuk biofilm. Uji aktivitas hambat biofilm ini diawali dengan melakukan selekesi bakteri uji, seperti yang dipaparkan dalam Gambar 11. Bakteri pembentuk biofilm yang digunakan adalah genus Vibrio, hal ini mengacu pada hasil penelitian Mayavu et al. (2009) dan Yildiz and Visick (2009) yang menyatakan Vibrio spp. adalah bakteri pembentuk biofilm dan dapat memicu pembentukan fouling. Bakteri Vibrio spp. yang digunakan dalam penelitian diseleksi dari isolat bakteri koleksi Laboratorium Mikrobiologi P2O – LIPI. Seleksi bakteri dilakukan untuk mendapatkan bakteri Vibrio sp. pembentuk biofilm tertinggi dengan menggunakan metode Biofilm Formation Assay (Ramage et al. 2001). Isolat bakteri pembentuk biofilm terpilih kemudian diremajakan kembali dalam media Marine agar, berikutnya dikultur pada media selektif Thiosulfat Citrate Bile Sucrose (TCBS) untuk mendapatkan genus Vibrio (Feliatra 1999), proses ini dapat dilihat pada Gambar 12.
57
Gambar 11 Alur skematik seleksi bakteri uji
Uji aktivitas hambat biofilm ini menggunakan metode difusi agar yang diadopsi dari Jensen et al. (1998) dan El-Hady et al. (2007), yaitu bakteri terpilih dikulturkan pada media marine agar dan diletakkan pada masing masing cawan petri, kemudian didiamkan selama 1 jam pada suhu 28 0C. Pada saat yang bersamaan, kertas cakram yang telah disiapkan dicelupkan kedalam ekstrak lamun dengan konsentrasi 200 mg/ml dan 20mg/ml, kemudian didiamkan selama 1 jam agar pelarut menguap. Kertas cakram yang sudah dicelupkan diletakan pada media agar yang telah disebar bakteri biofilm terpilih, kemudian diinkubasi selama 18-24 jam pada suhu 37 0C. Aktivitas hambat ekstrak lamun diukur berdasarkan diameter zona bening yang terbentuk. Proses uji aktivitas hambat biofilm selama penelitian ini ditampilkan pada Gambar 13.
Isolat bakteri pembentuk biofilm, koleksi Laboratorium
mikrobiologi P2O LIPI
Seleksi isolat bakteri Vibrio spp. dengan menggunakan
media agar selektif TCBS
2 isolat bakteri uji Vibrio spp.
Identifikasi awal bakteri, dengan metode pewarnaan