1
BAB V
HASIL DAN PEMBAHASAN V.1 Hasil
Penelitian dilakukan dengan metode eksperimenta post test only control group design. Alat uji yang digunakan adalah walking tract analysis, seperti terlihat pada gambar di bawah.
Gambar 1. Walking Track Box.
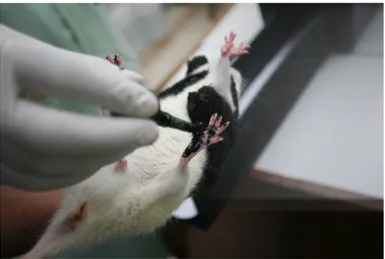
Tikus yang akan diperiksa terlebih dahulu dioleskan tintan pada kedua telapak kaki seperti pada gambar berikut:
2
Gambar 2. Telapak kaki tikus dioleskan tinta pada sisi yang sehat dan yang sakit.
Setelah diberikan tinta, kemudian tikus diletakkan diujung alat dan kemudian tikus akan berjalan ke dalam kotak yang kondisinya lebih gelap.
3
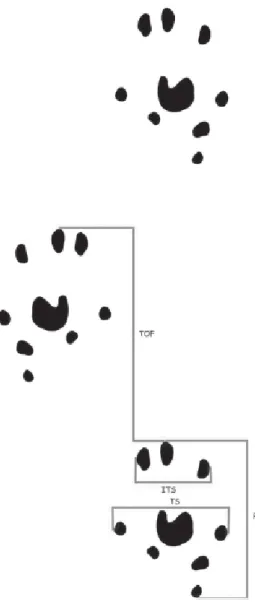
Dari gambaran cetakan kaki tikus yang didapat melalui walking tract analysis kemudian dihitung: PL — jarak dari tumit ke jari ke-3,merupakan panjang cetakan (Print Length); TS — jarak dari jari pertama ke jari ke-5, lebar kaki (toe spread); ITS — jarak jari ke-2 ke jari ke-4, (the intermediate toe spread); TOF — jarak ke kaki sebelahnya (Sarikcioglu et al. 2008) seperti terlihat pada gambar berikut:
4
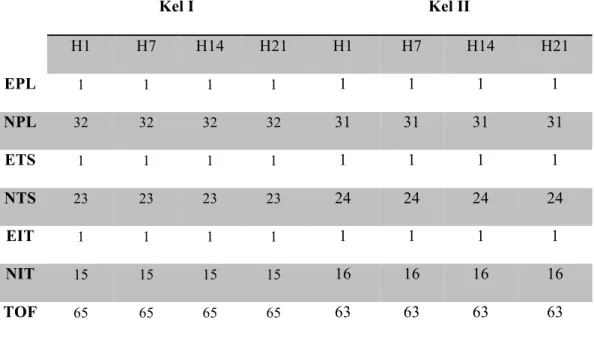
Data yang didapat kemudian dihitung menggunakan rumus sciatic nerve functional index (SFI) yang disajikan dalam tabel berikut:
Kel I Kel II H1 H7 H14 H21 H1 H7 H14 H21 EPL 1 1 1 1 1 1 1 1 NPL 32 32 32 32 31 31 31 31 ETS 1 1 1 1 1 1 1 1 NTS 23 23 23 23 24 24 24 24 EIT 1 1 1 1 1 1 1 1 NIT 15 15 15 15 16 16 16 16 TOF 65 65 65 65 63 63 63 63
Tabel 1. Hasil rerata Walking Tract Analysis tikus kelompok kontrol (Kel I) dan kelompok perlakuan (Kel II).
Perhitungan pada tungkai normal (NPL, NTS dan NIT) kemudian dibandingkan dengan tungkai yang mengalami cidera potong tajam n. ischiadicus (EPL, ETS dan EIT). Dari data tersebut kemudian dihitung Sciatic nerve Functional Index (SFI) menggunakan rumus sebagai berikut:
5
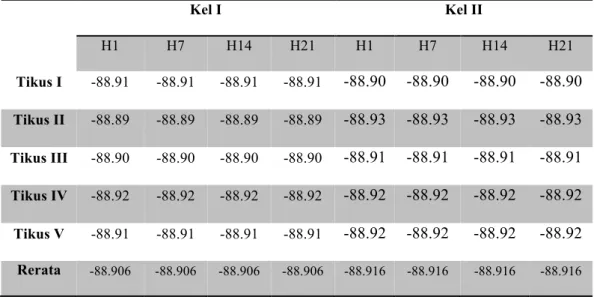
Adapun hasil perhitungan SFI masing-masing tikus disajikan pada tabel berikut:
Kel I Kel II H1 H7 H14 H21 H1 H7 H14 H21 Tikus I -88.91 -88.91 -88.91 -88.91 -88.90 -88.90 -88.90 -88.90 Tikus II -88.89 -88.89 -88.89 -88.89 -88.93 -88.93 -88.93 -88.93 Tikus III -88.90 -88.90 -88.90 -88.90 -88.91 -88.91 -88.91 -88.91 Tikus IV -88.92 -88.92 -88.92 -88.92 -88.92 -88.92 -88.92 -88.92 Tikus V -88.91 -88.91 -88.91 -88.91 -88.92 -88.92 -88.92 -88.92 Rerata -88.906 -88.906 -88.906 -88.906 -88.916 -88.916 -88.916 -88.916
Tabel 2. Hasil perhitungan SFI masing-masing tikus pada kelompok kontrol (Kel I) dan kelompok perlakuan (Kel II)
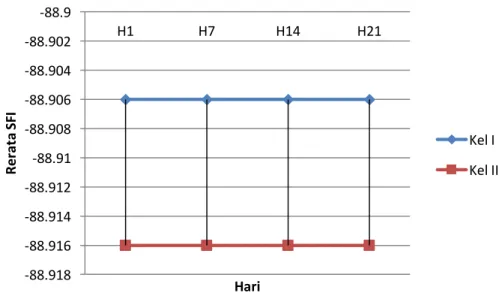
Pada tabel 2 terlihat bahwa SFI masing-masing tikus tidak berubah dari hari ke-1 sampai hari ke-21. Untuk lebih jelasnya data rerata SFI kelompok I danII disajikan dalam grafik garis dibawah ini.
6
Grafik 1. Perbandingan Rerata SFI Kelompok I dan II pada hari ke-1, 7, 14 dan 21.
Nilai rerata kedua kelompok mendekati nilai -100 (K1= -88.9060 ± 0.01140; K2 = -88.9160 ± 0.01140). Hal ini menunjukkan penurunan fungsi yang mendekati penurunan fungsi total. Pada Grafik 1 dapat dilihat gambaran garis lurus untuk kedua kelompok. Rerata SFI untuk kelompok I tidak berubah sampai hari ke-21. Begitu juga dengan kelompok II. Hal ini menunjukkan bahwa tidak terdapat perbaikan fungsi n. ischiadicus pada kedua kelompok.
Dari hasil analisis dengan uji T menggunakan program SPSS 16 didapatkan perbedaan yang tidak signifikan antara kedua kelompok. Berikut ini adalah tabel hasil Uji-T untuk kelompok 1 dan 2 pada hari ke-1, 7, 14 dan 21.
-88.918 -88.916 -88.914 -88.912 -88.91 -88.908 -88.906 -88.904 -88.902 -88.9 H1 H7 H14 H21 Re ra ta S FI Hari Kel I Kel II
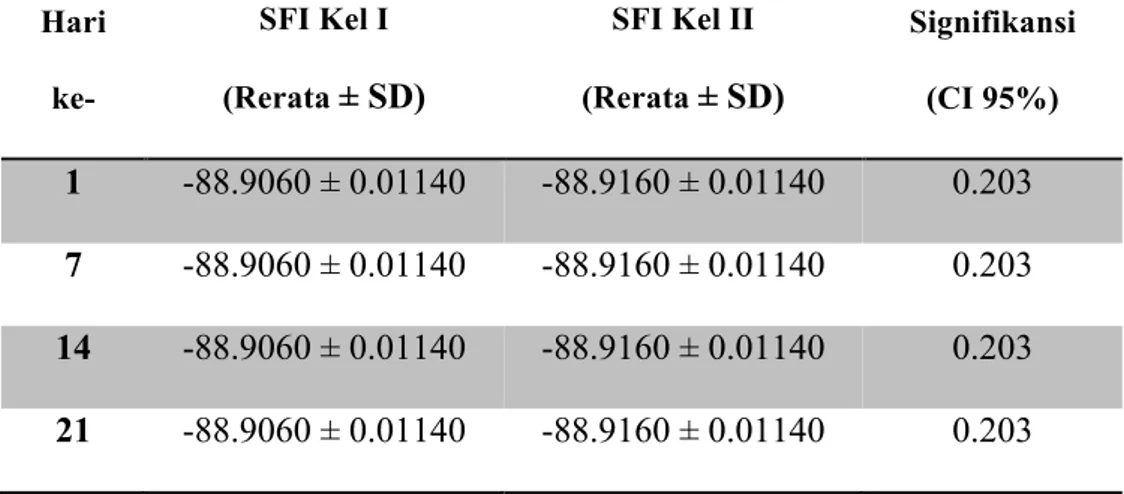
7 Hari ke- SFI Kel I (Rerata ± SD) SFI Kel II (Rerata ± SD) Signifikansi (CI 95%) 1 -88.9060 ± 0.01140 -88.9160 ± 0.01140 0.203 7 -88.9060 ± 0.01140 -88.9160 ± 0.01140 0.203 14 -88.9060 ± 0.01140 -88.9160 ± 0.01140 0.203 21 -88.9060 ± 0.01140 -88.9160 ± 0.01140 0.203
Tabel 3. Perbandingan rerata SFI kelompok I dan II pada hari ke-1,7,14 dan21.
Dari tabel diatas dapat dilihat bahwa perbedaan rerata SFI kelompok I dan II pada hari ke-1, 7, 14 dan 21 tidak signifikan (p > 0.05). Dari tabel diatas juga dapat dilihat bahwa tidak terjadi perbaikan fungsi saraf pada masing-masing kelompok. Hal ini dapat dilihat dari rerata SFI yang sama pada masing-masing kelompok pada hari ke1, 7, 14 dan 21.
V.2 Pembahasan
Akhir-akhir ini penelitian tentang peran membran amnion pada pengobatan regeneratif sedang giat dilakukan. Karaman et al (2013) pada penelitiannya mengatakan bahwa membran amnion merupakan membran yang avaskular yang terdiri dari sel epitelial dan jaringan mesodermal, yang dapat menekan potensi proinflamatori sitokin. Selain digunakan pada pengobatan regeneratif, membran amnion juga telah banyak digunakan karena efek antiinflamasinya pada operasi mata, perawatan luka bakar, dan operasi penutupan luka. Membran amnion juga dipercaya memiliki potensi reaksi penolakan yang rendah. Tsai et al (2004) pada penelitiannya mengatakan bahwa hanya human
8
amniotic membrane-derived mesenchymal stem cells yang tidak mengekspresikan molekul major histocompatibility complex class I (MHC I). Mungkin hal ini yang menyebabkan toleransi imunologi yang tinggi. (Tsai et al. 2004)
Forbes J dan Fetterolf DE (2012) meneliti tentang penggunaan membran amnion pada perawatan luka dan memberikan hasil yang baik. Roosenlbum B (2014) meneliti tentang penggunan alograft membran amnion pada ulkus diabetikum ada ekstremitas bawah. 5 ulkus dari 3 pasien dirawat menggunakan allograft membran amnion setelah dilakukan debridement, dan hasilnya semua luka membaik dalam rentang waktu yang berbeda beda (Roosenblum B. 2014).
Badan Neural Regeneration Research, USA telah melakukan beberapa penelitian tentang membran amnion. Pada salah satu penelitiaanya badan penelitian tersebut menyebutkan bahwa sel epitel membran amnion mengeskpresikan fenotip neuronal (microtubule-associated protein-2, glial fibrillary acidic protein and nestin). Medium terkondisi dari human amniotic epithelial cells dapat memicu pertumbuhan dan proliferasi kultur sel glia tikus in vitro. Sedangkan pada penelitian yang lain badan penelitian tersebut membuktikan transformasi human amniotic epithelial cells menjadi neuron-like cells pada lingkungan mikro cedera kepala, in vivo dan in vitro. (Neural Regeneration Research. 2012). Karatman et al (2013) membuktikan bahwa membran amnion dapat membantu pemulihan cidera nervus fascialis.
Hasil yang berbeda didapatkan pada penelitian ini. Evaluasi selama 21 hari menunjukkan tidak ada perbaikan pada kelompok yang diberikan membran
9
amnion. Hal ini menunjukkan bahwa dalam jangka waktu tiga minggu tersebut membran amnion tidak terbukti dapat membantu pemulihan fungsi n. ischiadicus yang mengalami cidera. Keterbatasan dari peneiltian ini adalah waktu evaluasi yang singkat, yaitu 3 minggu. Penelitian lebih lanjut dengan rentang waktu yang lebih lama diperlukan untuk melihat peran membran amnion dalam regenerasi cidera saraf perifer. Evaluasi dengan metode lain juga diperlukan untuk mendapatkan data yang lebih valid. Selain evaluasi fungsi, evaluasi regenerasi saraf juga bisa dilakukan dengan pembuatan preparat histopatologi (Breshah MN et al. 2013; Karaman M et al. 2013); evaluasi elektrofisiologi, histomorfometri, (Dellon ,Mackinnon. 1989;; postural eksternal (Hadlock TA et al. 1999), maupun dengan pengukuran sudut pergelangan kaki (Sarikcioglu et al. 2009). Kombinasi beberapa metode evaluasi akan menghasilkan data yang lebih valid dan reliabel.
10
BAB VI
KESIMPULAN DAN SARAN VI.1 Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa pada evaluasi fungsi selama 21 hari tidak didapatkan perbedaan yang signifikan antara kelompok kontrol dan kelompok yang mendapatkan membran amnion, dan tidak didapatkan perbaikan fungsi pada kedua kelompok.
VI. 2 Saran
Saran yang dapat diberikan pada penelitian ini adalah perlu dilakukan penelitian lebih lanjut dengan durasi penelitian yang lebih lama dan metode evaluasi regenerasi saraf tepi yang lebih kompleks sehingga bisa didapatkan data yang lebih valid dan reliabel.
11
Daftar Pustaka
Bobinski F, et al. Neuroprotective and neuroregenerative effects of low-intensity aerobic exercise on sciatic nerve crush injury in mice. Neuroscience. 2011 Oct 27;194:337-48.
Breshah M N et al. 2013. Functional and histological evaluation of rat sciatic nerve anastomosis using cyanoacrylate and fibrin glue. Tanta Dental Journal: 10 (2013) 67 e 74.
Burnett MG, Zager EL. Pathophysiology of Peripheral Nerve Injury: A Brief Review. Neurosurg Focus. 2004;16(5)
Carlton JM, Goldberg NH. 1986. Quantitating integrated muscle function following reinnervation. Surg Forum, 37: 611–614.
de Albornoz PM, Delgado PJ, Forriol F, Maffulli N. Non-surgical therapies for peripheral nerve injury. Br Med Bull. 2011;100:73-100
de Medinaceli L, Freed WJ, Wyatt RJ (1982) An index of the functional condition of rat sciatic nerve based on measurements made from walking tracks. Exp Neurol, 77: 634–643.
Elmstedt N., 2006, Development of biosynthetic conduit for spinal cord and peripheral nerve injury repair, in vitro study. Thesis. Stockholm, Sweden Forbes J, Fetterolf DE. Dehydrated amniotic membrane allografts for the
treatment of chronic wounds: a case series. Journal of wound care. 2012; 21:6
Gaudet AD, Popovich PG, Ramer MS. Wallerian degeneration: gaining perspective on inflammatory events after peripheral nerve injury. J Neuroinflammation. 2011; 8: 110.
Human amniotic membrane and nerve tissue engineering. Neural Regeneration Research. 2012;7(4):319.
Jun-Ming Zhang, Wenrui Xie, Judith Ann Strong, Huiqing Li. Sympathetic sprouting near sensory neurons after nerve injury occurs preferentially on spontaneously active cells and is reduced by early nerve block. J Neurophysiol. 2007 Jan; 97(1): 492–502.
12
Karatman M et al. Amniotinc Membrane Covering for Facial Nerve Repair. Neural Regen Res. 2013 15; 8(11): 975–982.
Khrisnamurithy G, et al. Human amniotic membrane as a chondrocyte carrier vehicle / substrate: In vitro study. Society for Biomaterials. Wiley Library. Malaysia. May 2011.
Lee, SK. Wolfe, SD. Peripheral Nerve Injury and Repair. Journal of American Academy of Orthopaedic Surgeon 2000; 8: 243-252
Mohammadi R, Esmaeil-Sani Z, Amini K. Effect of local administration of insulin-like growth factor I combined with inside-out artery graft on peripheral nerve regeneration.Injury. 2013 Oct;44(10):1295-301
Nakamura T, et al. Sterilized, freeze-dried amniotic membrane: a useful substrate for ocular surface reconstruction. Invest Ophthalmol Vis Sci. 2004 Jan;45(1):93-9.
Niknejad H, et al. Properties of The Amniotic Membrane for Potential Use in Tissue Engineering. European Cells and Materials. Vol 15. 2008. P. 88-99. Rennie K, et.al. Aplication of Amniotic Membrane and Fluid in Stem Cell
Biology and Regenerative Medicine. Stem Cells International. Hindawi Publishing Corporation. Sept 2012.
Sarikcioglu L, Demirel BM. Walking track analysis: an assessment method for functional recovery after sciatic nerve Injury in the rat. Folia Morphol. 2008; 68:1–7
Tsai MS, Lee JL, Chang YJ, et al. Isolation of human multipotent mesenchymal stem cells from second-trimester amniotic fluid using a novel two-stage culture protocol. Hum Reprod. 2004;19(6):1450–1456.
Wolfe et al. 2010. Green’s Operative Hands Surgery. 6th Ed. Churcil Livingstone: United State of America.
Yuan Y, Shen H, Yao J, Hu N, Ding F, Gu X. The protective effects of Achyranthes bidentata polypeptides in an experimental model of mouse sciatic nerve crush injury. Brain Res Bull. 2010 Jan 15;81(1):25-32.
13
Dellon, A. L. and Mackinnon, S. E. (1989), Sciatic nerve regeneration in the rat. Validity of walking track assessment in the presence of chronic contractures. Microsurgery, 10: 220–225. doi: 10.1002/micr.1920100316 Hadlock TA, Koka R. Quantification of functional recovery following rat sciatic