BAB II
TINJAUAN PUSTAKA
2.1 Anatomi Hidung 2.1.1 Hidung luar
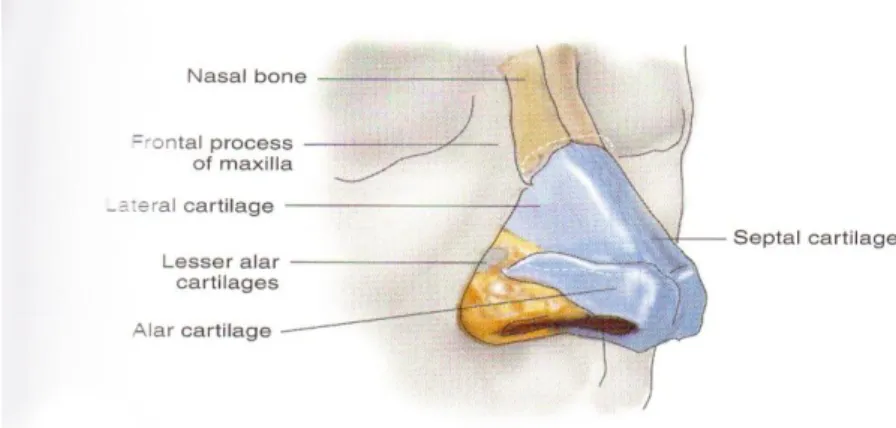
Hidung berbentuk piramid dengan puncaknya di atas dan di bagian bawah terdapat dasar. Piramid hidung terdiri dari tulang dan tulang rawan yang dilapisi oleh otot dan kulit (Dhingra, 2014).
Sepertiga atas hidung luar merupakan tulang dan duapertiga bawah merupakan tulang rawan. Bagian tulang terdiri dari dua tulang hidung yang bertemu di garis tengah dan pada bagian atas dari prosesus nasalis os frontal dan keduanya melekat diantara prosesus frontalis os maksila (Dhingra, 2014).
Bagian tulang rawan terdiri dari sepasang kartilago nasalis lateralis superior, sepasang kartilago nasalis lateralis inferior (kartilago alar mayor), kartilago alar minor dan kartilago septum (gambar 2.1) (Dhingra, 2014).
2.1.2 Hidung dalam
Dibagi menjadi kavum nasi kanan dan kiri oleh septum nasi. Setiap kavum nasi berhubungan dengan bagian luar melalui lubang hidung (nares anterior) dan dengan nasofaring melalui koana. Setiap kavum nasi terdiri dari bagian yang ditutupi kulit, disebut vestibulum dan bagian yang ditutupi mukosa disebut kavum nasi yang sebenarnya (Dhingra, 2014).
Vestibulum merupakan bagian anterior dan inferior dari kavum nasi. Vestibulum dilapisi oleh kulit dan berisi kelenjar sebasea, folikel rambut dan rambut-rambut yang disebut vibrise. Bagian atas vestibulum terbatas pada dinding lateral yang ditandai oleh ala nasi (katup hidung) yang dibentuk oleh batas belakang dari kartilago nasalis lateralis superior. Dinding medial vestibulum dibentuk oleh kolumela dan bagian bawah dari septum nasi (Dhingra, 2014).
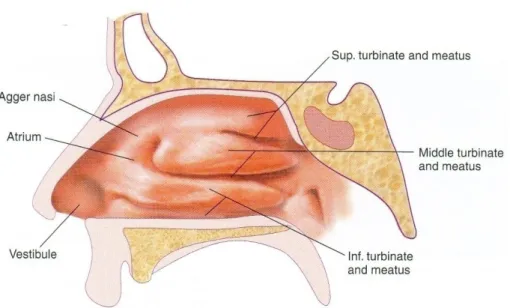
Setiap kavum nasi memiliki dinding lateral, medial, superior dan inferior. Pada dinding lateral terdapat 4 buah konka. Konka menggulung seperti proyeksi tulang yang dilapisi oleh membran mukosa. Daerah di bawah konka disebut dengan meatus (Dhingra, 2014).
Konka inferior merupakan struktur dinding lateral hidung yang paling menyolok pada rinoskopi anterior. Konka inferior terdiri dari tulang yang dilapisi oleh mukoperiostium, jaringan lunak yang meliputi pleksus kavernosus, dan di atasnya terdapat mukosa respiratori. Tulang konka inferior berartikulasi dengan tulang lakrimal di bagian anterior, dan melekat ke prosesus medial dari maksila dan tulang palatina di bagian lateral. Pleksus kavernosus dapat membesar karena aliran darah sebagai respon terhadap siklus hidung atau terhadap berbagai macam pemicu dari lingkungan (Hwang dan Abdalkhani, 2009).
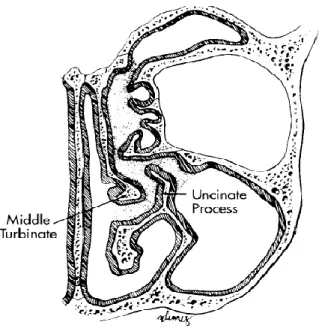
Konka media membentuk batas media dari meatus media dan menjadi tanda utama yang penting dalam operasi sinus. Orientasi dari konka media berjalan sepanjang 3 bidang yang berbeda dalam
perjalanannya dari anterior ke posterior dan dapat dipahami secara skematik dalam ketiga bagian. Sepertiga anterior dari konka media berjalan sepanjang bidang sagital. Bagian dari konka media ini adalah yang paling mudah diamati dengan rinoskopi anterior, dan bagian ini melekat pada dinding lateral hidung dan lempeng kribriformis di bagian superior. Pada sepertiga tengah, konka direfleksikan dari orientasi sagital ke koronal, membentuk lamela basalis dari konka media yang melintang untuk masuk ke dinding lateral hidung. Bagian melintang dari konka media ini yang memisahkan sel etmoid anterior dari sel etmoid posterior. Pada bagian anterior dari lamela basalis dari konka media, drainase sel melalui meatus media. Pada bagian posterior dari lamela basalis, drainase sel melalui meatus superior. Bagian sepertiga posterior dari konka berjalan pada bidang axial dengan perlekatannya yang berlanjut sepanjang dinding lateral hidung. Bagian akhir posterior dari konka media memasuki perbatasan foramen sfenopalatina dan ke tempat munculnya arteri sfenopalatina ke dalam hidung (Hwang dan Abdalkhani, 2009).
Konka superior merupakan yang paling belakang dari konka-konka yang lain. Merupakan jalan masuk superior yang paling umum ke dasar tengkorak bersama dengan konka media dan membantu menentukan batas dari sel etmoid posterior. Bagian medial dari konka superior dan bagian lateral dari septum nasi adalah daerah dari resesus sfenoetmoidalis, dimana ostium sinus sfenoid dapat dijumpai (gambar 2.2) (Hwang dan Abdalkhani, 2009).
Gambar 2.2. Struktur dinding lateral hidung (Dhingra, 2014)
Konka suprema terkadang terlihat di atas konka superior dan memiliki meatus yang sempit di bawahnya. Ostium sinus sfenoid terletak di resesus sfenoetmoidalis, bagian medial dari konka superior atau suprema. Ostium sinus sfenoid secara endoskopik dapat berada kira-kira 1 cm di atas pinggir atas dari koana posterior dekat dengan pinggir posterior dari septum nasi (Dhingra, 2014).
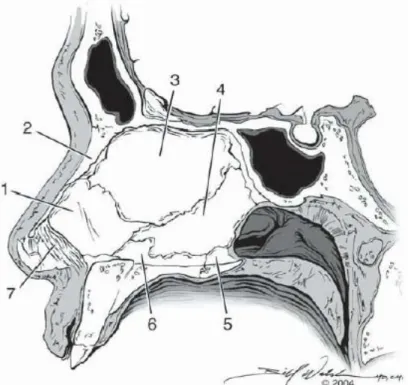
Dinding medial kavum nasi dibentuk oleh septum nasi. Septum nasi memisahkan kedua kavum nasi, menyediakan penopang struktural untuk hidung, dan mempengaruhi aliran udara di dalam kavum nasi. Septum nasi terdiri dari tulang rawan dan tulang yang dilapisi oleh mukosa respiratori (Leung, Walsh dan Kern, 2014). Septum bagian anterior dibentuk oleh lamina kuadrangularis dan premaksila; bagian posterior dibentuk oleh lamina perpendikularis os etmoid dan sinus sfenoid; dan bagian inferior dibentuk oleh vomer, krista nasalis os maksila, dan krista nasalis os palatina (gambar 2.3) (Hwang dan Abdalkhani, 2009).
Gambar 2.3. Anatomi Hidung, Septum nasi (1), kartilago kuadrangularis (2), os nasal (3), os vomer (4), krista nasalis os palatina (5), krista nasalis
os maksila (6), membran septum (7) (Leung, Walsh dan Kern, 2014)
Dinding superior kavum nasi bagian anterior yang miring dibentuk oleh tulang hidung; bagian posterior yang miring dibentuk oleh tulang sfenoid; dan bagian media yang horizontal dibentuk oleh lamina kribriformis etmoid tempat masuknya nervus olfaktorius ke kavum nasi (Dhingra, 2014).
Dinding inferior kavum nasi dibentuk oleh prosesus palatina maksila pada ¾ bagian anteriornya dan bagian horizontal dari os palatina pada ¼ bagian posteriornya (Dhingra, 2014).
2.1.3 Membran mukosa hidung
Lapisan epitel dari kavum nasi berubah dari anterior ke posterior. Kulit di dalam vestibulum nasi berkeratin, epitel sel skuamosa yang mengandung vibrise dan kelenjar sebasea. Pada bagian tepi dari konka
inferior, epitel berubah menjadi sel kuboidal dan kemudian berubah menjadi epitel kolumnar bersilia berlapis semu. Pada bagian paling posterior dari nasofaring, mukosa berubah menjadi tidak berkeratin, epitel sel skuamosa (Hwang dan Abdalkhani, 2009).
2.1.4 Pendarahan hidung
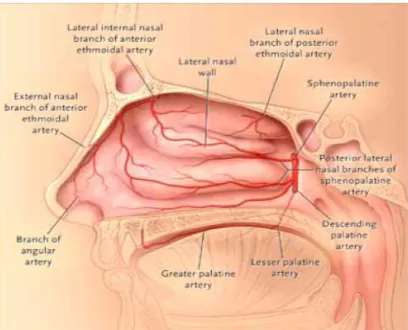
Pendarahan dari kavum nasi terutama berasal dari arteri etmoid anterior dan posterior (cabang dari arteri oftalmika) dan arteri sfenopalatina (cabang terminal dari arteri maksilaris interna). Arteri etmoid anterior melewati rektus media dan memasuki lamina papirasea. Arteri ini kemudian berjalan melewati atap sinus etmoid di dalam tulang pembungkus yang tipis, kemudian memperdarahi lamina kribriformis dan bagian anterior septum. Arteri ini merupakan tanda yang paling posterior untuk pembedahan resesus frontalis. Arteri etmoid posterior keluar dari rongga orbita, kira-kira 12 mm pada bagian posterior dari arteri etmoid anterior. Arteri ini memperdarahi bagian posterior yang lebih kecil, termasuk celah olfaktorius (Hwang dan Abdalkhani, 2009).
Arteri maksilaris interna memasuki fosa pterigomaksilaris dan keluar ke kavum nasi melalui foramen sfenopalatina seperti arteri sfenopalatina. Foramen sfenopalatina terletak pada bagian lateral dari ujung posterior konka media. Pada saat memasuki hidung, arteri sfenopalatina terbagi menjadi cabang hidung posterolateral dan cabang septum posterior (Hwang dan Abdalkhani, 2009).
Vena berjalan sejajar dengan arteri sfenopalatina dan dan cabangnya, bermuara ke pleksus oftalmika dan sebagian ke sinus kavernosus. Vena-vena ini tidak memiliki katup sehingga merupakan faktor predisposisi untuk penyebaran infeksi dari hidung ke sinus kavernosus (Hwang dan Abdalkhani, 2009).
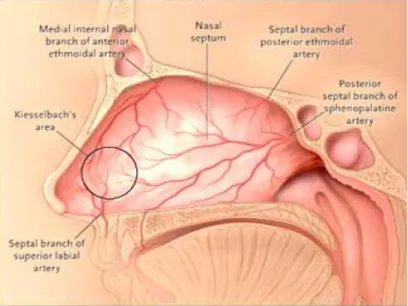
Terdapat dua daerah anastomosis arteri yang sering terlibat dalam epistaksis yaitu pleksus Kiesselbach, yang sering terlibat pada epistaksis
anterior, dan pleksus Woodruff, yang sering terlibat pada epistaksis posterior. Pleksus Kiesselbach terletak pada septum nasi anterior dan dibentuk oleh anastomosis dari arteri sfenopalatina, arteri palatina mayor, arteri labialis superior, dan arteri etmoid anterior (gambar 2.4). Pleksus Woodruff terletak pada bagian posterior dari konka media dan meatus inferior yang dibentuk oleh anastomosis dari cabang arteri maksilaris interna, yaitu arteri sfenopalatina dan arteri faringeus asenden (gambar 2.5) (Hwang dan Abdalkhani, 2009).
Gambar 2.4. pembuluh darah daerah septum nasi (Schlosser dan Woodworth , 2009)
Gambar 2.5. Pembuluh darah daerah dinding lateral hidung (Schlosser dan Woodworth, 2009)
2.1.5 Persarafan hidung
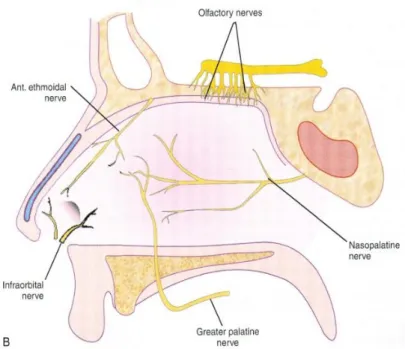
Nervus olfaktorius memberikan indra penghidu. Terdapat filamen utama dari sel olfaktorius dan tersusun 12-20 nervus yang melewati lamina kribrosa dan berakhir pada bulbus olfaktorius. Nervus ini dapat membawa pembungkus duramater, arachnoid dan piamater ke dalam hidung. Trauma pada nervus ini dapat menyebabkan terbukanya daerah cairan serebrospinal berada sehingga dapat menyebabkan terjadinya rinore cairan serebrospinal atau meningitis (Dhingra, 2014).
Sebagian besar dari 2/3 bagian posterior kavum nasi (septum dan dinding lateral) dipersarafi oleh ganglion sfenopalatina yang dapat diblok dengan meletakkan tampon kapas yang telah dibasahi cairan anestesi di dekat foramen sfenopalatina yang terletak pada bagian posterior konka media. Nervus etmoidalis anterior mempersarafi bagian anterior dan superior kavum nasi (dinding lateral dan septum) dapat diblok dengan meletakkan tampon pada tulang hidung bagian atas dimana nervus
tersebut masuk. Cabang nervus infra orbital mempersarafi vestibulum pada sisi medial dan lateral (Dhingra, 2014).
Saraf otonom terdiri dari saraf parasimpatis dan saraf simpatis. Saraf parasimpatis mengontrol sekresi hidung dan kelenjar hidung. Saraf parasimpatis berasal dari nervus petrosa superfisial yang besar, berjalan pada nervus dari kanalis pterigoideus (nervus vidianus) dan mencapai ganglion sfenopalatina dimana saraf ini bercabang sebelum mencapai kavum nasi. Saraf ini juga mensuplai pembuluh darah hidung dan menyebabkan vasodilatasi (Dhingra, 2014).
Saraf simpatis berasal dari dua segmen toraks bagian atas dari tulang belakang, melewati ganglion servikalis superior, berjalan di dalam nervus petrosa dan bergabung dengan saraf parasimpatis dari nervus petrosa yang besar untuk membentuk nervus dari kanalis pterigoideus (nervus vidianus). Saraf simpatis mencapai kavum nasi tanpa bercabang pada ganglion sfenopalatina. Rangsangan pada saraf simpatis dapat menyebabkan vasokonstriksi. Rinore yang berlebihan pada kasus rinitis alergi dan vasomotor dapat dikontrol dengan memotong nervus vidianus (gambar 2.6) (Dhingra, 2014).
Gambar 2.6. Persarafan hidung. (A) Ganglion sfenopalatina berada pada bagian ujung posterior dari konka media mensuplai sebagian besar 2/3
posterior hidung. (B) Saraf pada dinding medial (Dhingra, 2014)
2.2 Anatomi Sinus Paranasal 2.2.1 Sinus maksila
Sinus maksila adalah daerah berpneumatisasi di dalam tulang maksila dan merupakan sinus paranasal yang terbesar. Dinding anterior berasal dari permukaan fasial os maksila, dinding posterior berbatasan dengan fosa pterigopalatina, dinding medial merupakan dinding lateral dari kavum nasi, dasar dari sinus adalah prosesus alveolaris, dan dinding superior adalah dasar orbita. Nervus infra orbita melewati dasar orbita kemudian keluar dari bagian anterior maksila melalui foramen infra orbita. Kanalis nervus infra orbita menghilang sampai ke sinus maksila pada 14% kasus dan dapat menjadi resiko selama bedah sinus endoskopi. Akar gigi molar pertama dan kedua dapat menghilang sampai ke sinus maksila pada 2% kasus. Pada kondisi ini beresiko untuk terjadinya fistel oroantral
bila dilakukan pencabutan gigi pada daerah ini (Leung, Walsh dan Kern, 2014).
Ostium alami sinus maksila terbuka ke bagian superior dari dinding media yang berdrainase ke infundibulum etmoid. Ostium aksesori sinus maksila dapat dijumpai pada 15-40% kasus, sebagian besar pada bagian superior dan posterior dari prosesus unsinatus di atas konka inferior. Kadang-kadang sel Haller, atau sel etmoid yang berpneumatisasi pada bagian lateral antara sinus maksila dan dasar orbita dapat dijumpai. Adanya sel Haller berpotensial untuk menyempitkan infundibulum maksila dan mengganggu drainase sinus (Leung, Walsh dan Kern, 2014).
2.2.2 Sinus frontal
Ukuran dan bentuk dari sinus frontal bervariasi tergantung pada derajat pneumatisasinya, dapat juga tidak berkembang pada kurang lebih 5% orang dewasa. Sinus frontal dapat tidak dijumpai pada satu sisi atau dapat sangat besar meluas sampai ke atap orbita. Kedua sinus frontal sering asimetris dan dipisahkan oleh septum intersinus yang tipis dan posisinya sering oblik atau bahkan dapat tidak sempurna (Dhingra, 2014; Leung, Walsh dan Kern, 2014). Dinding anterior sinus berhubungan dengan kulit dahi, dinding inferior berhubungan dengan orbita, dan dinding posterior berhubungan dengan selaput otak dan lobus frontal dari otak (Dhingra, 2014).
Drainase dari sinus frontal adalah kompleks dengan saluran keluar yang menyerupai bentuk jam pasir pada potongan sagital. Bagian superior meluas sampai ke sinus frontal dan bagian inferiornya meluas sampai ke resesus frontalis. Variasi pola drainase saluran keluar sinus frontal tergantung pada pneumatisasi dari sekitar sel etmoid dan posisi dari prosesus unsinatus. Adanya pneumatisasi yang jelas dari sel ager nasi atau bula etmoid dapat mengobstruksi drainase sinus frontal dengan menyempitkan resesus frontalis. Drainase sinus frontal juga tergantung
pada perlekatan dari bagian superior prosesus unsinatus (Leung, Walsh dan Kern, 2014). Pembukaan dari sinus frontal berada di dasarnya dan menuju ke meatus media. Pada meatus media, drainase sinus frontal ke resesus frontalis dijumpai sebanyak 55%, di atas namun tidak ke infundibulum sebanyak 30%, ke infundibulum sebanyak 15% dan di atas bula etmoid sebanyak 1% (Dhingra, 2014).
2.2.3 Sinus etmoid
Sinus etmoid merupakan rongga berisi udara dengan dinding yang tipis, dengan jumlah yang bervariasi dari 3 sampai 18, yang mengisi ruangan antara 1/3 atas dari dinding lateral hidung dan dinding medial orbita. Secara klinis sel etmoid dibagi menjadi etmoid anterior yang bermuara di meatus media, dan etmoid posterior yang bermuara di meatus superior (Dhingra, 2014). Bula etmoid adalah sel etmoid anterior yang paling konstan dan yang paling besar. Infundibulum etmoid
mengumpulkan sekresi dari sel etmoid anterior, sinus maksila dan pada beberapa kasus, sinus frontal. Infundibulum etmoid berhubungan dengan meatus media melalui hiatus semilunaris (Lee, 2008).
Setiap labirin etmoid memiliki hubungan yang penting. Bagian atap dibentuk oleh fosa cranii anterior, di sebelah lateral dari lamina kribrosa. Selaput otak membentuk hubungan yang penting disini. Dinding lateral berhubungan dengan orbita. Lamina dari tulang yang tipis seperti kertas (lamina papirasea) memisahkan sel udara dari orbita, yang dapat dengan mudah hancur yang dapat menyebabkan penyebaran infeksi pada etmoid ke orbita. Nervus optikus berhubungan dekat dengan sel etmoid posterior dan beresiko selama pembedahan etmoid (Dhingra, 2014).
2.2.4 Sinus sfenoid
Kedua sinus sfenoid kanan dan kiri jarang simetris dan dipisahkan oleh septum tulang yang tipis, posisinya sering miring dan bahkan dapat tidak sempurna. Derajat pneumatisasi sinus sfenoid bervariasi dan juga
perluasan dari sinus dan struktur yang berhubungan dengannya. Kavum sinus dapat besar dan meluas sampai ke sayap sfenoid dan bahkan pterigoideus (Dhingra, 2014). Sinus sfenoid memiliki banyak hubungan penting dengan neurovaskular. Arteri karotis interna berada di sebelah lateral dari sinus sfenoid yang berjalan melalui sinus kavernosus membentuk penonjolan pada bagian lateral dinding sinus sfenoid pada 65% individu. Kira-kira 25% tulang pembungkus yang memisahkan arteri karotis interna dari sinus sfenoid sebagian menghilang. Penonjolan nervus optikus terjadi pada 40% individu dan menghilang pada 6% (Leung, Walsh dan Kern, 2014). Sel sfenoetmoid (sel Onodi) adalah sel etmoid yang paling posterosuperior yang berpneumatisasi ke atas, lateral dan posterior dari bagian depan sfenoid. Secara radiologis, sel ini terlihat seperti sinus sfenoid yang bersepta dengan ruangan pada bagian superior yang menggambarkan sel sfenoetmoid. Sel ini berhubungan dekat dengan nervus optikus yang membentuk tonjolan lateral, pembedahan yang tidak bijaksana di dalam sel ini dapat menyebabkan trauma nervus optikus dan kebutaan (Lee, 2008).
Ostium sinus sfenoid terbuka ke resesus sfenoetmoid. Pada suatu penelitian dari ostium sinus sfenoid mengidentifikasikan bahwa ujung dari bagian posteroinferior dari konka superior sebagai petunjuk untuk mengidentifikasi ostium alami sinus sfenoid. Pada kebanyakan kasus ujung dari bagian posteroinferior dari konka superior terletak pada bidang horizontal yang sama seperti dasar dari sinus sfenoid. Ostium terletak di sebelah medial dari konka superior pada 83% kasus dan di sebelah lateral pada 17% kasus (Leung, Walsh dan Kern, 2014).
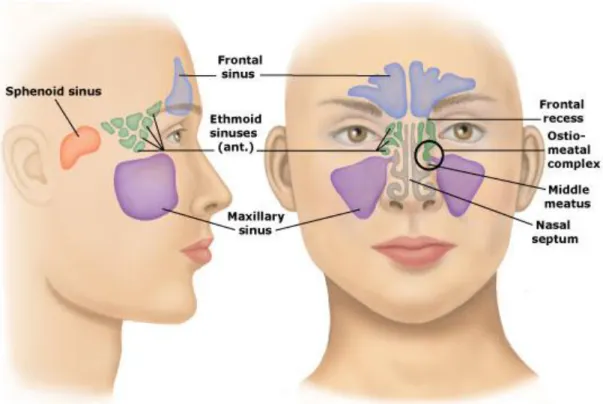
Gambar sinus paranasal:
Gambar 2.7. sinus paranasal (National Cancer Institute, 2015)
2.2.5 Membran mukosa sinus paranasal
Sinus paranasal dilapisi oleh membran mukosa yang bersambung dengan kavum nasi melalui ostium sinus. Membran mukosa sinus paranasal lebih tipis dan lebih sedikit pembuluh darah dibandingkan dengan kavum nasi. Secara histologi tampak epitel silindris bersilia dengan sel goblet yang mensekresi mukus. Silia lebih terlihat jelas di dekat ostium sinus dan membantu drainase mukus ke kavum nasi (Dhingra, 2014).
2.2.6 Kompleks ostiomeatal
Kompleks ostio-meatal menggambarkan jalur utama yang umum dari mucociliary clearance untuk etmoid anterior, sinus maksila dan sinus frontal. Kompleks ostio-meatal bukan merupakan sebutan anatomi yang benar melainkan suatu area fungsional. Kompleks ostio-meatal meliputi beberapa struktur yang berdrainase ke meatus media: ostium sinus maksila, infundibulum etmoid, sel etmoid anterior dan resesus frontalis. Inflamasi fokal atau obstruksi massa pada unit ostio-meatal dapat mengganggu aliran mukosiliar pada beberapa tempat, berpotensi menyebabkan rinosinusitis (gambar 2.8) (Hwang dan Abdalkhani, 2009).
Gambar 2.8. Kompleks ostiomeatal (Hwang dan Abdalkhani, 2009)
2.3 Rinosinusitis Kronis 2.3.1 Definisi
Rinosinusitis kronis merupakan gangguan klinis yang meliputi infeksi heterogen dan kondisi inflamasi yang mempengaruhi sinus paranasal. Menurut sejarah, sinusitis merupakan terminologi yang umum
digunakan untuk inflamasi pada sinus paranasal. Terminologi ini perlahan-lahan ditinggalkan dan lebih disukai istilah rinosinusitis karena inflamasi hidung hampir selalu bersamaan dengan inflamasi sinus paranasal. Namun tetap masih ada kontroversi mengenai definisi dan diagnosis dari semua bentuk rinosinusitis. Hal ini dikarenakan pada kenyataannya bahwa rinosinusitis kronis mencakup spektrum penyakit yang memiliki penyebab yang banyak dan berbagai pengobatan yang tepat (Schlosser dan Woodworth, 2009).
Definisi rinosinusitis menurut American Academy of Otolaryngology-Head and Neck Surgery (AAO-HNS) pada tahun 1996
berdasarkan durasi tanda dan gejala klinis dibagi menjadi akut (lebih dari 4 minggu), subakut (4 sampai 12 minggu), kronis (lebih dari 12 minggu), akut rekuren (≥4 episode per tahun dan setiap episodenya berlangsung hingga ≥7 sampai 10 hari dan tanpa intervensi terhadap tanda rinosinusitis kronis), dan kronis eksaserbasi akut (rinosinusitis kronis memburuk tiba-tiba, kembali pada keadaan awal setelah terapi). Untuk praktisnya, sebagian besar praktisi lebih suka membagi menjadi 2 kategori, rinosinusitis akut dan kronis. Penting untuk diperhatikan bahwa rinosinusitis akut dapat berkembang menjadi rinosinusitis kronis pada beberapa kasus. Bagaimanapun juga, rinosinusitis akut biasanya merupakan infeksi dari alam, sedangkan yang kronis mungkin disebabkan oleh berbagai proses inflamasi. Rinosinusitis kronis paling sering dibagi menjadi kategori pasien dengan perubahan mukosa hiperplastik dengan polip dan tanpa polip (Schlosser dan Woodworth, 2009).
2.3.2 Kekerapan
Penelitian Munir (2006) terhadap 35 penderita rinosinusitis kronik yang menjalani operasi tahun 2002-2003 di RSUP H. Adam Malik, Medan mendapatkan kelompok umur terbanyak adalah 35-44 tahun sebanyak
34,3%, sedangkan jumlah penderita perempuan sebanyak 20 penderita (57%) dan laki-laki sebanyak 15 penderita (43%).
Penelitian Multazar (2011) mengenai penderita rinosinusitis kronik di poliklinik THT-KL RS. H. Adam Malik Medan periode Januari 2008 sampai dengan Desember 2008, menjumpai 296 penderita rinosinusitis kronis dengan tindakan operasi terbanyak adalah bedah sinus endoskopi fungsional sebanyak 54 penderita (80,6%), diikuti antrostomi (11,94%),
CWL (5,97%) dan trepanasi sinus frontal sebesar 1,49%.
Dewi (2013) dalam penelitiannya mengenai penderita rinosinusitis kronik yang menjalani tindakan bedah sinus endoskopik fungsional di RSUP H. Adam Malik Medan tahun 2008-2011 menjumpai 111 penderita yang terdiri dari 59 penderita rinosinusitis kronik tanpa polip dan 52 penderita rinosinusitis kronik dengan polip.
2.3.3 Etiologi dan patofisiologi
Rinosinusitis kronis memiliki banyak penyebab yang terdiri dari infeksi (virus, bakteri dan jamur), anatomi, alergi, disfungsi mukosilier kongenital (misalnya fibrosis kistik, diskinesia siliari primer atau didapat) dan gangguan sistemik. Adanya bakteri di dalam hidung dan sinus paranasal pada populasi rinosinusitis kronis telah dapat dibuktikan, dan kebanyakan praktisi percaya bahwa bakteri memiliki peranan pada sebagian besar kasus. Apakah bakteri memiliki peranan secara langsung atau tidak langsung dalam perkembangan rinosinusitis kronis belum dapat ditentukan secara pasti (Schlosser dan Woodworth, 2009).
a. Progresi dari rinosinusitis akut
Kondisi yang mempengaruhi rinosinusitis kronis sama dengan infeksi akut dalam hal faktor ekstrinsik, intrinsik, sistemik dan faktor lokal penjamu. Selanjutnya, episode berulang dari rinosinusitis akut pada akhirnya dapat menyebabkan disfungsi mukosa dan infeksi kronis. Gejala pada rinosinusitis kronis lebih bervariasi dibanadingkan dengan
rinosinusitis akut. Rinosinusitis kronis secara khas mengalami disregulasi mukosa yang luas dan proses inflamasi kronis yang sangat sulit untuk diterapi. Penyakit ini sering tahan terhadap terapi obat-obatan dan pembedahan yang tersedia saat ini. Kortikosteroid sistemik lebih sering digunakan pada rinosinusitis kronis, oleh karena penyakit ini mempunyai komponen inflamasi kronis yang mendasari secara signifikan. Selanjutnya rinosinusitis akut secara histologi menunjukkan proses eksudatif yang ditandai dengan inflamasi neutrofilik dan nekrosis, sedangkan rinosinusitis kronis merupakan proses proliferatif yang paling sering ditandai dengan menebalnya membran mukosa dan lamina propria. Karena rinosinusitis akut hampir selalu merupakan infeksi, ini ditandai dengan normal inflamasi tipe T helper 1 (Th1) yang berhubungan dengan dikeluarkannya neutrofil sebagai tipe sel predominan untuk melawan infeksi. Sementara itu tipe inflamasi infeksius ini predominan pada rinosinusitis kronis sekunder terhadap fibrosis kistik, diskinesia siliari dan rinosinusitis yang berasal dari infeksi gigi, kebanyakan rinosinusitis kronis memiliki respon inflamasi tipe atopi (Th2) dimana eosinofil merupakan sel inflamasi yang predominan pada rinosinusitis kronis atopi maupun non atopi (Schlosser dan Woodworth, 2009).
b. Faktor anatomi
Pada beberapa kasus, rinosinusitis kronis berkembang dari infeksi bakteri kronis pada rongga sinus dengan adanya obstruksi ostium anatomis. Abnormalitas anatomis menyebabkan penyempitan saluran yang mengakibatkan seseorang dapat mengalami rinosinusitis kronis, terutama dengan adanya beberapa macam inflamasi yang dapat berulang kembali. Beberapa variasi anatomi yang juga dapat menyebabkan seseorang menderita rinosinusitis kronis termasuk diantaranya sel Haller (infundibular), jalur pengaliran sinus frontal yang sempit karena sel ager nasi ataupun sel frontal yang besar. Sekali ostium tersumbat, terjadi hipoksia lokal pada rongga sinus dan sekresi sinus menumpuk. Hal ini
menyebabkan terbentuknya lingkungan yang cocok untuk perkembangan bakteri yang cepat. Toksin bakteri dan mediator endogen selanjutnya merusak terutama epitel respiratori bersilia dan akibatnya terjadi penurunan mucociliary clearance. Terjadi lingkaran setan dengan tertahannya hasil sekresi dan infeksi lebih lanjut (Schlosser dan Woodworth, 2009).
c. Disfungsi mukosilier
Mucociliary clearance merupakan hal yang penting khususnya
dalam menjaga homeostasis sinus paranasal. Gerakan silia epitel mengeluarkan alergen, bakteri dan polutan yang terperangkap pada mukus atau lapisan jeli dari lapisan mukosilier melalui jalur drainase alami. Sisa mukus pada cairan perisilier atau lapisan sol yang memungkinkan eliminasi yang cepat dari sekresi yang kental. Mucociliary clearance dapat diganggu oleh rusaknya fungsi siliari yang disebabkan oleh faktor intrinsik dan ekstrinsik atau perubahan kekentalan dan produksi mukus. Faktor intrinsik yang dapat menyebabkan disfungsi silia diantaranya diskinesia siliari primer atau sindrom Kartagener. Faktor ekstrinsik yang dapat mengganggu mucociliary clearance diantaranya trauma oleh iritan lingkungan, mediator endogen dari inflamasi, atau trauma operasi. Pasien dengan fibrosis kistik memiliki kekentalan mukus yang tinggi sebagai proses sekunder dari perubahan transpor air dan elektrolit. Lapisan jeli dan sol dari lapisan mukus juga dipengaruhi, dengan demikian menghalangi pengeluaran bakteri. Iritan yang berasal dari udara, alergen, paparan udara dingin, ataupun infeksi virus pada saluran pernafasan atas dapat meningkatkan produksi mukus dan melampaui kecepatan
mucociliary clearance. Semua faktor-faktor ini dapat menyebabkan
penumpukan mukus di dalam sinus, menurunkan pengeluaran bakteri dan menciptakan lingkungan yang cocok untuk perkembangan bakteri (Schlosser dan Woodworth, 2009).
d. Inflamasi tulang
Penelitian baru-baru ini menyatakan bahwa tulang mungkin dapat berperan aktif dalam proses penyakit ini; inflamasi yang berhubungan dengan RSK dapat menyebar melalui sistem Haversian di dalam tulang. Angka perubahan tulang pada RSK sama seperti pada osteomyelitis. Selanjutnya, operasi yang menginduksi infeksi baik dengan
Staphylococcus aureus atau pun Pseudomonas aeruginosa dapat
menginduksi semua perubahan klasik dari osteomyelitis dan menginduksi perubahan inflamasi kronik di sepanjang mukosa pada jarak yang signifikan dari daerah infeksi. Oleh karena itu, inflamasi tulang mungkin merupakan faktor penting dalam penyebaran perubahan inflamasi kronis dan dapat menjelaskan kekebalan terhadap terapi medis. Masih belum jelas, apakah tulang menjadi terinfeksi dengan bakteri atau terapi medis. Namun masih belum jelas apakah tulang benar-benar menjadi terinfeksi dengan bakteri atau perubahan yang diamati benar-benar reaktif (Schlosser dan Woodworth, 2009).
e. Sinusitis dentogen
Patologi pada gigi dapat menyebabkan sinusitis pada sinus maksila dengan penyebaran selanjutnya ke sinus yang berdekatan. Patologi ini dapat berupa infeksi gigi, abses akar gigi, fistel oro-antral dan prosedur operasi pada mulut yang menimbulkan sinusitis. Pasien-pasien ini khususnya membutuhkan terapi, baik terapi pada mulut maupun sinus untuk mengeradikasi infeksi (Schlosser dan Woodworth, 2009).
f. Biofilm
Penelitian yang terbaru membuktikan bahwa P. aeruginosa membentuk biofilm pada sinus, yang mungkin menyebabkan penyakit pada sinus yang membandel. Bakteri yang menghasilkan bifilm merupakan organisasi kompleks dari bakteri yang melekat pada permukaan. Biofilm sangat kompleks, merupakan struktur tiga dimensi dari
bakteri hidup, yang secara in vivo membentuk menara dan lapisan organisme hidup yang dibungkus oleh polisakarida. Mereka dapat menyerang pertahanan tubuh penjamu dan menunjukkan penurunan kepekaan terapi antibiotik baik secara lokal maupun secara sistemik. Bertahannya biofilm disebabkan oleh metode pertumbuhannya. P.
aeruginosa berkembang dalam mikrokoloni yang dikelilingi oleh matriks
ekstraseluler dari alginat eksopolisakarida. Biofilm yang terbentuk pada permukaan mukosa disebut dengan biofilm mukosa, sebagai bakteri penghasil biofilm yang terbentuk pada lingkungan khusus dari mukosa bersilia, daerah yang diharapkan memiliki proteksi terhadap formasi
biofilm (Lee, 2008; Schlosser dan Woodworth, 2009).
2.3.4 Diagnosa
Berdasarkan European Position Paper on Rhinosinusitis and Nasal
Polyps 2012 rinosinusitis kronis dengan atau tanpa polip nasi pada
dewasa didefinisikan sebagai inflamasi pada hidung dan sinus paranasal yang ditandai dengan dua atau lebih gejala dengan satu diantaranya berupa hidung tersumbat atau adanya sekret pada hidung (anterior / posterior nasal drip) yang disertai dengan nyeri wajah atau berkurang / hilang penciuman selama ≥ 12 minggu. Gejala tersebut harus didukung oleh gambaran pada endoskopi berupa polip nasi dan / atau sekret mukopurulen terutama berasal dari meatus media dan / atau edema atau obstruksi mukosa terutama pada meatus media, dan / atau perubahan pada gambaran CT scan berupa perubahan mukosa dalam kompleks ostiomeatal dan / atau sinus (Fokkens, et al., 2012).
2.4 Biofilm Secara Umum
Biofilm didefinisikan sebagai komunitas mikroba dalam bentuk sesil
yang ditandai dengan sel-sel yang secara ireversibel melekat pada substratum atau satu sama lainnya. Mereka tertanam dalam matriks
substansi polimer ekstraseluler (EPS) yang mereka hasilkan, dan menunjukkan perubahan fenotip berhubungan dengan tingkat pertumbuhan dan transkripsi gen (Donlan dan Costerton, 2002; Foreman, at al., 2009; Hassan, et al., 2011).
Secara alami 99% bakteri dalam bentuk sesil, hanya 1% yang dalam bentuk planktonik, dalam keadaan bebas mengambang (Keir, Pedelty dan Swift, 2011). Meskipun sebagian besar bakteri di alam ada sebagai biofilm, namun sebagian besar infeksi bakteri akut dalam bentuk planktonik, bakteri yang bebas bergerak (Ferguson dan Donna, 2005).
Biofilm dan bentuk planktonik dari spesies bakteri yang sama dijumpai
berbeda dalam hal transkripsi gen dan ekspresi fenotip. Biofilm tidak hanya terbatas pada bakteri, patogen jamur juga mampu memproduksi
biofilm (Costerton, et al., 2003; Keir, Pedelty dan Swift, 2011; Sanglard,
2002).
Berdasarkan publikasi oleh National Institutes of Health, lebih dari 80% dari semua infeksi melibatkan biofilm. Biofilm berhubungan dengan banyak kondisi medis termasuk diantaranya alat-alat medis yang terpasang lama, plak gigi, infeksi saluran pernapasan atas, peritonitis, dan infeksi urogenital. Baik bakteri gram-positif maupun gram-negatif memiliki kemampuan untuk membentuk biofilm. Bakteri yang sering terlibat termasuk diantaranya Enterococcus faecalis, Staphylococcus aureus,
Staphylococcus epidermidis, Streptococcus viridans, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis dan Pseudomonas aeruginosa
(Donlan, 2001; Hassan, et al., 2011; Reid, 1999)
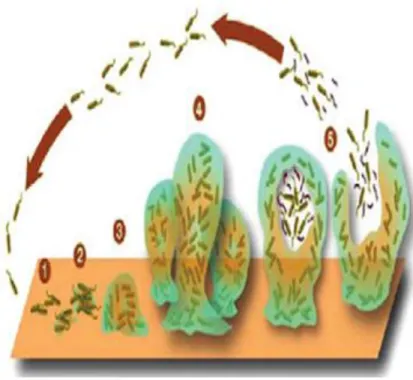
Proses pembentukan biofilm terdiri dari perlekatan (attachment), pertumbuhan (growth) dan pelepasan (detachment) (gambar 2.9). Perlekatan awalnya reversibel dan berdasarkan pada daya tarik elektrostatik. Namun, permukaan bakteri mediasi protein dan pembentukan struktur penahan oleh beberapa sel menyebabkan adesi
ireversibel (Costerton, Montanaro dan Arciola, 2004; Keir, Pedelty dan Swift, 2011). Pada bakteri pseudomonas, tahap ini difasilitasi oleh pili tipe IV. Hal ini diperlukan untuk aktivitas berkerut dan juga untuk membantu akses ke mukosa saluran napas hidung (Keir, Pedelty dan Swift, 2011; Sun, et al., 2013).
Gambar 2.9. Formasi biofilm. sel individu melekat di permukaan (1), substansi polimer ekstraseluler diproduksi perlekatan menjadi ireversibel
(2), biofilm matang dan berkembang (3 dan 4), sel tunggal keluar dari
biofilm (5) (Keir, Pedelty dan Swift, 2011)
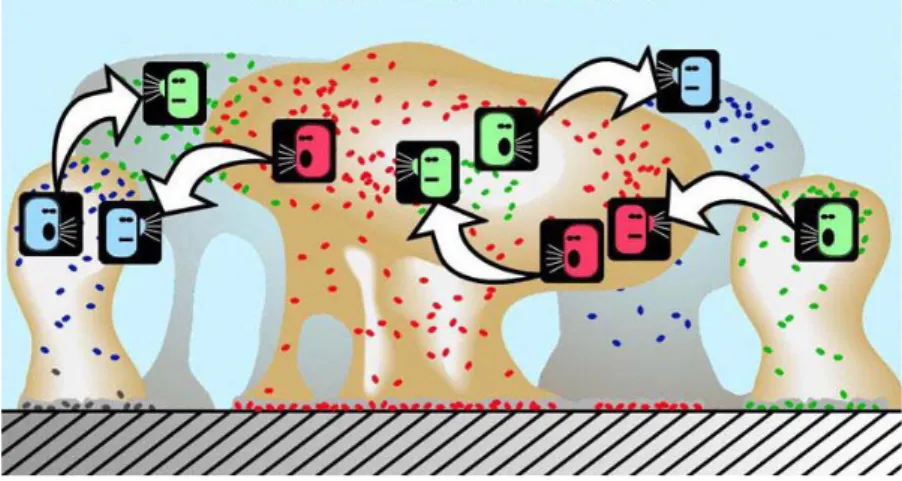
Proses perlekatan bakteri pada substratum dan pertumbuhan bakteri hingga beban yang cukup diakibatkan oleh sinyal kimia yang terkoordinasi di antara sel, yang dikenal sebagai quorum sensing (Keir, Pedelty dan Swift, 2011; Singh, et al., 2000; Sun, et al., 2013). Bakteri gram-positif menghasilkan γ-butyrolactones dan 'auto-inducing peptida';
bakteri gram negatif menghasilkan N-acylated homoserine lactones, kuinolon dan dipeptida siklik. Senyawa ini berjalan melalui difusi dan berinteraksi dengan permukaan bakteri tetangga dan / atau reseptor intraseluler (gambar 2.10) (Dunn dan Handelsman, 2002; Keir, Pedelty dan Swift, 2011; Sun, et al., 2013).
Gambar 2.10. Quorum sensing: sel sesil dalam biofilm berkomunikasi satu sama lain via quorum sensing untuk membangun mikrokoloni dan
menjaga saluran air tetap terbuka (Levchenko, at al., 2015)
Komunikasi ini mengakibatkan induksi gen, peningkatan regulasi protom, dan akhirnya produksi dari ekstraseluler, substansi polimer yang terdiri dari polisakarida, asam nukleat dan protein (Keir, Pedelty dan Swift, 2011; Sun, et al., 2013 Sutherland, 2001). Substansi ini membentuk matriks, menyediakan ekosistem yang cocok dengan kebutuhan kolini
biofilm, yaitu mengurangi kebutuhan nutrisi dan oksigen; memediasi untuk
adesi ke permukaan; perlindungan dari kondisi eksternal yang tidak menguntungkan; lingkungan anaerobik yang menguntungkan; dan pembentukan saluran air yang memungkinkan pengeluaran produk limbah
dan transportasi nutrisi (Chole dan Faddis, 2003; Keir, Pedelty dan Swift, 2011; Sun, et al., 2013).
Pelepasan (detachment) bakteri dari biofilm terjadi karena kekuatan eksternal, atau dengan proses yang aktif segera setelah tingkat kematangan kritis tercapai. Pelepasan biofilm dapat difasilitasi oleh konduksi gerakan fisik seperti gelombang, oleh degradasi enzimatik dari matriks ekstraseluler dan oleh modulasi adesi permukaan (Keir, Pedelty dan Swift, 2011; Sun, et al., 2013). Produk dari proses pelepasan merangsang pelepasan lebih lanjut dari bakteri planktonik. Embolisasi bakteri ke daerah lain kemudian dapat terjadi, memungkinkan seluruh proses untuk mulai lagi. (Keir, Pedelty dan Swift, 2011; Sanclement, et al., 2005; Sun, et al., 2013).
Mikroorganisme yang tumbuh di dalam biofilm secara intrinsik lebih tahan terhadap agen antimikroba dibandingkan sel planktonik. Resistensi terhadap antibiotik ini dapat meningkat hingga 1000 kali lipat (Hassan, et al., 2011; Keir, Pedelty dan Swift, 2011; Sun, et al., 2013). Hal ini terjadi melalui beberapa mekanisme. Dalam biofilm, kontak antar sel diantara mikroorganisme tetangga memfasilitasi pertukaran plasmid yang mudah, memungkinkan evolusi dari resistensi antibiotik (Donlan, 2002; Keir, Pedelty dan Swift, 2011). Selain itu, biofilm dapat menghasilkan β-laktamase yang menonaktifkan antibiotik β-laktam, matriks bermuatan negatif juga menolak aminoglikosida bermuatan positif. Akhirnya, pertumbuhan bakteri yang relatif lambat dalam biofilm mengganggu efektivitas antimikroba, yang mana obat-obatan tersebut lebih efektif dalam membunuh sel yang berkembang secara cepat (Keir, Pedelty dan Swift, 2011; Walters, et al., 2003).
2.5 Biofilm pada Rinosinusitis Kronis
Rinosinusitis kronis merupakan penyakit yang sering dijumpai pada bagian telinga hidung tenggorok kepala dan leher. Patogenesisnya belum sepenuhnya ditemukan. Teori multifaktor yang secara luas diterima diantaranya adalah infeksi (bakteri, jamur, virus), abnormalitas anatomi dari kompleks ostiomeatal, hipersensitivitas, disfungsi sistem mukosiliar. Pada beberapa tahun belakangan ini penelitian tentang bakteri pada rinosinusitis kronis melaporkan nilai positif sebanyak 32,5% sampai 96%, mengindikasikan adanya hubungan antara rinosinusitis kronis dengan bakteri (Yildirun, et al., 2004; You, et al., 2011). Beberapa peneliti mengemukakan bahwa biofilm adalah penyebab yang umum dari infeksi persisten kronis (Bendouah, et al., 2006; You, et al., 2011).
Bakteri biofilm terdiri dari polimer ekstraseluler yang disekresi oleh bakteri dan mozaik bakteri di dalamnya, bakteri biofilm ini memiliki karakteristik angka pertumbuhan yang lambat, resisten terhadap antibiotik yang kuat, kemampuan mentransfer gen secara bersamaan. Sekali biofilm terbentuk resistensi terhadap antibiotik meningkat 500 sampai 1000 kali dibandingkan dengan daerah yang bebas bakteri (Tewart dan Costerton, 2001; You, et al., 2011).
Peran biofilm sebagai etiologi patologis utama pada rinosinusitis kronis dapat membantu menjelaskan manifestasi klinis dari penyakit. Pada rinosinusitis kronis perubahan mukosa mengakibatkan kondisi yang baik untuk pertumbuhan biofilm. Sekali biofilm terbentuk, dapat menyebabkan resisten terhadap pertahanan tubuh host dan terapi eksternal dikarenakan antigen yang terus-menerus ada dan perkembangan proses inflamasi kronis (Harvey dan Lund, 2007; Keir, Pedelty dan Swift, 2011).
Penelitian yang dilakukan oleh Ramadan dkk mengambil spesimen mukosa dari sinus etmoid dan maksila dari 5 kasus yang didiagnosa dengan rinosinusitis kronis semuanya menunjukkan biofilm (+), yang
terlihat di bawah mikroskop elektron dan kebanyakan seperti biofilm
Staphylococcus aureus. Semua kasus menunjukkan derajat abnormalitas
permukaan mukosa yang berbeda, susunan silia yang tidak teratur atau bahkan tidak ada silia dan sel goblet (Ramadan, Sanclement dan Thomas, 2005; You, et al., 2011). Sanclement dkk meneliti 30 kasus rinosinusitis kronis yang menjalani bedah sinus endoskopik fungsional dan 4 kasus kontrol (3 kasus septoplasty dan 1 kasus rinore cairan serebrospinal). Bakteri biofilm dijumpai pada 24 kasus dari kelompok rinosinusitis (80%), sedangkan pada kelompok kontrol tidak dijumpai biofilm (Sanclement, et al., 2005; You, et al., 2011). Zhang dkk meneliti 12 spesimen mukosa pasien rinosinusitis kronis, yang menunjukkan angka biofilm (+) sebanyak 83,3% dan biofilm tersebut dijumpai pada semua fase yaitu perlekatan, perkembangan dan pelepasan (You, et al., 2011; Zhang, et al., 2008). Hasil-hasil penelitian tersebut mengindikasikan bahwa biofilm
kemungkinan terlibat dalam patogenesis rinosinusitis kronis (You, et al., 2011).
Boase dkk pada tahun 2013 menemukan Staphylococcus aureus sebagai organisme yang paling banyak dijumpai pada pasien rinosinusitis kronis (61%), diikuti oleh Staphylococcus epidermidis (55%), dan
Propionibacterium acnes (37%). Nocardia asteroides (24%), Haemophilus influenzae (13%) dan Pseudomonas aeruginosa (8%) lebih sedikit
terdeteksi (Boase, et al., 2013). Stephenson dkk menemukan
Haemophilus influenzae sebanyak 17% pada pasien rinosinusitis kronis,
berbeda dengan penelitian belakangan ini yang menggunakan FISH (fluorescent in situ hybridisation) mengemukakan Haemophilus influenzae sebagai organisme dominan pada rinosinusitis kronis (Sanderson, Leid dan Hunsaker, 2006). Studi molekular terbaru menemukan Pseudomonas
aeruginosa sebagai organisme dominan pada pasien rinosinusitis kronis.
pola penggunaan antimikroba, perbedaan metodologi, atau gambaran keparahan penyakit (Boase, et al., 2013).
Dengan menggunakan berbagai macam teknik pencitraan, biofilm telah dijumpai pada mukosa sinonasal dari pasien rinosinusitis kronis (Cryer, et al., 2004; Ferguson dan Stolz, 2005; Sanderson, Leid dan Hunsaker, 2006). Lebih lanjut lagi, adanya biofilm telah dihubungkan dengan sinusitis yang gejala klinisnya lebih buruk (Bendouah, et al., 2006; Foreman, et al., 2009). Temuan ini direplikasikan pada studi baru-baru ini dimana dijumpai pasien rinosinusitis kronis dengan biofilm (+) memiliki skor gejala klinis yang lebih buruk secara signifikan dibandingkan dengan yang nonbiofilm. Tetapi tidak ada perbedaan antara skor CT Lund-Mackay, yang menguatkan kurangnya korelasi antara skor gejala dan pemeriksaan radiologis terhadap keparahan penyakit (Foreman, et al., 2009).
2.6 Pemeriksaan Biofilm
Ada beberapa teknik pemeriksaan biofilm, teknik yang telah distandarisasi sangat penting sekali dikembangkan. Berbagai metode telah distandarisasi pada beberapa laboratorium, masing-masing mempunyai kelebihannya masing-masing. Metode-metode ini diantaranya metode lempeng kultur jaringan, metode tabung, metode agar merah kongo, liquid-interface coverslip assay, scanning mikroskop elektron, dan pemeriksaan dengan mikroskop cahaya atau fluoresens (Mathur, et al., 2006; Taj, et al., 2012). Saat ini baku emas untuk mengidentifikasi adanya
biofilm adalah confocal scanning laser microscopy yang digunakan
bersamaan dengan fluorescent in-situ hybridisation (FISH) (Keir, Pedelty dan Swift, 2011).
Hong dkk dalam penelitiannya terhadap 55 orang pasien rinosinusitis kronis yang menjalani bedah sinus endoskopi fungsional
mendeteksi biofilm menggunakan pewarnaan hematoxylin eosin dengan 3 observer independent, menyimpulkan bahwa pewarnaan hematoxylin eosin dalam mendeteksi biofilm dapat menjadi metode yang praktis dan murah (Hong, et al., 2013).
Toth dkk dalam penelitiannya terhadap 50 pasien rinosinusitis kronis dan 12 orang yang menjalani septoplasti tanpa rinosinusitis kronis sebagai kontol negatif mendeteksi adanya biofilm bakteri dengan pewarnaan hematoxylin eosin dan menyimpulkan bahwa pewarnaan hematoxylin eosin merupakan metode yang kuat dan terpercaya dalam mendeteksi biofilm bakteri pada rinosinusitis kronis (Toth, et al., 2011).
Hochstim dkk dalam penelitiannya yang membandingkan antara pemeriksaan dengan pewarnaan hematoxylin eosin dengan fluorescent
in-situ hybridisation menyatakan bahwa semua biofilm yang terdeteksi
dengan hematoxylin eosin juga terdeteksi dengan FISH. Selanjutnya, semua sampel yang biofilm negatif dengan hematoxylin eosin juga diklasifikasikan sebagai biofilm negatif dengan FISH, dimana dikatakan
biofilm positif bila terdapat kuantitas yang bermakna dari pewarnaan baik
dengan melapisi permukaan epitel atau berkelompok di sepanjang permukaan. Oleh karena itu pada penelitian ini hematoxylin eosin dengan tepat dapat mengidentifikasi keberadaan dan ketidak adaan dari biofilm pada semua kasus, dengan FISH sebagai standar kontrolnya, dimana sensitivitasnya 78% dan spesifisitasnya 93% (Boase, et al., 2013; Hochstim, et al., 2010).
Pada pemeriksaan dengan pewarnaan hematoxylin eosin mukosa yang diambil dari sinus etmoid difiksasi dalam formalin 4% selama 48 jam. Kemudian diwarnai dengan hematoxylin eosin dengan menggunakan prosedur patologi standar. Secara singkatnya, potongan mukosa dideparafinisasi dalam xylene (2x5 menit) dan direhidrasi secara berturut-turut selama 1 menit dicuci dengan ethanol 100%, 96%, 80%, dan 70%.
Kemudian diwarnai dengan hematoxylin selama 2 menit, dicuci dengan air suling, dicuci dengan asam hidroklorida 0,1% dalam 50% ethanol, dicuci dengan air keran selama 15 menit, diwarnai dengan eosin selama 1 menit, dan dicuci lagi dengan air suling. Slide-nya kemudian didehidrasi dengan ethanol 95% dan 100% secara berurutan diikuti dengan xylene (2x5 menit) dan ditutup dengan coverslip. Kemudian slide dianalisa dengan menggunakan mikroskop cahaya dengan pembesaran 20x dan 40x. Secara histologis biofilm tampak sebagai bentuk yang ireguler dari kelompok bakteri basofilik kecil, substansi ekstrapolimer, dan sisa eritrosit dan leukosit yang terperangkap pada permukaan epitel (gambar 2.11). Sampel diklasifikasikan menjadi, memiliki biofilm yang luas bila terdapat keterlibatan 50% atau lebih dari permukaan mukosa yang dianalisa, sedangkan bila kurang dari 50% diklasifikasikan sebagai biofilm (+), atau bila tidak ada dikatakan sebagai biofilm (-) (Hochstim, et al., 2010).
Gambar 2.11. Biofilm dengan pewarnaan hematoxylin eosin (Hochstim, et al., 2010)
Sangat disayangkan confocal scanning laser microscopy
merupakan peralatan yang tidak murah dan tidak tersedia luas. Namun dikarenakan terdapat peningkatan bukti bahwa biofilm berperan penting dalam banyak penyakit kronis, maka penting untuk mengidentifikasi metode yang lebih mudah dan lebih murah untuk meneliti biofilm pada sampel klinis. Ketersediaan pewarnaan hematoxylin eosin yang luas dalam laboratorium patologi klinik membuatnya menjadi metode yang sangat praktis untuk mendeteksi biofilm dalam praktek klinis (Hochstim, et al., 2010; Natili dan Leipzig, 2014).
2.7 Penatalaksanaan Biofilm
Penatalaksanaan standar rinosinusitis kronis pada orang dewasa saat ini yang direkomendasikan oleh kelompok studi Rinologi PERHATI-KL meliputi pemberian antibiotik, dekongestan oral, kortikosteroid dan mukolitik disertai terapi tambahan irigasi hidung. Penatalaksanaan terhadap rinosinusitis kronis yang disebabkan oleh biofilm juga sama (Mangunkusumo, 2011).
Meskipun komunitas medis telah mengetahui bahwa banyak penyakit dan infeksi yang disebabkan oleh biofilm, namun kebanyakan peneliti meyakini bahwa biofilm sulit atau tidak mungkin dimusnahkan, terutama sel yang membentuk lapisan bagian dalam dari biofilm yang tebal. Kebanyakan tulisan tentang biofilm menyatakan bahwa biofilm resisten terhadap antibiotik yang diberikan secara standar. Beberapa peneliti telah berulang kali mencoba memusnahkan biofilm dengan memberikan kepada pasien antibiotik dengan dosis tinggi dan secara konstan. Namun sayangnya ketika diberikan dengan dosis tinggi, antibiotik tersebut dapat melemahkan biofilm sementara, tetapi tidak dapat menghancurkannya (Deb, et al., 2014). Kemampuan biofilm dalam mentoleransi antibiotik dalam dosis tinggi ini dikarenakan oleh beberapa
faktor, yaitu kurangnya penetrasi antibiotik ke dalam matriks dari biofilm; di dalam biofilm bakteri secara fisiologis berubah dari bentuk planktonis yang aktif menjadi immobile dan tidak berkembang di dalam biofilm, sementara antibiotik lebih efektif dalam menghancurkan sel yang sedang berkembang aktif; adanya perubahan lingkungan kecil di dalam biofilm sepert pH dan kadar oksigen yang dapat menurunkan aktivitas agen antimikroba; adanya perubahan ekspresi gen organisme di dalam biofilm; dan berkurangnya fenotip spesifik dari biofilm (Aziz dan Aeron, 2014).
Antibiotik hanya efektif melawan biofilm bila diberikan dengan cara yang sangat spesifik. Selanjutnya, hanya antibiotik tertentu yang efektif terhadap biofilm. Contohnya, beberapa penelitian menunjukkan bahwa penetrasi dari oxacillin, cefotaxime (β-laktamase) dan vancomycin (glikopeptida) berkurang seccara signifikan terhadap biofilm Staphylococcus aureus dan Streptococcus epidermidis sedangkan
amikacin (aminoglikosida) dan ciprofloxacin (fluorokuinolon) tidak terpengaruh. Setelah beberapa dekade penelitian, yang kebanyakan berasal dari molecular modeling data, Marshall adalah orang pertama yang menciptakan regimen antibiotik yang secara efektif mentarget dan menghancurkan biofilm, yang disebut dengan Marshall Protocol. Yang utama dari Marshall Protocol ini adalah fakta bahwa biofilm dapat dimusnahkan sampai tuntas dengan pemberian antibiotik bakteriostatik spesifik yang diberikan dalam dosis rendah dan berpulsasi. Pemberian antibiotik dengan dosis standar hanya dapat memusnahkan bakteri dalam bentuk planktonis saja tetapi menyisakan persister (Deb, et al., 2014).
Persister adalah subpopulasi kecil dari bakteri di dalam biofilm yang
berdiferensiasi menjadi sel dorman (Aziz dan Aeron, 2014). Antibiotik dalam dosis rendah dan berpulsasi ini diberikan dengan cara pertama-tama antibiotik diberikan lalu kemudian dihentikan sementara setelah itu diberikan lagi. Pemberian antibiotik yang pertama kali dapat memusnahkan sebagian besar sel biofilm dan menyisakan persister.
Penghentian antibiotik memungkinkan populasi persister untuk mulai berkembang. Karena pemberian antibiotik dihentikan sementara, persister yang tersisa tidak dapat berkembang lebih lanjut lagi dikarenakan sel
persister tersebut kehilangan fenotipnya (bentuk dan properti biokimianya), artinya sel persister tersebut tidak dapat berubah kembali menjadi bentuk biofilm. pemberian antibiotik yang kedua selanjutnya dapat memusnahkan sel persister yang tetap dalam bentuk planktonis (Deb, et al., 2014).
Antibiotik yang digunakan dalam Marshall Protocol umumnya antibiotik yang bersifat bakteriostatik, seperti eritromisin, azitromisin ataupun golongan makrolida lainnya. Dosis yang diberikan adalah di bawah dari dosis minimal terapi yang lazim digunakan dengan pemberian selama tidak kurang dari 2 bulan, misalkan azitromisin diberikan di bawah dosis 250mg. Selain itu pasien juga mengkonsumsi olmesartan (Benicar) yang dapat mengikat dan mengaktifkan vitamin D receptor (VDR), sehingga memperbaharui kemampuan tubuh untuk, mengaktifkan sistem imun. Olmesartan diberikan dengan dosis 40mg 4x sahari, terkadang dapat ditingkatkan hingga tiap 4 jam sekali (Proal, 2008; Trister, 2013).
Dari beberapa penelitian didapatkan bahwa larutan cuci hidung (larutan saline) yang dicampur dengan 1% sampo bayi pada rinosinusitis kronis memberikan hasil yang baik dibandingkan dengan yang hanya diberi larutan saline. Chiu dkk pada tahun 2008 mendapatkan 60% pasien menunjukkan perkembangan hasil yang lebih baik pada keringnya post
nasal drip dan kekentalan mukus. Hal ini disebabkan oleh karena sampo
bayi mengandung surfaktan (Chiu, et al., 2008).
Pada beberapa tahun belakangan ini, pendekatan anti-biofilm baru telah dikembangkan sebagai alternatif dari terapi antibiotik klasik, diantaranya antimikroba peptida, enzim yang melemahkan matriks biofilm, bakteriofag, terapi ultrasonik, quorum sensing inhibitors, agen anti adesi.
Pemahaman yang mendalam mengenai mekanisme resistensi biofilm terhadap antimikroba akan sangat bermanfaat dalam mengembangkan agen anti-biofilm baru yang inovatif (Aziz dan Aeron, 2014; Chen, Yu dan Sun, 2013; Sun, et al., 2013).
2.8 Kerangka Teori
Rhinosinusitis
Kronis
Jenis kelamin
Usia
Gejala klinis
Lama gejala
Progresi dari rinosinusitis akut
Faktor anatomi
Disfungsi mukosilier
Inflamasi tulang
Sinusitis dentogen
Biofilm
Polip (+)
Polip (-)
Medikamentosa
Operasi
2.9 Kerangka Konsep