BAB II
Bakteri Filosfer Ageratum conyzoides L. dan Degradasi Kitin
A. Keragaman Bakteri Filosfer
Permukaan tanaman umumnya dihuni oleh berbagai jenis mikroorganisme, seperti bakteri dan fungi (Lindow & Bradl 2003). Koloni mikroorganisme berbeda-beda, sesuai dengan jenis tanaman dan jaringan yang didiaminya, seperti daun, akar ataupun bunga. Ada beberapa faktor yang dapat mempengaruhi keragaman mikroorganisme yang mendiami pemukaan daun, yaitu radiasi ultraviolet, kelembaban, kecepatan angin dan sumber nutrisi. Komunitas bakteri filosfer yang tidak ternaungi kanopi atau setengah ternaungi, akan sangat dipengaruhi oleh radiasi ultraviolet. Adanya radiasi ini menyebabkan dihasilkannya dua jenis mikroorganisme filosfer, yaitu mikroorganisme sensitif ultraviolet dan mikroorganisme yang toleran terhadap ultraviolet (Lindow 2006; Lindow & Bradl 2003; Wilson et al.,2006). Bakteri yang bersifat toleran terhadap UV adalah bakteri yang memiliki pigmen. Pigmen itu diantaranya, merah muda, orange dan kuning (Sundin & Jacob 2001).
Keragaman bakteri filosfer juga sangat dipengaruhi oleh kelembaban dan kecepatan angin, kelembaban dapat diperoleh dari air hujan dan embun. Kelembaban ini dapat hilang disebabkan oleh temperatur, angin dan aktivitas sel tanaman. Kelembaban dan kecepatan angin mempengaruhi mobilitas bakteri, yang akhirnya dapat menentukan keberadaan bakteri. Hal lain yang dapat menentukan keragaman dan keberadaan bakteri filosfer, yaitu nutrisi. Kelimpahan nutrisi pada daun dapat mengindikasikan keberadaan
mikroorganisme. Terutama nutrisi sumber karbon dan sumber nitrogen (Lindow, 2006; Wilson et al.,2006).
Banyak sekali kesulitan dalam proses identifikasi mikroorganisme pada permukaan tanaman, karena tidak semua mikroorganisme dapat diisolasi (dikultur) pada media tumbuh di laboratorium. Namun, hal ini dapat diatasi oleh adanya teknik identifikasi secara molekuler, bahkan bagi mikroorganisme yang bersifat unculturable sekalipun. Dalam teknik identifikasi ini, gen yang banyak digunakan adalah gen 16S rRNA untuk identifikasi bakteri dan gen 18S rRNA untuk fungi (Wilson et al.,2006). Contoh bakteri penghuni filosfer adalah
Pseudomonas fluorescens, Pseudomonas syringae, Bacillus cereus, Bacillus subtilis, Erwinia herbicola, Erwinia amylivora dan Serratia sp, dan telah
diketahui bahwa bakteri tersebut memiliki aktivitas kitinolitik (Lindow & Bradl 2003; Yurnaliza, 2002; El-Hamshary and Khattab, 2008). Menurut Busam (1997), patogenitas mikrooorganisme terhadap tanaman dapat dilakukan dengan beberapa cara, diantaranya mengeluarkan protein dalam bentuk enzim kitinase dan hal ini dapat memicu reaksi ketahanan sistemik (systemic acquired resistance/SAR) tanaman, Systemic acquired resistance atau SAR dapat memicu tanaman untuk menghasilkan metabolit sekunder dalam sel tanaman tersebut (Percival, 2001; Busam 1997).
B. Deskripsi dan Klasifikasi Ageratum conyzoides L
Ageratum conyzoides merupakan tumbuhan dari famili Asteraceae.
Memiliki habitus herba dengan tinggi 30 cm sampai 80 cm, duduk daun oposita dan memiliki trikoma glandular (Ming, 1999). Tumbuhan ini di berbagai daerah
di Indonesia memiliki nama yang berbeda antara lain di Jawa disebut bandotan. Di Indonesia, bandotan merupakan tumbuhan liar dan lebih dikenal sebagai tumbuhan pengganggu (gulma) di kebun dan di ladang. Tumbuhan ini, dapat ditemukan juga di pekarangan rumah, tepi jalan, tanggul, dan sekitar saluran air pada ketinggian 1 m sampai 2.100 m di atas permukaan laut (Sukamto, 2007). Meskipun dianggap gulma, tanaman ini juga sering digunakan sebagai obat tradisional oleh sebagian masyarakat Indonesia. Tanaman ini digunakan untuk mengobati berbagai jenis penyakit kulit, malaria, influenza, radang paru-paru dan tumor (Utami dan Robara 2008).
Klasifikasi Ageratum conyzoides L menurut Sukamto (2007) dan Ming (1999).
Daun Ageratum conyzoides L yang ada di kebun botani UPI memiliki kandungan kimia seperti beta-caryophyllene, precocone II (6,7-dimethoxy, 2,2-dimethyl Ageratochrome), phytol, dan flavoniod (Hardikasari, 2009). Diketahui bahwa metabolit sekunder yang berasal baik dari tanaman maupun hewan menunjukkan beragam aktivitas biologi. Begitu pula senyawa yang terkandung pada daun A. conyzoides, beberapa penelitian telah dilakukan, di antaranya
Gambar 2.1 Ageratum conyzoides
(Dokumentasi Pribadi) Divisio : Magnoliophyta Classis : Magnoliopsida Ordo : Asterales Famili : Asteraceae Genus : Ageratum
sebagai antifungi Candida albicans dan Trichophyton mentagrophytes (Hapsakti, 2009; Hardikasari, 2009). Ekstrak daun A. conyzoides juga digunakan sebagai antibakteri Staphylococcus aureus, Streptococcus pyogenes dan Pseudomonas
aeruginosa (Desiarianty, 2009; Pramitha, 2009; Rosantika, 2009). C. Kitin dan Kitinase
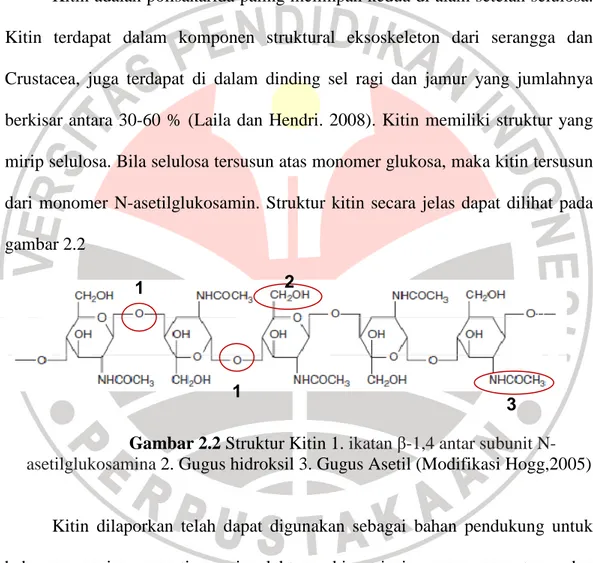
Kitin adalah polisakarida paling melimpah kedua di alam setelah selulosa. Kitin terdapat dalam komponen struktural eksoskeleton dari serangga dan Crustacea, juga terdapat di dalam dinding sel ragi dan jamur yang jumlahnya berkisar antara 30-60 % (Laila dan Hendri. 2008). Kitin memiliki struktur yang mirip selulosa. Bila selulosa tersusun atas monomer glukosa, maka kitin tersusun dari monomer N-asetilglukosamin. Struktur kitin secara jelas dapat dilihat pada gambar 2.2
Gambar 2.2 Struktur Kitin 1. ikatan β-1,4 antar subunit N-asetilglukosamina 2. Gugus hidroksil 3. Gugus Asetil (Modifikasi Hogg,2005)
Kitin dilaporkan telah dapat digunakan sebagai bahan pendukung untuk beberapa enzim, seperti papain, laktase, kimotripsin, asam pospatase, dan glukosa isomerase. Sebagai bahan pendukung enzim penggunaannya yang terbesar adalah pada industri makanan dan kosmetik (Laila dan Hendri, 2008). Kitin memiliki tingkat kelarutan yang sangat rendah dalam air, serta mengalami biodegradasi melalui beberapa mekanisme dengan melibatkan kompleks enzim. Salah satu enzim yang dapat mengurai kitin adalah kitinase.
1 2
3 1
Kitinase adalah enzim yang umum diproduksi sel bakteri, cendawan, hewan, dan tumbuhan (Pudjihartati, et al. 2006). Enzim kitinase yang dihasilkan tumbuhan dapat menghidrolisis ikatan β-1,4 antar subunit N-asetilglukosamina (NAcGlc) pada polimer kitin. Hidrolisis polimer kitin sebagai salah satu komponen dinding sel hifa cendawan dapat menghambat pertumbuhan hifa. Oleh sebab itu, kitinase dikenal sebagai salah satu protein anti cendawan (Wang et al. 2005 dalam Pudjihartati et al. 2006). Berdasarkan cara kerja hidrolisis, kitinase dikelompokkan menjadi tiga tipe utama, yaitu: (i) endokitinase, yang memotong secara acak polimer kitin secara internal sehingga menghasilkan oligomer pendek, (ii) eksokitinase (1,4-β-kitobiosidase), yang memotong unit trimer kitobiosa pada ujung terminal polimer kitin, dan (iii) N-asetilglukosamidase, yang memotong unit monomer pada ujung terminal polimer kitin (Brurberg et al. 1996 dalam Pudjihartati et al. 2006). Menurut Oku (1994) dalam Pudjihartati et al. (2006), peranan kitinase pada ketahanan tanaman terhadap serangan pathogen terjadi melalui dua cara, yaitu: (i) menghambat pertumbuhan cendawan dengan secara langsung menghidrolisis dinding miselia cendawan dan (ii) melalui pelepasan elisitor endogen oleh aktivitas kitinase yang kemudian memicu reaksi ketahanan sistemik (systemic acquired resistance/SAR) pada inang.
Menurut Angelova (2006), elisitor adalah senyawa-senyawa penginduksi ketahanan sistemik pada tanaman. Elisitor mampu menginduksi berbagai jenis ketahanan sistemik tanaman, diantaranya sintesis metabolit sekunder. Elisitor dapat dibedakan menjadi dua kelompok, yaitu elisitor biotik dan abiotik. Elisitor biotik ditemukan pada awal tahun 1970-an, sejak saat itu banyak publikasi yang menunjukan fakta bahwa derivat suatu senyawa yang dihasilkan oleh bakteri,
dapat menginduksi pertahanan sistemik pada tanaman. Elisitor biotik merupakan molekul-molekul yang berasal dari pathogen atau tanaman itu sendiri. Berdasarkan asal substansi pemicu ketahanan sistemik, elisitor biotik dapat dikelompokan kembali menjadi dua, yaitu elisitor eksogen (substansi pemicu berasal dari pathogen) dan elisitor endogen (substansi pemicu berasal dari tanaman). Beberapa molekul yang dapat menjadi elisitor, yaitu polisakarida, oligosakarida, protein, glikoprotein dan asam lemak.
D. Gen 16S rRNA
Sebuah ribosom prokariotik bila dilihat melalui mikroskop elektron, tersusun dari dua subunit, yaitu sub unit besar dan subunit kecil. Subunit ribosom dibangun oleh protein-protein dan molekul-molekul RNA, yang disebut RNA ribosom (rRNA, ribosomal RNA). Sekitar 60% dari berat suatu ribosom terdiri dari RNA (Campbell et al. 2000:327-328). Pada prokariot terdapat tiga jenis rRNAs, yaitu: 16S, 23S dan 5S (Olsen et al. 1986). Baik pada eukariota maupun prokariota, subunit besar dan kecil bergabung untuk membentuk ribosom fungsional hanya ketika kedua subunit tersebut terikat pada molekul mRNA (Campbell et al. 2000:328). Pengikatan ini terjadi pada 16S rRNA di bagian sub unit 30S (subunit kecil) pada ribosom prokariot, karena pada mRNA prokariot terdapat urutan basa tertentu yang disebut sebagai tempat pengikatan ribosom
(ribosom binding site) atau urutan Shine-Dalgarno (5’-AGGAGGU-3’), urutan ini
spesifik dikenali oleh 16S rRNA, dengan demikan dapat dikatakan bahwa, sikuen 16S rRNA berfungsi sebagai sikuen anti-Shine-Dalgarno (Korostelev et al. 2007; Moat et al.,2002). Gen 16S rRNA berukuran panjang antara 1500-1550 pb dan
kaya akan basa nitrogen guanin dan sitosin (Moat et al. 2002:56; Clarridge, 2004:842).
Pada gen 16S rRNA terdapat suatu daerah yang dinamakan daerah lestari
(conserved area) dan daerah variabel, sebagian atau seluruh urutan basa pada
daerah inilah yang akan menjadi urutan basa yang akan dikenali oleh primer gen
16S. Daerah lestari (conserved area) pada gen 16S rRNA umumnya memiliki
ukuran sekitar 540 pb (Clarridge, 2004:842). Hal ini yang menjadikan gen 16S
rRNA sebagai alat dalam metode identifikasi bakteri pada bidang molekuler. Gen 16S rRNA memiliki beberapa keunggulan yang memperkuat penggunaanya
sebagai alat identifikasi diantaranya, gen ini relatif konstan dan tidak berubah dalam jangka waktu yang sangat lama atau dengan kata lain laju mutasinya sangat kecil (Janda and Abbott, 2007:2761). Pada bidang molekuler terdapat beberapa jenis primer yang dihasilkan dari gen 16S rRNA, menurut Marchesi (1997), primer yang paling baik dan stabil adalah primer 63f dan 1387r.
E. PCR (Polymerse Chain Reaction)
Polymerase Chain Reaction merupakan suatu teknik atau metode
perbanyakan (replikasi) DNA secara enzimatik tanpa menggunakan organisme. Untuk lebih jelasnya dapat dilihat pada gambar 2.3. Menurut Paul (2007), PCR meliputi tiga tahapan dalam satu siklus, yaitu:
1. Tahap Denaturasi
Tahap ini berlangsung pada suhu tinggi, antara 92-96oC.Hal ini dimaksudkan untuk memisahkan double-strand DNA, menjadi rantai utas tunggal. Pemisahan ini diakibatkan oleh suhu tinggi, yang memicu putusnya ikatan hydrogen pada DNA. Setelah DNA menjadi rantai utas tunggal, maka
DNA siap menjadi template (“cetakan”) bagi primer (rantai pendek nukleotida atau yang biasa disebut oligonukleotida yang urutan basa nitrogennya telah diketahui).
2. Tahap annealing
Pada tahap ini primer menempel pada bagian DNA template yang komplementer urutan basa nitrogennya. Ini dilakukan pada suhu antara 42– 65°C. Penempelan ini bersifat spesifik. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan primer pada DNA target atau primer menempel di sembarang tempat. Lamanya waktu yang digunakan pada tahap ini biasanya tergantung kepada primer yang digunakan.
3. Tahap elongasi (pemanjangan)
Suhu untuk proses ini tergantung dari jenis DNA-polimerase yang digunakan pada reaksi. Secara universal, biasanya enzim yang digunakan adalah Taqpolimerase yang diisolasi dari bakteri Thermus aquaticus. Enzim ini relative stabil bekerja pada suhu tinggi dan tidak terdenaturasi lebih cepat. Proses ini biasanya dilakukan pada suhu 72° C.
Gambar 2.3 Bagan Proses dalam mesin PCR (Paul, 2007:105)
Ketiga proses di atas diulang-ulang antara 25–30 kali. Akibat proses diatas pula dihasilkan rantai DNA baru yang akan dijadikan template badi primer lain. Karena hal ini berlangsung secara berulang dan terus menerus, maka dihasilkanlah DNA yang berlimpah sesuai dengan jumlah primer. Pada akhirnya akan dihasilkan amplikon, yaitu produk PCR, yang selanjutnya dapat digunakan untuk berbagai keperluan dalam bidang molekuler.
F. Elektroforesis
Produk PCR (amplikon) dapat divisulisasikan melalui metode elektroforesis atau “running”. Prinsip dasar teknik elektroforesis adalah pemisahan molekul bermuatan oleh medan listrik. Dalam proses ini molekul-molekul tersebut dipisahkan berdasarkan laju perpindahannya oleh gaya gerak listrik di dalam matriks gel. Medium (matriks gel) elektroforesis yang paling umum digunakan adalah agarosa. Gambar 2.4 akan memperjelas tentang agarosa dan single bands amplikon setelah selesai proses elektroforesis. Konsentrasi agarosa yang digunakan sesuai dengan asam nukleat yang diidentifikasi yaitu antara 0,1-70 kb. Dalam proses elektroforesis, sampel molekul ditempatkan ke dalam sumur (well) pada gel yang ditempatkan di dalam larutan penyangga, dan listrik dialirkan kepadanya.
Gambar 2.4 Agarosa dan single bands amplikon setelah selesai proses
elektroforesis ( Modifikasi Tortora et al., 2010)
Karena asam nukleat bermuatan negatif dan akan berjalan menuju kutub positif, maka well (sumur) agarosa pada alat elektroforesis diletakan dikutub negatif. Kecepatan migrasi molekul polar (bermuatan) bervariasi tergantung rasio massa dengan muatan, ukuran molekul, berat molekul dan konformasi molekul itu sendiri. Hasil elektroforesis dapat dilihat satelah diwarnai, dan dilihat dengan bantuan cahaya UV. Pewarna etidium bromida dapat dicampurkan langsung dalam gel, gel buffer ataupun setelah elektroforesis berakhir. Etidium bromida akan berinteraksi dengan basa dari molekul DNA dan akan memberikan warna “orange fluoresance” (berpendar) dibawah lampu Ultra Violet (UV).
G. Sikuensing DNA
Salah satu metode identifikasi organisme adalah sikuensing. Pada prinsipnya sikuensing adalah metode yang digunakan untuk mendapatkan urutan basa DNA suatu organisme dengan menggunakan mesin sequencer. Metode ini mengalami perkembangan yang progresif setelah Sanger menemukan metode sikuensing yang baru pada tahun 1977. Sanger memanfaatkan dua sifat salah satu subunit enzim DNA polimerase yang disebut fragmen klenow. Kedua sifat
Single band Single band ( - )
( + )
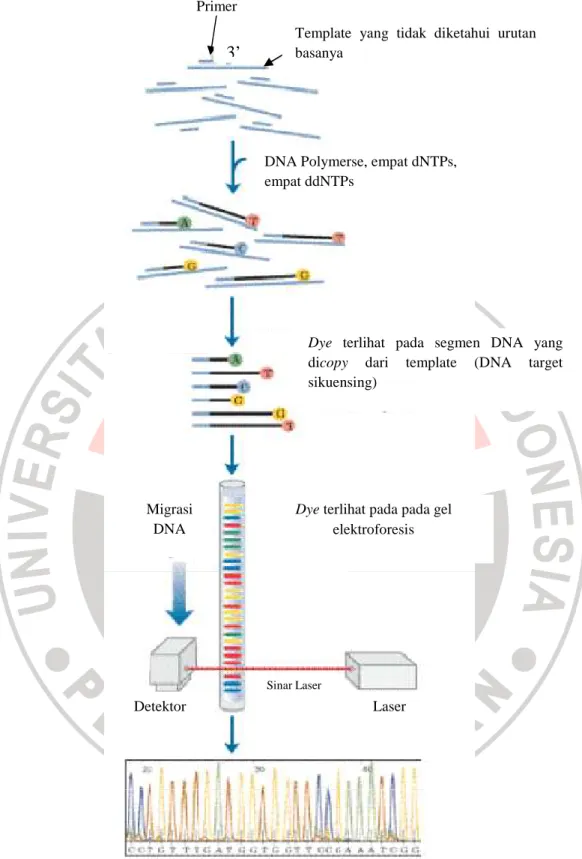
tersebut adalah kemampuannya untuk mensintesis DNA dengan adanya dNTP dan ketidakmampuannya untuk membedakan dNTP dengan ddNTP. Jika molekul dNTP hanya kehilangan gugus hidroksil (OH) pada atom C nomor 2 gula pentosa, molekul ddNTP atau dideoksi nukleotida juga mengalami kehilangan gugus OH pada atom C nomor 3 sehingga tidak dapat membentuk ikatan fosfodiester (Paul., 2007:102; Moat et al., 2002:172-173). Gambaran umum proses sikuensing dapat dilihat pada gambar 2.5.
Gambar 2.5 Sebuah DNA template ditambahkan primer, DNA polymerase, deoxynucleotides dan dideoxynucleotides. Molekul ddNTPs dilabeli dengan
pewarna (dye) yang akan berfluoresensi. Panjang gelombang saat fluroresensi ditangkap oleh detektor dan diterjemahkan oleh computer dalam bentuk grafik (Modifikasi Lehninger, 1997; Moat et al., 2002:172-173).
3’
Template yang tidak diketahui urutan basanya
DNA Polymerse, empat dNTPs, empat ddNTPs
Dye terlihat pada segmen DNA yang dicopy dari template (DNA target sikuensing)
Dye terlihat pada pada gel elektroforesis Migrasi
DNA
Detektor Laser
Hasil pembacaan komputer Sinar Laser
Saat produk sikuensing diseparasikan pada matriks gel, sinar laser ion argon akan menyebabkan eksitasi elektron pada molekul DNA hasil sikuensing yang ujungnya mengandung molekul dideoxynucleotide terminator dye. Hal ini menyebabkan molekul DNA yang ukurannya berbeda-beda akan berfluororesensi. Panjang gelombang yang dihasilkan saat fluroresensi inilah yang akan ditangkap oleh detektor dan diterjemahkan menjadi urutan nukleotida dari gen yang disikuensing. Secara otomatis komputer akan memproses data dari detektor dan hasil sikuen akan muncul dalam bentuk grafik pembacaan sikuen yang dapat dicetak dan lebih memudahkan proses sikuensing DNA.
H. Bioinformatika
Bioinformatika merupakan kajian yang memadukan disiplin biologi molekul, matematika dan teknik informasi (TI). Ilmu ini didefinisikan sebagai aplikasi dari alat komputasi dan analisa untuk menangkap dan menginterpretasikan data-data biologi molekul. Biologi molekul sendiri juga merupakan bidang interdisipliner, mempelajari kehidupan dalam level molekul. Kajian baru Bioinformatika ini tak lepas dari perkembangan biologi molekul modern yang ditandai dengan kemampuan manusia untuk memahami genom, yaitu cetak biru informasi genetik yang menentukan sifat setiap makhluk hidup yang disandi dalam bentuk pita molekul DNA (asam deoksiribonukleat). Kemampuan untuk memahami dan memanipulasi kode genetik DNA ini sangat didukung oleh TI melalui perangkat perangkat keras maupun lunak. Hal ini bisa dilihat pada upaya Celera Genomics, perusahaan bioteknologi Amerika Serikat yang melakukan pembacaan sekuen genom manusia yang secara maksimal memanfaatkan TI sehingga bisa melakukan pekerjaannya dalam waktu yang
singkat (hanya beberapa tahun), dibanding usaha konsorsium lembaga riset publik AS, Eropa, dan lain-lain, yang memakan waktu lebih dari 10 tahun (Aprijani and Elfaizi, 2004)
Bioinformatika yang digunakan pada penelitian ini berkaitan dengan analisis filogenetik. Teknologi ini merupakan salah satu tahapan yang digunakan untuk mengetahui informasi yang kita butuhkan tentang spasies bakteri yang kita analisis. Sekuen dianalisis dengan cara mencari homologi atau membandingkan (pensejajaran) hasil sekuen yang kita miliki dengan yang terdapat di “GenBank”. Homologi dicari dengan menggunakan teknik BLAST pada server National Center for Biotechnology Information atau server lain sebagai “GenBank”. Beberapa server yang menyimpan database mengenai data biologi molekuler, diantaranya adalah GenBank NCBI (National Center for Biotechnology
Information) (http://www.ncbi.nlm.nih.gov/Web/Genbank/index/htm), European Molecular Biology Laoratory Nucleotide Sequence
(http://www.ebi.ac.uk/ebi_docs/embl_db.html), Ribosomal Database Project-II (http://www.rdp.cme.msu.edu/) (Moat et al., 2002; Cole., 2005; Clarridge, 2004; Aprijani and Elfaizi, 2004).