KARAKTERISASI SELULASE BAKTERI
ASAL TANAH PERTANIAN JAWA TENGAH DAN JAWA
BARAT
Oleh:
WAHYU WIDO SARI
G 34103024
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
WAHYU WIDO SARI. Karakterisasi Selulase Bakteri Asal Tanah Pertanian Jawa Tengah dan Jawa Barat. Dibimbing oleh ANJA MERYANDINI dan NISA RACHMANIA MUBARIK.
Selulosa merupakan komponen terbesar pada tanaman. Enzim selulase memiliki potensi yang besar dalam pengolahan limbah pertanian. Enam isolat bakteri selulolitik asal tanah pertanian Jawa Tengah dan Jawa Barat telah dikarakterisasi meliputi suhu dan pH optimum serta substrat yang sesuai. Isolat C4-4 memiliki pH optimum 5, suhu optimum 70 °C, dan avisel sebagai substrat yang sesuai. Isolat C5-1 memiliki pH optimum 3.5, suhu optimum 90 °C, dan karboksimetil selulosa (CMC) sebagai substrat yang sesuai. Isolat C5-3 memiliki pH optimum 5, suhu optimum 80 °C, dan filter paper sebagai substrat yang sesuai. Isolat C11-1 memiliki pH optimum 8, suhu optimum 70 °C, dan CMC sebagai substrat yang sesuai. Isolat KBM 2 memiliki dua waktu produksi enzim tertinggi yaitu pada umur kultur 3 hari dan 6 hari, memiliki pH optimum 7 dan suhu optimum 50 °C pada umur kultur 3 hari, memiliki pH optimum 5 dan suhu optimum 30 °C pada umur kultur 6 hari. Substrat yang sesuai untuk KBM 2 ialah CMC. Isolat KBM 4 memiliki pH optimum 7, suhu optimum 50 °C, dan CMC sebagai substrat yang sesuai.
ABSTRACT
WAHYU WIDO SARI. Characterization of Bacterial Cellulase from Central Java and West Java Agricultural Soil. Under direction of ANJA MERYANDINI and NISA RACHMANIA MUBARIK.
Cellulose is the major component of plant. Cellulase is an enzyme with great potential to reduce agricultural waste. Six of cellulolitic isolates from Central and West Java had been characterized. The characterization consists of optimum pH and temperature, and also the appropriate substrate. C4-4 showed optimum activity at pH 5, 70 °C, and avicel as its appropriate substrate. C5-1 had an optimum activity at pH 3.5, 90 °C, and carboxymethyl cellulose (CMC) as its appropriate substrate. C5-3 had an optimum activity at pH 5, 80 °C, and filter paper as its appropriate substrate. C11-1 had an optimum activity at pH 8, 70 °C, and CMC as its appropriate substrate. KBM 2 had two enzyme production peaks, in 3rd day and 6th day after incubation. These enzymes showed different character in optimum pH. In the 3rd day the enzyme display optimum pH at 7 whereas in the 6th day at 5. It showed also differences in optimum temperature. In the 3rd day it display optimum temperature at 50 °C whereas in the 6th day 30 °C. It had CMC as its appropriate substrate. KBM 4 had an optimum activity at pH 7, 50 °C, and CMC as its appropriate substrate.
KARAKTERISASI SELULASE BAKTERI
ASAL TANAH PERTANIAN JAWA TENGAH DAN JAWA
BARAT
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
Oleh:
WAHYU WIDO SARI
G 34103024
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi: Karakterisasi Selulase Bakteri Asal Tanah Pertanian Jawa Tengah
dan
Jawa
Barat
Nama : Wahyu Wido Sari
NIM : G 34103024
Menyetujui
Pembimbing I Pembimbing II
Dr. Anja Meryandini, M.S. Dr. Nisa Rachmania Mubarik, M. Si.
NIP. 131663016 NIP. 132045531
Mengetahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP. 131578806
PRAKATA
Puji Syukur penulis panjatkan kepada Allah atas segala rahmat, anugerah, dan karunia selama penulis melaksanakan penelitian hingga selesainya penulisan skripsi ini. Skripsi ini merupakan salah satu syarat memperoleh gelar Sarjana Sains pada Departemen Biologi.
Penelitian ini dilaksanakan mulai bulan Februari hingga Agustus 2007 bertempat di Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB dan Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, IPB. Topik penelitian ini berjudul “Karakterisasi Selulase Bakteri Asal Tanah Pertanian Jawa Tengah dan Jawa Barat”.
Penulis ingin menyampaikan ucapan terima kasih yang mendalam kepada Dr. Anja Meryandini, M. S dan Dr. Nisa Rachmania Mubarik, M. Si selaku pembimbing atas dana penelitian, bimbingan, arahan, kesabaran, teladan, serta nasihat yang diberikan kepada penulis selama penelitian hingga penulisan skripsi ini. Terima kasih kepada Ir. Tri Heru Widarto, MSc selaku Wakil Komisi Pendidikan yang telah bersedia menguji dan memberi banyak masukan kepada penulis. Tidak lupa penulis mengucapkan terima kasih kepada teknisi Laboratorium Mikrobiologi; Mba Henny, Pak Endang, Pak Jaka, Pak Husein, dan Bu Kokoy, teknisi Laboratorium Bioteknologi dan Biomedis; Mba Dewi, dan pegawai Departemen Biologi; Pak Joni dan Mba Yuni atas segala bantuannya.
Terima kasih juga penulis sampaikan kepada teman dan saudara seperjuangan Tri, Besty, Mba Niken, Mas Hasrul, dan Bu It yang telah banyak memberi bantuan dan masukan selama ini, sahabat terbaik penulis; Sari, Rut, Dona, P. Dian, teman-teman di kos TM 3, Claudio, Anton, Renta, rekan-rekan pendamping, dan rekan-rekan biologi angkatan 40 yang tidak dapat disebutkan satu persatu, atas dukungan, persaudaraan, kasih sayang, dan persahabatan selama ini.
Penulis menyampaikan terima kasih terdalam kepada Bapak, Ibu, Nenek, dan kakak-kakak, serta Manto untuk doa, dukungan, cinta, pengertian, dan kasih sayang tanpa syarat kepada penulis.
Akhir kata, semoga tulisan ini memberikan manfaat bagi pihak yang membutuhkan.
Bogor, Januari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 23 Mei 1985. Penulis merupakan anak bungsu dari delapan bersaudara dari Bapak Sagi dan Ibu Sri Wanulyo. Tahun 2003 penulis lulus dari SMU Negeri I Klaten dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI) pada tahun yang sama. Selama perkuliahan penulis pernah menjadi asisten Mikrobiologi Dasar ( semester ganjil 2006/2007, semester genap 2006/2007, dan pada Program Matrikulasi Pasca sarjana BUD MAN 2007, semester ganjil 2007/2008) dan Fisiologi Prokariot (2007/2008). Penulis melaksanakan Praktik Lapang di bidang Quality Control di Perusahaan AMDK SBQUA Bogor. Selain itu selama kuliah penulis mendapatkan beasiswa prestasi Student Equity dan pernah meraih juara II Debat Bahasa Inggris dalam rangka HUT Bogor ke-525. Penulis aktif di kegiatan kerohanian di kampus yaitu menjadi anggota tim pendamping agama Katolik IPB.
DAFTAR ISI Halaman DAFTAR TABEL ... vi DAFTAR GAMBAR ... vi DAFTAR LAMPIRAN ... vi PENDAHULUAN Latar Belakang ... 1 Tujuan ... 1
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 1
Bahan dan Alat ... 1
Metode Penelitian ... 1
Peremajaan Isolat ... 1
Pembuatan Kurva Tumbuh dan Aktivitas Selulase Harian ... 2
Karakterisasi Selulase ... 2
HASIL Peremajaan Isolat ... 2
Pembuatan Kurva Tumbuh dan Aktivitas Selulase Harian ... 2
Karakterisasi Selulase ... 3 PEMBAHASAN ... 5 SIMPULAN ... 7 SARAN ... 7 DAFTAR PUSTAKA ... 7 LAMPIRAN ... 9
vi
DAFTAR TABEL
Halaman
1 Pertumbuhan isolat C4-4, C5-1, C5-3, dan C11-1 ... 3
2 Aktivitas selulase harian yang diuji pada 0.2 M bufer fosfat pH 7 dan suhu inkubasi 50 °C ... 3
3 Aktivitas spesifik selulase harian yang diuji pada 0.2 M bufer fosfat pH 7 dan suhu inkubasi 50 °C ... 4
4 Aktivitas selulase masing-masing isolat yang diuji pada berbagai pH (konsentrasi bufer 0.2 M) ... 4
5 Aktivitas spesifik selulase masing-masing isolat yang diuji pada berbagai pH (konsentrasi bufer 0.2 M) ... 4
6 Aktivitas selulase masing-masing isolat yang diuji pada pH optimumnya dan diinkubasi pada berbagai suhu ... 4
7 Aktivitas spesifik selulase masing-masing isolat yang diuji pada pH optimumnya dan diinkubasi pada berbagai suhu ... 5
8 Aktivitas selulase masing-masing isolat yang diuji pada berbagai substrat (CMC, Avisel, Whatmann Filter Paper) pada hari, pH, dan suhu optimum produksi ... 5
9 Aktivitas spesifik masing-masing isolat yang diuji pada berbagai substrat (CMC, Avisel, Whatmann Filter Paper) pada hari, pH, dan suhu optimum produksi ... 5
DAFTAR GAMBAR Halaman 1 Koloni isolat KBM 2 dan KBM 4 pada media agar-agar CMC setelah diinkubasi selama 4 hari ... 2
2 Kemampuan selulolitik isolat C4-4, C5-1, C5-3, dan C11-1 pada media agar-agar CMC setelah inkubasi 24 jam ... 2
DAFTAR LAMPIRAN Halaman 1 Situs pemotongan selulosa menjadi monomernya ... 9
2 Data isolat yang digunakan dalam penelitian ini ... 9
3 Penentuan aktivitas selulase (Miller 1959) ... 10
4 Komposisi reagen asam dinitro salisilat ... 10
1
PENDAHULUAN Latar Belakang
Peningkatan produk pertanian menyebabkan tingginya hasil limbah pertanian seperti jerami, tongkol jagung, batang kedelai, kulit pisang, dan kulit cokelat. Limbah tersebut memiliki komponen utama lignoselulosa sehingga sukar didegradasi. Lignoselulosa terdiri atas tiga polimer yaitu selulosa, hemiselulosa, dan lignin (Perez et al. 2002). Selulosa adalah polimer glukosa dengan ikatan β-1,4-glikosidik dan merupakan limbah organik yang paling melimpah di alam dan didegradasi dalam kurun waktu yang lama (Kim et al. 2004).
Penanganan limbah pertanian secara biologi dapat dilakukan dengan menggunakan enzim misalnya selulase. Selulase merupakan enzim ekstraseluler yang terdiri atas kompleks
endo-β-1,4-glukonase (endoselulase, carboxymethyl cellulase atau CMCase, Cx
selulase), kompleks ekso-β-1,4-glukonase (selobiohidrolase, aviselase, C1 selulase), dan β-1,4-glukosidase atau selobiase (Crueger & Crueger 1984). Selulase akan memecah polimer selulosa menjadi monomer-monomernya (Madigan et al. 2000) (Lampiran 1).
Teknologi pemanfaatan enzim mendapat prioritas untuk dikembangkan di Indonesia karena banyaknya limbah berserat hasil pertanian yang dapat digunakan sebagai media tumbuh mikroorganisme (Montesqrit 1998). Karakterisasi enzim perlu dilakukan karena penanganan masalah yang menggunakan enzim membutuhkan enzim dengan karakter tertentu. Karakter utama yang perlu diketahui ialah suhu dan pH optimum serta jenis substrat yang sesuai.
Tanah merupakan habitat yang didominasi oleh mikroorganisme seperti bakteri, fungi, alga, dan protozoa. Kualitas dan kuantitas mikroorganisme tersebut mempengaruhi kesuburan tanah, karena beberapa mikrob berperan sebagai dekomposer (Rao 1995). Beberapa dekomposer seperti bakteri dan cendawan mampu menghasilkan selulase.
Penelitian mengenai potensi bakteri selulolitik dan kondisi optimum untuk pertumbuhan dan aktivitas enzimnya sangat penting dilakukan, karena mikroorganisme penghasil selulase menawarkan potensi yang besar di bidang penanganan limbah selulosa (Alam et al. 2004). Penelitian terdahulu berhasil mendapatkan bakteri selulolitik yang unik. Isolat tersebut dapat hidup dan memiliki aktivitas selulolitik pada suhu 50 ˚C sehingga
dapat dikategorikan sebagai termozim. Bakteri tersebut memiliki potensi untuk pengomposan dan penanganan limbah pertanian.
Penelitian ini menggunakan enam isolat bakteri selulolitik hasil penelitian terdahulu yang memiliki aktivitas selulase pada suhu 50 ˚C asal Jawa Tengah dan Jawa Barat. Isolat tersebut ialah C4-4, C5-1, C5-3, C11-1, KBM 2 dan KBM 4.
Tujuan
Tujuan penelitian ini ialah melakukan karakterisasi selulase dari bakteri selulolitik asal Jawa Tengah dan Jawa Barat, yang meliputi pH dan suhu optimum serta substrat yang sesuai.
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Februari hingga Agustus 2007 di Laboratorium Mikrobiologi FMIPA, IPB dan Laboratorium Bioteknologi Hewan dan Biomedis Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, IPB.
Bahan dan Alat
Bahan yang digunakan ialah empat isolat bakteri selulolitik dan dua aktinomiset selulolitik yang berasal dari tanah pertanian Jawa Tengah dan Jawa Barat koleksi Dr. Anja Meryandini. Empat isolat bakteri tersebut yaitu C4-4, C5-1, C5-3, dan C4-4. Aktinomiset yang digunakan yaitu KBM 2 dan KBM 4 (Lampiran 2). Substrat carboxy methyl cellulose (Sigma, St. Louis), avisel (Sigma, St. Louis) dan Whatmann Filter Paper no. 1.
Alat-alat yang digunakan meliputi spektrofotometer, pH meter, inkubator bergoyang, sentrifusa, penangas air, dan peralatan laboratorium lainnya.
Metode Penelitian Peremajaan Isolat
Isolat koleksi tersebut diremajakan pada media agar-agar CMC 1% (1 g CMC, 0.02 g MgSO4.7H2O, 0.075 g KNO3, 0.05 g K2HPO4, 0.002 g FeSO4.7H2O, 0.004 g CaCl2.2H2O, 0.2 g ekstrak khamir, 1.5 g agar-agar bakto, dan 0.1 g glukosa dalam 100 ml media) dan diinkubasi pada suhu ruang selama 24-48 jam untuk bakteri dan 4 hari untuk aktinomiset. Hasil peremajaan tersebut digunakan untuk penentuan kurva tumbuh dan kurva aktivitas selulase.
2
Pembuatan Kurva Tumbuh dan Kurva Aktivitas Selulase
Bakteri yang sudah diremajakan diinokulasikan sebanyak dua lup penuh atau 5 cock bor untuk aktinomiset ke dalam 100 ml media CMC 1 % cair dan diinkubasi dalam inkubator bergoyang. Setiap 24 jam sekali dilakukan pengukuran kekeruhan sel dan aktivitas selulase.
Enzim selulase ekstrak kasar didapat dengan mensentrifugasi hasil kultur pada kecepatan 8400 g selama 10 menit pada suhu 4 ˚C. Aktivitas selulase diukur menggunakan metode Miller (1959) (Lampiran 3) dengan cara menambahkan enzim ekstrak kasar sebanyak 1 ml dalam substrat CMC 1 % pada bufer fosfat 0.2 M pH 7, diinkubasi pada suhu 50 ˚C selama 60 menit. Reaksi dihentikan dengan menambahkan 2 ml asam dinitro salisilat (DNS, Lampiran 4) dan dididihkan selama 15 menit, kemudian didinginkan sampai suhu ruang dan diukur pada panjang gelombang 540 nm. Jumlah gula yang diproduksi ditentukan dengan standar glukosa. Satu unit aktivitas selulase didefinisikan sebagai jumlah enzim yang menghasilkan 1 μmol glukosa dalam satu menit. Satu unit aktivitas setara dengan 16.67 nkat. Dengan demikian satu katal (kat) merupakan jumlah enzim yang menghasilkan 1 μmol glukosa dalam 1 detik.
Kadar protein diukur menggunakan metode Bradford (1976), dengan cara mencampurkan 400 μl enzim ekstrak kasar dengan 4 ml reagen Bradford, dikocok kuat-kuat, diinkubasi selama 15 menit, kemudian diukur absorbansinya pada panjang gelombang 595 nm. Standar protein yang digunakan ialah bovin serum albumin (BSA).
Aktivitas spesifik enzim dihitung dari nilai aktivitas selulase dibagi dengan kadar proteinnya.
Karakterisasi Selulase
Karakterisasi enzim selulase meliputi penentuan pH dan suhu optimum serta substrat yang sesuai.
Penentuan pH optimum dilakukan dengan cara menguji aktivitas selulase pada substrat CMC 1 % dalam berbagai pH (pH 3 sampai dengan pH 9 dengan selang 0.5 unit) menggunakan bufer sitrat fosfat 0.2 M (pH 3-5,5), bufer fosfat 0.2 M (pH 6-8) dan bufer tris-HCl 0.2 M (pH 8-9). Komposisi bufer dapat dilihat pada lampiran 2.
Penentuan suhu optimum dilakukan dengan cara menguji aktivitas selulase pada berbagai suhu (30 ˚C sampai dengan 90 ˚C
dengan selang 10 ˚C) dalam substrat CMC 1 % dalam bufer pH optimum dan inkubasi selama 30 menit.
Penentuan susbtrat yang paling sesuai dilakukan dengan cara menguji aktivitas selulase pada berbagai substrat (CMC, avisel, Whatmann filter paper no.1) dalam bufer dengan pH optimum dan diinkubasi pada suhu optimum.
HASIL Peremajaan Isolat
Keenam isolat bakteri yaitu C4-4, C5-1, C5-3, C11-1, KBM 2 dan KBM 4 yang ditumbuhkan pada media agar-agar CMC masing-masing memiliki ciri koloni yang berbeda. KBM 2 dan KBM 4 merupakan aktinomiset, memperlihatkan warna spora yang berbeda dan KBM 2 menghasilkan pigmen terdifusi berwarna kuning kecoklatan (Gambar 1).
KBM 2 KBM 4
Gambar 1 Koloni isolat KBM 2 dan KBM 4 pada media agar-agar CMC setelah diinkubasi selama 4 hari.
Isolat-isolat selulolitik memperlihatkan kemampuan menghasilkan selulase dengan terbentuknya zona bening di sekitar koloni pada media CMC dengan pewarnaan merah kongo 0.1 % (Gambar 2).
Gambar 2 Kemampuan selulolitik isolat C4-4, C5-1, C5-3, dan C11-1 pada media agar-agar CMC setelah inkubasi 24 jam.
Pembuatan Kurva Tumbuh dan Aktivitas Selulase Harian
Pertumbuhan isolat bakteri selulolitik ditunjukkan dengan adanya perubahan jumlah sel (Tabel 1). Dari pengukuran tersebut didapatkan puncak pertumbuhan isolat C4-4 pada hari ke-5, C5-1 pada hari ke-6, C5-3 pada hari ke-6, dan C11-1 pada hari ke-3. Isolat KBM 2 dan KBM 4 merupakan bakteri berfilamen, kurva pertumbuhan untuk isolat
3
ini tidak dapat dibuat dengan cara mengukur kepekatan sel.
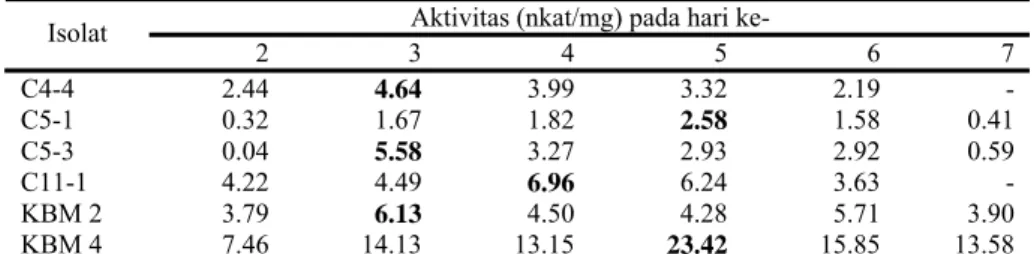
Produksi selulase ekstraseluler tertinggi masing-masing isolat tercapai pada hari ke-3 dengan aktivitas 0.534 nkat/ml (C4-4), hari ke-5 dengan aktivitas 1.818 nkat/ml (C5-1), hari ke-4 dengan aktivitas 0.179 nkat/ml (C5-3), pada hari ke-4 dengan aktivitas 0.639 nkat/ml (C11-1), hari ke-3 dan ke-6 dengan aktivitas 0.738 nkat/ml dan 0.669 nkat/ml (KBM 2), dan hari ke-5 dengan aktivitas 1.447 nkat/ml (KBM 4) (Tabel 2).
Masing-masing isolat memiliki aktivitas spesifik harian tertinggi sebesar 4.64 nkat/mg (C4-4), 2.58 nkat/mg (C5-1), 5.58 nkat/mg (C5-3), 6.96 nkat/mg (C11-1), 6.13 dan 5.71 nkat/mg (KBM 2), dan 23.42 nkat/mg (KBM 4) (Tabel 3).
Karakterisasi Selulase
Pengaruh pH pada keenam isolat diuji pada masing-masing hari aktivitas tertingginya. Isolat C4-4 mencapai aktivitas tertinggi pada pH 5 (0.542 nkat/ml), isolat C5-1 pada pH 3.5 (0.C5-146 nkat/ml), isolat C5-3 pada pH 5 (0.282 nkat/ml), isolat C11-1 pada pH 8 (0.401 nkat/ml dengan bufer fosfat dan 0.596 nkat/ml dengan bufer tris-HCl), isolat KBM 2 pada pH 7 dan pH 5 (0.628 nkat/ml dan 0.490 nkat/ml), dan KBM 4 pada pH 7 (0.783 nkat/ml).
Aktivitas spesifik tertinggi pada pH optimum ialah 3.95 nkat/mg (C4-4), 3.74 nkat/mg (C5-1), 7.84 nkat/mg (C5-3), 3.01 dan 4.44 nkat/mg dengan bufer fosfat dan bufer tris-HCl (C11-1), 4.36 nkat/mg dan
3.15 nkat/mg pada (KBM 2), dan7.65 nkat/mg (KBM 4).
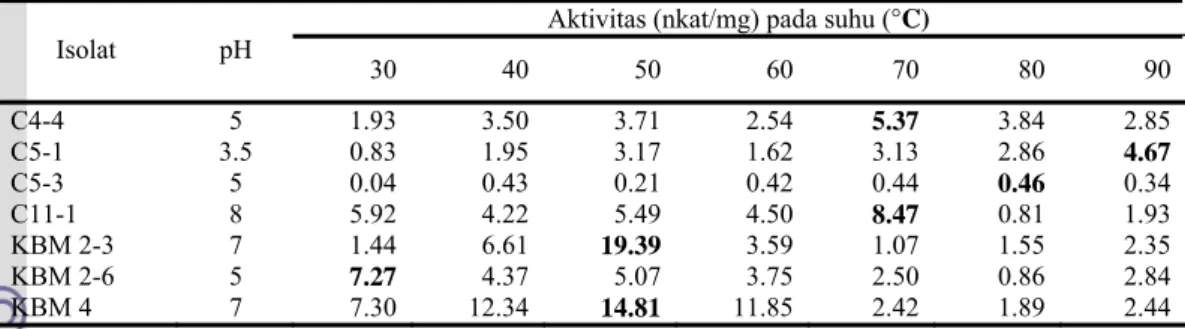
Pengaruh suhu terhadap aktivitas enzim pada pH optimum dilakukan dengan mengujinya pada berbagai suhu (30 ºC sampai 90 ºC dengan selang 10 ºC). Isolat C4-4 mencapai aktivitas tertinggi pada suhu 70 ºC dengan aktivitas 0.663 nkat/ml, isolat C5-1 pada suhu 90 ºC (0.426 nkat/ml), isolat C5-3 pada suhu 80 ºC (0.023 nkat/ml), isolat C11-1 pada suhu 70 ºC (1.067 nkat/ml), isolat KBM 2 pada 50 ºC dan 30 ºC (1.460 nkat/ml dan 0.987 nkat/ml), dan isolat KBM 4 pada 50 ºC (1.592 nkat/ml).
Aktivitas spesifik selulasenya pada pH dan suhu optimumnya adalah 5.37 nkat/mg (C4-4), 4.67 nkat/mg (C5-1), 0.46 nkat/mg (C5-3), 8.47 nkat/mg (C11-1), 19.39 nkat/mg dan 7.26 nkat/ml (KBM 2), 14.81 nkat/ml (KBM 4).
Substrat yang sesuai untuk masing-masing isolat adalah avisel dengan aktivitas 0.470 nkat/ml (C4-4), CMC dengan aktivitas 0.731 nkat/ml (C5-1), Whatmann filter paper dengan aktivitas 0.025 nkat/ml (C5-3), CMC dengan aktivitas 0.428 nkat/ml (C11-1), CMC dengan aktivitas 1.075 nkat/ml dan 0.675 nkat/ml (KBM 2), dan CMC dengan aktivitas 1.220 nkat/ml (KBM 4).
Aktivitas spesifik selulase pada berbagai substrat masing-masing isolat ialah 3.60 nkat/mg (C4-4), 8.085 nkat/mg (C5-1), 0.505 nkat/mg (C5-3), 3.41 nkat/mg (C11-1), 7.79 nkat/mg dan 4.57 nkat/mg (KBM 2), dan 11.35 nkat/mg (KBM4).
Tabel 1 Pertumbuhan isolat C4-4, C5-1, C5-3 dan C11-1 sampai 7 hari inkubasi Jumlah sel pada hari ke-
( x 108) Isolat 2 3 4 5 6 7 C4-4 C5-1 C5-3 C11-1 3.35 0.51 5.18 2.82 3.95 0.54 5.47 3.51 4.18 0.57 4.96 3.51 4.51 0.59 4.91 2.59 4.28 0.61 5.40 3.34 < 30 0.57 5.11 < 30 < 30: tidak memenuhi rentang statistik penghitungan koloni (30-300)
Tabel 2 Aktivitas selulase harian yang diuji pada 0.2 M bufer fosfat pH 7 dan suhu inkubasi 50 ºC
Aktivitas (nkat/ml) pada hari ke-Isolat 2 3 4 5 6 7 C4-4 C5-1 C5-3 C11-1 KBM 2 KBM 4 0.270 0.016 0.005 0.444 0.495 0.660 0.534 0.088 0.152 0.424 0.738 1.023 0.512 0.096 0.179 0.639 0.546 0.913 0.410 0.116 0.122 0.509 0.509 1.447 0.189 0.079 0.109 0.281 0.669 0.979 - 0.019 0.021 - 0.457 0.846 ( - ): tidak dilakukan pengukuran
4
Tabel 3 Aktivitas spesifik selulase harian yang diuji pada 0.2 M bufer fosfat pH 7 dan suhu inkubasi 50 ºC
Aktivitas (nkat/mg) pada hari ke-Isolat 2 3 4 5 6 7 C4-4 C5-1 C5-3 C11-1 KBM 2 KBM 4 2.44 0.32 0.04 4.22 3.79 7.46 4.64 1.67 5.58 4.49 6.13 14.13 3.99 1.82 3.27 6.96 4.50 13.15 3.32 2.58 2.93 6.24 4.28 23.42 2.19 1.58 2.92 3.63 5.71 15.85 - 0.41 0.59 - 3.90 13.58 Tabel 4 Aktivitas selulase masing-masing isolat yang diuji pada berbagai pH (konsentrasi bufer
0.2 M)
Aktivitas (nkat/ml) pada isolat KBM 2 pH C4-4 C5-1 C5-3 C11-1 H 3* H 6* KBM 4 Bufer sitrat fosfat 3 3.5 4 4.5 5 5.5 0 0 0 0.306 0.542 0.348 0.045 0.146 0 0.071 0.071 0.084 0.005 0 0.190 0.122 0.282 0.105 0.009 0.058 0.068 0.245 0.225 0.143 0.588 0 0 0.070 0.303 0.417 0.109 0 0 0.214 0.490 0.427 0.098 0 0.141 0.275 0.669 0.239 Bufer fosfat 6 6.5 7 7.5 8 0.214 0.385 0.349 0.336 0.251 0.064 0.002 0.053 0.038 0.094 0.107 0.047 0.078 0.034 0.047 0.090 0.198 0.132 0.228 0.401 0 0.035 0.628 0.256 0.129 0 0.203 0.385 0.260 0.391 0.135 0.507 0.783 0.371 0.357 Bufer Tris-HCl 8 8.5 9 0.596 0.226 0.087
• hari optimum produksi
Tabel 5 Aktivitas spesifik selulase pada berbagai pH (konsentrasi bufer 0.2 M) Aktivitas (nkat/mg) pada isolat
KBM 2 pH C4-4 C5-1 C5-3 C11-1 H 3* H 6* KBM 4 Bufer sitrat fosfat 3 3.5 4 4.5 5 5.5 0 0 0 2.22 3.95 2.53 1.12 3.74 0 1.76 1.76 2.09 0.13 0 5.29 3.37 7.84 2.92 0.07 0.45 0.53 1.84 1.70 1.10 0.59 0 0 0.49 2.76 2.63 0.79 0 0 1.53 3.51 3.39 0.95 0 1.37 2.69 6.53 2.33 Bufer fosfat 6 6.5 7 7.5 8 1.55 2.80 2.54 2.44 1.81 1.56 0.07 1.31 0.92 2.43 2.30 1.31 2.17 0.96 1.31 0.70 1.51 0.96 1.69 3.01 0 0.25 4.36 1.82 0.91 0 1.41 2.77 1.88 2.80 1.32 2.92 7.65 6.32 4.39 Bufer Tris-HCl 8 8.5 9 4.44 1.67 0.64
• hari optimum produksi
Tabel 6 Aktivitas selulase masing-masing isolat yang diuji pada pH optimumnya dan diinkubasi pada berbagai suhu
Aktivitas (nkat/ml) pada suhu (°C) Isolat pH 30 40 50 60 70 80 90 C4-4 C5-1 C5-3 C11-1 KBM 2-3 KBM 2-6 KBM 4 5 3.5 5 8 7 5 7 0.238 0.080 0.002 0.756 0.195 0.987 0.785 0.432 0.176 0.021 0.531 0.916 0.581 1.326 0.458 0.285 0.011 0.692 1.460 0.589 1.592 0.314 0.149 0.021 0.567 0.498 0.510 1.274 0.663 0.279 0.022 1.067 0.149 0.340 0.260 0.475 0.259 0.023 0.102 0.212 0.115 0.204 0.352 0.426 0.017 0.243 0.325 0.387 0.263
5
Tabel 7 Aktivitas spesifik selulase masing-masing isolat yang diuji pada pH optimumnya dan diinkubasi pada berbagai suhu
Aktivitas (nkat/mg) pada suhu (°C) Isolat pH 30 40 50 60 70 80 90 C4-4 C5-1 C5-3 C11-1 KBM 2-3 KBM 2-6 KBM 4 5 3.5 5 8 7 5 7 1.93 0.83 0.04 5.92 1.44 7.27 7.30 3.50 1.95 0.43 4.22 6.61 4.37 12.34 3.71 3.17 0.21 5.49 19.39 5.07 14.81 2.54 1.62 0.42 4.50 3.59 3.75 11.85 5.37 3.13 0.44 8.47 1.07 2.50 2.42 3.84 2.86 0.46 0.81 1.55 0.86 1.89 2.85 4.67 0.34 1.93 2.35 2.84 2.44 Tabel 8 Aktivitas selulase masing-masing isolat yang diuji pada berbagai substrat (CMC, Avisel,
Whatmann Filter Paper) pada hari, pH, dan suhu optimum produksi
Aktivitas (nkat/ml) pada substrat
Isolat pH Suhu (°C) CMC Avisel FP C4-4 C5-1 C5-3 C11-1 KBM 2-3 KBM 2-6 KBM 4 5 3.5 5 8 7 5 7 70 90 80 70 50 30 50 0.376 0.731 0.015 0.428 1.075 0.675 1.220 0.470 0.048 0.005 0.175 0.132 0.167 0.070 0.146 0.019 0.025 0.147 0.363 0.505 0.320 Tabel 9 Aktivitas spesifik selulase masing-masing isolat yang diuji pada berbagai substrat (CMC,
Avisel, Whatmann Filter Paper) pada hari, pH, dan suhu optimum produksi Aktivitas (nkat/mg) pada substrat
Isolat pH Suhu (°C) CMC Avisel FP C4-4 C5-1 C5-3 C11-1 KBM 2-3 KBM 2-6 KBM 4 5 3.5 5 8 7 5 7 70 90 80 70 50 30 50 2.88 8.09 0.31 3.41 7.79 4.57 11.35 3.60 0.57 0.10 1.39 0.56 1.37 0.65 1.12 0.20 0.51 1.17 2.56 3.72 2.95 PEMBAHASAN Isolat C4-4, C5-1, C11-1, KBM 2 dan KBM 4 mampu menggunakan CMC sebagai sumber karbon. Hal itu ditunjukkan dengan terbentuknya zona bening pada media agar-agar CMC setelah masa inkubasi dan diwarnai dengan merah kongo.
Puncak pertumbuhan keempat isolat tersebut tidak pada hari yang sama dengan aktivitas enzim tertinggi. Pada Isolat C5-3 hari tertinggi produksi selulase tidak sama antara aktivitas (nkat/ml) dengan aktivitas spesifik (nkat/mg), hal ini menunjukkan kadar protein enzim pada hari ke-3 dan ke-4 berbeda, kadar protein pada hari ke-3 lebih kecil daripada hari ke-4. Isolat KBM 2 memiliki dua hari produksi selulase tertinggi (hari ke-3 dan hari ke-6 ) dengan selisih aktivitas enzim yang kecil yaitu 0.728 nkat/ml dan 0.669 nkat/ml dengan aktivitas spesifik 6.13 nkat/mg dan
5.71 nkat/mg. Kemungkinan kedua enzim ini merupakan isozim sehingga dikarakterisasi lebih lanjut. KBM 4 memiliki aktivitas 1.447 nkat/ml dengan aktivitas spesifik terbesar dari keenam isolat yaitu 23.42 nkat/mg. Selisih antara aktivitas dengan aktivitas spesifik KBM 4 sangat besar hal itu dikarenakan kadar protein pada enzim ekstrak kasarnya sangat kecil.
Aktivitas enzim dipengaruhi oleh pH, karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi oleh pH. Perubahan pH atau pH yang tidak sesuai akan menyebabkan daerah katalitik dan konformasi enzim berubah. Selain itu perubahan pH juga menyebabkan denaturasi enzim dan mengakibatkan hilangnya aktivitas enzim (Girindra 1993). Isolat-isolat yang dikarakterisasi menunjukkan keragaman pH optimum. Isolat C4-4 dan C5-3 memiliki aktivitas tertinggi pada pH 5, C5-1 pada pH 3.5, C11-1 pada pH 8, dan
6
KBM 4 pada pH 7. KBM 2 memiliki dua pH optimum yang berbeda pada kedua hari produksi selulase tertinggi yaitu pH 7 pada hari ke-3 dan pH 5 pada hari ke-6.
Isolat-isolat ini merupakan bakteri selulolitik yang diisolasi dari tanah pertanian yang umumnya bersifat asam dan serasah yang umumnya bersifat alkali hingga netral. Isolat C4-4, C5-3, dan KBM 2-6 memiliki pH optimum pada pH asam. Isolat C5-1 memiliki pH optimum yang ekstrem asam dan C11-1 memiliki pH optimum yang alkalin. Salah satu contoh bakteri selulolitik yang memiliki pH optimum ekstrem asam ialah Clostridium acetobutylicum dengan pH optimum 4.6 (Allock & Woods 1981). Kisaran pH untuk selulase tergolong luas, Bacillus sp. galur N-4 menghasilkan selulase yang aktif pada rentang pH 5-10 (Horikhosi 1999). Aviselase yang merupakan salah satu enzim dari sistem enzim selulase memiliki pH optimum 4.5 dan 5 dengan rentang 4-9 (Walter & Schrempf 1996). CMCase cenderung optimum pada pH asam yaitu pada rentang 4-6.5 (Li & Gao 1997).
Selain pH, suhu memainkan peranan yang sangat penting dalam reaksi enzimatik. Ketika suhu bertambah sampai suhu optimum, kecepatan reaksi enzim naik karena energi kinetik bertambah. Bertambahnya energi kinetik akan mempercepat gerak vibrasi, translasi, dan rotasi baik enzim maupun substrat. Hal ini akan memperbesar peluang enzim dan substrat bereaksi. Ketika suhu lebih tinggi dari suhu optimum, protein berubah konformasi sehingga gugus reaktif terhambat. Perubahan konformasi ini dapat menyebabkan enzim terdenaturasi (Girindra 1993). Substrat juga dapat berubah konformasi pada suhu yang tidak sesuai, sehingga substrat tidak dapat masuk ke dalam sisi aktif enzim.
C4-4 dan C11-1 memiliki suhu optimum pada 70 °C, C5-1 memiliki suhu optimum paling ekstrim yaitu 90 °C, C5-3 memiliki suhu optimum 80 °C, KBM 2 hari ke-6 memiliki suhu optimum 30 °C, dan KBM 2 hari ke-3 dan KBM 4 memiliki suhu optimum 50 °C.
Enzim yang memiliki aktivitas optimum pada suhu 50 °C sampai dengan 80 °C disebut termozim dan enzim yang memiliki aktivitas optimum di atas 80 °C disebut hipertermozim (Hough & Danson 1999). Oleh karena itu selulase yang dihasilkan isolat C4-4, C5-3, C11-1, KBM 2 dan KBM 4 termasuk termozim. Selulase yang
dihasilkan C5-1 termasuk hipertermozim. Contoh organisme hipertermozim yaitu Thermoproteus tenak yang tahan pada suhu 88 °C (Andrade et al. 1999). Kondisi alami bakteri selulolitik yang berperan sebagai dekomposer memungkinkan bakteri tersebut memiliki sistem enzim yang optimum pada suhu tinggi. Saha (2003) mengemukakan suhu pada proses pengomposan cenderung naik hingga 70 °C.
Semua isolat memiliki aktivitas pada CMC, avisel dan filter paper, sehingga dapat dikatakan enzim selulase yang dihasilkan adalah endo-β-1,4-glukonase (CMCase) dan ekso-β-1,4-glukonase (aviselase). Substrat yang sesuai untuk C4-4 ialah avisel. Kompleks enzim yang dominan pada isolat C4-4 ialah enzim ekso-β-1,4-glukonase. Enzim ekso-β-1,4-glukonase memotong secara berurutan pada ujung reduksi maupun nonpereduksi dari rantai polisakarida selulosa dan membebaskan glukosa atau selobiosa sebagai produk utama (Lynd et al. 2002).
Substrat yang sesuai untuk isolat C5-1, C11-1, KBM 2, dan KBM 4 yaitu CMC. CMC ialah selulosa amorf. Kompleks enzim yang dominan pada isolat-isolat tersebut ialah endo-β-1,4-glukonase yang memotong secara acak pada daerah amorf internal pada rantai polisakarida (Lynd et al. 2002).
Isolat C5-3 memiliki aktivitas tertinggi pada filter paper. Kertas saring merupakan contoh dari selulosa yang mengandung daerah amorf dan kristalin. Hal ini menunjukkan adanya sinergi dalam sistem enzim selulase yang dimiliki oleh isolat C5-3. Dalam hal ini disebut endo-ekso sinergi antara endoglukonase dan eksoglukonase (Lynd et al. 2002), karena selulase yang disekresikan memiliki aktivitas pada CMC dan avisel.
Selulase yang dihasilkan oleh keenam isolat yang telah dikarakterisasi memiliki potensi di bidang industri dan pengomposan karena memiliki suhu optimum yang tinggi, memiliki pH optimum yang beragam dari asam hingga alkali, serta memiliki aktivitas pada substrat amorf, kristalin, dan gabungan keduanya. Enzim selulase yang dihasilkan C4-4 dan C5-3 memiliki potensi besar pada industri yang memerlukan fermentasi, contohnya sebagai penjernih jus buah dan beverage. Pada industri tersebut memerlukan enzim yang optimum pada kisaran pH 5. Enzim selulase yang memiliki pH optimum alkalin dapat digunakan sebagai bahan tambahan dalam industri
7
detergen (detergent laundry additive) (Horikhosi 1999), sehingga selulase yang dihasilkan C11-1 yang optimum pada pH 8 memiliki potensi sebagai bahan tambahan pada industri detergen.
SIMPULAN
Karakter selulase dari keenam bakteri selulolitik asal tanah pertanian Jawa Tengah dan Jawa Barat sangat beragam baik dalam waktu optimum pertumbuhan, waktu produksi tertinggi, pH dan suhu optimum, serta substrat yang sesuai.
Isolat C4-4, C5-1, C5-3, C11-1, KBM 2 dan KBM 4 masing-masing mencapai waktu produksi tertinggi pada umur kultur 3 hari, 5 hari, 4 hari, 4 hari, 3 dan 6 hari, dan 5 hari.
Isolat C4-4 memiliki pH optimum 5, suhu optimum 70 °C, dan avisel sebagai substrat yang sesuai. Isolat C5-1 memiliki pH optimum 3.5, suhu optimum 90 °C, dan CMC sebagai substrat yang sesuai. Isolat C5-3 memiliki pH optimum 5, suhu optimum 80 °C, dan filter paper sebagai substrat yang sesuai. Isolat C11-1 memiliki pH optimum 8, suhu optimum 70 °C, dan CMC sebagai substrat yang sesuai. Isolat KBM 4 memiliki pH optimum 7, suhu optimum 50 °C, dan CMC sebagai substrat yang sesuai.
Isolat KBM 2 memiliki dua waktu optimum produksi yaitu pada umur kultur 3 hari dan 6 hari. Kemungkinan enzim ini adalah isozim karena berbeda pada karakter pH dan suhu, namun menghidrolisis substrat yang sama yaitu CMC. Pada umur kultur 3 hari, pH optimum selulase ialah 7 dengan suhu optimum 50 °C, sedangkan pada umur kultur 6 hari, pH optimum 5 dengan suhu optimum 30 °C.
SARAN
Untuk mengetahui berapa lama aktivitas selulase pada suhu optimumnya disarankan melakukan uji stabilitas enzim pada suhu optimum dibandingkan dengan suhu penyimpanan.
Keragaman karakter dari keenam isolat perlu digali lebih lanjut mengingat masing-masing isolat memiliki keunikan. Hal tersebut perlu dilakukan untuk mendapatkan data yang dapat digunakan sebagai acuan dalam aplikasi enzim selulase ini.
DAFTAR PUSTAKA
Alam MZ, Manchur MA, Anwar MN. 2004.
Isolation, purification, characterization of cellulolytic
enzymes produced by Streptomyces omiyaensin. J Biol Sci 10: 1647-1653.
Allcock ER, Woods DR. 1981. Carboxymethyl cellulase and cellobiase production by Clostridium acetobutylicum in industrial fermentation medium. J Appl Environ Microbiol 41: 539-541.
Andrade C, Pereira N, Antranikian G. 1999.
Extremely thermophilic microorganism and their polymer
hydrolitic enzyme. J Rev Microbiol 30: 287-298.
Bradford MM. 1976. A rapid and sensitif methode for the quantition of microorganism quantities of protein utilizing the principle of protein binding. Anal Biochem 72: 248- 254. Crueger W, Crueger A. 1984.
Biotechnology: A Textbook of Industrial Mikrobiology. Brock TD, editor. Sunderland: Minuaer Associates.
Girindra A. 1993. Biokimia I. Jakarta: PT. Gramedia Pustaka.
Horikhosi K. 1999. Alkaliphiles: some applications of their products for biotechnology. J Microbiol Molec Biol Rev 64: 735-750.
Hough DW, Danson MJ. 1999. Extremozymes. Cur Opini Chem Biol. 3: 39-46.
Kim T.I et al. 2004. Isolation and characterization of cellulase secreting bacterium from cattle manure: application of composting. J Compost Sci Utiliz 12: 242-248.
Li X, Gao P. 1996. CMC-liquefying enzyme, a low molecular mass initial cellulose-decomposing cellulose responsible for fragmentation from Streptomyces sp. LX. J Appl Microbiol 83: 56-66
Lynd L. R et al. 2002. Microbial cellulose utilization: fundamental and biotechnology, review. Microbiol Mol Biol Rev 66: 506-577
Madigan MT, Martinko JM, Parker J.2000. Brock Biology of Microorganisms. Ed. ke-9. Upper Saddle River : Prentice Hall.
8
Miller GL. 1959. Dinitrosalisic assay. Anal Chem 31: 426-428.
Montesqrit. 1998. Ekstraksi selulase dari kapang tanah dan aplikasinya dalam meningkatkan kecernaan pakan limbah berserat pada ruminansia (in vitro) [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Perez J, Munoz-Dorado J, Rubia T, Martinez J. 2002. Biodegradation and biological treatments of cellulose, hemicellulose and lignin. J Int Microbiol 5: 53-63.
Rao S. 1995. Soil Microorganisms and Plant Growth. Ed. ke-3. New Hampshire: Science Publicer Inc.
Saha BC. 2003. Hemicellulose bioconversion. J Ind Microbiol Biotechnol 30: 279-291.
Walter S, Schrempf H. 1996. Physiological studies of cellulase (avicelase) synthesis in Streptomyces reticuli. J Appl Enviroment Microbiol 62: 1065-1069.