`BAB II
TINJAUAN PUSTAKA
2.1 PENDAHULUAN
Gunung Sinabung merupakan salah satu gunung di dataran tinggi Kabupaten Karo, Sumatera Utara, Indonesia. Koordinat puncak Gunung Sinabung adalah 03o 10’ LU dan 98o 23’ BT dengan puncak tertinggi gunung ini adalah 2.460 meter dari permukaan laut yang menjadi puncak tertinggi di Sumatera Utara (Global Volcanism Program, 2008).
Semula gunung api ini masuk dalam klasifikasi tipe B, gunung api yang tidak punya sejarah letusan sejak tahun 1600. Pada 29 Agustus 2010 Gunung Sinabung meletus. Peristiwa ini adalah gunung api tipe B pertama yang meletus. Dengan demikian klasifikasinya berubah menjadi tipe A, gunung api yang pernah meletus sejak tahun 1600 sampai sekarang (Wittiri, 2010). Setelah istirahat (dormand) selama tiga tahun, pada 15 September 2013 Gunung Sinabung kembali meletus hingga kini.
Gambar 2.1 Abu Vulkanik Menutupi Wilayah Karo Sumber: Liputan 6, 2017
2.2 LOGAM SENG (Zn)
Seng (bahasa Belanda: zink), zink, atau timah sari adalah unsur kimia dengan lambang kimia Zn, bernomor atom 30, dan massa atom relatif 65,39. Ia merupakan unsur pertama golongan 12 pada tabel periodik. Beberapa sifat kimia seng mirip dengan magnesium (Mg). Hal ini dikarenakan ion kedua unsur ini berukuran hampir sama. Selain itu, keduanya juga memiliki keadaan oksidasi +2. Seng merupakan unsur paling melimpah ke-24 di kerak bumi dan memiliki lima isotop stabil. Bijih seng yang paling banyak ditambang adalah sfalerit (seng sulfida).
Kuningan, yang merupakan aloi tembaga dan seng, telah lama digunakan paling tidak sejak abad ke-10 SM. Logam seng tak murni mulai diproduksi secara besar-besaran pada abad ke-13 di India, manakala logam ini masih belum di kenal oleh bangsa Eropa sampai dengan akhir abad ke-16. Para alkimiawan membakar seng untuk menghasilkan apa yang mereka sebut sebagai "salju putih" ataupun "wol filsuf". Kimiawan Jerman Andreas Sigismund Marggraf umumnya dianggap sebagai penemu logam seng murni pada tahun 1746. Karya Luigi Galvani dan Alessandro Volta berhasil menyingkap sifat-sifat elektrokimia seng pada tahun 1800. Pelapisan seng pada baja untuk mencegah perkaratan merupakan aplikasi utama seng. Aplikasi-aplikasi lainnya meliputi penggunaannya pada baterai dan aloi. Terdapat berbagai jenis senyawa seng yang dapat ditemukan, seperti seng karbonat dan seng glukonat (suplemen makanan), seng klorida (pada deodoran), seng pirition (pada sampo anti ketombe), seng sulfida (pada cat berpendar), dan seng metil ataupun seng dietil di laboratorium organik.
Seng merupakan zat mineral esensial yang sangat penting bagi tubuh. Terdapat sekitar dua miliar orang di negara-negara berkembang yang kekurangan asupan seng. Defisiensi ini juga dapat menyebabkan banyak penyakit. Pada anak-anak, defisiensi ini menyebabkan gangguan pertumbuhan, memengaruhi pematangan seksual, mudah terkena infeksi, diare, dan setiap tahunnya menyebabkan kematian sekitar 800.000 anak-anak di seluruh dunia. Konsumsi seng yang berlebihan dapat menyebabkan ataksia, lemah lesu, dan defisiensi tembaga. Dalam bahasa sehari-hari, seng juga dimaksudkan sebagai pelat seng yang digunakan sebagai bahan bangunan. (wikipedia, 2016)
Gambar 2.2 Logam Zn Sumber: Wikipedia, 2016
a. Karakteristik Umum
Seng diambil dari bahasa Belanda yaitu zink adalah unsur kimia dengan lambang kimia Zn, nomor atom 30, dan massa atom relatif 65,39. Ia merupakan unsur pertama golongan 12 pada tabel periodik. Beberapa aspek kimiawi seng mirip dengan magnesium. Hal ini dikarenakan ion kedua unsur ini berukuran hampir sama. Selain itu, keduanya juga memiliki keadaan oksidasi +2. Seng merupakan unsur paling melimpah ke-24 di kerak Bumi dan memiliki lima isotop stabil. Bijih seng yang paling banyak ditambang adalah sfalerit (seng sulfida).
b. Sifat Fisik
Seng merupakan logam yang berwarna putih kebiruan, berkilau, dan bersifat diamagnetik. Walau demikian, kebanyakan seng mutu komersial tidak berkilau. Seng sedikit kurang padat daripada besi dan berstruktur kristal heksagonal.Lehto 1968, p. 826 Logam ini keras dan rapuh pada kebanyakan suhu, namun menjadi dapat ditempa antara 100 sampai dengan 150 °C. Di atas 210 °C, logam ini kembali menjadi rapuh dan dapat dihancurkan menjadi bubuk dengan memukul-mukulnya. Seng juga mampu menghantarkan listrik. Dibandingkan dengan logam-logam lainnya, seng memiliki titik lebur (420 °C) dan tidik didih (900 °C) yang relatif rendah. Dan sebenarnya pun, titik lebur seng merupakan yang terendah di antara semua logam-logam transisi selain raksa dan kadmium.
Terdapat banyak sekali aloi yang mengandung seng. Salah satu contohnya adalah kuningan (aloi seng dan tembaga). Logam-logam lainnya yang juga diketahui dapat membentuk aloi dengan seng adalah aluminium, antimon, bismut, emas, besi, timbal, raksa, perak, timah, magnesium, kobalt, nikel, telurium, dan natrium. Walaupun seng maupun zirkonium tidak bersifat feromagnetik, aloi ZrZn2 memperlihatkan feromagnetisme di bawah suhu 35 K.
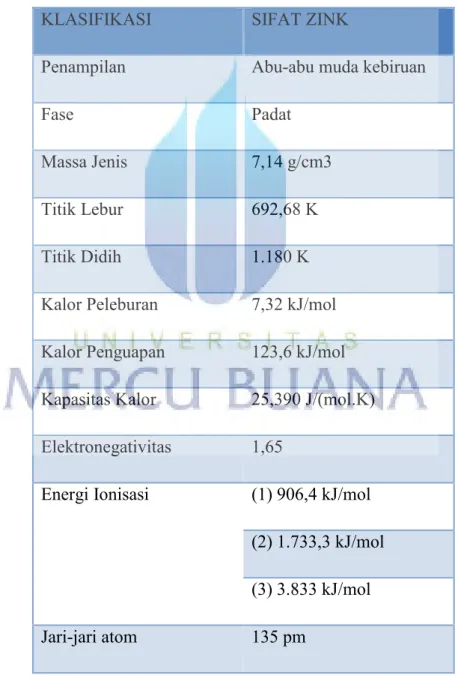
Tabel 2.1 Klasifikasi sifat zink Sumber: Sony,2009 KLASIFIKASI SIFAT ZINK
Penampilan Abu-abu muda kebiruan
Fase Padat
Massa Jenis 7,14 g/cm3 Titik Lebur 692,68 K Titik Didih 1.180 K Kalor Peleburan 7,32 kJ/mol Kalor Penguapan 123,6 kJ/mol Kapasitas Kalor 25,390 J/(mol.K) Elektronegativitas 1,65
Energi Ionisasi (1) 906,4 kJ/mol (2) 1.733,3 kJ/mol (3) 3.833 kJ/mol Jari-jari atom 135 pm
c. Sifat Kimia
Reaktivitas seng memiliki konfigurasi elektron [Ar]3d104s2 dan merupakan unsur golongan 12 tabel periodik. Seng cukup reaktif dan merupakan reduktor kuat.. Permukaan logam seng murni akan dengan cepat mengusam, membentuk lapisan seng karbonat, Zn5(OH)6CO3, seketika berkontak dengan karbon dioksida. Lapisan ini membantu mencegah reaksi lebih lanjut dengan udara dan air.
Seng yang dibakar akan menghasilkan lidah api berwarna hijau kebiruan dan mengeluarkan asap seng oksida. Seng bereaksi dengan asam, basa, dan non-logam lainnya Seng yang sangat murni hanya akan bereaksi secara lambat dengan asam pada suhu kamar. Asam kuat seperti asam klorida maupun asam sulfat dapat menghilangkan lapisan pelindung seng karbonat dan reaksi seng dengan air yang ada akan melepaskan gas hidrogen.
Seng secara umum memiliki keadaan oksidasi +2. Ketika senyawa dengan keadaan oksidasi +2 terbentuk, elektron pada kelopak elektron terluar s akan terlepas, dan ion seng yang terbentuk akan memiliki konfigurasi [Ar]3d10. Hal ini mengijinkan pembentukan empat ikatan kovalen dengan menerima empat pasangan elektron dan mematuhi kaidah oktet. Stereokimia senyawa yang dibentuk ini adalah tetrahedral dan ikatan yang terbentuk dapat dikatakan sebagai sp3. Pada larutan akuatik, kompleks oktaherdal, [Zn(H2O)6]2+, merupakan spesi yang dominan.
Penguapan seng yang dikombinasikan dengan seng klorida pada temperatur di atas 285 °C mengindikasikan adanya Zn2Cl2 yang terbentuk, yakni senyawa seng yang berkeadaan oksidasi +1. Tiada senyawa seng berkeadaan oksidasi selain +1 dan +2 yang diketahui. Perhitungan teoritis mengindikasikan bahwa senyawa seng dengan keadaan oksidasi +4 sangatlah tidak memungkinkan terbentuk.
Sifat kimiawi seng mirip dengan logam-logam transisi periode pertama seperti nikel dan tembaga. Ia bersifat diamagnetik dan hampir tak berwarna. Jari-jari ion seng dan magnesium juga hampir identik. Oleh karenanya, garam kedua senyawa ini akan memiliki struktur kristal yang sama. Pada kasus di mana jari-jari ion merupakan faktor penentu, sifat-sifat kimiawi keduanya akan sangat mirip. Seng cenderung membentuk ikatan kovalen berderajat tinggi. Ia juga akan membentuk senyawa kompleks dengan
pendonor N- dan S-. Senyawa kompleks seng kebanyakan berkoordinasi 4 ataupun 6 walaupun koordinasi 5 juga diketahui ada (Sony, 2009).
2.3 KOROSI
Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari, korosi disebut perkaratan. Korosi merupakan penurunan kualitas yang disebabkan oleh reaksi kimia bahan logam dengan unsur-unsur lain yang terdapat di alam (Sidiq,2013).
Faktor-faktor seperti temperatur, kelembaban dan kandungan bahan kimia dalam udara sangat menentukan laju korosi (Fontana, 1986; Agung, 2004). Sementara itu, komposisi logam, struktur metalurgi, dan proses pembuatan logam juga mempercepat timbulnya korosi.
2.3.1 JENIS – JENIS KOROSI
Korosi memiliki berbagai macam bentuk. Setiap bentuk korosi memiliki karakteristik dan mekanisme yang berbeda-beda. Jenis-jenis korosi adalah sebagai berikut (Lisjar, 2015):
a. Korosi Merata (Uniform Corrosion)
Korosi merata adalah bentuk korosi yang pada umumnya sering terjadi. Hal ini biasanya ditandai dengan adanya reaksi kimia atau elektrokimia yang terjadi pada permukaan yang bereaksi. Logam menjadi tipis dan akhirnya terjadi kegagalan pada logam tersebut. Korosi merata dapat dilakukan pencegahan dengan cara pelapisan, inhibitor dan proteksi katodik.
b. Korosi Galvanik (Galvanic Corrosion)
Perbedaan potensial biasanya terjadi diantara dua logam yang berbeda, ketika keduanya di celupkan ke dalam larutan korosif. Ketika logam tersebut berkontak, dengan adanya perbedaan potensial akan menghasilkan aliran elektron. Elektron mengalir dari logam yang kurang mulia (anodik) menuju ke metal yang lebih mulia (katodik). Akibatnya metal yang kurang mulia berubah menjadi ionion positif karena kehilangan elektron. Ion-ion positif metal bereaksi dengan ionion negatif yang berada di dalam elektrolit menjadi garam metal. Karena peristiwa tersebut permukaan anoda kehilangan metal.
c. Korosi Celah (Crevice Corrosion)
Merupakan bentuk korosi dimana korosi terjadi ketika terdapat celah akibat penggabungan atau penyatuan dua logam yang sama memiliki kadar oksigen berbeda dengan area luarnya. Jenis korosi ini biasanya disebabkan oleh lubang yang kecil, dan celah-celah di bawah kepala baut dan paku keling.
d. Korosi Sumuran (Pitting Corrosion)
Korosi sumuran adalah bentuk serangan korosi yang sangat lokal (menyerang pada daerah tertentu saja) yang mengakibatkan lubang dalam logam. Lubang
ini mungkin memiliki diameter yang kecil atau besar, namun dalam banyak kasus lubang tersebut relatif kecil. Korosi sumuran adalah salah satu bentuk korosi yang paling merusak dan berbahaya. Hal itu menyebabkan peralatan menjadi gagal karena dengan penurunan massa yang sedikit saja akibat adanya lubang, maka kegagalan dapat terjadi dengan mudah.
e. Korosi Erosi (Erosion Corrosion)
Korosi erosi adalah percepatan tingkat kerusakan atau serangan pada logam karena gerakan relatif antara cairan korosif dan permukaan logam. Umumnya gerakan ini cukup cepat, dan berkaitan dengan abrasi. Logam yang berada di permukaan akan berubah menjadi ion terlarut atau menjadi bentuk produk korosi yang padat. Bentuk fisik dari korosi erosi ditandai dalam penampilan berupa alur, parit, gelombang, lubang bulat, lembah-lembah, dan biasanya menunjukan pola arah.
f. Korosi Tegangan (Stress Corrosion)
Gaya-gaya mekanis seperti tarikan atau kompresi berpengaruh sangat kecil pada proses pengkaratan pada bagian metal yang sama jika ditinjau dari laju pengkaratan dalam mils pertahun. Namun demikian apabila itu merupakan kombinasi antara tensile stress dan lingkungan yang korosif, maka kondisi ini merupakan salah satu dari penyebab utama kegagalan material. Kegagalan ini berupa retakan yang lazim disebut korosi tegangan.
2.3.2 Laju Korosi (CR)
Laju korosi adalah kecepatan rambatan atau kecepatan penurunan kualitas bahan terhadap waktu. Kecepatan korosi dapat dihitung dengan pertarnbahan berat persatuan waktu persatuan luas dapat juga dihitung dengan tebalnya oksidasi yang terbentuk persatuan waktu (Suhartanti, 2005). Sering pula penunjukkan korosi dibuat dengan grafik penambahan atau pengurangan berat sebagai fungsi dari waktu. Seperti yang digunakan oleh Neuveld (1999) untuk mengetahui tingkatan laju korosi baja pada berbagai kondisi atau musim. Menurut Agung (2004) apabila data yang
diprediksi dengan model matematik hubungan laju korosi dengan faktor iklim dan polutan.
2.4 METODE KEHILANGAN BERAT
Metode kehilangan berat adalah perhitungan laju korosi dengan mengukur kekurangan berat akibat korosi yang terjadi. Metode ini menggunakan jangka waktu penelitian hingga mendapatkan jumlah kehilangan akibat korosi yang terjadi. Perhitungan laju korosi atas dasar kehilangan berat selama pengujian sesuai dengan standar ASTM G1 seperti pada persamaan di bawah ini:
𝐶𝑅 = 𝐾 × 𝑊 𝐴 × 𝑡 × 𝐷 Keterangan:
CR = laju korosi (mpy)
K = konstanta laju korosi = 534 (Konstanta) W = massa yang hilang (mg)
T = waktu perendaman (jam) A = luas permukaan spesimen (in2) D = densitas spesimen (g/cm3)
Metode ini meupakan cara untuk mengetahui corrosion rate (mpy) pada sampel uji.cara untuk mengetahui corrosion rate (mpy) juga dapat menggunakan alat elektrokimia. (Fontana,1986).
2.5 METODE ELEKTROKIMIA
Metode elektrokimia adalah metode mengukur laju korosi dengan mengukur beda potensial objek hingga didapat laju korosi yang terjadi, metode inimengukur laju korosi pada saat diukur saja dimana memperkirakan laju tersebut dengan waktu yang panjang (memperkirakan walaupun hasil yang terjadi antara satu waktu dengan waktu lainya berbeda). Kelemahan metode ini adalah tidak dapat menggambarkan secara pasti laju korosi hanya pada waktu tertentu saja, hingga secara umur pemakaian maupun kondisi untuk dapat di treatmen tidak dapat diketahui. Kelebihan
dari metode ini adalah kita bisa langsung mengetahui laju korosi pada saat di ukur, hingga waktu pengukuran tidak memakan waktu yang lama dan salah satu contoh alat dari metode elektrokimia sekaligus yang dipakai untuk penelitian ini adalah potensiostat.
Potensiostat adalah Teknik elektrokimia untuk keperluan analisis kuantitatif instrumental membutuhkan pengetahuan dan alat-alat tambahan untuk pengolahan data. Hal ini berkenaan dengan kenyataan bahwa pembangkit sinyal analitik yang dihasilkan dalam komponen instrumen memerlukan pengolahan agar dapat memberikan data yang mudah dibaca dan diolah untuk bahan informasi (Suharman dan Mulja, 1995). Potensiostat merupakan instrumen yang dapat digunakan untuk mengukur arus yang melewati pasangan elektroda kerja dan elektroda kounter dan selalu menjaga keseimbangan beda potensial antara elektroda kerja dan elektroda pembanding (Bard and Faulker, 1980).
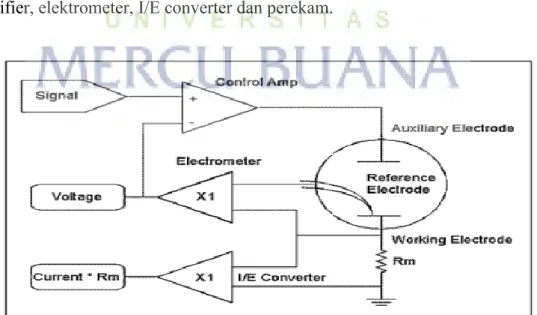
Potensiostat mengukur arus yang mengalir antara elektroda kerja dan elektroda pembanding. Variabel yang dikontrol oleh potensiostat adalah potensial sel, sedangkan variabel yang diukur adalah arus sel. Bentuk dari potensiostat dapat dilihat pada gambar yang terdiri dari lima komponen yaitu: sinyal generator, power amplifier, elektrometer, I/E converter dan perekam.
a. Signal Generator (Pembangkit Sinyal) Pembangkit sinyal ini menghasilkan perbedaan potensial antara elektroda kerja dengan elektroda pembanding. Perbedaan potensial dibentuk dari potensial tunggal atau potensial yang dikontrol oleh komputer. Output digital ke analog (D/A) mengubah bilangan yang dihasilkan komputer kedalam potensial. Pemilihan yang tepat dari urutan bilangan memungkinkan komputer menghasilkan potensial yang konstan, potensial yang linier dan gelombang sinus datar (sinusoidal). Bilangan dari eksitasi potensial menghasilkan variasi yang berbeda dari voltammetri.
b. Elektrometer Rangkaian elektrometer mengukur beda potensial antara elektroda kerja dengan elektroda pembanding. Outputnya memiliki dua fungsi yaitu feedback signal pada rangkaian potensiostat dan sinyal diukur sewaktu-waktu potensial sel dibutuhkan. Elektrometer yang ideal memiliki arus input nol dan memiliki impedansi input yang tidak terbatas.
c. The I/E conventer (pengubah arus ke potensial) Pengubah arus ke potensial merupakan rangkaian pengikut arus untuk mengukur arus sel dan menampilkan sebagai potensil. Potensial output, E out diperoleh dari arus sel X resistor feedback.
d. The Power Amplifier (Daya Amplifier) Daya amplifier atau pengontrol amplifier dari potensiostat berfungsi mengatur potensial pada elektroda kounter–elektroda kerja untuk mencapai selisih yang tepat pada elektroda pembanding-elektroda kerja. Pengontrol amplifier membandingkan potensial sel yang diukur dengan potensial yang diharapkan dan mengendalikan arus yang masuk kedalam sel untuk memaksa potensialnya menjadi sama. Potensial yang diukur adalah input yang masuk ke dalam input negatif dari pengontrol amplifier. Perekam Data/ The Recorder Merupakan peralatan sederhana untuk menampilkan dan merekam potensiostat dalam bentuk chart recorder output atau voltmeteter digital.
e. Perekam Data/ The Recorder
Merupakan peralatan sederhana untuk menampilkan dan merekam output potensiostat dalam bentuk chart recorder atau voltmeter digital (Siswoyo, dkk, 2000).
2.6 SCANNING ELECTRON MICROSCOPY
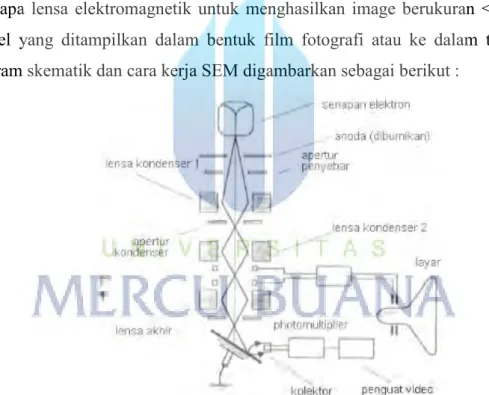
SEM terdiri dari sebuah senapan elektron yang memproduksi berkas elektron pada tegangan dipercepat sebesar 2 – 30 kV. Berkas elektron tersebut dilewatkan pada beberapa lensa elektromagnetik untuk menghasilkan image berukuran <~10nm pada sampel yang ditampilkan dalam bentuk film fotografi atau ke dalam tabung layar. Diagram skematik dan cara kerja SEM digambarkan sebagai berikut :
Gambar 2.5 Diagram skematik fungsi dasar dan cara kerja SEM.
SEM sangat cocok digunakan dalam situasi yang membutuhkan pengamatan permukaan kasar dengan pembesaran berkisar antara 20 kali sampai 500.000 kali. Sebelum melalui lensa elektromagnetik terakhir scanning raster mendeflesikan berkas elektron untuk men-scan permukaan sampel. Hasil scan ini tersinkronisasi dengan tabung sinar katoda dan gambar sampel akan tampak pada area yang di-scan. Tingkat kontras yang tampak pada tabung sinar katoda timbul karena hasil refleksi yang
berbeda-beda dari sampel. Sewaktu berkas elektron menumbuk permukaan sampel sejumlah elektron direfleksikan sebagai backscattered electron (BSE) dan yang lain membebaskan energi rendah secondary electron (SE). Emisi radiasi elektromagnetik dari sampel timbul pada panjang gelombang yang bervariasi tapi pada dasarnya panjang gelombang yang lebih menarik untuk digunakan adalah daerah panjang gelombang cahaya tampak (cathodoluminescence) dan sinar-X. Elektron-elektron BSE dan SE yang direfleksikan dan dipancarkan sampel dikumpulkan oleh sebuah scintillator yang memancarkan sebuah pulsa cahaya pada elektron yang datang. Cahaya yang dipancarkan kemudian diubah menjadi sinyal listrik dan diperbesar oleh photomultiplier. Setelah melalui proses pembesaran sinyal tersebut dikirim ke bagian grid tabung sinar katoda. Scintillator biasanya memiliki potensial positif sebesar 5 – 10 kV untuk mempercepat energi rendah yang dipancarkan elektron agar cukup untuk mengemisikan cahaya tampak ketika menumbuk scintillator. Scintillator harus dilindungi agar tidak terkena defleksi berkas elektron utama yang memiliki potensial tinggi. Pelindung metal yang mengandung metal gauze terbuka yang menghadap sampel memungkinkan hampir seluruh elektron melalui permukaan scintillato (Anggraeni, 2008).