2.1 Mangrove
Kata mangrove merupakan perpaduan antara bahasa Portugis yaitu mangue dan bahasa Inggris yaitu grove (McNae 1968). Dalam bahasa Inggris, kata mangrove digunakan baik untuk komunitas pohon-pohonan atau rumput-rumputan, atau semak belukar yang tumbuh di daerah pesisir, maupun untuk jenis tumbuhan lainnya yang berasosiasi dengannya. Sedangkan dalam Bahasa Portugis, kata mangrove digunakan untuk jenis tumbuhan, dan kata mangal untuk komunitas hutan, yang terdiri atas jenis mangrove tersebut. Sementara itu, menurut UU Nomor 5 tahun 1967, kata mangrove berarti vegetasi hutan yang tumbuh diantara garis pasang surut, tetapi juga dapat tumbuh pada pantai karang atau dataran koral mati, yang diatasnya ditimbuni selapis tipis pasir atau lumpur, atau pada pantai berlumpur (Darsidi 1986).
2.1.1 Komposisi Jenis Mangrove dan Parameter Lingkungannya
Komunitas mangrove di Indonesia memiliki keragaman hayati tertinggi di dunia, dengan jumlah total kurang lebih 89 spesies, yang terdiri atas 35 spesies tanaman, 9 spesies perdu, 9 spesies liana, 29 spesies epifit dan 2 spesies parasitik (Nontji 1987). Beberapa jenis yang umum dijumpai di wilayah pesisir Indonesia adalah: bakau (Rhizophora), api-api (Avicennia), pedada (Sonneratia), tanjang (Bruguiera), nyirih (Xylocarpus), tengar (Ceriops) dan buta-buta (Exoecaria). Menurut laporan Departemen Kehutanan tahun 1982, luas areal mangrove di Indonesia tercatat 4.25 juta ha, dan tersebar di seluruh wilayah Indonesia. Sedangkan berdasarkan laporan PHPA-AWB tahun 1987, luas areal mangrove di Indonesia tinggal 3.24 juta ha (Agustono 1996).
Komposisi jenis tumbuhan penyusun komunitas mangrove ditentukan oleh beberapa faktor lingkungan, terutama jenis tanah, genangan pasang surut dan salinitas (Bengen 1997). Pada wilayah pesisir yang terbuka, jenis pohon yang dominan dan merupakan pohon perintis adalah api-api dan pedada. Api-api lebih suka hidup pada tanah berpasir agak keras, sedangkan pedada pada tanah berlumpur lembut. Pada daerah yang terlindung dari hempasan ombak, komunitas mangrove biasanya didominasi oleh bakau. Lebih ke arah daratan (hulu) pada tanah lempung yang agak pejal, biasanya tumbuh komunitas tanjang.
Paku laut (Acrostichum aureum) dan jeruju (Acanthus ilicifolius), seringkali dijumpai di daerah pinggiran pohon-pohon mangrove sebagai tumbuhan bawah (Dahuri 1996). Jenis palma yang disebut nipa (Nypa fruticans), merupakan salah satu komponen penyusun komunitas mangrove dan seringkali tumbuh di tepian sungai ke arah hulu dengan pengaruh air tawar yang sangat dominan.
Parameter lingkungan utama yang menentukan kelangsungan hidup dan pertumbuhan mangrove adalah pasokan air tawar, salinitas, stabilitas substrat, dan pasokan nutrien. Ketersediaan air tawar dan parameter salinitas yang mengendalikan efisiensi metabolisme dari ekosistem mangrove, dipengaruhi oleh frekwensi dan volume air tawar, frekwensi dan volume pertukaran pasang surut, dan tingkat evaporasi. Stabilitas substrat dipengaruhi oleh kecepatan aliran air tawar dan muatan sedimen yang dikandungnya, laju limpasan arus pasang surut, serta gaya gelombang (Berwick 1983). Sedangkan pasokan nutrien bagi ekosistem mangrove, dipengaruhi oleh berbagai proses yang saling terkait, meliputi masukan ion-ion mineral organik dan anorganik, serta pendaur ulangan nutrien secara internal melalui jaring makanan berbasis (detritus).
2.1.2 Fungsi dan Manfaat Ekosistem Mangrove
Ekosistem mangrove, merupakan sumberdaya alam wilayah tropis, yang memiliki manfaat ganda dengan pengaruh yang sangat luas terhadap aspek sosial, ekonomi dan ekologi. Besarnya peranan ekosistem mangrove terhadap kehidupan dapat dilihat dari keragaman jenis hewan, baik yang hidup di perairan, di atas substrat, maupun di tajuk-tajuk tumbuhan mangrove, serta ketergantungan manusia secara langsung terhadap ekosistem ini (Naamin 1991)
Ekosistem mangrove merupakan produsen primer melalui serasah yang dihasilkannya. Serasah mangrove setelah melalui proses dekomposisi oleh sejumlah mikroorganisme, menghasilkan detritus yang meningkatkan kesuburan perairan, sehingga berbagai jenis fitoplankton dapat hidup dan berkembang. Fitoplankton selanjutnya dimanfaatkan oleh konsumer primer yang terdiri dari zooplankton, ikan dan krustasea, sampai akhirnya dimangsa oleh manusia sebagai konsumer utama (Sumarna 1985). Vegetasi mangrove juga merupakan pendaur ulang zat hara tanah yang diperlukan bagi tanaman. Hasil penelitian di Florida menunjukan bahwa 90.0% kotoran hutan menghasilkan 35-60% unsur hara yang terlarut di pantai. Pada awal pembusukan, daun-daun bakau
(Rhizophora spp.) mengadung kadar protein 3.1% dan setelah satu tahun meningkat menjadi 21.0%. Kadar N daun kering adalah sekitar 0.55 kg dan diperkirakan setelah satu tahun menghasilkan sekitar 47 kg N. Produksi serasah dalam satu hektar lahan hutan magrove dapat mencapai 7.1-8.8 ton per tahun (Sumarna 1985).
Menurut pendapat para ahli, mangrove merupakan suatu ekosistem yang unik dengan berbagai macam fungsi yakni fungsi fisik, biologi dan ekonomi atau produksi (Naamin 1991). Fungsi fisik dari ekosistem mangrove adalah menjaga garis pantai agar tetap stabil, melindungi pantai dan tebing sungai, mencegah terjadinya erosi pantai, sebagai perangkap bahan pencemar dan limbah, perlindungan bagi tata guna lahan di wilayah pantai dari badai dan tsunami, pencegahan terhadap intrusi garam, pemurnian alami perairan pantai terhadap polusi, serta suplai detritus dan zat hara untuk perairan pantai di dekatnya. Sedangkan fungsi biologi ekosistem mangrove adalah sebagai daerah asuhan bagi larva dan individu muda, tempat bertelur, tempat mencari makan serta habitat alami berbagai jenis biota, yang beberapa diantaranya memiliki nilai komersial. Daun-daun mangrove yang berjatuhan dan berakumulasi pada sedimen mangrove sebagai lapisan sisa-sisa daun (leaf litter), mendukung kehadiran sejumlah besar komunitas organisme detrital. Organisme ini bertindak sebagai pengurai detritus, dan mengubahnya menjadi energi yang dapat dimanfaatkan oleh sejumlah spesies termasuk kepiting bakau dan jenis krustasea lainnya, ikan, moluska, reptilia, mamalia serta burung (Dahuri 1996). Sependapat dengan hal tersebut, Nontji (1987) melaporkan bahwa terdapat kurang lebih 80 spesies krustasea dan 65 spesies moluska di ekosistem mangrove di Indonesia.
White dalam Naamin (1991), menyatakan bahwa ekosistem mangrove memiliki produktifitas yang tinggi. Fungsi ekonomi ekosistem mangrove sangat banyak, baik secara kualitas maupun kuantitas. Menurut Saenger (1983), ada 67 macam produk yang dapat dihasilkan oleh tumbuhan mangrove bagi kepentingan manusia, baik produk langsung, seperti; bahan bakar, bahan bangunan, alat penangkap ikan, pupuk pertanian, bahan baku pembuatan kertas, makanan, obat-obatan, minuman dan tekstil, maupun produk tidak langsung seperti tempat rekreasi dan bahan makanan. Dikatakan pula bahwa sebagian besar produk yang dihasikan telah dimanfaatkan oleh masyarakat.
2.1.3 Ketergantungan Kepiting Bakau pada Ekosistem Mangrove
Banyak penelitian menunjukkan bahwa komunitas mangrove memainkan peranan penting bagi berbagai jenis biota yang hidup pada, atau di sekitar ekosistem tersebut. Nontji (1987), mengatakan bahwa beberapa produk perikanan yang bernilai ekonomi penting, mempunyai hubungan yang erat dengan ekosistem mangrove seperti udang (Paneus), kepiting bakau (Scylla) dan Tiram (Crassostrea)
Kepiting bakau menjalani sebagian besar hidupnya di ekosistem mangrove dan memanfatkan ekosistem mangrove sebagai habitat alami utamanya, yakni sebagai tempat berlindung, mencari makan, dan pembesaran. Kepiting bakau melangsungkan perkawinan di perairan hutan mangrove, dan secara berangsur-angsur sesuai dengan perkembangan telurnya, kepiting bakau betina akan beruaya dari perairan hutan mangrove ke perairan laut untuk memijah, sedangkan kepiting bakau jantan akan tetap berada di hutan mangrove untuk melanjutkan aktifitas hidupnya. Setelah memijah, kepiting bakau betina akan kembali ke hutan mangrove. Demikian pula dengan juvenil kepiting bakau yang akan bermigrasi ke hulu estuari, untuk kemudian berangsur-angsur memasuki hutan mangrove.
Ekosistem mangrove, merupakan tempat ideal bagi kepiting bakau untuk berlindung. Kepiting bakau muda pascalarva yang berasal dari laut, banyak dijumpai di sekitar estuari dan hutan mangrove, karena terbawa arus dan air pasang dan akan menempel pada akar-akar mengrove untuk berlindung (Hutching & Saenger 1987). Sedangkan kepiting bakau dewasa merupakan penghuni tetap hutan mangrove, dan sering dijumpai membenamkan diri dalam substrat lumpur, atau menggali lobang pada substrat lunak sebagai tempat persembunyaian (Queensland Depertment of Industries 1989a). Lebih lanjut Pagcatipunan (1972), menyatakan bahwa setelah berganti kulit (moulting), kepiting bakau akan melindungi dirinya dengan cara membenamkan diri, atau bersembunyi dalam lobang sampai karapaksnya mengeras. Hutcing dan Saenger (1987), menyatakan bahwa kepiting bakau hidup di sekitar hutan mangrove, dan memakan akar-akarnya (pneumatophore). Sementara Hill (1982), menyatakan bahwa perairan di sekitar hutan mangrove sangat cocok untuk kehidupan kepiting bakau, karena sumber makanannya seperti bentos dan serasah cukup tersedia.
2.2 Kepiting Bakau 2.2.1 Klasifikasi
Kepiting bakau tergolong dalam famili Portunidae, yang terdiri atas enam subfamili yaitu: Carcininae, Polybiinae, Caphyrinae, Catoptrinae, Podophthalminae dan Portuninae. Moosa (1979), memperkirakan bahwa ada sekitar 234 jenis yang tergolong dalam famili Potunidae, di wilayah Indopasifik Barat dan 124 jenis di Indonesia. Portunidae tergolong dalam kelompok kepiting perenang (swimming crabs), karena memiliki pasangan kaki terakhir yang memipih, dan dapat digunakan untuk berenang. Famili Portunidae mencakup rajungan (Portunus, Charybdis & Thalamita) dan kepiting bakau (Scylla spp.). Dinamakan kepiting bakau (Scylla spp.) karena banyak ditemukan di wilayah hutan bakau/mangrove. Meskipun demikian, kepiting bakau memiliki nama lokal yang beragam. Di Jawa, masyarakat mengenalnya dengan nama kepiting, di sebagian daerah di Maluku Tengah, dikenal sebagai katang nene, sedangkan di sebagian Sumatera, dikenal sebagai ketam batu, kepiting cina, atau kepiting hijau. Di manca negara, kepiting bakau juga dikenal dengan beragam nama yaitu: kepiting batu di Malaysia (Ong 1966), kepiting lumpur (mud crab) di Australia, kepiting samoa di Hawai, alimango di Philipina, tsai jim di Taiwan, dan nokogiri gozami di Jepang (Cowan 1984).
Motoh (1977), mengklasifikasikan kepiting bakau sebagai berikut Filum : Arthropoda Subfilum : Mandibulata Kelas : Crustasea Subkelas : Malacostraca Tribe : Eumalacostaca Supertribe : Eucarida Ordo : Decapoda Subordo : Pleocyemata Suku : Brachyura Famili : Portunidae Subfamili : Portuninae Genus : Scylla
Selanjutnya Estampador (1949a), membagi genus Scylla atas tiga jenis dan satu varietas, yaitu: Scylla serrata (Forskal), Scylla oceanica (Dana),
Scylla tranquebarica (Fabricius) dan Scylla serrata var. paramamosin (Estampador). Meskipun demikian, menurut Stephenson dan Campbell (1960) dalam Watanabe et al. (2001), genus Scylla hanya memiliki satu jenis saja yaitu Scylla serrata. Hal yang sama juga diyakini oleh Alcock (1989) dalam Sulaeman dan Naevdal (2000), yang menyatakan bahwa Scylla dari perairan India terdiri atas satu jenis yaitu Scylla serrata. Demikian pula halnya dengan Moosa et al. (1985), yang mendukung kesimpulan tersebut melalui kajian terhadap kepiting bakau di perairan Indonesia. Seiring dengan perkembangan ilmu pengetahuan, maka berdasarkan hasil penelitiannya dengan menggunakan metode Allozyme electrophoresis dan mitocondria DNA, Keenan et al. (1998) menyatakan bahwa kepiting bakau terdiri atas empat jenis yaitu: Scylla serrata, S. tranquebarica, S. pararamosain dan S. olivacea.
2.2.2 Taksonomi dan Identifikasi
Menurut Moosa (1981), untuk mengenal dan memberikan diagnosa dari tiap jenis krustasea, terlebih dahulu diperlukan pengetahuan tentang istilah bagian-bagian tubuh yang biasanya dipergunakan dalam taksonomi binatang yang bersangkutan. Dijelaskan pula bahwa bagian-bagian tubuh penting yang digunakan dalam pengenalan jenis dari famili Portunidae adalah
1. Karapaks (carapace), yaitu selubung kepala-dada serta bagian-bagian yang ada di atasnya.
2. Jumlah, bentuk dan sifat duri pada bagian dahi karapaks (rostrum) 3. Jumlah, bentuk dan sifat duri pada tepi antero-lateral karapaks 4. Bentuk sudut postero-lateral tubuh
5. Bagian-bagian yang terdapat pada ruas-ruas kaki jalan (periopod), terutama dari pasangan kaki pertama yang berbentuk capit (cheliped) dan pasangan kaki terakhir yang berbentuk dayung
6. Bentuk tutup abdomen dan bentuk pleopod 7. Bentuk mulut terutama maxilliped III
8. Bentuk bagian ruas dasar antenne (Basal antennal joint).
Kriteria-kriteria tersebut di atas tidak semuanya berlaku untuk satu genus. Ada kriteria yang dapat digunakan untuk genus yang satu, tetapi tidak penting atau kurang penting bila digunakan pada genus yang lain. Meskipun demikian, ada
kriteria yang sama-sama dapat digunakan untuk mengidentifikasi jenis-jenis dari beberapa genus.
Secara umum, ciri dari jenis-jenis organisme yang tergolong dalam famili Portunidae adalah: karapaks pipih atau agak cembung, berbentuk heksagonal atau agak persegi, bentuk umum adalah bulat telur memanjang atau berbentuk kebulat-bulatan, karapaks umumnya berukuran lebih lebar dari pada panjangnya dengan permukaan yang tidak selalu jelas pembagiannya; tepi antero-lateral karapaks berduri lima (jarang kurang dari lima kecuali pada subfamili Podophthalminae) sampai sembilan buah; dahi lebar, serta terpisah dengan jelas dari sudut supraorbital dan memiliki jumlah duri dua sampai enam buah; antenne (antennulae) kecil, terletak melintang atau menyerong; pasangan kaki terakhir berbentuk pipih menyerupai dayung, terutama pada dua ruas terakhir (ada beberapa genus yang berkaki tidak berbentuk demikian) (Moosa 1981).
Sedangkan ciri kepiting bakau secara khusus menurut Sulistiono et al. (1992), adalah: karapaks berbentuk cembung dan halus, lebar karapaks satu setengah dari panjangnya; bentuk alur yang menyerupai huruf H antara area pencernaan (gastric area) dan area jantung (cardiac area) jelas; empat duri berbentuk segitiga pada bagian dahi berukuran sama, serta memiliki orbit yang lebar dengan dua celah.
Kathirvel dan Srinivasagam (1992) yang membedakan kepiting bakau berdasarkan habitatnya di wilayah Indo-Pasifik, menyatakan bahwa ada dua jenis dari genus Scylla yaitu S. serrata dan S. tranquebarica, yang adalah sejenis dengan S. oceanica. Kedua spesies ini dibedakan melalui warna tubuh dan habitatnya. S. serrata hidup pada lobang-lobang di hutan mangrove sementara S. tranquebarica yang memiliki ukuran tubuh lebih besar adalah perenang bebas. Sebaliknya Estampador (1949), menggolongkan kepiting bakau ke dalam dua kelompok, yaitu banhawin dan mamosain. Kelompok Banhawin terdiri atas individu dengan warna tubuh hijau, dan memiliki tanda/pola poligonal pada semua kaki dan cheliped-nya. Sedangkan kelompok kedua adalah individu berwarna coklat gelap dan tidak memiliki tanda/pola apapun pada kaki-kaki dan cheliped-nya. Kepiting banhawin adalah perenang bebas, sedangkan kelompok mamosain tinggal menetap di dalam lobang. Jenis S. oceanica dan S. tranquebarica digolongkan kedalam kelompok banhawin yakni sebagai perenang
bebas, sedangkan S. serrata digolongkan ke dalam kelompok mamosain yaitu yang hidup di dalam lobang-lobang pada areal mangrove.
Untuk membedakan keempat jenis dari genus Scylla, Estampador (1949) mempergunakan warna sebagai salah satu faktor pembeda utama, walaupun menurut Warner (1977), identifikasi jenis berdasarkan warna tubuh saja mungkin akan keliru, karena kondisi setempat seperti cahaya, panas dan warna latar belakang habitat tempat kepiting bakau hidup, dapat berdampak terhadap dispersi pigmen pada tubuh kepiting bakau. S. oceanica dan S. tranquebarica mempunyai warna dasar kehijauan atau hijau keabu-abuan, atau disebut juga warna hijau buah zaitun, sedangkan S. serrata dan S. serrata var. paramamosin mempunyai warna dasar hijau merah kecoklatan atau coklat keabu-abuan sampai abu-abu. Estampador (1949), mengkaji juga beberapa perbedaan morfologis untuk membedakan keempat jenis dari genus Scylla seperti: sumber pembuat warna, bentuk H pada karapaks, bentuk duri pada dahi karapaks, bentuk duri pada fingerjoint dan bentuk rambut/setae (Tabel 1).
Tabel 1 Karakteristik jenis kepiting bakau (Scylla spp.) menurut Estampador (1949) Warna dan ciri
morfologis
Scylla oceanica
Scylla tranquebarica
Scylla serrata Scylla serrata var. paramamosin Warna karapaks Hijau
keabu-abuan
Hijau buah zaitun Coklat merah se-perti karat
Coklat kehijauan
Sumber pigmen polygonal
Pada capit dan semua kaki jalan
Hanya pada bagian terakhir kaki jalan
Tidak ada Pigmen putih pada bagian terakhir dari kaki-kaki
Bentuk alur “H” pada karapaks
Dalam Dalam tidak dalam Relatif tidak
begitu dalam
Bentuk duri depan Tajam Tajam Tumpul Sedang
Bentuk duri pada “fingerjoint”
Kedua duri jelas dan runcing
Kedua duri jelas dan satu agak tumpul
Duri tidak ada dan berubah menjadi vestigial - Bentuk Rambut/setae Melimpah pada karapaks - Hanya pada hepatic area -
Selain perbedaan warna dan perbedaan morfologis tubuh, telah dikembangkan suatu teknik baru untuk memperoleh status taksonomi dari jenis organisme tertentu, yaitu melalui analisa genetik. Analisa ini merupakan suatu komponen penting dari penelitian taksonomi dan biologi perikanan, dan umumnya dikembangkan melalui pendekatan karakter-karakter individu dari suatu jenis organisme, yang tidak terpengaruh oleh kondisi lingkungan. Analisa ini telah dikembangkan terhadap kepiting bakau oleh Keenan et al. (1998), yang
kemudian merubah klasifikasi genus Scylla dari klasifikasi sebelumnya, dengan karakter tiap jenis seperti pada Tabel 2.
Klasifikasi jenis kelamin kepiting bakau dapat dilakukan secara eksternal. Menurut Moosa et al. (1985), ruas-ruas pada tutup abdomen kepiting bakau jantan umumnya sempit dan berbentuk segitiga, sedangkan ruas-ruas pada tutup abdomen kepiting bakau betina berukuran lebar dan sedikit membulat.
Tabel 2 Karakter jenis kepiting bakau (Scylla spp.) menurut Keenan et al. (1998).
Jenis Fakror pembeda / ciri morfologis
Pola poligon dan warna
Chela dan kaki-kakinya memiliki pola poligon yang sempurna
untuk kedua jenis kelamin dan pada abdomen betina. Warna bervariasi dari ungu, hijau sampai hitam kecoklatan
Duri pada dahi Tinggi, tipis dan agak tumpul dengan tepian yang cenderung cekung dan membulat
Scylla serrata
Duri pada bagian luar cheliped
Dua duri tajam pada propondus dan sepasang duri tajam pada carpus
Pola poligon dan warna
Chela dan dua pasang kaki jalan pertama berpola poligon
serta dua pasang kaki terakhir dengan pola bervariasi. Pola poligon juga terdapat pada abdomen betina dan tidak pada abdomen jantan. Warna bervariasi mirip dengan S. serrata
Duri pada dahi Tumpul dan dikelilingi celah sempit Scylla
tranquebarica
Duri pada bagian luar cheliped
Dua duri tajam pada propondus dan sepasang duri tajam pada carpus.
Pola poligon dan warna
Chela dan kaki-kakinya berpola poligon untuk kedua jenis
kelamin. Warna bervariasi dari ungu sampai coklat kehitaman.
Duri pada dahi Tajam, berbentuk segitiga dengan tepian yang bergaris lurus dan membentuk ruang yang kaku
Scylla
paramamosain
Duri pada bagian luar cheliped
Pada dewasa tidak ada duri pada bagian luar carpus dan sepasang duri agak tajam yang berukuran sedang pada
propondus sedangkan pada juvenil duri di bagian luar carpus
tajam.
Pola poligon dan warna
Chela dan kaki-kakinya tanpa pola poligon yang jelas untuk
kedua jenis kelamin dan pada abdomen betina saja. Warna bervariasi dari oranye kemerahan sampai coklat kehitaman.
Duri pada dahi Tumpul dan dikelilingi raung-ruang yang sempit Scylla olivacea
Duri pada bagian luar cheliped
Umumnya tidak ada duri pada carpus. Sedangkan pada bagian propondus duri mengalami reduksi dari tajam ke tumpul
2.2.3 Daur Hidup
Menurut Arriola (1940); Hill (1974); dan Le Reste et al. (1976), kepiting bakau melangsungkan perkawinannya di perairan hutan mangrove, dan secara berangsur-angsur sesuai dengan perkembangan telurnya, kepiting bakau betina akan bermigrasi ke perairan laut atau menjauhi pantai, untuk mencari perairan yang parameter lingkungannya (terutama suhu dan salinitas perairan) cocok, sebagai tempat memijah. Dikatakan selanjutnya, kepiting bakau jantan setelah
melakukan perkawinan akan tetap berada di perairan hutan mangrove, tambak atau sela-sela perakaran mangrove.
Menurut Estampador (1949), perkembangan kepiting bakau dalam daur hidupnya dibagi atas tiga stadia, yaitu: stadia embrionik, stadia larva dan stadia pascalarva). Secara lebih detil Motoh (1977), menyatakan bahwa perkembangan kepiting bakau (Scylla serrata) mulai dari telur hingga mencapai dewasa mengalami beberapa tingkat perkembangan, yaitu: stadia zoea, stadia megalopa, stadia kepiting muda (juvenil) dan stadia kepiting bakau dewasa.
Setelah telur menetas di perairan laut, muncul larva tingkat I (zoea I) yang akan terus menerus berganti kulit (moulting), kemudian terbawa arus ke perairan pantai, hingga mencapai stadia zoea V. Proses ini memerlukan waktu minimal 18 hari. Setiap kali pergantian kulit zoea tumbuh dan berkembang, yang antara lain ditandai oleh penambahan setae renang pada endopod maxilliped-nya (Warner 1977). Zoea V kemudian akan mengalami pergantian kulit menjadi megalopa, yang bentuk tubuhnya sudah mirip dengan kepiting dewasa, kecuali masih memiliki bagian ekor yang panjang. Menurut Motoh (1977), megalopa yang lebih mirip kepiting dewasa sering dirujuk sebagai kepiting pada stadia pascalarva. Proses perkembangan dari stadia megalopa ke stadia kepiting bakau muda (juvenil), memerlukan waktu antara 11-12 hari. Kepiting bakau muda akan bermigrasi kembali ke hulu estuari, kemudian berangsur-angsur memasuki hutan mangrove, hingga berkembang menjadi kepiting bakau dewasa. Gambaran daur hidup kepiting bakau tersaji pada Gambar 2.
2.2.4 Sistem Neurosecretory Tangkai Mata
Kepiting bakau memiliki sepasang mata. Mata kepiting bakau dilengkapi dengan tangkai dan menempel pada bagian tepi anterior karapaks, tepat di sisi kiri dan kanan bagian dahi karapaks. Tangkai pada mata kepiting bakau, memungkinkan kedua mata dapat digerakan dengan leluasa ke segala arah (Warner 1977). Tangkai mata kepiting bakau akan dimasukan dan ditempelkan rapat-rapat di dalam rongga mata, bila ada gangguan dari luar. Bila diamati melalui bagian ventral tubuh, maka terlihat jelas bahwa diantara kedua mata terdapat mulut. Sistem neurosecretory yang berasosiasi dengan optic ganglia sangat kompleks. Sistem neurosecretory dibentuk oleh organ-X, yaitu:
sekumpulan sel neurosecretory yang berasosiasi dengan tiap ganglion pada optic ganglia, saluran sinus gland dan sinus gland (Carlisle & Passano 1953).
Proses kawin (kopulasi)
Proses penetasan telur
Masa telur yang menempel pada rambut di pleopod betina
Zoea tingkat I - V Megalopa / juvenil
Kepiting muda
Proses percumbuan (berpasangan/doublers)
Proses ganti kulit (moulting) pada individu betina
Peningkatan salinitas
Hutan mangrove Estuari Laut
Gambar 2 Skema daur hidup kepiting bakau (Scylla serrata) yang diadaptasikan dari Soim (1999)
Menurut Johnson (1980), sel-sel neurosecretory pada jaringan tangkai mata kepiting biru (Callinectes sapidus) adalah sel-sel besar yang berukuran sekitar 20-100 µm. Sel-sel ini memiliki sebuah inti (nukleus) pucat yang sangat besar dengan satu atau beberapa anak inti (nukleolus). Dikatakan selanjutnya bahwa kebanyakan sel neurosecretory memiliki chromatin bergranula kasar dan pada kepiting biru (Callinectes sapidus), sitoplasma dari sel-sel neurosecretory adalah basophilic atau neutrophilic.
Rao (1985) membuat gambaran sistem neurosecretory tangkai mata krustacea yang dimodifikasi dari Carlisle (1959), dan menyatakan bahwa kumpulan sel neurosecretory yang berasosiasi dengan medulla externa disebut organ-X medulla externa, kumpulan sel neurosecretory yang berasosiasi dengan medulla interna disebut organ-X medulla interna, kumpulan sel neurosecretory yang berasosiasi dengan medulla terminalis disebut organ-X medulla terminalis, sedangkan kumpulan sel neurosecretory yang berasosiasi pada bagian antara
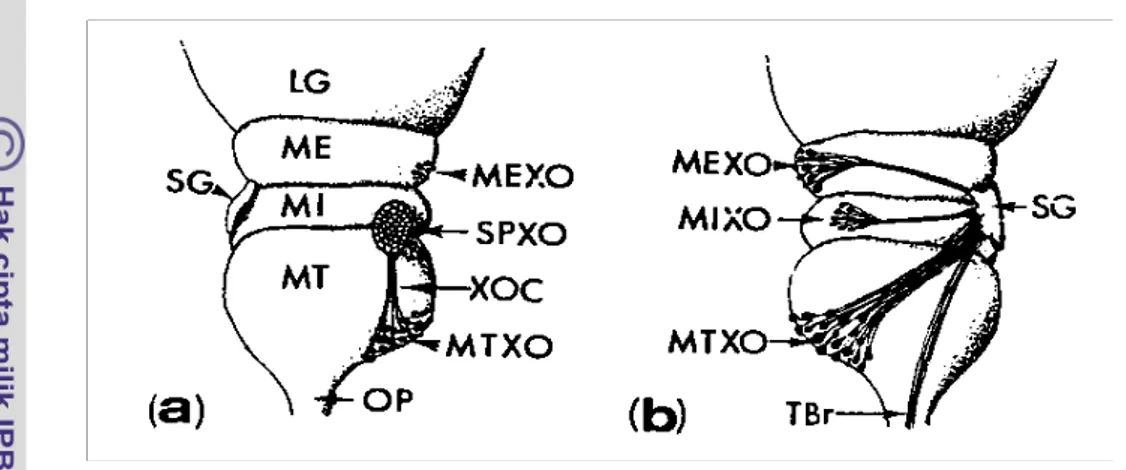
medulla interna dan medulla terminalis serta berada pada lokasi yang kurang lebih berhadapan dengan sinus gland disebut organ-X sensory pore. Diagram sistem neurosecretory pada tangkai mata krustasea tersaji pada Gambar 3.
Gambar 3 Diagram sistem neurosecretory pada tangkai mata krustasea menurut Rao (1985). (a) tampak dorsal (b) tampak ventral (LG: lamina ganglionaris, ME: medulla extrna, MI: medulla interna, MT: medulla terminalis, SG: sinus gland, MEXO: organ-Xmedulla externa, MIXO:: organ-X medulla interna, MTXO: organ-X medulla terminalis, XOC: Penghubung organ-X, SPXO: organ-X sensory pore, TBr: aliran syaraf dari otak, OP: tangkai mata
Menurut Shangguan dan Li (1994a; 1995) dalam Li et al. (1999), ada dua tipe sel neurosecretory yakni tipe B dan tipe C yang dapat dibedakan melalui karakter secretory. Dikatakan juga bahwa kedua tipe sel ini menghasilkan produksi hormon yang berbeda.
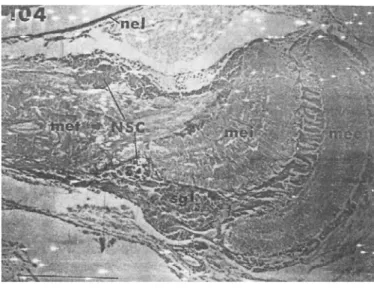
Johnson (1980), menyatakan bahwa serabut neuron (axon) dari organ-X mengalir menuju ke sinus gland. Serabut neuron akhir dari sel-sel neurosecretory yang mengarah kedalam sinus gland umumnya tebal dan bertekstur kasar, serta acidophilic dan Periodic Acid-Schiff (PAS) positif. Dikatakan selanjutnya bahwa sinus gland adalah organ neurohemal yang menyimpan dan mendistribusikan produk yang dihasilkan oleh sel-sel neurosecretory kedalam sirkulasi umum. Carlisle dan Passano (1953), juga menyatakan bahwa sinus gland merupakan tempat pertemuan berbagai neurofibra neurosecretory dengan vas sinusoidea yang membentuk organ neurochemal. Struktur jaringan tangkai mata blue crab (Calinectes sapidus) (Gambar 4), memperlihatkan posisi sel-sel neurosecretory dan posisi sinus gland yang berlokasi pada bagian atas samping (dorsolateral) antara medulla externa dan medulla interna (Johnson 1980).
Menurut Highnam dan Hill (1969), terdapat perbedaan struktur sel neurosecretory tangkai mata pada masing-masing kelompok krustasea. Pada
Lysmata seticaudata, organ-X terletak pada medulla terminalis; pada Palaemon serratus, terdapat dua buah organ-X, yang masing-masing terletak pada medulla externa dan medulla terminalis; sedangkan pada Gecarcinus lateralis terdapat dua buah organ-X, masing-masing terdapat pada medulla interna. Welsh (1961), menambahkan bahwa organ-X pada kelompok Brachyura terletak pada bagian dorsolateral tangkai mata, medulla externa, dan medulla interna. Sedangkan pada kelompok Natantia, organ-X terletak pada bagian distal medulla terminalis.
Gambar 4 Struktur jaringan tangkai mata blue crab (Callinectes sapidus). (Nel: neulirema, mee: medulla externa, mei: medulla interna, met: medulla interna, NSC: sel neurosecretory, sgl: sinus gland (Sumber: Johnson 1980)
Bullock dan Horidge (1965) dalam Johnson (1980), menyatakan bahwa organ-X menghasilkan beberapa hormon, diantaranya ovarium inhibiting hormone dan testis inhibiting hormone, atau yang disebut gonado inhibiting hormone (GIH), yang berfungsi secara langsung untuk menghambat perkembangan kelenjar androgen pada individu jantan, dan ovarium pada betina, sehingga spermatozoa atau ovum akan terhambat perkembangannya. Organ-X juga menghambat aktivitas organ-Y, yang terletak pada bagian kepala (chepalothorax), untuk menghasilkan gonado stimulating hormone (GSH), yang bekerja merangsang pembentukan spermatozoa pada jantan atau ovum pada betina.
2.2.5 Reproduksi
2.2.5.1 Organ Reproduksi
Organ reproduksi pada kepiting bakau jantan maupun betina merupakan organ berpasangan yang terletak pada bagian posterior thorax, dibawah
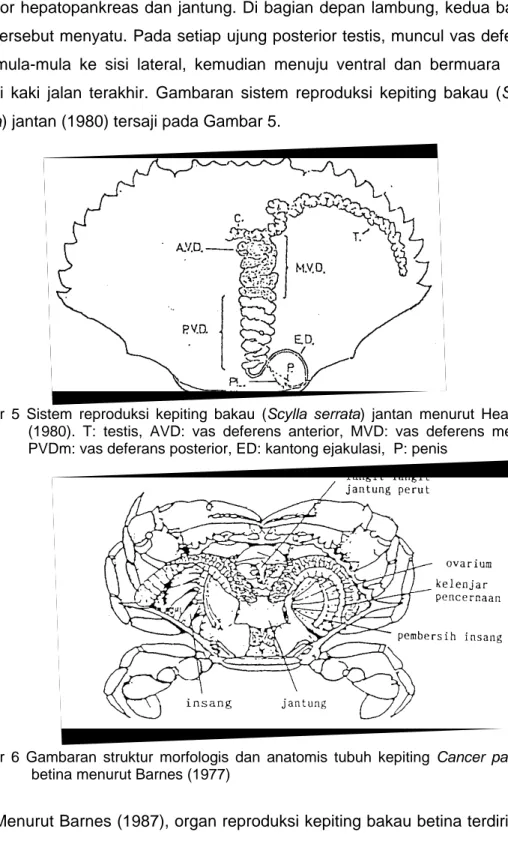
karapaks dan melintang pada bagian dorsal hepatopankreas. Organ reproduksi kepiting bakau jantan terdiri atas sepasang testis dan sepasang vas deferens. Testis berbentuk lonjong, berwarna putih dan terletak pada bagian atas bagian posterior hepatopankreas dan jantung. Di bagian depan lambung, kedua bagian testis tersebut menyatu. Pada setiap ujung posterior testis, muncul vas deferens yang mula-mula ke sisi lateral, kemudian menuju ventral dan bermuara pada tungkai kaki jalan terakhir. Gambaran sistem reproduksi kepiting bakau (Scylla serrata) jantan (1980) tersaji pada Gambar 5.
Gambar 5 Sis asman
(1980). T: testis, AVD: vas deferens anterior, MVD: vas deferens median, PVDm: vas deferans posterior, ED: kantong ejakulasi, P: penis
tem reproduksi kepiting bakau (Scylla serrata) jantan menurut He
ambar 6 Ga s
enurut Barnes (1987), organ reproduksi kepiting bakau betina terdiri atas sepas
G mbaran struktur morfologis dan anatomis tubuh kepiting Cancer paguru betina menurut Barnes (1977)
M
sepasang wadah sperma (spermatheca). Ovarium adalah organ berupa badan berbentuk sabit, terletak melintang pada bagian dorsal hepatopankreas. Struktur morfologis ovarium bervariasi, sesuai dengan umur dan tingkat perkembangannya. Oviduct muncul dari bagian pertengahan ovarium. Pada bagian sisi terluar oviduct terdapat wadah penyimpanan sperma (spermatheca). Ujung oviduct dan spermatheca berbentuk corong, yang mengarah menuju ke bagian ventral tubuh secara vertikal, dan bermuara pada bukaan kelamin yang terletak pada thorachic sternum. Gambaran struktur morfologis dan anatomis tubuh kepiting Cancer pagurus betina yang memperlihatkan posisi gonad (ovarium) tersaji pada Gambar 6.
2.2.5.2 Peranan Hormon dalam Reproduksi
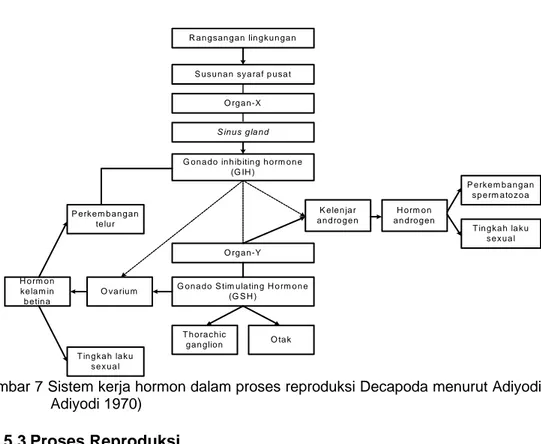
Neurohormon yang berperan dalam siklus pematangan gonad kepiting bakau adalah gonado inhibiting hormone (GIH), yang dihasilkan oleh organ-X serta dilepaskan oleh sinus gland ke sirkulasi darah, dan gonado stimulating hormone (GSH), yang dihasilkan oleh thoracic ganglion dan otak (Sirojini et al. 1995 dalam Fujaya 1996). Adiyodi dan adiyodi (1970), mengemukakan sistem kerja hormon dalam proses reproduksi Decapoda (Gambar 7), dan menyatakan bahwa kondisi lingkungan merupakan sumber rangsangan alami pertama yang mempengaruhi susunan syaraf pusat. Sebelum dilepaskan ke organ sasaran, GIH terlebih dahulu disimpan dalam sinus gland.
Fungsi GIH adalah secara langsung menghambat perkembangan kelenjar androgen pada individu jantan dan ovarium pada individu betina, sehingga spermatozoa atau ovum terhambat perkembangannya. Selain itu, GIH juga dapat mempengaruhi perkembangan gonad secara langsung, dengan cara menghambat aktivitas organ-Y. Padahal bila organ-Y bekerja aktif, akan dihasilkan GSH yang berfungsi merangsang kelenjar adrogen untuk menghasilkan hormon androgen, yang berfungsi merangsang testis untuk menghasilkan spermatozoa pada individu jantan, dan merangsang ovum untuk menghasilkan telur pada individu betina.
Selanjutnya Adiyodi dan Adiyodi (1970), mengemukakan bahwa apabila konsentrasi GSH meningkat dan konsentrasi GIH menurun dalam sirkulasi darah (hemolimfa) kepiting bakau, maka pematangan ovum akan segera berlangsung.
G on a do in hibitin g h o rm o n e (G IH )
G on a do S tim ula tin g H o rm o n e (G S H ) O rg a n-X S u s u na n sy a raf p u sa t R a n g s an g an lin gk u n ga n K ele n ja r an d ro g e n H o rm o n a n dro g en P erk e m b a ng a n s p e rm a to z o a T in g k a h la k u se xua l O rg a n-Y H o rm o n kela m in b etin a O va riu m P erk e m b a ng a n telu r T ing ka h la ku se xua l T h ora c hic ga n glio n O ta k S in u s g la nd
Gambar 7 Sistem kerja hormon dalam proses reproduksi Decapoda menurut Adiyodi dan Adiyodi 1970)
2.2.5.3 Proses Reproduksi
Waterman dan Chace (1960) dalam Heasman (1980), menyatakan bahwa krustasea pada umumnya bersifat dieocious, yakni memiliki kelamin yang terpisah. Berdasarkan struktur organ reproduksinya, kepiting (Branchyura) dapat dibagi atas dua kelompok. Pada kelompok Gymnopleura dan Dromlaceae, proses fertilisasi terjadi di luar tubuh (external fertilization), sedangkan pada kelompok Corystoldea, Oxystomata, Branchyncha, dan Oxyrhyncha, proses fertilisasi terjadi di dalam tubuh (internal fertilization). Scylla termasuk dalam kelompok Branchyncha, sehingga proses fertilisasinya berlangsung di dalam tubuh (Hartnoll 1969).
Menurut Ong (1966), fase-fase dalam proses reproduksi kepiting bakau dimulai dari proses transfer sperma (kopulasi) dan perkembangan ovarium yang berlangsung sekitar 30 hari, serta proses pemijahan, pembuahan, inkubasi dan penetasan telur yang berlangsung sekitar 17 hari. Hartnoll (1969), menyatakan bahwa proses perkembangan gonad dapat berlangsung apabila kepiting bakau betina telah mengalami proses kopulasi. Umumnya kepiting bakau yang siap untuk matang gonad adalah yang ukuran lebar karapaksnya berkisar antara 105-123 mm (Arriola 1940). Meskipun demikian Ong (1966), melaporkan bahwa
kepiting bakau dapat mencapai kematangan gonad pada ukuran lebar karapaks 99.1mm.
1 Proses Kopulasi
Kawin (kopulasi) atau proses transfer sperma, hanya terjadi pada kepiting bakau betina dan jantan yang telah dewasa kelamin. Kopulasi terjadi pada saat karapaks kepiting bakau betina masih dalam keadaan lunak, atau sesaat setelah proses moulting berlangsung. Kasry (1996), menyatakan bahwa kopulasi kepiting bakau pada umumnya terjadi pada saat suhu perairan naik. Proses ini diawali dengan peristiwa pengeluaran feromon ke dalam air oleh kepiting bakau betina sehingga mengundang kehadiran kepiting bakau jantan pasangannya untuk mendekatinya kembali. Kepiting bakau jantan akan melindungi kepiting bakau betina mulai proses moulting berlangsung hingga karapaks mengeras. Sesaat sebelum karapaks kepiting bakau betina mengeras, kepiting bakau jantan akan membantu membalikan tubuh kepiting bakau betina yang masih berkulit lunak, hingga berada dalam posisi terlentang, yaitu perut dan alat kelaminnya saling berhadapan. Pada saat itu, pleopod kepiting bakau jantan akan berfungsi sebagai alat kopulasi. Pleopod pertama dimasukan ke dalam bukaan kelamin betina, sedangkan pleopod kedua berperan untuk memompa kumpulan kantong sperma (spermathopore) (Hartnoll 1969).
Spermatophore yang ditransfer oleh kepiting bakau jantan akan disimpan di dalam wadah penyimpan sperma (spermatheca), yang terdapat pada tubuh kepiting bakau betina, sampai telur matang dan siap untuk dibuahi (Mardjono et al. 1994). Spermatophore yang tersimpan dalam spermatheca masih tetap hidup dan aktif selama beberapa bulan (Warner 1977). Heasman dan Fielder (1983), menyatakan bahwa sekali kopulasi, spermatozoa yang terdapat dalam spermatheca cukup untuk melakukan pembuahan dalam dua kali pemijahan atau lebih. Hal ini dikemukakan juga oleh Ong (1966), yang menyatakan bahwa kepiting bakau betina bertelur yang ditangkap di laut dan dipelihara di laboratorium, dapat memijah tiga kali dalam lima bulan tanpa melakukan proses moulting dan kopulasi lagi. Dikatakan pula bahwa proses kopulasi pertama kali dapat dilakukan oleh kepiting bakau dengan lebar karapaks antara 99.1-144.2 mm.
2 Proses Perkembangan Gonad
Menurut Warner (1977), dalam tubuh krustasea terdapat sistem syaraf khas yang sangat berbeda dengan organisme lainnya. Mata yang selain menjalankan fungsi utamanya sebagai organ penglihatan, juga merupakan lokasi dari organ-organ penunjang reproduksi. Pada tangkai mata kepiting bakau terdapat organ-X yang menghasilkan gonado inhibiting hormone (GIH), yang berfungsi secara langsung untuk menghambat perkembangan kelenjar androgen pada jantan dan ovarium pada betina sehingga spermatozoa atau ovum terhambat perkembangannya. Gonado inhibiting hormone juga menghambat aktifitas organ-Y sehingga bebas menghasilkan gonado stimulating hormone (GSH), yang bekerja merangsang pembentukan spermatozoa pada jantan atau ovum pada betina.
Perkembangan ovarium diawali oleh proses vitelogenesis, yakni proses pembentukan kuning telur yang ditandai dengan terjadinya deposisi vitelogenin ke dalam ovum. Vitelogenin disekresi ke dalam darah (hemolimfa) dan dibawa ke ovum untuk disintesis menjadi kuning telur. Yano (1992), menyatakan bahwa vitelogenin adalah bahan baku atau prekursor protein kuning telur yang disintesis untuk mematangkan sel telur (oocyte). Kuning telur akan menjadi sumber nutrien selama perkembangan embrio (Silversand et al. 1993). Sedangkan bahan baku dari vetelogenin adalah vitelin, yang disintesis oleh jaringan ekstraovarium dan dilepaskan ke dalam hemolimfa sebagai respons terhadap vitellogenin stimulating ovarian hormone (VSOH).
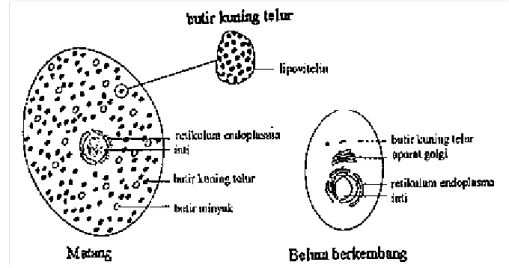
Vitelin pada krustasea adalah gabungan pigmen dengan lipoprotein yang berwarna jingga, serta mengandung 48% lemak, 50% protein dan 2% karbohidrat (Lee 1991). Konsentrasi lipovitelin akan terus meningkat menjadi komponen yang lebih besar, seiring dengan perkembangan kematangan ovarium dan sel telur (Lee & Walker 1995). Dikatakan selanjutnya bahwa umumnya akumulasi lipoprotein akan segera diikuti oleh akumulasi butiran minyak, yang pada krustasea akan nampak pada tingkat akhir vitelogenesis. Lipovitelin dan butiran minyak berupa komponen kecil yang ditemukan pada sel telur yang belum berkembang, dan konsentrasinya akan terus meningkat menjadi komponen besar pada sel telur matang (Lee & Walker 1995). Sedangkan menurut Lee dan Watson (1995), akumulasi lipoprotein akan diikuti oleh akumulasi butiran minyak.
Pada krustasea butiran-butiran minyak akan nampak pada tahap akhir vitelogenesis.
Butir-butir kuning telur disintesa dalam badan golgi dan retikulum endoplasma, sedangkan hepatopankreas merupakan sumber dari butir-butir minyak, yang dalam proses pembentukannya dibantu oleh sel-sel folikel yang berperan penting. Secara umum, hemolimfa juga memegang peranan penting dalam sintesa lipovitelin. Meusy dan Payen (1988), mengemukakan bahwa pada awal vitelogenesis, terbentuk sebuah pembungkus folikel yang mengelilingi tiap oocyte. Selanjutnya terbentuk jaringan berbentuk pipa (tubuler) yang menghubungkan semua ruang ekstraseluler. Jaringan ini memudahkan pengangkutan substansi dari hemolimfa ke oocyte. Jumlah jaringan tubuler tersebut akan menurun pada akhir vitelogenesis. Perkembangan telur selama
Gambar 8 Diagram sel telur matang dan sel telur belum Walker (1995)
proses vitelogenesis dapat dilihat pada Gambar 8.
berkembang menurut Lee dan
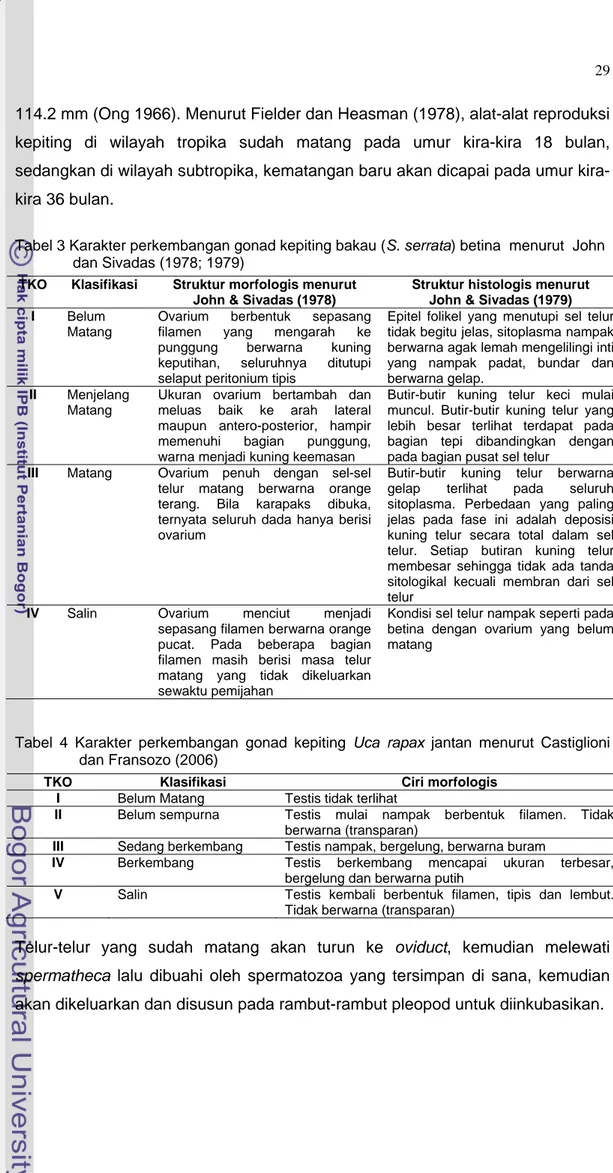
John dan Sivadas (1978; 1979), mengklasifikasikan kematangan gonad as empat tingkat yaitu belum matang, menjelang matang, atang dan salin (Tabel 3). Sedangkan Castiglioni dan Fransozo (2006), embagi tingkat kematangan gonad kepiting Uca rapax jantan atas lima tingkat aitu belum matang, belum sempurna, sedang berkembang, berkembang dan alin (Tabel 4). Tingkat kematangan gonad pada kepiting bakau (Scylla serrata) etina berbeda menurut umur dan ukuran tubuhnya (Escritor 1970). Kepiting akau yang dipelihara dalam kondisi laboratorium, untuk pertama kalinya matang
onad setelah berumur sebelas bulan dengan rata-rata lebar karapaks kepiting bakau betina at
m m y s b b G
114.2 mm (Ong 1966). Menurut Fielder dan Heasman (1978), alat-alat reproduksi i wilayah tropika sud
kepiting d ah matang pada umur kira-kira 18 bulan, sedan
Tabel 4 Karakter pe dan Franso
Telur-telur yang s
spermatheca lalu d tersimpan di sana, kemudian
akan dikeluarkan d untuk diinkubasikan.
gkan di wilayah subtropika, kematangan baru akan dicapai pada umur kira-kira 36 bulan.
Tabel 3 Karakter perkembangan gonad kepiting bakau (S. serrata) betina menurut John dan Sivadas (1978; 1979)
TKO Klasifikasi Struktur morfologis menurut John & Sivadas (1978)
Struktur histologis menurut John & Sivadas (1979) I Belum
Matang
Ovarium berbentuk sepasang filamen yang mengarah ke punggung berwarna kuning keputihan, seluruhnya ditutupi selaput peritonium tipis
Epitel folikel yang menutupi sel telur tidak begitu jelas, sitoplasma nampak berwarna agak lemah mengelilingi inti yang nampak padat, bundar dan berwarna gelap.
II Menjelang Matang
Ukuran ovarium bertambah dan meluas baik ke arah lateral maupun antero-posterior, hampir memenuhi bagian punggung, warna menjadi kuning keemasan
Butir-butir kuning telur keci mulai muncul. Butir-butir kuning telur yang lebih besar terlihat terdapat pada bagian tepi dibandingkan dengan pada bagian pusat sel telur
III Matang Ovarium penuh dengan sel-sel telur matang berwarna orange
Butir-butir kuning telur berwarna gelap terlihat pada seluruh terang. Bila karapaks dibuka,
ternyata seluruh dada hanya berisi ovarium
sitoplasma. Perbedaan yang paling jelas pada fase ini adalah deposisi kuning telur secara total dalam sel
sitologikal kecuali membran dari sel telu
telur. Setiap butiran kuning telur membesar sehingga tidak ada tanda
r
IV Salin Ovarium menciut menjadi Kondis pada
sepasang filamen berwarna orange pucat. Pada beberapa bagian filamen masih berisi masa telur matang yang tidak dikeluarkan sewaktu pemijahan
i sel telur nampak seperti betina dengan ovarium yang belum matang
rkembangan gonad kepiting Uca zo (2006)
rapax jantan menurut Castiglioni
udah matang akan turun ke ibuahi oleh spermatozoa yang
an disusun pada rambut-rambut pleopod
oviduct, kemudian melewati
TKO Klasifikasi Ciri morfologis
I Belum Matang Testis tidak terlihat
II Belum
p sempurna Testis mulai n berwarna (trans
ampak berbentuk filamen. Tidak aran)
III Sedang berkembang Testis nampak, bergelung, berwarna buram
IV Berkembang Testis berkem
bergelung dan b
bang mencapai ukuran terbesar, erwarna putih
V Salin Testis kembali
Tidak berwarna (transparan)
3 Proses Pemijahan
Telur-telur yang sudah matang akan dikeluarka ses pemijahan melalui oviduc dah sper a) yang berada pada bagian sisi luar oviduct, sehingga akan t atozoa yang tersimpan
dala perm emik
telah keluar dan menempel pada r elah terbuahi (zigote).
etelah dikeluarkan, massa telur akan dikumpulkan dan dilekatkan pada rambut-an brambut-anturambut-an sejenis perekat berwarna coklat (Kasry 1996).
4 Ink
ada telur kepiting pertama kali adalah n dalam pro
t melewati wa ma (spermathec erbuahi oleh sperm
m s atheca. Dengan d ian maka secara otomatis massa telur yang ambut-rambut pleopod, adalah massa telur yang yang t
Setelah telur hampir mencapai tingkat kematangan sempurna, kepiting bakau betina akan bermigrasi ke perairan laut untuk memijah, dan jumlah telur yang dikeluarkan dapat mencapai 1-8 juta butir, tergantung pada ukuran induk. S
rambut pleopod, deng
Selanjutnya diinkubasikan pada rambut-rambut pleopod. Saat menempel pada rambut-rambut pleopod, umumnya telur telah mencapai stadium blastula, dengan ukuran rata-rata 63 µm. Proses pemijahan yang meliputi pengeluaran sampai penyusunan massa telur pada rambut-rambut pleopod, berlangsung selama satu sampai satu setengah jam, dan proses ini umumnya berlangsung pada bagian perairan yang terlindung dan bersubstrat lumpur atau pasir.
ubasi Telur dan Penetasan Telur
Perkembangan telur (zigote) yang dierami selama masa inkubasi, dapat teramati melalui perubahan warna massa zigote, dari oranye menjadi coklat sampai kehitam-hitaman. Telur yang baru dikeluarkan berwarna oranye, karena masih mengadung kuning telur. Telur makin lama makin menghitam, seiring dengan berkurangnya volume kuning telur dan berkembangnya embrio. Warna hitam yang nampak umumnya disebabkan oleh bagian mata embrio. Sastry (1983) dalam Hastuti (1998), menyatakan bahwa perkembangan embrio krustasea pada umumnya dimulai dari tahap blastulasi, gastrulasi, penampakan pigmen, denyut jantung pertama kali, penampakan anggota badan dan ciri morfologis lainnya. Sedangkan menurut Warner (1977), p
Aratus pisori tahap perkembangan yang dapat terlihat
terbentuknya mata dan bintik pigmen setelah outline embrio terlihat, yang disusul oleh penampakan abdomen dan chepalothorax. Sementara Booltian et al. (1959) dalam Heasman (1980) membuat kriteria perkembangan embrio sebagai berikut
Tingkat I Tingkat II Tingkat III Tingkat IV Tingkat V Tingakt VI Tingkat VII Tingkat VIII
Menurut Hill et al. (1989), lama masa inkubasi kepiting Aratus pisori adalah 16 hari, pada kepiting biru (Callinectes sapidus), proses ini berlangsung selama 7-14 hari). Sedangkan proses inkubasi kepiting bakau (S.serrata), berlangsung antara 9-11 hari (Heasman 1980).
2.2.5.4 Siklus Reproduksi
Menurut Estampador (1949), daur hidup kepiting bakau dapat dibagi atas tiga tahap yaitu tahap embrionik, tahap larva dan tahap pascalarva. Sedangkan menurut Ong (1966) dan Motoh (1977), perkembangan Scylla serrata mulai dari telur hingga mencapai kepiting dewasa mengalami beberapa tingkat perkembangan. Tingkat perkembangan tersebut adalah zoea, megalopa, kepiting
uda
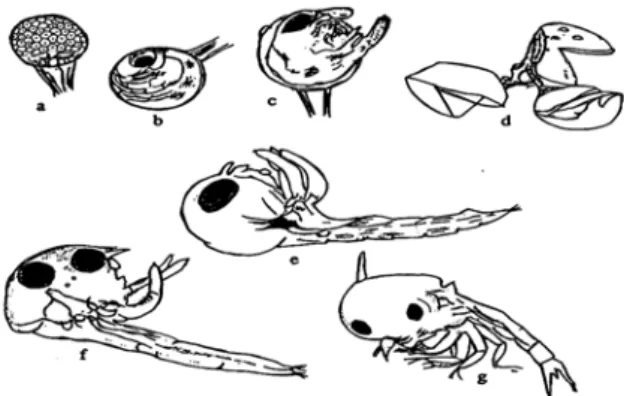
baru menempel pada rambut zoea, (e&f) Larva zoea I yang berenang bebas, (g) Larva
m dan kepiting dewasa. Telur akan menetas setelah 17 hari proses pemijahan, dan embrio dapat tetap berkembang meskipun induknya telah mati (Ong 1966). Perkembangan telur menjadi larva dapat dilihat pada Gambar 9.
Gambar 9 Perkembangan telur menjadi larva kepiting bakau (Scylla serrata) Menurut Arriola (1940). (a) Telur dalam fase blástula, (b) Zoea dalam telur yang belum dierami, (c) Zoea dalam telur yang baru menetas, (d) Kapsul telur yang
Tingkat IX
Tingkat X
: Pembelahan tidak nyata : Pembelahan nampak nyata
: Mulai terbentuk area bebas yolk berukuran kecil
: Area bebas yolk semakin terlihat nyata. Pigmen mata belum nampak
: Pigmen mata nampak nyata
: Nampak jalur-jalur pigmen tubuh (chromathophores). Mulai nampak denyut jantung
: Pigmen larva semakin nyata telihat. Denyut jantung sangat nyata
:Yolk semakin berkurang. Mulai terlihat getaran kaki.
:Yolk hampir tidak ada atau tidak ada sama sekali. Kaki terlihat bergerak
Pada fase awal, setelah telur kepiting bakau menetas akan muncul larva tingkat I (zoea I), yang terus menerus berganti kulit. Zoea I kemudian terbawa arus ke
erairan pantai, dan berkembang hingga mencapai tingkat zoea V. Tiap tingkat oea dibedakan oleh penambahan/perkembangan organ tubuh, baik organ enunjang kemampuan bergerak, maupun organ penunjang aktivitas makan ardjono et al. 1994). Hal ini dikemukakan pula oleh Warner (1977), bahwa ada tiap pergantian kulit, zoea tumbuh dan berkembang, yang ditandai oleh
g pada endopod maxilliped-nya.
Dalam perkembangan dari tingkat zoea I ke tingkat zoea selanjutnya,
punggung
thetes dan dua seta p
z p (M p
penambahan seta renan
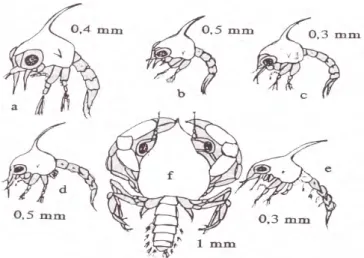
akan terjadi satu kali pergantian kulit melalui proses perobekan pada bagian tubuh. Proses tersebut membutuhkan waktu sekitr 18-20 hari (Ong 1966 & Warner 1977). Lavina dan Buling (1977), mendeskripsikan karakter perkembangan larva sebagai berikut: Larva kepiting bakau bersifat planktonik. Pada tingkat zoea I, tidak berwarna (transparan), dapat mencapai panjang 1.15 mm, duri-duri rostrum berukuran 0.35 mm, duri dorsal 0.48 mm dan duri lateral 0.19 mm. Mata menempel, antenne tidak bersegmen dan pendek. Antennula berduri dan panjang, exopodite antenne berupa duri pendek, serta memiliki seta yang panjang; pada tingkat zoea II, panjang tubuh mencapai 1.51 mm, duri rostrum 0.39 mm, duri dorsal 0.54 mm dan duri lateral 0.2 mm. Mata bertangkai, memiliki antenna dengan empat aes
pendek yang berbeda ukuran, memiliki antenne seperti yang dimiliki oleh kepiting bakau tingkat zoea I, tetapi lebih besar ukurannya; pada tingkat zoea III, panjang tubuh mencapai 1.93 mm, duri rostrum 0.52 mm duri dorsal 0.63 mm dan duri lateral 0.24 mm. Memiliki antenne seperti yang terdapat pada zoea tingkat II, tetapi lebih besar ukurannya; pada tingkat zoea IV, panjang tubuh mencapai 2.40 mm, duri rostrum 0.72 mm, duri dorsal 0.86 mm, dan duri lateral 0.28 mm. Antenne mempunyai aesthestes yang panjang dan dua seta serta subterminal; pada tingkat zoea V, panjang tubuh mencapai 3.43 mm, duri rostal 1.07 mm, duri dorsal 1.31 mm, dan duri lateral 0.32 mm. Memiliki antenne dengan aesthetes dalam tiga tingkatan, seluruh periopod bertambah panjang dan mulai bersegmen. Setelah melewati lima tingkat zoea dengan cara lima kali moulting, terbentuklah stadia megalopa (Brick 1974).
Proses pergantian kulit pada tingkat tingkat megalopa sama seperti yang terjadi pada tingkat zoea, yaitu melui proses perobekan pada bagian punggung cephalotorax dan abdomen (Warner 1977). Perkembangan kepiting bakau (Scylla serrata) pada tingkat larva hingga megalopa dapat dilihat pada Gambar 10.
zoea III, (d) Larva zoeaIV(e), Larva zoea V, (f) megalopa
bakau dewasa,
tetapi masih me ai tingkat
pascalarva. kepiting
bakau muda, memerlu kat juvenil
memerlukan kat dewasa dicapai
setelah me ase zoea.
1977).
.3 Habitat Kepiting Bakau
keberadaan piting bakau.
eng
Gambar 10 Perkembangan kepiting bakau (Scylla serrata) pada tingkat larva dan megalopa menurut Ong (1964) (a) Larva zoea I, (b) Larva zoea II, (c) Larva
Pada tingkat megalopa, bentuk tubuh sudah mirip kepiting miliki ekor yang panjang, sehingga sering dirujuk sebag Proses perkembangan dari tingkat megalopa ke tingkat kan waktu 11-12 hari (Moosa et al. 1985). Ting waktu kurang lebih 30-34 hari, sedangkan ting
ngalami moulting kurang lebih 20 kali sejak mulai dari f
Kepiting bakau mulai dewasa pada ukuran panjang karapaks 42.0 mm. (Lavina
2
Kualitas lingkungan adalah fakor penting yang dapat mempengaruhi dan pertumbuhan semua organisme termasuk ke
D an demikian maka di alam, kepiting bakau hanya akan menempati bagian-bagian perairan yang memiliki kondisi kualitas lingkungan yang mampu ditolelir olehnya. Untuk mengetahui habitat alami kepiting bakau, maka perlu diketahui toleransi kepiting bakau terhadap karakteristik kualitas lingkungan yang menjadi habitatnya.
2.3.1 Suhu
Menurut Queensland Department of Primary Industries (1989a), kepiting bakau dapat mentolelir perairan dengan kisaran suhu antara 12.0-35.0°C. Sedangkan menurut Baliao (1983), kepiting bakau dapat tumbuh cepat pada
23.0-32.0°C. Menurut Hill (1982); Hill et al. (1989); Queensl
a perairan dengan kisaran suhu 28.8°C-36.0°C (Wahyuni & Sunaryo ngkan di perairan Laguna Segara Anakan, kepiting bakau dijumpai pada
k memijah kepiting bakau mencari perair
urut Baliao (1983
perairan dengan kisaran suhu
and Department of Primary Industries (1989a), suhu air dapat mempengaruhi pertumbuhan, aktifitas dan nafsu makan kepiting bakau. Suhu air yang lebih rendah dari 20°C akan mengakibatkan aktifitas dan nafsu makan kepiting bakau menurun secara drastis. Pada saat itu pertumbuhan akan berhenti walaupun kepiting masih dapat tetap hidup.
Di perairan hutan mangrove Muara Dua Segara Anakan, kepiting bakau dijumpai pad
1981), seda
kisaran 13-40°C (Sulistiono et al. 1994). Toro (1987), menjumpai kepiting bakau pada perairan dengan kisaran suhu air 27.6-30.5°C. Pada perairan hutan mangrove Tanjung Pasir Tanggerang, kepiting bakau bakau dijumpai pada perairan dengan suhu rata-rata 28.8°C (Wahyuni & Ismail 1987), sedangkan pada perairan hutan mangrove Teluk Pelita jaya Seram Barat Maluku, kepiting dijumpai pada perairan dengan suhu air berkisar antara 26.0-30.5°C.
Brick (1974), menyatakan bahwa di Hawai, kepiting bakau betina bermigrasi untuk memijah ke perairan dengan kisaran suhu air antara 24-28°C (rata-rata 25°C), sedangkan di Thailand untu
an dengan suhu rata-rata 29.0°C (Varikul et al. 1970). Menurut Fielder dan Heasman (1978), perairan yang bersuhu tinggi cenderung akan meningkatkan pertumbuhan kepiting bakau sehingga waktu untuk mencapai dewasa menjadi singkat.
Suhu perairan juga dapat mempengaruhi tingkat perkembangan larva kepiting bakau. Tingkat zoea V pertama kali dapat dicapai dalam waktu 15 hari pada suhu air rata-rata 27.5°C (Ong 1964); 14-15 hari pada suhu air rata-rata 22.5°C (Brick 1974); 13-14 hari pada suhu air rata-rata 27°C (Motoh 1977); dan 14-18 hari pada suhu air rta-rata 27.0°C (Heasman 1980). Men
0, disamping kepadatan makanan, suhu perairan diduga berperan terhadap efisiensi pemanfaatan makanan dan peningkatan kelulushidupan larva kepiting
bakau. Dikatakan juga bahwa kepiting bakau tumbuh lebih cepat pada perairan dengan kisaran suhu 23-32°C.
2.3.2 Salinitas
lebih kecil dari 0.5‰), perairan payau (salinitas .5-30.0‰), perairan hypersaline (salinitas 40-80‰) dan brine water (salinitas
um kisaran salinitas yang dapat ditolelir oleh kepiting bakau cukup
Menurut Kinne (1964) dalam Sara (1994), salinitas perairan diduga mempengaruhi struktur dan fungsi organ organisme perairan, melalui perubahan tekanan osmotik, proporsi relatif bahan pelarut, koefisien absorsi dan kejenuhan kelarutan, kerapatan dan fiskositas, perubahan penyerapan sinar, pengantaran suara dan daya hantar listrik. Hal ini akan mengubah komposisi spesies pada situasi ekologis saat itu. Selanjutnya ditambahkan bahwa keanekaragaman organisme dan jumlah spesies akan mencapai maksimum pada perairan-perairan samudera (salinitas 30-40‰), dan kemudian berturut-turut menurun pada perairan tawar (salinitas
0
lebih dari 80‰).
Tiap fase dari siklus hidup suatu spesies membutuhkan kisaran salintas yang berbeda (Clark 1974). Hill et al. (1989), menyatakan bahwa salinitas perairan berpengaruh terhadap tiap fase kehidupan kepiting bakau, terutama pada saat ganti kulit. Walaupun demikian menurut Queensland Department of Primary Industries (1989a), kisaran salinitas yang ideal untuk pertumbuhan kepiting bakau belum dapat ditentukan, akan tetapi kepiting bakau pada tingkat zoea sangat sensitif terhadap perairan bersalinitas rendah. Sebaliknya kepiting bakau dewasa kawin dan mematangkan telurnya pada perairan dengan salinitas 15-20‰ dan kemudian beruaya ke perairan laut dalam untuk memijah (Kasry 1996).
Secara um
luas. Kasry (1996), melaporkan bahwa kepiting bakau dapat hidup pada kisaran salinitas yang lebih kecil dari 15‰ sampai lebih besar dari 30‰. Di Queensland, kepiting bakau dapat hidup pada kisaran salinitas 2-50‰, walaupun belum diketahui pengaruh nilai salinitas tersebut terhadap pertumbuhannya (Queensland Department of Primary Industries 1989a). Hill (1978), melaporkan bahwa Scylla serrta mampu mentolelir perairan dengan salinitas sampai 60‰. Wahyuni dan Ismail (1987), menjumpai kepiting bakau dewasa di perairan mangrove Tanjung Pasir, Tanggerang pada kisaran salinitas 0-18‰. Wahyuni
dan Sunaryo (1981) menjumpai kepiting bakau dewasa pada perairan mangrove Muara Dua Segara Anakan yang bersalinitas 2-34‰, sedangkan Retnowati (1991
lebar karapaks >15.0 cm dan 10.0-15.0 cm, dijumpai
melim
di erairan sekitar hutan mangrove ketika air laut surut. Larva kepiting bakau yang banyak dijumpai di sekitar estuaria dan hutan mangrove ),menjumpai kepiting bakau pada perairan mangrove Muara Kamal dengan kisaran salinitas 5-30‰.
Sirait (1997) melalui penelitiannya pada hutan mangrove RPH Cibuaya Karawang, melaporkan bahwa jenis Scylla oceanica berukuran antara 10.0-13.8 cm, menyukai perairan bersalinitas 18.4-27.8‰; jenis S. tranquebarica berukuran antara 6.2-9.9 cm menyukai perairan bersalinitas 8.9-18.4‰, sedangkan jenis S. tranquebarica berukuran 10.0-13.8 cm, banyak dijumpai pada perairan bersalinitas 18.4-27.8‰. Kepiting bakau jenis S. serrata berukuran antara 6.2-9.9 cm, menyukai perairan bersalinitas 8.9-18.3‰, sedangkan jenis S. serrata berukuran 10.0-13.8 cm, menyukai sebagian besar wilayah perairan yang disyaratkan bagi kepiting bakau secara umum. Pada perairan hutan mangrove Teluk Pelita Jaya Seram Barat Maluku Tengah, kepiting bakau jenis Scylla tranquebarica berukuran
pah pada perairan bersalinitas air dan salinitas substrat berturut-turut 26.7-31.5‰ dan 29.1-32.0‰. Sedangkan yang berukuran <10.0 cm, melimpah pada perairan bersalinitas air dan substrat berturut-turut sebesar 26.5‰ dan 27.1‰. Selain itu ditemukan juga jenis Scylla serrata dan S. oceanica dengan ukuran lebar karapaks <10.0 cm dan 10.0-15.0 cm, keduanya menyukai perairan bersalinitas air dan substrat berturut-turut sebesar 2.0-15.0‰ dan 2.7-16.3‰.
2.3.3 Kedalaman Air
Kedalaman air dipengaruhi salah satunya, oleh peristiwa pasang surut. Kedalaman air berpengaruh bagi kehidupan kepiting bakau pada saat terjadi kerkawinan. Walaupun demikian, kepiting bakau dapat hidup pada perairan yang dangkal. Wahyuni dan Ismail (1987), menjumpai kepiting bakau pada kedalaman 30.0-79.0 cm di perairan dekat hutan mangrove, dan 30.0-125.0 cm di muara sungai.
Hill (1978), menyatakan bahwa pada siang hari kepiting bakau terlihat menuju perairan yang dangkal, sedangkan Pirrene (1978), menyatakan bahwa di pulau-pulau Caroline bagian timur, kepiting bakau jenis S. serrata tertangkap p
karen
g membenamkan diri dalam substrat lumpur atau menggali lubang pada subst
i Laguna Talanca Cikaso Sukabumi, kepiting bakau dijumpai pada isaran pH 6.21-8.50. Selain itu, penelitian lain melaporkan bahwa kepiting bakau
perairan asam, yaitu pada daerah bersubstrat lumpur deng
a terbawa arus dan air pasang, akan menempel pada akar-akar mangrove untuk berlindung. Hutching dan Saenger (1987), menyatakan bahwa kepiting bakau pada stadia juvenil (first crab) mengikuti pasang tertinggi di zona intertidal untuk mencari makanan, kemudian kembali ke zona subtidal pada saat air surut. Sedangkan kepiting bakau dewasa merupakan penghuni tetap zona intertidal, dan serin
rat lunak. Pagcatipunan (1972), menyatakan bahwa kepiting bakau sebelum moulting (premoult), membenamkan diri dalam lumpur atau masuk kedalam lubang, sampai karapaksnya mengeras. Dengan demikian kemungkinan besar untuk mendapatkan kepiting bakau yang memiliki karapaks yang lunak, adalah dengan mencarinya pada bagian hutan mangrove yang bersubstrat dasar lumpur.
2.3.4 Derajat Keasaman
Perairan yang mempunyai substrat lumpur cendrung mempunyai pH asam. Sedangkan perairan yang substratnya banyak mengandung kalsium dalam bentuk CaCO3, bersifat basa (Clough et al. 1983). Dari hasil penelitian Sudiarta (1988), dikatakan bahwa kisaran pH antara 7.9-8.3 dapat mendukung kehidupan kepiting bakau yang dipelihara. Wahyuni dan Sunaryo (1981), menambahkan bahwa pada perairan mangrove Segara Anakan Cilacap, kepiting bakau dijumpai pada kisaran pH 6.16-7.50,sedangkan di pertambakan Muara Kamal, kepiting bakau dijumpai pada kisaran pH 7.0-8.0 (Retnowati 1991). Menurut Hutasoit (1991), d
k
dapat hidup pada kondisi
an pH rata-rata 6.16 (Toro 1987); kisaran nilai pH 6.5-7.0 (Walsh 1967); dan pada perairan dengan pH rata-rata 6.5 (Wahyuni & Ismail 1987).
2.3.5 Fraksi Substrat
Fraksi substrat di sekitar hutan mangrove umumnya terdiri atas lumpur dan liat. Hal ini dimungkinkan karena partikel lumpur dan liat dapat mengendap cepat akibat gerakan air di sekitarnya yang relatif tenang dan terlindung (Clough et al. 1983). Substrat di hutan mangrove sangat mendukung kehidupan kepiting bakau, terutama untuk melangsungkan perkawinan. Menurut Snedaker dan Getter
(1985), habitat kepiting bakau adalah pada perairan intertidal (dekat hutan mangrove) yang bersubstrat lumpur. Substrat di dalam dan di sekitar hutan mangrove yang didominasi oleh kandungan lumpur, mengandung banyak bahan organik yang berasal dari serasah mangrove, yang terurai membentuk partikel detritus yang kemudian akan mengendap pada substrat (Robertson 1988).
upakan makanan alami kepiting bakau seperti yang dikem
2.4 P
i kemampuan untuk enangkap ikan. Oleh sebab itu, Pagcatipunan (1972); Hill (1976); Hutching dan
piting bakau dewasa merupakan pemakan u organisme yang bergerak lambat seperti bivalva, siput, serta jenis kepiting kecil lainnya, kumang (hermit crab), cacing, serta jenis-jenis gastr
Serasah dikenal mer
ukakan oleh Moosa et al. (1985).
Substrat halus (lumpur dan liat) yang mengandung banyak serasah dan bahan organik, juga mendukung kehidupan berbagai organisme, terutama organisme pemakan detritus dari kelompok gastropoda (Ellobiidae & Potamididae). Gastropoda diketahui merupakan salah satu makanan alami kepiting bakau berdasarkan hasil penelitian Opnai (1986), yang menyatakan bahwa 89% isi lambung kepiting bakau adalah bivalva, gastropoda dan moluska lainnya. Dengan demikian dalam kaitannya dengan kehidupan dan distribusi kepiting bakau, kandungan substrat dasar perairan hutan mangrove merupakan faktor pendukung penting, karena mempengaruhi kehidupan dan distribusi moluska yang merupakan makanan alami kepiting bakau.
akan dan Tingkah Laku Makan 2.4.1 Jenis Pakan
2.4.1.1 Pakan alami
Menurut Chen (1976) dan Lavina (1977), kepiting bakau mempunyai sifat tidak memilih-milih pakan, dan dapat makan segala jenis makanan seperti isi perut dan daging ikan, isi perut hewan, siput, kulit kodok, daging kerang-kerangan, sampah dapur, atau sisa-sisa makanan lainnya. Chen (1976), menyatakan bahwa kepiting pada fase megalopa bersifat karnivora, dan setelah dewasa bersifat omnivorous scavenger. Dalam kondisi alami, kepiting bakau jarang sekali memakan ikan karena tidak mempunya
m
Saenger (1987) menyatakan bahwa ke organisme bentos ata
opoda dan krustasea. Opnai (1986), menyatakan bahwa dari hasil pemeriksaan isi lambung kepiting bakau di perairan hutan mangrove Purari dan
Aird Deltas (Papua New Guinea), ternyata 89% berisi bivalva, gastropoda dan moluska lainnya, serta 11% sisanya terdiri dari krustasea yang sulit diidentifikasikan. Sedangkan Gunarto et al. (1987) menyatakan bahwa 90% isi lambung kepiting bakau terdiri dari jenis-jenis alga (Spirogyra sp, dan Chara sp), larva insekta dan benih tiram.
Sulaeman dan Hanafi (1992) berdasarkan hasil penelitian terhadap kepiting bakau yang dipelihara dalam wadah pemeliharaan, menyatakan bahwa ransum ikan rucah yang diberikan pada kepiting bakau akan langsung diterkam dengan capitnya dan kemudian dicabik-cabik. Pakan yang hancur tidak semua dapat ditelan, sehingga sebagian pakan akan buyar di dalam air dan mengendap di dasar wadah. Hutching dan Saenger (1987), menyatakan bahwa kepiting bakau hidup di sekitar hutan mangrove dan memakan akar-akarnya (pneumatophore). Sedangkan Hill (1978) menyatakan bahwa perairan di sekitar hutan mangrove sangat cocok untuk kehidupan kepiting bakau, karena sumber makanannya seperti bentos dan serasah cukup tersedia. Hal senada dikemukakan juga oleh Sned
an untuk pertumbuhan jaringan dan organ; pemberian lemak ditujukan sebagai komponen utama dari kuning telur, dan berperan dalam metabolisme an aktivitas ganti kulit; sedangkan pemberian karbohidrat aker dan Getter (1985) serta Moosa et al. (1985), bahwa kepiting bakau merupakan organisme bentik, yang memakan serasah, dan berhabitat pada perairan intertidal (dekat hutan mangrove) yang bersubstrat lumpur. Perairan Segara Anakan Cilacap, yang banyak mengandung moluska dan tiram, merupakan habitat yang baik bagi kehidupan kepiting bakau (Toro 1979 & Toro 1987).
2.4.1.2 Pakan buatan
Kepiting bakau merupakan organisme pemakan segala jenis makanan (ominvorous). Di alam, terutama pada ekosistem mangrove, kepiting bakau mudah menemukan pakan alaminya. Meskipun demikian, untuk tujuan pemeliharaan dan pembesaran, kepiting bakau biasanya juga diberikan pakan buatan. Untuk tujuan pematangkan ovarium kepiting bakau, Salam et al. (1990) dalam Fattah (1998), memberikan hati sapi yang mengandung kolesterol tinggi. Pada krustasea, pemberian protein yang mengandung asam amino esensial, diperluk
dibut
), menunjukkan bahwa pemberian ikan teri rebus dapat meng
nisme pemakan segala ngkai (omnivorous-scavenger), pemakan sesama jenis (cannibal), pemakan u, bambu, dan benda-benda lain yang membusuk. uhkan sebagai sumber energi, yang juga berfungsi sebagai bahan baku sintesa kitin.
Millamena et al. (1986) dalam Fattah (1998), menyatakan bahwa untuk formulasi pakan buatan kepiting bakau, digunakan daging cumi-cumi, daging kepala udang dan daging ikan. (Rusdi 1993), melaporkan bahwa pemberian kombinasi pakan ikan lemuru dan kerang laut dengan perbandingan 1:1, akan mempercepat laju pematangan gonad (ovarium) kepiting bakau, dibandingkan dengan pemberian ikan rucah, cumi-cumi dan kerang, ikan lemuru serta kombinasi ikan lemuru dan cumi-cumi. Dilaporkan selanjutnya bahwa penambahan tepung udang, tepung cumi-cumi atau kerang hijau dapat meningkatkan daya pikat pakan. Sedangkan hasil penelitian Bonga (1992) dalam Fattah (1998
hasilkan pertumbuhan yang lebih cepat dari pada pemberian usus ayam dan ikan teri segar pada pakan buatan kepiting bakau.
2.4.2 Tingkah Laku Makan
Kasry (1996), menyatakan bahwa pada tingkat larva, kepiting bakau termasuk pemakan plankton. Queensland Department Of Primary Industries (1989b), menyatakan bahwa makanan larva kepiting bakau di alam terdiri dari berbagai organisme planktonik seperti diatom, moluska dan cacing; pada tingkat kepiting muda, jenis makanan alami kepiting bakau adalah ikan-ikan kecil, udang dan moluska, terutama kerang-kerangan; sedangkan pada tingkat dewasa, kepiting bakau merupakan organisme pemakan bangkai (scavenger). Arriola (1940), meyatakan bahwa kepiting bakau adalah orga
ba
algae, sisa-sisa potongan kay
Menurut Kasry (1996), capit (chela) kepiting bakau yang besar dan kuat memungkinkannya untuk menyerang musuh, atau merobek-robek makanannya. Sobekan-sobekan makanan tersebut akan dibawa ke mulut dengan bantuan kedua capitnya. Waktu makan kepiting bakau tidak teratur, tetapi umumnya lebih aktif di malam hari daripada di siang hari. Sehingga kepiting bakau tergolong sebagai hewan noktural, yang aktif di malam hari (Queensland Departement of Primary Industries, 1989b). Hal senada dikemukakan oleh Hill (1976) dan Rajinder et al. (1976), bahwa kepiting bakau aktif mencari makan pada malam
hari, terutama pada periode bulan gelap. Aktivitas mencari makan dilakukan lebih dari satu kali dalam semalam. Hal ini terbukti dari frekwensi pengisian lambung kepiting bakau yang dapat berlangsung beberapa kali.