SKRIPSI
IDENTIFIKASI SENYAWA ASAM FENOLAT PADA SAYURAN INDIGENOUS INDONESIA
Oleh:
RIZA ARIS APRIADY F24050276
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
IDENTIFIKASI SENYAWA ASAM FENOLAT PADA SAYURAN INDIGENOUS INDONESIA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh:
RIZA ARIS APRIADY F24050276
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Identifikasi Senyawa Asam Fenolat pada Sayuran Indigenous Indonesia
Nama : Riza Aris Apriady NIM : F24050276
Menyetujui Dosen Pembimbing,
Dr. Ir. Nuri Andarwulan, M.Si. NIP: 19630701.198811.2.001
Mengetahui, Ketua Departemen,
Dr. Ir. Dahrul Syah NIP: 19650814.199002.1.001
Riza Aris Apriady. F24050276. Identifikasi Senyawa Asam Fenolat pada
Sayuran Indigenous Indonesia. Di Bawah Bimbingan Dr. Ir. Nuri Andarwulan, M.Si.
ABSTRAK
Jawa Barat merupakan salah satu provinsi penghasil sayur-sayuran yang memiliki peran cukup signifikan dalam menghasilkan jenis sayur-sayuran di Indonesia. Spesies sayuran asli Indonesia yang berasal dari daerah/wilayah/ekosistem tertentu, termasuk spesies pendatang dari wilayah geografis lain tetapi telah berevolusi dengan iklim dan geografis wilayah Indonesia dinamakan sayuran indigenous. Beberapa balai penelitian seperti Balai Penelitian Tanaman Sayuran (Balitsa) bekerjasama dengan Asian Vegetables Research Development Center (AVRDC) telah melakukan pendataan terhadap sayuran ini terutama yang mempunyai kandungan gizi dan non gizi yang bermanfaat secara fisiologis bagi tubuh manusia yaitu vitamin A, zat besi, dan antioksidan.
Antioksidan merupakan senyawa yang sangat baik untuk menangkap radikal bebas. Keberadaan senyawa antioksidan ini akan mencegah penyakit kanker maupun penyakit degeneratif lainnya. Salah satu senyawa antioksidan yang penting yaitu senyawa polifenol. Senyawa polifenol yang ada di sayuran, buah-buahan, dan teh dapat mencegah penyakit degeneratif termasuk kanker melalui aktivitas antioksidatif dan/atau modulasi fungsi beberapa protein.
Salah satu senyawa polifenol yang banyak terdapat pada sayuran yaitu flavonoid dan asam fenolat. Senyawa asam fenolat (phenolic acids) mendapatkan perhatian yang lebih dalam beberapa tahun terakhir ini karena pengaruhnya untuk kesehatan manusia. Sebagai polifenol, asam fenolat merupakan antioksidan yang sangat kuat dan memiliki aktivitas antibakteri, antivirus, antikarsinogenik, antiinflamasi, dan aktivitas vasodilatory. Selain itu asam fenolat juga mempunyai peranan untuk melindungi dari kanker dan penyakit jantung.
Penelitian ini meneliti kandungan asam fenolat (asam klorogenat, asam kafeat, dan asam ferulat) pada dua puluh empat jenis sayuran indigenous Indonesia yang berasal dari Jawa Barat yaitu kenikir, kecombrang, kemangi, katuk, pohpohan, ginseng, takokak, lembayung, terubuk, labu siam, pepaya, mete, pakis, beluntas, mangkokan putih, mangkokan, kendondong cina, antanan, antanan beurit, krokot, turi, kelor, dan mengkudu. Bagian tanaman yang digunakan untuk penelitian ini bisa berupa daun, batang, dan seluruh bagian tanaman. Penelitian ini dilakukan dalam beberapa tahap yaitu persiapan sampel, pembuatan kurva standar dan Limit of Detection (LOD), analisis asam fenolat dengan HPLC, serta analisis statistik. Analisis asam fenolat dengan HPLC dilakukan secara dua ulangan duplo. Analisis statistik yang digunakan yaitu uji Tukey pada taraf α 5%, uji T pada taraf α 1%, dan principal component analysis (PCA).
Hasil penelitian ini mendapatkan data kisaran asam klorogenat 0.08–47.02 mg per 100 gram sampel segar, asam kafeat 0.36 – 8.65 mg per 100 gram sampel segar, dan asam ferulat 0.09– 5.02 mg per 100 gram sampel segar.
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 7 April 1987, penulis adalah anak pertama dari Bapak Drs. Nazarudin, SH dan Sundari. Penulis memiliki dua orang adik perempuan yaitu Riska Pahyuni dan Ririn Wirdayani. Penulis menempuh pendidikan sekolah dasar di SD Negeri 1 Bukit, Musi Banyuasin, Sumatra Selatan pada tahun 1993-1999, pendidikan lanjutan tingkat pertama di SLTP Negeri 22 Bandar Lampung pada tahun 1999-2002, dan pendidikan lanjutan tingkat atas di SMU Negeri 2 Bandar Lampung pada tahun 2002-2005.
Penulis diterima di Institut Pertanian Bogor melalui jalur SPMB pada tahun 2005. Penulis diterima di Departemen Ilmu dan Teknologi Pangan IPB pada tahun 2006 setelah melalui satu tahun TPB (Tahap Persiapan Bersama). Selama menjadi mahasiswa di IPB (Institut Pertanian Bogor). Penulis aktif di berbagai kegiatan baik kegiatan akademik maupun kegiatan ektrakurikuler.
Pada bidang akademik, penulis aktif dalam mengikuti berbagai lomba baik nasional maupun internasional di antaranya juara 3 dunia dalam lomba DSDC (Developing Solutions for Developing Countries Competition) di Anaheim, California pada bulan Juni 2009 dan mendapatkan penghargaan dari Menteri Pertanian RI terkait dengan prestasi internasional (DSDC), juara 1 debat bahasa Inggris IPB pada tahun 2007 dan 2008, finalis IEC (Innovative Entrepreneur Challenge) pada tahun 2008, mendapatkan pendanaan dari DIKTI dalam lomba program kreativitas mahasiswa, mendapatkan pendanaan dari IPB dalam program pengembangan kewirausahaan mahasiswa. Selain lomba penulis juga menjadi presenter dalam 37th International Forestry Student Symposium 2009, presenter di National Students Conference UNIKA Soegijapranata Semarang 2008, mendapatkan beasiswa PPA pada tahun 2006, menjadi asisten praktikum kimia dan biokimia pangan, menjadi asisten praktikum teknologi pengolahan pangan. Penulis pernah mengikuti training ISO 9001:2000, ISO 22000:2005, dan Sitem Manajemen Halal, terlibat dalam The International Technical Forum for Cooperation and Exchange between Korea and Indonesia pada tahun 2009, penulis juga aktif dalam mengikuti seminar-seminar yang terkait dengan teknologi
pangan maupun kewirausahaan, di antaranya yaitu International Nano Food Science Technology Conference di Anaheim, California pada tahun 2009, seminar Wirausaha Muda Mandiri 2009, dan seminar Nasional Ketahanan Pangan Bangsa. Pada bidang ekstrakurikuler penulis merupakan anggota dari IFT (Institute of Food Technologist), HMPPI (Himpunan Mahasiswa Peduli Pangan Indonesia), HIMITEPA (Himpunan Mahasiswa Teknologi Pangan), penulis pernah mengkoordinatori bidang akademik dan kerohanian di KEMALA (Kesatuan Mahasiswa Lampung) pada periode tahun 2005-2006. Penulis juga pernah menjadi ketua FCC (Food Chat Club) pada periode tahun 2008-2009. Penulis aktif dalam kepanitiaan kegiatan nasional seperti menjadi wakil pada kegiatan the 7th National Students Paper Competition pada tahun 2008, menjadi PJK pada kegiatan BAUR 2007, dan menjadi penyuluh dalam kegiatan Penyuluhan Keamanan Pangan yang diselenggarakan oleh SEAFAST Center IPB. Dalam sela-sela kesibukan akademik dan penelitian, penulis menyibukkan dirinya dengan membuka café bersama teman-temannya, café tersebut diberi nama FRIENDS 24 CAFÉ yang menjual produk-produk seafood olahan yang siap santap dan siap saji. Penulis melakukan penelitian dengan judul “IDENTIFIKASI
SENYAWA ASAM FENOLAT PADA SAYURAN INDIGENOUS
INDONESIA” sebagai syarat untuk meraih gelar sarjana. Penelitian ini
KATA PENGANTAR
Segala puji bagi Alloh Azza wa jalla yang telah memberikan kekuatan pada penulis sehingga skripsi dengan judul Identifikasi Senyawa Asam Fenolat Pada Sayuran Indigenous Indonesia dapat diselesaikan. Shalawat serta salam semoga selalu tercurah kepada baginda Rasululloh Muhammad SAW karena beliau telah membawa jalan yang terang benderang kepada manusia. Penulisan skripsi ini tidak terlepas dalam bantuan berbagai pihak, oleh karena itu penulis ingin menyampaikan terima kasih kepada:
1. Ayah, Ibu, Riska, dan Ririn yang selalu mendo’akan, memberikan nasihat, motivasi, kasih sayang, dan bantuan materil.
2. Ibu Dr. Ir. Nuri Andarwulan, M.Si selaku dosen pembimbing akademik yang telah memberikan nasihat, motivasi, dan masukan dalam pembuatan skripsi ini. 3. Dewi Kurniasih, Riska Rudiyanti Dewi selaku teman satu bimbingan yang selalu memberikan motivasi, masukan, dan do’a. Terima kasih atas kebersamaannya dalam menggapai cita-cita.
4. Teman-teman Friends 24 Cafe (Fahmi, Tiwi, Dilla, Widi, dan Widya). 5. Teman-teman kosan (Dimas, Erwin, Muji, Sobur, Deni, Tri Erza, dan Sigit). 6. Seluruh teman-teman ITP 42 yang telah bersama baik dalam keadaan senang
maupun duka selama lebih kurang tiga tahun.
7. Abah, mba Irin, mba Ria, dan kak Marto yang telah membantu penulis di Laboratorium SEAFAST Center IPB.
Penulis menyadari skripsi ini tidak lepas dari kesalahan. Oleh karena itu penulis minta maaf dan dengan senang hati menerima kritik dan saran dari berbagai pihak. Penulis berharap semoga skripsi ini dapat bermanfaat untuk kehidupan manusia.
Bogor, Januari 2010
Penulis
ii DAFTAR ISI KATA PENGANTAR. ... i DAFTAR ISI. ... ii DAFTAR TABEL. ... iv DAFTAR GAMBAR. ... vi DAFTAR LAMPIRAN. ... ix I. PENDAHULUAN. ... 1 A. LATAR BELAKANG. ... 1 B. TUJUAN. ... 3 C. MANFAAT. ... 3
II. TINJAUAN PUSTAKA. ... 4
A. SAYURAN INDIGENOUS. ... 4
B. ASAM FENOLAT (PHENOLIC ACID). ... 6
C. IDENTIFIKASI SENYAWA ASAM FENOLAT. ... 13
III. BAHAN DAN METODE. ... 16
A. BAHAN DAN ALAT. ... 16
1. Bahan. ... 16
2. Alat. ... 18
B. METODE. ... 18
1. Persiapan Sampel. ... 18
2. Pembuatan Kurva Standar dan Limit of Detection (LOD). ... 20
3. Analisis Asam Fenolat pada Sayuran. ... 21
4. Analisis Statistik. ... 23
IV. HASIL DAN PEMBAHASAN. ... 30
A. KURVA STANDAR ASAM FENOLAT DAN LIMIT DETEKSI. ... 30
1. Standar Asam Fenolat Bentuk Tunggal. ... 30
2. Limit Deteksi. ... 32
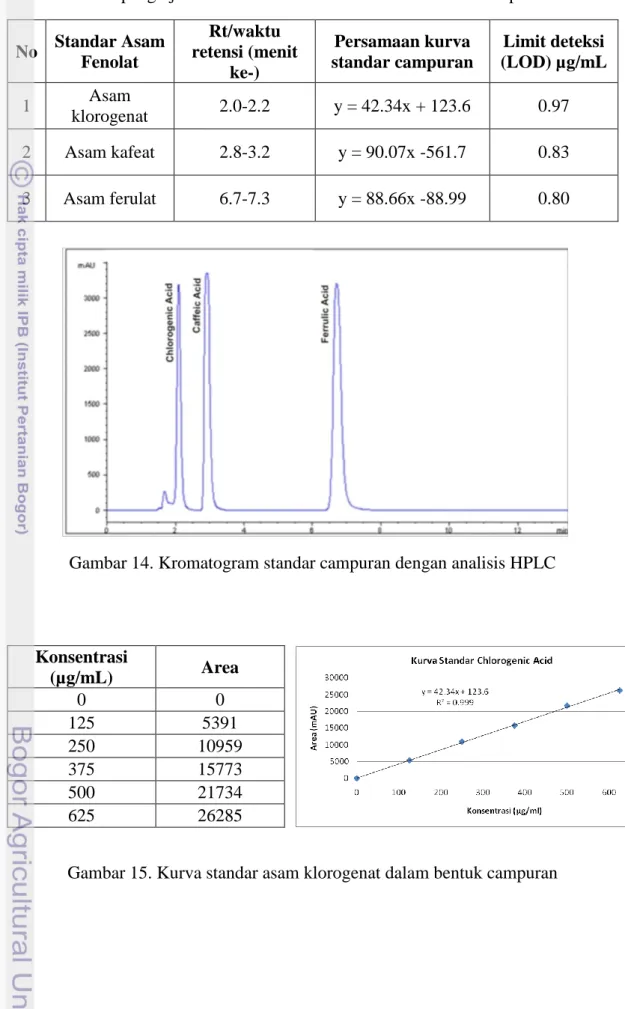
3. Standar Asam Fenolat Bentuk Campuran. ... 34
B. TOTAL FENOL. ... 36
C. ANALISIS ASAM FENOLAT PADA SAYURAN INDIGENOUS. ... 38
D. REKAPITULASI HASIL DAN SENYAWA YANG BELUM TERIDENTIFIKASI PADA SAYURAN INDIGENOUS. ... 96
iii
E. ANALISIS STATISTIK ...105
V. KESIMPULAN DAN SARAN. ...114
A. KESIMPULAN. ... 114
B. SARAN. ... 115
DAFTAR PUSTAKA. ...116
iv
DAFTAR TABEL
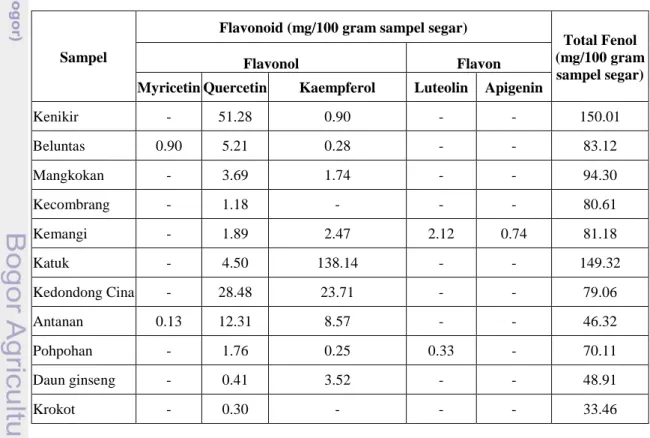
Tabel 1. Kandungan Senyawa Flavonoid Pada Sebelas Sayuran Indigenous
Jawa Barat (mg/100 gam sampel segar). ... 5
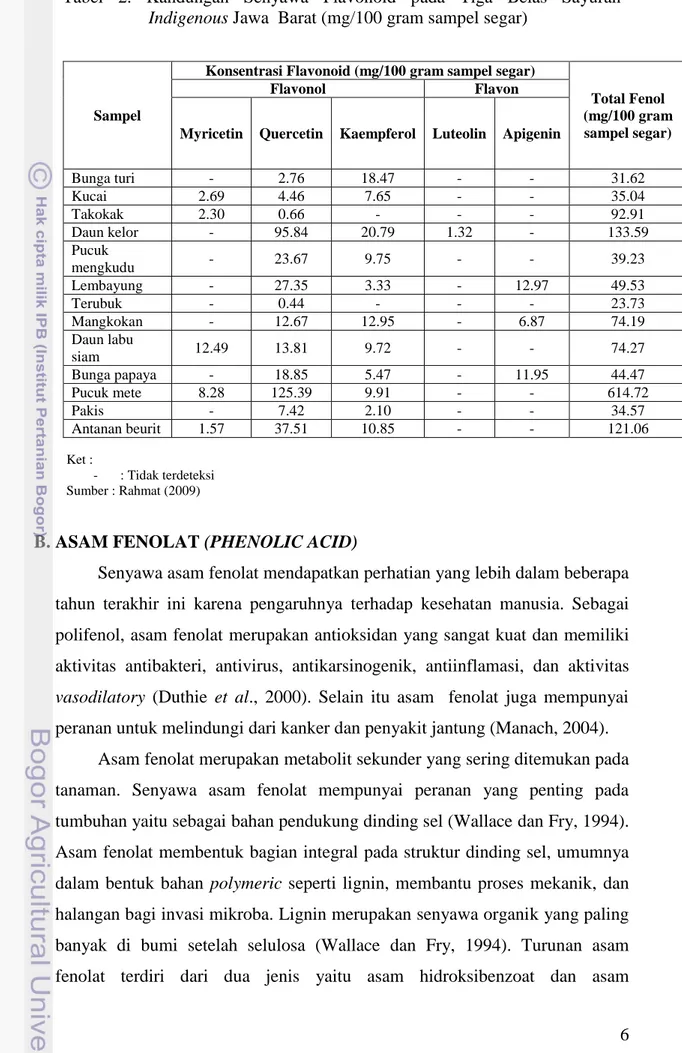
Tabel 2. Kandungan Senyawa Flavonoid Pada Tiga Belas Sayuran Indigenous Jawa Barat (mg/100 gam sampel segar). ... 6
Tabel 3. Dua Puluh Empat Jenis Sayuran Indigenous Indonesia. ... 17
Tabel 4. Perhitungan LOD Asam Klorogenat. ... 32
Tabel 5. Perhitungan LOD Asam Kafeat. ... 33
Tabel 6. Perhitungan LOD Asam Ferulat. ... 33
Tabel 7. Hasil Penginjeksian Standar Asam Fenolat dalam Bentuk Campuran. 35 Tabel 8. Total Fenol Sayuran Indigenous. ... 37
Tabel 9. Perhitungan Kandungan Asam Fenolat dengan Kurva Standar Campuran. ... 39
Tabel 10. Perhitungan Kandungan Asam Fenolat dengan Eksternal Standar Campuran. ... 40
Tabel 11. Perbandingan Perhitungan Kandungan Asam Fenolat antara Kurva Standar Campuran dan Eksternal Standar Campuran. ... 41
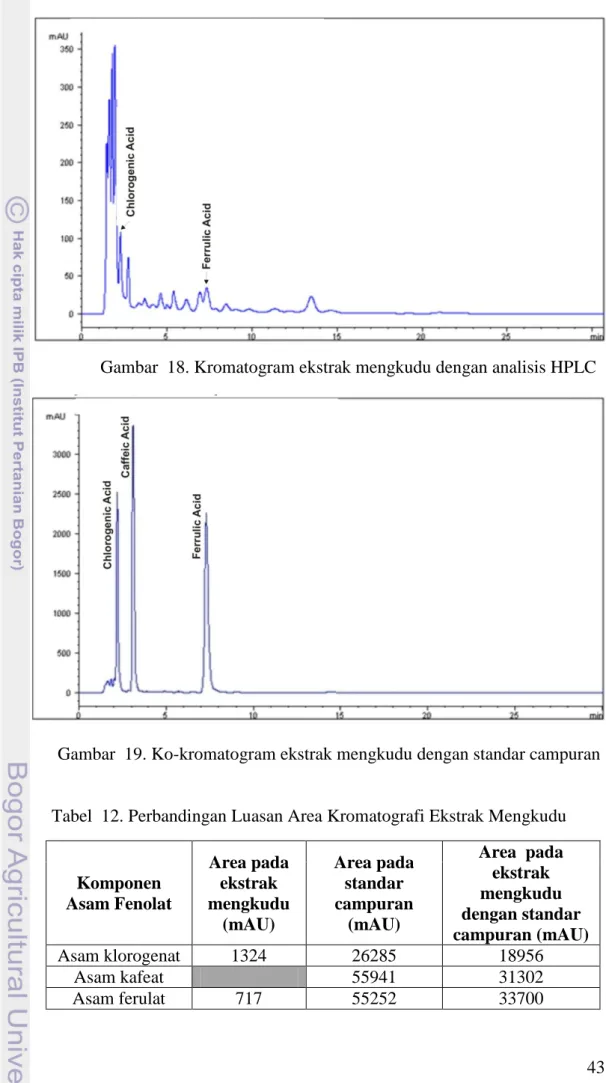
Tabel 12. Perbandingan Luasan Area Kromatografi Ekstrak Mengkudu. ... 43
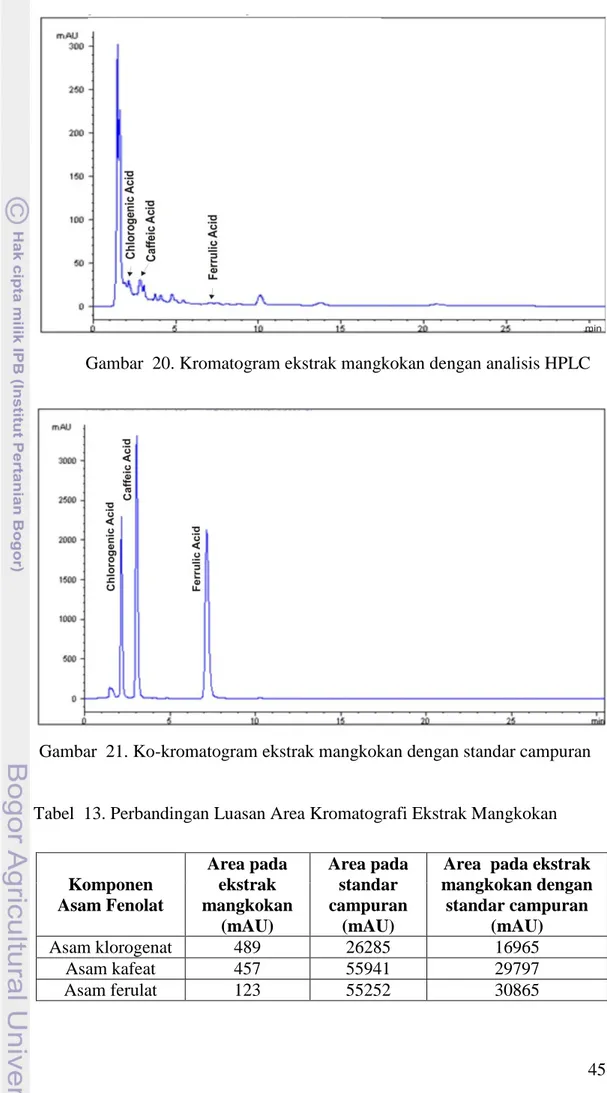
Tabel 13. Perbandingan Luasan Area Kromatografi Ekstrak Mangkokan. ... 45
Tabel 14. Perbandingan Luasan Area Kromatografi Ekstrak Daun Labu Siam. . 47
Tabel 15. Perbandingan Luasan Area Kromatografi Ekstrak Daun Lembayung. 49 Tabel 16. Perbandingan Luasan Area Kromatografi Ekstrak Daun Katuk. ... 52
Tabel 17. Perbandingan Luasan Area Kromatografi Ekstrak Daun Kemangi. .... 54
Tabel 18. Perbandingan Luasan Area Kromatografi Ekstrak Daun Pakis. ... 56
Tabel 19. Perbandingan Luasan Area Kromatografi Ekstrak Daun Pohpohan. ... 59
Tabel 20. Perbandingan Luasan Area Kromatografi Ekstrak Bunga Pepaya. ... 61
Tabel 21. Perbandingan Luasan Area Kromatografi Ekstrak Mangkokan Putih. 63 Tabel 22. Perbandingan Luasan Area Kromatografi Ekstrak Kenikir. ... 65
Tabel 23. Perbandingan Luasan Area Kromatografi Ekstrak Daun Kelor... 67
Tabel 24. Perbandingan Luasan Area Kromatografi Ekstrak Daun Kucai. ... 70
Tabel 25. Perbandingan Luasan Area Kromatografi Ekstrak Daun Jambu Mete. ... 72
v
Tabel 26. Perbandingan Luasan Area Kromatografi Ekstrak Buah Takokak. ... 74
Tabel 27. Perbandingan Luasan Area Kromatografi Ekstrak Antanan. ... 77
Tabel 28. Perbandingan Luasan Area Kromatografi Ekstrak Krokot. ... 79
Tabel 29. Perbandingan Luasan Area Kromatografi Ekstrak Antanan Beurit. ... 81
Tabel 30. Perbandingan Luasan Area Kromatografi Ekstrak Daun Ginseng. ... 83
Tabel 31. Perbandingan Luasan Area Kromatografi Ekstrak Bunga Kecombrang. ... 85
Tabel 32. Perbandingan Luasan Area Kromatografi Ekstrak Daun Beluntas. ... 88
Tabel 33. Perbandingan Luasan Area Kromatografi Ekstrak Bunga Turi. ... 90
Tabel 34. Perbandingan Luasan Area Kromatografi Ekstrak Terubuk. ... 92
Tabel 35. Perbandingan Luasan Area Kromatografi Ekstrak Kedondong Cina. .. 95
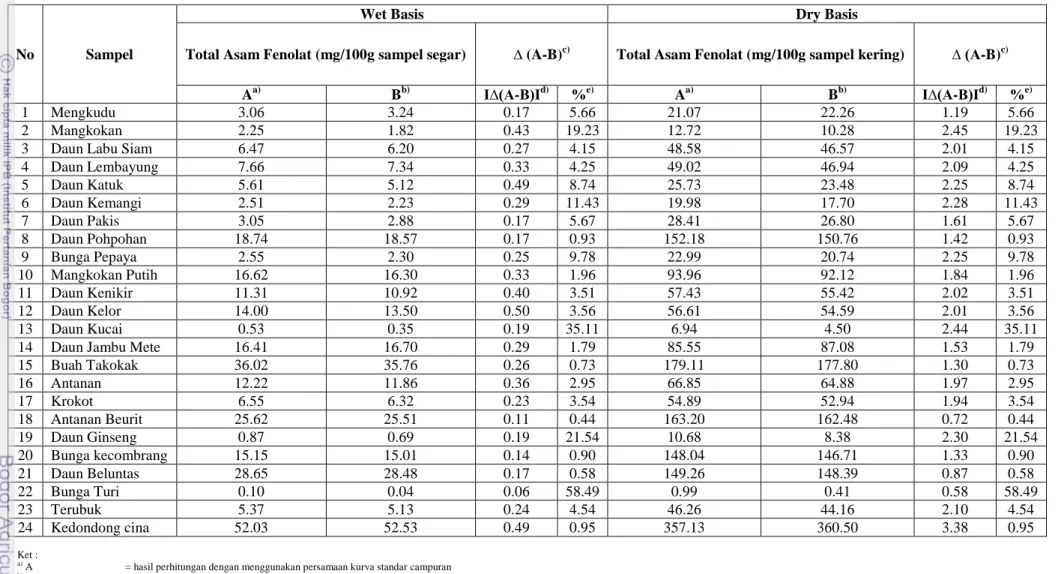
Tabel 36. Kandungan Asam Fenolat Pada Dua Puluh Empat Jenis Sayuran Indigenous Segar. ... 97
Tabel 37. Kandungan Asam Fenolat pada Dua Puluh Empat Jenis Sayuran Indigenous Berdasarkan Bagian yang diteliti. ... 98
Tabel 38. Rekapitulasi Kadar Air, Total Fenol, dan Asam Fenolat Sayuran Indigenous. ... 101
Tabel 39. Rekapitulasi Komponen yang Terdeteksi Pada Sampel Sayuran Indigenous Menggunakan HPLC. ... 103
Tabel 40. Rekapitulasi Area Unknown pada Waktu Retensi Tertentu. ... 104
Tabel 41. Uji T pada Perhitungan Kandungan Asam Fenolat antara Kurva Standar Campuran dan Eksternal Standar Campuran. ... 105
Tabel 42. Akar Ciri (Eigen Value), Proporsi, dan Kumulatif Keragaman dari Sembilan Variabel. ...107
Tabel 43. Matriks Korelasi Sembilan Variabel. ... 108
Tabel 44. Nilai-Nilai Vektor dari Hubungan antara Masing-Masing Variabel dengan Komponen Utama. ... 108
Tabel 45. Akar Ciri, Proporsi, dan Kumulatif Tiga Variabel...110
Tabel 46. Matriks Korelasi Total Fenol, Total Flavonoid, dan Total Asam Fenolat. ...111
Tabel 47. Nilai-Nilai Vektor dari Hubungan antara Masing-Masing Variabel dengan Komponen Utama. ... 111
vi
DAFTAR GAMBAR
Gambar 1. Struktur Kimia : (a) turunan asam benzoat (b) turunan asam. ... 7
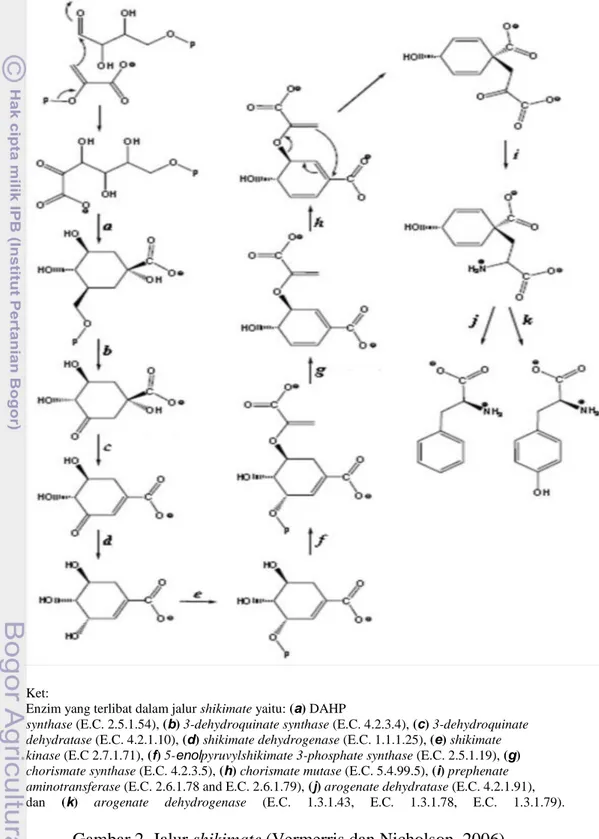
Gambar 2. Jalur Shikimate . ... 9
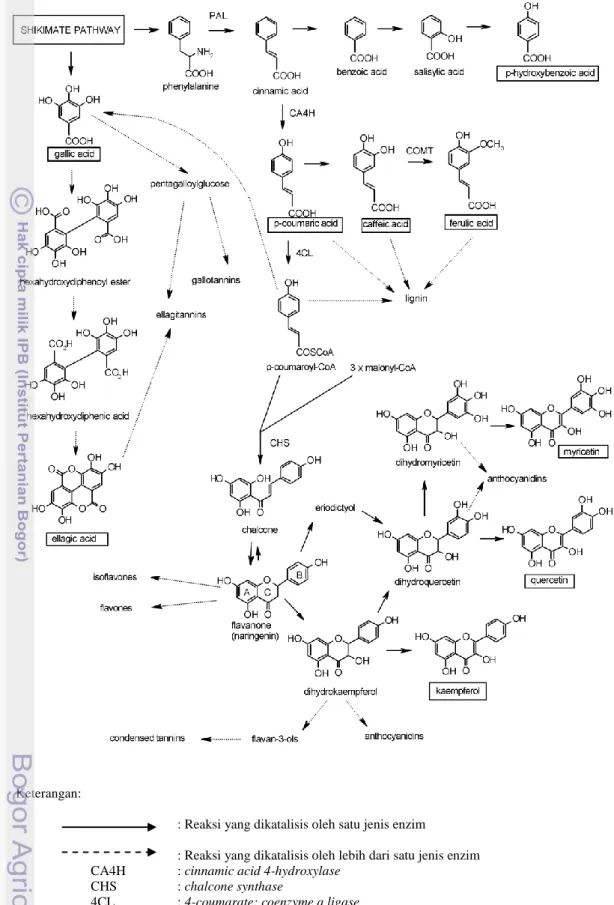
Gambar 3. Biosintesis Hidroksibenzoat, Hidroksinamat, dan Flavonoid. ... 11
Gambar 4. Biosintesis Asam Klorogenat. ... 12
Gambar 5. Persiapan Sampel. ... 24
Gambar 6. Prosedur Analisis Total Fenol. ... 25
Gambar 7. Metode Ekstraksi Asam Fenolat dari Sayuran Indigenous. ... 26
Gambar 8. Metode Hidrolisis Basa. ... 27
Gambar 9. Metode Hidrolisis Asam. ... 28
Gambar 10. Metode Pembuatan Standar Asam Fenolat. ... 29
Gambar 11. Kromatogram Standar Asam Klorogenat dengan Analisis HPLC. ... 30
Gambar 12. Kromatogram Standar Asam Kafeat dengan Analisis HPLC. ... 31
Gambar 13. Kromatogram Standar Asam Ferulat dengan Analisis HPLC. ... 31
Gambar 14. Kromatogram Standar Campuran dengan Analisis HPLC. ... 35
Gambar 15. Kurva Standar Campuran Asam Klorogenat. ... 35
Gambar 16. Kurva Standar Campuran Asam Kafeat. ... 36
Gambar 17. Kurva Standar Campuran Asam Ferulat ... 36
Gambar 18. Kromatogram Ekstrak Mengkudu dengan Analisis HPLC. ... 43
Gambar 19. Ko-kromatogram Ekstrak Mengkudu dengan Standar Campuran. ... 43
Gambar 20. Kromatogram Ekstrak Mangkokan dengan Analisis HPLC. ... 45
Gambar 21. Ko-kromatogram Ekstrak Mangkokan dengan Standar Campuran. . 45
Gambar 22. Kromatogram Ekstrak Daun Labu Siam dengan Analisis HPLC. .... 47
Gambar 23. Ko-kromatogram Ekstrak Daun Labu Siam dengan Standar Campuran. ... 47
Gambar 24. Kromatogram Ekstrak Daun Lembayung dengan Analisis HPLC... 49
Gambar 25. Ko-Kromatogram Ekstrak Daun Lembayung dengan Standar Campuran. ... 49
Gambar 26. Kromatogram Ekstrak Daun Katuk dengan Analisis HPLC. ... 52
Gambar 27. Ko-Kromatogram Ekstrak Daun Katuk dengan Standar Campuran. ... 52
vii
Gambar 28. Kromatogram Ekstrak Daun Kemangi dengan Analisis HPLC. ... 54
Gambar 29. Ko-Kromatogram Ekstrak Daun Kemangi dengan Standar Campuran. ... 54
Gambar 30. Kromatogram Ekstrak Daun Pakis dengan Analisis HPLC. ... 56
Gambar 31. Ko-Kromatogram Ekstrak Daun Pakis dengan Standar Campuran. 56 Gambar 32. Kromatogram Ekstrak Daun Pohpohan dengan Analisis HPLC. ... 59
Gambar 33. Ko-Kromatogram Ekstrak Daun Pohpohan dengan Standar Campuran. ... 59
Gambar 34. Kromatogram Ekstrak Bunga Pepaya dengan Analisis HPLC. ... 61
Gambar 35. Ko-Kromatogram Ekstrak Bunga Pepaya dengan Standar Campuran. ... 61
Gambar 36. Kromatogram Ekstrak Mangkokan Putih dengan Analisis HPLC. .. 63
Gambar 37. Ko-Kromatogram Ekstrak Mangkokan Putih dengan Standar Campuran. ... 63
Gambar 38. Kromatogram Ekstrak Kenikir dengan Analisis HPLC. ... 65
Gambar 39. Ko-Kromatogram Ekstrak Kenikir dengan Standar Campuran. ... 65
Gambar 40. Kromatogram Ekstrak Daun Kelor dengan Analisis HPLC... 67
Gambar 41. Ko-Kromatogram Ekstrak Daun Kelor dengan Standar Campuran. ... 67
Gambar 42. Kromatogram Ekstrak Daun Kucai dengan Analisis HPLC. ... 70
Gambar 43. Ko-Kromatogram Ekstrak Daun Kucai dengan Standar Campuran. 70 Gambar 44. Kromatogram Ekstrak Daun Jambu Mete dengan Analisis HPLC. . 72
Gambar 45. Ko-Kromatogram Ekstrak Daun Jambu Mete dengan Standar Campuran. ... 72
Gambar 46. Kromatogram Ekstrak Buah Takokak dengan Analisis HPLC. ... 74
Gambar 47. Ko-Kromatogram Ekstrak Buah Takokak dengan Standar Campuran. ... 74
Gambar 48. Kromatogram Ekstrak Antanan dengan Analisis HPLC. ... 77
Gambar 49. Ko-Kromatogram Ekstrak Antanan dengan Standar Campuran. ... 77
Gambar 50. Kromatogram Ekstrak Krokot dengan Analisis HPLC. ... 79
Gambar 51. Ko-Kromatogram Ekstrak Krokot dengan Standar Campuran. ... 79
viii Gambar 53. Ko-Kromatogram Ekstrak Antanan Beurit dengan
Standar Campuran. ... 81 Gambar 54. Kromatogram Ekstrak Daun Ginseng dengan Analisis HPLC. ... 83 Gambar 55. Ko-Kromatogram Ekstrak Daun Ginseng dengan
Standar Campuran. ... 83 Gambar 56. Kromatogram Ekstrak Bunga Kecombrang dengan
Analisis HPLC. ... 85 Gambar 57. Ko-Kromatogram Ekstrak Bunga Kecombrang dengan
Standar Campuran. ... 85 Gambar 58. Kromatogram Ekstrak Daun Beluntas dengan Analisis HPLC. ... 88 Gambar 59. Ko-Kromatogram Ekstrak Daun Beluntas dengan
Standar Campuran. ... 88 Gambar 60. Kromatogram Ekstrak Bunga Turi dengan Analisis HPLC. ... 90 Gambar 61. Ko-Kromatogram Ekstrak Bunga Turi dengan Standar Campuran. 90 Gambar 62. Kromatogram Ekstrak Terubuk dengan Analisis HPLC. ... 92 Gambar 63. Ko-Kromatogram Ekstrak Terubuk dengan Standar Campuran. ... 92 Gambar 64. Kromatogram Ekstrak Kedondong Cina dengan Analisis HPLC. ... 95 Gambar 65. Ko-Kromatogram Ekstrak Kedondong Cina dengan
Standar Campuran. ... 95 Gambar 66. Biplot Hubungan Total Fenol, Asam Klorogenat, Asam Kafeat,
Asam Ferulat, Myricetin, Luteolin, Quercetin, Apigenin,
dan Kaempferol. ... 109 Gambar 67. Biplot Hubungan Antara Total Fenol, Total Asam Fenolat,
ix
DAFTAR LAMPIRAN
Lampiran 1. Gambar Dua Puluh Empat Sayuran Indigenous Indonesia. ... 120
Lampiran 2. Uji Tukey’s Kadar Air Sayuran Indigenous Indonesia. ...122
Lampiran 3. Uji Tukey’s Total Fenol Sayuran Indigenous Indonesia. ...124
Lampiran 4. Uji Tukey’s Asam Fenolat Pada Sayuran Indigenous Indonesia...126
Lampiran 5. Uji Tukey’s Asam Klorogenat Sayuran Indigenous Indonesia. ..128
Lampiran 6. Uji Tukey’s Asam Kafeat Sayuran Indigenous Indonesia. ...130
Lampiran 7. Uji Tukey Asam Ferulat Sayuran Indigenous Indonesia. ...132
Lampiran 8. Kadar Air Sayuran Indigenous Indonesia. ...134
Lampiran 9. Kadar Air Freeze Drier Sayuran Indigenous Indonesia. ...137
Lampiran 10. Kurva Standar Total Fenol . ...140
Lampiran 11. Total Fenol Sayuran Indigenous Indonesia. ...141
Lampiran 12. Asam Klorogenat Sayuran Indigenous dengan Perhitungan Kurva Standar Campuran. ...147
Lampiran 13. Asam Kafeat Sayuran Indigenous dengan Perhitungan Kurva Standar Campuran. ...153
Lampiran 14. Asam Ferulat Sayuran Indigenous dengan Perhitungan Kurva Standar Campuran. ...159
Lampiran 15. Asam Klorogenat Sayuran Indigenous dengan Perhitungan Eksternal Standar Campuran. ...165
Lampiran 16. Kafeat Acid Sayuran Indigenous dengan Perhitungan Eksternal Standar Campuran. ...171
Lampiran 17. Asam Ferulat Sayuran Indigenous dengan Perhitungan Eksternal Standar Campuran. ...177
1
I. PENDAHULUAN
A. LATAR BELAKANG
Indonesia merupakan negara yang kaya sumber daya alam baik hasil perikanan, pertanian, maupun perkebunan. Tanaman sayuran di Indonesia sangat banyak dan bervariasi. Akan tetapi masih banyak dari sayuran tersebut yang belum dimanfaatkan dan diidentifikasi secara ilmiah kandungan senyawa yang bermanfaat untuk kesehatan tubuh manusia. Pemanfaatannya masih terbatas hanya sebagai lalapan maupun campuran gulai. Sayuran sangat diperlukan oleh tubuh untuk memenuhi asupan vitamin, mineral, dan serat seseorang setiap harinya.
Jawa Barat merupakan salah satu provinsi penghasil sayur-sayuran yang memiliki peran cukup signifikan dalam menghasilkan jenis sayur-sayuran di Indonesia. Spesies sayuran asli Indonesia yang berasal dari daerah/wilayah/ekosistem tertentu, termasuk spesies pendatang dari wilayah geografis lain tetapi telah berevolusi dengan iklim dan geografis wilayah Indonesia dinamakan sayuran indigenous (Anonim, 2007). Beberapa balai penelitian seperti Balai Penelitian Tanaman Sayuran (Balitsa) bekerjasama dengan Asian Vegetables Research Development Center (AVRDC) telah melakukan pendataan terhadap sayuran ini terutama yang mempunyai kandungan gizi dan non gizi yang bermanfaat secara fisiologis bagi tubuh manusia yaitu vitamin A, zat besi, dan antioksidan.
Antioksidan merupakan senyawa yang sangat baik untuk menangkap radikal bebas. Keberadaan senyawa antioksidan ini akan mencegah penyakit kanker maupun penyakit degeneratif lainnya. Salah satu senyawa antioksidan yang penting yaitu senyawa polifenol. Senyawa polifenol yang ada pada sayuran, buah-buahan, dan teh dapat mencegah penyakit degeneratif termasuk kanker melalui aktivitas antioksidatif dan/atau modulasi fungsi beberapa protein. Contohnya konsumsi senyawa polifenol dapat mereduksi kematian akibat penyakit jantung koroner (Hertog, 1995) dengan cara menekan oksidasi lipoprotein berat jenis rendah (Meyer, 1998). Polifenol menunjukkan sifat antagonis dengan reseptor karsinogenesis seperti faktor pertumbuhan
2 asepidermal (Agullo, 1997), dan reseptor arylhidrokarbon (Ashida et al., 2000). Polifenol mengatur sekresi senyawa sitokin, meregulasi siklus sel (Frey et al., 2001) dan ekspresi protein kinase dalam proliferasi sel tumor (Kobuchi et al., 1999). Senyawa polifenol juga menginduksi ekspresi enzim antikarsinogenik (Williamson et al., 1996). Dalam percobaan pada hewan, konsumsi senyawa polifenol dapat menekan karsinogenesis dari beberapa karsinogen (Yang et al., 2001). Kemampuan yang dimiliki oleh polifenol untuk menangkap radikal bebas serta memiliki aktivitas antioksidan mempunyai peranan yang penting untuk melindungi sel dan jaringan dari stres oksidatif dan efek biologis lain yang berhubungan dengan penyakit kronis (Rimbach et al., 2005). Senyawa polifenol dapat menekan efek di dalam usus. seperti efek dalam mengikat besi, menangkap nitrogen reaktif, klorin, dan spesies oksigen, serta menghambat cyclooxygenases dan lipoxygenases (Halliwell et al., 2005).
Salah satu senyawa polifenol yang banyak terdapat di sayuran yaitu flavonoid dan asam fenolat. Batari (2007) telah melakukan penelitian terhadap sebelas jenis sayuran indigenous Jawa Barat yaitu kenikir, beluntas, mangkokan, kemangi, pohpohan, katuk, antanan, ginseng, kecombrang, kedondong cina, dan krokot mengenai kandungan senyawa flavonoid (Flavonol dan Flavone) pada sayuran tersebut. Selain itu Rahmat (2009) juga telah melakukan penelitian mengenai kandungan senyawa flavonoid (Flavonol dan Flavone) pada tiga belas jenis sayuran indigenous Jawa Barat yaitu mengkudu, mangkokan putih, labu siam, lembayung, pakis, pepaya, kelor, kucai, turi, jambu mete, terubuk, takokak, dan antanan beurit.
Pada penelitian ini dilakukan identifikasi senyawa asam fenolat yang terdapat pada sayuran indigenous Indonesia yang berasal dari Jawa Barat. Asam fenolat memiliki dua jenis golongan yaitu golongan asam hidroksinamat dan golongan asam hidroksibenzoat. Asam fenolat yang dominan terdapat pada sayuran adalah golongan asam hidroksinamat (Shahidi dan Naczk, 1995). Bentuk senyawa asam hidroksinamat yang terdapat pada sayuran yaitu asam p-koumarat, asam ferulat, asam kafeat, dan asam klorogenat. Sedangkan menurut hasil penelitian Sakakibara et al. (2003) senyawa asam fenolat yang banyak terdapat pada sayuran yaitu asam ferulat, asam kafeat, dan asam klorogenat.
3 Dengan demikian pada penelitian ini diidentifikasi keberadaan senyawa asam ferulat, asam kafeat, dan asam klorogenat pada sayuran indigenous Indonesia yang berasal dari Jawa Barat.
Jenis sayuran yang digunakan pada penelitian ini adalah sayuran lokal yang banyak dan sering dikonsumsi oleh masyarakat Indonesia. Bagian tanaman yang digunakan dalam penelitian ini adalah bagian yang sering dikonsumsi oleh masyarakat. Sayuran yang digunakan dalam penelitian ini adalah sayuran yang digunakan juga oleh Batari (2007) yaitu kenikir, beluntas, mangkokan, kemangi, pohpohan, katuk, antanan, ginseng, kecombrang, kedondong cina, dan krokot maupun yang digunakan oleh Rahmat (2009) yaitu mengkudu, mangkokan putih, labu siam, lembayung, pakis, pepaya, kelor, kucai, turi, jambu mete, terubuk, takokak, dan antanan beurit.
B. TUJUAN
Tujuan dari penelitian ini adalah mengidentifikasi kandungan komponen asam fenolat (asam klorogenat, asam kafeat, dan asam ferulat) pada dua puluh empat jenis sayuran indigenous Indonesia.
C. MANFAAT
Manfaat penelitian ini adalah mendapatkan data mengenai kandungan komponen asam fenolat (asam klorogenat, asam kafeat, dan asam ferulat) pada dua puluh empat jenis sayuran indigenous Indonesia sehingga dapat dimanfaatkan lebih lanjut.
4
II. TINJAUAN PUSTAKA
A. SAYURAN INDIGENOUS
Sayuran indigenous Indonesia adalah spesies sayuran asli Indonesia yang berasal dari daerah/wilayah/ekosistem tertentu, termasuk spesies pendatang dari wilayah geografis lain tetapi telah berevolusi dengan iklim dan geografis wilayah Indonesia (Anonim, 2007). Sayuran ini biasa digunakan oleh masyarakat sebagai lalapan, campuran gulai, maupun obat.
Perkembangan budaya dan teknologi menyebabkan perkembangan sayuran indigenous menjadi terdesak, maka potensi sayuran ini harus digali dan dikaji kembali untuk mendapatkan manfaat yang lebih baik dalam meningkatkan gizi keluarga. Pada penelitian ini diidentifikasi kandungan asam fenolat dari sayuran indigenous tersebut. Sayur yang digunakan adalah sayur-sayuran yang banyak dikonsumsi oleh masyarakat dan banyak tumbuh di Indonesia yang berasal dari provinsi Jawa Barat. Bagian dari sayur-sayuran indigenous yang digunakan dalam penelitian ini adalah bagian yang biasa dikonsumsi (dapat berupa batang, daun, bunga atau seluruh bagian tanaman). Sayuran tersebut diantaranya adalah Kenikir (Cosmos caudatus H.B.K), beluntas (Pluchea indica (L.) Less.), mangkokan putih (Nothopanax scutellarium (Burm.f.) Fosb.), mangkokan (Nothopanax scutellarius (Burm.f.) Merr.), kendondong cina (Polyscias pinnata), kecombrang (Etlingera elatior (Jack) R.M.Sm.), kemangi (Ocimum americanum L.), katuk (Sauropus androgynus (L.) Merr.), antanan (Centelia asiatica (L.) Urb.), antanan beurit (Hydrocotyle sibthorpioides Lmk.), pohpohan (Pilea melastomoides (Poir.) Bl.), ginseng (Talinum triangulare (Jacq.) Willd.), krokot (Portulaca oleracea L.), turi (Sesbania grandiflora (L.) Pers.), kucai (Allium schoenoprasum L.), takokak (Solanum torvum Swartz), kelor (Moringa pterygosperma Gaertn.), mengkudu (Morinda citrifolia L.), lembayung (Vigna unguiculata (L.) Walp.), terubuk (Saccharum edule Hassk.), labu siam (Sechium edule (Jacq.) Swartz.), pepaya (Carica papaya L.), jambu mete (Anacardium occidentale L.), dan pakis (Arcypteris irregularis (C.Presl) Ching.).
5 Batari (2007) telah melakukan penelitian terhadap sebelas sayuran indigenous Indonesia yaitu kenikir, beluntas, mangkokan, kemangi, pohpohan, katuk, antanan, ginseng, kecombrang, kedondong cina, dan krokot. Penelitian Batari (2007) menunjukkan bahwa kesebelas sayuran indigenous Jawa Barat tersebut mengandung senyawa flavonoid (flavonol dan flavones), lihat Tabel 1. Rahmat (2009) telah melakukan penelitian yang serupa pada tiga belas sayuran indigenous Jawa Barat yaitu mengkudu, mangkokan putih, labu siam, lembayung, pakis, pepaya, kelor, kucai, turi, jambu mete, terubuk, takokak, dan antanan beurit. Penelitian Rahmat (2009) menunjukkan bahwa ketiga belas sayuran indigenous Jawa Barat tersebut mengandung senyawa flavonoid (flavonol dan flavone), lihat Tabel 2. Senyawa flavonoid adalah salah satu antioksidan yang penting bagi tubuh manusia untuk menjaga kesehatan. Sayuran indigenous di atas mengandung senyawa flavonoid (antioksidan) sehingga baik untuk menjaga kesehatan tubuh manusia.
Sampel
Flavonoid (mg/100 gram sampel segar)
Total Fenol (mg/100 gram sampel segar)
Flavonol Flavon
Myricetin Quercetin Kaempferol Luteolin Apigenin
Kenikir - 51.28 0.90 - - 150.01 Beluntas 0.90 5.21 0.28 - - 83.12 Mangkokan - 3.69 1.74 - - 94.30 Kecombrang - 1.18 - - - 80.61 Kemangi - 1.89 2.47 2.12 0.74 81.18 Katuk - 4.50 138.14 - - 149.32 Kedondong Cina - 28.48 23.71 - - 79.06 Antanan 0.13 12.31 8.57 - - 46.32 Pohpohan - 1.76 0.25 0.33 - 70.11 Daun ginseng - 0.41 3.52 - - 48.91 Krokot - 0.30 - - - 33.46
Tabel 1. Kandungan Senyawa Flavonoid pada Sebelas Sayuran Indigenous Jawa Barat (mg/100 gram sampel segar)
Ket :
- : Tidak terdeteksi Sumber : Batari (2007)
6
B. ASAM FENOLAT (PHENOLIC ACID)
Senyawa asam fenolat mendapatkan perhatian yang lebih dalam beberapa tahun terakhir ini karena pengaruhnya terhadap kesehatan manusia. Sebagai polifenol, asam fenolat merupakan antioksidan yang sangat kuat dan memiliki aktivitas antibakteri, antivirus, antikarsinogenik, antiinflamasi, dan aktivitas vasodilatory (Duthie et al., 2000). Selain itu asam fenolat juga mempunyai peranan untuk melindungi dari kanker dan penyakit jantung (Manach, 2004).
Asam fenolat merupakan metabolit sekunder yang sering ditemukan pada tanaman. Senyawa asam fenolat mempunyai peranan yang penting pada tumbuhan yaitu sebagai bahan pendukung dinding sel (Wallace dan Fry, 1994). Asam fenolat membentuk bagian integral pada struktur dinding sel, umumnya dalam bentuk bahan polymeric seperti lignin, membantu proses mekanik, dan halangan bagi invasi mikroba. Lignin merupakan senyawa organik yang paling banyak di bumi setelah selulosa (Wallace dan Fry, 1994). Turunan asam fenolat terdiri dari dua jenis yaitu asam hidroksibenzoat dan asam
Sampel
Konsentrasi Flavonoid (mg/100 gram sampel segar)
Total Fenol (mg/100 gram sampel segar)
Flavonol Flavon
Myricetin Quercetin Kaempferol Luteolin Apigenin
Bunga turi - 2.76 18.47 - - 31.62 Kucai 2.69 4.46 7.65 - - 35.04 Takokak 2.30 0.66 - - - 92.91 Daun kelor - 95.84 20.79 1.32 - 133.59 Pucuk mengkudu - 23.67 9.75 - - 39.23 Lembayung - 27.35 3.33 - 12.97 49.53 Terubuk - 0.44 - - - 23.73 Mangkokan - 12.67 12.95 - 6.87 74.19 Daun labu siam 12.49 13.81 9.72 - - 74.27 Bunga papaya - 18.85 5.47 - 11.95 44.47 Pucuk mete 8.28 125.39 9.91 - - 614.72 Pakis - 7.42 2.10 - - 34.57 Antanan beurit 1.57 37.51 10.85 - - 121.06
Tabel 2. Kandungan Senyawa Flavonoid pada Tiga Belas Sayuran Indigenous Jawa Barat (mg/100 gram sampel segar)
Ket :
- : Tidak terdeteksi Sumber : Rahmat (2009)
7 hidroksinamat. Perbedaan kedua turunan dari senyawa asam fenolat ini terletak pada pola hidroksilasi dan metoksilasi cincin aromatiknya. Struktur kimia kedua senyawa tersebut dapat dilihat pada Gambar 1. Aktivitas biologis yang penting pada senyawa benzoat, klorogenat, kafeat, ferulat, dan asam galat adalah kemampuan aktivitas sitoprotektifnya dan kemampuan dalam menghambat karsinogenesis, mutagenesis, dan generasi tumor (Birosova, 2005).
Gambar 1. Struktur Kimia : (a) turunan asam benzoat (b) turunan asam sinamat (Mattila et al., 2002)
Senyawa asam fenolat pada tumbuhan disintesis oleh tumbuhan melalui jalur Shikimate (Häkkinen, 2000). Jalur shikimate merupakan hasil dari biosintesis senyawa chorismate yang dapat berfungsi sebagai prekursor terbentuknya biosintesis senyawa aromatik asam amino triptofan, fenilalanin, dan tirosin. Jalur shikimate biasa terdapat pada tumbuhan dan mikroorganisme. Shikimate disintesis dari substrat fosfoenolpiruvat dan eritrosa 4-fosfat. Kedua prekursor ini merupakan hasil dari jalur glikolisis dan jalur fosfat pentosa dan mengalami kondensasi menjadi 3-deoxy-D-arabino-heptulosonate 7-phosphate (DAHP) oleh enzim DAHP synthase. Tahapan selanjutnya yaitu pembentukan 3-dehydroquinate oleh enzim 3-dehydroquinate synthase, 3-dehydroshikimate oleh enzim 3-dehydroquinate dehydratase, dan terakhir shikimate oleh enzim shikimate dehydrogenase. Shikimate kemudian dirubah menjadi shikimate 3-phosphate oleh enzim shikimate kinase, dan setelah itu menjadi
5-(a)
8 enolpyruvylshikimate 3-phosphate (EPSP) oleh enzim 5-enolpyruvylshikimate 3-phosphate synthase. EPSP kemudian dirubah menjadi chorismate oleh enzim chorismate synthase. Chorismate adalah cabang untuk membentuk asam amino aromatik, yaitu triptofan pada bagian yang satu, dan fenilalanin serta tirosin pada bagian yang lainnya. Jika diperhatikan secara seksama pada bagian akhir jalur shikimate, biosintesis fenilalanin dan tirosin terdapat pada Gambar 2 karena mereka merupakan prekursor kelas penting yaitu senyawa asam fenolat, fenilpropanoid, dan beberapa kelas senyawa asam fenolat lainnya. Pada proses ini membutuhkan perubahan chorismate menjadi prephenate yang dikatalisis oleh chorismate mutase dan arogenate yang dikatalisis oleh prephenat aminotransferase. Enzim arogenate dehydratase merubah arogenate menjadi fenilalanin, sedangkan enzim arogenate dehydrogenase menghasilkan tirosin. Jalur biosintesis shikimate (Shikimate Pathway) pada tumbuhan dapat dilihat pada Gambar 2.
Pembentukan asam hidroksinamat (kafeat, ferulat, 5-hydroxyferrulic, dan asam sinapat) dari asam p-koumarat membutuhkan dua jenis reaksi yaitu hidroksilasi dan metilasi. Adanya pelekatan Gugus Hidroksil pada asam p-koumarat akan membentuk asam kafeat (Gambar 3), pembentukan ini dikatalisis oleh monophenol mono-oxygenases, grup enzim tanaman yang sudah sangat terkenal (Macheix et al., 1990). Metilasi pada asam kafeat akan membentuk asam ferulat, yang bersamaan dengan asam p-koumarat, merupakan prekursor lignin (Gambar 3). Metilasi ini dikatalisis oleh omethyltransferase (Macheix et al., 1990). Asam kafeat merupakan substrat untuk 5-hydroxyferrulic acid, yang akan menghasilkan asam sinapat sebagai hasil dari o-metilasi.
Pembentukan turunan asam hidroksinamat membutuhkan pembentukan hydroxycinnamte-CoAs, contoh p-coumaroyl-CoA dikatalisis oleh hydroxycinnamoyl-CoA ligase atau oleh oglycosyl transferase. hydroxycinnamate-CoAs masuk kedalam berbagai macam reaksi phenylpropanoid. (Gambar 3), seperti kondensasi dengan malonyl-CoA membentuk flavonoid atau reduksi NADPH-dependent membentuk lignin. Selain itu hydroxycinnamate-CoAs dapat berkonjugasi dengan asam organik
9 (Strack, 1997). Di biosintesis turunan gula asam hidroksinamat, transfer glukosa dari uridine diphosphoglucose menjadi asam hidroksinamat dikatalisis oleh glucosyl transferase (Strack, 1997).
Gambar 2. Jalur shikimate (Vermerris dan Nicholson, 2006)
Ket:
Enzim yang terlibat dalam jalur shikimate yaitu: (a) DAHP
synthase (E.C. 2.5.1.54), (b) 3-dehydroquinate synthase (E.C. 4.2.3.4), (c) 3-dehydroquinate dehydratase (E.C. 4.2.1.10), (d) shikimate dehydrogenase (E.C. 1.1.1.25), (e) shikimate kinase (E.C 2.7.1.71), (f) 5-enolpyruvylshikimate 3-phosphate synthase (E.C. 2.5.1.19), (g) chorismate synthase (E.C. 4.2.3.5), (h) chorismate mutase (E.C. 5.4.99.5), (i) prephenate aminotransferase (E.C. 2.6.1.78 and E.C. 2.6.1.79), (j) arogenate dehydratase (E.C. 4.2.1.91),
10 Banyak jalur untuk biosintesis asam hidroksibenzoat pada tanaman, jalur pembentukan ini tergantung dari jenis tanamannya. Asam hidroksibenzoat dapat dibentuk dari jalur shikimate (Gambar 3), terutama dari dehydroshikimic acid. Reaksi ini merupakan reaksi utama untuk pembentukan gallic acid (Haddock et al., 1982). Selain itu asam hidroksibenzoat juga dapat dibentuk melalui degradasi asam hidroksinamat, sama seperti proses β oksidasi pada asam lemak, senyawa antaranya yaitu cinnamoyl-CoA esters (Macheix et al., 1990) (Gambar 3). Asam hidroksibenzoat dapat juga dibentuk melalui degradasi senyawa flavonoid (Strack, 1997). Penjelasan lebih detail mengenai proses pembentukan hidroksibenzoat, hidroksinamat, dan flavonoid melalui jalur shikimate dapat dilihat pada Gambar 3. Senyawa asam klorogenat merupakan senyawa ester dari gabungan senyawa asam kafeat dan senyawa quinic acids. Secara ringkas pembentukan asam klorogenat dapat dilihat pada Gambar 4.
Asam hidroksibenzoat pada tumbuhan biasanya terdapat dalam bentuk terikat. Asam hidroksibenzoat merupakan komponen struktur kompleks seperti lignin dan tannin yang dapat dihidrolisis (Shahidi et al., 1995). Asam hidroksibenzoat juga ditemukan dalam bentuk asam organik dan turunan gula (Schuster dan Herrmann, 1985). Secara umum kandungan asam hidroksibenzoat di dalam tumbuhan rendah kecuali blackberry, raspberry (Morsel dan Herrmann, 1974), black currant, red currant (Stohr dan Herrmann, 1975a), dan strawberry (Stohr dan Herrmann, 1975b). Senyawa hidroksibenzoat banyak terdapat pada sayuran seperti bawang (Schmidtlein dan Herrmann, 1975a) dan horseradish (Schmidtlein dan Herrmann, 1975b), dengan komponen asam hidroksibenzoat yang dominan yaitu senyawa protocatechuic, p-hydroxybenzoic, dan gallic acid.
Asam hidroksinamat banyak terdapat di dalam bahan pangan yang berasal dari tumbuh-tumbuhan. Asam hidroksinamat biasanya terdapat dalam bentuk terikat dan jarang ditemukan dalam bentuk bebasnya. Proses pengolahan buah dan sayuran dengan (Azar et al., 1987), sterilisasi (Rivas dan Luh, 1968) dan fermentasi dalam pembuatan anggur (Singleton, 1980) berkontribusi dalam pembentukan asam hidroksinamat bebas di dalam produk.
11
Keterangan:
: Reaksi yang dikatalisis oleh satu jenis enzim
: Reaksi yang dikatalisis oleh lebih dari satu jenis enzim CA4H : cinnamic acid 4-hydroxylase
CHS : chalcone synthase
4CL : 4-coumarate: coenzyme a ligase PAL : phenylalanine ammonialyase
Gambar 3. Biosintesis hidroksibenzoat, hidroksinamat, dan flavonoid (Häkkinen, 2000)
12 Gambar 4. Biosintesis asam klorogenat (Cadenas dan Packer, 2002)
Senyawa asam kafeat merupakan asam hidroksinamat yang banyak ditemukan pada buah-buahan. Asam kafeat banyak ditemukan pada plums, apel, apricots, blueberries, dan tomat dengan kandungan asam kafeat lebih dari 75 %. Senyawa asam p-koumarat merupakan senyawa asam hidroksinamat yang banyak terdapat pada buah sitrus dan nanas (Macheix et al., 1989). Mattila dan HellstrÖm (2007) menambahkan bahwa senyawa asam
hidroksinamat yang banyak ditemukan yaitu kafeat, p-koumarat, dan asam ferulat, biasanya terdapat di bahan pangan dalam bentuk ester sederhana dengan quinic acid atau glukosa. Bentuk terikat dari senyawa asam hidroksinamat ditemukan dalam bentuk ester asam hidroksinamat yaitu quinic,
13 shikimic, tartaric acids, dan senyawa turunan gulanya. Mattila dan HellstrÖm
(2007) menambahkan bahwa asam hidroksinamat yang terkenal dalam bentuk terikat yaitu asam klorogenat yang merupakan gabungan dari asam kafeat dan quinic acids. Sedangkan menurut hasil penelitian (Sakakibara et al., 2003) senyawa asam fenolat yang banyak terdapat pada sayuran yaitu asam ferulat, asam kafeat, dan asam klorogenat.
C. IDENTIFIKASI SENYAWA ASAM FENOLAT
Analisis kimia dengan metode kromatografi didasarkan pada pemisahan komponen yang terpartisi diantara dua fase dalam suatu kesetimbangan dinamis dan mengalir. Proses ini dilakukan dengan menggerakkan suatu fase secara mekanis (fase gerak), relatif terhadap fase lainnya.
Secara teori pemisahan kromatografi yang paling baik akan diperoleh jika fase diam mempunyai luas permukaan sebesar-besarnya, sehingga memastikan kesetimbangan yang baik antar fase. Persyaratan kedua agar pemisahan baik adalah fase gerak harus bergerak dengan cepat sehingga difusi sekecil-kecilnya. Untuk memperoleh permukaan fase diam yang luas, pada sebagian besar sistem kromatografi digunakan penjerap atau penyangga berupa serbuk halus. Untuk memaksa fase gerak bergerak lebih cepat melalui fase diam yang terbagi pada serbuk halus harus digunakan tekanan tinggi. Dengan dipenuhinya kedua persayaratan tersebut, diperoleh teknik kromatografi cair yang paling kuat yakni HPLC (High Performance Liquid Chromatography). Jadi pada HPLC fase gerak dialirkan dengan cepat dan hasilnya dideteksi dengan instrumen.
Komponen utama dari sistem HPLC adalah pompa (tekanan tetap dan volume tetap), penginjeksi, kolom (ekternal dan internal), detektor, dan rekorder atau sistem data yang terintegrasi (Rounds dan Gregor, 2003). Parameter-parameter yang akan mempengaruhi sistem kerja pada HPLC antara lain diameter dari kolom HPLC, ukuran partikel, ukuran lubang pada fase diam, dan tekanan pompa.
Terdapat lima tipe HPLC yaitu normal phase chromatography, reversed phase chromatography, ion-exchange chromatography, size-exclusion
14 chromatography, dan affinity chromatography (Rounds dan Gregor, 2003). Pada penelitian ini, tipe HPLC yang digunakan adalah reversed phase chromatography (RP-HPLC). Fase diam dari HPLC jenis ini adalah senyawa nonpolar, sedangkan fase geraknya polar. Karena hal tersebutlah maka komponen yang akan keluar dahulu adalah komponen yang polar dibandingkan yang nonpolar.
Lebih dari 70% teknik pemisahan dengan metode HPLC menggunakan tipe reversed phase. Beberapa contoh teknik pemisahan yang menggunakan metode RP-HPLC adalah analisis protein dari tanaman, protein dari biji-bijian, analisis vitamin larut air dan larut lemak, pemisahan karbohidrat, dan penentuan unsur-unsur pokok dari minuman ringan. reversed phase HPLC dengan metode deteksi yang sangat bervariasi, digunakan untuk menganalisis lemak (Rounds dan Gregor, 2003).
Antioksidan, seperti butylated hydroxylanisole (BHA) dan butylated hydroxytoluene (BHT), dapat diekstrak dari bahan pangan kering dan dianalisis dengan menggunakan detektor UV dan fluoresens secara bersamaan. Bahan pangan basah, pigmen (seperti klorofil, karotenoid, dan antosianin), dan komponen Asam Fenolat (seperti vanili) dapat pula dianalisis dengan menggunakan metode RP-HPLC (Rounds dan Gregor, 2003).
Kolom reversed phase chromatography lebih sulit untuk rusak dibandingkan dengan kolom silika normal. Hal ini dikarenakan kolom RP-HPLC terdiri atas alkil turunan silika dan tidak pernah digunakan dengan larutan basa (karena larutan basa akan menghancurkan ikatan silika). Kolom RP-HPLC dapat digunakan dengan larutan asam tetapi tidak boleh kontak terlalu lama karena asam dapat menimbulkan korosi pada logam yang ada dalam peralatan HPLC. Kandungan logam pada kolom HPLC harus dijaga agar tetap rendah supaya dapat memberikan hasil terbaik pada pemisahan komponen. Salah satu cara untuk mengetahui kandungan logam di dalam kolom HPLC adalah dengan menginjeksikan campuran dari 2,2’- dan 4,4’-bipiridin. Bila terdapat ion logam di permukaan silika, maka senyawa 2,2’-bipiridin akan mengkelat logam tersebut dan peak dari senyawa yang akan
15 diidentifikasi menjadi tidak teratur sehingga dapat memberikan hasil yang tidak sesuai.
Berbagai penelitian telah dilakukan untuk mendeteksi komponen fenolik dalam bahan pangan dengan metode HPLC. Komponen fenolik merupakan senyawa aromatik, oleh karena itu, senyawa tersebut akan memberikan penyerapan yang baik pada panjang gelombang sinar UV. Asam fenolat merupakan bagian dari senyawa fenolik. Panjang gelombang yang digunakan untuk menentukan komponen asam fenolat yaitu 290 nm untuk asam kafeat, asam ferulat, dan asam klorogenat. (Singh et al., 2008). Fase gerak yang digunakan dalam identifikasi senyawa asam fenolat dengan HPLC adalah metanol-0.4% asam asetat (80:20, v/v) (Singh et al., 2008).
Pemisahan senyawa asam fenolat dilakukan menggunakan kolom RP C-18 (4.6 x 150 mm, 5µm) dengan kolom guard C-C-18. Fase gerak yang digunakan yaitu metanol-0.4% asam asetat (80:20, v/v), laju alir 1 mL/menit, panjang gelombang 290 nm, dan kondisi isokratik (Singh et al., 2008).
Keuntungan utama dari HPLC adalah kemampuannya untuk menangkap komponen dengan stabilitas panas yang terbatas ataupun yang bersifat volatil. HPLC merupakan metode yang sangat sensitif, tepat, selektif, dan memiliki tingkat otomatisasi yang tinggi, sehingga lebih sederhana dalam pengoperasiannya. Di samping itu, HPLC banyak digunakan untuk analisis karena kemudahan injeksi, deteksi, dan pengolahan data serta dapat digunakan untuk berbagai macam sampel seperti sampel cairan, padatan yang dilarutkan, maupun sampel yang labil terhadap pemanasan. Modern HPLC telah banyak diaplikasikan seperti pemisahan, identifikasi, pemurnian, dan penghitungan komponen yang bervariasi.
16
III. BAHAN DAN METODE
A. BAHAN DAN ALAT 1. Bahan
Bahan-bahan yang akan digunakan dalam penelitian ini adalah bahan untuk membuat larutan standar asam fenolat, bahan untuk membuat ekstrak sayuran indigenous, dan bahan untuk analisis kimia. Bahan-bahan yang digunakan dalam pembuatan larutan standar adalah standar asam kafeat (Sigma-Aldrich), standar asam ferulat (Sigma-Aldrich), dan standar asam klorogenat (Sigma-Aldrich), water for chromatography (MERCK), dan methanol HPLC grade (MERCK).
Bahan-bahan yang digunakan dalam pembuatan ekstrak sayuran adalah dua puluh empat jenis sayuran indigenous Indonesia yang berasal dari provinsi Jawa Barat yaitu kenikir, kecombrang, kemangi, katuk, pohpohan, ginseng, takokak, lembayung, terubuk, labu siam, pepaya, mete, pakis, beluntas, mangkokan putih, mangkokan, kendondong cina, antanan, antanan beurit, krokot, turi, kelor dan mengkudu. Bagian yang digunakan dalam penelitian ini bisa berupa daun, batang, dan seluruh bagian tanaman, methanol (MERCK), BHA (Sigma-Aldrich), asam asetat (MERCK), dan aquadest. Kedua puluh empat jenis sayuran tersebut telah berhasil diidentifikasi oleh pihak “Herbarium Bogoriense”, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor dengan Kepala Bidang Botani LIPI adalah Dr. Eko Baroto Walujo, APU. Tabel 3 menunjukkan secara lengkap kedua puluh empat jenis sayuran indigenous Indonesia yang berasal dari provinsi Jawa Barat, bagian yang digunakan dalam penelitian, serta daerah tempat asal sayuran indigenous tersebut diperoleh.
Bahan-bahan yang digunakan untuk analisis kimia adalah methanol (MERCK), asam asetat (MERCK), alufo, water for chromatography (MERCK), folin ciocalteu (MERCK), Na2CO3 (MERCK), aquadest, standar
17 Tabel 3. Dua Puluh Empat Jenis Sayuran Indigenous Indonesia
Spesies Nama
Indonesia
Bagian yang
digunakan Sumber
Morinda citrifolia L. Mengkudu Daun Muda Kebun Petani
Dramaga
Nothopanax scutellarius (Burm.f.)
Merr. Mangkokan Daun Muda
Kebun Petani Dramaga
Sechium edule (Jacq.) Swartz. Labu Siam Daun Muda Pasar Bogor
Vigna unguiculata (L.) Walp. Lembayung Daun Muda Pasar Bogor
Sauropus androgynus (L.) Merr. Katuk Daun Muda Pasar Bogor
Ocimum americanum L. Kemangi Daun Muda Pasar Bogor
Arcypteris irregularis (C.Presl)
Ching Pakis Daun Muda Pasar Bogor
Pilea melastomoides Pohpohan Daun Muda Pasar Bogor
Carica papaya L. Pepaya Bunga Pasar Bogor
Nothopanax scutellarium (Burm.f.)
Fosb.
Mangkokan
Putih Daun Muda
Kebun Petani Dramaga
Cosmos caudatus H.B.K. Kenikir Daun Muda Pasar Bogor
Moringa pterygosperma Gaertn. Kelor Daun Muda Kebun Petani
Dramaga
Allium schoenoprasum L. Kucai Seluruh Bagian Pasar Bogor
Anacardium occidentale L. Jambu Mete Daun Muda Pasar Bogor
Solanum torvum Swartz. Takokak Buah Pasar Bogor
Centelia asiatica (L.) Urb. Antanan Seluruh Bagian Kebun Petani Dramaga
Portulaca oleracea L. Krokot Daun dan
Batang
Kebun Petani Dramaga
Hydrocotyle sibthorpioides Lmk. Antanan Beurit Seluruh Bagian Kebun Petani Dramaga
Talinum triangulare (Jacq.) Willd. Ginseng Daun Muda Pasar Bogor
Etlingera elatior (Jack) R.M.Sm. kecombrang Bunga Pasar Bogor
Pluchea indica (L.) Less. Beluntas Daun Muda Kebun Petani
Dramaga
Sesbania grandiflora (L.) Pers. Turi Bunga Kebun Petani
Dramaga
Saccharum edule Hassk Terubuk Bunga Pasar Bogor
Polyscias pinnata Kedondong
cina Daun Muda
Kebun Petani Dramaga
18
2. Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat untuk membuat larutan standar, ekstrak sayuran, dan analisis. Pada pembuatan larutan standar alat-alat yang digunakan adalah labu takar, gelas ukur, pipet mohr, pipet tetes, neraca analitik, dan spatula. Alat-alat yang digunakan untuk membuat ekstrak sayuran adalah freezer, blender, freeze dryer, Buchi Rotavapor, neraca analitik, blender kering, labu takar, gelas piala, gelas ukur, pipet mohr, pipet tetes, spatula, baskom, botol gelap, ultrasonic Branson 3510,VELP Scientific vortex, IEC Centra-8 centrifuge, dan pisau. Pada proses analisis, alat-alat yang digunakan adalah High Performance Liquid Chromatography (HPLC) UV Vis Hewlet Packard Agilent 1100 series. Kolom HPLC RP C-18 (4.6 x 150 mm, 5µm), alat injektor sampel HPLC, filter syringe 0.45µm (PTFE), vial, oven, neraca analitik, desikator, VELP Scientific vortex, labu takar, gelas piala, tabung reaksi, spatula, gegep, ultrasonic Branson 3510, Shimadzu UV-2450 UV Vis spectrophotometer, IEC Centra-8 centrifuge, dan cawan alumunium.
B. METODE
Penelitian ini dilakukan dalam beberapa tahap yaitu persiapan sampel, pembuatan kurva standar dan Limit of Detection (LOD), analisis asam fenolat dengan HPLC, serta analisis statistik. Analisis asam fenolat dengan HPLC dilakukan secara dua ulangan duplo.
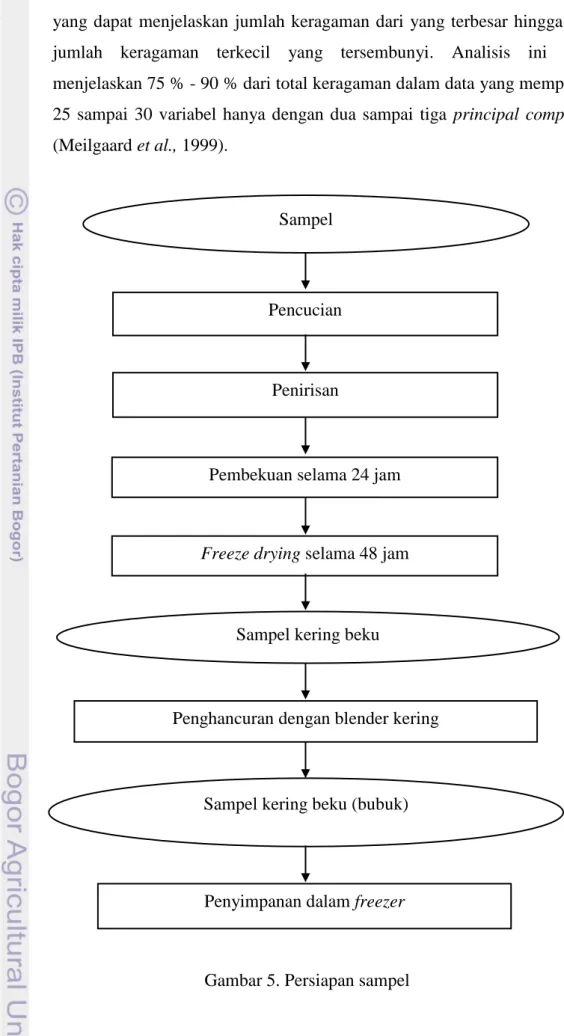
1. Persiapan Sampel
Mula-mula sampel dicuci sampai bersih, kemudian ditiriskan. Selanjutnya sayuran dibekukan dalam freezer selama satu malam untuk memudahkan proses pengeringan vakum. Waktu pengeringan dengan freeze dryer dapat berlangsung selama satu sampai dua hari tergantung dari banyaknya sampel. Setelah sampel kering, dilakukan penghancuran menggunakan blender kering sampai dihasilkan sampel kering bubuk yang lolos ayakan 32 mesh. Sampel tersebut kemudian dikemas dalam plastik ber-seal dan disimpan dalam freezer. Sampel siap untuk digunakan dalam
19 ekstraksi. Tahap persiapan sampel dapat dilihat pada Gambar 5. Selanjutnya dilakukan analisis kadar air dan total fenol pada sampel. Analisis kadar air dilakukan secara satu ulangan duplo sedangkan analisis total fenol dilakukan secara dua ulangan duplo.
Analisis Kadar Air menggunakan metode yang dikembangkan oleh AOAC (1984). Penetapan kadar air merupakan cara untuk mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukan pada sampel sayuran segar (awal) dan pada sampel sayuran setelah freeze drying. Penentuan kadar air ini dilakukan dengan metode pengeringan dengan oven biasa. Prinsip dari metode ini adalah air dikeluarkan dari sampel dengan cara menguapkan air yang terdapat dalam bahan pangan.
Persiapan yang perlu dilakukan adalah cawan alumunium yang akan digunakan terlebih dahulu dikeringkan dalam oven pada suhu 100oC selama 15 menit kemudian didinginkan dalam desikator Selama 10 menit. Selanjutnya cawan ditimbang dengan menggunakan neraca analitik. Sampel ditimbang sebanyak kurang lebih 5 gram kemudian dikeringkan dalam oven selama kurang lebih 6 jam. Setelah itu didinginkan dalam desikator kemudian ditimbang. Sampel kembali dikeringkan dalam oven selama 30 menit lalu ditimbang kembali. Perlakuan terakhir ini diulangi terus hingga diperoleh berat kering yang relatif konstan (berat dianggap konstan jika selisih berat sampel kering yang ditimbang ≤ 0,0003 gram).
W = bobot contoh sebelum dikeringkan (g)
W1 = bobot (contoh + cawan) sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
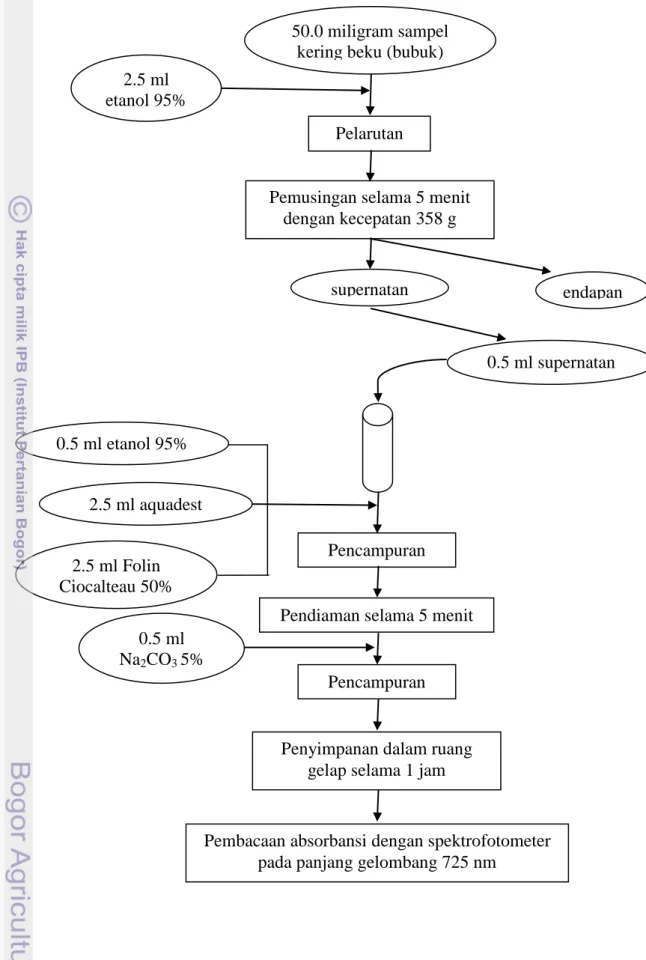
Analisis Total Fenol menggunkan metode yang dikembangkan oleh Shetty et al. (1995) yang dikutip oleh Ishartani (2004). Penentuan total fenol bertujuan untuk mengetahui kandungan senyawa fenol pada sampel. Sampel kering beku bubuk mula-mula diambil sebanyak 50.0 mg dan dilarutkan
Kadar air (%) = W - (W1-W2) x 100% W
20 dalam 2.5 mL etanol 95%, kemudian divorteks. Setelah itu dilakukan sentrifuse terhadap campuran tersebut selama 5 menit dengan kecepatan putaran 358 g. Supernatan diambil sebanyak 0,5 mL dan dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 0.50 mL etanol 95%, 2.5 mL aquadest, dan 2.5 mL reagen folin ciocalteu 50%. Campuran tersebut didiamkan dahulu selama 5 menit, lalu ditambahkan 0.5 mL Na2CO3 5%
dan divorteks. Setelah itu, sampel disimpan dalam ruang gelap selama satu jam, lalu dilakukan pengukuran dengan spektrofotometer pada panjang gelombang 725 nm. Prosedur penentuan total fenol dapat dilihat secara ringkas pada Gambar 6. Standar yang digunakan dalam penentuan total fenol adalah asam galat yang dibeli dari Sigma-Aldrich. Standar asam galat dibuat dengan variasi konsentrasi antara 50 – 250 mg/L.
2. Pembuatan Kurva Standar dan Limit of Detection (LOD)
a. Pembuatan larutan Standar (Mattila dan kumpulainen, 2002)
Sebanyak 24 mg standar yang tersedia dilarutkan dalam 12 mL methanol 62.5%, sehingga diperoleh standar stock dengan konsentrasi 2000 µg/mL. selanjutnya diambil 3.125 mL dari standar stock dimasukan ke dalam labu takar 10 mL, kemudian ditambahkan methanol 62.5% hingga volume mencapai 10 mL, sehingga konsentrasi yang diperoleh adalah 625 µg/mL. Setelah itu dibuat larutan standar campuran dengan cara mencampur ketiga standar yang ada. Volume untuk larutan standar yang dicampur sama besar yaitu 1:1 (v/v). Larutan standar campuran yang digunakan dalam penelitian ini terdiri atas lima konsentrasi, yaitu 125, 250, 375, 500, dan 625 µg/mL. Pembuatan larutan standar campuran dengan konsentrasi 125, 250, 375, 500, dan 625 µg/mL dilakukan dengan melakukan pengenceran dari larutan standar campuran yang memiliki konsentrasi 625 µg/mL. Proses pembuatan larutan standar yang dibutuhkan pada penelitian ini dapat dilihat secara ringkas pada Gambar 10.
21 b. Injeksi larutan standar ke kolom HPLC (Singh et al., 2008).
Larutan standar campuran dengan berbagai konsentrasi tersebut diinjeksikan ke dalam kolom RP C-18 (4.6 x 150 mm, 5µm) dengan kolom guard C-18. Fase gerak yang digunakan yaitu metanol-0.4% asam asetat (80:20, v/v), laju alir 1 mL/menit, volume yang diinjeksikan 20 µl, panjang gelombang 290 nm, dan kondisi isokratik.
c. Pembuatan kurva standar
Hasil dari kromatogram standar campuran pada berbagai konsentrasi (125, 250, 375, 500, dan 625 µg/mL ) kemudian dimasukkan ke dalam satu grafik. Dari data masing-masing, dibuat persamaan garis untuk masing-masing standar yang akan digunakan pada perhitungan Limit of Detection (LOD) masing-masing standar. Persamaan garis tersebut juga digunakan pada perhitungan komponen asam fenolat yang terdapat di sampel.
d. Perhitungan limit deteksi (Rounds dan Nielsen, 2000)
Limit of Detection (LOD) atau limit deteksi diperoleh dengan cara menginjeksikan standar campuran sebanyak sepuluh kali. Konsentrasi yang digunakan untuk menentukan LOD adalah konsentrasi yang terendah yaitu 125 µg/mL. Setelah diperoleh kesepuluh area tersebut, dimasukkan kedalam persamaan kurva standar masing-masing, sehingga diperoleh konsentrasi dan standar deviasinya. Besarnya LOD adalah tiga kali dari nilai standar deviasi.
3. Analisis Asam Fenolat pada Sayuran
a. Ekstraksi Senyawa Asam Fenolat dari Sayuran Indigenous (Mattila dan Kumpulainen, 2002) dengan modifikasi
Ekstraksi senyawa asam fenolat dari sayuran indigenous Indonesia melalui tiga tahap yaitu tahap pertama pengekstrakan dengan methanol 62.5%, tahap kedua hidrolisis basa, dan tahap ketiga hidrolisis asam. Tahap pertama yaitu pelarutan sebanyak 0.5 gram sampel kering beku ke dalam 7 mL methanol 62,5% yang mengandung 10% asam asetat (85:15;v/v) dan 2 g/L BHA sebagai antioksidan. Kemudian divortex agar campuran homogen. Selanjutnya sampel tersebut di ultrasonik selama 30
22 menit. Kemudian volume sampel dibuat menjadi 10 mL dengan cara menambahkan air destilata (aquadest) ke dalamnya. Setelah itu diambil 1 mL sampel, kemudian disaring dengan penyaring berdiameter 0.45µm filter syringe (PTFE) maka didapatkan asam fenolat yang larut (soluble phenolic acid) dan sampel tersebut siap untuk diinjeksikan ke dalam kolom HPLC. Tahap kedua adalah hidrolisis basa, 9 mL sampel sisa pengekstrakan tahap pertama dilanjutkan dengan proses hidrolisis basa. Hasil ekstrak sampel dari hidrolisis basa merupakan insoluble phenolic acid. Selanjutnya hasil ekstrak tersebut diinjeksikan ke kolom HPLC. Tahap ketiga ialah hidrolisis asam, tahapan ini melanjutkan tahap kedua yaitu melakukan proses hidrolisis asam pada lapisan aqueous hasil pengekstrakan dengan tahap kedua. Hasil pengekstrakan tahap ketiga ini merupakan insoluble phenolic acid yang tahan proses hidrolisis basa. Setelah itu hasil pengekstrakan diinjeksikan ke kolom HPLC. Hidrolisis basa dan asam dilakukan karena asam fenolat berada dalam bentuk terikat, dengan demikian fungsi dari hidrolisis basa dan asam di sini untuk membebaskan asam fenolat tersebut dari berbagai senyawa lainnya yang ada di tanaman. Setelah dapat maka sampel siap untuk diinjeksikan ke kolom HPLC. Pada proses awal pengujian ekstrak sampel sayuran melalui ketiga tahapan ekstraksi menunjukkan bahwa senyawa asam fenolat yang diinginkan (asam klorogenat, asam kafeat, dan asam ferulat) terdapat pada ekstrak sampel yang menggunakan tahapan ekstraksi tahap pertama tanpa dilanjutkan ke tahap kedua dan ketiga. Oleh karena itu proses penelitian selanjutnya hanya menggunakan tahapan ekstraksi tahap pertama saja. Prosedur ekstraksi asam fenolat dari sayuran indigenous dapat dilihat pada Gambar 7. Adapun prosedur hidrolisis basa dan hidrolisis asam dapat dilihat pada Gambar 8 dan 9.
. b. Injeksi ekstrak sampel ke kolom HPLC (Singh et al., 2008).
Ekstrak sampel yang telah disaring dengan syringe filter 0.45 µm, diinjeksikan ke dalam kolom RP C-18 (4.6 x 150 mm, 5µm) dengan kolom guard C-18. Fase gerak yang digunakan yaitu metanol-0.4% asam
23 asetat (80:20, v/v), laju alir 1 mL/menit, volume yang diinjeksikan 20 µl, panjang gelombang 290 nm, dan kondisi isokratik.
c. Pembuatan Ko-kromatogram
Pembuatan ko-kromatogram dilakukan dengan cara menginjeksikan ektrak sampel yang telah ditambahkan standar campuran. Volume pencampuran yang digunakan yaitu 1:1 (v/v). Konsentrasi standar campuran yang digunakan adalah konsentrasi tertinggi yaitu 625 µg/mL. Pembuatan ko-kromatogram ini bertujuan memvalidasi keberadaan senyawa asam fenolat yang diinginkan (asam klorogenat, asam kafeat, dan asam ferulat) pada sampel. Standar campuran yang digunakan untuk membuat ko-kromatogram berfungsi sebagai eksternal standar.
d. Identifikasi asam fenolat pada sampel
Hasil dari kromatogram sampel kemudian dibandingkan dengan kromatogram standar campuran. Penentuan komponen yang terdapat pada sampel dilihat berdasarkan waktu retensi masing-masing standar. Dari area yang diperoleh, dihitung konsentrasinya dengan menggunakan persamaan garis dari kurva standar campuran yang sudah diperoleh. Selain itu dilakukan pula perhitungan dengan menggunakan eksternal standar, yaitu dengan membandingkan luas area komponen pada sampel dengan luas area pada standar campuran. Standar campuran yang digunakan sebagai eksternal standar adalah standar campuran dengan konsentrasi yang tertinggi (625 µg/mL).
4. Analisis Statistik
Analisis statistik yang digunakan dalam penelitian ini terdiri dari uji Tukey, uji T, dan Principal Component Analysis (PCA). Uji Tukey digunakan pada taraf 5% untuk melihat apakah perlakuan yang diberikan pada sampel berpengaruh nyata atau tidak. Uji T digunakan untuk membandingkan perhitungan kandungan asam fenolat antara kurva standar campuran dan eksternal standar campuran pada sampel pada taraf 1%. PCA (Principal Component Analysis) merupakan metode statistik yang dapat mengidentifikasi suatu keragaman dinamakan principal component analysis
24 yang dapat menjelaskan jumlah keragaman dari yang terbesar hingga yang jumlah keragaman terkecil yang tersembunyi. Analisis ini dapat menjelaskan 75 % - 90 % dari total keragaman dalam data yang mempunyai 25 sampai 30 variabel hanya dengan dua sampai tiga principal component (Meilgaard et al., 1999).
Gambar 5. Persiapan sampel Penyimpanan dalam freezer Sampel kering beku (bubuk)
Sampel
Pencucian
Penghancuran dengan blender kering Freeze drying selama 48 jam
Sampel kering beku Pembekuan selama 24 jam
25
Gambar 6. Prosedur analisis total fenol
endapan 50.0 miligram sampel
kering beku (bubuk)
0.5 ml supernatan supernatan
Pelarutan
Pemusingan selama 5 menit dengan kecepatan 358 g 2.5 ml etanol 95% 0.5 ml etanol 95% 2.5 ml Folin Ciocalteau 50% 2.5 ml aquadest 0.5 ml Na2CO3 5% Pencampuran Pendiaman selama 5 menit
Pencampuran
Penyimpanan dalam ruang gelap selama 1 jam
Pembacaan absorbansi dengan spektrofotometer pada panjang gelombang 725 nm
26 Gambar 7. Metode ekstraksi asam fenolat dari sayuran indigenous
9 ml sampel sisanya dilakukan Hidrolisis basa (Tahap 2) kemudian hidrolisis asam (Tahap 3) Ambil 1 ml sampel (Tahap 1)
Soluble Phenolic Acid
Insoluble Phenolic Acid (Pencampuran sampai volume 10 ml)
7 ml Campuran Metanol 62.5% (2 g/L BHA 10% Asam Asetat (85:15;v/v)) 0.5 g sampel kering beku Gelas piala 100 ml Vortex Ultrasonik 30 menit Gelas piala 100 ml Aquadest
Saring dengan saringan berdiameter 0.45µm syringe filter (PTFE)
27 Gambar 8. Metode hidrolisis basa
Ditutup, Stirer (magnetic stirer) selama 16 jam pada suhu ruangan (20 oC)
Pemipetan lapisan organic phase (supernatan) 12 ml Air destilata
(1% Asam Askorbat dan 0.415% EDTA) dan
5 ml NaOH 10 M
Sentrifuse 201 g selama 10 menit
Pengekstrakan 3x (15 ml campuran dietil eter dingin dan etil asetat (1:1;v/v))
Vortex 45 detik
Pengaturan pH menjadi pH 2 dengan HCl 6N
Terdapat 2 lapisan yaitu lapisan organic phase dan aqueous
Lakukan hidrolisis asam pada lapisan aqueous Evaporasi dengan rotary vacuum
Residu dilarutkan kembali sebanyak 3kali dalam 1.5 ml metanol/air (75:25;v/v), buat
sampai volume 5 ml (labu takar)
penyaringan dengan diameter 0.45µm Syringe Filter (PTFE) Gelas piala 50 ml 9 ml sampel Disemprotkan nitrogen
28 Gambar 9. Metode hidrolisis asam
Pemipetan lapisan organic phase (supernatan)
Lapisan aqueous
Gelas piala 50 ml 2.5 ml HCl
pekat 12 N
Pengekstrakan 3x (15 ml campuran dietil eter dingin dan etil asetat (1:1;v/v))
Sentrifuse 201 g selama 10 menit
Inkubasi dalam water bath suhu 85oC selama 30 menit
Vortex 45 detik
Terdapat 2 lapisan yaitu lapisan organic phase dan aqueous
residu (lapisan aqueous)
Evaporasi dengan rotary vacuum
Residu dilarutkan kembali sebanyak 3kali dalam 1.5 ml metanol/air (75:25;v/v), buat
sampai volume 5 ml (Labu takar)
penyaringan dengan diameter 0.45µm Syringe Filter (PTFE)
29 Gambar 10. Metode pembuatan standar asam fenolat
24 mg standar asam fenolat Pelarutan 12 ml MeOH(aq) 62.5% Standar stock MeOH(aq) 62,5% 3.125 ml standar stock Larutan standar asam fenolat Pencampuran (sampai volume 10 ml) Labu takar 10 ml
30
IV. HASIL DAN PEMBAHASAN
A. KURVA STANDAR ASAM FENOLAT DAN LIMIT DETEKSI 1. Standar Asam Fenolat Bentuk Tunggal
Pembuatan standar asam fenolat dalam bentuk tunggal ditujukan untuk mengetahui waktu retensi dari masing-masing standar asam fenolat sehingga dapat diketahui benar kapan munculnya senyawa yang diidentifikasi. Konsentrasi yang digunakan dalam pembuatan standar tunggal ini yaitu 625 µg/mL untuk masing-masing standar asam fenolat. Hasil penginjeksian masing-masing standar asam fenolat yang digunakan dijelaskan sebagai berikut:
a. Asam klorogenat
Puncak senyawa asam klorogenat muncul pada kisaran menit ke-2.0 sampai menit ke-2.2. Gambar 11 menunjukkan kromatogram standar asam klorogenat pada konsentrasi 625 µg/mL dengan analisis HPLC.
Gambar 11. Kromatogram standar asam klorogenat dengan analisis HPLC