INSTRUMEN PENILAIAN KOGNITIF
Kompetensi Inti
KI 3 : Memahami ,menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingintahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
Kompetensi Dasar
11.3.9. Menentukan hubungan kuantitatif antara pereaksi dengan hasil reaksi dari suatu reaksi kesetimbangan
11.4.9. Memecahkan masalah terkait hubungan kuantitatif antara pereaksi dengan hasil reaksi kesetimbangan
Indikator
11.3.9.1. Menjelaskan definisi reaksi reversible 11.3.9.2. Menjelaskan definisi reaksi ireversibel 11.3.9.3. Menjelaskan definisi kesetimbangan dinamis
11.3.9.4. Menjelaskan konsep kesetimbangan dan proses apa yang terjadi didalamnya 11.3.9.5. Menjelaskan definisi kesetimbangan homegen dan heterogen
11.3.9.6. Menyatakan tetapan kesetimbangan dalam Kc 11.3.9.7. Menyatakan tetapan kesetimbangan dalam Kp.
11.3.9.8. Menjelaskan hubungan Kc danKp melalui persamaan gas ideal
Lampiran 8
KISI-KISI PENULISAN SOAL
Satuan Pendidikan : Sekolah Menengah Atas (SMA) Alokasi waktu : 60 menit
Mata Pelajaran : Kimia Jumlah Soal : 15 soal
Materi : Kesetimbangan Kimia Bentuk Soal : 15 Pilihan Ganda
Indikator Soal JenjangKogniti f
No
Soal Butir Soal PengetahuaJenis
n
Kunci Jawaban
11.3.9.1. Menjelaskan definisi reaksi reversible
C1 6 Perhatikan peristiwa beikut : 1. Kertas yang dibakar 2. Pelarutan garam dapur 3. Perkaratan besi
4. Penguapan air
Yang merupakan reaksi reversibel ditunjukkan oleh no. …. a. 1 dan 2
b. 2 dan 3 c. 2 dan 4 d. 3 dan 4 e. 1 dan 4
Faktual 2 dan 4 (C)
11.3.9.2. Menjelaskan definisi reaksi ireversibel
C1 1 Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali ….
a. Reaksi reversibel
b. Reaksinya tidak dapat balik c. Terjadi dalam ruang tertutup
d. Tidak terjadi perubahan makroskopis
e. Laju reaksi ke kiri sama dengan laju reaksi ke kanan
Faktual B
C1 9 Suatu kesetimbangan dikatakan dinamis, apabila dalam keadaan setimbang ….
a. Reaksi berjalan dua arah dan bersifat makroskopis b. Ada perubahan dari kiri ke kanan tetapi jumlahnya
setimbang
Lampiran 9
ANALISIS BUTIR SOAL
Satuan Pendidikan : Sekolah Menengah Atas (SMA) Alokasi waktu : 90 menit
Mata Pelajaran : Kimia Jumlah Soal : 15 soal
Materi : Kesetimbangan Kimia Bentuk Soal : 15 Pilihan Ganda dan 3 Uraian
Indikator Soal SoalNo. BentukSoal Kunci C1 C2 C3 C4 C5 C6Jenjang Kognitif Faktual Konseptual Prosedural Mudah Sedang SulitJenis Pengetahuan Tingkat Kesukaran 11.3.9.1. Menjelaskan definisi
reaksi reversible 6 PG C √ √ √
11.3.9.2. Menjelaskan definisi
reaksi ireversibel 1 PG B √ √ √
11.3.9.3. Menjelaskan definisi kesetimbangan
dinamis
9 PG A √ √ √
12 PG E √ √ √
11.3.9.4. Menjelaskan konsep kesetimbangan dan proses apa yang terjadi di dalamnya
15 PG E √ √ √
11.3.9.5. Menjelaskan definisi kesetimbangan
homogen dan heterogen
2 PG E √ √ √
11.3.9.6. Menyatakan tetapan kesetimbangan dalam Kc
3 PG C √ √ √
1 Uraian lampirter √ √ √
7 PG C √ √ √
5 PG C √ √ √
11.3.9.7. Menyatakan tetapan kesetimbangan dalam Kp
2 uraian ter
lampir √
√
√
11 PG B √ √ √
Lampiran 10
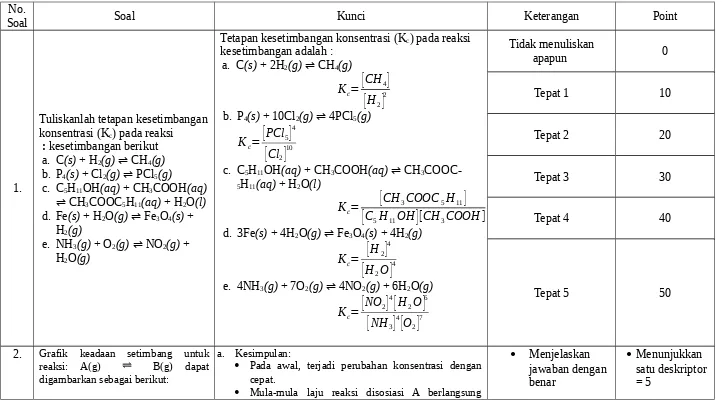
Rubrik Penilaian Soal Tes Uraian Kesetimbangan Kimia
No.
Soal Soal Kunci Keterangan Point
1.
Tuliskanlah tetapan kesetimbangan konsentrasi (Kc) pada reaksi
kesetimbangan berikut :
a. C(s) + H2(g) ⇌ CH4(g) b. P4(s) + Cl2(g) ⇌ PCl5(g)
c. C5H11OH(aq) + CH3COOH(aq) ⇌ CH3COOC5H11(aq) + H2O(l) d. Fe(s) + H2O(g) ⇌ Fe3O4(s) +
H2(g)
e. NH3(g) + O2(g) ⇌ NO2(g) + H2O(g)
Tetapan kesetimbangan konsentrasi (Kc) pada reaksi kesetimbangan adalah :
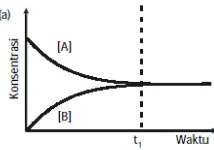
Gambar 1. Grafik Pencapaian Kesetimbangan
c. Bagaimana kesimpulanmu mengenai laju perubahan konsentrasi A dan laju perubahan konsentrasi B sebelum keadaan setimbang tercapai?
d. Dalam kondisi yang sama, mungkinkah keadaan setimbang tercapai dalam waktu kurang dari t1? Jika ya, dalam kondisi bagaimana? Dan jika tidak, mengapa? Berikan alasanmu!
relatif lebih cepat daripada laju pembentukan A. Namun laju reaksi pembentukan A juga makin lama makin bertambah besar sesuai dengan pertambahan jumlah B yang terbentuk.
Pada waktu t, konsentrasi tidak berubah karena sistem berada dalam keadaan kesetimbangan. b. Ya, apabila ditambahkan katalis.
Karena katalis berfungsi untuk mempercepat tercapainya kesetimbangan, sehingga keadaan setimbang tercapai dalam waktu kurang dari t1.
Memaparkan
Pengangkutan oksigen dari paru-paru ke seluruh jaringan oleh hemoglobin (Hb) berlangsung berdasarkan reaksi kesetimbangan:
Hb + O2(aq) ⇌ HbO2 Di dalam paru-paru, reaksi tersebut condong ke kanan, sedangkan dalam jaringan, condong ke kiri. Jelaskan mengapa demikian.
Di dalam paru-paru, reaksi condong ke kanan. Alasannya karena konsentrasi oksigen di dalam paru-paru cukup tinggi sehingga menggeser kesetimbangan ke kanan, yaitu hemoglobin bereaksi dengan oksigen membentuk
oksihemoglobin
Dalam jaringan, konsentrasi oksigen rendah, sehingga reaksi yang sebaliknya yang terjadi, yaitu menghasilkan oksigen untuk digunakan dalam sel tubuh
Menjelaskan jawaban dengan benar
Memaparkan alasan Jawaban dan alasan
saling berhubungan
Lampiran 11
TES PEMAHAMAN MATERI KESETIMBANGAN KIMIA
Mata Pelajaran : Kimia
Kelas/Program : XI
Waktu : 90 Menit
Petunjuk
1. Tidak diperkenankan melihat buku,bekerjasama dan sejenisnya
2. Tidak diperkenankan menggunakan kalkulator dan alat hitung yang lainya 3. Berdoalah sebelum mengerjakan soal
4. Selamat mengerjakan!
I. Pilihlah satu jawaban yang paling tepat.
1. Berikut ini adalah ciri-ciri terjadinya reaksi kesetimbangan, kecuali …. a. Reaksi reversibel
b. Reaksinya tidak dapat balik c. Terjadi dalam ruang tertutup
d. Tidak terjadi perubahan makroskopis
e. Laju reaksi ke kiri sama dengan laju reaksi ke kanan 2. Kesetimbangan reaksi homogen ditunjukkan oleh reaksi ….
a. H2O(g) ⇌ H2O(l)
b. AgCl(s) ⇌ Ag+(aq) + Cl-(aq) c. CaCO3(s) ⇌ CaO(s) + CO2(g) d. Ni(s) + 4CO(g) ⇌ Ni(CO)4(g)
e. Fe3+(aq) + SCN-(aq) ⇌ Fe(SCN)2+(aq) 3. Persamaan reaksi kesetimbangan :
2Na2CO3(s) + 2SO2(g) + O2(g) ⇌ 2Na2SO4(s) + 2 CO2(g) Tetapan kesetimbangan untuk reaksi tersebut adalah ….
a. Kc=
[
Na2SO4]
4. Reaksi yang mempunyai harga Kp = Kc adalah ….a. N2O4(g) ⇌ 2NO2(g) b. H2(g) + S(g) ⇌ H2S(g) c. 2HBr(g) ⇌ H2(g) + Br2(g)
d. N2(g) + 3H2(g) ⇌ 2NH3(g) e. 2SO3(g) ⇌ 2SO2(g) + O2(g)
5. Jika 1 mol AB dalam 1 liter air terurai sebanyak 40% menurut persamaan AB ⇌ A + B, maka tetapan kesetimbangan reaksi tersebut adalah …. a. 0,07
b. 0,09
e. 0,00027
6. Perhatikan peristiwa beikut : 1. Kertas yang dibakar 2. Pelarutan garam dapur 3. Perkaratan besi
4. Penguapan air
Yang merupakan reaksi reversibel ditunjukkan oleh no. …. a. 1 dan 2 = 0,15 mol/L. jika pada saat kesetimbangan masih tersisa I2 = 0,05 mol/L, maka tetapan kesetimbangan ….
8. Tetapan kesetimbangan untuk reaksi : 2SO2(g) + O2(g) ⇌ 2SO3(g) pada suhu 10000K adalah 2,8 x 102. Harga Kp reaksi pada suhu tersebut adalah ….
a. 3,414 b. 2,3 x 103 c. 2,3 x 104
d. 2,414 x 102 e. 3,414 x 102
9. Suatu kesetimbangan dikatakan dinamis, apabila dalam keadaan setimbang …. a. Reaksi berjalan dua arah dan bersifat makroskopis
b. Ada perubahan dari kiri ke kanan tetapi jumlahnya setimbang c. Reaksi dari kiri selalu sama dengan reaksi dari kanan
d. Perubahan kesetimbangan dari kiri dan kanan yang berlangsung terus menerus e. Reaksi berlangsung terus-menerus dan bersifat makroskopis
10. Reaksi CO(g) + H2O(g) ⇌ CO2(g) + H2(g) digunakan oleh industri sebagai sumber hidrogen. Nilai Kc untuk reaksi ini pada 5000C adalah 4. Pada temperatur tersebut nilai Kp adalah ….
11. Harga Kp untuk reaksi kesetimbangan 2X(g) ⇌ 3Y(g) pada suhu tertentu adalah 1 8 . Jika tekanan parsial X sebesar 8, maka tekanan parsial Y sebesar ….
a. 1
64
d. 6 e. 8
12. Suatu sistem kesetimbangan bersifat dinamis mikroskopis, berarti …. a. Tidak terjadi perubahan dan dapat diukur
b. Perubahan berlangsung terus menerus dan dapat diamati
c. Perubahan berlangsung kemudian berhenti sehingga tidak dapat diukur d. Reaksi terus-menerus berlangsung ke kanan dan ke kiri dan dapat teramati e. Reaksi terus-menerus berlangsung ke kanan dan ke kiri tetapi tidak dapat teramati 13. Reaksi PCl5(g) ⇌ PCl3(g) + Cl2(g) mempunyai nilai Kp = 1,25 pada suhu 1500C. pada
suhu tersebut tekanan parsial gas PCl5 dan gas PCl3 dalam kesetimbangan adalah 0,90 atm dan 0,75 atm, maka tekanan parsial gas Cl2 (dalam atm) adalah ….
a. 0,15 b. 0,75 c. 0,90
d. 1,50 e. 1,65
14. Ammonium karbamat, NH4CO2NH2 mengurai menurut reaksi berikut :
NH4CO2NH2(s) ⇌ 2NH3(g) + CO2(g). Jika pada suhu tertentu tekanan gas total sistem adalah 0,30 atm, maka nilai tetapan kesetimbangan Kp adalah ….
a. 2 x 10-2 b. 4 x 10-2 c. 1 x 10-3
d. 2 x 10-3 e. 4 x 10-3
15. Contoh peristiwa alam yang menggunakan prinsip kesetimbangan, kecuali ….
a. Siklus air b. Siklus karbon
c. Siklus oksigen d. Siklus nitrogen
e. Siklus peredaran darah
II. Jawablah dengan singkat dan jelas!
1. Tuliskanlah tetapan kesetimbangan konsentrasi (Kc) pada maing-masing reaksi kesetimbangan berikut!
a. C(s) + H2(g) ⇌ CH4(g) b. P4(s) + Cl2(g) ⇌ PCl5(g)
c. C5H11OH(aq) + CH3COOH(aq) ⇌ CH3COOC5H11(aq) + H2O(l) d. Fe(s) + H2O(g) ⇌ Fe3O4(s) + H2(g)
e. NH3(g) + O2(g) ⇌ NO2(g) + H2O(g)
2. Perhatikanlah grafik keadaan setimbang untuk reaksi: A(g)⇌ B(g) berikut!
a. Bagaimana kesimpulanmu mengenai laju perubahan konsentrasi A dan laju perubahan konsentrasi B sebelum keadaan setimbang tercapai?
b. Dalam kondisi yang sama, mungkinkah keadaan setimbang tercapai dalam waktu kurang dari t1? Jika ya, dalam kondisi bagaimana? Dan jika tidak, mengapa? Berikan alasanmu! 3. Pengangkutan oksigen dari paru-paru ke seluruh jaringan oleh hemoglobin (Hb) berlangsung
berdasarkan reaksi kesetimbangan:
Hb + O2(aq) ⇌ HbO2.
Indikator :
11.4.9.1. Menafsirkan data percobaan mengenai konsentrasi pereaksi dan hasil reaksi pada keadaan setimbang untuk menentukan tetapan kesetimbangan (Kc dan Kp) 11.4.9.2. Menulis laporan hasil diskusi mengenai konsentrasi pereaksi dan hasil reaksi pada keadaan setimbang untuk menentukan tetapan kesetimbangan (Kc dan Kp) No
. Aspek Kinerja yang dinilai
Memperhatikan tabel dengan teliti
2 Menuliskan temuan yang diperoleh berdasarkan tabel yang telah diamati 3 Menuliskan hal-hal yang tidak dipahami berdasarkan pengamatan yang telah
dilakukan
4 Merumuskan persamaan yang menunjukkan harga perbandingan dari konsentrasi-konsentrasi yang ada
5 Menuliskan persamaan kesetimbangan yang benar
6 Merumuskan apa yang dimaksud dengan tetapan kesetimbangan 7 Mengerjakan latihan yang ada di LKS
8 Berdiskusi di dalam kelompok dalam merumuskan jawaban setiap masing-masing pertanyaan
9 Mempresentasikan hasil diskusi kelompok
FORMAT PENILAIAN KINERJA (PERFORMANCE ASSESSMENT)
Nama Siswa : ………
Kelas : ………
Tanggal : ………
Pedoman Pengisian :
Berikan tanda checklist (√) pada kolom ya atau tidak sesuai dengan yang dikerjakan oleh siswa!
No
. Aspek Kinerja yang dinilai
Jawaban
Ya Tidak
Memperhatikan tabel dengan teliti
2 Menuliskan temuan yang diperoleh berdasarkan tabel yang telah diamati
3 Menuliskan hal-hal yang tidak dipahami berdasarkan pengamatan yang telah dilakukan
4 Merumuskan persamaan yang menunjukkan harga perbandingan dari konsentrasi-konsentrasi yang ada 5 Menuliskan persamaan kesetimbangan yang benar 6 Merumuskan apa yang dimaksud dengan tetapan
kesetimbangan
7 Mengerjakan latihan yang ada di LKS
8 Berdiskusi di dalam kelompok dalam merumuskan jawaban setiap masing-masing pertanyaan
9 Mempresentasikan hasil diskusi kelompok 10 Jawaban LKS sesuai dengan yang seharusnya
Kriteria penskoran, jika siswa melakukan sesuai dengan rubrik yang telah disediakan mendapat nilai 1 jika tidak melakukan nilai 0.