Laporan Praktikum KI2241
Energetika Kimia
Percobaan C-2
KESETIMBANGAN KIMIA
Nama : Intan Mulyani
NIM : 10513090
Kelompok / Shift : 8 / Kamis Pagi Tanggal Percobaan : 26 Maret 2015 Tanggal Pengumpulan : 2 April 2015 Asisten : Iis (20514029)
Reksy (10511106)
LABORATORIUM KIMIA FISIK PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI BANDUNG
I. Judul Percobaan
Kesetimbangan kimia
II. Tujuan Percobaan
1. Menentukan koefisien distribusi I2 dalam air dan kloroform. 2. Menentukan tetapan kesetimbangan reaksi, I2 + I- I3
-III. Teori Dasar
Kesetimbangan kimia adalah keadaan dimana tidak ada perubahan menyuluruh yang dapat teramati (walapun aktivitas yang berkesinambungan terus berlangsung dalam tingkat molekul). Suatu reaksi kimia dikatakan setimbang jika reaksi dapat berlangsung dalam dua arah (reversible), dengan catatan jumlah molekul-molekul yang terurai dari produk sama dengan jumlah molekul-molekul reaktan (Chang, 2004: 92). Kesetimbangan kimia terjadi apabila laju reaksi ke arah reaktan sama dengan laju reaksi ke arah produk. Reaksi kimia bergerak menuju kesetimbangan dinamis, dimana terdapat reaktan dan produk tetapi keduanya tidak lagi mempunyai kecenderungan untuk berubah. (Atkins, 1990: 226).
Dalam kesetimbangan kimia, terdapat konstanta kesetimbangan kimia yang merupakan suatu persamaan yang menghubungkan konsentrasi reaktan dan konsentrasi produk dalam keadaan setimbang. Rumus ini didasarkan pada bukti empiris (Chang, 2004: 68). Setiap reaksi kestimbangan pasti memiliki konstanta kesetimbangan yang berbeda. Konstanta kesetimbangan ada kaitannya dengan fungsi Gibbs reaksi (G) yang dinyatakan sebagai berikut.
G = Go – RT.ln K
Pada saat setimbang, Go=0, sehingga G = – RT.ln K
Konstanta kesetimbangan ini dipengaruhi oleh reaksi dan kondisi reaksi tersebut. Hal-hal yang mempengaruhi kesetimbangan adalah konsentrasi reaktan, konsentrasi produk, tekanan, suhu, dan volume.
Kesetimbangan homogen berlaku untuk reaksi yang semua spesi bereaksinya terdapat dalam fasa yang sama. Reaksi reversibel yang melibatkan reaktan dan produk dalam fasa yang berbeda menghasilkan kesetimbangan heterogen (Chang, 2004: 69). Jika terdapat dua pelarut yang saling tidak melarutkan, maka akan terbentuk dua buah fasa. Apabila ke dalam campuran pelarut tersebut ditambahkan zat yang larut dalam keduanya, maka zat tersebut akan terdistribusi ke dalam dua pelarut tersebut, misalnya iodin. Iodin merupakan zat yang nonpolar, sehingga tentu iodin akan larut dalam pelarut yang nonpolar. Namun, setiap zat mempunyai potensial kimia yang mengharuskan agar campuran iodin dan pelarut homogen. Dengan adanya potensial kimia ini, iodin akan larut sebagian pada air yang bersifat polar. Daya kelarutan iodin pada pelarut nonpolar
akan sangat besar sedangkan pada pelarut polar sdaya kelarutannya sangat kecil. Iodin akan bermigrasi dalam air. Pada saat kesetimbangan, potensial kimia iodin pada fasa yang polar akan sama dengan potensial kimia iodin pada fasa yang nonpolar.
µ1 = µ2
Jika kedua larutan encer ideal, maka, µ1 = µ1o + RT ln x1
Sehingga,
µ1o + RT ln x1 = µ2o + RT ln x2
Karena µ1o dan µ2o tidak bergantung pada komposisi, maka pada T tetap,
x1 x2
=k⟺[A ]1 [A ]2
=k ; dimana k adalah koefisien distribusi zat dalam pelarut (KD) Koefisien distribusi zat merupakan perbandingan konsentrasi zat pada pelarut organik dan pelarut air. KD sangat bergantung sekali pada suhu, karena kelarutan suatu zat dipengaruhi oleh suhu (Alberty, 1983: 159).
Pada penentuan tetapan kesetimbangan (KC) dari reaksi iodin, konsentrasi iodin tidak dapat ditentukan secara langsung karena kelarutan iodin sangat kecil di dalam air. Untuk menentukan konsentrasi iodin ini, dilakukan distribusi iodin pada campuran pelarut air dan kloroform. Dengan mengetahui koefisien distribusi dari iodin, konsentrasi iodin dalam air dapat ditentukan. Karena KD sangat bergantung pada suhu, maka penentuan konsentrasi iodin, iodida, dan iodat juga harus dilakukan pada suhu yang sama.
IV. Data Pengamatan
Massa kristal KIA = 2,01 g Massa kristal KIB = 2,01 g [Na2S2O3] = 0,0164 M
[KI] = 0,0973 M
Terlenmeyer A = 31oC
Terlenmeyer B = 31oC
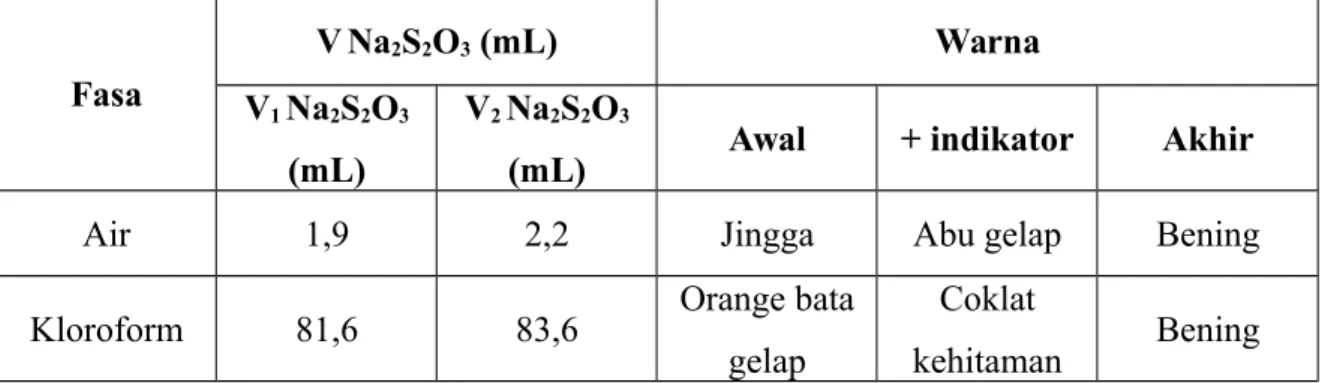
Tabel 1. Data Pengamatan Erlenemeyer A
Fasa
VNa2S2O3 (mL) Warna
V1 Na2S2O3
(mL)
V2 Na2S2O3
(mL) Awal + indikator Akhir
Air 1,9 2,2 Jingga Abu gelap Bening
Kloroform 81,6 83,6 Orange bata gelap
Coklat
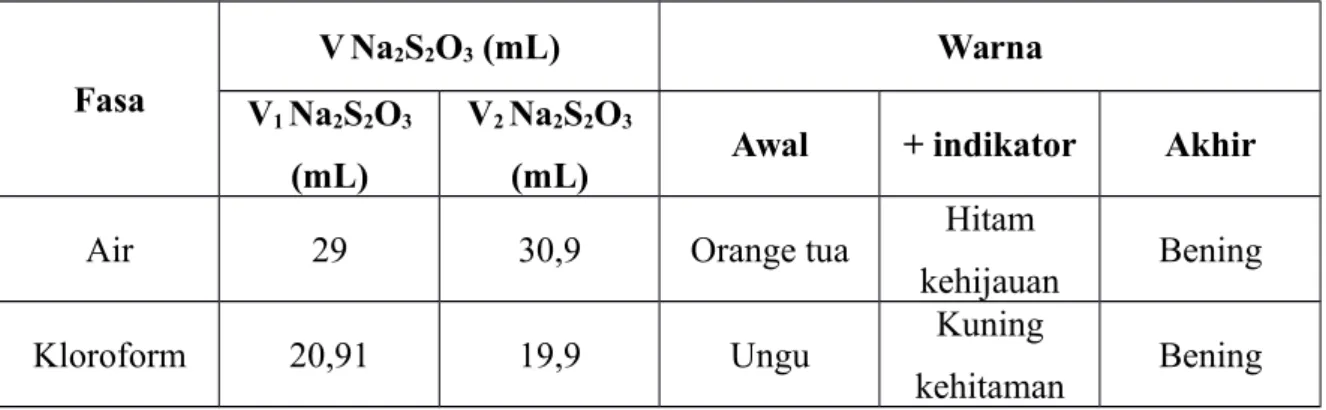
Tabel 1. Data Pengamatan Erlenemeyer B Fasa VNa2S2O3 (mL) Warna V1 Na2S2O3 (mL) V2 Na2S2O3
(mL) Awal + indikator Akhir
Air 29 30,9 Orange tua Hitam
kehijauan Bening
Kloroform 20,91 19,9 Ungu Kuning
kehitaman Bening V. Pengolahan Data I2 + 2S2O32- 2I- + S4O6 2-a. Perhitungan KD (erlnemeyer A) 1. [I2] dalam CHCl3
[
Na2S2O3]
×VNa2S2O3=VI2×[
I2]
CHCl 3×2[
I2]
CHCl 3=[
Na2S2O3]
×VNa2S2O3 VI2×2 = 0,0164 M ×82,6 mL 5 mL× 2 =0,1355 M2. [I2] dalam air
[
Na2S2O3]
×VNa2S2O3=VI2×[
I2]
CHCl 3×2[
I2]
H2O=[
Na2S2O3]
×VNa2S2O3 VI2×2 = 0,0164 M × 2,05 mL 5 0 mL×2 =3,362 ×10 −4 M 3. Nilai KD KD=[
I2]
CHCl 3[
I2]
H2O = 0,1355 M 3,362 ×10−4M=403,0339 b. Perhitungan KD (erlnemeyer B) 1. [I2] dalam CHCl3[
Na2S2O3]
×VNa2S2O3=VI2×[
I2]
CHCl3×2[
I2]
CHCl 3=[
Na2S2O3]
×VNa2S2O3 VI2×2 = 0,0164 M ×20,405 mL 5 mL×2 =0,0335 M2. [I2] dalam air
[
Na2S2O3]
×VNa2S2O3=VI2×[
I2]
CHCl 3×2[
I2]
H2O=[
Na2S2O3]
×VNa2S2O3 VI2×2 = 0,0164 M × 29,95 mL 25 mL×2 =9,8236× 10 −3 M = xc. Konsentrasi I2 bebas dalam air
KD=
[
I2]
CHCl 3[
I2]
H2O [I2]H2O=[
I2]
CHCl3 KD =0,0335 M 403,0339=8,3120× 10 −5 =y d. Konsentrasi I3 -I2 + I- I3 -[I3-] = x –y [I3-] = 9,8236 ×10−3 M – (8,3120 x 10-5) M [I3-] = 9,7405 x 10-3 M e. Konsentrasi I -KI K+ + I -[I-] = [KI] – (x-y) [I-] = 0,0973 M – (9,7405 x 10-3) M [I-] = 0,0876 M f. Tetapan kesetimbangan (KC) −¿ I3 ¿ ¿ −¿ I¿ ¿[
I2]
¿ ¿ KC=¿ KC= x − y y([
KI]
−(x− y ))
KC= 9,7405 ×10 −3M(
8,3120 ×10−5M)
(0,0876 M ) KC=1337,7397 L .mol−1VI. Kesimpulan
1. Koefisien distribusi I2 dalam air dan kloroform adalah 403,0339
2. Tetapan kesetimbangan reaksi (KC) I2 + I- I3- adalah 1337,7397 L.mol-1
VII. Daftar Pustaka
Chang, Raymond. 2003. Kimia Dasar : Konsep-Konsep Inti, Jilid 2, Edisi Ketiga. Jakarta: Erlangga. Hlm 67-95.
Atkins, P. W. 1990. Kimia Fisika, Jilid 1, Edisi Keempat. Jakarta: Erlangga. Hlm. 226-230.
Alberty, A. Robert., Farrington Daniels. 1983. Kimia Fisika Edisi Kelima. Jakarta: Erlangga. Hlm. 159-162.
LAMPIRAN I
PERTANYAAN
1. Pada percobaan ini apa tujuan dari penyamaan suhu pada kedua erlenmeyer menggunakan termostat ?
2. Jelaskan prinsip penentuan tetapan kesetimbangan secara tidak langsung dan hubungan antara Kc dan KD pada percobaan ini !
3. Jika ada suatu substrat, misalnya A, larut dalam pelarut B, tetapi kurang larut dalam pelarut C, dimana pelarut B dan pelarut C tidak saling melarutkan, jika A dilarutkan dalam pelarut B dan C, maka :
a. Jika definisi K d= [A ]C
[A]B , berapakah nilai Kd ? <1 atau >1 ? Artinya apa dan
mengapa ?
b. Jika B sifatnya polar dan C nonpolar, apa sifat dari substrat A ? c. Kapan MA pada pelarut B sama dengan MA pada pelarut C ?
1. Pada percobaan ini menggunakan dua buah erlenmeyer, agar data Kd yang telah dihitung dapat digunakan pada kedua larutan (tetap), maka suhu dalam kedua larutan haruslah sama, karena nilai Kd bergantung pada suhu.
2. Pada penentuan tetapan kesetimbangan (Kc) dari reaksi iodin, konsentrasi iodin tidak dapat ditentukan secara langsung karena kelarutan iodin sangat kecil di dalam air. Untuk menentukan konsentrasi iodin ini, dilakukan distribusi iodin pada campuran pelarut air dan kloroform. Dengan mengetahui koefisien distribusi (Kd) dari iodin, konsentrasi iodin dalam air dapat ditentukan.
Kd=[I2]CCl4 [I2]H2O −¿ I3¿ ¿ −¿ I¿ ¿
[
I2]
¿ ¿ KC=¿ KC=(
[
I2]
H2O)
A−(
[
I2]
CHCl3)
B KD(
[
I2]
CHCl3)
B KD ×(
[
KI]
−(
(
[
I2]
H2O)
A−(
[
I2]
CHCl3)
B KD)
)
3. a. Kd < 1, artinya zat A merupakan zat yag larut dalam fasa air dan bersifat polar, karena pelarut C merupakan pelarut organik yang bersifat nonpolar dan pelarut B merupakan pelarut air yang bersifat polar.
b. Zat A bersifat polar