LAPORAN PRAKTIKUM PTK III KIMIA ORGANIK
“PEMBUATAN NITROBENZENA”
DISUSUN OLEH KIDUNG WULAN UTAMI
(1513008)
KEMENTERIAN PERINDUSTRIAN REPUBLIK INDONESIA
POLITEKNIK STMI JAKARTA
Jalan Letjen Soeprapto No. 26 Cempaka Putih-Jakarta Utara 10510 Telp. (021) 42886064 Fax. (021) 42888206
I. JUDUL PERCOBAAN :
PEMBUATAN NITROBENZENA
II. PRINSIP PERCOBAAN
Nitrasi adalah suatu reaksi subtitusi gugus Nitro (NO2) ke dalam senyawa
Benzena (C6H6).
III. MAKSUD DAN TUJUAN
o Untuk mengetahui pembuatan Nitrobenzena dari Benzena dan asam Nitrat menggunakan katalis asam Sulfat H2SO4
o Untuk memurnikan Nitrobenzena dengan cara distilasi
o Untuk mengetahui sifat fisika dan kimia Nitrobenzena
o Untuk mengetahui refraksi dari Nitrobenzena praktis
IV. REAKSI
C6H6 + HNO3 → C6H5NO2 + H2O
V. LANDASAN TEORI
Senyawa organik secara umum digolongkan sebagai senyawa hidrokarbon aromatis. Senyawa hidrokarbon aromatis adalah senyawa hidrokarbon dengan rantai atom karbon tertutup (siklis). Senyawa hidrokarbon aromatis digolongkan menjadi senyawa aromatis hidrokarbon dan senyawa aromatis heterosiklis. Senyawa romatik hidrokarbon misalnya senyawa Benzena dengan turunannya. Sedangkan senyawa aromatis heterosiklis misalnya Piridin, Furan dan Pirol.
(NO2). Digunakan pada pembuatan beberapa jenis sabun dan minyak wangi, serta
juga pada produksi pembuatan Aniline. Gugus Nitro (NO2), terikat pada rantai
Benzena, dengan formula sederhananya C6H5NO2.
BAHAN BAKU Benzena (C6H6)
Benzena merupakan bahan baku utama pembuatan Nitrobenzena. Benzena sering disebut petroleum atanu bensol. Benzena memiliki struktur yang merupakan suatu hybrid resonansi yang digambarkan struktur kekule.
Rumus molekul
Benzen a memperhatikan
ketidak jenuhan sifat adisi seperti halnya alkena atau alkuna. Dengan larutan alkalis Kalium Permanganat (KMnO4) maka Benzena tidak mengadisi gugus (OH), sedang
Etena mengadisinya. Jelaslah sudah bahwa sifat-sifat Benzena berbeda dengan alifatik tak jenuh.
Bukti Rumus Benzena
Karena dari Benzena hanya dikenal sebuah hasil monosubtitusi, jadi hanya ada sebuah Fenil Klorida C6H5Cl, sebuah Fenol C6H5OH dan sebagainya, maka semua
atom H dari Benzena adalah seharga.
Rumus Bangun:
atau atau
Jika dilihat pada gambar maka dapat bahwa Benzena mudah disubtitusi tetapi tidak mudah diadisi, ikatan Benzena dapat berpindah tempat (resonansi). Hal ini dijelaskan bahwa ikatan rangkap ini berpindah-pindah sehingga akan mempunyai struktur yag sama dengan pada saat electron berpindah.
Dapat disimpulkan bahwa struktur Benzena lebih stabil jika dilihat dari struktur resonansi. Benzena tidak mengandung ikatan rangkap atau tunggal dari karbon-karbon, tetapi keenam elektron terbagi rata pada tiap-tiap karbonnya hingga panjang ikatan karbonnya sama.
Sifat Fisika Sifat Kimia
Merupakan zat cair tidak berwarna Ikatan rangkap dua pada Benzena mempunyai sifat seolah jenuh
Tidak larut dalam air, tetapi larut dalam alkohol, eter, aseton
Dengan katalisator tertentu dapat mengalami oksidasi atau adisi dengan gas Hidrogen dan Halogen
Uap Benzena bersifat toksik (racun) Hidrolisis asam Benzena Sulfonat (dipanaskan dengan Hidrokarbon)
Titik didih = 80oC
Reaksi Adisi
a) Dengan katalisator Nikel atau Platina temperatur 200oC Benzena beradisi dengan
gas Hidrogen
b) Dengan katalisator cahaya matahari Benzena beradisi dengan gas khlor/brom.
Ket: Walaupun dengan suhu tinggi katalisator Ni reaksi berekasi lambat.
Reaksi Oksidasi
Pada suhu kamar dalam suasana asam dengan oksidator Kalium atau Potassium permanganate atau Bichromat katalisator Vanadium Benzena teroksidasi menjadi anhidrida asam Atendikarboksilat 1,2 (asam Fumarat).
Reaksi Subtitusi
Hidrogenasis dengan zat gas halogen (Cl atau Br2) kecuali iod bereaksi lambat
Nitrasi dengan asam Nitrat pekat katalisator asam Sulfat pekat, membentuk Nitrobenzena.
C6H6 + HNO3 C6H5NO2 + H2O
Sulfonasi dengan asam Sulfat pekat berasap (campuran H2SO4) dengan SO3
membentuk asam Benzene Sulfonat.
Sintesa friedel Crafts : reaksi suatu alkil halogenida atau karbon halogenida dengan direaksikan dengan golongan halide katalisator AlCl3
Kegunaan Benzena :
1. Sebagai bahan pelarut utama terutama lemak atau karet, alkaloid, dammar 2. Bahan sintesa untuk fenol, analine atau zat warna
3. Sebagai insektisida 4. Bahan dasar nilon GG
ASAM NITRAT (HNO3)
Asam Nitrat adalah larutan Nitrat (NO2) dalam air, yang dalam perdagangan
terdapat berbagai macam konsentrasi. Banyak digunakan dalam industri pupuk, produksi berbagai macam bahan kimia, zat warna, bahan farmasi, serta dipakai dalam reagen laboratorium. Asam Nitrat adalah bahan kimia yang korosif dan merupakan oksidator kuat.
Senyawa kimia asam Nitrat (HNO3) adalah sejenis cairan korosif yang tak
berwarna, dan merupakan asam beracun yang dapat menyebabkan luka bakar. Larutan asam Nitrat dengan kandungan asam Nitrat lebih dari 86% disebut sebagai asam Nitrat berasap, dan dapat dibagi menjadi dua jenis asam, yaitu asam Nitrat berasap putih dan asam Nitrat berasap merah. Asam Nitrat memiliki nama lain yaitu Nitric Acid, Asam Sendawa, Aqua Fortis, Azotic Acid, Hydrogen Nitrate, Nitryl Hidroxides.
Proses modern untuk menghasilkan asam Nitrat (HNO3) adalah okidasi Ammonia
di udara. Dalam proses ini, Ammonia dicampur dengan udara berlebih, dan campurannya dipanaskan sampai temperatur tinggi dengan katalis Platina (Pt). Amonia akan diubah menjadi Nitrogen oksida (NO), yang kemudian dioksidasi lebih lanjut di udara menjadi Nitrogen dioksida (NO2). Nitrogen dioksida direaksikan
dengan air menghasilkan asam Nitrat.
Sifat Fisika Sifat Kimia
Asam Nitrat murni 100% merupakan cairan tak berwarna dengan berat jenis 1,522 kg/m3 dan
mengeluarkan asap atau uap
Bila dipanaskan mudah terurai 4HNO3 4NO2 + O2 + 2H2O
Membeku pada suhu -42oC membentuk Kristal
putih dan mendidih pada suhu 83 oC
Berfungsi sebagai :
Bereaksi dengan air menghasilkan azeotrop dengan konsentrasi 68% HNO3 dan titik didih 120.5 oC
(1 atm)
2. Zat pengoksidasi, belerang teroksidasi menjadi H2SO4 dan fosfor tereduksi menjadi H3PO4
3. Penitro, HNO3 bereaksi dengan senyawa organic
lebih sering membentuk CO2 dan H2O tetapi dalam banyak hal mengakibatkan pergantian suatu atom atau lebih H dari senyawa organic dan gugus NO2.
Kegunaan Asam Nitrat:
1. Di laboratorium digunakan sebagai pelarut bijih mineral atau sebagai pengoksidasi (pengabuan basah).
2. Dalam aneka industri, misalnya:
HNO3 encer untuk membuat pupuk buatan (NaNO3, Ca(NO3)2)
HNO3 pekat untuk membuat bahan peledak (nitro selulosa, nitro gliserin,
TNT), serta untuk membuat zat warna azo, anilin, nitril, sianida, dan lain-lain. 3. Sebagai oksidator dalam pembuatan asam sulfat (cara bilik-asam Glover).
BAHAN TAMBAHAN ASAM SULFAT (H2SO4)
Nitrobenzena dibuat dengan mereaksikan Benzena dengan asam Nitrat dengan bantuan asam Sulfat pekat sebagai katalisator. Reaksi tanpa katalis akan berjalan lambat. Katalis bertindak sebagai asam lewis yang akan mengubah elektrofil lemah menjadi elektrofil kuat. Ion Nitronium (NO2+ dari HNO3) merupakan elektrofil pada
proses ini. Adanya substituen lain pada cincin aromatic sebelum di Nitrasi dapat mempercepat reaksi dan ada juga yang memperlambat reaksi. Substituen CH3 akan
mempercepat reaksi, karena ia akan membuat cincin lebih reaktif, sedangkan substituen Cl- dapat memperlambat Nitrasi.
Sifat Fisika Sifat Kimia
Asam Sulfat memiliki aroma yang khas yaitu
bau belerang Asam Sulfat merupakan asam kuat
Berbentuk cair, dan bersifat korosif Asam Sulfat encer tidak bereaksi dengan Bi, Hg, Cu dan logam mulia
Bersifat higroskopis (kemampuan menyerap molekul air yang baik)
Asam Sulfat pekat akan mengoksidasi logam-logam
Titik didih = 240oC
Titik beku = 10oC
Berat jenis = 1,84 gram/ mL
Asam Sulfat merupakan oksidator dan reduktor terkuat
Kegunaan Asam Sulfat
Ca5F(PO4)3 + 5 H2SO4 + 10 H2O → 5 CaSO4• 2H2O + HF + 3 H3PO4
Asam Sulfat digunakan dalam jumlah yang besar oleh industri besi dan baja untuk menghilangkan oksidasi, karat, dan kerak air sebelum dijual ke industri otomobil. Asam yang telah digunakan sering kali didaur ulang dalam kilang regenerasi asam bekas. Kilang ini membakar asam bekas dengan gas alam, gas kilang, bahan bakar minyak, ataupun sumber bahan bakar lainnya. Proses pembakaran ini akan menghasilkan gas sulfur dioksida (SO2) dan sulfur trioksida (SO3) yang kemudian
digunakan untuk membuat asam Sulfat yang "baru".
Ammonium Sulfat, yang merupakan pupuk Nitrogen yang penting, umumnya diproduksi sebagai produk sampingan dari kilang pemroses kokas untuk produksi besi dan baja.
Kegunaan asam sulfat lainnya yang penting adalah untuk pembuatan Aluminium Sulfat. Alumunium sulfat dapat bereaksi dengan sejumlah kecil sabun pada serat pulp kertas untuk menghasilkan Aluminium Karboksilat yang membantu mengentalkan serat pulp menjadi permukaan kertas yang keras. Aluminium sulfat juga digunakan untuk membuat aluminium hidroksida.
Digunakan pada pembuatan beberapa jenis sabun dan minyak wangi, serta juga pada pembuatan aniline(C6H5NH2). Nitrobenzena Golongan nitro (NO2) terikat pada rantai
Benzena formula sederhananya Nitrobenzena (C6H5NO2).
Nitrobenzena termasuk dalam golongan Benzena, dengan beberapa sifat Benzena yaitu meskipun Benzena tampak sebagai suatu senyawa yang sangat jenuh, namun tidak mempunyai sifat adisi yang kuat, dimana Hidrogen dapat di adisi hanya jika ada katalis yang tepat, seperti Nikel (Ni) atau Platina (Pt) halus, Benzena dapat juga mengadisi Klorin (Cl) atau Bromine (Br) jika terkena sinar matahari, sehingga terbentuk Heksaklorosikloheksana atau Heksa-bromosikloheksana. Sifat selanjutnya yaitu Klorine dan Bromine dapat juga mensubtitusi atom-atom Hidrogen dari Benzena asalkan terdapat katalis yang tertentu.
Sifat Fisika Sifat Kimia
Zat cair berwarna kuning. Nonpolar
Titik didih 210,8oC Tidak larut dalam air
Titik cair 5,7oC. Mudah menguap dan terbakar
Indeks bias 1,5530. Larut dalam eter
Berat jenis 1,2037 g/mL. Tidak dapat dioksidasi oleh KMnO4
Berat molekul 123 g/mol Jika direduksi membentuk anilin
Nitrobenzena adalah benar-benar senyawa Nitro sebab tidak dapat dipersabunkan oleh Kalium hidroksida (KOH) dan pada reduksi dengan gas Hidrogen H2
membentuk Fenil Amina (Anilin)
Ammonium Klorida. Jika Anilium Chloride dipanaskan dengan NaOH makan Fenil Amina dapat dibebaskan.
Kegunaan Nitrobenzena:
1. Bahan dasar pembuatan anilina
2. Sebagai pemberi aroma sabun
3. Pembuatan semir sepatu
4. Pembuatan piroksilin
5. Bahan kimia karet dan peptisida
6. Bahan peledak 7. Bahan pembuat cat
8. Bahan campuran minyak nabati 9. Bahan solvent (zat pelarut)
METODE PROSES Distilasi
Distilasi merupakan teknik pemisahan yang didasari atas perbedaan perbedaan titik didik atau titik cair dari masing-masing zat penyusun dari campuran homogen. Dalam proses destilasi terdapat dua tahap proses yaitu tahap penguapan dan dilanjutkan dengan tahap pengembangan kembali uap menjadi cair atau padatan. Atas dasar ini maka perangkat peralatan destilasi menggunakan alat pemanas dan alat pendingin.
pendingin, proses pendinginan terjadi karena kita mengalirkan air kedalam dinding (bagian luar condenser), sehingga uap yang dihasilkan akan kembali cair. Proses ini berjalan terus menerus dan akhirnya kita dapat memisahkan seluruh senyawa-senyawa yang ada dalam campuran homogen tersebut.
Macam-Macam Distilasi :
1. Distilasi Sederhana, prinsipnya memisahkan dua atau lebih komponen cairan berdasarkan perbedaan titik didih yang jauh berbeda.
2. Distilasi Fraksionasi (Bertingkat), sama prinsipnya dengan distilasi sederhana, hanya distilasi bertingkat ini memiliki rangkaian alat kondensor yang lebih baik, sehingga mampu memisahkan dua komponen yang memiliki perbedaan titik didih yang berdekatan.
3. Distilasi Azeotrop : memisahkan campuran azeotrop (campuran dua atau lebih komponen yang sulit di pisahkan), biasanya dalam prosesnya digunakan senyawa lain yang dapat memecah ikatan azeotrop tersebut, atau dengan menggunakan tekanan tinggi.
4. Distilasi Kering : memanaskan material padat untuk mendapatkan fasa uap dan cairnya. Biasanya digunakan untuk mengambil cairan bahan bakar dari kayu atau batu bata.
5. Distilasi Vakum: memisahkan dua kompenen yang titik didihnya sangat tinggi, motede yang digunakan adalah dengan menurunkan tekanan permukaan lebih rendah dari 1 atm, sehingga titik didihnya juga menjadi rendah, dalam prosesnya suhu yang digunakan untuk mendistilasinya tidak perlu terlalu tinggi.
Kelebihan Destilasi :
1. Dapat memisahkan zat dengan perbedaan titik didih yang tinggi. 2. Produk yang dihasilkan benar-benar murni.
Kekurangan Destilasi :
1. Hanya dapat memisahkan zat yang memiliki perbedaan titik didih yang besar. 2. Biaya penggunaan alat ini relatif mahal.
3. Diperlukan energi yang besar dalam memanaskan larutan.
4. Dibutuhkan waktu yang lama untuk mendapatkan larutan dengan titik didih yang tinggi.
VI. DIAGRAM ALIR PROSES
Campurkan 42 ml H2SO4 dengan
HNO3 37 ml sedikit demi sedikit,
campuran didinginkan di air
Tambahkan Benzena sambil terus diaduk, sedikit demi sedikit
Camputan dipanaskan diatas water bath selama 30 menit, sambil terus
diaduk Setelah dingin ditambahkan ke
dalamnya 500 ml air, lalu kocok hingga membentuk 2 lapisanKedua lapisan dipisahkan dengan
corong pemisah, lalu tambahkan 300 ml air dan kocok lagi hingga
VII. ALAT DAN BAHAN A. ALAT :
- Statif - Water bath
- Termometer - Styg buis
- Klem - Pendingin udara
- Corong pemisah - Labu Erlenmeyer
- Tutup gabus - Gelas ukur
- Labu distilasi - Labu bulat 250ml B. BAHAN :
Pisahkan lapisan atas dan lapisan bawah yang terbentuk dengan corong
pemisah
Lapisan atas dipisahkan kemudian ditambah dengan sedikit CaCl2
exicatus Kemudian Nitrobenzena
dipisahkan dari CaCl2 dengan
disuling tanpa memakai mantel air
- Benzena (C6H6)
1) Tuangkan 42 ml H2SO4 ke dalam tabung 500 ml, kemudian perlahan-lahan
masukkan HNO3 sedikit demi sedikit sebanyak 37 ml, campuran didinginkan
di air dingin
2) Setelah dingin dimasukkan sedikit demi sedikit Benzena sambil terus diaduk, pada saat Benzena dimasukkan akan timbul warna cokelat yang akan hilang, jika suhu sudah tinggi masukkan kedalam air dingin
3) Untuk menyempurnakan reaksi, campuran tadi dipanaskan diatas water bath selama 30 menit, selama pemanasan berlangsung campuran harus selalu dikocok agar tercampur sempurna
4) Dinginkan labu yang berisi campuran tadi, setelah dingin ditambahkan ke dalamnya 1500 ml air, akan terbentuk 2 lapisan yang berbeda di dalam air, kemudian pisahkan kedua lapisan dengan corong pemisah
5) Cairan yang seperti minyak dicuci dengan air menggunakan corong pemisah, cairan seperti minyak itulah Nitrobenzena
6) Kedalam Nitrobenzena yang masih keruh dimasukkan CaCl2 exicatus, biarkan
beberapa saat (kocoklah sampai cairan menjadi jernih)
7) Untuk mempercepat juga dapat dilakukan dengan cara memanaskannya diatas water bath
8) Kemudian Nitrobenzena dipisahkan dari CaCl2 lalu disuling tanpa memakai
mantel air
9) Pertama yang keluar sebagai distilat adalah air kemudian Nitrobenzena pada suhu 205-207oC
dapat menimbulkan ledakan (juga dijaga supaya isi labu distilasi jangan kering)
11) Hitung hasil rendeman praktis 27 gram dan teoritis, dengan titik didih 209oC
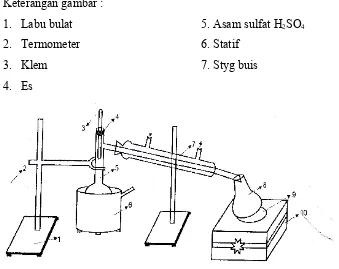
IX. GAMBAR RANGKAIAN ALAT
Gambar : Pembuatan Nitrobenzena Keterangan gambar :
1. Labu bulat 5. Asam sulfat H2SO4
2. Termometer 6. Statif
3. Klem 7. Styg buis
4. Es
1. Statif 6. Heater
2. Klem 7. Pendingin udara
3. Termometer 8. Labu erlenmeyer
4. Tutup Gabus 9. Alas Gabus
5. Labu distilasi 10. Lab. Jack
X. DATA PENGAMATAN
Massa labu erlenmeyer kosong 300 ml = 126,31 gram
Massa labu erlenmeyer + Nitrobenzena = 146,77 gram
Volume Nitrobenzena = 24 ml
XI. PERHITUNGAN
Diketahui :
Volume Asam Nitrat = 37 ml
Volume Benzena = 30 ml
Massa Jenis Asam Nitrat = 1,4 gramml
Massa Jenis Benzena = 0,89 gramml
Mr Asam Nitrat = 63 grammol
Mr Benzena = 78 grammol
Mr Nitrobenzena = 123 grammol
Massa Asam Nitrat = Massa jenis Asam Nitrat x Volume Asam Nitrat
= 1,4 gramml x 37 ml
= 51,8 gram
=
51,8gram
63grammol
= 0,822 mol
Massa Benzena = Massa jenis Benzena x Volume Benzena
= 0,89 gramml x 30 ml
= 26,7 gram
Mol Benzena = Massa BenzenaMr Benzena
=
26,7gram
78grammol
= 0,342 mol
C6H6 + HNO3 → C6H5NO2 + H2O
Mula-mula :0,342 0,822 -
-Bereaksi :0,342 0,342 0,342 0,342
Setimbang :- 0,480 0,342 0,342
Secara Teoritis
Massa Nitrobenzena = Mol Nitrobenzena x Mr Nitrobenzena
= 0,342 mol x 123 grammol
= 42,066 gram
Secara Praktis
Massa Erlenmeyer + Nitrobenzena = 146,77 gram
Massa Erlenmeyer 300 ml kosong = 126,31 gram -
% Rendeman Nitrobenzena = Massa Nitrobenzena praktisMassa Nitrobenzena teoritis x 100%
= 42,06620,46gramgram x 100%
= 48,64 %
Volume Nitrobenzena praktis = 24 ml
Densitas Nitrobenzena = 20,4624mlgram
= 0,8525 gramml
XII. PEMBAHASAN
Pada saat pencampuran HNO3 dengan H2SO4 terjadi reaksi yang menghasilkan
panas (eksoterm). Labu bulat yang berisi campuran tersebut, didinginkan dengan air dingin, kemudian pada saat penambahan Benzena akan terlihat warna sedikit coklat yang tidak lama akan hilang saat dikocok.
Labu bulat yang berisi campuran tersebut dipanaskan diatas water bath selama 30 menit, maka akan terbentuk 2 lapisan. Campuran yang telah dingin dimasukan ke dalam corong pemisah dan dicuci dengan 500ml dan yang kedua sebanyak 300ml. Cairan yang seperti minyak adalah Nitrobenzena (lapisan atas). Larutan Nitrobenzena ditambahkan CaCl2 (exicatus) untuk menjernihkan larutan yang keruh kemudian
didistilasi. Hasil distilasi pada suhu 80 0C akan keluar Benzena, suhu 1000C akan
keluar air dan suhu 180-2100C akan keluar Nitrobenzena. Destilasi dihentikan bila
larutan sudah mulai berwarna coklat dan larutan sudah agak sedikit kering.
Nitrobenzene merupakan larutan berwarna kuning, berwujud cair dan beracun. Pada pembuatan Nitrobenzene terjadi reaksi eksotermal, maka menimbulkan panas. Pada penambahan CaCl2 (exicatus) adalah untuk memurnikan senyawa Nitrobenzene
dan menyerap air. Berdasarkan hasil praktikium bahwa Nitrobenzene yang di dapat adalah 20,46 gram dan rendemennya adalah 48,64%.
XIV. TUGAS
1) Analisa kesalahan minimal 5
Adanya kelupaan memasangkan styg buis dan tutup gabus, sehingga Asam nitrat menguap.
Pengadukan bahan-bahan yang tidak konstan
Pencucian larutan dengan cara pengocokan yang kurang sempurna
Pembacaan termometer yang kurang jelas karena tertutup uap larutan distilasi
2) Pengertian larutan tidak stabil dan ciri-cirinya
Asam nitrat memiliki sifat yang merupakan cairan berasap sehingga akan mengeluarakan gas membuat ketidakstabilan pada campuran.
Larutan tidak stabil yang dimaksud adalah suspensi. Dalam ilmu kimia, suspensi adalah suatu campuran fluida yang mengandung partikel padat atau dengan kata lain campuran heterogen dari zat cair dan zat padat yang dilarutkan dalam zat cair tersebut. Partikel padat dalam sistem suspensi umumnya lebih besar dari 1 mikrometer sehingga cukup besar untuk memungkinkan terjadinya sedimentasi. Tidak seperti koloid, padatan pada suspensi akan mengalami pengendapan atau sedimentasi walaupun tidak terdapat gangguan. Singkatnya, suspensi merupakan campuran yang masih dapat dibedakan antara pelarut dan zat yang dilarutkan.
Suspensi cairan atau padatan (dalam jumlah kecil) didalam gas disebut sebagai aerosol. Contoh sistem aerosol dalam kehidupan manusia adalah debu diatmosfer.
Ciri-ciri suspensi adalah :
Terbentuk dua fase yang heterogen
Berwarna keruh
Mempunyai diameter partikel lebih dari100 nm
Dapat disaring dengan kertas saring biasa
3) Fungsi penambahan air
Penambahan air setelah pemanasan dalam water bath berfungsi untuk mencuci larutan Nitrobenzena, dengan cara mengikat pengotor yang terdapat dalam larutan Nitrobenzena tersebut. Tujuan pencucian yang pertama untuk mencuci garam Sulfat yang masih ada pada halide saat pemisahan.
4) Jenis-jenis katalis untuk Nitrobenzena
Katalis Homogen
Katalis homogen adalah katalis yang dapat bercampur secara homogen dengan zat pereaksinya karena mempunyai wujud yang sama.
Contoh Katalis Homogen :
a. Katalis dan pereaksi berwujud gas
2 SO2(g) + O2(g) → NO (g) + 2 SO3(g)
b. Katalis dan pereaksi berwujud cair
H+(aq)
C12H22O11(aq) + H2O(l) → C6H12O6(aq) + C6H12O6(aq)
Katalis Heterogen
Katalis heterogen adalah katalis yang tidak dapat bercampur secara homogen dengan pereaksinya karena wujudnya berbeda.
Contoh Katalis Heterogen :
Katalis berwujud padat, sedang pereaksi berwujud gas.
Autokatalis
Autokatalis adalah zat hasil reaksi yang bertindak sebagai katalis.
Contoh Autokatalis adalah CH3COOH yang dihasilkan dari reaksi metil asetat
dengan air merupakan autokatalis reaksi tersebut.
CH3COOCH3 (aq) + H2O (l) → CH3COOH (aq) + CH3OH (aq)
Biokatalis
Biokatalis adalah katalis yang bekerja pada proses metabolisme, yaitu enzim. Contoh Biokatalis adalah enzim hidrolase mempercepat pemecahan bahan makanan melalui reaksi hidrolisis.
Selain H2SO4, katalis yang digunakan adalah Nickel tetapi reaksi berjalan kurang
sempurna dan kurang mempercepat laju reaksi, oleh karena itu digunakan H2SO4
sebagai katalis untuk pembuatan Nitrobenzen ini karena H2SO4 yang paling baik
dibanding katalis lainnya.
5) Syarat-syarat pelarut yang baik
Pelarut memenuhi beberapa fungsi dalam reaksi kimia, dimana pelarut melarutkan reaktan dan reagen agar keduanya bercampur, sehingga hal ini akan memudahkan penggabungan antara reaktan dan reagen yang seharusnya terjadi agar dapat merubah reaktan menjadi produk. Pelarut juga bertindak sebagai
Ni(s)
kontrol suhu, salah satunya untuk meningkatkan energi dari tubrukan partikel sehingga partikel-partikel tersebut dapat bereaksi lebih cepat, atau untuk menyerap panas yang dihasilkan selama reaksi eksotermik.
Pada umumnya pelarut yang baik mempunyai kriteria sebagai berikut :
1. Pelarut harus tidak reaktif (inert) terhadap kondisi reaksi. 2. Pelarut harus dapat melarutkan reaktan dan reagen. 3. Pelarut harus memiliki titik didih yang tepat.
4. Pelarut harus mudah dihilangkan pada saat akhir dari reaksi.
Kriteria kedua adalah dengan menggunakan prinsip like dissolves like, dimana reaktan yang nonpolar akan larut dalam pelarut nonpolar sedangkan reaktan yang polar akan larut pada pelarut polar. Dalam hal ini juga terdapat tiga ukuran yang dapat menunjukkan kepolaran dari suatu pelarut yaitu :
a. momen dipol b. konstanta dielektrik c. kelarutannya dengan air
Molekul dari pelarut dengan momen dipol yang besar dan konsanta dielektrik yang tinggi termasuk polar. Sedangkan molekul dari pelarut yang memilki momen dipol yang kecil dan konstanta dielektrik rendah diklasifikasikan sebagai nonpolar. Sedangkan secara operasional, pelarut yang larut dengan air termasuk polar, sedangkan pelarut yang tidak larut dalam air termasuk nonpolar.
6) Jenis-jenis pelarut
Pelarut adalah benda cair atau gas yang melarutkan benda padat, cair atau gas, yang menghasilkan sebuah larutan.
(mengandung karbon) yang juga disebut pelarut organik. Pelarut biasanya memiliki titik didih rendah dan lebih mudah menguap, meninggalkan substansi terlarut yang didapatkan. Untuk membedakan antara pelarut dengan zat yang dilarutkan, pelarut biasanya terdapat dalam jumlah yang lebih besar.
7) Jenis-jenis kondensor
bertekanan tinggi, sedangkan setelah keluar dari kondenser refrigeran berupa cairan jenuh yang bertemperatur lebih rendah dan bertekanan sama (tinggi) seperti sebelum masuk ke kondenser.
Pembagian kondensor berdasarkan jenis media pendingin :
A. Kondensor berpendingin air (water cooled condenser)
Kondensor berpendingin air dapat dibedakan menjadi dua kategori, yaitu: 1) Kondensor yang air pendinginnya langsung dibuang.
2) Kondensor yang air pendinginnya disirkulasikan kembali. Sesuai dengan namanya, kondensor yang air pendinginnya langsung dibuang, maka air yang berasal dari suplai air dilewatkan ke kondensor akan langsung dibuang atau ditampung di suatu tempat dan tidak digunakan kembali. Sedangkan kondensor yang air pendinginnya digunakan kembali, maka air yang keluar dari kondensor dilewatkan melalui menara pendingin (cooling tower) agar temperaturnya turun. Selanjutnya air dialirkan kembali ke dalam kondensor, demikian seterusnya secara berulang - ulang.
B. Kondensor berpendingin udara (air cooled condenser).
Ada dua metoda mengalirkan udara pada jenis ini, yaitu konveksi alamiah dan konveksi paksa dengan bantuan kipas. Konveksi secara alamiah mempunyai laju aliran udara yang melewati kondenser sangat rendah, karena hanya mengandalkan kecepatan angin yang terjadi pada saat itu. Oleh karena itu kondensor jenis ini hanya cocok untuk unit-unit yang kecil seperti kulkas, freezer untuk keperluan rumah tangga, dll. Kondensor berpendingin udara yang menggunakan bantuan kipas dalam mensirkulasikan media pendinginannya dikenal sebagai kondensor berpendingin udara konveksi paksa.
cocok untuk beban mulai < 1kW s/d 500 kW, bahkan kadang dapat lebih dari 500 kW.
C. Kondensor evaporatif (evaporative condenser)
Kondensor evaporatif pada dasarnya adalah kombinasi antara kondensor dengan menara pendingin yang dirakit menjadi satu unit atau kondensor yang menggunakan udara dan air sebagai media pendinginnya. Jenis kondensor yang akan digunakan di KPPC Sinar Mulya Cihideung ini adalah jenis water cooled condenser sebanyak 2 buah. Fungsi dari masing-masing kondenser ialah sebagai berikut :
a. Kondensor yang pertama berfungsi untuk : 1) Media penukar kalor dan tempat terjadinya proses kondensasi 2) Sebagai heat recovery karena adanya kebutuhan air panas untuk membersihkan tangki– tangki susu. 3) Menurunkan temperatur discharge ke temperatur kondensasi sesuai rancangan yaitu 40oC.
b. Kondenser yang kedua berfungsi untuk : 1) Media penukar kalor sisa dari kondenser pertama. Bila kondisi air pada kondenser pertama sudah panas, kalor dari kondensor tidak dapat sepenuhnya diserap oleh air. Maka kondensor yang kedua akan menyerap kalor dari kondensor yang masih tersisa. 2) Memastikan refrigeran yang masuk ke dalam evaporator berada dalam keadaan cair. 3) Menurunkan temperatur kondensasi dari 75oC sampai
60oC. Untuk membantu kinerja sistem, air untuk mendinginkan kondenser kedua sehingga perpindahan kalor dapat maksimal yaitu berasal dari air sumur sebagai make up water dengan menggunakan katup apung sebagai alat kontrolnya. Keuntungan menggunakan 2 buah kondensor ialah : a. Kerja kompresor lebih ringan. b. Sangat sesuai dengan kondisi lingkungan yang banyak air dengan temperatur air yang cukup rendah.
c. Refrigeran yang keluar dari kondenser benar-benar dalam fasa cair, karena apabila pelepasan kalor pada kondenser pertama tidak sempurna maka kondenser kedua yang menyempurnakannya.
e. Hemat energi, karena menggunakan air ledeng hanya sebagai pendingin kondensor sehingga secara tidak langsung akan mengurangi kebutuhan energi listrik.
8) Mekanisme reaksi pengikatan Nitrobenzena
Mekanisme reaksi yang terjadi pada proses sintesis Nitrobenzena adalah proses nitrasi, yaitu penambahan gugus nitro (NO2) yang masuk ke dalam sebuah
molekul Benzena, Benzena (C6H6) adalah senyawa siklik dengan atom karbon
yang saling mengikat dan ikatan rangkap terkonjugasi.
Pertama-tama senyawa Asam nitrat (HNO3) akan bercampur dengan Asam
sulfat (H2SO4) lalu bereaksi dengan Benzena. Pada nitrasi akan terbentuk air,
inaktivasi atau penghilangan air perlu dilakukan untuk menghindari pengenceran Asam nitratnya meskipun merupakan reaksi irreversible. Nitrobenzena sendiri dapat disubstitusi. Pada proses ini substitusi elektrofilik dari gugus nitro (NO2)
diperoleh dari penarikan air pada Asam nitrat HNO3 pekat oleh Asam sulfat pekat
sebagai katalis.
Pada langkah kedua, Nitrobenzena (C6H5NO2) akan mengalami
hidrogenasi. Hidrogenasi adalah istilah yang merujuk pada reaksi kimia yang menghasilkan adisi hidrogen (H2). Proses ini umumnya terdiri dari adisi
sepasang atom hidrogen ke sebuah molekul.
9) Gambarkan kurva eksotermal dan endotermal tanpa dan menggunakan katalis
sebagai energi minimum yang dibutuhkan agar reaksi kimia tertentu dapat terjadi. Energi aktivasi sebuah reaksi biasanya dilambangkan sebagai Ea, dengan satuan
kilo joule per mol (molKJ ¿.
Energi aktivasi dapat dianggap sebagai penghalang potensial (hambatan energi) yang memisahkan energi potensial reaktan dan produk dari reaksi. Untuk melangsungkan reaksi, setidaknya harus ada energi yang sama atau lebih dari energi aktivasi.
Terkadang suatu reaksi kimia membutuhkan energi aktivasi yang teramat sangat besar, maka dari itu dibutuhkan suatu katalis agar reaksi dapat berlangsung dengan pasokan energi yang lebih rendah.
Fessenden dan Fessenden.. Kimia Organik Edisi Ketiga Jilid I.1986. Jakarta : Erlangga.
2014.”Buku penuntunpraktikum Teknik Kimia III”.Jakarta: Universitas Muhammadiyah Jakarta.
2014.”Ilmu Kimia Organik 2 Sekolah Menengah Farmasi”,Jakarta.Anshory Irfan.2000.”Kimia 2 SMU”.Jakarta: Erlangga
Fesenden.”Kimia Organik Jilid I”.