LAPORAN AKHIR PRAKTIKUM LIMNOLOGI
PERIKANAN-C KELOMPOK 2
NAMA ANGGOTA KELOMPOK : Wahyu Budi Sentosa 230110150158 Mohammad Rizki Akbar 230110150161
Fadhiilah 230110150170
Saepudin 230110150177
Diaz Dwi lintang 230110150184 Sri Astuti Prasetia 230110150189 Muthia N Putri 230110150197
Rifaldi 230110150206
UNIVERSITAS PADJADJARAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN PROGRAM STUDI PERIKANAN
KATA PENGANTAR
Syukur kami panjatkan kepada Allah SWT yang dengan rahmat dan hidayahNya. Kami dapat melaksanakan dan menyusun laporan akhir praktikum limnologi. Atas dukungan moral serta materi yang telah diberikan dalam penyusunan makalah ini, maka kami mengucapkan banyak terimakasih kepada Bapak dosen yakni Bapak Henhen dan asisten praktikum limnologi yang telah membimbing kami untuk menyelesaikan makalah ini.
Dalam penyusunan makalah ini kami telah berusaha dengan segenap kemampuan kami, sebagai pemula tentunya masih banyak kekurangan dan kesalahan. Demi kesempurnaan laporan ini kami mengharapkan kritik dan saran yang sifatnya membangun. Kritikan dan saran sangat kami butuhkan agar laporan ini menjadi lebih baik dan digunakan sebagaimana mestinya.
Dengan selesainya makalah ini saya mengharapkan akan dapat memberikan pengetahuan tambahan tentang pemahaman materi tentang Dasar-dasar manajemen khususnya bagi saya dan umumnya bagi teman-teman. Semoga karya ilmiah yang saya buat ini dapat menambah pengetahuan bagi kita semua. Akhir kata semoga segala bantuan yang telah diberikan kepada penulis mendapatkan balasan yang setimpal dari Allah SWT. Semoga laporan ini dapat bermanfaat bagi kita semua yang membacanya walaupun laporan ini masih jauh dari kesempurnaan
Jatinangor, Mei 2016
DAFTAR ISI
KATA PENGANTAR i DAFTAR ISIii
BAB II TINJAUAN PUSTAKA
2.1 Keadaan Umum Lokasi Praktikum a. Ciparanje
b. Cekdam c. Expendca
2.2 Transparansi Cahaya di Perairan 2.3 Karbondioksida Perairan
2.4 pH Perairan 2.5Alkalinitas Perairan
2.6 Oksigen Terlarut (DO) Perairan 2.7 Oksigen Biokimia (BOD) Perairan 2.8 Total Ammonia ( NH4-N) Perairan
2.9 Ammonia Undissosited ( NH3-N) Perairan
2.10 Fotosintesis dan Respirasi di Perairan
2.11 Produktivitas Primer Perairan ( Net Primary Produktivity) BAB III METODE PRAKTIKUM
3.1 Tempat dan Waktu Pelaksanaan Praktikum 3.2 Alat dan Bahan
3.3 Prosedur Kerja 3.4 Analisa Data
3.4.1 Transparansi Cahaya di Perairan 3.4.2 Karbondioksida Perairan
3.4.3 pH Perairan 3.4.4 Alkalinitas Perairan
3.4.5 Oksigen Terlarut (DO) Perairan 3.4.6 Oksigen Biokimia (BOD) Perairan 3.4.7 Total Ammonia ( NH4-N) Perairan
3.4.8 Produktivitas Primer Perairan ( Net Primary Produktivity) BAB IV HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Data Kelompok
a. Transparansi Cahaya di Perairan b. Karbondioksida Perairan
c. pH Perairan d. Alkalinitas Perairan
e. Oksigen Terlarut (DO) Perairan f. Oksigen Biokimia (BOD) Perairan g. Total Ammonia ( NH4-N) Perairan
h. Produktivitas Primer Perairan ( Net Primary Produktivity) 4.1.2 Data Angkatan
a. Transparansi Cahaya di Perairan b. Karbondioksida Perairan
c. pH Perairan d. Alkalinitas Perairan
e. Oksigen Terlarut (DO) Perairan f. Oksigen Biokimia (BOD) Perairan g. Total Ammonia ( NH4-N) Perairan
4.2 Pembahasan
4.2.1 Transparansi Cahaya di Perairan 4.2.2 Karbondioksida Perairan
4.2.3 pH Perairan 4.2.4 Alkalinitas Perairan
4.2.5 Oksigen Terlarut (DO) Perairan 4.2.6 Oksigen Biokimia (BOD) Perairan 4.2.7 Total Ammonia ( NH4-N) Perairan
4.2.8 Produktivitas Primer Perairan ( Net Primary Produktivity) BAB V SIMPULAN DAN SARAN
5.1 Simpulan 5.2 Saran
DAFTAR TABEL
Tabel 1-8 Data KelompokTabel 1. Transparansi Cahaya di Perairan Tabel 2. Karbondioksida Perairan
Tabel 3. pH Perairan
Tabel 4. Alkalinitas Perairan
Tabel 5. Oksigen Terlarut (DO) Perairan Tabel 6. Oksigen Biokimia (BOD) Perairan Tabel 7. Total Ammonia ( NH4-N) Perairan
Tabel 8. Produktivitas Primer Perairan ( Net Primary Produktivity) Tabel 9-16 Data Angkatan
Tabel 9. Transparansi Cahaya di Perairan Tabel 10. Karbondioksida Perairan Tabel 11. pH Perairan
Tabel 12. Alkalinitas Perairan
Tabel 13. Oksigen Terlarut (DO) Perairan Tabel 14. Oksigen Biokimia (BOD) Perairan Tabel 15. Total Ammonia ( NH4-N) Perairan
DAFTAR GAMBAR
Grafik 1-8 Data Kelompok
Grafik 1. Transparansi Cahaya di Perairan Grafik 2. Karbondioksida Perairan
Grafik 3. pH Perairan
Grafik 4. Alkalinitas Perairan
Grafik 5. Oksigen Terlarut (DO) Perairan Grafik 6. Oksigen Biokimia (BOD) Perairan Grafik 7. Total Ammonia ( NH4-N) Perairan
Grafik 8. Produktivitas Primer Perairan ( Net Primary Produktivity) Grafik 9-16 Data Angkatan
Grafik 9. Transparansi Cahaya di Perairan Grafik 10. Karbondioksida Perairan Grafik 11. pH Perairan
Grafik 12. Alkalinitas Perairan
Grafik 13. Oksigen Terlarut (DO) Perairan Grafik 14. Oksigen Biokimia (BOD) Perairan Grafik 15. Total Ammonia ( NH4-N) Perairan
DAFTAR LAMPIRAN
LAMPIRAN PRAKTIKUM KE-1
LAMPIRAN PRAKTIKUM KE-2
LAMPIRAN PRAKTIKUM KE-3
LAMPIRAN PRAKTIKUM KE-4
BAB I PENDAHULUAN
1.1 Latar Belakang
Limnologi merupakan cabang ilmu pengetahuan yang mempelajari tentang sifat struktur perairan daratan yang meliputi mata air, sungai, danau, kolam, dan rawa-rawa, baik yang berupa air tawar maupun air payau. Selain itu, dikenal oseanologi yang mempelajari tentang ekosistem laut. Lomnologi dan oseanologi merupakan cabang ilmu ekologi yang khusus mempelajari tentang sistem perairan yang terdapat di permukaan bumi (Barus, 2001). Limnologi (dari bahasa Inggris: limnology, dari bahasa Yunani: lymne, “danau”, dan logos, “pengetahuan”) merupakan padanan bagi biologi perairan darat, terutama perairan tawar. Lingkup kajiannya kadang-kadang mencakup juga perairan payau (estuaria). Limnologi merupakan kajian menyeluruh mengenai kehidupan di perairan darat, sehingga digolongkan sebagai bagian dari ekologi. Dalam bidang perikanan, limnologi dipelajari sebagai dasar bagi budidaya perairan (akuakultura) darat.
Istilah Limnologi pertama kali digunakan oleh seorang ilmuwan berkebangsaan Swiss (François Alfonse Forel) pada tahun 1892 yang mendefinisikan limnologi sebagai cabang ilmu yang mempelajari komponen biotik di perairan darat permukaan yang bersifat menggenang atau lentik. Tahun 1966, Dussart melengkapi definisi tersebut menjadi cabang ilmu yang mempelajari seluruh fenomena dan saling interaksi antar komponen biotik dan abiotik yang terjadi di dalamnya, baik pada ekosistem perairan darat permukaan yang tergenang (lentik) maupun pada perairan darat permukaan yang mengalir (lotik).
Dalam praktikum limnologi ini praktikan akan mempelajari tentang kualitas kimia air di kolam Ciparanje, Cekdam dan Expedca.
1.2 Tujuan Praktikum
1. Praktikan diharapkan bisa menganalisis kualitas air di kolam Ciparanje, Cekdam dan Expedca dengan menggunakan parameter kimia dan parameter fisika
2. Praktikan diharapkan bisa menggunakan alat-alat yang akan di praktikumkan dengan baik dan benar
3. Praktikan diharapkan bisa menghitung, dan memahami hasil yang di dapat setelah praktikum selesai
1.3 Manfaat Praktikum
1. Praktikan bisa mengetahui kualitas air yang ada di kolam Ciparanje, Cekdam, dan Expedca
2. Praktikan bisa menggunakan alat-alat praktikum dengan baik dan benar serta teliti
BAB II
TINJAUAN PUSTAKA
2.1 Parameter Fisik 2.1.1 Suhu
Suhu adalah suatu sifat fisika perairan yang secara langsung dipengaruhi oleh adanya radiasi dan perambatan kedalam peraoran. Suhu air mempunyai pengaruh yang sangat besar terhadap proses kimiawi dan biologis dalam suatu perairan. Suhu air yang optimal didaerah tropis biasaanya berkisar 25°C-35°C. Suhu air yang ideal adalah perbedaan antara siang dan malam tidak lebih dari 5°C, yaitu antara 25° sampai 30°C.
Suhu air juga mempengaruhi pertukaran zat-zat atau metabolisme dari mahluk hidup dan semakin tinggi suhu suhu, maka semakin sedikit Oksigen yang terlarut didalamnya. Karena suhu air mempunyai pengaruh yang sangat besar terhadap proses kimiawi dalam perairan. Suhu juga menyebabkan stratifikasi atau tingkat pelapisan air dimana suhu air dipermukaan lebih panas dibandingkan suhu air yang berada dilapisan bawahnya.
Oksigen yang berkurang berdampak pada aktivitas ikan berkurang atau berhenti karena nafsu makannya berhenti. Makanan akan tersisa dan berdampak pada meningkatnya akumulasi ammoniak di air. Suhu juga berpengaruh terhadap munculnya serangan penyakit dan jumlah ikan yang terkena penyakit. Secara umum imun sistem dari ikan akan optimum pada suhu 15 oC.
Pada kegiatan budidaya yang dilakukan di tambak atau di bak-bak pemeliharaan. Maka yang perlu mendapat perhatian adalah kedalaman dan volume air. Permasalahan muncul ketika kedalaman tambak kurang dari 80 cm, volume air di tambak sedikit sehingga suhu air akan lebih tinggi dibanding suhu air tambak yang lebih dalam dan volume lebih besar. Disamping itu, ketika plankton tidak tumbuh dengan baik, cahaya matahari akan masuk ke dalam air tanpa ada penghalang, akibatnya akan meningkatkan suhu air.
1. Suhu air di wiliayah lintang tinggi
Suhu perairan dilapisan permukaan diwilayah lintang tinggi cenderung sangat rendah (< -1°C) dan semakin meningkat hingga mencapai 1°C pada lapisan kedalaman tertentu. Setelah mencapai puncaknya, suhu menurun hingga dasar perairan.
2. Suhu air diwilayah lintang rendah
Suhu perairan dilapisan permukaan diwilayah lintang rendah cenderung lebih tinggi (> 24°C) dan semakin menurun hingga 4°C pada wilayah lapisan perairan dalam. Setelah mencapai puncaknya suhu menurun hingga wilayah dasar perairan dalam.
3. Suhu air diwilayah lintang tengah
Suhu perairan dilapisan permukaan diwilayah lintang tengah cenderung lebih tinggi (sekitar 10°C) dan sem akin menurun hingga 4°C hingga wilayah lapisan dasar laut dalam.
Suhu diukur dengan menggunakan thermometer, dimana menggunakan satuan unit °C.
Gambar 1. Termometer
2.1.1 Kecerahan
terkandung diperairan.
Kecerahan air yang baik untuk kehidupan organisme perairan berkisar antara 30 sampai 60 Cm. Kecerahan perairan berkaitan dengan kekeruhan perairan, mkecerahan yang rendah disebabkan oleh kekeruhan yang tinggi. Tingkat kecerahan suatu perairan tergantung pada partikel-partrikel koloid dan padatan tersuspensi yang terkandung dalam perairan. Padatan tersebut berupa lumpur, bahan organik, plankton, dan zat-zat garam, dimana tingkat kecerahan suatu perairan tersebut menunjukkan tingkat kedalaman perairan.
Tingkat kecerahan menyatakan tingkat cahaya yang diteruskan ke dalam kolom air dan dinyatakan dalam persentase (%), dari beberapa panjang gelombang yang ada yang jatuh agak lurus pada permukaan air.
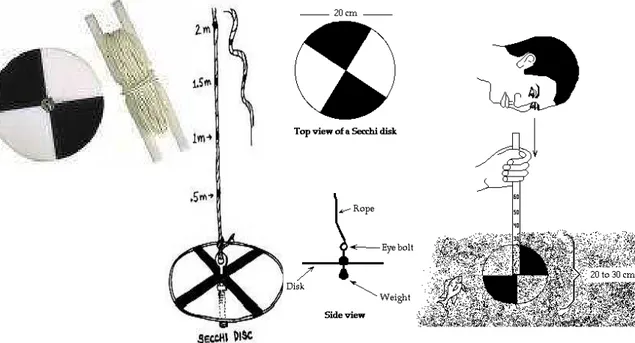
Pengukuran tingkat kecerahan air menggunakan ‘Secchidisc’.
Gambar 2. Secchi Disc dan Cara Pengukurannya
2.1.3 Kedalaman
surut, pergerakan pemeliharaan, rute navigasi. Kedalaman akan mempengaruhi kelimpahan makro zoobenthoss, dan juga mempengaruhi penyebaran suhu pada perairan. Pedalaman perairan yang baik dan normal untuk kehidupan organisme aquatik berkisar antara 1,5-2 meter. Bukan hanya itu, kedalaman perairan juga mempengaruhi jumlah dan jenis jasad renik dalam suatu perairan.
Faktor yang mempengaruhi kedalaman perairan menurut Ariana bathmetri adalah ukuran tinggi rendahnya dasar laut. Perubahan kondisi hidrografi diwilayah perairan laut dan pantai disamping disebabkan oleh fenomena perubahan penggunaan lahan diwilayah tersebut dan proses-proses yang terjadi diwilayah hulu sungai. Terbawahnya berbagai material partikel dan kandungan oleh aliran sungai semakin mempercepat proses pendangkalan diperairan pantai. Kedalaman perairan sangat berpengaruh terhadap kualitas air pada lokasi tersebut. Lokasi yang dangkal akan lebih mudah terjadinya pengadukan dasar akibat dari pengaruh gelombang yang pada akhirnya kedalaman perairan lebih dari dari 3 meter dari pengaruh gelombang yang pada akhirnya kedalaman perairan lebih dari dasar jaring.
2.2 Parameter Kimiawi
2.2.1 Derajat Keasaman (pH)
Derajat keasaman adalah suatu ukuran dari konsentrasi ion hidrogen, yangh menunjukan suasana asam atau basah. Derajat keasaman merupakan indikator baik buruknya lingkungan air, sehingga angka pH ini digunakan untuk memperoleh gambaran tentang daya produksi potensial air. Skala pH berkisar antara 0 sampai 14, pH 7 adalah bersifat netral artinya air tersebut tidak bersifat asam dan tidak basa. Apabila nilai pH dibawah 7, berarti air tersebut bersifat asam. Dan juga apabila pH diatas 7, maka air terrsebut bersifat basa.
kandungan alga tinggi, dimana proses photosinthesis membutuhkan banyak CO2.
pH akan meningkat hingga 9.0-10.0 atau lebih tinggi jika bikarbonat di serap dari air (Svobodova, at al, 1993). Untuk melawan kondisi pH yang rendah atau tinggi ikan akan memproduksi lendir di kulitnya dan di bagian dalam insang. Nilai pH juga mempunyai pengaruh yang signifikan pada kandungan ammonia, H2S, HCN,
dan logam berat pada ikan. Pada pH rendah akan meningkatkan potensi untuk kelarutan logam berat. Peningkatan nilai pH hingga 1 angka akan meningkatkan nilai konsentrasi ammonia di dalam air hingga 10 kali lipat dari semula. Stabilisasi pH dipengaruhi oleh aktivitas respirasi dan photosintesis.Respirasi akan menurunkan pH, dan sebaliknya fotosintesis menaikan nilai pH.
Tabel 1. Hubungan pH Dengan Dengan Sistem Perairan
Rang pH Dampak diperairan
9.0-10.0
Alga berkembang
NH3 dominan dan beracun
Proses nitrifikasi oleh bakteri terhambat
Kalsium karbonat dan logam mengendap 8.0-9.0
Kondisi normal air laut
Racun NH3 menjadi masalah
Optimal untuk proses nitrifikasi 7.0-8.0
Kondisi normal rawa-rawa dan estuari
Ion ammonium (NH4+) dominan, ammonia sedikit beracun
Proses nitrifikasi agak terhambat
6.0-7.0
Kondisirawapayau
Ion ammonium (NH4+) dominan, ammonia sedikit beracun
Proses nitrifikasi terhambat
Nitrit beracun
Batuan dan logam terlarut
dengan melakukan pergantian air. Pengukuran biasanya menggunakan alat yang dinamakan pH-meter. Tetapi, dapat juga menggunakan kertas lakmus.
Gambar 3. Alat Ukur Keasaman
2.2.2 Oksigen Terlarut (DO)
Oksigen terlarut adalah jumlah miligram mol Oksigen per liter atau konsentrasi kelarutan O2 dalam air. Kandungan oksigen terlarut dalam air sangat
penting bagi kehidupan dan penyebaran hewan dan tumbuhan air yang hidup didalamnya. Kandungan oksigen rendah hanya didominasi oleh beberapa spesies saja. Spesies-spesies tertentu dan kelompok makrozoobenthos mempunyi tingkat penyesuaian yang berbeda terhdap oksigen terlarut dan ada kelompok spesies yang dapat bertahan dalam kurun waktu yang terbatas, yaitu bila konsentrasi oksigen terlarut mencapai 1 mg/l.
dpl meningkat maka oksigen terlarut akan menurun. Oksigen terlarut di air laut lebih rendah dibanding dengan air tawar.
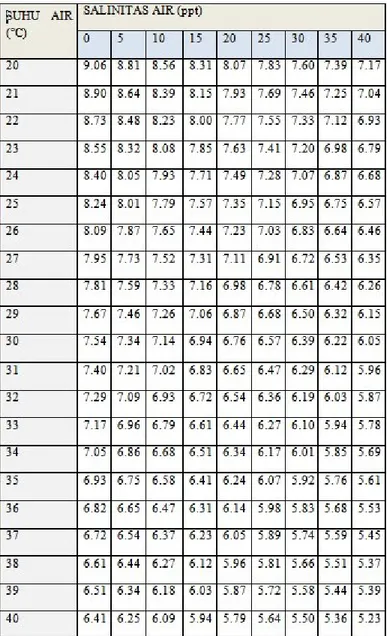
Tabel 2. Hubungan Antara Suhu Dan Salinitas Air Terhadap Oksigen Terlarut
Oksigen terlarut biasanya diukur dengan menggunakan DO-meter. Dimana alat ini terbagi menjadi dua, yakni DO-meter manual, dan DO-meter digital
.
2.2.3 Salinitas
Salintas merupakan salah satu parameter lingkungan yang mempengaruhi proses biologi dan secara langsung akan mempengaruhi laju pertumbuhan dan kehidupan organisme antara lain uyaitu mempengaruhi laju pertembuhan, jumlah makanan yang dikonsumsi, nilai konversi makanan, daya kelangsungan hidup.
Salinitas adalah ukuran jumlah garam yang terlarut di dalam air. Garam di laut adalah ada dalam bentuk NaCl. Secara umum jenis Crustacea tidak sensitif terhadap perubahan salinitas hingga 5 ppt (Malone & Burden, 1988). Suhu sangat mempengaruhi kondisi salinitas perairan, semakin tinggi suhu akan berdampak pada tingginya salinitas. Proses evaporasi akibat suhu yang meningkat akan meningkatkan salinitas walaupun lambat, seperti pada sistem resirkulasi budidaya soft shell (Malone & Burden, 1988), dan sistem resirkulasi pendederan kerapu macan (Udi Putra, et al. 2007a; 2007b).
Organisme perairan yang mempunyai teloransi salinitas sempit dikenal dengan stenohaline seperti ikan-ikan yang hidup di air tawar, sebaliknya dikenal dengan euryhaline seperti ikan-ikan laut, dan estuaria. Seperti udang mampu hidup dengan baik pada kisaran salinitas 0.5 – 40 ppt. uk mengatasi masalah tersebut adalah dengan melakukan penambahan air tawar atau penambahan air laut.
Salinitas dipengaruhi oleh beberapa hal, yakni : 1. Pola sirkulasi air,
Tabel 3. Klasifikasi Berdasarkan Tingkat Salinitas
Tingkatan salinitas dapat diukur dengan menggunakan alat refraktometer. 2.2.4 Gas Nitrogen, Amonia, Karbon Dioksida (CO2) Dan Nitrat
A. Gas Nitrogen
Nitrogen yang terlarut di dalam air terdapat dalam 5 bentuk yakni gas nitrogen (N2), nitrogen organik, ammonia, nitrit, dan nitrat (Malone & Burden,
1988). Istilah organik nitrogen berkaitan dengan jumlah nitrogen di dalam bahan organik yang terlarutkan atau tersuspensi di dalam air (Malone & Burden, 1988). Ammonia, nitrit dan nitrat merupakan produk kimia yang dihasilkan oleh organisma dan bakteri melalui proses biologi. Ammonia dan nitrit adalah dua bentuk nitrogen yang mempunyai daya racun yang tinggi bagi ikan, tapi sebaliknya bagi nitrat.
B. Amonia
Ammonia berasal dari kandungan nitrogen yang bersumber dari limbah rumah tangga ataupun industri. Di lain pihak bisa berasal dari sisa pakan dan sisa feses (sisa metabolisme protein oleh ikan) yang dihasilkan ikan itu sendiri dan bahan organik lainnya. Hampir 85% nitrogen pakan untuk udang dikonversi menjadi ammonia (Svobodova, at al, 1993). Ammonia di dalam air ada dalam bentuk molekul (non disosiasi/unionisasi) ada dalam bentuk NH3 dan ada dalam
bentuk ion ammonia (disosiasi) dalam bentuk NH4+. Kedua bentuk ammonia
tersebut sangat bergantung pada kondisi pH dan suhu air.
Dinding sel tidak dapat ditembus oleh ion ammonia (NH4+), akan tetapi
dan berpotensi menjadi racun bagi tubuh ikan. Sehingga kondisi normal ada dalam kondisi asam seimbang pada hubungan air dengan jaringan. Jika keseimbangan dirubah, seperti nilai pH di salah satu bagian turun akan mengudang terjadinya penambahan molekul ammonia (Svobodova, at al, 1993). Tingkat racun dari ammonia selain karena faktor pH dan ammonia juga dipengaruhi oleh kandungan oksigen di dalam air (Gambar 1) (Tabel 4). Air dengan nilai pH rendah maka yang dominan adalah ammonium (NH4+),
sebaliknya bila nilai pH tinggi yang dominan adalah ammonia (NH3). Ammonia
adalah bentuk yang paling beracun dari ammonia. Pengukurankadarammonia:
1. metodespektrofotometri 2 . testkit(alattescepat)
C. Karbondioksida (CO2)
Karbondioksida yang ideal untuk kehidupan adalah berkisar 10 sampai 20 mg/l. Sumber utama CO2 diperairan adalah proses perombaklan lahan organik
mati oleh mikroorganisme pengurai dan proses respirasi hewan serta tumbuh-tumbuhan air yang tenggelam pada waktu malam hari.
Karbondioksida terlarut di dalam air dalam bentuk melekul gas. Kelarutan CO2 diperoleh dari aktivitas respirasi mikroorganisme dan photosyntesis phytoplankton. Hanya 10% dalam bentuk asam karbonat (H2CO3). Ada dua
bentuk CO2 yang kemudian membentuk CO2 bebas. Bentuk ion, penjerapan CO2
terepresentasikan oleh ion bikarbonat, dan karbonat (HCO3- dan CO32-).
Keberadaannya sangat penting sebagai buffer di dalam air. Jumlah CO2 yang ada
dipermukaan air hanya sedikit dan bervariasi karena sangat berkaitan dengan proses photosynthesis tumbuhan air dan phytoplankton. Pada bagian permukaan air mempunyai kandungan CO2 yang rendah dibanding pada strata rendah. Jika
CO2 bebas dipermukaan dipakai untuk photosynthesis maka pH meningkat hingga
8.3, dan di dalam air dengan bikarbonat sedang bisa mencapai 10. dan akan terus meningkat pada waktu-waktu dimana intensitas cahaya cahaya kuat.
permukaan respirator terbatas, ikan akan meningkatkan peredaran udara, ikan akan nampak gelisah, kurang keseimbangan dan bisa mati. Karena konsenrasi CO2
yang tinggi akan mengurangi kemampuan ikan/udang mengekstraksi oksigen dari air dan akan mengurangi tingkat teloransinya terhadap rendahnya kandungan oksigen di dalam air. Efeknya ke ikan adalah akan meningkatkan konsentasi CO2
di dalam darah, yang akan mendorong menurunnya pH darah yang akan berperan pada menurunnya kemampuan darah mengikat oksigen dan memasukannya ke dalam jaringan.
Munculnya masalah akibat CO2 terjadi karena banyaknya CO2 bebas di
dalam air akibat penggunaan CO2 untuk proses photosynthesis oleh
phytoplankton. Konsentrasi CO2 bebas kurang dari 1 mg/L bepengaruh pada
keseimbangan asam di dalam jaringan dan darah ikan dan menyebabkan alkalosis. Kekurangan CO2 bebas khususnya berbahaya bagi anak-anak ikan jenis tilapia
yang baru melewati bentuk pakan endogenous dan eksogenous. Mereka melakukan respirasi menggunakan permukaan tubuhnya dan tidak dapat mengatur keseimbangan asam dengan insangnya. Tekanan rendah CO2 bebas di dalam air
menimbulkan tingginya tingkat difusi CO2 dari tubuhnya, menimbulkan alkalosis
dan akhirnya mati. Pemberian aerasi adalah tindakan efektif untuk mengatasi kelebihan C
D. Nitrit dan Nitrat
Nitrit dan nitrat ada di dalam air sebagai hasil dari oksidasi. Nitrit merupakan hasil oksidasi dari ammonia dengan bantuan bakteri Nitrisomonas dan Nitrat hasil dari oksidasi Nitrit dengan bantuan bakteri Nitrobacter. Keduanya selalu ada dalam konsentrasi yang rendah karena tidak stabil akibat proses oksidasi dan sangat tergantung pada keberadaan bahan yang dioksidasi dan bakteri. Kedua bakteri tersebut akan optimal melakukan proses nitrifikasi pada pH 7.0-7.3. Hampir tidak ada nitrat yang masuk di tanah karena proses pencucian dan penggunan pupuk.
dalam ikan dengan bantuan sel Klorida insang. Di dalam darah nitrit akan bersatu dengan haemoglobin, yang berakibat pada peningkatan methaemoglobin. Ini akan mengurangi kemampuan transportasi oksigen dalam darah. Peningkatan methaemoglobin akan terlihat pada perubahan warna ingsang menjadi coklat begitu juga warna darah. Jika jumlah methaemoglobon tidak lebih dari 50% dari total haemoglobin, ikan akan tetap hidup, tapi bila melebihi hingga 70-80% gerakannya akan melamban. Bila terus meningkat maka ikan akan kehilangan kemampuan untuk bergerak dan tidak akan merespon terhadap stimulan. Akan tetapi kondisi tersebut akan bisa kembali normal karena eritrosit di dalam darah terdapat enzim reduktase yang mampu mengkonversi methaemoglobin menjadi haemoglobin. Proses konversi akan berlangsung hingga menghabiskan waktu 24-48 jam. Ini terjadi bila kemudian ikan ditempatkan pada air yang terbebas dari nitrit.
2.3 Produktivitas Primer
Produktivitas primer menggambarkan jumlah pembentukan bahan organik baru per satuan waktu. Senyawa organik yang baru akan terbentuk melalui proses fotosintesis. Kegiatan fotosintesis di perairan waduk dilakukan oleh fitoplankton dan tanaman air (Boyd 1979). Produktivitas primer ini sering dinyatakan dalam mg C/m3/jam atau mg C/m3/hari untuk satuan volume air dan mg C/m2/jam atau mg C/m2/hari satuan luas kolom air. Menurut Suwigyo (1983) produktivitas primer dapat dipakai untuk menentukan keseburan suatu perairan. Klasifikasi tingkat kesuburan tersebut adalah: 0-200 mg C/m3/hari termasuk oligotrofik, 200-750 mg C/m3/hari termasuk mesotrofik dan lebih dari 200-750 mg C/m3/hari termasuk eutrofik (Triyatmo dkk 1997).
pengukuran adanya kesetaraan yang kuat antara O2 dan pangan yang dihasilkan
(Odum 1970).
Produktivitas primer dalam bentuk plankton dianggap salah satu unsur yang penting pada salah satu mata rantai perairan. Plankton-plankton yang ada dalam perairan akan sangat berguna dalam menunjang sumberdaya ikan, terutama dari golongan konsumen primer. Densitas dan diversitas fitoplankton dalam perairan sangat dipengaruhi oleh kondisi lingkungan tersebut. Densitas fitoplankton akan tinggi apabila perairan yang didiami subur (Boyd 1982).
Ada beberapa faktor yang mempengaruhi tinggi rendahnya produktivitas primer perairan. Faktor-faktor tersebut bisa dibagi menjadi 3 yaitu faktor kimia, fisika, dan biologi. Faktor kimia seperti kandungan fosfat dan nitrat adalah merupakan hara yang pentong untuk pertumbuhan dan reproduksi phytoplankton. Bila dikaitkan dengan faktor fisika dan level air maka pada level air yang rendah dengan tersedianya sinar matahari menghasilkan produktivitas primer yang tinggi. Disamping faktor kimia dan fisika, faktor biologi seperti perbandingan komposisi biomassa phytoplankton dan zooplankton, memperlihatkan bahwa jumlah individu dalam populasi phytoplankton jauh lebih besar dibandingkan dengan jumlah individu dalam populasi zooplankton, dan karena yang melakukan fotosintesa didalam ekosistem perairan adalah phytoplankton, ini berakibat langsung terhadap tingginya produktivitas primer (Kaswadji 1976).
Komposisi dalam suatu perairan dipengaruhi oleh proses-proses fisika, kimia, dan biologi yang terjadi. Air tawar berasal dari hujan atmosfer yang mengandung bervariasi zat organik dan anorganik. Partikel-partikel tersebut berasal dari garam-garam lautan, debu, atau emisi industri sebagai inti dari uap air yang mengalami kondensasi menjadi awan. Hujan jatuh ke daratan menyebabkan aliran permukaan diatas tanah dan batuan yang melarutkan bermacam-macam zat sehingga kandungan mineral air hujan meningkat. Air mengalir mencapai kolam, danau atau waduk, bahan partikel yang lebih besar mengendap karena gerakan turbulensi kurang cukup untuk mensuspensi kembali (Boyd 1979).
BAB III
METODE PRAKTIKUM
3.1 Tempat dan Waktu Pelaksanaan Praktikum
Tempat Waktu
Kolam Expedca Kamis , 31 Maret 2016 pukul 13.00 WIB Kolam Cekdam Kamis , 14 April 2016 pukul 10.00 WIB Kolam Cekdam Kamis 21 April 2016 pukul 10.00 WIB dan
pukul 15.00 WIB Lab. MSP Dekanat FPIK
UNPAD
Rabu, 11 Mei 2016 pukul 08.00 WIB
3.2 Alat dan Bahan
3.2.1 Alat yang Digunakan
1. Alat- alat titrasi (biuret, erlenmayer, dan gelas ukur) 2. Alat tulis dan penggaris (cm)
3. BOD Incubator 4. Botol Winkler 5. Gelas ukur
6. Keping Secchi (Secchi Disk) 7. pH- meter
8. Pipet tetes
9. Selotip gelap dan terang 10. Spectrofotometer 11. Tabung reaksi 12. Tali rapia 13. Thermometer 14. Thermometer Hg 3.2.2 Bahan yang Digunakan
2. Larutan NaOH 0,1 N
3. Larutan Indikator Mehtyl red/orange 4. Larutan HCL 0,1 N
5. Larutan pH-buffer 4,0 dan 7,0 6. Larutan Indikator Amylum 1 % 7. Larutan MnSO4 50 %
8. Larutan pereaksi O2
9. Larutan Na2S2O3 0,01 N (Larutan thiosulfat)
10. Larutan H2SO4-pekat
11. Larutan Signette 12. Larutan Nessler
3.3 Prosedur Kerja
3.3.1 Pengukuran Transparansi Cahaya
Keping Secchi
Dilihat skala (cm) pada tali penduga yang terendam atau bersinggung dengan
permukaan air
Pertama dimasukkan secara perlahan hingga tidak
terlihat
Dicatat SD1
Kedua, keping Secchi dimasukkan ke kolam dari tidak terlihat sampe terlihat pertama kali (skala cm)
3.3.2 Pengukuran CO2 – bebas (Metode Titrasi Alkalimetrik)
Ditambahkan 3 tetes larutan indikator PP (Phenolftalin)
Dititrasi dengan larutan NaOH 0,1 N sambil di kocok
Diamati hingga terjadi perubahan warna larutan dari tidak berwana menjadi
merah muda
3.3.3 Pengukuran pH Perairan (Metode Potensiometrik)
Prosedur Pengukuran :
pH-meter
Probe dibilas dengan aquadest
Dilakukan kalibrasi alat pH-meter dengan
menggunakan larutan pH buffer
Dimasukkan ujung sensor/probe pH-meter kedalam air di lapangan
Diaktifkan saklar on pada pH-meter
Dibaca skala/angka pH air pada display alat, hingga angka pada display stabil
3.3.4 Pengukuran Alkalinitas
[
Ca(HCO3)2]
(Metode Titrasi Asidimetrik)Prosedur Pengukuran :
Labu Erlenmeyer
Ditambahkan 3 tetes larutan indikator Metil Oranye Ditambahkan 50 ml air sampel kolam Cekdam
Dititrasi dengan larutan HCl 0,1 N sambil dikocok
Diamati hingga terjadi perubahan warna larutan dari jingga menjadi merah
muda
3.3.5 Pengukuran Oksigen Terlarut Perairan
Prosedur Pengukuran: 1. Menggunakan DO Meter
DO Meter
Masukkan DO Meter ke dalam kolam yang akan di uji Kalibrasikan DO Meter sehingga
menunjukkan angka 0
Perhatikan angka yang muncul di dalam DO Meter tersebut
2. Menggunakan Metode Winkler
Ditambahkan 1 mL MnSO4
Diisi air sampel kolam Ciparanje sampai penuh dan pastikan tidak ada oksigen yang masuk pada
saat pengambilan air sampel tersebut
Ditambahkan 1 mL O2 reagen 1
M lalu dikocok 10x dan didiamkan sehingga terbentuk
endapan
Setelah terbentuk endapan, ditambahkan 2 mLH2SO4, lalu
dikocok 10x sehingga endapan hilang
Botol Winkler
Setelah endapan hilang, air sampel tersebut dimasukkan ke dalam labu erlenmeyer sebanyak
50 mL
Dititrasi beberapa tetes Na2S2O3
3.3.6 Pengukuran Oksigen Biokimia (BOD) Perairan (Metode : Winkler, Titrasi Yodometrik)
1. Pengukuran DO0
Contoh air yang di ambil dari kolam Expedca (bagian tengah)
Dimasukkan contoh air hasil saringan tersebut ke dalam gelas
ukur sebanyak 75 mL Saring contoh air yang di ambil
dari kolam Expedca (bagian tengah) dengan menggunakan
kertas saring bebas abu
Diencerkan/ditambahkan dengan akuadest yang telah jenuh dengan oksigen (sebelumnya telah di aerasi) hingga mencapai
375 mL
Dimasukkan contoh air hasil pengenceran tersebut ke dalam 2
2. Pengukuran DO5
Botol winkler yang disimpan di inkubator selama 5 hari Salah satu botol winkler dianalisis kandungan oksigennya
(DO0) dengan metode
Yodometrik
Botol winkler yang kedua disimpan di inkubator dengan
suhu 20°C, selama 5 hari Ditutup kedua botol tersebut dengan hati-hati (jangan terjadi
gelembung udara)
Setelah 5 hari, analisis kandungan oksigen (D05)
dengan prosedur yang sama
Dibuka tutup botol tersebut, lalu ditambahkan 1 mL larutan
MnSO4 50%
Ditambahkan 1 mL larutan O2
Reagent
Biarkan hingga endapan mengendap sempurna
Jika endapan warna putih, pengukuran tidak dilanjutkan karena kandungan oksigen 0,0
(nol)
Jika terjadi endapan warna coklat, dibuka tutup botol
tersebut
Ditambahkan 2 mL larutan H2SO4 pekat dengan hati-hati
Ditutup kembali botol Winkler lalu dikocok
Biarkan endapan larut sempurna hingga larutan dalam botol
Winkler menjadi bening berwarna orange atau kuning
Dimasukkan 50 mL sampel kedalam gelas Erlenmeyer
3.3.7 Pengukuran Total Ammonia (NH4-N) Perairan
Prosedur Pengukuran : 1. Pengukuran total ammonia
Dititrasi dengan larutan thiosulfat (Na2S2O3) 0,01 N
hingga larutan berubah warna dari biru menjadi jernih
Dicatat larutan thiosulfat yang terpakai (mL)
Air yang di ambil dari kolam Cekdam (bagian tengah)
Saring contoh air tersebut dengan menggunakan kertas saring whatman(bebas abu) ke
dalam labu Erlenmeyer sebanyak 100 mL
Diambil sebanyak 25 mL contoh air yang telah disaring dengan
menggunakan pipet volume (bulb pipet)
Ditambahkan 1 mL larutan Signette
Dikalibrasikan alat Spectrofotometer Ditambahkan 0,5 mL larutan Nessler dengan mengguakan pipet volume (bulb pipet)
Dikocok dan biarkan 3 menit Dikocok dan biarkan 3 menit
Dimasukkan larutan tersebut ke dalam cool box
Dimasukkan larutan tersebut dan juga larutan standard NH4-N 5
µg/l (0,005 mg/l) ke dalam alat Spectrofotometer
Ukur absorbance kedua larutan tersebut dengan alat Spectrofotometer pada panjang
2. Pengukuran suhu
3. Pengukuran pH
Catat absorbance dari keduanya
Masukkan termometer ke dalam kolam yang akan diuji suhu nya
Catat angka yang ditunjukkan oleh termometer tersebut sebagai
hasil
Probe dibilas dengan aquadest pH-meter
Dilakukan kalibrasi alat pH-meter dengan menggunakan
larutan pH buffer
Dimasukkan ujung sensor/probe pH-meter kedalam air di
lapangan
3.3.8 Pengukuran Produktivitas Primer (Net Primary Productivity)
Prosedur Pengukuran :
Isi 3 buah botol Winkler (IB, DB dan LB) dengan contoh air hingga penuh/luber (jangan
terjadi gelembung udara)
Analisis kandungan oksigen pada botol Winkler IB (Initial
Bottle) saat itu juga
Catat kandungan oksigen IB (mg/l)
Biarkan kedua botol tersebut tergantung di lokasi pengambilan contoh air selama 4
jam
Inkubasi atau rendam botol DB dan LB dalam perairan terutama pada lokasi pengambilan contoh
air sebelumnya
Dibaca skala/angka pH air pada display alat, hingga angka pada
display stabil
Setelah waktu inkubasi berakhir, analisis kandungan oksigen dari
kedua botol tersebut
Hitung Produktivitas primer bersih (Net Primary
Productivity)
3.4 Analisa Data
3.4.1 Pengukuran Kecerahan
Rumus : SD(m)=SD1+2SD2
Inlet
SD(m)=SD1+2SD2 = 17+219,5=18,25cm=0,182m
Tengah
SD(m)=SD1+2SD2
=
17+219,5=18,25cm=0,182m Outllet
SD(m)=SD1+2SD2 = 17,62+17=17,3cm=0,173m
3.4.2 Pengukuran Karbondioksida Perairan
Rumus : mg/l CO2 – bebas = 100050 x(ml NaOH terpakai)×0,1×44
Inlet
mg/l CO2 – bebas = 100050 x1,6mL×0,1×44 = 140,8 ppm
Tengah
mg/l CO2 – bebas = 100050 x0,29mL×0,1×44 = 25,52 ppm
Outllet
mg/l CO2 – bebas = 100050 x0,19mL×0,1×44 = 16,72 ppm
3.4.3 Pengukuran pH Perairan
Nilai pH : Inlet = 7,85 Tengah = 7,75
3.4.4 Pengukuran Alkalinitas Perairan
3.4.5 Pengukuran Oksigen Terlarut Perairan
3.4.6 Pengukuran Oksigen Biokimia (BOD) Perairan
Pengenceran = 5
DO0=
3.4.7 Pengukuran Total Ammonia (NH4-N) Perairan
Tengah
3.4.8 Pengukuran Produktivitas Primer (Net Primary Productivity) Rumus :
Respirasi = IB – DB
Gross Primary Productivity (Fotosintesis) = LB – DB
Net Primari Productivity = (LB – DB) – (IB – DB) Keterangan :
IB (Initial Bottle) = Oksigen terlarut (mg/l) awal/sebelum inkubasi DB (Dark Bottle) = Oksigen terlarut (mg/l) pada botol gelap setelah Inkubasi dalam perairan
LB (Light Bottle) = Oksigen terlarut (mg/l) pada botol terang setelah Inkubasi dalam perairan
Gross Primary Productivity
LB – DB = 7,71 - 9,4 = -1,69 mg/l
Net Primary Productivity
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Data Kelompok a. Transparansi Cahaya
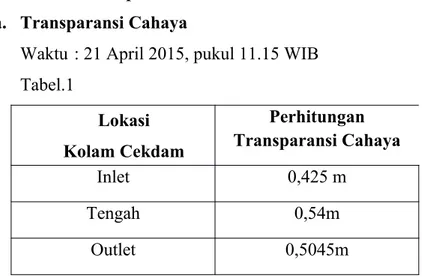
Waktu : 21 April 2015, pukul 11.15 WIB Tabel.1
Grafik 1. Perhitungan Tranparansi Cahaya
Inlet Tengah Outlet
0 0.1 0.2 0.3 0.4 0.5 0.6
Perhitungan Cahaya (m) Lokasi
Kolam Cekdam
Perhitungan Transparansi Cahaya
Inlet 0,425 m
Tengah 0,54m
b. Karbondioksida Perairan
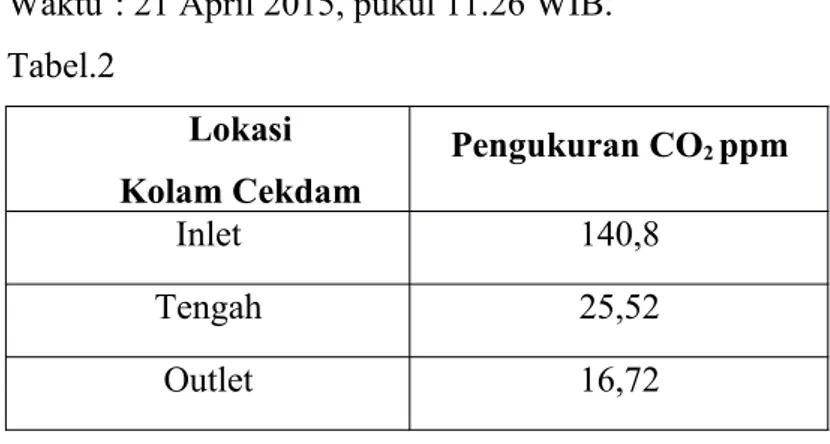
Waktu : 21 April 2015, pukul 11.26 WIB. Tabel.2
Lokasi Kolam Cekdam
Pengukuran CO2 ppm
Inlet 140,8
Tengah 25,52
Outlet 16,72
Grafik 2. Perhitungan Karbondioksida Perairan
Inlet Tengah Outlet
0 20 40 60 80 100 120 140 160
c. pH Perairan
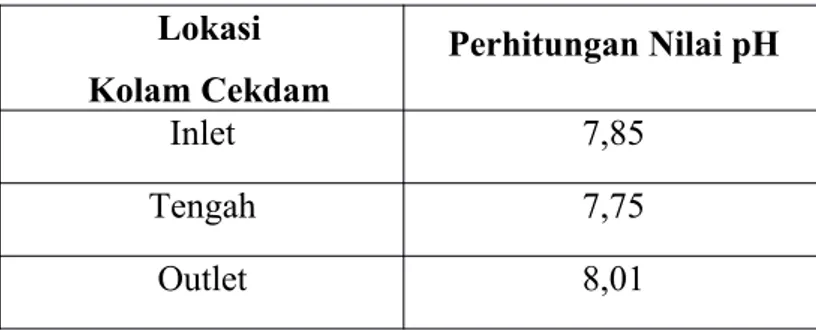
Waktu : 21 April 2015, pukul 11.25 WIB Tabel.3
Lokasi Kolam Cekdam
Perhitungan Nilai pH
Inlet 7,85
Tengah 7,75
Outlet 8,01
Grafik 3. Pengukuran pH Air (Metode Potensiometrik)
Inlet Tengah Outlet
7.6 7.65 7.7 7.75 7.8 7.85 7.9 7.95 8 8.05
d. Alkalinitas Perairan
Waktu : 21 April 2015, pukul 11.40 WIB. Tabel.4
Lokasi Kolam Cekdam
Pengukuran Alkalinitas meq/l
Inlet 190
Tengah 230
Outlet 160
Grafik 4. Pengukuran Alkalinitas
[
Ca(HCO3)2]
(Metode TitrasiAsidimetrik)
Inlet Tengah Outlet
0 50 100 150 200 250
Pengukuran Alkalinitas meq/l
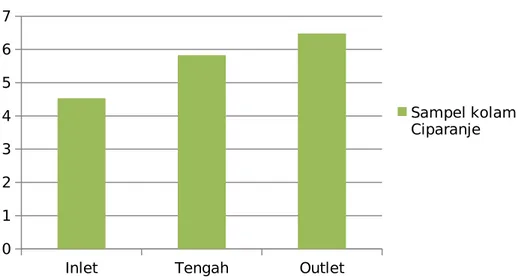
e. Oksigen Terlarut Perairan Sampel Kolam Ciparanje
Inlet Tengah Outlet
4,53 ppm 5,83 ppm 6,48 ppm
Grafik 5. Oksigen Terlarut Perairan
Perhitungan Oksigen Terlarut (ppm)
Sampel kolam Ciparanje
f. Biochemical Oxygen Demand (Metode : Winkler, Titrasi Yodometrik)
DO0 DO5 Kadar BOD5 (mg/l)
7,75 mg/l 0 mg/l 38,75 mg/l
Tabel 6
Grafik 6. Perhitungan DO0,DO5,BOD
DO0 DO5 Kadar BOD5 (mg/l)
g. Total Ammonia (NH4-N) dan Ammonia Undissosited (NH3-N) Perairan (Metode : Spectrofotometrik)
PH : 7,75 Suhu : 29°C
Grafik 7. Total Ammonia (NH4-N) dan Ammonia Undissosited (NH3-N) Perairan (Metode : Spectrofotometrik)
Inlet Tengah Outlet
h. Produktivitas Primer (Net Primary Productivity)
Lokasi
Hasil Pengukuran
IB DB LB Respirasi Gross Primary Productivity
Net Primary Productivity
Expedca Tengah 6,94 9,4 7,71 -2,46 -1,69 0,77
Tabel 8.
-4 -2 0 2 4 6 8 10 12
Hasil Pengukuran
a. Transparasi Cahaya
A 1
Tengah 16,76
Outlet 26,4
C 3 Expedca
Inlet 12,32
Tengah 42,24
Outlet 66
Tabel 10. Grafik 10. Pengkuran CO2 Perairan
Kelompok Lokasi Hasil PengukuranpH
Grafik 11. Pengukuran pH Data Angkatan
Kelompok Lokasi ParameterAlkalinitas
A 1 Ciparanje
Inlet 325
Tengah 325
Outlet 325
A 2 Cekdam
Inlet 290
Tengah 224
Outlet 176
A 3 Expedca Inlet 345
Outlet 255 B 1 Ciparanje
Inlet 133
Tengah 190
Outlet 157
B 2 Cekdam
Inlet 190
Tengah 230
Outlet 160
B 3 Expedca
Inlet 229
Tengah 100
Outlet 200
C 1 Ciparanje
Inlet 200
Tengah 159
Outlet 152
C 2 Cekdam
Inlet 143
Tengah 214
Outlet 180
C 3 Expedca
Inlet 60
Tengah 162
Outlet 160
Tabel 12
A 1
e. Oksigen Terlarut Perairan
Kelompok Lokasi DO0Hasil PengukuranDO5
A 3 Ciparanje 6,49 2,43
A 1 Cekdam 7,78 0,81
A 2 Expedca 7,8 3,57
B 3 Ciparanje 6,97 1,946
B 1 Cekdam 7,14 1,38
B 2 Expedca 7,75 0
C 3 Ciparanje 7,3 2,91
C 1 Cekdam 6,48 0
C 2 Expedca 6,48 3,89
Tabel 13
A 3
Hasil Perhitungan Oksigen Terlarut
DO0 DO5
f. Oksigen Biokimia (BOD) Perairan
Kelompok Lokasi
Hasil Pengukuran
BOD5
A 3 Ciparanje 20,3
A 1 Cekdam 34,85
A 2 Expedca 21,15
B 3 Ciparanje 25,12
B 1 Cekdam 28,8
B 2 Expedca 38,75
C 3 Ciparanje 21,95
C 1 Cekdam 32,4
C 2 Expedca 12,95
Tabel 14
A 3
g. Total Ammonia (NH4-N) Perairan
Kelompok Lokasi
Hasil Pengukuran
pH Suhu Total Ammonia (NH4 – N)
A 1
Ciparanje
Inlet 7,78 24°C 3,022 mg/l
A 2 Tengah 7,4 25°C 3,93 mg/l
A 3 Outlet 7,5 25°C 5,834 mg/l
B 1
Cekdam
Inlet 7,8 27°C 2,485 mg/l
B 2 Tengah 7,75 29°C 1,466mg/l
B 3 Outlet 7,73 27°C 8,6 mg/l
C 1
Expedca
Inlet 7,8 27°C 8,172 mg/l
C 2 Tengah 8,07 27°C 8mg/l
C 3 Outlet 8,13 27°C 4,82 mg/l
Tabel 15
0 Hasil Pengukuran Total Ammonia (NH4 – N)
a. Produktivitas Primer (Net Primary Productivity)
Kelompok Lokasi
Hasil Pengukuran
IB DB LB Respirasi Gross Primary Productivity
Net Primary Productivity C 1
Ciparanje Inlet 6,8 6,95 5,52 1,28 1,43 0,15
C 2 Tengah 6,16 5,09 10,48 1,07 5,39 4,32
C 3 Outlet 7,26 6,17 6,49 1,09 0,32 -0,77
A 1
Cekdam Inlet 6,16 5,18 5,83 0,96 0,65 -0,31
A 2 Tengah 4,31 3,98 4,15 0,33 0,17 -0,16
A 3 Outlet 6,16 6,16 8,76 0 2,6 2,6
B 1
Expedca Inlet 7,26 11,42 9,28 -4,16 -2,14 2,02
B 2 Tengah 6,94 9,4 7,71 -2,46 -1,69 0,77
B 3 Outlet 8,5 5,84 6,033 2,66 0,193 -2,467
Tabel 16
-6
Hasil Perhitungan Produktivitas Primer (Net Primary Productivity)
Hasil Pengukuran IB Hasil Pengukuran DB Hasil Pengukuran LB Hasil Pengukuran Respirasi Hasil Pengukuran Gross Primary Productivity Hasil Pengukuran Net Primary Productivity
Pada sampel air Kolam Ciparanje Transparansi Cahayanya sebesar 36,95 cm. Pada sampel air Kolam Cekdam Transparansi Cahayanya sebesar 49 cm. Pada sampel air Kolam Expedca Transparansi Cahayanya sebesar 23,36 cm. Transparansi Cahaya tertinggi yaitu pada Kolam Cekdam sehingga cahaya matahari masuk dapat masuk kedalam perairan dan dapat membantu kelangsungan hidup organisme air. Transparansi Cahaya terendah yaitu pada kolam Expedca sehingga cahaya yang masuk kedalam kolam terbatas atau sedikit.
4.2.2 Karbondioksida Perairan
Kandungan Karbondioksida bebas (CO2) dalam suatu perairan
maksimal 20 ppm (Rahmatin, 1976). Kandungan Karbondioksida bebas (CO2) pada suatu perairan melebihi 20 ppm, maka membahayakan biota
membahayakan kehidupan organisme perairan, dapat diasumsikan bahwa bila dalam suatu perairan kadar Karbondioksida (CO2) berlebihan dapat
berdampak kritis bagi kehidupan binatang air (Spotte, 1920).
Karbondioksida bebas (CO2) merupakan salah satu gas respirasi
yang penting bagi sistem perairan, kandungan karbondioksida bebas dipengaruhi oleh kandungan bahan organik terurai, agilasi suhu, pH, dan aktivitas fotosintesis. Sumber CO2 bebas berasal dari proses pembangunan
bahan organik oleh jasad renik dan respirasi organisme (Soesono 1970), dan menurut Widjadja (1975) karbondioksida bebas dalam perairan berasal dari hasil penguraian bahan-bahan organik oleh bakteri dekomposer atau mikroorganisme, naiknya CO2 selalu diiringi oleh turunya kadar O2 terlarut
yang diperlukan bagi pernafasan hewan-hewan air.
Dengan demikian walaupun CO2 belum mencapai kadar tinggi yang
mematikan, hewan-hewan air sudah mati karena kekurangan O2. Kadar
CO2 yang dikehendaki oleh ikan adalah tidak lebih dari 12 ppm dengan
kandungan O2 terendah adalah 2 ppm (Asmawi, 1983).
Istilah karbondioksida bebas digunakan untuk menjelaskan CO2
yang terlarut dalam air, selain yang berada dalam bentuk terikat sebagai ion bikarbonat ( HCO3) dan ion karbonat ( CO32-). Karbondioksida bebas
(CO2) bebas menggambarkan keberadaan gas CO2 di perairan yang
membentuk keseimbangan dengan CO2 di atmosfer. Nilai CO2 yang
terukur biasanya berupa CO2 bebas. Perairan tawar alami hampir tidak
memiliki pH > 9 sehingga tidak ditemukan karbon dalam bentuk karbonat. Pada air tanah, kandungan karbonat biasanya sekitar 10 mg/L karena sifat tanah yang cenderung alkalis.
Kadar karbon di perairan dapat mengalami penurunan bahkan hilang akibat proses fotosintesis, evaporasi dan agitasi air. Perairan yang diperuntukan untuk kepentingan perikanan sebaiknya mengandung kadar karbondioksida bebas < 5 mg/L. Kadar karbondioksida sebesar 10 mg/L masih dapat ditolerir oleh organisme akuatik, asal disertai oksigen yang cukup. Sebagian besar organisme akuatik dapat bertahan hidup hingga kadar karbondioksida bebas mencapai sebesar 60 mg/L (Byod, 1988 dalam Mahida, 1948).
Pada sampel air Kolam Ciparanje kadar CO2 sebesar 40,38 ppm.
Pada sampel air Kolam Cekdam kadar CO2 36,28 ppm. Pada sampel air
Kolam Expedca kadar CO2 51,43 ppm. Kadar CO2 pada ketiga kolam pengukuran kesuburan suatu perairan. Banyak reaksi kimia penting yang terjadi pada tingkatan pH yang sulit. Menurut jenis dan aktivitas biologinya suatu perairan dapat mengubah pH dari unit penanganan limbahnya (Mahida, 1984), tetapi pada umumnya batas toleransi ikan adalah berkisar pada pH 4 “Aerd penth point” sampai pH 2 “Basie death point”. Perairan yang memiliki kadar pH 6,5 – 8,5 merupakan perairan yang sangat ideal untuk tempat hidup dan produktifitas organisme air.
Pada sampel air Kolam Ciparanje kadar pH 7,43. Pada sampel air Kolam Cekdam kadar pH 7,76. Pada sampel air Kolam Expedca kadar pH 8,11. Hal ini menunjukan bahwa kadar pH dari ketiga kolam dapat dinyatakn normal dan merupakan air yang ideal untuk tempat hidup dan produktifitas organisme air.
mineral. Garam mineral merupakan faktor penentu bagi semua proses produksi di suatu perairan. Derajat keasaman perairan merupakan suatu parameter penting dalam pemantauan kualitas air, dengan mengetahui jumlah kadar pH suatu perairan kita dapat mengetahui tingkat produktifitas perairan tersebut. Kandungan pH dalam suatu perairan dapat berubah-ubah sepanjang hari akibat dari proses fotosintesis tumbuhan air.
Derajat keasaman suatu perairan juga sangat menentukan kelangsungan hidup organisme dan merupakan resultan sifat kimia, fisika perairan (Welch, 1952). Jumlah ion hidrogen dalam suatu larutan merupakan suatu tolak ukur keasaman. Lebih banyak ion H+ berarti lebih
asam suatu larutan dan lebih sedikit ion H+ berarti lebih basa larutan
tersebut. Larutan yang bersifat basa banyak mengandung OH- dan sedikit
ion H+. Keasaman dan kebasaan diukur dengan skala logaritma antara 1
sampai 14 satuan. Satuan ini disebut pH dan skalanya skala pH. Oleh karena itu, nilai pH rendah menunjukan kondisi asam, dan nilai pH yang tinggi menunjukan konsentrasi H+ rendah atau konsentrasi OH- tinggi
(Nybakken, 1988).
4.2.4 Alkalinitas Perairan
Dari hasil praktikum didapatkan nilai alkalinitas pada sampel kolam Ciparanje sebesar 218,44 mg/l dengan kondisi alkalinitas yang normal, alkalinitas pada sampel kolam Cekdam sebesar 200,78 mg/l dengan kondisi alkalinitas yang normal, alkalinitas pada sampel kolam Expedca sebesar 201,22 mg/l dengan kondisi alkalinitas yang normal, hal ini sesuai dengan pernyataan Effendi (2003), nilai alkalinitas yang baik antara 30-500 mg/l CaCO3 sehingga nilai alkalinitas pada ketiga kolam dapat
dikatakan baik.
4.2.5 Oksigen Terlarut Perairan
4,46 mg/l, nilai DO pada kolam Expedca sebesar 7,5 mg/l. Sedangkan dengan menggunakan alat (DO METER) pada kolam Ciparanje yaitu sebesar 8 mg/l. Kondisi tersebut cukup optimum dalam perairan menurut Effendi (2003) Kadar DO di perairan tawar berkisar sekitar 15 mg/ l pada suhu 00C dan 8 mg/ l pada suhu 250C, sehingga dapat dikatakan perairan
dalam kondisi baik.
4.2.6 Oksigen Biokimia (BOD) Perairan
Dari data praktikum didapatkan nilai BOD pada kolam Ciparanje sebesar 22,46 mg/l, nilai BOD pada kolam Cekdam sebesar 32 mg/l, nilai BOD pada kolam Expedca sebesar 24,28 mg/l nilai ini cukup tinggi karena nilai BOD merupakan indikator bahan organik yang ada di perairan. Menurut Effendi (2003) berdasarkan kemampuan beroksidasi, penggunaan BOD dianggap paling baik dalam menggamarkan keberadaan bahan organik, baik yang dapat dikomposisi secara biologis maupun tidak.
4.2.7 Total Ammonia (NH4-N) Perairan
Berdasarkan data hasil praktikum, didapat total Amonnia (NH4-N)
pada sampel Kolam Ciparanje sebesar 4,3 ppm, total Amonnia (NH4-N)
pada sampel Kolam Cekdam sebesar 4,18 ppm, total Amonnia (NH4-N)
pada sampel Kolam Expedca sebesar 6,99 ppm. Total Ammonia pada ketiga kolam sangat besar sehingga dapat mengakibatkan Ikan yang terus menerus terekspos NH3 pada konsentrasi lebih dari 0.02 mg/l dapat
menurunkan pertumbuhan dan semakin rentan terhadap penyakit (Butner 1993).
4.2.8 Produktivitas Primer (Net Primary Productivity)
Produktivitas primer dapat diartikan sebagai kandungan bahan-bahan organik yang dihasilkan dari proses fotosintesis oleh organisme berklorofil dan mampu mendukung aktivitas biologi di perairan tersebut. Produktivitas primer dapat diketahui nilainya dengan cara mengukur perubahan kandungan DO yang dihasilkan dari proses fotosintesis. Produksi oksigen dapat menjadi dasar pengukuran adanya kesetaraan yang kuat antara O2 dan pangan yang dihasilkan (Odum 1970).
BAB V
SIMPULAN DAN SARAN
5.1 Kesimpulan
1. Berdasarkan pengamatan yang telah praktikan lakukan menunjukkan bahwa hasil analisis kolam ciparanaje, cekdam dan expedca sebagai berikut:
a. Ciparanje
Kolam Ciparanje memiliki warna air yang cukup coklat. Keadaan kolam disana yang memiliki 3 titik yaitu inlet, tengah dan outlet. Kualitas kolam ini menunjukkan ... Sehingga ....
b. Cekdam
Keadaan kolam cekdam ini hampir sama dengan kolam ciparanje. Berdasarkan analisis yang praktikan lakukan, kolam ini ... sehingga... c. Expedca
Sama halnya dengan kolam ciparanje dan cekdam praktikan juga melakukan beberapa kegiatan pengamatan di kolam ini. Dengan hasilnya yaitu ...
2. Dengan melakukan praktikum ini maka praktikan mengenal juga alat serta fungsi yang digunakan pada saat praktikum, yaitu sebagai berikut: 1. Sechi disk, untuk mengukur transparasi cahaya
2. Ph meter, untuk mengukur Ph
3. Erlenmeyer, untuk menampung sample air 4. Botol winkler, untuk media sample percobaan
5. Spektrofotometer, untuk mengukur transmitan atau absorban 6. Termometer, untuk mengukur suhu
3. Dan dengan praktikum ini juga praktikan dapat mengetahui cara menghitung hasil analisis dengan rumus tertentu yang sudah di tentukan, salah satu diantaranya menghitung BOD dengan rumus:
DO0atau DO5 =
Kadar BOD5(mg/l) = DO0(mg/l) – DO5 (mg/l) x “Pengenceran”
5.2 Saran
1. Dalam penentuan kualitas air, kebersihan alat dan bahan harus selalu dijaga agar dalam melakukan analisis tidak terjadi kesalahan.
2. Gunakan waktu praktikum seefektif mungkin karena dalam melakukan analisis kualitas air diperlukan ketelitian yang benar.
3. Dalam praktikum analisis kualitas air harus dilakukan berulang ulang agar didapat hasil yang benar benar sesuai.
Anwar, D, D. A. Setiawibowo dan Y. Triwijiwati. 2009. Respirasi (Tingkat Konsumsi Oksigen) dan Ketahanan Ikan di luar Media Air. http://jurnal.pdii.lipi.go.id/admin/jurnal.pdf. Diakses pada tanggal 01 Juni 2015 pukul 10.00 WIB.
Arrignon and Jacques. 1999. Management of Freshwater Fisheries Science. Publishers, INC : USA
Barus T. A. 2002. Pengantar Limnologi. USU-Press. Medan
Boyd, C.E. 1979. Pengelolaan Kualitas Air. Dirjen Perikanan. Jakarta
Efendi, 2003. Telaah kualitas air bagi pengelolaan sumber daya dan lingkungan perairan. KANISIUS (Anggota IKAPI). Yogyakarta.
Hendra., Saputra, 1988. Membuat dan Membudidayakan Ikan dalam Kantong Jaring. CV.Simplex, Jakarta
Kordi, 2004. Penanggulang Hama dan Penyakit Ikan. Bina Adiaksara, Jakarta.
Kemili .P, Putri Mutiara.R, 2012. Pengaruh Durasi dan Intensitas Upwelling Berdasarkan Anomali Suhu Permukaan Laut Terhadap Variabilitas
Produktivitas Primer di Perairan Indonesia. Jurnal Ilmu dan Teknologi
Kelautan Tropis, Vol. 4, No. 1, Hlm. 66-79 : Ikatan Sarjana Oseanologi Indonesia dan Departemen Ilmu dan Teknologi Kelautan, FPIK-IPB
Mujiman., A, 1989. Makanan Ikan. Penebar Swadaya, Jakarta.
Nybakken, J. W. 1992. Biologi Laut Suatu Pendekatan Ekologi. Cetakan ke-2. PT. Gramedia Pustaka Utama. Jakarta
Salmin, 2005. Oksigen Terlarut (Do) dan Kebutuhan Oksigen Biologi (Bod) Sebagai Salah Satu Indikator untuk Menentukan Kualitas Perairan. Bidang Dinamika Laut, Pusat Penelitian Oseanografi-LIPI : Jakarta
Sastrawijaya, 2000. Pencemaran Lingkungan. Rineka Cipta, Jakarta.
Soeyasa, 2001. Ekologi Perairan. Departemen Kelautan dan Perikanan Dirjen.Pendidikan Menengah Atas, Jakarta.
LAMPIRAN
Lampiran Praktikum 1
1. Kecerahan 2. pH
3. CO2 Bebas
4. Alkalinitas
Lampiran Praktikum 3
Air hasil saringan dimasukkan Diencerkan dengan akuades yang telah kedalam gelas ukur sebanyak 75 ml jenuh dengan O2 hingga 375 mL
Dihomogenkan (dikocok) Sampel yang sudah dihomogenkan dimasukkan kedalam 2 buah botol Winkler
Ditambahkan 1 mL larutanMnSO4 Ditambahkan 1 mL larutan O2
Reagent
Dihomogenkan (Dikocok) Biarkan hingga endapan mengendap sempurna
Dimasukkan 50 mL sampel keDititrasi dengan larutan thiosulfat dalam gelas Erlenmeyer (Na2S2O3) 0,01 N
Larutan berubah menjadi bening Catat volume (Na2S2O3) 0,01 N
yang terpakai
Lampiran Praktikum 4
Penyaringan air kolam cekdam Air hasil saringan sebanyak 100 ml (tengah)
Pengambilan air sebanyak 25 mL Dimasukkan ke tabung reaksi
Dikocok dan dibiarkan 3 menit Pengambilan 0,5 mL larutan Nessel
Dimasukkan 0,5 mL larutan Dikocok dan dibiarkan 3 menit Nesser ke dalam tabung reaksi
Lampiran Praktikum 5
1. Produktivitas Primer (Net Primary Productivity) Perairan / Fitoplankton



![Grafik 4. Pengukuran Alkalinitas [ Ca(HCO 3 ) 2 ] (Metode Titrasi Asidimetrik)](https://thumb-ap.123doks.com/thumbv2/123dok/3975739.1919159/49.892.223.637.269.444/grafik-pengukuran-alkalinitas-ca-hco-metode-titrasi-asidimetrik.webp)