LAPORAN PRAKTIKUM
KIMIA ELEKTRO
PEMBUATAN BATERAI DARI UANG LOGAM UNTUK
ELEKTROLISIS
NAMA KELOMPOK :
HAYIN ICHDA YULIANTIKA 14030234003/KA’14
YOHANA ENDAH PERWITA S. 14030234029/KA’14
MAGHFIROTUL IMMA 14030234017/KB’14
DANANG SETIAWAN 14030234047/KB’14
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
I. Judul : Pembuatan baterai dari uang logam untuk elektrolisis
air
II. Hari dan Tanggal percobaan:
Mulai : Kamis, 4 Maret 2016 pukul 13.00 WIB
Selesai : Kamis, 4 Maret 2016 pukul 17.00 WIB
III. Tujuan :
a. Melakukan pembuatan baterai dari uang logam.
b. Menentukan besarnya tegangan yang dihasilkan dari baterai uang logam. c. Melakukan elektrolisis larutan soda dengan baterai koin.
d. Menentukan teganggan paling efektif untuk elektrolisis.
IV. Dasar Teori :
A. Sel Elektrolisis
Elektrokimia dengan reaksi redoks tidak spontan terjadi pada peristiwa elektrolisis. Pada elektrolisis, arus listrik digunakan untuk memacu berlangsungnya reaksi redoks yang tidak spontan. Dengan kata lain, energi listrik diubah menjadi energi kimia.
Elektrolisis adalah penguraian suatu elektrolit oleh arus listrik. Pada sel elektrolisis, reaksi kimia akan terjadi jika arus listrik dialirkan melalui larutan elektrolit,yaitu energi listrik (arus listrik) diubah menjadi energi kimia (reaksi redoks). Sel elektrolisis memiliki 3 ciri utama,yaitu :
Ada larutan elektrolit yang mengandung ion bebas. Ion – ion ini dapat memberikan atau menerima elektron sehingga elektron dapat mengalir melalui larutan.
Ada 2 elektroda dalam sel elektrolisis.
Ada sumber arus listrik dari luar,seperti baterai yang mengalirkan arus listrik searah (DC).
Dalam suatu elektrolit terdapat kation (ion positif) dan anion (ion negatif) yang berasal dari ionisasi elektrolit. Jika kita alirkan listrik dalam elektrolit tersebut, maka kation akan mengalami reduksi anion akan mengalami oksidasi. Kation akan menuju ke katode (tempat terjadi peristiwa reduksi), sedangkan anion akan menuju ke anode (tempat terjadi peristiwa oksidasi). Jadi, dalam sel elektrolisis, katode merupakan elektrode negatif sebab dituju oleh ion positif., sedangkan anode adalah elektrode positif sebab dituju oleh ion negatif.
Sel elektrolisis mempunyai beberapa komponen utama, yaitu wadah, elektrode, elektrolit, dan sumber arus searah. Dalam sel ini, pemakaian jenis elektrode dan elektrolit sangat mempengaruhi jenis produk yang dihasilkan. Reaksi pada katode dan anode (Elektrolisis) dibagi menjadi 3 macam / kelompok :
a) Sel Elektrolisis dengan Elektrolit Lelehan
Biasanya pada sel ini elektrode yang dipakai adalah electrode yang inert (tidak bereaksi), yaitu platina atau karbon. Lelehan adalah kondisi elektrolit tanpa mengandung pelarut (air). Jika arus listrik dialirkan kedalam senyawa ion, maka senyawa itu akan terurai menjadi anion dan kation. Pada waktu proses elektrolisis, kation akan menuju ke katode dan anion akan menuju ke anode. Kation langsung direduksi dan anion langsung dioksidasi.
Contoh :
NaCl (l) → Na+ + Cl- … x 2
Katode : Na+ → Na … x 2
Anode : 2Cl- → Cl
2 + 2e
b) Sel Elektrolisis dengan Elektrolit Larutan dan Elektrode Inert (Tidak Reaktif)
Unsur yang dapat dipakai sebagai elektrode inert adalah karbon (C) dan Pelatina (pt). elektrolit yang berupa larutan mengandung air. Adanya air dalam larutan mengakibatkan adanya kompetisi antara air dengan zat-zat tertentu yang terlihat dalam elektrolisis.
1) Reaksi pada Katode (Reduksi pada Kation)
Ion-ion logam golongan IA, IIA, Al, dan Mn, serta ion-ion logam yang direduksi menjadi logam yang diendapkanpada permukaan katode.
Mn+ + ne → M
Ion H+ dari asam direduksi menjadi hydrogen.
2H+ + 2e → H 2
2) Reaksi pada Anode (Oksidasi pada Anion)
Ion-ion yang mengandung oksigen (SO42-, NO3, CO32-) kecenderungan untuk
melakukan reaksi oksidasi lebih kecil dibanding air sehingga yang dioksidasi adalah air.
2H2O → 4H+ + 4e + O2
Ion-ion yang tidak mengandung oksigen (Cl-, Br, I-) cenderung mengalami
oksidasi disbanding air sehingga yang dioksidasi ion-ion itu. 2X- → X
2 + 2e
Ion OH- dari basa dioksidasi menjadi gas oksigen (O 2)
4OH- → 2H
2O + 4e + O2
c) Sel Elektrolisis dengan Elektrolit Larutan dan Elektrode Tidak Inert (Reaktif) Pada sel ini elektrode tidak inert ikut bereaksi dan hanya terjadi di anode. Contoh dari elektrode ini adalah Cu, Fe, Zn, dan sebagainya, kecuali Pt dan C.
1) Reaksi pada Katode
Reaksi yang terjadi sama dengan reaksi yang terjadi pada katode pada kondisi sel elektrolisis dengan electrode inert.
Logam anode akan teroksidasi menjadi larutan. Dalam hal ini, semua anion tidak perlu diperhatikan.
HUKUM FARADAY
Michael Faraday (1791-1867) adalah seorang ahli kimia yang telah menemukan
hubungan antara jumlah arus listrik yang dibutuhkan dengan massa zat yang dibebaskan pada proses elektrolisis. Faraday menemukan beberapa kaidah perhitungan elektrolisis yang dikenal dengan hukum Faraday.
Bunyi hukum Faraday adalah sebagai berikut :
I. Jumlah zat yangdihasilkan pada electrode berbanding lurus dengan jumlah arus listrik yang melalui elektrolisis.
II. Jika arus listrik yang sama dilewatkan pada beberapa sel elektrolisis, maka berat zat yang dihasilakan masing masing sel berbanding lurus dengan berat ekuivalen zat itu.
Gb.Hukum Faraday II
Nama Michael Faraday diabadikan dengan memberikan nama salah satu satuan dalam perhitungan elektrolisis, yaitu faraday (F) yang didefinisikan, satu faraday (1 F) adalah jumlah listrik yang terdiri atas 1 mol electron atau 6,0221367 x 1023 butir elektron.
Karena 1 butir elektron = 1,60217733 x 10-19 coulomb, maka 1 faraday setara dengan
muatan sebesar :
6,0221367 x 1023 x 1,60217733 x 10-19 coulomb = 9,64853 x 104 coulomb,
dibulatkan menjadi 9,65 x 10 4 atau 96500 coulomb.
Hubungan antara Faraday dan Coulomb dapat dinyatakan dalam persamaan berikut :
F=96500Q
Q = F x 96500
Coulomb adalah satuan muatan listrik. Coulomb dapat diperoleh melalui perkalian arus listrik (Ampere) dengan waktu (detik). Persamaan yang menunjukkan hubungan Coulomb, Ampere, dan detik adalah sebagai berikut :
Q = i x t
Dengan demikian, hubungan antara Faraday, Ampere, dan detik adalah sebagai berikut :
F=96500Q =96500i x t
Keterangan :
F = jumlah listrik dalam faraday/ jumlah mol elektron (F) Q = coulomb (C)
i = kuat arus (Ampere / A) t = waktu (detik / s)
Hukum Faraday I secara matematis dapat dirumuskan sebagai berikut :
w=e × i×t96500=e . F
Keterangan :
w = massa zat yang dihasilkan (gr)
e = massa ekuivalen = Ar atau Mrvalensi
i = kuat arus (Ampere / A) t = waktu (detik / s)
F = jumlah listrik dalam faraday/ jumlah mol elektron (F)
Jadi, jumlah faraday = jumlah mol elektron = nilai perubahan bilangan oksidasi 1 mol zat pada Hukum I Faraday, biasanya nilai nilai Ar diketahui sehingga nilai e diubah menjadi
e=Ar
n dengan
A
r = massa atom relatif dann
= jumlah elektron yang diterima atau dilepasjadi rumus Hukum I Faraday sebagai berikut
e=
Arn xi x tFatau w=Mn xr i x tF
e=
i x tF x w x nAr =konstanJadi, rumus Hukum Faraday II yaitu sebagai berikut : w1
e1 = w2
e2 Keterangan :
w1 = massa zat yang dihasilkan untuk elektrolisis I (gr)
w2
= massa zat yang dihasilkan untuk elektrolisis II (gr)
e1= massa ekuivalen elektrolisis I
e2
= massa ekuivalen elektrolisis II
KEGUNAAN ELEKTROLISIS
a) Pemurnian Logam
Logam yang ada dialam sebagian besar masih bercampur dengan logam lain. Untuk mendapatkan logam yang diinginkan, tentu saja zat lain yang bercampur dengan logam itu harus dihilangkan. Apabila campuran zat lain itu sudah hilang, maka fungsi logam yang kita kehendaki akan optimal dalam penggunaannya. Pada contoh berikut, akan dibahas tentang cara menghilangkan zat-zat lain yang bercampur dengan tembaga sehingga diperoleh unsur tembaga murni.
Tembaga adalah logam penghantar listrik yang baik. Supaya konduktivitasnya (daya hantar listrik) meningkat, maka tembaga perlu dibersihkan dari pengotornya.sel elektrolisis sering digunakan untuk memurnikan logam (dalam hal ini tembaga) dari pengotornya. Sebagai katode, tempatkan tembaga yang akan anda murnikan, sedangkan tembaga murni ditempatkan sebagai anode. Elektrolit yang digunakan adalah larutan yang mengandung kation logam yang akan dimurnikan ( dalam hal ini adalah larutan CuSO4).
Reaksi yang terjadi adalah sebagai berikut : CuSO4 (aq) → Cu2+(aq) + SO42-(aq)
Katode (tembaga kotor) : Cu2+
(aq) + 2e → Cu(s)
Kation tembaga direduksi menjadi tembaga yang mengendap di katode. Kation Cu2+ dari anode menuju larutan menggantikan ion Cu2+ yang mengalami
reduksi. Dengan mengatur tegangan selama elektrolisis, logam pengotor katode yang mempunyai potensial lebih positif dari tembaga yang akan jatuh ke bawah dan tidak larut. Adapun pengotor yang mempunyai potensial lebih negative dari tembaga, akan larut tetapi tidak akan mengendap di katode. Supaya kotoran itu tidak ke mana-mana, maka harus ada penyaring sehingga daerah katode akan bersih.
b) Penyepuhan Logam
Untuk mencegah logam supaya tidak mudah berkarat atau untuk memperindah warna logam, suatu logamdapat dilapisi dengan logam yang lain. Proses pelapisan logam oleh logam lain ini dikenal dengan nama penyepuhan logam. Logam yang biasa digunakan untuk melapisi (menyepuh) adalah emas, perak, kromium, titanium dan nikel.benda-benda yang biasa dilapisi adalah mesin-mesin kendaraan bermotor, alat-alat rumah tangga, dan aksesoris.
Pada penyepuhan ini, digunakan elektrode yang reaktif dan elektrolit larutan yang mengandung kation logam yang akan melapisi. Misalnya untuk melapisi sendok dengan perak, logam yang digunakan sebagai anode, sedangkan elektrolit yang digunakan adalah larutan AgNO3.Korosi (Perkaratan) adalah proses teroksidasinya
suatu logam oleh berbagai zat menjadi senyawa.
Proses korosi merupakan peristiwa elektrokimia. Suatu logam akan mengalami korosi bila permukaan logam terdapat bagian yang berperan sebagai anoda dan di bagian lain berperan sebagai katoda. Proses korosi yang banyak terjadi adalah korosi pada besi. Bagian tertentu dari besi berperan sebagai anoda, sehingga besi mengalami oksidasi.
Fe (s) <---> Fe2+ (aq) + 2e
Cara Mencegah Korosi Korosi dapat menimbulkan kerugian karena selain merusak alat atau bangunan dari logam juga menyebabkan logam menjadi rapuh dan tidak mengkilat.
Cara-cara pencegahan korosi yang sering dilakukan adalah sebagai berikut. 1) Melapisi logam dengan cat, minyak atau oli, plastik atau dengan logam lain yang tahan korosi misalnya krom, nikel, perak, dan sebagainya.
2) Perlindungan katoda. Logam yang dilindungi dari korosi diposisikan sebagai katoda, kemudian dihubungkan dengan logam lain yang lebih mudah teroksidasi (memiliki E° lebih negatif dari logam yang dilindungi). Misalnya pipa besi dalam tanah dihubungkan dengan logam Mg. Logam Mg sengaja dikorbankan agar teroksidasi tetapi pipa besi tidak teroksidasi.
3) Membuat alloy atau paduan logam, misalnya besi dicampur dengan logam Ni dan Cr menjadi baja stainless (72% Fe, 19%Cr, 9%Ni).
Adapun reaksi yang terjadi pada penyepuhan sendok dengan perak adalah sebagai berikut :
AgNO3 → Ag+ + NO3
-Katode (sendok) : Ag+
(aq) + e → Ag(s)
Anode (perak) : Ag(s)→ Ag+(aq) + e
Proses yang tejadi adalah kation dari larutan mengalamireduksi kemudian mengendap di permukaan katode (sendok). Logam perak pada anode mengalami oksidasi dan menghasilkan kation yang menuju ke larutan untuk menggantikan kation larutan yang mengalami reduksi.
c) Produksi Gas
Metode elektrolisis dipakai oleh industry untuk membuat gas klorin, oksigen, dan hidrogen dalam jumlah besar. Untuk memproduksi gas oksigen (O2) biasanya
digunakan larutan yang mengandung anion SO42-, NO3, dan CO32-. Demikian pula
untuk memproduksi gas hydrogen (H2) digunakan larutan yang mengandung kation
Larutan K2SO4 diperlukan sebagai penghantar listrik. Karena yang bereaksi
air, maka lama kelamaan air akan habis sehingga perlu selalu ditambah.
B. Sel Volta
Sel elektrokimia adalah peranti dengan arus listrik yang dilewatkan melalui rangkaian eksternal yang dikaitkan dengan setengah reaksi oksidasi dan reduksi yang masing-masing terjadi pada anoda dan katoda. Sel elektrokimia adalah alat khusus yang dapat membuat interaksi antara energi kimia (reaksi kimia) dengan energi listrik. Sel elektrokimia terbagi menjadi dua macam, yaitu sel Galvani (sel Volta) dan sel elektrolisis.
Perbedaan dari sel Galvani (sel Volta) dengan sel elektrolisis yaitu
a. Sel Galvani adalah alat yang dapat mengubah energi kimia menjadi energi listrik, sedangkan sel elektrolisis adalah sel yang dapat menguraikan senyawa kimia dengan arus listrik.
b. Pada sel Galvani (sel Volta) anoda disebut elektroda negatif (-) dan katoda disebut elektroda positif (+), sedangkan pada sel elektrolisis anoda disebut elektroda positif (+) dan katoda disebut elektroda negatif (-).
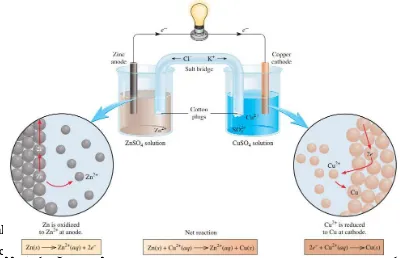
Sel volta adalah sel elektrokimia yang dapat menghasilkan energi listrik yang disebabkan oleh terjadinya reaksi redoks yang spontan. Sel Volta sering disebut juga sebagai sel Galvani karena Volta dan Galvani adalah ahli yang menemukan fenomena sel elektrokimia. Luigi Galvani (1737-1798), ahli fisiologi berkebangsaan Italia yang menyatakan adanya sifat listrik pada tulang hewan lewat percobaannya pada tulang katak. Sementara Alessandro Volta (1745-1827), ahli fisika yang juga berkebangsaan Italia, melakukan percobaan yang sama dan menyatakan bahwa aliran listrik yang terjadi adalah karena kontak logam yang tidak sama.
Gambar. rangkaian sel volta
Setengah sel yang satu terdiri dari logam seng (zinc) yang dicelupkan ke dalam larutan ZnSO4 dan setengah sel yang lainnya terdiri atas logam tembaga
(copper) yang dicelupkan ke dalam larutan CuSO4. Jika kedua elektrodanya
dihubungkan dengan rangkaian luar (misalnya kabel, kawat) maka akan dihasilkan arus listrik, yang dapat dibuktikan dengan bergeraknya jarum galvanometer yang dipasang pada rangkaian luar dari sel tersebut, ataupun dengan lam. Sel yang tampak di gambar sel volta di atas yang disebut juga sel Daniell, sesuai dengan nama orang yang mengembangkan alat tersebut. Ketika sel Daniell digunakan sebagai sumber listrik, terjad perubahan dari Zn menjadi Zn2+ yang bersifat dapat larut.
Zn(s) → Zn2+(aq) + 2e– (reaksi oksidasi)
Hal ini dapat diketahui dari semakin berkurangnya massa logam Zn. Di sisi lain, elektroda Cu semakin bertambah massanya karena terjadi pengendapan Cu dari Cu2+ dalam larutan.
Cu2+(aq) + 2e– → Cu(s) (reaksi reduksi)
elektroda tempat terjadinya reaksi oksidasi dan katoda adalah tempat terjadinya reaksi reduksi.
Ketika sel Daniell digunakan, terjadi arus elektron dari elektroda seng (Zn) ke elektroda tembaga (Cu) pada rangkaian luar. Kita ketahui bahwa dalam fisika ada konvensi yang menyatakan bahwa pada sumber arus, arus listrik mengalir dari kutub positif ke kutub negatif pada rangkaian luar, atau elektron mengalir mengalir dari kutub negatif ke kutub positif. Oleh karena itu, logam seng bertindak sebagai kutub negatif dan logam tembaga sebagai kitub positif. Bersamaan dengan itu pula, pada larutan dalam sel tersebut terjadi perpindahan sebagian ion Zn2+ dari kiri ke kanan.
Hal ini terjadi karena dalam larutan sebelah kiri terjadi kelebihan ion Zn2+ dibandingkan dengan ion SO
42- yang ada. Sementara itu, ion SO42- mengalir dari
kanan ke kiri karena di sisi kanan kelebihan ion SO42- dibandingkan dengan ion Cu2+.
Reaksi total yang terjadi pada sel Daniell / sel volta adalah:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Reaksi tersebut merupakan reaksi redoks spontan yang dapat digunakan untuk memproduksi listrik melalui suatu rangkaian sel elektrokimia.
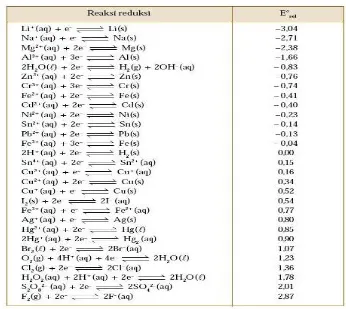
Potensial Sel Suatu sel Galvani (sel Volta) menghasilkan listrik karena adanya perbedaan daya tarik dua elektroda terhadap elektron, sehingga elektron mengalir dari yang lemah ke yang kuat daya tariknya. Perbedaan potensial kedua elektroda disebut potensial sel atau daya gerak listrik (DGL) sel dalam satuan volt (V). Potensial sel dapat diukur dengan menggunakan alat potensiometer.
Potensial elektroda standar Potensial elektroda standar dari suatu elektroda adalah DGL suatu sel terdiri dari elektroda yang dicelupkan ke dalam larutan yang mengandung ionnya dengan keaktifan satu dan elektroda hidrogen standar. Potensial elektroda standar dari suatu logam adalah beda potensial antara elektroda hidrogen standar dengan setengah sel yang terdapat logam tercelup dalam larutannya. Dengan konsentrasi 1molar pada 25 0C atau dengan kata lain DGL dari sel. Potensial elektroda
standar bernilai positif jika nilainya lebih positif dari elektroda hidrogen standar, dan bernilai negatif jika nilainya lebih negatif dari elektroda hidrogen standar.
Nilai potensial elektroda standar digunakan untuk menghitung potensial dari suatu sel. Misalnya untuk mengetahui potensial sel seng tembaga. Dengan mengetahui potensial reduksi standar elektroda seng dan tembaga, maka kita dapat memperkirakan potensial sel dan reaksi sel Zn/Cu.
Tegangan listrik (kadang disebut sebagai Voltase) adalah perbedaan potensial
listrik antara dua titik dalam rangkaian listrik, dan dinyatakan dalam satuan volt.
potensial listriknya, suatu tegangan listrik dapat dikatakan sebagai ekstra rendah, rendah, tinggi atau ekstra tinggi. Secara definisi tegangan listrik menyebabkan obyek bermuatan listrik negatif tertarik dari tempat bertegangan rendah menuju tempat bertegangan lebih tinggi. Sehingga arah arus listrik konvensional di dalam suatu konduktor mengalir dari tegangan tinggi menuju tegangan rendah. Voltase dapat diukur dengan menggunakan alat multimeter.
V= I .R
Satuan SI untuk Tegangan adalah volt (V).
Gambar 2. Multimeter
Multimeter adalah alat yang berfungsi untuk mengukur Voltage (Tegangan), Ampere (Arus Listrik), dan Ohm (Hambatan/resistansi) dalam satu unit. Multimeter sering disebut juga dengan istilah Multitester atau AVOMeter (singkatan dari Ampere Volt Ohm Meter). Terdapat 2 jenis Multimeter dalam menampilkan hasil pengukurannya yaitu Analog Multimeter (AMM) dan Digital Multimeter (DMM). Sehubungan dengan tuntutan akan keakurasian nilai pengukuran dan kemudahan pemakaiannya serta didukung dengan harga yang semakin terjangkau, Digital Multimeter (DMM) menjadi lebih populer dan lebih banyak dipergunakan oleh para Teknisi Elektronika ataupun penghobi Elektronika.
Cara Mengukur Tegangan Listrik (Volt/Voltage) DC : Yang perlu di Siapkan dan Perhatikan:
a. Pastikan alat ukur tidak rusak secara Fisik (tidak peccah).
c. Lakukan Kalibrasi alat ukur (Telah saya bahas diatas pada point 2 mengenai Tombol Pengatur Nol OHM). Posisikan Saklar Pemilih pada SKALA OHM pada x1 Ω, x10, x100, x1k, atau x10k selanjutnya tempelkan ujung kabel Terminal negatif (hitam) dan positif (merah). Nolkan jarum AVO tepat pada angka nol sebelah kanan dengan menggunakan Tombol pengatur Nol Ohm.
d. Setelah Kalibrasi Atur SAKLAR PEMILIH pada posisi Skala Tegangan yang anda ingin ukur, ACV untuk tegangan AC (bolak balik) dan DCV untuk tegangan DC (Searah).
e. Posisikan SKALA PENGUKURAN pada nilai yang paling besar terlebih dahulu seperti 1000 atau 750 jika anda TIDAK TAHU berapa nilai tegangan maksimal yang mengalir pada rangkaian.
f. Pasangkan alat ukur PARALEL terhadap beban/ sumber/komponen yang akan di ukur.
g. Baca Alat ukur.
C. Uang Koin
Bahan pembuat uang logam Rp. 500 kuning, adalah perunggu alumunium. Perunggu merupakan alloy dari tembaga dan timah yang dikenal sejak jaman kuno. Timah bisa juga diganti dengan unsur-unsur lain seperti fosfor, mangan, alumunium, atau silikon, dalam hal ini diganti dengan alumunium. Perunggu bersifat keras, tahan korosi dan mudah dibentuk. Dibanyak negara perunggu dimanfaatkan untuk membuat uang logam yang bernilai rendah. dan digunakan secara luas dalam industri.
Logam paduan (metal alloy) sering digunakan sebagai pengganti logam murni karena pada logam paduan memiliki sifat yang dapat memberikan keuntungan dan kemudahan sebagai material pabrikasi seperti kekerasan pada logam paduan dapat ditingkatkan dari kekerasan logam asalnya, kekuatan tarik dapat diperbesar, daya pemuaian dapat dikurangi, titik lebur dapat diturunkan atau dinaikkan dibanding logam-logam asalnya. Sifat-sifat tersebut itulah yang tidak dimiliki logam murni sehingga logam murni dapat ditambahkan unsur logam lainnya untuk mendapatkan kelebihan-kelebihan dari sifat-sifat tersebut.
yang memiliki sifat sangat ringan dan tahan terhadap korosi(karat). Logam ini berasal dari bijihnya, bauksit, dengan proses elektrolisis. Alumunium digunakan dalam kabel-kabel listrik lintas udara, pesawat terbang, kapal, mobil, kaleng minuman, dan foil dapur (pembungkus makanan). Di dalam kelistrikan Aluminium memiliki kepadatan rendah dan daktilitas tinggi adalah apa yang membuatnya cocok untuk transmisi listrik tegangan tinggi jarak jauh. Saluran listrik dari tembaga yang mahal dan perlu struktur pendukung tambahan untuk mendukung konduktivitas listrik yang tinggi. Sedangkan Aluminium tidak memerlukan semua ini, yang menghemat biaya dan menjadi tahan terhadap korosi, meningkatkan daya tahan. Oleh karena itu, aluminium menggantikan tembaga dalam transformator dan sistem kabel. Hal ini juga dapat digunakan dalam casing, penyangga, kotak sekering, piring satelit, televisi, peralatan rumah tangga, sistem suara, dan komunikasi lainnya dan peralatan elektronik.
V. ALAT DAN BAHAN
ALAT
Gunting
Cutter
Baskom
Tissue
Tabung reaksi
Elektroda grafit
Selotip
Capit buaya
Avometer
Karet gelang BAHAN
Soda kue
Air
Larutan cuka
Uang koin logam putih
A. Pembuatan baterai dari uang koin logam a. Pembuatan elektroda
Dicuci lagi dengan larutan asam cuka
Dikeringkan dengan tissue
elektroda
kertas karton
Dipotong seukuran dengan uang koin logam
Gb. Rangkaian baterai uang koin 1 sel
B. Percobaan elektrolisis
VII. REAKSI-REAKSI
Wadah baskom
waktu
- Dimasukkan larutan soda kue sampai ¾ volume wadah
- Diletakkan ke dalam 2 buah tabung reaksi secara terbalik, gunakan karet agar posisinya tidak goyang
- Dimasukkan 1 elektroda grafit ke dalam tabung reaksi yang dihubungkan dengan capit buaya
- Dihubungkan dengan baterai
a. Sel Baterai Uang Logam
Anoda : Al(s) Al3+(aq) + 3e- Eosel : 1,676 V
Katoda : Cu2+
(aq) + 2e-(aq) Cu(s) Eosel : 0,337 V
Reaksi Sel : 2Al (s) + 3Cu2+ (aq) Al3+(aq) + Cu(s) Eosel : 2,013 V
b. Sel elektrolisis
NaHCO3 → Na+ + HCO3
-Anoda : 2H2O → O2 + 4e- + 4H+ Eosel : -1,23 V
Katoda : 2H2O + 2e- → H2 + 2OH- Eosel : 0,5 V
Reaksi Sel : 2H2O → H2 + O2 Eosel : -0,73 V
VIII. HASIL PENGAMATAN
IX. ANALISIS
X. KESIMPULAN
XI. DAFTAR PUSTAKA
Oktavian, J. Tanpa Tahun. Makalah Elektrolisis. (Online).
http://www.academia.edu/9023219/Makalah_Elektrolisis. Diakses pada 11 Maret 2016.
Sugiarto, Bambang. 2014. Kimia Dasar. Surabaya:Universitas Negeri Suabaya
Toni. Tanpa Tahun. Makalah Kimia Dasar. (Online).
https://www.scribd.com/doc/240645229/makalahkimdasii-140525041240-phpapp01. Diakses pada 11 maret 2016.