TUGAS I
TERMODINAMIKA LANJUT
(Dr. Ir. Ratnawati, MT )
PERBANDINGAN PREDIKSI VOLUME MOLAR
N-BUTANA DENGAN MENGGUNAKAN PERSAMAAN
VAN DER WAALS, REDLICH-KWONG,
DAN SOAVE-REDLICH-KWONG
disusun oleh : Anis Roihatin Rr. Dewi Artanti P
MAGISTER TEKNIK KIMIA
UNIVERSITAS DIPONEGORO
SEMARANG
2010
DEPARTEMEN PENDIDIKAN NASIONAL
UNIVERSITAS DIPONEGORO
PROGRAM MAGISTER TEKNIK KIMIA
Jl. Prof. H. Soedarso, SH, Jur.T. Kimia Ruang B 22,
Kampus Tembalang Semarang 50239 Telepon (024)7460058,
Facsimile (024) 76480675, www.mtk.undip.ac.id
LEMBAR PENGESAHAN
Tugas ini telah diselesaikan oleh :
1. Anis Roihatin
2. Rr. Dewi Artanti P
Dosen Pengampu : Dr. Ir. Ratnawati, MT
Semarang, Oktober 2010
Mengetahui
Dosen Pengampu
BAB I
Pendahuluan
1.1 Latar Belakang
Di dalam fisika dan termodinamika, persamaan keadaan adalah persamaan termodinamika yang menggambarkan keadaan materi di bawah seperangkat kondisi fisika. Persamaan keadaan adalah sebuah persamaan konstitutif yang menyediakan hubungan matematik antara dua atau lebih fungsi keadaan yang berhubungan dengan materi, seperti temperatur, tekanan, volume dan energi dalam. Persamaan keadaan berguna dalam menggambarkan sifat-sifat fluida, campuran fluida, dan padatan.
Penggunaan paling umum dari sebuah persamaan keadaan adalah dalam memprediksi keadaan gas dan cairan. Salah satu persamaan keadaan paling sederhana dalam penggunaan ini adalah hukum gas ideal, yang cukup akurat dalam memprediksi keadaan gas pada tekanan rendah dan temperatur tinggi. Tetapi persamaan ini menjadi semakin tidak akurat pada tekanan yang makin tinggi dan temperatur yang makin rendah, dan gagal dalam memprediksi kondensasi dari gas menjadi cairan. Untuk mengkoreksi keadaan gas ideal yang tidak sesuai dengan keadaan gas nyata maka beberapa ilmuwan telah mengembangkan beberapa persamaan keadaan, diantaranya seperti :
Persamaan Virial
Persamaan Van der Waals
Persamaan Redlich-Kwong
Persamaan Soave-Redlich-Kwong
Persamaan Peng-Robinson
Dll
Saat ini, tidak ada persamaan keadaan tunggal yang dapat dengan akurat memperkirakan sifat-sifat semua zat pada semua kondisi. Selain memprediksi kelakuan gas dan cairan, terdapat juga beberapa persamaan keadaan dalam memperkirakan volume padatan, termasuk transisi padatan dari satu keadaan kristal ke keadaan kristal lainnya.
1. 2 Rumusan Masalah
Persamaan keadaan yang paling sederhana dalam memprediksi keadaan gas dan cairan adalah hukum gas ideal, yang cukup akurat dalam memprediksi keadaan gas pada tekanan rendah dan temperatur tinggi. Namun pada kenyataannya persamaan ini menjadi tidak akurat pada tekanan yang semakin tinggi dan temperatur yang semakin rendah. Beberapa persamaan keadaan telah dikembangkan untuk mengkoreksi keadaan gas ideal yang tidak sesuai dengan keadaan gas nyata. Oleh karena itu perlu dilakukan studi pendekatan untuk membandingkan persamaan-persamaan keadaan yang telah dikembangkan dengan keadaan nyata di lapangan. Dalam makalah ini kami melakukan perbandingan terhadap tiga persamaan keadaan pada senyawa n-butana (kondisi saturated), yaitu : Persamaan Van der Waals, Redlich-Kwong, dan Soave-Redlich-Kwong dengan data literatur (Perry’s Chemical Engineering Handbook).
1.3 Tujuan
Studi pendekatan ini bertujuan untuk membandingkan hasil prediksi volume molar pada senyawa n-Butana (kondisi saturated) untuk tiga persamaan keadaan : Persamaan Van der Waals, Redlich-Kwong, dan Soave-Redlich-Kwong dengan data literatur (Perry’s Chemical Engineering Handbook).
BAB II
ISI
2.1 Dasar Teori
Persamaan keadaan adalah persamaan yang menyatakan hubungan antara state variable yang menggambarkan keadaan dari suatu sistem pada kondisi fisik tertentu. State variable adalah Property dari sistem yang hanya tergantung pada keadaan sistem saat ini, bukan pada jalannya proses, antara lain : temperatur, tekanan, densitas, enthalpi, dll. Pada awalnya persamaan keadaan yang digunakan adalah persamaan gas ideal yang ternyata kurang tepat untuk diterapkan untuk gas nyata, sehingga muncullah beberapa persamaan keadaan baru untuk mengkoreksi persamaan gas ideal. Berikut ini adalah penjelasan tentang beberapa persamaan keadaan.
1. Persamaan Gas Ideal
Dalam thermodinamika, gas yang dipergunakan sebagai benda kerja umumnya semuanya dianggap bersifat sebagai gas ideal. Hal ini disebabkan karena sifat-sifat gas ideal hanya berbeda sedikit dari sifat-sifat gas yang sebenarnya. Gas ideal (sempurna) adalah gas dimana tenaga ikat molekul-molekulnya dapat diabaikan. Jadi setiap gas Bila tenaga ikat molekul-molekulnya dapat diabaikan tergolong dalam gas ideal. Persamaan gas ideal pertama kali dikemukakan oleh Boyle (1662), Charles dan Gay-Lussac (1787) dan disempurnakan oleh Emile Clapeyron (1834).
Persamaan Gas Ideal dapat dituliskan sebagai berikut :
PV = RT
(1)Keberlakuan untuk P0 (P< 1,5 bar)
2. Persamaan Van der Waals
Van der Waals (1873) melakukan koreksi terhadap persamaan keadaan untuk gas ideal. Koreksi dilakukan terhadap interaksi antara molekul-molekul gas yang mempengaruhi tekanan sehingga P diganti dengan (P + a/V2). Selain itu molekul dipandang sebagai partikel yang memiliki volume, sehingga V tidak boleh kurang dari suatu konstanta dan V diganti dengan (V-b)
(
) ( )
(2) Dengan a dan b adalah konstanta sebagai berikut :(3)
(4)
3. Persamaan Redlich-Kwong
Redlich & Kwong (1949) mengusulkan perbaikan untuk persamaan Van der Waals. Persamaan RK ini cukup akurat untuk prediksi sifat-sifat gas untuk kondisi:
(5)
Sehingga persamaan keadaannya menjadi :
( )
(6)
Dengan a dan b adalah konstanta sebagai berikut :
(8)
(9)
4. Persamaan Soave-Redlich-Kwong
Soave (1972) mengusulkan perbaikan persamaan Redlich-Kwong. Sehingga persamaannya menjadi :
( ) (10)
Dengan a, b dan adalah konstanta sebagai berikut :
(11)
(12)
α = { 1+(0.48508+1.55171ω – 0.15613 ω
2) (1-T
r 0.5)}
2 (13)Persamaan keadaan di atas dapat ditulis dalam bentuk umum, yaitu :
f(Z) = Z
3+ c
2Z
2+ c
1Z +c
0 (14)dengan nilai c
0, c
1, c
2adalah sebagai berikut :
Tabel 1. Nilai c
0, c
1, c
2untuk Berbagai Macam Persamaan Keadaan
Persamaan keadaan
c
0c
1c
2Van der Waals
– AB
A
– (1 + B)
Redlich Kwong
– AB
A – B – B
2– 1
Soave- Redlich-Kwong
– AB
A – B – B
2– 1
2.2 Pembahasan
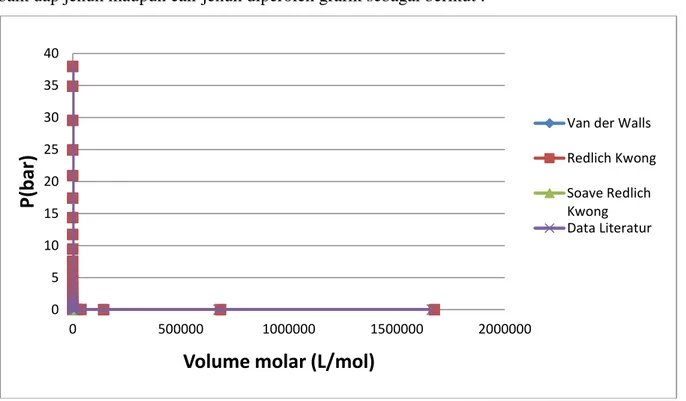
Studi pendekatan untuk membandingkan persamaan keadaan di atas, dilakukan pada senyawa n-Butana pada kondisi saturated. Data termodinamika dari senyawa n-Butana diperoleh dari Perry’s Chemical Engineering Handbook tabel 2-239 dan 2-164. Perhitungan ini dilakukan pada kisaran P = 6,7 x 10-6 bar s/d 37,96 bar dan T = 134,9 K s/d 425,2 K. Setelah dilakukan perhitungan untuk prediksi volume molar n-Butana pada keadaan jenuh, baik uap jenuh maupun cair jenuh diperoleh grafik sebagai berikut :
Gambar 1. Grafik Perbandingan P vs Vuntuk n-Butana (Uap Jenuh)
0 5 10 15 20 25 30 35 40 0 500000 1000000 1500000 2000000
P(
bar
)
Volume molar (L/mol)
Van der Walls Redlich Kwong Soave Redlich Kwong Data Literatur
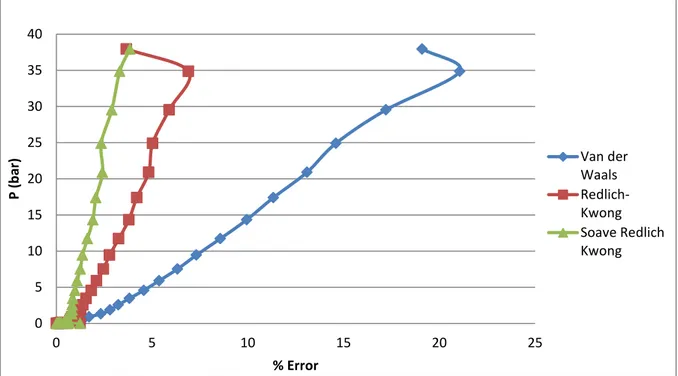
Gambar 2. Grafik Perbandingan P vs % error
Gambar 1 menunjukkan hubungan antara tekanan dan volume molar pada senyawa n-Butana untuk kondisi uap jenuh pada berbagai persamaan keadaan. Dari hasil perhitungan diperoleh perbandingan prediksi volume molar n-butana dari ketiga persamaan keadaan dengan data literatur, sehingga didapat % error rata-rata untuk persamaan Van der Waals sebesar 5,17%, Redlich Kwong sebesar 1,89%, dan Soave-Redlich Kwong sebesar 1,1%. Hal ini menunjukkan bahwa keakuratan persamaan keadaan yang paling mendekati keadaan nyata pada kondisi n-Butana uap jenuh adalah persamaan Soave-Redlich Kwong dengan % error yang terkecil dibandingkan dengan dua persamaan lainnya.
0 5 10 15 20 25 30 35 40 0 5 10 15 20 25 P (b ar ) % Error Van der Waals Redlich-Kwong Soave Redlich Kwong
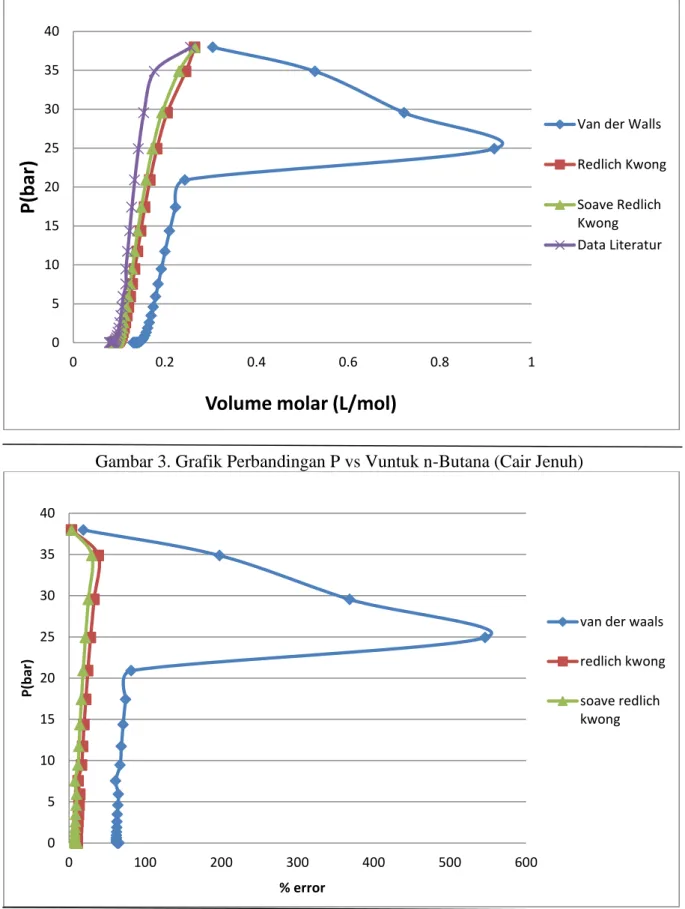
Gambar 3. Grafik Perbandingan P vs Vuntuk n-Butana (Cair Jenuh)
Gambar 3. Grafik Perbandingan P vs % error (Cair Jenuh)
0 5 10 15 20 25 30 35 40 0 0.2 0.4 0.6 0.8 1
P(
ba
r)
Volume molar (L/mol)
Van der Walls Redlich Kwong Soave Redlich Kwong Data Literatur 0 5 10 15 20 25 30 35 40 0 100 200 300 400 500 600 P(b ar ) % error
van der waals redlich kwong soave redlich kwong
Sedangkan untuk Gambar 3 menunjukkan hubungan antara tekanan dan volume molar pada senyawa n-Butana untuk kondisi cair jenuh pada berbagai persamaan keadaan. Dari hasil perhitungan diperoleh perbandingan prediksi volume molar n-butana dari ketiga persamaan keadaan dengan data literatur, sehingga didapat % error rata-rata untuk persamaan Van der Waals sebesar 93,28%, Redlich Kwong sebesar 14,31%, dan Soave-Redlich Kwong sebesar 11,29%. Hal ini menunjukkan bahwa keakuratan persamaan keadaan yang paling mendekati keadaan nyata pada kondisi n-Butana cair jenuh adalah persamaan Soave-Redlich Kwong dengan % error yang terkecil dibandingkan dengan dua persamaan lainnya.
Dari kedua grafik menunjukkan bahwa pendekatan persamaan keadaan dengan persamaan Van der Waals mempunyai % error yang paling besar daripada dua persamaan lainnya, Redlich-Kwong dan SRK. Pada tekanan yang semakin tinggi, prediksi volume molar n-butana dengan persamaan Van der Waals baik uap jenuh maupun cair jenuh menunjukkan % error yang semakin besar. Persamaan Redlich-Kwong memberikan hasil yang lebih baik persamaan Van der Waals, walaupun demikian persamaan dua-konstanta tetap hanya memberikan nilai akurasi yang terbatas apabila tekanan ditingkatkan. Sedangkan untuk persamaan Soave Redlich Kwong mempunyai % error yang paling kecil dan paling mendekati data literature. Persamaan Soave Redlich Kwong merupakan perbaikan terhadap persamaan Redlich Kwong dengan menambahkan parameter gas nyata yang lain yaitu faktor asentrik. Faktor asentrik (ω) merupakan deviasi antara tekanan uap jenuh tereduksi suatu fluida dengan tekanan uap jenuh tereduksi fluida sederhana.
BAB III
PENUTUP
3.1 Kesimpulan
1. Untuk kondisi n-Butana uap jenuh, persamaan keadaan yang paling mendekati data literatur adalah persamaan Soave-Redlich-Kwong dengan % error sebesar 1,1%
2. Untuk kondisi n-Butana cair jenuh, persamaan keadaan yang paling mendekati data literatur adalah persamaan Soave-Redlich-Kwong dengan % error sebesar 11,29% 3. Persamaan Soave Redlich Kwong mempunyai nilai akurasi yang mendekati keadaan
nyata karena adanya tambahan parameter gas nyata yang lain yaitu faktor asentrik
3.2 Saran
Dari studi yang telah dilakukan, terlihat perbandingan % error yang bervariasi pada ketiga persamaan keadaan. Maka diperlukan studi pendekatan lebih lanjut untuk merumuskan persamaan baru guna mengkoreksi persamaan keadaan yang telah ada.
LAMPIRAN
Data Termodinamika n-Butana
DAFTAR PUSTAKA
Perry, R.H and Green, D.W, 1986, “Perry’s Chemical Engineer’s Handbook”, 6th ed, Mc. Graw Hill Book Co., New York.
Smith, J.M, and Van Ness, H.C., 1975, “Introduction to Chemical Engineering Thermodynamics”, 5th ed, Mc Graw Hill Kogakusha Ltd. Tokyo.
Hasil Perhitungan
Volume Molar n-Butana Uap Jenuh
No P (bar) V molar (dari data Perry) V (L/mol) dalam uap jenuh %error uap jenuh
Uap jenuh Cair jenuh VDW RK SRK %error VDW %error RK %error SRK
1 0.0000067 1664061.49 0.07904728 1673966.93 1673965.9 1673965.86 0.595256878 0.595194884 0.595192793 2 0.000017 676261.105 0.079570387 684681.269 684680.313 684680.267 1.245105486 1.244964174 1.244957331 3 0.000087 143563.81 0.080616601 143343.824 143342.997 143342.934 0.153232333 0.153808538 0.1538522 4 0.00035 38012.442 0.081662815 38005.9234 38005.2025 38005.1295 0.017148532 0.019044954 0.019237036 5 0.00117 12031.461 0.082767152 12079.299 12078.6671 12078.5881 0.397607566 0.392355639 0.391698816 6 0.00337 4440.5972 0.083871489 4439.89509 4439.33834 4439.2564 0.015811205 0.02834888 0.030194231 7 0.00853 1848.3114 0.085033949 1851.11938 1850.62655 1850.54389 0.151921277 0.125257371 0.120785414 8 0.0194 854.4081 0.086254532 856.389288 855.951169 855.869367 0.231878369 0.180600922 0.171026788 9 0.0405 429.52897 0.087475115 430.411756 430.020712 429.940852 0.205524249 0.114484074 0.095891507 10 0.0781 232.492 0.088811944 233.548354 233.197993 233.120811 0.454361297 0.303663462 0.270465855 11 0.1411 134.26413 0.090148773 134.90576 134.590687 134.516657 0.477886587 0.243219657 0.188082398 12 0.2408 81.3722 0.091543725 82.27639 81.9920251 81.9214282 1.111177987 0.761715996 0.674957991 13 0.3915 51.903839 0.093054923 52.5296329 52.2720714 52.2050452 1.205679501 0.70945124 0.580315792 14 0.61 34.408816 0.094624244 34.8994616 34.6653667 34.6019486 1.425929968 0.745595823 0.561288146 15 0.9155 23.597938 0.096251688 24.0038818 23.7903988 23.7305577 1.72025114 0.815583267 0.561996915 16 1.3297 16.623178 0.097995378 17.0105178 16.8152004 16.758859 2.330118636 1.155148326 0.816215529 17 1.8765 12.031461 0.099855314 12.3693344 12.1848021 12.1314237 2.808249535 1.274500974 0.830844467 18 2.5811 8.9102559 0.101831496 9.19926641 9.03428816 8.98461596 3.243571322 1.392016831 0.83454461 19 3.4706 6.7190188 0.10404017 6.97567537 6.82343051 6.77690939 3.81985194 1.553972627 0.861592968 20 4.5731 5.1438855 0.10636509 5.37894403 5.23811849 5.1946277 4.569668796 1.831941741 0.986456594 21 5.9179 3.9930501 0.108922502 4.20754268 4.07701704 4.03644442 5.371647507 2.102827085 1.086746153 22 7.5354 3.1328297 0.114967294 3.33118449 3.21001048 3.17225697 6.331489673 2.463612231 1.258519482 23 9.4573 2.4818521 0.114967294 2.66353063 2.55091262 2.5158963 7.320280402 2.782620382 1.371725642
24 11.72 1.976182 0.118629043 2.14537341 2.04064532 2.00829928 8.561529836 3.262013289 1.625218677 25 14.35 1.5809456 0.122872022 1.73821194 1.64087326 1.61117755 9.947612484 3.790621388 1.912270134 26 17.4 1.2670814 0.1278706 1.41068665 1.32032964 1.29327152 11.33354611 4.202432726 2.066964165 27 20.9 1.0113402 0.134089761 1.143707 1.06013385 1.03578637 13.08825621 4.82465206 2.417205644 28 24.92 0.8020974 0.142226981 0.91925477 0.8424359 0.82091839 14.60637661 5.029127729 2.346471771 29 29.54 0.6161038 0.154142196 0.72218209 0.65242387 0.63394941 17.21760012 5.895121505 2.896525841 30 34.86 0.4359225 0.177158904 0.5277645 0.46601753 0.45036353 21.06842328 6.903757288 3.312750601 31 37.96 0.2557412 0.256031815 0.30460923 0.26511399 0.26558022 19.10839238 3.66495277 3.84725813 %error rata-rata 5.165657652 1.889116382 1.101008181 Hasil Perhitungan
Volume Molar n-Butana Cair Jenuh
No P (bar) V molar (dari data Perry) V (L/mol) dalam cair jenuh % error cair jenuh
Uap jenuh Cair jenuh VDW RK SRK %error VDW %error RK %error SRK
1 6.7E-06 1664061.49 0.07904728 0.130947 0.08783 0.087716 65.65660128 11.11043874 10.96611871 2 0.000017 676261.105 0.079570387 0.1316126 0.088261 0.08809 65.40405808 10.92212377 10.7072753 3 0.000087 143563.81 0.080616601 0.1329611 0.08915 0.08886 64.93019765 10.58576623 10.22581087 4 0.00035 38012.442 0.081662815 0.1343712 0.0901 0.089681 64.54398035 10.33218956 9.818535604 5 0.00117 12031.461 0.082767152 0.1358487 0.091115 0.090556 64.13360745 10.08584288 9.410834239 6 0.00337 4440.5972 0.083871489 0.1374 0.092199 0.091491 63.82207514 9.928769372 9.084832112 7 0.00853 1848.3114 0.085033949 0.1390326 0.093358 0.092491 63.50247107 9.788931013 8.769407277 8 0.0194 854.4081 0.086254532 0.1407551 0.094598 0.093562 63.18573017 9.67340544 8.472076613 9 0.0405 429.52897 0.087475115 0.1425774 0.095928 0.094712 62.99193382 9.662815358 8.272863925 10 0.0781 232.492 0.088811944 0.144511 0.097355 0.095949 62.715757 9.619056716 8.035600253 11 0.1411 134.26413 0.090148773 0.1465695 0.09889 0.097282 62.58619194 9.696414249 7.912685023 12 0.2408 81.3722 0.091543725 0.1487684 0.100545 0.098724 62.51078283 9.832979997 7.84306907 13 0.3915 51.903839 0.093054923 0.1511265 0.102335 0.100287 62.40567375 9.972394615 7.771554839
14 0.61 34.408816 0.094624244 0.1536657 0.104275 0.101987 62.39564969 10.1994952 7.781443476 15 0.9155 23.597938 0.096251688 0.1564124 0.106388 0.103844 62.50356964 10.53057427 7.88844735 16 1.3297 16.623178 0.097995378 0.1593989 0.108695 0.105881 62.65957734 10.91891724 8.046749336 17 1.8765 12.031461 0.099855314 0.1626644 0.111229 0.108124 62.90006126 11.38991136 8.280979406 18 2.5811 8.9102559 0.101831496 0.1662582 0.114024 0.110609 63.267973 11.97343381 8.619899052 19 3.4706 6.7190188 0.10404017 0.1702431 0.117128 0.113379 63.63206633 12.57932908 8.975823755 20 4.5731 5.1438855 0.10636509 0.1747006 0.120598 0.116487 64.24620809 13.38088541 9.516248094 21 5.9179 3.9930501 0.108922502 0.1797403 0.12451 0.120005 65.01666416 14.31058503 10.17507736 22 7.5354 3.1328297 0.114967294 0.185514 0.128965 0.124028 61.36241302 12.17572921 7.881130191 23 9.4573 2.4818521 0.114967294 0.1922431 0.134102 0.128683 67.21544258 16.64366179 11.93050086 24 11.72 1.976182 0.118629043 0.2002685 0.140115 0.134153 68.81908924 18.11152817 13.08627526 25 14.35 1.5809456 0.122872022 0.2101965 0.147297 0.140709 71.06942017 19.87800987 14.51650736 26 17.4 1.2670814 0.1278706 0.2232491 0.156099 0.148768 74.58983947 22.07550012 16.34236683 27 20.9 1.0113402 0.134089761 0.2438909 0.167312 0.159052 81.88628225 24.77610602 18.61630977 28 24.92 0.8020974 0.142226981 0.9192548 0.182427 0.172914 546.3293818 28.2647514 21.5764296 29 29.54 0.6161038 0.154142196 0.7221821 0.204903 0.193439 368.5168029 32.93130577 25.49366134 30 34.86 0.4359225 0.177158904 0.5277645 0.245554 0.230681 197.9045848 38.60646497 30.21128398 31 37.96 0.2557412 0.256031815 0.3046092 0.265114 0.26558 18.97319584 3.547285401 3.729383434 % error rata-rata 93.27991233 14.30660007 11.28900582